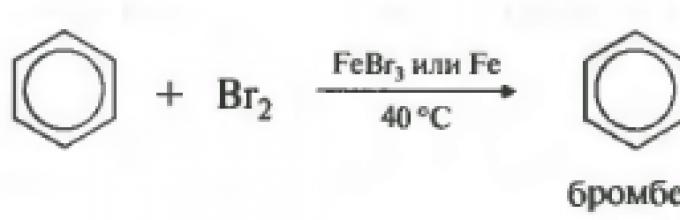Pierwszą grupą reakcji są reakcje podstawienia. Powiedzieliśmy, że areny nie mają wiązań wielokrotnych w strukturze cząsteczki, ale zawierają sprzężony układ sześciu elektronów, który jest bardzo stabilny i zapewnia dodatkową wytrzymałość pierścieniowi benzenowemu. Dlatego w reakcjach chemicznych najpierw następuje wymiana atomów wodoru, a nie zniszczenie pierścienia benzenowego.
Reakcje podstawienia spotykaliśmy już, gdy mowa o alkanach, ale dla nich reakcje te przebiegały według radykalnego mechanizmu, a dla arenów mechanizm jonowy reakcje substytucji.
Pierwszy właściwości chemiczne halogenowanie. Zastąpienie atomu wodoru atomem halogenu, chloru lub bromu.
Reakcja zachodzi po podgrzaniu i zawsze przy udziale katalizatora. W przypadku chloru może to być chlorek glinu lub chlorek żelaza trzy. Katalizator polaryzuje cząsteczkę halogenu, powodując rozerwanie wiązania heterolitycznego i wytwarzanie jonów.
Chlor jest jonem naładowanym dodatnio i reaguje z benzenem.
Jeśli reakcja zachodzi z bromem, wówczas katalizatorem jest bromek żelaza lub bromek glinu.

Należy zauważyć, że reakcja zachodzi z bromem cząsteczkowym, a nie z wodą bromową. Benzen nie reaguje z wodą bromową.
Halogenowanie homologów benzenu ma swoją własną charakterystykę. W cząsteczce toluenu grupa metylowa ułatwia podstawienie w pierścieniu, reaktywność wzrasta, a reakcja zachodzi w łagodniejszych warunkach, to znaczy w temperaturze pokojowej.

Należy zauważyć, że podstawienie zawsze następuje w pozycjach orto i para, dzięki czemu otrzymuje się mieszaninę izomerów.
Drugi właściwość nitrowanie benzenu, wprowadzenie grupy nitrowej do pierścienia benzenowego.

Tworzy się ciężka żółtawa ciecz o zapachu gorzkich migdałów, nitrobenzen, więc reakcja może być jakościowa do benzenu. Do nitrowania stosuje się mieszaninę nitrującą stężonych kwasów azotowego i siarkowego. Reakcję prowadzi się przez ogrzewanie.
Przypomnę, że do nitrowania alkanów w reakcji Konovalova stosowano rozcieńczony kwas azotowy bez dodatku kwasu siarkowego.
Podczas nitrowania toluenu, a także podczas halogenowania powstaje mieszanina orto- i para-izomerów.

Trzeci właściwość alkilowania benzenu haloalkanami.

Reakcja ta umożliwia wprowadzenie rodnika węglowodorowego do pierścienia benzenowego i można ją uznać za metodę wytwarzania homologów benzenowych. Jako katalizator stosuje się chlorek glinu, który sprzyja rozkładowi cząsteczki haloalkanu na jony. Ogrzewanie jest również konieczne.
Czwarty właściwość alkilowanie benzenu alkenami.

Można w ten sposób otrzymać np. kumen czy etylobenzen. Katalizator chlorek glinu.
2. Reakcje addycji do benzenu
Drugą grupą reakcji są reakcje addycji. Powiedzieliśmy, że te reakcje nie są typowe, ale są możliwe w dość rygorystycznych warunkach wraz ze zniszczeniem chmury pi-elektronów i utworzeniem wiązań sześć sigma.
Piąty właściwość na liście ogólnej uwodornienie, dodanie wodoru.

Temperatura, ciśnienie, katalizator nikiel lub platyna. Toluen może reagować w ten sam sposób.
Szósty chlorowanie nieruchomości. Należy pamiętać, że mówimy konkretnie o interakcji z chlorem, ponieważ brom nie bierze udziału w tej reakcji.

Reakcja zachodzi pod ostrym promieniowaniem ultrafioletowym. Tworzy się heksachlorocykloheksan, inna nazwa heksachloranu, substancja stała.
Należy o tym pamiętać w przypadku benzenu niemożliwe reakcje addycji halogenowodorów (hydrohalogenacja) i addycji wody (hydratacja).
3. Podstawienie w łańcuchu bocznym homologów benzenu
Trzecia grupa reakcji dotyczy wyłącznie homologów benzenu – jest to podstawienie w łańcuchu bocznym.
Siódmy właściwość na liście ogólnej halogenowanie przy atomie węgla alfa w łańcuchu bocznym.

Reakcja zachodzi po podgrzaniu lub napromieniowaniu i zawsze tylko przy węglu alfa. W miarę kontynuowania halogenowania drugi atom halogenu powróci do pozycji alfa.
4. Utlenianie homologów benzenu
Czwarta grupa reakcji to utlenianie.
Pierścień benzenowy jest zbyt mocny, więc benzen nie utlenia się nadmanganian potasu nie odbarwia roztworu. Jest to bardzo ważne, aby o tym pamiętać.
Ale homologi benzenu utleniają się po podgrzaniu zakwaszonym roztworem nadmanganianu potasu. I to jest ósma właściwość chemiczna.

W ten sposób powstaje kwas benzoesowy. Obserwuje się zmianę zabarwienia roztworu. W tym przypadku, niezależnie od długości łańcucha węglowego podstawnika, zawsze pęka on po pierwszym atomie węgla i atom alfa utlenia się do grupy karboksylowej z utworzeniem kwasu benzoesowego. Pozostała część cząsteczki utlenia się do odpowiedniego kwasu lub, jeśli jest to tylko jeden atom węgla, do dwutlenku węgla.
Jeśli homolog benzenowy ma w pierścieniu aromatycznym więcej niż jeden podstawnik węglowodorowy, wówczas utlenianie przebiega według tych samych zasad - utlenianiu ulega węgiel znajdujący się w pozycji alfa.

W w tym przykładzie otrzymuje się dwuzasadowy kwas aromatyczny, który nazywa się kwasem ftalowym.
Chciałbym szczególnie zwrócić uwagę na utlenianie kumenu, izopropylobenzenu, tlenem atmosferycznym w obecności kwasu siarkowego.

Jest to tak zwana metoda kumenowa do produkcji fenolu. Z taką reakcją spotyka się zwykle w sprawach związanych z produkcją fenolu. Jest to metoda przemysłowa.
Dziewiąty spalanie własności, całkowite utlenienie tlenem. Benzen i jego homologi spalają się do dwutlenku węgla i wody.
Zapiszmy równanie spalania benzenu w postaci ogólnej.
Zgodnie z prawem zachowania masy, po lewej stronie powinno znajdować się tyle atomów, ile jest atomów po prawej stronie. Ponieważ w reakcjach chemicznych atomy nie znikają, ale po prostu zmienia się kolejność wiązań między nimi. Zatem będzie tyle cząsteczek dwutlenku węgla, ile jest atomów węgla w cząsteczce arenu, ponieważ cząsteczka zawiera jeden atom węgla. Oznacza to, że n cząsteczek CO2. Cząsteczek wody będzie dwa razy mniej niż atomów wodoru, czyli (2n-6)/2, czyli n-3.
Po lewej i prawej stronie znajduje się taka sama liczba atomów tlenu. Po prawej stronie znajduje się 2n z dwutlenku węgla, ponieważ każda cząsteczka ma dwa atomy tlenu plus n-3 z wody, co daje w sumie 3n-3. Po lewej stronie znajduje się taka sama liczba atomów tlenu 3n-3, co oznacza, że cząsteczek jest dwa razy mniej, ponieważ cząsteczka zawiera dwa atomy. Oznacza to (3n-3)/2 cząsteczki tlenu.
W ten sposób opracowaliśmy równanie spalania homologów benzenu w ogólnej formie.
PRTSVSh (F) Federalna państwowa budżetowa instytucja edukacyjna wyższego kształcenia zawodowego
Katedra Bezpieczeństwa Pożarowego
Test
w dyscyplinie „Teoria spalania i wybuchów”
Zadanie nr 1
Wyznaczyć konkretne teoretyczne ilości i objętość powietrza potrzebne do całkowitego spalenia par benzenu. Warunki, w jakich znajduje się powietrze charakteryzują się temperaturą Tb i ciśnieniem Pb, a pary benzenu temperaturą Tg i ciśnieniem Pg. Wyraź wyniki obliczeń w następujących jednostkach: ; ;;;
Dane wyjściowe (N - numer grupy, n - numer według listy uczniów:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Рв=?10 3 =95900 Pa;
Tg=300?(?1) N ?2?N?(?1) n ?0,2?n= 321,6 K;
Рr=?10 3 =79400 Pa.
С6Н6+7,5О2+7,5?3,76N2=6CO2+3pO+7,5?3,76N2+Qp (1),
gdzie Qр jest ciepłem reakcji chemicznej. Z tego równania możemy wyznaczyć współczynniki stechiometryczne benzenu i tlenu cząsteczkowego: Vg = 1, V0 = 7,5
2. Określona teoretyczna ilość powietrza - liczba kilomoli powietrza potrzebna do całkowitego spalenia jednego kilometra benzenu, liczona ze wzoru:
gdzie 4,76 to ilość powietrza zawierająca jednostkową ilość tlenu, = to stosunek współczynników stechiometrycznych tlenu cząsteczkowego (Vo) i benzenu (Vg)
Podstawiając wartości Vo i Vg do (d), otrzymujemy:
3. Objętość powietrza niezbędną do całkowitego spalenia jednego kilometra benzenu określa się w następujący sposób:
gdzie jest objętością jednego kilometra mola powietrza w temperaturze Тb i ciśnieniu Рв. Wartość oblicza się za pomocą wzoru
gdzie 22,4 to objętość molowa gazu w normalne warunki, Po = 101325 Pa – ciśnienie normalne, To = 273 K – temperatura normalna.
Podstawiając TV, To, Pv, Po do (5) otrzymujemy
Specyficzną teoretyczną objętość powietrza oblicza się ze wzoru (4):
4. Objętość powietrza niezbędną do całkowitego spalenia jednostkowej objętości paliwa gazowego ustala się w następujący sposób:
gdzie jest objętością jednego kilometra mola paliwa - par benzenu w temperaturze Tg i ciśnieniu Pg. Biorąc pod uwagę, że
i podstawiając (8) i (5) do (7) otrzymujemy następujące wyrażenie na konkretną teoretyczną objętość powietrza:
Obliczamy wartość tego parametru procesu spalania:
Objętość powietrza niezbędną do całkowitego spalenia jednego kilograma benzenu określa się w następujący sposób:
gdzie jest masa molowa paliwa - masa jednego kilometra benzenu wyrażona w kilogramach. Masa molowa benzenu jest liczbowo równa jego masie cząsteczkowej, określonej wzorem:
Ac?nc+An?nn, УiAi?ni (11)
gdzie Ac i An to masy atomowe węgla i wodoru, nc i nn to liczba atomów węgla w cząsteczce benzenu. Zastępując wartości Ac = 12, nc = 6, An = 1, nn = 6, otrzymujemy:
Konkretną teoretyczną objętość powietrza znajdujemy, podstawiając wartości n do i do wzoru (10):
Wynik obliczeń:
Zadanie nr 2
Wyznaczyć konkretną teoretyczną ilość, objętość i skład produktów spalania benzenu, jeżeli znany jest współczynnik nadmiaru powietrza b, temperatura Tp i ciśnienie Pp produktów spalania, temperatura Tg i ciśnienie Pg par benzenu. Wyniki obliczeń wyraź w ułamkach molowych (w procentach) oraz w następujących jednostkach: ; ;;
Wstępne dane:
в=1,5+(?1) N ?0,1?N?(?1) n ?0,01?n = 0,2 ;
Рп=?10 3 = 68400 Pa;
Тп=1600?(?1) N ?20?N?(?1) n ?2?n = 1816 K;
Tg=273?(?1) N ?2?N+(?1) n ?0,2?n = 295,4 K;
Рг=?10 3 = 111600 Pa;
rozwiązanie (N=11, n=2).
1. Zapiszmy równanie stechiometryczne reakcji spalania benzenu w powietrzu:
C 6 H 6 +7,5O 2 +7,5–3,76N 2 =6CO 2 +3H 2O+7,5–3,76N 2 +Qp, (1)
gdzie Qp jest ciepłem reakcji chemicznej. Z tego równania wyznaczamy następujące współczynniki stechiometryczne:
V CO2 =6, V pO =3, V C6H6 =1, V O2 =7,5, V N2 =7,5–3,76
2. Określ szacunkową ilość produktów spalania jednego kilometra paliwa:
Podstawiając do (2) wartości współczynników stechiometrycznych produktów spalania i paliwa, otrzymujemy:
3. Konkretną teoretyczną ilość powietrza – liczbę kilomoli powietrza potrzebną do całkowitego spalenia jednego kilometra paliwa, oblicza się ze wzoru:
Gdzie 4,76 to ilość powietrza zawierająca jednostkową ilość tlenu,
Stosunek współczynników stechiometrycznych tlenu cząsteczkowego i benzenu.
Podstawiając do (4) wartości V O2 =7,5 i V C6H6 =1 otrzymujemy:
4. Nadmiar powietrza na 1 kmol paliwa określa się ze wzoru:
powietrze do spalania pary benzenowej
Podstawianie wartości do tego wyrażenia
37,7(0,2-1)=30,16(7)
5. Ogólną ilość produktów spalania przypadającą na jednostkę ilości substancji paliwowej ustala się sumą:
Po podstawieniu wartości i otrzymujemy:
6. Ułamki molowe produktów spalania, wyrażone procentowo, określa się w następujący sposób:
We wzorach (9) na ułamki molowe azotu i tlenu w produktach spalania 0,79 i 0,21 to ułamki molowe tych substancji w powietrzu, których nadmiar prowadzi do wzrostu udziału azotu i pojawienia się tlenu w produktach spalania.
7. Aby określić objętości właściwe i produkty spalania, należy obliczyć ich objętość molową – objętość jednego kilometra gazu w warunkach, w jakich produkty się znajdują:
gdzie 22,4 to objętość jednego kilomola gazu w normalnych warunkach, T 0 = 273 K to normalna temperatura, Po = 101325 Pa to normalne ciśnienie.
Podstawiając wartości Po, To do (10), otrzymujemy:
Objętość produktów powstałych podczas spalania jednego kilograma paliwa, bez uwzględnienia nadmiaru powietrza, oblicza się w następujący sposób:
gdzie jest masa molowa paliwa - masa jednego kilometra benzenu wyrażona w kilogramach. Masę molową benzenu oblicza się ze wzoru:
gdzie Ac i An to masy atomowe węgla (12) i wodoru (1), n c i n n to liczba atomów węgla (6) i wodoru (6) w cząsteczkach benzenu (C 6 H 6).
Zastępując wartości i w (12) otrzymujemy
Nadmiar powietrza na 1 kilogram paliwa określa się w następujący sposób:
gdzie jest objętością jednego kilomola nadmiaru powietrza wchodzącego w skład produktów spalania. Ponieważ temperatura i ciśnienie nadmiaru powietrza odpowiadają temperaturze i ciśnieniu produktów spalania, wówczas = =220,7.
Podstawiając tę wartość, a także w (14), otrzymujemy:
Aby obliczyć objętość właściwą produktów całkowitego spalania paliwa, założymy, że para benzenu ma temperaturę Tg pod ciśnieniem:
gdzie jest objętością jednego kilomola par benzenu w temperaturze Tg i ciśnieniu Pg. Objętość molową paliwa oblicza się ze wzoru:
Zastępując wynikową wartość i takie wartości w (17), otrzymujemy:
Nadmiar powietrza na metr sześcienny oparów benzenu określa się w następujący sposób:
Podstawienie do (20) wartości =30,16 , =i
daje następujący wynik:
Całkowita objętość właściwa produktów spalania, biorąc pod uwagę nadmiar powietrza, jest określana przez sumę
Wynik obliczeń:
XCO2 =%; XH2O = 4,4%; XN2 =%; X O2 = 11,7%
Podobne dokumenty
Obliczanie współczynnika palności nitrobenzenu C6H5NO2 i dwusiarczku węgla CS2. Równanie reakcji spalania octanu propylu w powietrzu. Obliczanie objętości powietrza i produktów spalania podczas spalania gazu palnego. Oznaczanie temperatury zapłonu toluenu za pomocą wzoru V. Blinowa.
test, dodano 08.04.2017
Obliczanie objętości powietrza i produktów spalania powstających podczas spalania substancji. Równanie reakcji spalania glikolu etylenowego w powietrzu. Spalanie mieszaniny gazów palnych. Obliczanie temperatury spalania adiabatycznego dla mieszaniny stechiometrycznej. Spalanie propanolu.
test, dodano 17.10.2012
Rodzaj spalania i jego główne parametry. Chemiczna przemiana paliwa i utleniacza w produkty spalania. Równania bilansu materiałowego i cieplnego reakcji spalania. Wpływ współczynnika nadmiaru powietrza na skład produktów spalania i temperaturę spalania.
test, dodano 17.01.2013
Wyznaczanie objętości powietrza potrzebnej do całkowitego spalenia jednostki masy substancji palnej. Skład produktów spalania na jednostkę masy substancji palnej. Granice rozprzestrzeniania się płomienia gazów, par, mieszanin pyłowo-powietrznych. Wybuchowe ciśnienie rozkładu.
praca na kursie, dodano 23.12.2013
Opracowanie środków zapobiegania powstawaniu pożarów i wybuchów, ocena warunków ich rozwoju i tłumienia. Pojęcie stopnia wypalenia zawodowego, metoda jego wyznaczania. Procedura układania równania reakcji spalania. Obliczanie objętości powietrza potrzebnego do spalania.
praca na kursie, dodano 07.10.2014
Oznaczanie składu produktów całkowitego spalania gazu. Obliczanie temperatury spalania adiabatycznego mieszaniny gazów przy stałej objętości i stałym ciśnieniu. Stałe kinetyczne reakcji samozapłonu gazu ziemnego. Granica palności mieszaniny gazów.
praca na kursie, dodano 19.02.2014
Charakterystyka przemysłowych metod alkilowania benzenu propylenem. Zasady alkilowania benzenu olefinami technologia chemiczna. Problemy projektowania instalacji do procesu alkilowania benzenu. Opis technologii procesu produkcyjnego.
teza, dodano 15.11.2010
Spalanie jako potężny proces utleniania. Rodzaje spalania: tlenie i spalanie płomieniem. Eksplozja jak szczególny przypadek spalanie. Właściwości elektryczne płomień. Różnorodne produkty spalania w wyniku niepełnego spalania paliwa. Filtracja dymu przez wodę.
praca naukowa, dodano 29.07.2009
Wyznaczanie objętości powietrza potrzebnej do całkowitego spalenia danej ilości propanu. Obliczanie zmian entalpii, entropii i energii Gibbsa z wykorzystaniem konsekwencji prawa Hessa. Definicja masy molowe równoważniki środka utleniającego i środka redukującego.
test, dodano 08.02.2012
Metody określania zużycia oleju absorpcyjnego, stężenia benzenu w oleju absorpcyjnym opuszczającym absorber. Obliczanie średnicy i wysokości absorbera z wypełnieniem. Wyznaczanie wymaganej powierzchni grzewczej w sześcianie kolumny oraz natężenia przepływu pary grzewczej.
Właściwości fizyczne
Benzen i jego najbliższe homologi to bezbarwne ciecze o specyficznym zapachu. Węglowodory aromatyczne są lżejsze od wody i nie rozpuszczają się w niej, ale łatwo rozpuszczają się w rozpuszczalnikach organicznych - alkoholu, eterze, acetonie.
Benzen i jego homologi same w sobie są dla wielu dobrymi rozpuszczalnikami materia organiczna. Wszystkie areny płoną dymiącym płomieniem ze względu na wysoką zawartość węgla w ich cząsteczkach.
Właściwości fizyczne niektórych aren przedstawiono w tabeli.
Tabela. Właściwości fizyczne niektórych aren
|
Nazwa |
Formuła |
t°.pl., |
t°.b.p., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metylobenzen) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Etylobenzen |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ksylen (dimetylobenzen) |
C 6 H 4 (CH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
para- |
13,26 |
138,35 |
|
|
Propylobenzen |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Kumen (izopropylobenzen) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Styren (winylobenzen) |
C 6 H 5 CH=CH 2 |
30,6 |
145,2 |
Benzen – niskowrzące ( Tbela= 80,1°C), bezbarwna ciecz, nierozpuszczalna w wodzie
Uwaga! Benzen – trucizna, wpływa na nerki, zmienia skład krwi (przy długotrwałym narażeniu), może zaburzać strukturę chromosomów.
Większość węglowodorów aromatycznych jest zagrażająca życiu i toksyczna.
Wytwarzanie arenów (benzenu i jego homologów)
W laboratorium
1. Fuzja soli kwasu benzoesowego ze stałymi zasadami
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
benzoesan sodu
2. Reakcja Wurtza-Fittera: (tutaj G oznacza halogen)
C 6H 5 -G + 2Nie + R-G →C 6 H 5 - R + 2 NieG
Z 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
W przemyśle
- izolowany z ropy naftowej i węgla metodą destylacji frakcyjnej i reformingu;
- ze smoły węglowej i gazu koksowniczego
1. Dehydrocyklizacja alkanów z więcej niż 6 atomami węgla:
C6H14 T , kat→C 6H 6 + 4H 2
2. Trimeryzacja acetylenu(tylko dla benzenu) – R. Zelińskiego:
3С 2 H 2 600°C, Działać. węgiel→C 6 H 6
3. Odwodornienie cykloheksan i jego homologi:
Radziecki akademik Nikołaj Dmitriewicz Zelinski ustalił, że benzen powstaje z cykloheksanu (odwodornienie cykloalkanów
C6H12 t, kat→C 6H 6 + 3H 2

C6H11-CH3 T , kat→C 6H 5 -CH 3 + 3H 2
metylocykloheksantoluen
4. Alkilowanie benzenu(przygotowanie homologów benzenu) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6H 5 -C 2 H 5 + HCl
chloroetan etylobenzen

Właściwości chemiczne arenów
I. REAKCJE UTLENIANIA
1. Spalanie (dymiący płomień):
2C6H6 + 15O2 T→12CO 2 + 6H 2 O + Q
2. W normalnych warunkach benzen nie odbarwia wody bromowej i roztwór wodny nadmanganian potasu
3. Homologi benzenu utlenia się nadmanganianem potasu (odbarwia nadmanganian potasu):
A) w środowisku kwaśnym do kwasu benzoesowego
Kiedy homologi benzenu są wystawione na działanie nadmanganianu potasu i innych silnych środków utleniających, łańcuchy boczne ulegają utlenieniu. Bez względu na to, jak złożony jest łańcuch podstawnika, ulega on zniszczeniu, z wyjątkiem atomu węgla a, który utlenia się do grupy karboksylowej.
Homologi benzenu z jednym łańcuchem bocznym dają kwas benzoesowy:
Homologi zawierające dwa łańcuchy boczne dają kwasy dwuzasadowe:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Uproszczony :
C6H5-CH3+3O KMnO4→C 6H 5COOH + H 2 O
B) w obojętnych i lekko zasadowych solach kwasu benzoesowego
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. REAKCJE DODAWANIA (twardszy niż alkeny)
1. Halogenowanie
C6H6+3Cl2 H ν → C 6 H 6 Cl 6 (heksachlorocykloheksan - heksachloran)
2. Uwodornienie
C6H6 + 3H2 T , PtLubNi→C 6 H 12 (cykloheksan)
3. Polimeryzacja
III. REAKCJE PODSTAWIENIA – mechanizm jonowy (lżejszy od alkanów)
1. Halogenowanie -
A ) benzen
C6H6+Cl2 AlCl 3 → C 6H 5 -Cl + HCl (chlorobenzen)
C6H6 + 6Cl2 t, AlCl3→C 6Cl 6 + 6HCl( heksachlorobenzen)
C 6 H 6 + Br 2 t, FeCl3→ C 6H 5-Br + HBr( bromobenzen)
b) homologi benzenu po napromienianiu lub ogrzewaniu
Właściwości chemiczne rodników alkilowych są podobne do alkanów. Atomy wodoru w nich są zastępowane przez halogen za pomocą mechanizmu wolnorodnikowego. Dlatego przy braku katalizatora, po podgrzaniu lub napromieniowaniu UV, w łańcuchu bocznym zachodzi reakcja podstawienia rodnikowego. Wpływ pierścienia benzenowego na podstawniki alkilowe prowadzi do tego, że Atom wodoru jest zawsze zastępowany przy atomie węgla bezpośrednio związanym z pierścieniem benzenowym (atom węgla).
1) C6H5-CH3 + Cl2 H ν → C 6H 5 -CH 2 -Cl + HCl
c) homologi benzenu w obecności katalizatora
C6H5-CH3 + Cl2 AlCl 3 → (mieszanina orta, para pochodnych) +HCl
2. Nitrowanie (z kwasy azotowe Auć)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6H 5 -NO 2 + H 2 O
nitrobenzen - zapach migdały!
C 6H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ Z H 3-C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotoluen (tol, TNT)
Zastosowanie benzenu i jego homologów
Benzen C6H6 jest dobrym rozpuszczalnikiem. Benzen jako dodatek poprawiający jakość paliwa silnikowego. Służy jako surowiec do produkcji wielu aromatycznych związków organicznych - nitrobenzenu C 6 H 5 NO 2 (rozpuszczalnik, z którego otrzymuje się anilinę), chlorobenzenu C 6 H 5 Cl, fenolu C 6 H 5 OH, styrenu itp.
Toluen C 6 H 5 –CH 3 – rozpuszczalnik, stosowany do produkcji barwników, środków leczniczych i materiałów wybuchowych (TNT (TNT), czyli 2,4,6-trójnitrotoluen TNT).
Ksyleny C6H4(CH3)2. Ksylen techniczny jest mieszaniną trzech izomerów ( orto-, meta- I para-ksyleny) – stosowane jako rozpuszczalnik i produkt wyjściowy w syntezie wielu związków organicznych.
Izopropylobenzen C 6 H 5 –CH(CH 3) 2 wykorzystuje się do produkcji fenolu i acetonu.
Chlorowane pochodne benzenu stosowany do ochrony roślin. Zatem produktem zastąpienia atomów H w benzenie atomami chloru jest heksachlorobenzen C 6 Cl 6 - środek grzybobójczy; służy do suchego zaprawiania nasion pszenicy i żyta przeciwko głowni. Produktem addycji chloru do benzenu jest heksachlorocykloheksan (heksachloran) C 6 H 6 Cl 6 - środek owadobójczy; służy do zwalczania szkodliwych owadów. Wymienione substancje są klasyfikowane jako pestycydy - chemikalia walka z mikroorganizmami, roślinami i zwierzętami.
Styren C 6 H 5 – CH = CH 2 bardzo łatwo polimeryzuje tworząc polistyren, a przy kopolimeryzacji z butadienem kauczuki styrenowo-butadienowe.
WIDEO
Areny to węglowodory aromatyczne zawierające jeden lub więcej pierścieni benzenowych. Pierścień benzenowy składa się z 6 atomów węgla, pomiędzy którymi występują naprzemiennie wiązania podwójne i pojedyncze.
Należy zauważyć, że wiązania podwójne w cząsteczce benzenu nie są stałe, ale stale poruszają się po okręgu.
Areny nazywane są również węglowodorami aromatycznymi. Pierwszy członek szereg homologiczny- benzen - C 6 H 6. Ogólny wzór ich serii homologicznej to CnH2n-6.
Przez długi czas formuła strukturalna benzen pozostawał tajemnicą. Wzór zaproponowany przez Kekule'a z dwoma potrójnymi wiązaniami nie mógł wyjaśnić faktu, że benzen nie wchodzi w reakcje addycji. Jak wspomniano powyżej, zgodnie ze współczesnymi koncepcjami wiązania podwójne w cząsteczce stale się poruszają, dlatego bardziej poprawne jest narysowanie ich w postaci pierścienia.
Z powodu podwójnych wiązań w cząsteczce benzenu powstaje koniugacja. Wszystkie atomy węgla są w stanie hybrydyzacji sp 2. Kąt wiązania - 120°.
Nazewnictwo i izomeria arenów
Nazwy arenów powstają poprzez dodanie nazw podstawników do głównego łańcucha - pierścienia benzenowego: benzen, metylobenzen (toluen), etylobenzen, propylobenzen itp. Zamienniki, jak zwykle, wymienione są w kolejności alfabetycznej. Jeśli w pierścieniu benzenowym znajduje się kilka podstawników, wybierana jest najkrótsza droga między nimi.

Areny charakteryzują się izomerią strukturalną związaną z pozycją podstawników. Na przykład dwa podstawniki w pierścieniu benzenowym mogą znajdować się w różnych pozycjach.
Pozycję podstawników w pierścieniu benzenowym nazywa się na podstawie ich pozycji względem siebie. Oznacza się go przedrostkami orto-, meta- i para. Poniżej znajdziesz wskazówki mnemoniczne, jak skutecznie je zapamiętać ;)

Zdobywanie aren
Areny zdobywa się na kilka sposobów:

Właściwości chemiczne arenów
Areny to węglowodory aromatyczne zawierające pierścień benzenowy ze sprzężonymi wiązaniami podwójnymi. Ta cecha sprawia, że reakcje addycji są trudne (a jednak możliwe!)
Należy pamiętać, że w odróżnieniu od innych związków nienasyconych, benzen i jego homologi nie odbarwiają wody bromowej i roztworu nadmanganianu potasu.

© Bellevich Yuri Sergeevich 2018-2020
Ten artykuł został napisany przez Jurija Siergiejewicza Bellewicza i stanowi jego własność intelektualną. Kopiowanie, rozpowszechnianie (w tym kopiowanie do innych witryn i zasobów w Internecie) lub jakiekolwiek inne wykorzystanie informacji i obiektów bez uprzedniej zgody właściciela praw autorskich jest karalne. W celu uzyskania materiałów do artykułu i zgody na ich wykorzystanie prosimy o kontakt
Przedstawiamy Państwu lekcję wideo poświęconą tematowi „Właściwości chemiczne benzenu”. Dzięki temu filmowi możesz poznać właściwości chemiczne benzenu, a także trudne warunki, w jakich benzen reaguje z innymi substancjami.
Temat:Aromatyczne węglowodory
Lekcja:Właściwości chemiczne benzenu
Ryż. 1. Cząsteczka benzenu
Trudno jest rozbić chmurę p-elektronów w cząsteczce benzenu. Dlatego wchodzi benzen reakcje chemiczne znacznie mniej aktywny w porównaniu do związków nienasyconych.


Aby benzen wszedł w reakcje chemiczne, wymagane są dość rygorystyczne warunki: podwyższona temperatura i w wielu przypadkach katalizator. W większości reakcji stabilny pierścień benzenowy zostaje zachowany.
1. Bromowanie.

Wymagany jest katalizator (żelazo (III) lub bromek glinu), a nawet niewielkie ilości wody są niedopuszczalne. Rola katalizatora polega na tym, że cząsteczka bromu jest przyciągana przez jeden z atomów bromu do atomu żelaza. W rezultacie ulega polaryzacji – para elektronów wiążących trafia do atomu bromu związanego z żelazem:
Br +…. br - lut 3 .
Br+ jest silnym elektrofilem. Przyciąga się do sześcioelektronowej chmury pierścienia benzenowego i rozbija ją, tworząc wiązanie kowalencyjne z atomem węgla:
Do powstałego kationu mógłby dołączyć anion bromu. Jednak redukcja układu aromatycznego pierścienia benzenowego jest energetycznie korzystniejsza niż dodanie anionu bromowego. Dlatego cząsteczka przechodzi w stan stabilny, wyrzucając jon wodoru:
Wszystkie reakcje podstawienia elektrofilowego w pierścieniu benzenowym przebiegają według podobnego mechanizmu.
2. Nitrowanie

Benzen i jego homologi reagują z mieszaniną stężonych kwasów siarkowego i azotowego (mieszanina nitrująca). W mieszaninie nitrującej jon nitronowy NO 2 + występuje w równowadze, czyli jest elektrofilowy:

3. Sulfonowanie.
Benzen i inne areny po podgrzaniu reagują ze stężonym kwasem siarkowym lub oleum - roztworem SO 3 w kwasie siarkowym:

4 . Alkilowanie Friedela-Craftsa
5. Alkilowanie alkenami

Reakcje te są niekorzystne energetycznie i dlatego zachodzą tylko po podgrzaniu lub napromieniowaniu.
1. Uwodornienie.
Po podgrzaniu pod podwyższonym ciśnieniem i w obecności katalizatora Ni, Pt lub Pd, benzenu i innych arenów dodaje się wodór, tworząc cykloheksan:

2. Chlorowanie benzenu.
Pod wpływem promieniowania ultrafioletowego benzen dodaje chlor. Jeśli kolbę ze szkła kwarcowego zawierającą roztwór chloru w benzenie wystawi się na działanie światła słonecznego, roztwór szybko odbarwi się, a chlor połączy się z benzenem, tworząc 1,2,3,4,5,6-heksachlorocykloheksan, znany jako heksachloran(wcześniej stosowany jako środek owadobójczy):

3. Spalanie benzenu.
W przeciwieństwie do alkanów, benzen i inne węglowodory aromatyczne mają jasny, dymny płomień.
Podsumowanie lekcji
Na tej lekcji zapoznałeś się z tematem „Właściwości chemiczne benzenu”. Korzystając z tego materiału, można było poznać właściwości chemiczne benzenu, a także trudne warunki, jakie są niezbędne, aby benzen reagował z innymi substancjami.
Bibliografia
1. Rudzitis G.E. Chemia. Podstawy chemia ogólna. Klasa 10: podręcznik dla instytucje edukacyjne: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
2. Chemia. klasa 10. Poziom profilu: podręcznik dla edukacji ogólnej instytucje/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i wsp. - M.: Drop, 2008. - 463 s.
3. Chemia. Klasa 11. Poziom profilu: akademicki. dla edukacji ogólnej instytucje/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i wsp. - M.: Drop, 2010. - 462 s.
4. Chomczenko G.P., Chomczenko I.G. Zbiór problemów z chemii dla osób rozpoczynających naukę na uniwersytetach. - 4. wyd. - M .: RIA „Nowa fala”: Wydawca Umerenkov, 2012. - 278 s.
Praca domowa
1. Nr 13, 14 (s. 62) Rudzitis G.E., Feldman F.G. Chemia: Chemia organiczna. Klasa 10: podręcznik dla placówek kształcenia ogólnego: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
2. Dlaczego związki aromatyczne czy różnią się właściwościami chemicznymi od węglowodorów nasyconych i nienasyconych?
3. Napisz równania reakcji spalania etylobenzenu i ksylenu.