Podczas przechodzenia przez roztwór lub stopiony elektrolit prąd elektryczny, na elektrodach następuje uwolnienie substancji rozpuszczonych lub innych substancji będących produktami reakcji wtórnych zachodzących na elektrodach. Ten proces fizyczny i chemiczny nazywa się elektrolizą.
Istota elektrolizy
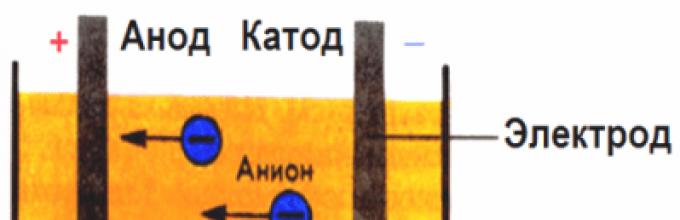
W polu elektrycznym wytwarzanym przez elektrody jony w cieczy przewodzącej wprawiają się w uporządkowany ruch. Elektroda ujemna to katoda, elektroda dodatnia to anoda.
Jony ujemne zwane anionami (jony grupy hydroksylowej i reszty kwasowe) przepływają do anody, a jony dodatnie zwane kationami (jony wodoru, metalu, amonowe itp.) pędzą do katody.

Na elektrodach zachodzi proces redoks: na katodzie następuje elektrochemiczna redukcja cząstek (atomów, cząsteczek, kationów), a na anodzie następuje elektrochemiczne utlenianie cząstek (atomów, cząsteczek, anionów). Reakcje dysocjacji w elektrolicie są reakcjami pierwotnymi, a reakcje zachodzące bezpośrednio na elektrodach nazywane są reakcjami wtórnymi.
Podział reakcji elektrolizy na pierwotne i wtórne pomógł Michaelowi Faradaya ustalić prawa elektrolizy:
Pierwsze prawo elektrolizy Faradaya: masa substancji osadzonej na elektrodzie podczas elektrolizy jest wprost proporcjonalna do ilości energii elektrycznej przekazanej do tej elektrody. Przez ilość prądu mamy na myśli ładunek elektryczny, zwykle mierzony w kulombach.
Drugie prawo elektrolizy Faradaya: dla danej ilości energii elektrycznej (ładunku elektrycznego) masa pierwiastek chemiczny osadzone na elektrodzie jest wprost proporcjonalne do równoważnej masy elementu. Masa równoważna substancji to jej masa masa cząsteczkowa, podzielone przez liczbę całkowitą w zależności od reakcji chemicznej, w której uczestniczy substancja.
![]()
m to masa substancji osadzonej na elektrodzie, Q to całkowity ładunek elektryczny przechodzący przez substancję F = 96 485,33(83) C mol−1 to stała Faradaya, M to masa molowa substancji (np. masa wody H2O = 18 g /mol), z jest liczbą walencyjną jonów substancji (liczbą elektronów na jon).
Należy zauważyć, że M/z jest równoważną masą osadzonej substancji. W przypadku pierwszego prawa Faradaya M, F i z są stałymi, zatem im większa wartość Q, tym większa będzie wartość m. W przypadku drugiego prawa Faradaya Q, F i z są stałymi, więc im większa wartość M/z (masa równoważna), tym większa będzie wartość m.
Elektroliza jest dziś szeroko stosowana w przemyśle i technologii. Na przykład elektroliza jest jednym z najskuteczniejsze sposoby produkcja przemysłowa wodór, nadtlenek wodoru, dwutlenek manganu, glin, sód, magnez, wapń i inne substancje. Do czyszczenia stosuje się elektrolizę Ścieki, w galwanizacji, w galwanoplastyce i wreszcie w chemicznych źródłach prądu. Ale najpierw najważniejsze.
Dzięki elektrolizie wiele metali wydobywa się z rud i poddaje dalszej obróbce. Tak więc, gdy rudę lub wzbogaconą rudę – koncentrat – traktuje się odczynnikami, metal przechodzi do roztworu, a następnie metal jest oddzielany od roztworu poprzez ekstrakcję elektryczną. Czysty metal wydziela się na katodzie. W ten sposób otrzymuje się cynk, miedź i kadm.
Metale poddawane są elektrorafinacji w celu usunięcia zanieczyszczeń i przekształcenia zawartych w nich zanieczyszczeń do postaci dogodnej do dalszej obróbki. Oczyszczony metal odlewa się w postaci płytek, które służą jako anody w procesie elektrolizy.
Kiedy przepływa prąd, metal anodowy rozpuszcza się, przechodzi do roztworu w postaci kationów, następnie kationy są wyładowywane na katodzie i tworzą osad czystego metalu. Zanieczyszczenia anody nie rozpuszczają się - wypadają w postaci szlamu anodowego lub przedostają się do elektrolitu, skąd są usuwane w sposób ciągły lub okresowy.

Weźmy jako przykład elektrorafinacja miedzi. Głównym składnikiem roztworu jest siarczan miedzi – najpopularniejsza i najtańsza sól tego metalu. Roztwór ma niską przewodność elektryczną. Aby go zwiększyć, do elektrolitu dodaje się kwas siarkowy.
Dodatkowo do roztworu wprowadza się niewielkie ilości dodatków, które pomagają uzyskać zwarty osad metalu. Generalnie miedź, nikiel, ołów, cyna, srebro i złoto poddawane są rafinacji elektrolitycznej.
Elektrolizę wykorzystuje się w oczyszczaniu ścieków (procesy elektrokoagulacji, elektroekstrakcji i elektroflotacji). Metoda czyszczenia elektrochemicznego jest jedną z najczęściej stosowanych. Do elektrolizy stosuje się anody nierozpuszczalne (magnetyt, tlenek ołowiu, grafit, mangan, które są nakładane na bazę tytanową) lub rozpuszczalne (aluminium, żelazo).
Metodę tę stosuje się do izolowania toksycznych substancji organicznych i substancje nieorganiczne. Na przykład rury miedziane są odkamieniane roztworem kwasu siarkowego, a następnie ścieki przemysłowe muszą zostać oczyszczone poprzez elektrolizę za pomocą nierozpuszczalnej anody. Na katodzie wydziela się miedź, którą można ponownie wykorzystać w tym samym przedsiębiorstwie.
Ścieki alkaliczne oczyszcza się metodą elektrolizy w celu usunięcia związków cyjanku. Aby przyspieszyć utlenianie cyjanków, zwiększyć przewodność elektryczną i zaoszczędzić energię, do wody stosuje się dodatek w postaci chlorku sodu.
Elektrolizę przeprowadza się za pomocą anody grafitowej i katody stalowej. Cyjanki ulegają zniszczeniu podczas utleniania elektrochemicznego i przez chlor uwalniający się na anodzie. Skuteczność takiego czyszczenia jest bliska 100%.

Oprócz bezpośredniego czyszczenia elektrochemicznego można go włączyć do procesu elektrolizy koagulacja. Eliminując dodatek soli, elektrolizę przeprowadza się za pomocą rozpuszczalnych anod aluminiowych lub żelaznych. Wtedy nie tylko zanieczyszczenia na anodzie zostaną zniszczone, ale sama anoda ulegnie rozpuszczeniu. Tworzą się aktywne, zdyspergowane związki, które koagulują (zagęszczają) rozproszone zanieczyszczenia koloidalne.
Metoda ta jest skuteczna w oczyszczaniu ścieków z tłuszczów, produktów naftowych, barwników, olejów, substancji radioaktywnych itp. Nazywa się ją elektrokoagulacją.

Galwanizacja to elektrolityczne nakładanie niektórych metali w celu zabezpieczenia wyrobów przed korozją i nadania im odpowiedniej estetyki (powlekanie odbywa się za pomocą chromu, niklu, srebra, złota, platyny itp.). Przedmiot jest dokładnie czyszczony, odtłuszczany i stosowany jako katoda w kąpieli elektrolitycznej, do której wlewa się roztwór soli metalu, którym ma być pokryty przedmiot.
Jako anodę stosuje się płytkę z tego samego metalu. Z reguły stosuje się parę płytek anodowych, a pomiędzy nimi umieszcza się przedmiot przeznaczony do galwanizacji.
Galwanizacja - osadzanie metalu na powierzchni różne ciała do odtworzenia ich kształtu: formy do odlewania części, rzeźby, klisze drukarskie itp.

Galwaniczne osadzanie metalu na powierzchni przedmiotu jest możliwe tylko wtedy, gdy ta powierzchnia lub cały przedmiot jest przewodnikiem prądu elektrycznego, dlatego pożądane jest stosowanie metali do produkcji modeli lub form. Do tego celu najlepiej nadają się metale niskotopliwe: ołów, cyna, lutowie, stop Wooda.
Metale te są miękkie, łatwe w obróbce narzędziami do obróbki metali oraz łatwe do grawerowania i odlewania. Po nałożeniu warstwy galwanicznej i wykończeniu, z gotowego produktu wytapia się metal formy.
Jednak największe możliwości tworzenia modeli nadal dają materiały dielektryczne. Aby metalizować takie modele, konieczne jest nadanie ich powierzchni przewodności elektrycznej. Sukces lub porażka ostatecznie zależy głównie od jakości warstwy przewodzącej. Warstwę tę można nakładać na jeden z trzech sposobów.
Najczęstszym sposobem jest grafityzacja nadaje się do modeli wykonanych z plasteliny i innych materiałów umożliwiających rozcieranie grafitu na powierzchni.
Następna sztuczka - brązownictwo metoda jest dobra w przypadku modeli o stosunkowo skomplikowanych kształtach, dla różnych materiałów, jednak ze względu na grubość warstwy brązu odwzorowanie drobnych detali jest nieco zniekształcone.
I w końcu srebrzenie, odpowiedni we wszystkich przypadkach, ale szczególnie niezbędny w przypadku delikatnych modeli z bardzo złożony kształt- rośliny, owady itp.
Chemiczne źródła prądu
Elektroliza to także główny proces, w ramach którego działają najnowocześniejsze chemiczne źródła energii, takie jak baterie i akumulatory. Z elektrolitem stykają się dwie elektrody.
Bateria cytrynowa (kliknij na zdjęcie, aby powiększyć)

Działanie chemicznych źródeł prądu polega na występowaniu przestrzennie oddzielonych procesów w zamkniętym obwodzie zewnętrznym: na anodzie ujemnej następuje utlenienie środka redukującego, powstałe wolne elektrony przechodzą przez obwód zewnętrzny do katody dodatniej, tworząc prąd wyładowczy , gdzie biorą udział w reakcji redukcji środka utleniającego. Zatem przepływ ujemnie naładowanych elektronów przez obwód zewnętrzny przechodzi od anody do katody, to znaczy od elektrody ujemnej do dodatniej.
Elektroliza na skalę przemysłową służy do ekstrakcji metali z rud zawierających metale i oczyszczania ich z zanieczyszczeń. Dzięki temu procesowi fizycznemu i chemicznemu podczas produkcji powstaje miedź i aluminium. W wyniku wystąpienia tej reakcji następuje także ładowanie chemicznych źródeł prądu (baterii).
Definicja elektrolizy
Reakcja chemiczna, w wyniku której na elektrodach osadzają się składniki z roztworów elektrolitycznych substancji i zachodząca pod wpływem prądu elektrycznego – to właśnie jest elektroliza. Obejmuje zespół procesów utleniania i redukcji zachodzących na elektrodach. Warunkiem jest ruch prąd stały od elektrody do elektrody.
Jaki jest proces?
Proces technologiczny elektrolizy, zwany także galwanolizą, przebiega zgodnie z prawami chemii i fizyki. W tym przypadku przyjmuje się roztwory przewodzące prąd elektryczny (ciecze), w których pole elektryczne jest zorganizowane za pomocą dwóch elektrod.
Uwaga! Elektrody mają nazwy. Katoda (K) jest elektrodą o potencjale ujemnym, anoda (A) jest elektrodą o potencjale dodatnim.
Jony przemieszczają się w sposób uporządkowany przez roztwór zwany elektrolitem. W tym przypadku jony należące do metali, wodór (kationy) kierowane są do katody, jony należące do reszt kwasowych lub grup hydroksylowych (aniony) zmierzają do anody. Kationy mają dodatni znak ładunku, aniony mają znak ujemny. Przepuszczanie prądu elektrycznego podczas elektrolizy można przeprowadzić zarówno przez roztwory, jak i stopione elektrolity.
Informacja. Podczas przygotowywania elektrolitu roztwór dysocjuje na jony. Dzieje się tak na skutek interakcji rozpuszczalnika z substancją rozpuszczoną. Reakcja ta nazywana jest pierwotną. Dalsza ekspozycja elektrolitu na działanie prądu elektrycznego powoduje wtórną reakcję galwanolizy.
Ten podział na pierwotne i wtórne pozwolił Michaelowi Faradaya uzasadnić prawa stosowane przy galwanolizie.

Elektroliza roztworów
Użycie wody do przygotowania roztworu elektrolitu komplikuje ten proces. W roztworach soli i zasad woda zachowuje się inaczej podczas elektrolizy. Znajduje to odzwierciedlenie w fakcie, że H2O zachowuje się zarówno jako środek utleniający, jak i reduktor. Na katodzie odbiera elektrony i redukuje atomy wodoru do gazowej postaci wodoru. Na anodzie woda wydziela ujemnie naładowane cząstki, następnie atomy tlenu utleniają się do gazowej postaci tlenu. Kwas stosowany jako roztwór elektrolitu nie powoduje tego problemu.
Procesy katodowe
Katoda umieszczona w roztworach soli przyciąga kationy metali. Kationy te działają jako środki utleniające.
Ważny! Poszczególne metale mają różną zdolność utleniania jonów. Aby ocenić możliwości utleniania i redukcji, należy oprzeć się na elektrochemicznym szeregu napięć.

Wartość ECP jest względna, dlatego poszczególne jony mają różne wartości ECP. Dla wodoru jest to zero.
Podczas procesu elektrolizy zachodzącego w roztworach soli zidentyfikowano następujące obserwacje:
- gdy aktywny M występuje w solach, to nie one ulegają redukcji na katodzie, ale wodór;
- jeśli M w elektrolicie ma średnią aktywność, wówczas zarówno wodór, jak i M są wyładowywane (redukowane) na katodzie;
- gdy M jest nieaktywne, ulega jedynie redukcji na katodzie, ponieważ jego jon jest silniejszym środkiem utleniającym niż jon wodorowy.
Przykładami takich procesów na katodzie są następujące reakcje:
- z aktywnym M: 2H2O +2ē → H2 + 2OH-;
- przy M średniej aktywności: Men+ + nē → Me0 i 2H+2O +2ē → H20 + 2OH-, gdzie Me oznacza rozpuszczony metal;
- w przypadku nieaktywnego M w solach: Men+ + nē → Me0.
Należy zauważyć, że kationy wodoru H+ oddziałując z katodą, ulegają rozładowywaniu do cząsteczek wodoru – 2H+ + 2ē → H20
Procesy anodowe
Dodatkowo nałożony na anodę przyciąga aniony wraz z cząsteczkami wody. W tym przypadku anoda jest utleniaczem, a reduktorem są cząsteczki H2O lub aniony reszt kwasowych.
Podczas galwanolizy na anodzie zachodzą następujące reakcje:
- reszty kwasowe niezawierające tlenu ulegają utlenieniu stopień zerowy utlenianie: neМen- – nē = neМе0, gdzie – neМе jest niemetalem;
- gdy pozostałość zawiera tlen, woda utlenia się i uwalnia cząsteczki tlenu (tlen cząsteczkowy O2): 2H2O-2 – 4ē → O20 + 4H+;
- w przypadku kontaktu z anodą utlenia się także jon wodorotlenkowy: 4O-2H– – 4ē → O20 + 2H2O, uwalniając tlen cząsteczkowy.
Wyjątek. Fluor ma wyższą elektroujemność niż tlen. Dlatego elektroliza roztworów fluorków przebiega poprzez utlenianie cząsteczek wody zamiast jonów fluorkowych.
Całkowite procesy elektrolizy
To, co dzieje się w ogólnej reakcji galwanolizy, można rozważyć na przykładzie chlorku sodu. Kiedy przez elektrody przepływa prąd elektryczny, następuje:
- katoda – H – na niej następuje redukcja wodoru: 2H+2O +2ē → H20 + 2OH–;
- anoda – na elektrodzie następuje utlenianie jonów chlorkowych: 2Cl– – 2ē → Cl20.
Jony sodu nie biorą udziału w tej reakcji elektrolizy. Są one jednak uwzględniane w całkowitym równaniu roztworu chlorku sodu podczas elektrolizy. To wygląda jak:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
Elektroliza stopów
Jeśli porównamy galwanolizę wytopów i roztworów, to w wytopach wszystkie M: aktywne, niskoaktywne i nieaktywne, reagują na proces elektryfikacji w ten sam sposób.
Uwaga! Podczas elektrolizy stopów w elektrolicie nie ma wody. Dlatego nie ma żadnych powikłań związanych z jego interwencją. Opis takiej reakcji można rozważyć na przykładzie stopionego NaCl (chlorku sodu).
W tym przypadku kationy Na ulegają redukcji na katodzie:
Na+ + ē → Na0.
Anoda powoduje utlenianie anionów Cl:
2Cl– – 2ē → Cl20.
Ogólne równanie galwanolizy stopionego NaCl będzie wyglądało następująco:
2Na+Cl– → 2Na0 + Cl2O.

Elektroliza z elektrodami rozpuszczalnymi
W tym przypadku elektrolizę metali przeprowadza się za pomocą elektrod wykonanych z tego samego M, który jest obecny w elektrolicie. Elektrody mogą być również wykonane z M o wyższej aktywności.
Ważny! Podczas tego procesu na anodzie nie ulegają redukcji aniony ani cząsteczki H2O, ale sama anoda ulega utlenieniu. Jego cząsteczki rozpuszczają się (utleniają) i ulegają redukcji na katodzie.
W przypadku anody miedzianej podczas elektrolizy miedzi, gdzie elektrolitem jest siarczan miedzi, dzieje się co następuje:
- jony miedzi wchodzące do roztworu ulegają redukcji na katodzie: Cu2+ + 2ē → Cu0;
- w anodzie miedzianej utleniają się cząsteczki miedzi: Cu0 – 2ē → Cu2+.
Tak więc, jeśli jako anodę podczas galwanolizy w siarczanie miedzi zostanie użyty kęs miedzi zawierający zanieczyszczenia, na katodzie osadzi się czysta miedź. Elektroda anodowa rozpuści się.

Oto lista niektórych metali, które mogą być elektrodami rozpuszczalnymi:
- miedź (Cu);
- srebro (Ag);
- cynk (Zn);
- kobalt (Co);
- cyna (Sn);
- nikiel (Ni);
- kadm (Cd).
Na rozpuszczalnej anodzie w początkowej fazie elektrolizy procesy zachodzą przy minimalnych ilościach standardowy potencjał na elektrodzie. Jeśli elektroliza nie zostanie zatrzymana, wartość potencjału odchyli się w kierunku ujemnym. Jest to spowodowane polaryzacją wynikającą z obecności elektronów na katodzie.
Dla Twojej informacji. Podczas elektrolizy potencjały elektrod mogą odbiegać od ich pierwotnej wartości. Zjawisko to nazywa się polaryzacją. Może być elektrochemiczny i koncentracyjny.
Metale aktywne
Jest to rodzaj metalu, który łatwo reaguje. W układzie okresowym są to pierwiastki I i II grupy. Ponieważ właściwości metaliczne elementy słabną w rzędzie od lewej do prawej, to należą do nich:
- metale alkaliczne: lit, potas, sód, cez, frans, rubid;
- pierwiastki ziem alkalicznych: beryl, magnez, wapń, stront, bar, rad;
- aluminium.
Metale te mają jeden lub dwa elektrony walencyjne i łatwo je oddają, będąc czynnikami redukującymi. DO cechy charakterystyczne metale aktywne odnieść się:
- miękkość;
- łatwość;
- niska temperatura topnienia.
Podczas interakcji z tlenem (w powietrzu) metale alkaliczne możliwy jest samozapłon. Spontaniczne spalanie metali ziem alkalicznych następuje wraz ze wzrostem temperatury. Kiedy wchodzą w interakcję z wodą, tworzą się zasady i wodór, a gdy reagują z kwasami, tworzą sole.
Metale mniej aktywne i metale nieaktywne
Średnią aktywność wykazują metale w szeregu po aluminium Al i przed wodorem H2.
Pierwiastki nieaktywne obejmują pierwiastki na prawo od wodoru: miedź (Cu), rtęć (Hg), srebro (Ag), platynę (Pt), złoto (Au).

Praktyczne zastosowanie w produkcji
Proces elektrochemiczny, taki jak elektroliza, którego przykłady można zobaczyć wszędzie, jest integralną częścią przemysłu:
- otrzymywanie chemicznie czystych surowców: fluoru, chloru, zasad, czystego wodoru i tlenu itp.;
- zastosowanie elektrolizy w hydrometalurgii: przetwarzanie surowców zawierających metale;
- elektrorafinacja (zastosowanie rozpuszczalnych anod) do końcowego oczyszczania metali;
- elektroekstrakcja (zastosowanie nierozpuszczalnych anod) w celu oddzielenia pożądanych metali od roztworów;
- procesy galwaniczne: galwanoplastyka i galwanostegia.
Informacja. Procesy elektrolizy nie przebiegają w sposób niekontrolowany. W obwodzie elektrolizera znajduje się kulometr miedziany. Jednostką miary tego urządzenia jest 1 C (kulomb). W tym przypadku ilość wyniku (produktu) reakcji anodowych i katodowych jest kontrolowana przy 100% mocy wyjściowej pod względem prądu wymaganego do zajścia reakcji.
Galwanizacja to metoda elektrochemicznego powlekania powierzchni metali innymi metalami:
- stal poddawana jest niklowaniu, chromowaniu, cynkowaniu;
- miedź powlekana jest srebrem, niklem i innymi metalami.
Powierzchnia podstawy jest obrabiana w taki sposób, że powłoka mocno przylega i chroni konstrukcję przed wpływami czynniki zewnętrzne. Jednocześnie produktom nadano estetyczny wygląd.
Galwanizacja pozwala uzyskać dokładne kopie przedmiotu wykonanego z metali szlachetnych. Szeroko stosowany w produkcji matryc, kopii rzeźb, biżuterii i części o złożonej geometrii. W tej metodzie ważne jest oddzielenie przedmiotu obrabianego od powłoki.

Elektroliza otwiera szerokie możliwości pracy z metalami i elektrolitami. Dzięki temu procesowi można samodzielnie wykonywać prace nie tylko w zakresie galwanizacji, ale także uzyskiwać czyste metale w małych ilościach. Jednocześnie nie należy mylić spontanicznych reakcji chemicznych w ogniwach galwanicznych z reakcjami zachodzącymi w elektrolizerach.
Wideo
Elektroliza jest szeroko stosowana w sektorze przemysłowym, na przykład do produkcji aluminium (aparaty z wypalanymi anodami PA-300, PA-400, PA-550 itp.) czy chloru (jednostki przemysłowe Asahi Kasei). W życiu codziennym ten proces elektrochemiczny był stosowany znacznie rzadziej, czego przykładem może być elektrolizer basenowy Intellichlor czy spawarka plazmowa Star 7000. Wzrost cen paliw, gazu i ogrzewania radykalnie zmienił sytuację, sprawiając, że pomysł popularna elektroliza wody w domu. Zastanówmy się, jakie są urządzenia do rozdzielania wody (elektrolizery) i jaka jest ich konstrukcja, a także jak zrobić proste urządzenie własnymi rękami.
Co to jest elektrolizer, jego charakterystyka i zastosowanie
Tak nazywa się urządzenie do procesu elektrochemicznego o tej samej nazwie, które wymaga zewnętrznego źródła zasilania. Strukturalnie urządzenie to jest wanną wypełnioną elektrolitem, w której umieszczone są dwie lub więcej elektrod.
Główną cechą takich urządzeń jest wydajność, często ten parametr jest wskazany w nazwie modelu, na przykład w stacjonarnych instalacjach do elektrolizy SEU-10, SEU-20, SEU-40, MBE-125 (elektrolizery membranowe) itp. . W tych przypadkach liczby wskazują produkcję wodoru (m 3 /h).
Jeśli chodzi o pozostałe cechy, zależą one od konkretnego rodzaju urządzenia i zakresu zastosowania, np. w przypadku przeprowadzania elektrolizy wody na wydajność instalacji wpływają następujące parametry:

Zatem przykładając 14 woltów do wyjść, otrzymamy 2 wolty na każde ogniwo, podczas gdy płytki po każdej stronie będą miały inny potencjał. Elektrolizery wykorzystujące podobny system łączenia płyt nazywane są elektrolizerami suchymi.
- Odległość między płytkami (między przestrzenią katodową a anodową), im jest mniejsza, tym mniejszy będzie opór, a zatem większy prąd przepłynie przez roztwór elektrolitu, co doprowadzi do zwiększonego wytwarzania gazu.
- Wymiary płytki (czyli powierzchnia elektrod) są wprost proporcjonalne do prądu przepływającego przez elektrolit, a zatem również wpływają na wydajność.
- Stężenie elektrolitu i jego bilans cieplny.
- Charakterystyka materiału, z którego wykonuje się elektrody (złoto jest materiałem idealnym, ale zbyt drogim, dlatego w domowych obwodach stosuje się stal nierdzewną).
- Zastosowanie katalizatorów procesowych itp.
Jak wspomniano powyżej, instalacje tego typu mogą służyć jako generator wodoru do produkcji chloru, aluminium lub innych substancji. Znajdują również zastosowanie jako urządzenia oczyszczające i dezynfekujące wodę (UPEV, VGE), a także przeprowadzają analiza porównawcza jego właściwości (Tesp 001).

Interesują nas przede wszystkim urządzenia wytwarzające gaz Browna (wodór z tlenem), ponieważ to właśnie ta mieszanina ma wszelkie szanse na zastosowanie jako alternatywny nośnik energii lub dodatek do paliw. Przyjrzymy się im nieco później, ale na razie przejdźmy do budowy i zasady działania prostego elektrolizera, który rozdziela wodę na wodór i tlen.
Urządzenie i szczegółowa zasada działania
Urządzenia do produkcji gazu detonującego ze względów bezpieczeństwa nie polegają na jego akumulacji, czyli mieszanina gazowa jest spalana bezpośrednio po wytworzeniu. Upraszcza to nieco konstrukcję. W poprzedniej sekcji sprawdziliśmy główne kryteria, które wpływają na wydajność urządzenia i nakładają pewne wymagania wydajnościowe.
Zasadę działania urządzenia pokazano na rysunku 4, do elektrod zanurzonych w roztworze elektrolitu podłącza się źródło napięcia stałego. W rezultacie zaczyna przez niego przepływać prąd, którego napięcie jest wyższe niż temperatura rozkładu cząsteczek wody.
 Rysunek 4. Projekt prostego elektrolizera
Rysunek 4. Projekt prostego elektrolizera W wyniku tego procesu elektrochemicznego katoda uwalnia wodór, a anoda tlen w stosunku 2 do 1.
Rodzaje elektrolizerów
Przyjrzyjmy się krótko cechom konstrukcyjnym głównych typów urządzeń do rozdzielania wody.
Suchy
Budowę urządzenia tego typu pokazano na rysunku 2, którego osobliwością jest to, że manipulując liczbą ogniw, można zasilić urządzenie ze źródła o napięciu znacznie przekraczającym minimalny potencjał elektrody.
Przepływ przez
Uproszczoną konstrukcję urządzeń tego typu przedstawiono na rysunku 5. Jak widać, konstrukcja obejmuje wannę z elektrodami „A” całkowicie wypełnioną roztworem oraz zbiornik „D”.
 Rysunek 5. Konstrukcja elektrolizera przepływowego
Rysunek 5. Konstrukcja elektrolizera przepływowego Zasada działania urządzenia jest następująca:
- na wejściu procesu elektrochemicznego gaz wraz z elektrolitem jest wciskany do pojemnika „D” rurą „B”;
- w zbiorniku „D” oddziela się gaz od roztworu elektrolitu, który jest odprowadzany przez zawór wylotowy „C”;
- elektrolit powraca do kąpieli hydrolitycznej rurką „E”.
Membrana
Główną cechą urządzeń tego typu jest zastosowanie stałego elektrolitu (membrany) na bazie polimeru. Konstrukcję urządzeń tego typu można zobaczyć na rysunku 6.
 Rysunek 6. Elektrolizer membranowy
Rysunek 6. Elektrolizer membranowy Główną cechą takich urządzeń jest podwójne zadanie membrany: nie tylko przenosi protony i jony, ale także poziom fizyczny oddziela zarówno elektrody, jak i produkty procesu elektrochemicznego.
Membrana
W przypadkach, gdy dyfuzja produktów elektrolizy pomiędzy komorami elektrod jest niedopuszczalna, stosuje się porowatą membranę (od której wzięła się nazwa tego typu urządzeń). Materiałem do tego może być ceramika, azbest lub szkło. W niektórych przypadkach do wytworzenia takiej membrany można zastosować włókna polimerowe lub watę szklaną. Rysunek 7 przedstawia najprostszą wersję urządzenia membranowego do procesów elektrochemicznych.

Wyjaśnienie:
- Wylot tlenu.
- Kolba w kształcie litery U.
- Wylot wodoru.
- Anoda.
- Katoda.
- Membrana.
Alkaliczny
Proces elektrochemiczny jest niemożliwy w wodzie destylowanej, jako katalizator stosuje się stężony roztwór alkaliczny (stosowanie soli jest niepożądane, ponieważ powoduje to uwolnienie chloru). Na tej podstawie większość urządzeń elektrochemicznych do rozdzielania wody można nazwać alkalicznymi.
Na forach tematycznych zaleca się stosowanie wodorotlenku sodu (NaOH), który w przeciwieństwie do sody oczyszczonej (NaHCO 3) nie powoduje korozji elektrody. Należy pamiętać, że ten ostatni ma dwie istotne zalety:
- Można stosować elektrody żelazne.
- Nie wydzielają się żadne szkodliwe substancje.
Ale jedna istotna wada neguje wszystkie zalety sody oczyszczonej jako katalizatora. Jego stężenie w wodzie nie przekracza 80 gramów na litr. Zmniejsza to mrozoodporność elektrolitu i jego przewodność prądową. Jeśli pierwszy może być nadal tolerowany w ciepłym sezonie, drugi wymaga zwiększenia powierzchni płytek elektrodowych, co z kolei zwiększa rozmiar konstrukcji.
Elektrolizer do produkcji wodoru: rysunki, schemat
Przyjrzyjmy się, jak można zrobić potężny palnik gazowy zasilany mieszaniną wodoru i tlenu. Schemat takiego urządzenia można zobaczyć na rysunku 8.
 Ryż. 8. Projekt palnika wodorowego
Ryż. 8. Projekt palnika wodorowego Wyjaśnienie:
- Dysza palnika.
- Gumowe rurki.
- Drugie uszczelnienie wodne.
- Pierwsza foka wodna.
- Anoda.
- Katoda.
- Elektrody.
- Kąpiel elektrolizera.
Rysunek 9 przedstawia schematyczny diagram zasilania elektrolizera naszego palnika.
 Ryż. 9. Zasilanie palnika elektrolizy
Ryż. 9. Zasilanie palnika elektrolizy Do potężnego prostownika będziemy potrzebować następujących części:
- Tranzystory: VT1 – MP26B; VT2 – P308.
- Tyrystory: VS1 – KU202N.
- Diody: VD1-VD4 – D232; VD5 – D226B; VD6, VD7 – D814B.
- Kondensatory: 0,5 µF.
- Rezystory zmienne: R3 -22 kOhm.
- Rezystory: R1 – 30 kOhm; R2 – 15 kOhm; R4 – 800 omów; R5 – 2,7 kOhm; R6 – 3 kOhm; R7 – 10 kOhm.
- PA1 to amperomierz ze skalą pomiarową co najmniej 20 A.
Krótka instrukcja dotycząca części elektrolizera.
Wannę można wykonać ze starej baterii. Płyty należy wyciąć z blachy dachowej o wymiarach 150x150 mm (grubość blachy 0,5 mm). Aby pracować z opisanym powyżej zasilaczem, będziesz musiał zmontować elektrolizer z 81 ogniwami. Rysunek montażu pokazano na rysunku 10.
 Ryż. 10. Rysunek elektrolizera palnika wodorowego
Ryż. 10. Rysunek elektrolizera palnika wodorowego Należy pamiętać, że obsługa i zarządzanie takim urządzeniem nie nastręcza trudności.
Elektrolizer DIY do samochodu
W Internecie można znaleźć wiele schematów systemów HHO, które zdaniem autorów pozwalają zaoszczędzić od 30% do 50% paliwa. Stwierdzenia takie są zbyt optymistyczne i z reguły nie poparte żadnymi dowodami. Uproszczony schemat takiego układu pokazano na rysunku 11.
 Uproszczony schemat elektrolizera do samochodu
Uproszczony schemat elektrolizera do samochodu Teoretycznie takie urządzenie powinno zmniejszyć zużycie paliwa ze względu na jego całkowite wypalenie. W tym celu mieszanina Browna jest dostarczana do filtra powietrza układu paliwowego. Jest to wodór i tlen pozyskiwany z elektrolizera zasilanego z sieci wewnętrznej samochodu, co zwiększa zużycie paliwa. Błędne koło.
Oczywiście można zastosować obwód regulatora prądu PWM, można zastosować bardziej wydajny zasilacz impulsowy lub można zastosować inne sztuczki w celu zmniejszenia zużycia energii. Czasami w Internecie można spotkać oferty zakupu zasilacza o niskim natężeniu prądu do elektrolizera, co jest ogólnie bzdurą, ponieważ wydajność procesu zależy bezpośrednio od aktualnej siły.
To jest jak system Kuzniecowa, w którym utracono aktywator wody, brakuje patentu itp. W powyższych filmach, w których opowiadają o niezaprzeczalnych zaletach takich systemów, praktycznie nie ma uzasadnionych argumentów. Nie oznacza to, że pomysł nie ma prawa zaistnieć, ale deklarowane oszczędności są „nieco” przesadzone.
Elektrolizer DIY do ogrzewania domu
Wykonanie domowego elektrolizera do ogrzewania domu ten moment nie ma sensu, ponieważ koszt wodoru uzyskanego w drodze elektrolizy jest znacznie droższy niż gazu ziemnego lub innych chłodziw.
Należy również wziąć pod uwagę, że żaden metal nie jest w stanie wytrzymać temperatury spalania wodoru. To prawda, że istnieje rozwiązanie opatentowane przez Stana Martina, które pozwala obejść ten problem. Warto zwrócić uwagę na kluczową kwestię, która pozwala odróżnić wartościowy pomysł od oczywistych bzdur. Różnica między nimi polega na tym, że ten pierwszy otrzymuje patent, a drugi znajduje swoich zwolenników w Internecie.
Na tym można by zakończyć artykuł o elektrolizerach domowych i przemysłowych, warto jednak dokonać krótkiego przeglądu firm produkujących te urządzenia.
Przegląd producentów elektrolizerów
Podajemy producentów produkujących ogniwa paliwowe w oparciu o elektrolizery część firm produkuje także urządzenia gospodarstwa domowego: NEL Hydrogen (Norwegia, na rynku od 1927 r.), Hydrogenics (Belgia), Teledyne Inc (USA), Uralkhimmash (Rosja), RusAl (Rosja, znacznie ulepszona technologia Soderberga), RutTech (Rosja).
Elektroliza (grecki elektron - bursztyn + liza - rozkład) - Reakcja chemiczna, co występuje, gdy prąd stały przepływa przez elektrolit. Jest to rozkład substancji na części składowe pod wpływem prądu elektrycznego.
Proces elektrolizy polega na przemieszczaniu się kationów (jonów naładowanych dodatnio) do katody (naładowanych ujemnie) i jonów naładowanych ujemnie (anionów) do anody (naładowanych dodatnio).
Zatem aniony i kationy pędzą odpowiednio do anody i katody. To tutaj zachodzi reakcja chemiczna. Aby skutecznie rozwiązać problemy w tym temacie i zapisać reakcje, konieczne jest oddzielenie procesów na katodzie i anodzie. Dokładnie tak będzie skonstruowany ten artykuł.
Katoda
Do katody przyciągają kationy - jony naładowane dodatnio: Na +, K +, Cu 2+, Fe 3+, Ag + itp.
Aby ustalić, jaka reakcja zachodzi na katodzie, należy przede wszystkim określić aktywność metalu: jego położenie w elektrochemicznym szeregu napięć metalu.

Jeśli na katodzie pojawi się aktywny metal (Li, Na, K), wówczas zamiast tego ulegają redukcji cząsteczki wody, z których uwalnia się wodór. Jeśli metal ma średnią aktywność (Cr, Fe, Cd), na katodzie wydziela się zarówno wodór, jak i sam metal. Metale o niskiej aktywności są uwalniane na katodzie w czystej postaci (Cu, Ag).
Pragnę zauważyć, że aluminium jest uważane za granicę między metalami aktywnymi i średnioaktywnymi w szeregu napięciowym. Podczas elektrolizy na katodzie metale, łącznie z aluminium, nie ulegają redukcji, lecz zamiast tego ulegają redukcji cząsteczki wody i uwalnia się wodór.
Jeśli do katody dostarczane są jony wodoru - H + (na przykład podczas elektrolizy kwasów HCl, H 2 SO 4), wodór jest redukowany z cząsteczek kwasu: 2H + - 2e = H 2
Anoda
Do anody przyciągane są aniony - jony naładowane ujemnie: SO 4 2-, PO 4 3-, Cl -, Br -, I -, F -, S 2-, CH 3 COO -.

Podczas elektrolizy anionów zawierających tlen: SO 4 2-, PO 4 3- - na anodzie utleniają się nie aniony, ale cząsteczki wody, z których uwalniany jest tlen.
Aniony beztlenowe utleniają się i uwalniają odpowiednie halogeny. Jon siarczkowy podczas utleniania i utleniania siarki. Wyjątkiem jest fluor – jeśli dostanie się do anody, cząsteczka wody zostanie wyładowana i uwolniony zostanie tlen. Fluor jest pierwiastkiem najbardziej elektroujemnym i dlatego stanowi wyjątek.
Aniony kwasów organicznych utleniają się w specjalny sposób: rodnik sąsiadujący z grupą karboksylową podwaja się, a sama grupa karboksylowa (COO) przekształca się w dwutlenek węgla - CO2.
Przykłady rozwiązań
Podczas treningu możesz natknąć się na metale, które pominąłeś w serii ćwiczeń. Na etapie nauki możesz skorzystać z rozszerzonej oferty zajęć metalowych.

Teraz będziesz dokładnie wiedział co wydziela się na katodzie ;-)
Zatem poćwiczmy. Dowiedzmy się, co powstaje na katodzie i anodzie podczas elektrolizy roztworów AgCl, Cu(NO 3) 2, AlBr 3, NaF, FeI 2, CH 3 COOLi.

Czasami zadania wymagają zapisania reakcji elektrolizy. Powiem ci: jeśli rozumiesz, co powstaje na katodzie i co powstaje na anodzie, wówczas napisanie reakcji nie jest trudne. Weźmy na przykład elektrolizę NaCl i zapiszmy reakcję:
NaCl + H 2 O → H 2 + Cl 2 + NaOH
Sód jest metalem aktywnym, dlatego na katodzie wydziela się wodór. Anion nie zawiera tlenu, wydziela się chlorowiec - chlor. Zapisujemy równanie, żeby sód nie odparował bez śladu :) Sód reaguje z wodą tworząc NaOH.
Zapiszmy reakcję elektrolizy dla CuSO 4:
CuSO 4 + H 2 O → Cu + O 2 + H 2 SO 4
Miedź jest metalem o niskiej aktywności, dlatego jest uwalniana w czystej postaci na katodzie. Anion zawiera tlen, więc w reakcji uwalnia się tlen. Jon siarczanowy nigdzie nie znika, łączy się z wodorem wody i zamienia się w szary kwas.
Elektroliza stopów
Wszystko, co omówiliśmy do tej pory, dotyczyło elektrolizy roztworów, w których rozpuszczalnikiem jest woda.
Chemia przemysłowa stoi przed ważnym zadaniem - otrzymaniem metali (substancji) w czystej postaci. Metale niskoaktywne (Ag, Cu) można łatwo otrzymać poprzez elektrolizę roztworów.
A co z aktywnymi metalami: Na, K, Li? Rzeczywiście, podczas elektrolizy ich roztworów nie są one uwalniane na katodzie w czystej postaci, lecz zamiast tego cząsteczki wody ulegają redukcji i uwalnia się wodór. Tutaj z pomocą przychodzą topniki niezawierające wody.

W bezwodnych stopach reakcje są zapisywane jeszcze prościej: substancje rozkładają się na części składowe:
AlCl 3 → Al + Cl 2
LiBr → Li + Br 2
© Bellevich Yuri Sergeevich 2018-2020
Ten artykuł został napisany przez Jurija Siergiejewicza Bellewicza i stanowi jego własność intelektualną. Kopiowanie, rozpowszechnianie (w tym kopiowanie do innych witryn i zasobów w Internecie) lub jakiekolwiek inne wykorzystanie informacji i obiektów bez uprzedniej zgody właściciela praw autorskich jest karalne. W celu uzyskania materiałów do artykułu i zgody na ich wykorzystanie prosimy o kontakt
Elektroliza to reakcja redoks zachodząca na elektrodach, gdy prąd elektryczny przepływa przez stopiony roztwór lub roztwór elektrolitu.
Katoda jest czynnikiem redukującym i oddaje elektrony kationom.
Anoda jest środkiem utleniającym i przyjmuje elektrony z anionów.
|
Szeregi aktywności kationów: |
Na + , Mg 2+ , Al 3+ , Zn 2+ , Ni 2+ , Sn 2+ , Pb 2+ , H+ , Cu2+ , Ag + _____________________________→ Zwiększona pojemność oksydacyjna |
|
Seria aktywności anionów: |
I - , Br - , Cl - , OH - , NO 3 - , CO 3 2- , SO 4 2- ←__________________________________ Zwiększona zdolność regeneracji |
Procesy zachodzące na elektrodach podczas elektrolizy stopów
(nie zależą od materiału elektrod i charakteru jonów).
1. Aniony są wyładowywane na anodzie ( Jestem - ; OH-
A m - - m ē → A °; 4 OH - - 4ē → O 2 + 2 H 2 O (procesy utleniania).
2. Kationy są wyładowywane na katodzie ( Me n + , H + ), zamieniając się w neutralne atomy lub cząsteczki:
Me n + + n ē → Me °; 2 H. + + 2ē → H. 2 0 (procesy odzyskiwania).
Procesy zachodzące na elektrodach podczas elektrolizy roztworów
|
KATODA (-) Nie zależy od materiału katody; zależą od położenia metalu w szeregu naprężeń |
ANODA (+) Zależy od materiału anody i charakteru anionów. |
|
|
Anoda jest nierozpuszczalna (obojętna), tj. zrobiony z węgiel, grafit, platyna, złoto. |
Anoda jest rozpuszczalna (aktywna), tj. zrobiony zCu, Ag, Zn, Ni, Fei inne metale (z wyjątkiemPt, Au) |
|
|
1. Przede wszystkim redukowane są kationy metali, które znajdują się w szeregu naprężeń poH 2 : Me n+ +nē → Me° |
1. Przede wszystkim utleniają się aniony kwasów beztlenowych (z wyjątkiemF - ): A m- - mē → A° |
Aniony nie utleniają się. Atomy metalu anody ulegają utlenieniu: Me° - nē → Me n+ Mężczyźni + kationy przejdź do rozwiązania. Masa anody maleje. |
|
2.Kationy metali o średniej aktywności, stojące pomiędzyGlin I H 2 , są przywracane jednocześnie z wodą: Me n+ + nē →Me° 2H 2O + 2ē → H 2 + 2OH - |
2.Aniony oksokwasów (WIĘC 4 2- , WSPÓŁ 3 2- ,..) I F - nie utleniają się, cząsteczki ulegają utlenieniuH 2 O : 2H 2O - 4ē → O 2 +4H + |
|
|
3. Kationy metali aktywnych zLi zanim Glin (włącznie) nie są redukowane, ale cząsteczki są przywracaneH 2 O : 2 H 2 O + 2ē →H 2 + 2OH - |
3. Podczas elektrolizy roztworów alkalicznych jony ulegają utlenieniuOH- : 4OH - - 4ē → O 2 +2H 2 O |
|
|
4. Podczas elektrolizy roztworów kwasowych kationy ulegają redukcji H+: 2H + + 2ē → H 2 0 |
||
ELEKTROLIZA STOPÓW
Ćwiczenie 1. Narysuj schemat elektrolizy stopionego bromku sodu. (Algorytm 1.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
NaBr → Na + + Br - |
|
|
K- (katoda): Na+, A+ (anoda): Br - |
|
|
K + : Na + + 1ē → Na 0 (powrót do zdrowia), A + : 2 Br - - 2ē → Br 2 0 (utlenianie). |
|
|
2NaBr = 2Na +Br2 |
Zadanie 2. Narysuj schemat elektrolizy stopionego wodorotlenku sodu. (Algorytm 2.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
NaOH → Na + + OH - |
|
|
2.Pokaż ruch jonów do odpowiednich elektrod |
K- (katoda): Na+, A + (anoda): OH -. |
|
3. Sporządzać schematy procesów utleniania i redukcji |
K - : Na + + 1ē → Na 0 (powrót do zdrowia), A + : 4 OH - - 4ē → 2 H 2 O + O 2 (utlenianie). |
|
4. Utwórz równanie elektrolizy stopionego alkalia |
4NaOH = 4Na + 2H 2 O + O 2 |
Zadanie 3.Narysuj schemat elektrolizy stopionego siarczanu sodu. (Algorytm 3.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
1. Utwórz równanie dysocjacji soli |
Na 2 SO 4 → 2Na + + SO 4 2- |
|
2.Pokaż ruch jonów do odpowiednich elektrod |
K- (katoda): Na+ A+ (anoda): SO 4 2- |
|
K - : Na + + 1ē → Na 0 , A + : 2SO 4 2- - 4ē → 2SO 3 + O 2 |
|
|
4. Utwórz równanie elektrolizy stopionej soli |
2Na2SO4 = 4Na + 2SO3 + O2 |
ELEKTROLIZA ROZTWORÓW
Ćwiczenie 1.Narysuj schemat elektrolizy wodnego roztworu chlorku sodu przy użyciu elektrod obojętnych. (Algorytm 1.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
1. Utwórz równanie dysocjacji soli |
NaCl → Na + + Cl - |
|
Jony sodu w roztworze nie ulegają redukcji, zatem ulega redukcji woda. Jony chloru ulegają utlenieniu. |
|
|
3. Sporządzać schematy procesów redukcji i utleniania |
K - : 2H 2 O + 2ē → H 2 + 2OH - A + : 2Cl - - 2ē → Cl 2 |
|
2NaCl + 2H2O = H2 + Cl2 + 2NaOH |
Zadanie 2.Narysuj schemat elektrolizy wodnego roztworu siarczanu miedzi ( II ) przy użyciu elektrod obojętnych. (Algorytm 2.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
1. Utwórz równanie dysocjacji soli |
CuSO 4 → Cu 2+ + SO 4 2- |
|
2. Wybierz jony, które będą wyładowywane na elektrodach |
Jony miedzi ulegają redukcji na katodzie. Na anodzie w roztworze wodnym jony siarczanowe nie ulegają utlenieniu, więc woda ulega utlenieniu. |
|
3. Sporządzać schematy procesów redukcji i utleniania |
K - : Cu 2+ + 2ē → Cu 0 A + : 2H 2O - 4ē → O 2 +4H + |
|
4.Ułóż równanie elektrolizy roztwór wodny sól |
2CuSO4 +2H2O = 2Cu + O2 + 2H2SO4 |
Zadanie 3.Narysuj schemat elektrolizy wodnego roztworu wodnego roztworu wodorotlenku sodu przy użyciu elektrod obojętnych. (Algorytm 3.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
1. Utwórz równanie dysocjacji zasady |
NaOH → Na + + OH - |
|
2. Wybierz jony, które będą wyładowywane na elektrodach |
Jony sodu nie mogą zostać zredukowane, więc woda ulega redukcji na katodzie. Jony wodorotlenkowe utleniają się na anodzie. |
|
3. Sporządzać schematy procesów redukcji i utleniania |
K - : 2 H 2 O + 2ē → H 2 + 2 OH - A + : 4 OH - - 4ē → 2 H 2 O + O 2 |
|
4.Ułóż równanie elektrolizy wodnego roztworu zasady |
2 H. 2 O = 2 H. 2 + O 2 , tj. Elektroliza wodnego roztworu alkalicznego sprowadza się do elektrolizy wody. |
Pamiętać.Podczas elektrolizy kwasów zawierających tlen (H 2 SO 4 itp.), zasady (NaOH, Ca (OH) 2 itp.) , sole metali aktywnych i kwasów zawierających tlen(K 2 SO 4 itp.) Elektroliza wody zachodzi na elektrodach: 2 H. 2 O = 2 H. 2 + O 2
Zadanie 4.Narysuj schemat elektrolizy wodnego roztworu azotanu srebra przy użyciu anody wykonanej ze srebra, tj. anoda jest rozpuszczalna. (Algorytm 4.)
|
Sekwencjonowanie |
Wykonywanie akcji |
|
1. Utwórz równanie dysocjacji soli |
AgNO 3 → Ag + + NO 3 - |
|
2. Wybierz jony, które będą wyładowywane na elektrodach |
Jony srebra ulegają redukcji na katodzie, a srebrna anoda rozpuszcza się. |
|
3. Sporządzać schematy procesów redukcji i utleniania |
K-: Ag + + 1ē → Ag 0 ; Odpowiedź +: Ag 0 - 1ē → Ag + |
|
4. Utwórz równanie elektrolizy wodnego roztworu soli |
Ag + + Ag 0 = Ag 0 + Ag + Elektroliza sprowadza się do przeniesienia srebra z anody na katodę. |