Długie okresy układu Mendelejewa, obejmujące tzw. dekady interkalarne, zawierają każdy po dziesięć elementów, dla których liczba elektronów w powłoce zewnętrznej jest równa dwa (dwa -elektrony) i które różnią się jedynie liczbą -elektronów W drugi na zewnątrz powłoka. Takimi pierwiastkami są na przykład skand do cynku lub itr do kadmu.
Druga powłoka z zewnątrz odgrywa mniejszą rolę w manifestowaniu właściwości chemicznych niż powłoka zewnętrzna, ponieważ połączenie między elektronami powłoki zewnętrznej a jądrem jest słabsze niż w drugi na zewnątrz. Zatem pierwiastki, w których atomach powłoki zewnętrzne są zbudowane identycznie, a różnią się jedynie drugie powłoki na zewnątrz, różnią się między sobą znacznie mniej właściwościami chemicznymi niż pierwiastki o różnej budowie powłok zewnętrznych. Zatem wszystkie pierwiastki dekad interkalarnych, które razem tworzą tak zwane podgrupy wtórne ośmiu głównych grup układu Mendelejewa, są metalami i wszystkie charakteryzują się zmienną wartościowością. W szósty okres układ okresowy, oprócz wstawionej dekady, po lantanie występuje jeszcze 14 pierwiastków, w których różnica w budowie powłok elektronowych objawia się dopiero w trzeciej zewnętrznej powłoce elektronowej (wypełnienie /-miejsc w czwartej powłoce następuje w obecności miejsc wypełnionych Pierwiastki te (lantanowce) na -23
W wyniku eksperymentów mających na celu określenie ładunków jąder atomowych do roku 4 całkowita liczba znanych pierwiastków - od wodoru (Z = 1) do uranu (Z = 92) - wyniosła 86. Sześć pierwiastków o liczbach atomowych = 43, W układzie brakowało 61, 72, 75, 85, 87. Jednak pomimo tych luk było już jasne, że w pierwszym okresie układu okresowego powinny znajdować się dwa pierwiastki - wodór i hel, w drugim i trzecim - po osiem elementów, w czwartym i piątym - po osiemnaście, w szóstym trzydzieści dwa elementy.13
Zanim wyjaśniono budowę szóstego okresu układu Mendelejewa, wśród pierwiastków ziem rzadkich poszukiwano pierwiastka nr 72 i nawet poszczególni naukowcy ogłaszali odkrycie tego pierwiastka. Kiedy stało się to jasne szósty okres układu okresowego zawiera 32 pierwiastki, z czego 14 to pierwiastki ziem rzadkich, wówczas N. Bohr wskazał, że pierwiastek nr 72 znajduje się już za pierwiastkami ziem rzadkich, w czwartej grupie i jest, zgodnie z oczekiwaniami Mendelejewa, analogiem cyrkonu.
Podobnie Bohr wskazał, że pierwiastek nr 75 należy do grupy siódmej i jest przewidywanym przez Mendelejewa analogiem manganu. Rzeczywiście, w 3 w rudach cyrkonu odkryto pierwiastek nr 72, zwany hafnem, i okazało się, że wszystko, co wcześniej nazywano cyrkonem, było zasadniczo mieszaniną cyrkonu i hafnu.
W tym samym roku 3 podjęto poszukiwania pierwiastka nr 75 w różnych minerałach, gdzie na podstawie związku z manganem spodziewano się obecności tego pierwiastka. Operacje chemiczne mające na celu wyizolowanie tego pierwiastka również opierały się na jego rzekomym podobieństwie właściwości do manganu. Poszukiwania zakończyły się w roku 5 naszej ery odkryciem nowego pierwiastka zwanego renem.24
Ale to nie wyczerpało jeszcze wszystkich możliwości sztucznego pozyskiwania nowych pierwiastków. Granica układ okresowy w obszarze jąder lekkich podaje wodór, ponieważ nie może istnieć pierwiastek o ładunku jądrowym mniejszym niż jeden.
Jednak w obszarze ciężkich jąder granica ta w żadnym wypadku nie jest wyznaczana przez uran. Tak naprawdę brak w przyrodzie pierwiastków cięższych od uranu wskazuje jedynie, że okresy półtrwania takich pierwiastków są znacznie krótsze niż wiek Ziemi. Dlatego spośród trzech drzew naturalnego rozpadu promieniotwórczego, obejmujących izotopy o liczbach masowych A = 4n, 4n- -2 i 4 4-3, tylko gałęzie rozpoczynające się od izotopów długookresowych Tb i 2 oraz Wszystkie gałęzie krótkookresowe, mówiąc w przenośni, wyschło i odpadło od niepamiętnych czasów. Ponadto czwarte drzewo rozpadu promieniotwórczego, obejmujące izotopy o liczbach masowych A = 4n + 1, całkowicie wyschło i obumarło, jeśli kiedykolwiek na Ziemi istniały izotopy tego szeregu.
Jak wiadomo, okresy czwarty i piąty układu Mendelejewa zawierają 18 pierwiastków, natomiast okres szósty zawiera 32 pierwiastki, gdyż pomiędzy pierwiastkiem trzeciej grupy – lantanem (nr 57) a pierwiastkiem czwartej grupy – hafnem (nr 72) znajdują się czternaście więcej pierwiastków ziem rzadkich podobnych do lantanu.
Po wyjaśnieniu struktury siódmego okresu układu D.I. Mendelejewa stało się jasne, że w układzie okresowym po pierwszym okresie dwóch elementów następują dwa okresy ośmiu elementów, następnie dwa okresy osiemnastu elementów i dwa okresy trzydziestu dwóch elementów elementy. W drugim takim okresie, który powinien zakończyć się elementem-. Tom nr., choć brakuje jeszcze siedemnastu pierwiastków, to dwa z nich to za mało do skompletowania rodziny aktynowców, a pierwiastek nr. powinien już znajdować się w czwartej grupie układu okresowego, będąc analogiem hafnu.
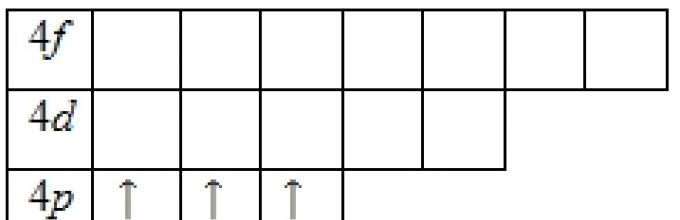
Gdy n + / = 5, wypełnione są poziomy l = 3, 1 = 2 (M), l = 4, / = 1 (4p) i wreszcie l = 5, / = O (55). Jeżeli przed wapniem wypełnianie poziomów elektronowych przebiegało w kolejności rosnącej liczby powłok elektronowych (15, 25, 2p, 33, 3p, 45), to po wypełnieniu 5-ciu miejsc czwartej powłoki elektronowej, zamiast kontynuować wypełnianie tej powłoka z /7-elektronami, rozpoczyna się zapełnianie poprzedniej, trzeciej, powłoki - elektrony. W sumie każda powłoka może zawierać, jak wynika z powyższego, 10 elektronów. Odpowiednio po wapniu w układzie okresowym następuje 10 pierwiastków od skandu (3452) do cynku (3452), w których atomach wypełniona jest warstwa - trzeciej powłoki, i dopiero wtedy znajduje się warstwa p czwartej powłoki wypełniony - od galu (3(Sh3 p) do kryptonu ZiShchz r). W rubidzie i stroncie, które rozpoczynają piąty okres, pojawia się 55 i 552 elektrony.19
Badania prowadzone w ciągu ostatnich piętnastu lat doprowadziły do sztucznej produkcji szeregu krótkotrwałych. izotopy jąder pierwiastków od rtęci do uranu, po wskrzeszenie dawno zmarłych rodziców uranu, protaktynu i toru w przyrodzie - pierwiastki sauranowe od nr 93 do nr - oraz rekonstrukcję czwartej serii rozpadów, w tym izotopy o liczbach masowych /4 = 4r-1. Szereg ten można warunkowo nazwać serią rozpadu neptunu, gdyż najdłużej żyjącym w szeregu jest izotop pierwiastka nr 93, którego okres półtrwania wynosi blisko 2 miliony lat.
Szósty okres rozpoczyna się od wypełnienia dwóch miejsc dla s-elektronów w szóstej powłoce, tak że struktura zewnętrznych powłok atomów pierwiastka nr 56 – baru – ma postać 4s j0 d 05s2p66s2. Oczywiste jest, że wraz z dalszym wzrostem liczby elektronów w atomach pierwiastków następujących po barze powłoki można wypełnić elektronami 4/-, bd- lub wreszcie br-elektronami. Już w czwartej i piątej kwarcie układ okresowy, zawierający 18 elementów, wypełniający miejsca d drugi na zewnątrz powłoka wystąpiła przed wypełnieniem punktów p powłoki zewnętrznej. Więc w szósty okres wypełnienie 6/7 miejsc zaczyna się dopiero od pierwiastka nr 81 – talu.W atomach dwudziestu czterech pierwiastków znajdujących się pomiędzy barem i talem czwarta powłoka jest wypełniona /-elektronami, a piąta powłoka d-elektronami.
Wzorce zmian aktywności pierwiastków d w tym okresie
Kategorie
Wybierz nagłówek 1. WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE ROPY I GAZU ZIEMNEGO 3. PODSTAWY ZAGOSPODAROWANIA I EKSPLOATACJI ZŁÓŻ NAFTOWYCH 3.1. Płynna eksploatacja odwiertów naftowych 3.4. Eksploatacja studni za pomocą zanurzeniowej wirówki elektrycznej 3.6. Koncepcja zagospodarowania odwiertów naftowych i gazowych 7. SPOSOBY ODDZIAŁYWANIA NA OBU STREFĘ BLISKOODWROTNĄ FORMACJI GŁÓWNE ELEMENTY ELEMENTÓW TESTERÓW FORMACJI SILNIKI ŚRUBOWE ZNIŻKOWE AWARYJNE I SPECJALNE TRYBY PRACY URZĄDZEŃ ELEKTRYCZNYCH JEDNOSTKI DO NAPRAWY I WIERCENIA STACJI ANALIZA PRZYCZYN KILKA ANALIZA WYDAJNOŚCI ODLEWÓW TECHNOLOGIE REMONTÓW ODWIEDNIÓW Armatura głowic odwiertów ZŁOŻA ŻYWICY-PARAFINY ASFALTU Bez wyrobisk BEZDYMNE SPALANIE GAZU BEZTŁOCZOWE JEDNOSTKI POMPOWE ODWIERTÓW JEDNOSTKI UKŁADÓW CYRKULACJI. zwalczanie hydratów ZWALCZANIE DEPOZYCJI PARAFIN W RURACH PRZENOŚNYCH wiercenie Wiercenie bocznic DYREKTYWNE STANY WIERTNICZE I STUDNIE POZIOME Wiercenie studni WIERTNICE WIERCENIE SZNUROWE AUTOMATYCZNE kleszcze STACJONARNE AGREGATÓW I INSTALACJI WIERCĄCYCH DO BADAŃ GEOLOGICZNYCH WIERCENIA WIERTNICE POMPY WIERCĄCE POMPY WIERCĄCE WĘŻE WIERTARCZE ZESTAW ING W ZAWRZE PERMAFROST (MMP). RODZAJE NIEJEDNORNORODNOŚCI W STRUKTURZE ZASOBÓW ROPY ROPY Rodzaje odwiertów ŚRUBOWE POMPY ZATAPIALNE NAPĘDZANE W GŁOWICY ZAWARTOŚĆ WILGOCI I GAZU ZIEMNEGO SKŁAD HYDRATU HYDRAT Wpływ różne czynniki na charakterystyce SDM PYTANIA DOTYCZĄCE OPTYMALIZACJI PRACY SYSTEMU ZBIORNIK-ESP DOBÓR URZĄDZENIA I TRYBU PRACY ESP DOBÓR MASZYNY POMPOWEJ Instalacja LN Wyciąg gazowy Eksploatacja odwiertów naftowych Wyciąg gazowy Metoda wydobycia ropy naftowej GAZÓW ROPY I POLA GAZOWE I ICH WŁAŚCIWOŚCI Tworzenie hydry w studniach kondensatu gazu Tworzenie hydratu w układzie odbioru ropy naftowej Zabezpieczenie hydrauliczne zanurzalnego silnika elektrycznego Hydrauliczna pompa tłokowa GIDROKEY GKSH-1500MT Rozdział 8. SPOSOBY I METODY KALIWACJI I KONTROLI UKŁADÓW POMIAROWYCH PRZEPŁYWU POMPY GŁĘBOKIE Wiercenie poziome GÓRNICTWO WARUNKI GEOLOGICZNE WIERCENIA ODBUDÓW NAFTOWYCH I GAZOWYCH GRANULOMETRYCZNY (MECHANIK CHESKY) SKŁAD SKAŁ DŁUGI DŁUGI TRANSPORT ODKSZTAŁCENIA ROPY I GAZU MIERNIKI CIŚNIENIA Elektryczne pompy membranowe ZESPÓŁ DIESLOWO-HYDRAULICZNY SAT-450 JEDNOSTKI DIESLA I WYSOKO-HYDRAULICZNE DYNAMOMETROWANIE DOLNYCH JEDNOSTEK Z KONSTRUKCJAMI LMP OJSC " ORENBURGNEFT" produkcja ropy naftowej produkcja ropy w trudnych warunkach PRODUKCJA OLEJU Z UŻYCIEM MIERNIKÓW CIŚNIENIA CIECZY SPU SILNIKI DOWNHEATOWE Wtłaczanie roztworów kwasów do odwiertu ARMATURA KONSTYTUCYJNA. OCHRONA URZĄDZEŃ ZŁOŻA NAFTOWEGO PRZED KOROZJĄ OCHRONA PRZED KOROZJĄ SPRZĘTU ZŁOŻA NAFTOWEGO ZMIANA PRZEBIEGU ODWIERU Pomiar ciśnienia, przepływu, cieczy, gazu i pary POMIAR ILOŚCI CIECZY I GAZÓW POMIAR PRZEPŁYWU CIECZY, GAZÓW I PAR POMIARY POZIOMU CIECZY POMIARY PRODUKTÓW NISKODOZYSKOWYCH TECHNOLOGIA INFORMATYCZNA W PRODUKCJI ROPY I GAZU BADANIA GRZEJNIKÓW ELEKTRYCZNYCH ODSTĘPÓW Badania studni głębinowych BADANIA EFEKTYWNOŚCI Kabel ESP remonty studni Kompleks urządzeń typu KOS i KOS1 PROJEKTOWANIE POMP ŚRUBOWYCH PROJEKTOWANIE ZESPOŁU ZAWOROWEGO korozja Dźwigi. STUDNIE MOCUJĄCE ROZLEWKI KTPPN Układ wahadłowy Środki bezpieczeństwa przy sporządzaniu roztworów kwasowych METODA OBLICZENIOWA LINII WIERTNICZYCH METODY ZWALCZANIA ZŁOŻEŃ PARAFIN W studzienach przepływowych Metody oddziaływania na strefę przyodwiertową w celu zwiększenia wydobycia ropy naftowej METODY I ŚRODKI POMIARU POZIOMU CIECZY EY Metody badania przekrojów odwiertów . METODY POŚREDNIEGO POMIARU CIŚNIENIA METODY USUWANIA SOLI MECHANIZMY RUCHU I USTAWIENIA WIERTNIC MECHANIZMY RUCHU I USTAWIENIA MECHANIZMÓW PODCZAS OPERACJI OLINOWANIA PODCZAS WIERCENIA OBCIĄŻENIA ODDZIAŁAJĄCE NA JEDNOSTCE Naziemny nowy sprzęt Eksploatacja studni RURKI POMPOWE I KOMPRESOROWE Zbiornik heterogeniczny Ropa i benzyna produkty eum Nowości portalu NOWOŚĆ TECHNOLOGICZNO-TECHNICZNA ZAPEWNIAJĄCA BEZPIECZEŃSTWO ŚRODOWISKOWE PROCESÓW PRODUKCYJNYCH URZĄDZENIA DO ODWRÓTÓW GAZOWYCH SPRZĘT DO MECHANIZACJI OPERACJI WYDOBYWCZYCH Sprzęt dla ropy i gazu SPRZĘT DO JEDNOCZESNEJ ODDZIELNEJ PRACY SPRZĘT DO Udostępniania ZASOBÓW OTWARTYCH NOWY SPRZĘT DO OGÓLNEGO ZASTOSOWANIA Wyposażenie odwiertów uzupełnione o wiercenie COMPRES SOR WELLHEAD WYPOSAŻENIE WYPOSAŻENIE GŁOWICY ODWROTÓW Wyposażenie głowicy wiertniczej do obsługi elektrofiltru WYPOSAŻENIE SZYB PRZEPŁYWOWYCH WYPOSAŻENIE ODSTĘPÓW PRZEPŁYWOWYCH Oczyszczanie strefy dennej TWORZENIE HYDRATÓW I SPOSOBY ICH ZWALCZANIA TWORZENIE SIĘ KRYSTALICZNYCH HYDRATÓW W ODLEWACH NAFTOWYCH POJĘCIA OGÓLNE DOTYCZĄCE NAPRAW PODZIEMNYCH I REMONTOWYCH POJĘCIA OGÓLNE MAM O BUDOWNICTWIE STUDNI OGRANICZAJĄCYCH DOPŁYW WODY WARSTWOWEJ Niebezpieczne i szkodliwe czynniki fizyczne OKREŚLENIE CIŚNIENIA NA WYJŚCIU POMPY BADANIA OBIECUJĄCE HORYZONTY OPTYMALIZACJA TRYBU PRACY JEDNOSTKI PUSH PUSH DOŚWIADCZENIE W OBSŁUDZE BORÓW Z ELASTYCZNYM ELEMENTEM TRAKCYJNYM ROZWÓJ I TESTOWANIE STUDNI OPRACOWANIE I URUCHOMIENIE KWIATÓW KOMPLIKACJE ODSTĘPÓW W PROCESIE POGŁĘBIANIA ODWIEB INNE PODSTAWOWE POJĘCIA I PRZEPISY PODSTAWOWE POJĘCIA I PRZEPISY PODSTAWOWE INFORMACJE O ROPIE, GAZU I KONDENSACIE GAZU PODSTAWY OBLICZEŃ HYDRAULICZNYCH W WIERCENIACH PODSTAWY WYDOBYCIA ROPY I GAZU PODSTAWY PROJEKTOWANIA ODWRÓTÓW KIEROWANYCH FUNDA MENTALIZACJA BEZPIECZEŃSTWA PRZEMYSŁOWEGO CZYSZCZENIE WIERCENIA Studnie z cięć CZYSZCZENIE GAZÓW ZWIĄZANYCH lutowanie i napawanie HYDROMECHANICZNY PAKARK DWUSTRONNY PGMD1 PAKARKI HYDROMECHANICZNE TJ. HYDRAULICZNE I MECHANICZNE PAKIERY DO KOLUMN BADAWCZYCH PRMP-1 GUMOWO-METALOWE PODŁOGI UKŁADACZE I KOTWY PARAMETRY I KOMPLETNOŚĆ UKŁADÓW CYRKULACYJNYCH Parametry bloków jezdnych dla pracować z ASP PODSTAWOWE OTWARCIE FORMACJI PRODUKCYJNYCH PODSTAWOWE SPOSOBY CEMENTOWANIA MOBILNE ZESPÓŁ POMPOWANIA I PRZETWARZANIA ODPUSZCZALNIKÓW OLEJU (SZUMU NAFTOWEGO) OKRESOWE PODNOŚNIE GAZU PERSPEKTYWY WYKORZYSTANIA DP U ZWIĘKSZANIE WYDAJNOŚCI ZWIĘKSZANIE SPRAWNOŚCI POMPOWANIA SPULS Pompy zanurzeniowe pod poziomem dynamicznym Urządzenia podziemne do studni płynących PODNOSZENIE LEPKA CIECZ PRZEZ ODLEW COROCZNE NARZĘDZIA DO NISZCZENIA SKAŁ MIERNIKI CIŚNIENIA TŁOKOWEGO Strata ciśnienia podczas ruchu płynu wzdłuż rurek Zasady bezpieczeństwa pracy odwiertu Zasady prac naprawczych w odwiertach RD 153-39-023-97 ZAPOBIEGANIE TWORZENIU SOLI PR Podstawy teoretyczne bezpieczeństwo TECHNIKI POMIARÓW PRZEPŁYWU Fizyka techniczna TRAJEKTORIA RUCHU DNA ODDNIENIA Rury INSTRUKCJA OBLICZANIA PRĄDÓW ZWARCIOWYCH WARUNKI DOPŁYWU CIECZY I GAZU DO STUDNI Instalacje hydraulicznych pomp tłokowych do wydobycia ropy naftowej Instalacje elektrycznych pomp głębinowych śrubowych Instalacje zanurzeniowych membran zamiennych elektrycznych pompy Wyposażenie głowicy wiertniczej WAŻONE RURY WIERTNICZE ESP ESP całkowicie CZYNNIKI WPŁYWAJĄCE NA INTENSYWNOŚĆ FORMOWANIA ASPO Właściwości fizyczne i mechaniczne skał zbiornikowych CHARAKTERYSTYKA FIZYCZNA GAZÓW MIEJSCA ROPY I GAZU FILTRY Fontanna Metoda wydobycia ropy naftowej STUDNIE CEMENTOWE SYSTEMY CYRKULACJI WIEŻNIC WIERTNICZYCH Cementy żużlowo-piaskowe Żużel- cementy piaskowe do współmielenia Szt. żerdzie pompujące (SHN) JEDNOSTKI POMPOWE PRĘTOWE (SHPU) POMPY PRĘTOWE DO PODNOSZENIA LEPKIEJ OLEJU POMPY SZYBOWE Pompy żerdziowe ShSN OBSŁUGA SZTURNÓW GAZOWYCH eksploatacja odwiertów niskowydobywczych PRACA ODSTĘPÓW NISKOPADOWYCH W CIĄGŁYM WYDAJNOŚCI TRYB PRACY ODWODNIKÓW WODNYCH ZAWIERAJĄCYCH PARAFINĘ TRYB PRACY ODWODNIKA ELEKTRYCZNEGO ESP ESP. ELEKTRYCZNA POMPA MEMBRANOWA Energooszczędna elektryczna pompa głębinowa YAKORIpierwiastki d i ich związki mają wiele charakterystyczne właściwości: zmienne stopnie utlenienia; zdolność do tworzenia jonów złożonych; tworzenie barwnych związków.
Cynk nie jest pierwiastkiem przejściowym. Jego właściwości fizyczne i chemiczne nie pozwalają na zaklasyfikowanie go jako metalu przejściowego. W szczególności w swoich związkach wykazuje tylko jeden stopień utlenienia i nie wykazuje aktywności katalitycznej.
d-Elementy mają pewne cechy w porównaniu do elementów głównych podgrup.
1. W pierwiastkach d tylko niewielka część elektronów walencyjnych jest delokalizowana w całym krysztale (w przypadku pierwiastków alkalicznych i metale ziem alkalicznych elektrony walencyjne są całkowicie oddane do użytku zbiorowego). Pozostałe d-elektrony uczestniczą w tworzeniu ukierunkowanych wiązań kowalencyjnych pomiędzy sąsiadującymi atomami. Zatem pierwiastki te w stanie krystalicznym nie mają wiązania czysto metalicznego, ale wiązanie kowalencyjnie-metaliczne. Dlatego wszystkie są metalami twardymi (z wyjątkiem Hg) i ogniotrwałymi (z wyjątkiem Zn, Cd).
Najbardziej ogniotrwałymi metalami są metale z podgrup VB i VIB. W nich połowa podpoziomu d jest wypełniona elektronami i realizowana jest maksymalna możliwa liczba niesparowanych elektronów, a zatem największa liczba wiązania kowalencyjne. Dalsze wypełnianie prowadzi do zmniejszenia liczby wiązań kowalencyjnych i spadku temperatury topnienia.
2. Ze względu na niewypełnione powłoki d i obecność niewypełnionych poziomów ns i np o bliskiej energii, pierwiastki d są podatne na tworzenie kompleksów; ich złożone związki z reguły są kolorowe i paramagnetyczne.
3. Pierwiastki d częściej niż pierwiastki głównych podgrup tworzą związki o zmiennym składzie (tlenki, wodorki, węgliki, krzemki, azotki, borki). Ponadto tworzą stopy między sobą oraz z innymi metalami, a także związki międzymetaliczne.
4. Pierwiastki D charakteryzują się dużym zestawem stanów walencyjnych (tabela 8.10) i co za tym idzie, zmianami właściwości kwasowo-zasadowych i redoks w szerokim zakresie.
Ponieważ niektóre elektrony walencyjne znajdują się na orbitaliach s, najniższy stopień utlenienia, jaki wykazują, wynosi zwykle dwa. Wyjątkiem są pierwiastki, których jony E +3 i E + mają stabilne konfiguracje d 0, d 5 i d 10: Sc 3+, Fe 3+, Cr +, Cu +, Ag +, Au +.
Związki, w których pierwiastki d znajdują się na najniższym stopniu utlenienia, tworzą kryształy typu jonowego, w reakcje chemiczne wykazują podstawowe właściwości i są z reguły reduktorami.
Stabilność związków, w których pierwiastki d znajdują się na najwyższym stopniu utlenienia (równym liczbie grupowej) wzrasta w każdej serii przejściowej od lewej do prawej, osiągając maksimum dla pierwiastków 3d w Mn oraz w drugiej i trzeciej serii przejściowej odpowiednio w Ru i Os. W obrębie jednej podgrupy stabilność związków o najwyższym stopniu utlenienia maleje w szeregu 5d > 4d > 3d, o czym świadczy charakter zmiany energii Gibbsa (potencjału izobaryczno-izotermicznego) związków tego samego typu np. :
Zjawisko to wynika z faktu, że wraz ze wzrostem głównej liczby kwantowej w obrębie jednej podgrupy zmniejsza się różnica energii podpoziomów (n – 1)d i ns. Związki te charakteryzują się kowalencyjnymi wiązaniami polarnymi. Mają charakter kwaśny i są utleniaczami (CrO 3 i K 2 CrO 4, Mn 2 O 7 i KMnO 4).
Związki, w których d-elektrony znajdują się na pośrednich stopniach utlenienia, wykazują właściwości amfoteryczne i dualizm redoks.
5. Podobieństwo elementów d do elementów głównych podgrup E(0) w pełni objawia się w elementach trzeciej grupy ns 2 np 1 i (n – 1)d 1 ns 2. Wraz ze wzrostem liczby grup maleje; pierwiastki podgrupy VIIIA to gazy, VIIIB to metale. W pierwszej grupie znów pojawia się odległe podobieństwo (wszystkie pierwiastki są metalami), a pierwiastki podgrupy IB są dobrymi przewodnikami; to podobieństwo jest zwiększone w drugiej grupie, ponieważ pierwiastki d Zn, Cd i Hg nie uczestniczą w tworzeniu wiązania chemicznego.
6. pierwiastki d IIIB–VIIB podgrup na wyższych stopniach utlenienia mają właściwości podobne do odpowiadających im pierwiastków p. Zatem na wyższych stopniach utlenienia Mn (VII) i Cl (VII) są analogami elektronicznymi. Podobieństwo konfiguracji elektronowych (s 2 p 6) prowadzi do podobnych właściwości związków siedmiowartościowego manganu i chloru. Mn 2 O 7 i Cl 2 O 7 w normalnych warunkach są niestabilnymi cieczami, którymi są bezwodniki mocnych kwasów o ogólnym wzorze NEO 4. Na niższych stopniach utlenienia mangan i chlor różnią się struktura elektroniczna, co powoduje wyraźną różnicę we właściwościach ich związków. Na przykład niższy tlenek chloru Cl 2 O (s 2 p 4) jest substancją gazową, czyli bezwodnikiem kwasu podchlorawego (HClO), podczas gdy niższy tlenek manganu MnO (d 5) jest substancją stałą substancja krystaliczna podstawowy charakter.
7. Jak wiadomo, o zdolności redukcyjnej metalu decyduje nie tylko jego energia jonizacji (M – ne – → M n + ; +∆H jonizacja), ale także entalpia hydratacji utworzonego kationu (M n + + mH 2 O → M n + mH 2 O, –∆H hydr. Energie jonizacji pierwiastków d są wysokie w porównaniu z innymi metalami, ale są kompensowane przez duże entalpie hydratacji ich jonów. w konsekwencji potencjały elektrod większość pierwiastków d jest ujemna.
Wraz ze wzrostem Z zmniejszają się właściwości redukcyjne metali, osiągając minimum dla pierwiastków grupy IB. Metale ciężkie Grupy VIIIB i IV nazywane są szlachetnymi ze względu na ich bezwładność.
Tendencje redoks związków pierwiastków d determinowane są zmianami stabilności wyższych i niższych stopni utlenienia, w zależności od ich położenia w układzie okresowym. Związki o najwyższym stopniu utlenienia pierwiastka wykazują wyłącznie właściwości utleniające, a te o najniższym - właściwości redukujące. Mn(OH) 2 łatwo utlenia się w powietrzu Mn(OH) 2 + 1/2O 2 = MnO 2 + H 2 O. Związki Mn(IV) łatwo ulegają redukcji do Mn (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O, ale jest utleniany do Mn (VII) za pomocą silnych utleniaczy. Jon nadmanganianowy MnO 4 może być jedynie środkiem utleniającym.
Ponieważ dla pierwiastków d w podgrupie stabilność wyższych stopni utlenienia wzrasta od góry do dołu, właściwości utleniające związków o najwyższych stopniach utlenienia gwałtownie maleją. Zatem związki chromu (VI) (CrO 3, K 2 CrO 4, K 2 Cr 2 O 7) i manganu (VII) (Mn 2 O 7, KMnO 4) są silnymi utleniaczami, a WO 3, Re 2 O 7 i sole odpowiednich kwasów (H2WO4, HReO4) są redukowane z trudem.
8. Na właściwości kwasowo-zasadowe wodorotlenków pierwiastka d wpływają te same czynniki (promień jonowy i ładunek jonowy), co wodorotlenki pierwiastka p.
Wodorotlenki niższych stopni utlenienia pierwiastków d zwykle wykazują właściwości zasadowe i odpowiadające im wyższe stopnie utlenianie – kwaśne. Na pośrednich stopniach utlenienia wodorotlenki są amfoteryczne. Zmiana właściwości kwasowo-zasadowych wodorotlenków wraz ze zmianą stopnia utlenienia jest szczególnie wyraźna w związkach manganu. W szeregu Mn(OH) 2 – Mn(OH) 3 – Mn(OH) 4 – H 2 MnO 4 – HMnO 4 właściwości wodorotlenków różnią się od słabej zasady Mn(OH) 2 poprzez amfoteryczny Mn(OH) 3 i Mn(OH) 4 tys mocne kwasy H 2 MnO 4 i HMnO 4 .
W obrębie jednej podgrupy wodorotlenki pierwiastków D o tym samym stopniu utlenienia charakteryzują się wzrostem podstawowych właściwości przy przemieszczaniu się z góry na dół. Na przykład w grupie IIIB Sc(OH) 3 oznacza słabą zasadę, a La(OH) 3 oznacza mocną zasadę. Pierwiastki IVB z grupy Ti, Zn, Hf wodorotlenki amfoteryczne E(OH) 4, ale właściwości kwasowe słabną podczas przejścia od Ti do Hf.
9. Osobliwość elementami przejściowymi jest tworzenie faz o zmiennym składzie. Są to, po pierwsze, śródmiąższowe i substytucyjne roztwory stałe, a po drugie, związki o zmiennym składzie. Roztwory stałe tworzą pierwiastki o podobnej elektroujemności, promieniach atomowych i identycznych sieciach krystalicznych. Im bardziej pierwiastki różnią się charakterem, tym mniej są w sobie rozpuszczalne i tym bardziej podatne są na tworzenie związków chemicznych. Związki takie mogą mieć zarówno skład stały, jak i zmienny. W odróżnieniu od roztworów stałych, w których zachowana jest siatka jednego ze składników, związki charakteryzują się utworzeniem nowej sieci i nowej wiązania chemiczne. Inaczej mówiąc, do związki chemiczne obejmują tylko te fazy o zmiennym składzie, które znacznie różnią się strukturą i właściwościami od pierwotnych.
Związki o zmiennym składzie charakteryzują się następującymi cechami:
a) Skład tych związków zależy od sposobu ich przygotowania. Zatem w zależności od warunków syntezy tlenki tytanu mają skład TiO 1,2–1,5 i TiO 1,9–2,0; węgliki tytanu i wanadu – TiC 0,6–1,0 i VС 0,58–1,09, azotek tytanu TiN 0,45–1,00.
b) Połączenia zachowują swoje sieci krystalicznej przy znacznych wahaniach składu ilościowego, to znaczy mają szeroki zakres jednorodności. Zatem TiC 0,6–1,0, jak wynika ze wzoru, zatrzymuje siatkę węglika tytanu pozbawioną w niej do 40% atomów węgla.
c) Charakter wiązania w takich związkach zależy od stopnia wypełnienia orbitali d metalu. Elektrony wprowadzonego niemetalu zajmują wolne orbitale d, co prowadzi do zwiększonej kowalencji wiązań. Dlatego w związkach pierwiastków początkowych szeregu d (grupy IV–V) zmniejsza się udział wiązań metalicznych.
Dostępność wiązanie kowalencyjne Potwierdzają je duże dodatnie entalpie tworzenia związków, wyższa twardość i temperatura topnienia, niższa przewodność elektryczna w porównaniu do metali je tworzących.
Miedź jest pierwiastkiem jedenastej grupy czwartego okresu układu okresowego pierwiastki chemiczne D.I. Mendelejew, o liczbie atomowej 29. Oznaczony symbolem Cu (łac. Cuprum). Prosta substancja miedź (numer CAS: 7440-50-8) jest plastyczna metal przejściowy złoty- Różowy kolor(kolor różowy w przypadku braku warstwy tlenkowej). Jest szeroko stosowany przez ludzi od dawna.
DEFINICJA
Potas- pierwszy element czwartego okresu. Znajduje się w I grupie głównej (A) podgrupy układu okresowego.
Odnosi się do elementów rodziny s. Metal. Pierwiastki metalowe zawarte w tej grupie nazywane są łącznie alkalicznymi. Oznaczenie – K. Numer seryjny- 19. Względna masa atomowa - 39,102 amu.
Struktura elektronowa atomu potasu
Atom potasu składa się z dodatnio naładowanego jądra (+19), wewnątrz którego znajduje się 19 protonów i 20 neutronów, a 19 elektronów porusza się po 4 orbitach.
Ryc.1. Schematyczna budowa atomu potasu.
Rozkład elektronów pomiędzy orbitalami jest następujący:
1S 2 2S 2 2P 6 3S 2 3P 6 4S 1 .
Zewnętrzny poziom energii atomu potasu zawiera 1 elektron, który jest elektronem walencyjnym. Stopień utlenienia potasu wynosi +1. Schemat energetyczny stanu podstawowego przyjmuje następującą postać:
Stan podekscytowania pomimo obecności wolnych miejsc 3 P- i 3 D-nie ma orbitali.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Atom pierwiastka ma następującą konfigurację elektronową 1 S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 3. Wskazać: a) ładunek jądrowy; b) liczba ukończonych poziomy energii w powłoce elektronowej tego atomu; c) maksymalny możliwy stopień utlenienia; d) wartościowość atomu w połączeniu z wodorem. |
| Rozwiązanie | Aby odpowiedzieć na postawione pytania, należy najpierw określić całkowitą liczbę elektronów w atomie pierwiastka chemicznego. Można tego dokonać dodając wszystkie elektrony obecne w atomie, bez uwzględnienia ich rozkładu na poziomach energetycznych: 2+2+6+2+6+10+2+3 = 33. To jest arsen (As). Teraz odpowiedzmy na pytania: a) ładunek jądrowy wynosi +33; b) atom ma cztery poziomy, z których trzy są kompletne; c) zapisz diagram energii elektronów walencyjnych atomu arsenu w stanie podstawowym. Arsen może przejść w stan wzbudzony: elektrony S-podpoziomy wyparowują i jeden z nich przenosi się na pusty D-orbitalny. Pięć niesparowanych elektronów wskazuje, że maksymalny możliwy stopień utlenienia arsenu wynosi +5; d) Wartościowość arsenu w połączeniu z wodorem wynosi III (AsH 3). |
W artykule brakuje linków do źródeł informacji. Informacje muszą być weryfikowalne, w przeciwnym razie mogą zostać zakwestionowane i usunięte. Można... Wikipedia
Okres to rząd okresowego układu pierwiastków chemicznych, sekwencja atomów w kolejności zwiększania się ładunku jądrowego i wypełniania elektronami zewnętrznej powłoki elektronowej. Układ okresowy ma siedem okresów. Pierwszy okres zawierający 2 elementy... Wikipedia
104 Laurencium ← Rutherfordium → Dubnium ... Wikipedia
D. I. Mendelejew, naturalna klasyfikacja pierwiastków chemicznych, która jest wyrażeniem tabelarycznym (lub innym graficznym). prawo okresowe Mendelejew (patrz prawo okresowe Mendelejewa). P.S. mi. opracowany przez DI Mendelejewa w 1869 roku... ... Wielka encyklopedia radziecka
Mendelejew Dmitrij Iwanowicz- (Dmitrij Iwanowicz Mendelejew) Biografia Mendelejewa, działalność naukowa Mendelejewa Informacje o biografii Mendelejewa, działalność naukowa Mendelejewa Spis treści Spis treści 1. Biografia 2. Członek narodu rosyjskiego 3. Działalność naukowa Okresowy... Encyklopedia inwestorów
Układ okresowy pierwiastków chemicznych (tablica Mendelejewa) klasyfikacja pierwiastków chemicznych, ustalenie zależności różnych właściwości pierwiastków od ładunku jądro atomowe. System jest graficznym wyrazem prawa okresowości, ... ... Wikipedia
Układ okresowy pierwiastków chemicznych (tabela Mendelejewa) to klasyfikacja pierwiastków chemicznych, która ustala zależność różnych właściwości pierwiastków od ładunku jądra atomowego. System jest graficznym wyrazem prawa okresowości, ... ... Wikipedia
Układ okresowy pierwiastków chemicznych (tabela Mendelejewa) to klasyfikacja pierwiastków chemicznych, która ustala zależność różnych właściwości pierwiastków od ładunku jądra atomowego. System jest graficznym wyrazem prawa okresowości, ... ... Wikipedia
Pierwiastki chemiczne (układ okresowy) Klasyfikacja pierwiastków chemicznych, ustalenie zależności różnych właściwości pierwiastków od ładunku jądra atomowego. System jest graficznym wyrazem prawa okresowości ustanowionego przez rosyjską... Wikipedię
Pojęcie element przejściowy zwykle używane w odniesieniu do dowolnego pierwiastka z elektronami walencyjnymi d lub f. Pierwiastki te zajmują pozycję przejściową w układzie okresowym pomiędzy elektrododatnimi pierwiastkami s i elektroujemnymi pierwiastkami p.
elementy d są zwykle nazywane głównymi elementami przejściowymi. Ich atomy charakteryzują się wewnętrzną strukturą podpowłok d. Faktem jest, że orbital s ich zewnętrznej powłoki jest zwykle zapełniany przed rozpoczęciem wypełniania orbitali d w poprzedniej powłoce elektronowej. Oznacza to, że każdy nowy elektron dodany do powłoka elektronowa kolejny element d, zgodnie z zasadą wypełnienia, przypada nie na powłokę zewnętrzną, lecz na poprzedzającą ją podpowłokę wewnętrzną. Właściwości chemiczne tych pierwiastków zależy od udziału w reakcjach elektronów z obu tych powłok.

d-Elementy tworzą trzy serie przejściowe - odpowiednio w 4., 5. i 6. okresie. Pierwsza seria przejściowa obejmuje 10 pierwiastków, od skandu do cynku. Charakteryzuje się wewnętrzną konfiguracją orbitali 3d. Orbital 4s jest zapełniony wcześniej niż orbital 3d, ponieważ ma mniej energii (reguła Klechkowskiego).
Należy jednak zaznaczyć, że występują dwie anomalie. Chrom i miedź mają tylko jeden elektron na swoich orbitali 4s. Faktem jest, że podpowłoki wypełnione w połowie lub całkowicie wypełnione są bardziej stabilne niż podpowłoki częściowo wypełnione.
Atom chromu ma jeden elektron na każdym z pięciu orbitali 3d tworzących podpowłokę 3d. Ta podpowłoka jest w połowie wypełniona. W atomie miedzi każdy z pięciu orbitali 3d zawiera parę elektronów. Podobną anomalię obserwuje się w srebrze.
Wszystkie pierwiastki d są metalami.
Konfiguracje elektroniczne pierwiastków czwartego okresu od skandu do cynku: 


Chrom
Chrom znajduje się w IV okresie, w grupie VI, w podgrupie wtórnej. Jest to metal o średniej aktywności. W swoich związkach chrom wykazuje stopnie utlenienia +2, +3 i +6. CrO to typowy zasadowy tlenek, Cr 2 O 3 - tlenek amfoteryczny, CrO 3 jest typowym tlenkiem kwasowym o właściwościach silnego utleniacza, tj. wzrostowi stopnia utlenienia towarzyszy wzrost właściwości kwasowych.

Żelazo
Żelazo znajduje się w czwartym okresie, w grupie VIII, w podgrupie wtórnej. Żelazo jest metalem o średniej aktywności, w swoich związkach wykazuje najwięcej charakterystyczne stopnie utlenianie +2 i +3. Znane są także związki żelaza, w których stopień utlenienia wynosi +6, które są silnymi utleniaczami. FeO wykazuje właściwości zasadowe, natomiast Fe 2 O 3 wykazuje właściwości amfoteryczne z przewagą właściwości zasadowych.

Miedź
Miedź znajduje się w IV okresie, w grupie I, w podgrupie wtórnej. Jego najbardziej stabilne stopnie utlenienia to +2 i +1. W szeregu napięć metali miedź znajduje się po wodorze, jego aktywność chemiczna nie zbyt duży. Tlenki miedzi: Cu2O CuO. Ten ostatni oraz wodorotlenek miedzi Cu(OH)2 wykazują właściwości amfoteryczne z przewagą zasadowych.
Cynk
Cynk znajduje się w IV okresie, w grupie II, w podgrupie wtórnej. Cynk jest metalem średnioaktywnym, w swoich związkach wykazuje pojedynczy stopień utlenienia +2. Tlenek i wodorotlenek cynku są amfoteryczne.