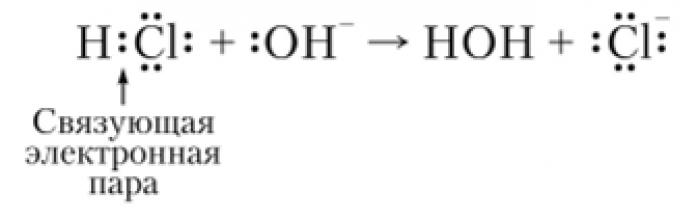W przestrzeni wokół jąder w porównaniu z rozkładem gęstości elektronów w atomach obojętnych tworzących dane wiązanie.
Jako ilościową miarę polarności wiązania stosuje się tak zwane ładunki efektywne na atomach.
Ładunek efektywny definiuje się jako różnicę między ładunkiem elektronów znajdujących się w pewnym obszarze przestrzeni w pobliżu jądra a ładunkiem jądra. Miara ta ma jednak jedynie znaczenie warunkowe i przybliżone, gdyż nie da się jednoznacznie zidentyfikować w cząsteczce obszaru, który odnosi się wyłącznie do pojedynczego atomu, a w przypadku kilku wiązań – do konkretnego wiązania.
Obecność ładunku efektywnego można wskazać za pomocą symboli ładunków na atomach (na przykład H + δ - Cl - δ, gdzie δ to pewna część ładunku elementarnego).
Prawie wszystkie wiązania chemiczne, z wyjątkiem wiązań w dwuatomowych cząsteczkach homojądrowych, są w takim czy innym stopniu polarne. Wiązania kowalencyjne są zwykle słabo polarne. Wiązania jonowe są silnie polarne.
Zobacz też
Źródła
Fundacja Wikimedia. 2010.
- strzałka polarna
- Wyprawy polarne
Zobacz, co oznacza „Polaryzacja wiązań chemicznych” w innych słownikach:
Polaryzacja wiązań chemicznych- charakterystyka wiązania chemicznego (patrz Wiązanie chemiczne), pokazująca redystrybucję gęstości elektronów w przestrzeni w pobliżu jąder w porównaniu z początkowym rozkładem tej gęstości w obojętnych atomach tworzących to wiązanie.... ...
Biegunowość- W Wikisłowniku znajduje się artykuł „polaryzacja” Polaryzacja (← łac. polaris ← ... Wikipedia
Wiązanie chemiczne- ... Wikipedii
Cząsteczka- Schemat wiązań kowalencyjnych pomiędzy atomami w cząsteczce tlenu... Wikipedia
Wartościowość (chemiczna)- Wartościowość (od łac. Walentia ≈ siła), zdolność atomu do tworzenia wiązań chemicznych. Za ilościową miarę siły uważa się zwykle liczbę innych atomów w cząsteczce, z którą dany atom tworzy wiązania. V. to jedno z podstawowych pojęć... ... Wielka encyklopedia radziecka
Wartościowość- I Walencja (od łac. Walencja) to zdolność atomu do tworzenia wiązań chemicznych. Za ilościową miarę siły uważa się zwykle liczbę innych atomów w cząsteczce, z którą dany atom tworzy wiązania. V. jeden z podstawowych... ... Wielka encyklopedia radziecka
Reguła oktetu- Wiązania w dwutlenku węgla (CO2) wszystkie atomy są otoczone 8 elektronami zgodnie z regułą oktetu. Dlatego CO2 jest stabilną cząsteczką. Regułę oktetu (teorię oktetu) zaproponował G. N. Lewis w celu wyjaśnienia powodów… ... Wikipedia
Chemia strukturalna- Sekcja chemii strukturalnej, obszar chemii badający zależności między różnymi właściwościami fizycznymi i fizykochemicznymi różne substancje z ich struktura chemiczna i reaktywność. Chemia strukturalna uwzględnia nie tylko geometryę... ...Wikipedię
Elektroujemność- (χ) fundamentalny Właściwości chemiczne atom, ilościowa cecha zdolności atomu w cząsteczce do przemieszczania wspólnych par elektronów ku sobie. Nowoczesną koncepcję elektroujemności atomów wprowadził amerykański chemik L. Pauling.... ...Wikipedia
Izomeria- Nie mylić z izomerią jądra atomowe. Izomeria (z innych greckich ἴσος „równy” i μέρος „udział, część”) to zjawisko polegające na istnieniu związków chemicznych (izomerów) identycznych pod względem składu i masy cząsteczkowej, ale ... ... Wikipedia
Kiedy między różnymi atomami tworzy się wiązanie kowalencyjne, para wiążąca elektronów przesuwa się w stronę atomu bardziej elektroujemnego. Prowadzi to do polaryzacji cząsteczek, więc wszystkie cząsteczki dwuatomowe składające się z odmiennych elementów okazują się w takim czy innym stopniu polarne. W bardziej złożonych cząsteczkach polarność zależy również od geometrii cząsteczki. Aby pojawiła się polaryzacja, konieczne jest, aby środki rozkładu ładunków dodatnich i ujemnych nie pokrywały się.
W cząsteczce CO 2 wiązania węgiel-tlen są polarne, a atom węgla ma pewien ładunek dodatni, a każdy z atomów tlenu ma ten sam ładunek ujemny. W rezultacie środek ładunku dodatniego koncentruje się na atomie węgla. Ponieważ atomy tlenu znajdują się na tej samej linii prostej, ale obie strony atomu węgla (cząsteczka liniowa) są włączone równe odległości, wówczas ładunek dodatni zostaje zneutralizowany. Zatem pomimo polarności każdego wiązania w CO., cała cząsteczka jako całość jest niepolarna, a powodem tego jest
Ryż. 434. Przykładami budowy i polarności cząsteczek jest ich struktura liniowa. Przeciwnie, cząsteczka S=C=0 jest polarna, ponieważ wiązania węgiel-siarka i węgiel-tlen mają różną długość i różną polaryzację. Na ryc. Rysunek 4.34 przedstawia strukturę i polaryzację niektórych cząsteczek.
Z powyższych przykładów wynika, że jeśli atomy lub grupy atomów przyłączone do atomu centralnego są identyczne lub rozmieszczone symetrycznie względem niego (struktury liniowe, płaskie trójkątne, czworościenne i inne), to cząsteczka będzie niepolarna. Jeśli do atomu centralnego są przyłączone nierówne grupy lub występuje asymetryczne rozmieszczenie grup, wówczas cząsteczki są polarne.
Efektywny ładunek atomów w cząsteczce jest ważny przy rozważaniu wiązań polarnych. Przykładowo w cząsteczce HC1 chmura elektronów wiążących zostaje przesunięta w stronę bardziej elektroujemnego atomu chloru, w wyniku czego ładunek jądra wodoru nie jest kompensowany, a na atomie chloru gęstość elektronów staje się nadmierna w stosunku do ładunku jego jądra. Dlatego atom wodoru jest spolaryzowany dodatnio, a atom chloru jest spolaryzowany ujemnie. Atom wodoru ma ładunek dodatni, a atom chloru ładunek ujemny. Ładunek ten 8, zwany ładunkiem efektywnym, jest zwykle ustalany eksperymentalnie. Zatem dla wodoru 8 H = +0,18 i dla chloru 5 C = -0,18 absolutny ładunek elektronów, w wyniku czego wiązanie w cząsteczce HC1 ma 18% charakteru jonowego (tj. stopień jonowości wynosi 0,18 ) .
Ponieważ polarność wiązania zależy od stopnia przemieszczenia pary wiążącej elektronów w kierunku elementu bardziej elektroujemnego, należy wziąć pod uwagę, co następuje:
- a) elektroujemność (EO) - nieścisła wielkość fizyczna, które można wyznaczyć bezpośrednio eksperymentalnie;
- b) wartość elektroujemności nie jest stała, ale zależy od charakteru drugiego atomu, z którym atom jest związany;
- c) ten sam atom w danym wiązaniu chemicznym może czasami działać zarówno jako elektrododatni, jak i elektroujemny.
Dane eksperymentalne sugerują, że pierwiastkom można przypisać względne wartości elektroujemności (REV), których zastosowanie pozwala ocenić stopień polarności wiązań między atomami w cząsteczce (patrz także paragrafy 3.6 i 4.3).
W cząsteczce składającej się z dwóch atomów, im wyższy OEO jednego z nich, tym większa polarność wiązania kowalencyjnego, zatem wraz ze wzrostem OEO drugiego pierwiastka wzrasta stopień jonowości związku.
Dla cech reaktywność W cząsteczkach ważny jest nie tylko charakter rozkładu gęstości elektronowej, ale także możliwość jego zmiany pod wpływem wpływów zewnętrznych. Miarą tej zmiany jest polaryzowalność wiązania, tj. jego zdolność do stawania się polarnym lub jeszcze bardziej polarnym. Polaryzacja połączenia następuje zarówno pod wpływem czynników zewnętrznych pole elektryczne i pod wpływem innej cząsteczki będącej partnerem reakcji. Skutkiem tych wpływów może być polaryzacja połączenia, której towarzyszy całkowite zerwanie. W tym przypadku para wiążąca elektronów pozostaje z atomem bardziej elektroujemnym, co prowadzi do powstania odmiennych jonów. Ten typ rozerwania wiązania nazywa się teterolitycznym. Na przykład:

W powyższym przykładzie asymetrycznego rozerwania wiązania wodór jest eliminowany w postaci jonu H+, a wiążąca para elektronów pozostaje z chlorem, więc ten ostatni zamienia się w anion C1.
Oprócz tego typu rozerwania wiązania możliwe jest również rozerwanie symetryczne, gdy powstają nie jony, ale atomy i rodniki. Ten typ rozszczepienia wiązania nazywa się homolitycznym.
Elektroujemność atomów pierwiastków. Względna elektroujemność. Zmiany okresów i grup układu okresowego. Polaryzacja wiązań chemicznych, polarność cząsteczek i jonów.
Elektroujemność (e.o.) to zdolność atomu do przemieszczania par elektronów w swoim kierunku.
Meroy e.o. jest energią równą arytmetycznie ½ sumy energii jonizacji I i energii powinowactwa elektronów E
EO = ½ (I+E)
Względna elektroujemność. (OEO)
Fluorowi, jako najsilniejszemu pierwiastkowi EO, przypisuje się wartość 4,00, względem której uwzględniane są pozostałe pierwiastki.
Zmiany okresów i grup układu okresowego.
W okresach, gdy ładunek jądrowy rośnie od lewej do prawej, elektroujemność wzrasta.
Najmniej znaczenie obserwuje się w przypadku metali alkalicznych i metali ziem alkalicznych.
Największy- dla halogenów.
Im wyższa elektroujemność, tym wyraźniejsze są niemetaliczne właściwości pierwiastków.
Elektroujemność (χ) jest podstawową właściwością chemiczną atomu, ilościową cechą zdolności atomu w cząsteczce do przemieszczania wspólnych par elektronów w swoją stronę.
Nowoczesną koncepcję elektroujemności atomów wprowadził amerykański chemik L. Pauling. L. Pauling użył pojęcia elektroujemności do wyjaśnienia faktu, że energia heteroatomowa Połączenia A-B(A, B - symbole dowolnego pierwiastki chemiczne) jest na ogół większa niż średnia geometryczna wartości homoatomowej Połączenia A-A i B-B.
Najwyższa wartość e.o. fluor, a najniższy to cez.
Teoretyczną definicję elektroujemności zaproponował amerykański fizyk R. Mulliken. Opierając się na oczywistym twierdzeniu, że zdolność atomu w cząsteczce do przyciągania ładunku elektronicznego zależy od energii jonizacji atomu i jego powinowactwa elektronowego, R. Mulliken wprowadził ideę elektroujemności atomu A jako wartość średnią energii wiązania elektronów zewnętrznych podczas jonizacji stanów walencyjnych (np. od A− do A+) i na tej podstawie zaproponował bardzo prostą zależność na elektroujemność atomu:
gdzie J1A i εA są odpowiednio energią jonizacji atomu i jego powinowactwem elektronowym.
Ściśle mówiąc, pierwiastkowi nie można przypisać stałej elektroujemności. Elektroujemność atomu zależy od wielu czynników, w szczególności od stanu wartościowości atomu, formalnego stopnia utlenienia, liczby koordynacyjnej, charakteru ligandów tworzących środowisko atomu w układzie molekularnym i niektórych inni. Ostatnio do charakteryzowania elektroujemności coraz częściej stosuje się tak zwaną elektroujemność orbity, w zależności od rodzaju orbitalu atomowego biorącego udział w tworzeniu wiązania i jego populacji elektronów, tj. od tego, czy orbital atomowy jest zajęty przez samotną parę elektronów, jest pojedynczo zajęty przez niesparowany elektron lub jest pusty. Jednak pomimo znanych trudności w interpretacji i określaniu elektroujemności, zawsze pozostaje konieczny jakościowy opis i przewidywanie natury wiązań w układzie molekularnym, w tym energii wiązania, rozkładu ładunku elektronowego i stopnia jonowości, stałej siły itp. Jeden z najbardziej rozwiniętych w Obecnym podejściem jest podejście Sandersona. Podejście to opiera się na idei wyrównywania elektroujemności atomów podczas tworzenia się między nimi wiązania chemicznego. Liczne badania wykazały związek między elektroujemnością Sandersona a najważniejszym fizyczne i chemiczne właściwości związki nieorganiczne zdecydowana większość pierwiastków układu okresowego. Bardzo owocna okazała się także modyfikacja metody Sandersona, polegająca na redystrybucji elektroujemności pomiędzy atomami cząsteczki związków organicznych.
2) Polaryzacja wiązań chemicznych, polarność cząsteczek i jonów.
Co jest w abstrakcie i w podręczniku - Polaryzacja jest związana z momentem dipolowym.Przejawia się w wyniku przemieszczenia wspólnej pary elektronów do jednego z atomów.Polaryzacja zależy również od różnicy elektroujemności połączonych atomów Im wyższa wartość e.o. dwa atomy, tym bardziej polarne jest wiązanie chemiczne między nimi. W zależności od tego, jak gęstość elektronów jest redystrybuowana podczas tworzenia wiązania chemicznego, wyróżnia się kilka typów. Granicznym przypadkiem polaryzacji wiązania chemicznego jest całkowite przejście od jednego atomu do innego.
Tworzą się w tym przypadku dwa jony, pomiędzy którymi zachodzi wiązanie jonowe.Aby dwa atomy mogły utworzyć wiązanie jonowe konieczne jest, aby ich e.o. były bardzo różne.Jeśli e.o. są sobie równe, wówczas powstaje wiązanie kowalencyjne niepolarne.Najczęściej spotykane jest wiązanie kowalencyjne polarne - powstaje pomiędzy dowolnymi atomami, które mają inne znaczenie eo
Ilościową oceną polarności wiązania mogą być ładunki efektywne atomów.Ładunek efektywny atomu charakteryzuje się różnicą pomiędzy liczbą elektronów należących do danego atomu w związku chemicznym a liczbą elektronów wolnego atom.Atom pierwiastka bardziej elektroujemnego silniej przyciąga elektrony, więc elektrony są bliżej niego i otrzymuje on pewien ładunek ujemny, który nazywamy efektywnym, a jego partner ma ten sam dodatni ładunek efektywny.Jeśli elektrony tworzące atom wiązanie między atomami należy do nich jednakowo, efektywne ładunki wynoszą zero.
W przypadku cząsteczek dwuatomowych można scharakteryzować polarność wiązania i wyznaczyć efektywne ładunki atomów na podstawie pomiaru momentu dipolowego M=q*r gdzie q jest ładunkiem bieguna dipolowego równym ładunkowi efektywnemu dla cząsteczki dwuatomowej, r jest odległością międzyjądrową, a moment dipolowy wiązania jest wielkością wektorową. Jest kierowany od dodatnio naładowanej części cząsteczki do jej ujemnej części.Efektywny ładunek na atomie pierwiastka nie pokrywa się ze stopniem utlenienia.
Polarność cząsteczek w dużej mierze determinuje właściwości substancji. Cząsteczki polarne zwracają się ku sobie z przeciwnie naładowanymi biegunami i powstaje między nimi wzajemne przyciąganie. Dlatego substancje utworzone przez cząsteczki polarne mają wyższe temperatury topnienia i wrzenia niż substancje, których cząsteczki są niepolarne.
Ciecze, których cząsteczki są polarne, mają większą zdolność rozpuszczania. Co więcej, im większa polarność cząsteczek rozpuszczalnika, tym większa rozpuszczalność w nim związków polarnych lub jonowych. Zależność tę tłumaczy się faktem, że cząsteczki rozpuszczalnika polarnego, w wyniku oddziaływań dipol-dipol lub jon-dipol z substancją rozpuszczoną, przyczyniają się do rozkładu substancji rozpuszczonej na jony. Na przykład roztwór chlorowodoru w wodzie, którego cząsteczki są polarne, dobrze przewodzi Elektryczność. Roztwór chlorowodoru w benzenie nie ma zauważalnej przewodności elektrycznej. Wskazuje to na brak jonizacji chlorowodoru w roztworze benzenu, ponieważ cząsteczki benzenu są niepolarne.
Jony, podobnie jak pole elektryczne, oddziałują na siebie polaryzująco. Kiedy spotykają się dwa jony, następuje ich wzajemna polaryzacja, tj. przemieszczenie elektronów w warstwach zewnętrznych względem jąder. Wzajemna polaryzacja jonów zależy od ładunków jądra i jonu, promienia jonu i innych czynników.
W ramach grup m.in. maleje.
Zwiększają się właściwości metaliczne pierwiastków.
Elementy metalowe na zewnątrz poziom energii zawierają 1,2,3 elektronów i charakteryzują się niskim potencjałem jonizacji i e.o. ponieważ metale wykazują silną tendencję do utraty elektronów.
Pierwiastki niemetaliczne mają wyższą energię jonizacji.
W miarę wypełniania się zewnętrznej powłoki niemetali wewnątrz okresów promień atomów maleje. W powłoce zewnętrznej liczba elektronów wynosi 4,5,6,7,8.
Polaryzacja wiązania chemicznego. Polaryzacja cząsteczek i jonów.
Polarność wiązania chemicznego jest określona przez przemieszczenie wiązań pary elektronów z jednym z atomów.
Wiązanie chemiczne powstaje w wyniku redystrybucji elektronów na orbitali walencyjnych, w wyniku czego powstaje stabilny elektroniczna Konfiguracja gaz szlachetny, w wyniku tworzenia się jonów lub tworzenia wspólnych par elektronów.
Wiązanie chemiczne charakteryzuje się energią i długością.
Miarą siły wiązania jest energia zużyta na rozerwanie wiązania.
Na przykład. H – H = 435 kJmol-1
Elektroujemność pierwiastków atomowych
Elektroujemność jest właściwością chemiczną atomu, ilościową cechą zdolności atomu w cząsteczce do przyciągania elektronów z atomów innych pierwiastków.
Względna elektroujemność
Pierwszą i najbardziej znaną skalą względnej elektroujemności jest skala L. Paulinga, uzyskana na podstawie danych termochemicznych i zaproponowana w 1932 r. Za punkt wyjścia przyjmuje się arbitralnie wartość elektroujemności najbardziej elektroujemnego pierwiastka fluoru (F) = 4,0. skala.
Elementy grupy VIII układ okresowy(gazy szlachetne) mają zerową elektroujemność;
Za konwencjonalną granicę między metalami i niemetalami uważa się względną wartość elektroujemności wynoszącą 2.
Elektroujemność pierwiastków układu okresowego z reguły wzrasta sekwencyjnie od lewej do prawej w każdym okresie. W każdej grupie, z kilkoma wyjątkami, elektroujemność maleje konsekwentnie od góry do dołu. Elektroujemność można wykorzystać do scharakteryzowania wiązania chemicznego.
Wiązania o mniejszej różnicy elektroujemności atomów zaliczamy do polarnych wiązań kowalencyjnych. Im mniejsza różnica elektroujemności atomów tworzących wiązanie chemiczne, tym niższy stopień jonowości tego wiązania. Zerowa różnica w elektroujemności atomów wskazuje na brak charakteru jonowego w utworzonym przez nie wiązaniu, czyli jego czysto kowalencyjny charakter.
Polaryzacja wiązania chemicznego, polarność cząsteczek i jonów
Polaryzacja wiązań chemicznych, cecha wiązania chemicznego, pokazująca redystrybucję gęstości elektronów w przestrzeni w pobliżu jąder w porównaniu z początkowym rozkładem tej gęstości w obojętnych atomach tworzących to wiązanie.
Prawie wszystkie wiązania chemiczne, z wyjątkiem wiązań w dwuatomowych cząsteczkach homojądrowych, są w takim czy innym stopniu polarne. Zazwyczaj wiązania kowalencyjne są słabo polarne, wiązania jonowe są silnie polarne.
Na przykład:
kowalencyjne niepolarne: Cl2, O2, N2, H2,Br2
kowalencyjny polarny: H2O, SO2, HCl, NH3 itp.
W cząsteczkach homojądrowych (H 2 , F 2 itp.) para elektronów tworząca wiązanie należy jednakowo do każdego atomu, dlatego środki ładunków dodatnich i ujemnych w cząsteczce pokrywają się. Takie cząsteczki są niepolarne.
Jednak w cząsteczkach heterojądrowych udział w sprzężeniu funkcji falowych różne atomy nie ten sam. W pobliżu jednego z atomów pojawia się zatem nadmierna gęstość elektronowa, czyli nadmierny ładunek ujemny, a w pobliżu drugiego - dodatni. W tym przypadku mówią o przemieszczeniu pary elektronów z jednego atomu na drugi, ale nie należy tego rozumieć dosłownie, a jedynie jako wzrost prawdopodobieństwa znalezienia pary elektronów w pobliżu jednego z jąder cząsteczki.
Aby określić kierunek takiego przesunięcia i półilościowo oszacować jego wielkość, wprowadzono pojęcie elektroujemności.
Istnieje kilka skal elektroujemności. Jednak pierwiastki są ułożone w tej samej kolejności w szeregu elektroujemności, więc różnice są nieistotne, a skale elektroujemności są w miarę porównywalne.
Elektroujemność według R. Mullikena stanowi połowę sumy energii jonizacji i powinowactwa elektronowego (patrz rozdział 2.10.3):
Para elektronów walencyjnych przesuwa się w stronę atomu bardziej elektroujemnego.
Wygodniej jest stosować względne niż bezwzględne wartości elektroujemności. Elektroujemność litu 3 Li przyjmuje się jako jeden. Względna elektroujemność dowolnego pierwiastka A jest równa:
Ciężkie metale alkaliczne mają najniższą elektroujemność (XFr = 0,7). Najbardziej elektroujemnym pierwiastkiem jest fluor (X F = 4,0). Według okresów istnieje ogólna tendencja do zwiększania elektroujemności, a według podgrup - jej spadku (tabela 3.4).
Na praktyczne użycie Dane z tej tabeli (a także dane z innych skal elektroujemności) należy pamiętać, że w cząsteczkach składających się z trzech lub więcej atomów wartość elektroujemności może zauważalnie zmieniać się pod wpływem sąsiednich atomów. Ściśle mówiąc, pierwiastkowi w ogóle nie można przypisać stałej elektroujemności. Zależy to od stanu wartościowości pierwiastka, rodzaju związku itp. Niemniej jednak koncepcja ta jest przydatna do jakościowego wyjaśnienia właściwości wiązań i związków chemicznych.
Tabela 3.4
Elektroujemność pierwiastków s i p według Paulinga
|
Okres |
Grupa |
||||||
Polaryzacja wiązania jest określana przez przemieszczenie pary elektronów walencyjnych w cząsteczkach dwuatomowych i charakteryzowana ilościowo moment dipolowy, Lub elektryczny moment dipolowy, Cząsteczki. Jest ona równa iloczynowi odległości między jądrami G w cząsteczce i efektywny ładunek 5 odpowiadający tej odległości:
Ponieważ G jest uważany za wektor skierowany od ładunku dodatniego do ujemnego, moment dipolowy jest również wektorem i ma ten sam kierunek. Jednostką momentu dipolowego jest debye D (1D = 3,33 Yu -30 C m).
Moment dipolowy złożonej cząsteczki definiuje się jako suma wektorowa momenty dipolowe wszystkich wiązań. Dlatego też, jeśli cząsteczka AB jest symetryczna względem linii każdego wiązania, całkowity moment dipolowy takiej cząsteczki, pomimo polaryzacji
siła wiązań A-B jest równa zeru: D = ^ D; = 0. Przykłady obejmują
żyją wcześniej uważane za symetryczne cząsteczki, w których wiązania tworzą orbitale hybrydowe: BeF 2, BF 3, CH 4, SF 6 itp.
Cząsteczki, w których wiązania utworzone są przez orbitale niehybrydowe lub orbitale hybrydowe zawierające wolne pary elektronów, są asymetryczne względem linii wiązań. Momenty dipolowe takich cząsteczek nie są równe zeru. Przykłady takich cząsteczek polarnych: H 2 S, NH 3, H 2 0 itp. Na ryc. Rysunek 3.18 przedstawia graficzną interpretację sumowania wektorów wiązań polarnych w symetrycznej cząsteczce BeF 2 (fl) i asymetrycznej cząsteczce H 2 S (B).

Ryż. 3.18. Momenty dipolowe cząsteczek BeF 2 (a) i H 2 S (b).
Jak już zauważono, im większa różnica elektroujemności atomów tworzących wiązanie, tym silniejsze przesunięcie pary elektronów walencyjnych, tym bardziej polarne wiązanie, a zatem większy efektywny ładunek b, jak pokazano w tabeli. 3.5.
Tabela 3.5
Zmiana charakteru wiązania szeregu związków pierwiastków okresu II z fluorem
W wiązaniu polarnym można z grubsza rozróżnić dwa składniki: jonowy ze względu na przyciąganie elektrostatyczne i kowalencyjny ze względu na nakładające się orbitale. Wraz ze wzrostem różnicy elektroujemności OH para elektronów walencyjnych jest coraz bardziej przesuwana w stronę atomu fluoru, który uzyskuje coraz bardziej ujemny ładunek skuteczny. Udział składnika jonowego w wiązaniu wzrasta, a udział składnika kowalencyjnego maleje. Zmiany ilościowe zamieniają się w jakościowe: w cząsteczce UF para elektronów prawie w całości należy do fluoru, a jej ładunek efektywny zbliża się do jedności, tj. do ładunku elektronu. Można założyć, że powstały dwa jony: kation Li+ i anion F~, a połączenie wynika jedynie z ich przyciągania elektrostatycznego (składnik kowalencyjny można pominąć). To połączenie nazywa się joński. Można to uznać za skrajny przypadek polarnego wiązania kowalencyjnego.
Pole elektrostatyczne nie ma preferowanych kierunków. Dlatego wiązanie jonowe w przeciwieństwie do kowalencyjnego kierunkowość nie jest charakterystyczna. Jon oddziałuje z dowolną liczbą jonów o przeciwnym ładunku. Stanowi to kolejną charakterystyczną właściwość wiązania jonowego - brak nasycenia.
Dla cząsteczki jonowe można obliczyć energię wiązania. Jeśli uznamy jony za nieodkształcalne kulki z ładunkami ±, wówczas siła przyciągania między nimi zależy od odległości między środkami jonów G można wyrazić równaniem Coulomba:
Energia przyciągania jest określona przez zależność 
Kiedy się zbliżasz, w wyniku interakcji pojawia się siła odpychająca powłoki elektroniczne. Jest odwrotnie proporcjonalna do odległości do potęgi P:
Gdzie W- jakaś stała. Wykładnik potęgowy P jest znacznie większa od jedności i dla różnych konfiguracji jonowych mieści się w przedziale od 5 do 12. Biorąc pod uwagę, że siła jest pochodną energii po odległości, z równania (3.6) otrzymujemy:

Ze zmianą G zmiana Fnp I Fqtt. W pewnej odległości g 0 siły te są wyrównane, co odpowiada minimum powstałej energii oddziaływania U Q . Po przekształceniach można uzyskać
Równanie to znane jest jako równanie Borna.
Minimum na krzywej zależności U=f(r) odpowiadają odległości równowagi r 0 i energii U Q . Jest to energia wiązania pomiędzy jonami. Nawet P jest nieznana, wówczas możemy oszacować energię wiązania, przyjmując 1 /P równe zeru:

Błąd nie przekroczy 20%.
Dla jonów z ładunkami z l oraz z 2 równania (3.7) i (3.8) przyjmują postać:

Ponieważ w cząsteczkach tego typu istnienie wiązania zbliżonego do czysto jonowego jest problematyczne, ostatnie równania należy traktować jako bardzo przybliżone przybliżenie.
Jednocześnie do zagadnień polarności i jonowości wiązań można podejść od strony przeciwnej – z punktu widzenia polaryzacji jonów. Zakłada się, że następuje całkowite przeniesienie elektronów, a cząsteczka składa się z izolowanych jonów. Następnie chmury elektronów przesuwają się pod wpływem pola elektrycznego wytworzonego przez jony - polaryzacja jony.
Polaryzacja to proces dwutorowy, który łączy efekt polaryzacyjny jony z nich polaryzowalność. Polaryzowalność to zdolność chmury elektronów jonu, cząsteczki lub atomu do odkształcania się pod wpływem pole elektrostatyczne kolejny jon. Siła tego pola określa działanie polaryzujące jonu. Z równania (3.10) wynika, że działanie polaryzujące jonu jest tym większe, im większy jest jego ładunek i im mniejszy jest jego promień. Promienie kationów są z reguły znacznie mniejsze niż promienie anionów, dlatego w praktyce często spotyka się polaryzację anionów pod wpływem kationów, a nie odwrotnie. Polaryzowalność jonów zależy również od ich ładunku i promienia. Jony o dużych rozmiarach i ładunku łatwiej ulegają polaryzacji. Działanie polaryzacyjne jonu sprowadza się do przyciągania do siebie chmury elektronów jonu o przeciwnym ładunku. W rezultacie maleje jonowość wiązania, tj. wiązanie staje się polarne kowalencyjne. Zatem polaryzacja jonowa zmniejsza stopień jonowości wiązania i ma odwrotny efekt do polaryzacji wiązania.
Polaryzacja jonów w cząsteczce, tj. Wzrost udziału w nim wiązań kowalencyjnych zwiększa siłę jego rozkładu na jony. W szeregu związków danego kationu z anionami tego samego typu stopień dysocjacji w roztworach maleje wraz ze wzrostem polaryzowalności anionów. Na przykład w szeregu halogenków ołowiu PbCl 2 - PbBr 2 - PI 2 promień anionów halogenkowych wzrasta, zwiększa się ich polaryzowalność, a rozkład na jony jest osłabiony, co znajduje odzwierciedlenie w spadku rozpuszczalności.
Porównując właściwości soli z tym samym anionem i odpowiednio dużymi kationami, należy wziąć pod uwagę polaryzację kationów. Na przykład promień jonu Hg 2+ jest większy niż promień jonu Ca 2+, więc Hg 2+ jest bardziej spolaryzowany niż Ca 2+. W rezultacie CaCl 2 jest mocnym elektrolitem, tj. dysocjuje całkowicie w roztworze, a HgCl2 jest słabym elektrolitem, tj. praktycznie nie dysocjuje w roztworach.
Polaryzacja jonów w cząsteczce zmniejsza jej siłę, gdy rozpada się ona na atomy lub cząsteczki. Na przykład w szeregu CaCl 2 - CaBr 2 - Ca1 2 promień jonów halogenkowych wzrasta, zwiększa się ich polaryzacja przez jon Ca 2+, a zatem temperatura dysocjacji termicznej na wapń i halogen maleje: CaHa1 2 = Ca + Ha1 2.
Jeśli jon łatwo ulega polaryzacji, to jego wzbudzenie wymaga niewielkiej energii, co odpowiada absorpcji kwantów światła widzialnego. Jest to przyczyną zabarwienia roztworów takich związków. Wzrost polaryzowalności prowadzi do wzrostu koloru, na przykład w szeregu NiCl 2 - NiBr 2 - Nil 2 (zwiększona polaryzowalność anionu) lub w szeregu KC1 - CuCl 2 (zwiększona polaryzowalność kationu).
Granica między polarnymi wiązaniami kowalencyjnymi i jonowymi jest bardzo dowolna. W przypadku cząsteczek w stanie gazowym uważa się, że z różnicą elektroujemności Ach > Wiązanie 2,5 jest jonowe. W roztworach rozpuszczalników polarnych, a także w stanie krystalicznym, silny wpływ mają odpowiednio cząsteczki rozpuszczalnika i sąsiednie cząstki w węzłach. sieci krystalicznej. Dlatego jonowy charakter wiązania pojawia się przy znacznie mniejszej różnicy elektroujemności. W praktyce można przyjąć, że wiązanie pomiędzy typowymi metalami i niemetalami w roztworach i kryształach ma charakter jonowy.
W cząsteczkach dodatnie ładunki jąder są kompensowane przez ujemne ładunki elektronów. Jednakże ładunki dodatnie i ujemne można oddzielić przestrzennie. Załóżmy, że cząsteczka składa się z atomów różne elementy(HC1, CO itp.). W tym przypadku elektrony są przesunięte do atomu o większej elektroujemności, a środki ciężkości ładunków dodatnich i ujemnych nie pokrywają się, tworząc Dipole elektryczne- układ dwóch ładunków o jednakowej wielkości i przeciwnych znakach Q, położony w pewnej odległości l, zwany długość dipola. Długość dipola jest wielkością wektorową. Tradycyjnie przyjmuje się jego kierunek od ładunku ujemnego do dodatniego. Takie cząsteczki nazywane są cząsteczki polarne lub dipole.
Polaryzacja cząsteczki jest tym większa, im większa jest wartość bezwzględna ładunku i długość dipola. Miarą biegunowości jest iloczyn Q. ja, zwany elektrycznym momentem dipolowym μ: μ = q. l.
Jednostka miary μ Debye (D) serwuje. 1 D = 3,3. 10 -30 kl. M.
W cząsteczkach składających się z dwóch identycznych atomów μ = 0. Nazywa się je niepolarny. Jeśli taka cząstka wejdzie w pole elektryczne, to pod wpływem tego pola doświadczy polaryzacja- przesunięcie środków ciężkości ładunków dodatnich i ujemnych. W cząstce pojawia się elektryczny moment dipolowy, tzw indukowany dipol.
Moment dipolowy dwuatomowej cząsteczki AB można utożsamić z momentem dipolowym Połączenia A-B w tym. Jeśli wspólna para elektronów zostanie przesunięta do jednego z atomów, wówczas moment elektryczny dipola wiązania nie będzie wynosił zero. Połączenie w tym przypadku nazywa się polarne wiązanie kowalencyjne. Jeśli para elektronów jest ułożona symetrycznie względem atomów, wówczas nazywa się to wiązaniem niepolarny.
W cząsteczce wieloatomowej każdemu wiązaniu można przypisać określony elektryczny moment dipolowy. Następnie elektryczny moment dipolowy cząsteczki można przedstawić jako sumę wektorową elektrycznych momentów dipolowych poszczególnych wiązań. Istnienie lub brak momentu dipolowego w cząsteczce jest powiązany z jej symetrią. Cząsteczki o symetrycznej strukturze są niepolarne (μ = 0). Należą do nich cząsteczki dwuatomowe z identycznymi atomami (H 2, C1 2 itp.), cząsteczka benzenu, cząsteczki z wiązaniami polarnymi BF 3, A1F 3, CO 2, BeCl 2 itp.
Elektryczny moment dipolowy cząsteczki jest ważnym parametrem molekularnym. Znajomość wartości μ może wskazać strukturę geometryczną cząsteczki. Na przykład polarność cząsteczki wody wskazuje na jej strukturę kątową, a brak momentu dipolowego CO 2 wskazuje na jej liniowość.
Wiązanie jonowe
Ograniczającym przypadkiem kowalencyjnego wiązania polarnego jest wiązanie jonowe. Jeśli elektroujemności atomów różnią się bardzo znacznie (na przykład atomy metale alkaliczne i halogeny), a gdy się zbliżą, elektrony walencyjne jednego atomu są całkowicie przenoszone na drugi atom. W wyniku tego przejścia oba atomy stają się jonami i przyjmują je struktura elektroniczna najbliższy gaz szlachetny. Na przykład, gdy atomy sodu i chloru oddziałują, zamieniają się w jony Na + i Cl -, pomiędzy którymi powstaje przyciąganie elektrostatyczne. Wiązanie jonowe można opisać w ramach metod BC i MO, ale zwykle rozważa się je przy użyciu klasycznych praw elektrostatyki.
Cząsteczki, w których występuje czyste wiązanie jonowe, występują w stanie pary substancji. Kryształy jonowe składają się z nieskończonych rzędów naprzemiennych jonów dodatnich i ujemnych, połączonych siłami elektrostatycznymi. Kiedy kryształy jonowe rozpuszczają się lub topią, jony dodatnie i ujemne przechodzą do roztworu lub topią się.
Należy zauważyć, że wiązania jonowe są bardzo silne, więc aby zniszczyć kryształy jonowe, trzeba wydać dużo energii. Wyjaśnia to fakt, że związki jonowe mają wysokie temperatury topnienia.
W przeciwieństwie do wiązania kowalencyjnego, wiązanie jonowe nie ma właściwości nasycenia i kierunkowości. Dzieje się tak dlatego, że pole elektryczne wytwarzane przez jony ma symetrię kulistą i działa jednakowo na wszystkie jony. Dlatego o liczbie jonów otaczających dany jon i ich rozmieszczeniu przestrzennym decyduje jedynie wielkość ładunków jonów i ich rozmiary.
Rozważając wiązanie jonowe należy pamiętać, że podczas elektrostatycznego oddziaływania pomiędzy jonami następuje ich odkształcenie, tzw. polaryzacja. Na ryc. 2.1, A przedstawia dwa elektrostatycznie obojętne jony oddziałujące na siebie i utrzymujące idealnie kulisty kształt. Na ryc. 2.1, B pokazuje polaryzację jonów, co prowadzi do zmniejszenia efektywnej odległości między środkami ładunków dodatnich i ujemnych. Im większa polaryzacja jonów, tym mniejszy stopień jonowości wiązania, tj. Im większy kowalencyjny charakter wiązania między nimi. W kryształach polaryzacja okazuje się niska, ponieważ jony są symetrycznie otoczone jonami o przeciwnym znaku i jon jest poddawany takiemu samemu wpływowi we wszystkich kierunkach.