HNO3, mocny kwas jednozasadowy zawierający tlen. Stały kwas azotowy tworzy dwie modyfikacje krystaliczne z siatkami jednoskośnymi i ortorombowymi.
Kwas azotowy miesza się z wodą w dowolnym stosunku. W roztwory wodne prawie całkowicie dysocjuje na jony.
Otrzymuje się go w wyniku katalitycznego utleniania syntetycznego amoniaku na katalizatorach platynowo-rodowych (metoda Habera) do mieszaniny tlenków azotu (gazów azotowych), z dalszą ich absorpcją przez wodę
4NH3 + 5O2 (Pt) > 4NO + 6H2O
2NO + O2 > 2NO2 4NO2 + O2 + 2H2O > 4HNO3 Stężenie kwasu azotowego otrzymywanego tą metodą waha się w zależności od projektu technologicznego procesu od 45 do 58%. Alchemicy jako pierwsi uzyskali kwas azotowy poprzez ogrzewanie mieszaniny saletry i siarczanu żelaza:
4KNO3 + 2(FeSO4 · 7H2O) (t°) > Fe2O3 + 2K2SO4 + 2HNO3^ + NO2^ + 13H2O
Czysty kwas azotowy został po raz pierwszy otrzymany przez Johanna Rudolfa Glaubera poprzez działanie na azotany stężonym kwasem siarkowym:
KNO3 + H2SO4(stęż.) (t°) > KHSO4 + HNO3^
W drodze dalszej destylacji tzw „dymiący kwas azotowy”, praktycznie nie zawierający wody.
Aplikacja:
w produkcji nawozów mineralnych;
w przemyśle wojskowym;
w fotografii - zakwaszenie niektórych roztworów barwiących;
w grafice sztalugowej - do akwaforty form drukarskich (tablice akwafortowe, cynkograficzne formy drukarskie i klisze magnezowe).
1. Rozcieńczony kwas azotowy ma wszystkie właściwości mocnych kwasów, w roztworach wodnych dysocjuje według następującego schematu:
HNO3 H+ + NO3–,
bezwodny kwas:
2HNO3® NO2+ + NO3–+ H2O.
Stopniowo, szczególnie pod wpływem światła lub po podgrzaniu, kwas azotowy rozkłada się, podczas przechowywania roztwór staje się brązowawy z powodu dwutlenku azotu:
4HNO3 4NO2 + 2H2O + O2.
2. Kwas azotowy reaguje z prawie wszystkimi metalami. Rozcieńczony kwas azotowy metalami alkalicznymi i ziem alkalicznych, a także żelazem i cynkiem tworzy odpowiednie azotany, azotan amonu lub półtlenek azotu, w zależności od aktywności metalu i wodę:
4Mg + 10HNO3® 4Mg(NO3)2 + N2O + 5H2O,
W przypadku metali ciężkich rozcieńczony kwas tworzy odpowiednie azotany, uwalnia się woda i tlenek azotu, a w przypadku mocniejszego rozcieńczenia azot:
5Fe + 12HNO3(ultrarozcieńczony)®5Fe(NO3)3 + N2+ 6H2O,
3Cu + 8HNO3® 3Cu(NO3)2 + 2NO + 4H2O.
Stężony kwas azotowy podczas interakcji z metalami alkalicznymi i alkalicznymi tworzy odpowiednie azotany, uwalnia się woda i półtlenek azotu:
8Na + 10HNO3® 8NaNO3 + N2O + 5H2O.
Metale takie jak żelazo, chrom, aluminium, złoto, platyna, iryd, tantal poddaje się pasywacji stężonym kwasem, tj. Na powierzchni metalu tworzy się warstwa tlenków, nieprzepuszczalna dla kwasów. Inny metale ciężkie podczas interakcji ze stężonym kwasem azotowym tworzą odpowiednie azotany, wodę i uwalniają tlenek lub dwutlenek azotu:
3Hg + 8HNO3(zimny)®3Hg(NO3)2 + 2NO + 4H2O,
Hg + 4HNO3(hor.)®Hg(NO3)2 + 2NO2+ 2H2O,
Ag + 2HNO3® AgNO3 + NO2+ 2H2O.
3. Kwas azotowy może rozpuszczać złoto, platynę i inne metale szlachetne, ale w mieszaninie z kwasem solnym. Ich mieszanina w stosunku do trzech objętości koncentratu kwasu solnego a jedna objętość stężonego kwasu azotowego nazywana jest „wodą królewską”. Działanie wody królewskiej polega na tym, że kwas azotowy utlenia kwas solny do wolnego chloru, który łączy się z metalami:
HNO3 + HCl® Cl2 + 2H2O + NOCl,
2NOCl® 2NO + Cl2.
Aqua regia jest w stanie rozpuścić złoto, platynę, rod, iryd i tantal, które nie rozpuszczają się w kwasie azotowym, a tym bardziej w kwasie solnym:
Au + HNO3 + 3HCl® AuCl3 + NO + 2H2O,
HCl + AuCl3®H;
3Pt + 4HNO3 + 12HCl® 3PtCl4 + 4NO + 8H2O,
2HCl + PtCl4® H2.
4.Niemetale są również utleniane kwasem azotowym do odpowiednich kwasów, rozcieńczony kwas uwalnia tlenek azotu:
3P + 5HNO3 + 2H2O® 3H3PO4 + 5NO,
stężony kwas uwalnia dwutlenek azotu:
S + 6HNO3® H2SO4 + 6NO2+ 2H2O,
kwas azotowy może również utleniać niektóre związki nieorganiczne:
3H2S + 8HNO3® 3H2SO4 + 8NO + 4H2O.
HNO2 jest słabym kwasem monoprotonowym, który występuje tylko w rozcieńczonych roztworach wodnych, zabarwionych na jasnoniebieski kolor i w fazie gazowej. Sole kwasu azotawego nazywane są azotynami lub kwasami azotawymi. Azotany są znacznie bardziej stabilne niż HNO2, a wszystkie one są toksyczne.
W fazie gazowej płaska cząsteczka kwasu azotawego występuje w dwóch konfiguracjach, cis i trans. Na temperatura pokojowa przeważa izomer trans
Chem. święci
W roztworach wodnych równowaga:
2HNO2 - N2O3 + H2O - NO^ + NO2^ + H2O
Po ogrzaniu roztworu kwas azotawy rozkłada się, uwalniając NO i NO2:
3HNO2 - HNO3 + 2NO^ + H2O.
HNO2 jest trochę silniejszy kwas octowy. Łatwo zastąpione przez mocniejsze kwasy z soli:
H2SO4 + Ba(NO2)2 > BaSO4v + HNO2.
Kwas azotowy wykazuje właściwości utleniające i redukujące. Pod wpływem silniejszych utleniaczy (H2O2, KMnO4) ulega utlenieniu do HNO3:
2HNO2 + 2HI > 2NO^ + I2v + 2H2O;
5HNO2 + 2HMnO4 >2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O > HNO3 + 2HCl.
Kwas azotawy służy do diazowania pierwszorzędowych amin aromatycznych i tworzenia soli diazoniowych. Azotyny wykorzystywane są w syntezie organicznej do produkcji barwników organicznych.
Paragon:
N2O3 + H2O 2HNO2,
NaNO2 + H2SO4 (0° C)® NaHSO4 + HNO2
AgNO2 + HCl® AgCl + HNO2
Właściwości soli
Wszystkie azotany są dobrze rozpuszczalne w wodzie. Wraz ze wzrostem temperatury ich rozpuszczalność znacznie wzrasta. Po podgrzaniu azotany rozkładają się, uwalniając tlen. Azotany amonu, alkaliczne i metale ziem alkalicznych zwany azotanem, np. NaNO3 – azotan sodu (azotan chilijski), KNO3 – azotan potasu, NH4NO3 – azotan amonu. Azotany powstają w wyniku działania kwasu azotowego HNO3 na metale, tlenki, wodorotlenki i sole. Prawie wszystkie azotany są dobrze rozpuszczalne w wodzie.
Azotany są stabilne w zwykłych temperaturach. Zwykle topią się w temperaturze względnej niskie temperatury(200-600°C), często z rozkładem.
Azotany metali alkalicznych rozkładają się do azotynów z wydzieleniem tlenu (a przy długotrwałym ogrzewaniu rozkładają się stopniowo na tlenek metalu, azot cząsteczkowy i tlen, dlatego są dobrymi utleniaczami).
Azotany metali o średniej aktywności rozkładają się po podgrzaniu do tlenków metali, uwalniając dwutlenek azotu i tlen.
Azotany są najmniejsze metale aktywne(metale szlachetne) rozkładają się głównie do wolnych metali z wydzieleniem dwutlenku azotu i tlenu.
Azotany są dość silnymi utleniaczami w stanie stałym (zwykle w postaci stopu), ale w roztworze praktycznie nie mają właściwości utleniających, w przeciwieństwie do kwasu azotowego.
Azotyn jest solą kwasu azotawego HNO2. Azotyny są mniej stabilne termicznie niż azotany. Wykorzystuje się je do produkcji barwników azowych oraz w medycynie.
HNO 2 ma słaby charakter. Bardzo niestabilny, można go znaleźć tylko w rozcieńczonych roztworach:2 HNO 2 NIE + NIE 2 + H 2 O.
Nazywa się sole kwasu azotawego azotyny Lub kwas azotowy. Azotyny są znacznie bardziej stabilne niż HNO2, wszystkie są toksyczne.
2HNO 2 + 2HI = I 2 + 2NO + 2H 2 O,
HNO 2 + H 2 O 2 = HNO 3 + H 2 O,
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + K 2 SO 4 + 2MnSO 4 + 3H 2 O.
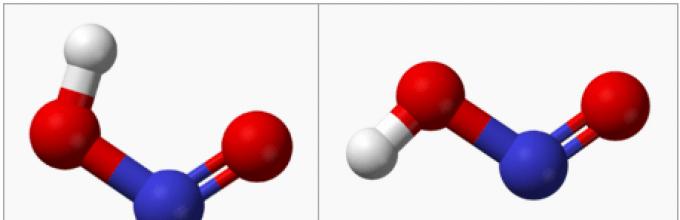
Struktura kwasu azotawego.
W fazie gazowej płaska cząsteczka kwasu azotawego występuje w postaci dwóch konfiguracji: cis- i trans-:

W temperaturze pokojowej dominuje izomer trans: ta struktura jest bardziej stabilna. Więc dla cis- HNO2(G) DG° f= −42,59 kJ/mol, a dla trans- HNO2(G) DG= −44,65 kJ/mol.
Właściwości chemiczne kwasu azotawego.
W roztworach wodnych równowaga:
Po podgrzaniu roztwór kwasu azotawego rozkłada się, uwalniając NIE i powstawanie kwasu azotowego:
HNO2 dysocjuje w roztworach wodnych ( K D=4,6·10−4), nieco silniejszy od kwasu octowego. Łatwo zastąpione przez mocniejsze kwasy z soli:
Kwas azotawy wykazuje właściwości utleniające i redukujące. Pod wpływem silniejszych utleniaczy (nadtlenek wodoru, chlor, nadmanganian potasu) następuje utlenianie do kwasu azotowego:
Ponadto może utleniać substancje posiadające właściwości redukujące:
Wytwarzanie kwasu azotawego.
Kwas azotawy otrzymuje się przez rozpuszczenie tlenku azotu (III) N2O3 w wodzie:
Ponadto powstaje, gdy tlenek azotu (IV) rozpuszcza się w wodzie. NIE 2:
.
Zastosowanie kwasu azotawego.
Kwas azotawy służy do diazowania pierwszorzędowych amin aromatycznych i tworzenia soli diazoniowych. Azotyny wykorzystywane są w syntezie organicznej do produkcji barwników organicznych.
Fizjologiczne działanie kwasu azotawego.
Kwas azotawy jest toksyczny i ma wyraźne działanie mutagenne, ponieważ jest środkiem deaminującym.
Kwas azotowy. Czysty kwas azotowy HNO 3 jest bezbarwną cieczą o gęstości 1,51 g/cm w temperaturze -42°C, krzepnącą w przezroczystą krystaliczną masę. W powietrzu podobnie jak stężony kwas solny „dymi”, ponieważ jego opary tworzą z wilgocią w powietrzu małe kropelki mgły,
Kwas azotowy nie jest trwały, nawet pod wpływem światła ulega stopniowemu rozkładowi:
Im wyższa temperatura i bardziej stężony kwas, tym szybciej następuje rozkład. Uwolniony dwutlenek azotu rozpuszcza się w kwasie i nadaje mu brązowy kolor.
Kwas azotowy jest jednym z najsilniejszych kwasów; w rozcieńczonych roztworach całkowicie rozkłada się na jony H + i - NO 3.
Właściwości utleniające kwasu azotowego. Charakterystyczną właściwością kwasu azotowego jest jego wyraźna zdolność utleniająca. Kwas azotowy-jeden
jeden z najbardziej energetycznych utleniaczy. Wiele niemetali łatwo się przez niego utlenia, zamieniając się w odpowiednie kwasy. Zatem po ugotowaniu z kwasem azotowym siarka stopniowo utlenia się do kwasu siarkowego, a fosfor do kwasu fosforowego. Tlący się węgiel zanurzony w stężonym HNO 3 płonie jasno.
Kwas azotowy działa na prawie wszystkie metale (z wyjątkiem złota, platyny, tantalu, rodu, irydu), zamieniając je w azotany, a niektóre metale w tlenki.
Stężony HNO 3 pasywuje niektóre metale. Łomonosow odkrył również, że żelazo, które łatwo rozpuszcza się w rozcieńczonym kwasie azotowym, nie rozpuszcza się
w zimnym stężonym HNO 3. Później odkryto, że kwas azotowy ma podobny wpływ na chrom i aluminium. Te metale idą na dno
poprzez działanie stężonego kwasu azotowego w stan pasywny.
Stopień utlenienia azotu w kwasie azotowym wynosi 4-5. Działając jako środek utleniający, HNO 3 można zredukować do różnych produktów:
Paragon.
1. W laboratorium kwas azotowy otrzymuje się w reakcji bezwodnych azotanów ze stężonym kwasem siarkowym:
Ba (NO 3) 2 + H 2 SO 4 → BaSO 4 ↓ + 2HNO 3.
2. W przemyśle produkcja kwasu azotowego przebiega w trzech etapach:
1. Utlenianie amoniaku do tlenku azotu (II):
4NH3 + 5O2 → 4NO + 6H2O
2. Utlenianie tlenku azotu (II) do tlenku azotu (IV):
2NO + O2 → 2NO2
3. Rozpuszczanie tlenku azotu (IV) w wodzie z nadmiarem tlenu:
4NO 2 + 2H 2 O + O 2 → 4HNO 3
Właściwości chemiczne . Wykazuje wszystkie właściwości kwasów. Kwas azotowy jest jednym z najsilniejszych kwasów mineralnych.
1. W roztworach wodnych ulega całkowitej dysocjacji na jony:
HNO 3 → H + + NO - 3
2. Reaguje z tlenkami metali:
MgO + 2HNO 3 → Mg(NO 3) 2 + H 2 O,
3. Reaguje z zasadami:
Mg(OH) 2 + 2HNO 3 → Mg(NO 3) 2 + 2H 2 O,
4. Stężony HNO 3 podczas interakcji z najbardziej aktywnymi metalami do Al ulega redukcji do N 2 O. Na przykład:
4Ca + 10HNO 3 → 4Ca(NO 3) 2 + N 2 O+ 5H 2 O
5. Stężony HNO 3 w reakcji z mniej aktywnymi metalami (Ni, Cu, Ag, Hg) ulega redukcji do NO 2. Na przykład:
4HNO 3 + Ni → Ni(NO 3) 2 + 2NO 2 + 2H 2 O.
6. Stężony HNO 3 reaguje podobnie z niemetalami. Niemetal ulega utlenieniu. Na przykład:
5HNO 3 + Po → HP + 5O 3 + 5NO 2 + 2H 2 O.
C sole kwasu azotowego – azotany po podgrzaniu rozkładają się według następującego schematu:
po lewej stronie Mg: MeNO 3 → MeNO 2 + O 2
Mg – Cu: MeNO 3 → MeO + NO 2 + O 2
po prawej Cu MeNO 3 → Me + NO 2 +O 2
Aplikacja.
Kwas azotowy wykorzystywany jest do produkcji nawozów azotowych, substancji leczniczych i materiałów wybuchowych.
Wodór. Budowa atomu, właściwości fizyczne i chemiczne, wytwarzanie i wykorzystanie wodoru.
WODÓR, H, pierwiastek chemiczny o liczbie atomowej 1, masa atomowa 1,00794.
Naturalny wodór składa się z mieszaniny dwóch stabilnych nuklidów o liczbach masowych 1,007825 (99,985% w mieszaninie) i 2,0140 (0,015%). Ponadto naturalny wodór zawsze zawiera znikome ilości radioaktywnego nuklidu - trytu 3H (okres półtrwania T1/2 = 12,43 lat). Ponieważ jądro atomu wodoru zawiera tylko 1 proton (w jądrze atomu pierwiastka nie może być mniej protonów), czasami mówi się, że wodór stanowi naturalną dolną granicę układu okresowego pierwiastków D. I. Mendelejewa (chociaż pierwiastek sam wodór znajduje się w górnej części tabel). Pierwiastek wodór znajduje się w pierwszym okresie układu okresowego. Należy zarówno do grupy 1 (metale alkaliczne grupy IA), jak i grupy 7 (halogeny grupy VIIA).
Masy atomowe izotopów wodoru różnią się znacznie (kilkukrotnie). Prowadzi to do zauważalnych różnic w ich zachowaniu w procesach fizycznych (destylacja, elektroliza itp.) oraz do pewnych różnic chemicznych (różnice w zachowaniu izotopów jednego pierwiastka nazywane są efektami izotopowymi; w przypadku wodoru efekty izotopowe są najbardziej znaczące). Dlatego w przeciwieństwie do izotopów wszystkich innych pierwiastków, izotopy wodoru mają specjalne symbole i nazwy. Wodór o liczbie masowej 1 nazywany jest lekkim wodorem, czyli protium (łac. Protium, od greckiego protos - pierwszy), oznaczony symbolem H, a jego jądro nazywa się protonem, symbolem p. Wodór o liczbie masowej 2 nazywany jest ciężkim wodorem, deuterem (łac. Deuter, od greckiego deuteros - drugi), do jego oznaczenia używa się symboli 2 H lub D (czytaj „de”), jądrem d jest deuteron. Izotop promieniotwórczy o liczbie masowej 3 nazywany jest superciężkim wodorem, czyli trytem (łac. Tritum, od greckiego tritos - trzeci), symbolem 3 H lub T (czytaj „te”), jądro t - tryton.
Konfiguracja pojedynczej warstwy elektronowej obojętnego, niewzbudnego atomu wodoru wynosi 1s1. W związkach wykazuje stopnie utlenienia +1 i rzadziej –1 (wartościowość I). Promień obojętnego atomu wodoru wynosi 0,0529 nm. Energia jonizacji atomu wynosi 13,595 eV, powinowactwo elektronowe wynosi 0,75 eV. Według skali Paulinga elektroujemność wodoru wynosi 2,20. Wodór jest niemetalem.
W wolnej postaci jest to lekko palny gaz, bez koloru, zapachu i smaku.
Fizyczne i chemiczne właściwości: w normalnych warunkach wodór jest lekkim (gęstość w normalnych warunkach 0,0899 kg/m3) bezbarwnym gazem. Temperatura topnienia –259,15°C, temperatura wrzenia –252,7°C. Ciekły wodór (w temperaturze wrzenia) ma gęstość 70,8 kg/m 3 i jest najlżejszą cieczą. Standardowy potencjał elektrody H 2 /H– w roztworze wodnym przyjmuje się jako równy 0. Wodór jest słabo rozpuszczalny w wodzie: w temperaturze 0 ° C rozpuszczalność jest mniejsza niż 0,02 cm 3 / ml, ale jest dobrze rozpuszczalny w niektórych metalach ( żelazo gąbczaste i inne), szczególnie dobre - w metalicznym palladzie (około 850 objętości wodoru w 1 objętości metalu). Ciepło spalania wodoru wynosi 143,06 MJ/kg.
Występuje w postaci dwuatomowych cząsteczek H2. Stała dysocjacji H2 na atomy w temperaturze 300 K wynosi 2,56·10–34. Energia dysocjacji cząsteczki H2 na atomy wynosi 436 kJ/mol. Odległość międzyjądrowa w cząsteczce H2 wynosi 0,07414 nm.
Ponieważ jądro każdego atomu H wchodzącego w skład cząsteczki ma swój własny spin, wodór cząsteczkowy może występować w dwóch postaciach: w postaci ortowodoru (o-H2) (oba spiny mają tę samą orientację) oraz w postaci parawodoru ( p-H 2 ) (tyły mają różną orientację). W normalnych warunkach normalny wodór jest mieszaniną 75% o-H2 i 25% p-H2. Właściwości fizyczne p- i o-H2 różnią się nieznacznie od siebie. Tak więc, jeśli temperatura wrzenia czysty o-N 2 20,45 K, zatem czysty p-N 2 - 20,26 tys. Transformacja o-H 2 w pH 2 towarzyszy wydzielanie 1418 J/mol ciepła.
Dużą siłę wiązania chemicznego pomiędzy atomami w cząsteczce H2 (co np. stosując metodę orbitali molekularnych można wytłumaczyć faktem, że w tej cząsteczce para elektronów znajduje się na orbicie wiążącym, a orbital antywiążący jest nie zajmowany przez elektrony) prowadzi do tego, że w temperaturze pokojowej gazowy wodór jest chemicznie nieaktywny. Zatem bez ogrzewania, po prostym zmieszaniu, wodór reaguje (wybuchowo) tylko z gazowym fluorem (F):
H2 + F2 = 2HF + Q.
Jeśli mieszaninę wodoru i chloru (Cl) napromieniuje się światłem ultrafioletowym w temperaturze pokojowej, obserwuje się natychmiastowe utworzenie się chlorowodoru HCl. Reakcja wodoru z tlenem (O) zachodzi wybuchowo, jeśli do mieszaniny tych gazów dodaje się katalizator, metaliczny pallad (Pd) (lub platynę (Pt)). W wyniku zapłonu wybucha mieszanina wodoru i tlenu (O) (tzw. gaz detonujący), a wybuch może nastąpić w mieszaninach, w których zawartość wodoru waha się od 5 do 95 procent objętościowych. Czysty wodór w powietrzu lub w czystym tlenie (O) spala się cicho, wydzielając dużą ilość ciepła:
H2 + 1/2O2 = H2O + 285,75 kJ/mol
Jeśli wodór oddziałuje z innymi niemetalami i metalami, dzieje się to tylko pod pewnymi warunkami (ogrzewanie, wysokie ciśnienie, obecność katalizatora). Zatem wodór reaguje odwracalnie z azotem (N) pod podwyższonym ciśnieniem (20-30 MPa lub więcej) i w temperaturze 300-400°C w obecności katalizatora - żelaza (Fe):
3H 2 + N 2 = 2NH 3 + Q.
Ponadto tylko po podgrzaniu wodór reaguje z siarką (S), tworząc siarkowodór H2S, z bromem (Br) tworząc bromowodór HBr, z jodem (I) tworząc jodowodór HI. Wodór reaguje z węglem (grafitem) tworząc mieszaninę węglowodorów o różnym składzie. Wodór nie oddziałuje bezpośrednio z borem (B), krzemem (Si), fosforem (P), związki tych pierwiastków z wodorem powstają pośrednio.
Po podgrzaniu wodór może reagować z metalami alkalicznymi, ziem alkalicznych i magnezem (Mg), tworząc związki z wiązaniem jonowym, które zawierają wodór na –1 stopniu utlenienia. Tak więc, gdy wapń jest podgrzewany w atmosferze wodoru, powstaje wodorek podobny do soli o składzie CaH2. Polimer wodorek glinu (AlH 3)x - jeden z najsilniejszych reduktorów - otrzymywany jest pośrednio (np. przy użyciu związków glinoorganicznych). W przypadku wielu metali przejściowych (na przykład cyrkonu (Zr), hafnu (Hf) itp.) wodór tworzy związki o zmiennym składzie (roztwory stałe).
Wodór może reagować nie tylko z wieloma prostymi, ale także złożonymi substancjami. Przede wszystkim należy zwrócić uwagę na zdolność wodoru do redukcji wielu metali z ich tlenków (takich jak żelazo (Fe), nikiel (Ni), ołów (Pb), wolfram (W), miedź (Cu) itp. ). Zatem po podgrzaniu do temperatury 400-450°C i wyższej żelazo (Fe) jest redukowane przez wodór z któregokolwiek z jego tlenków, na przykład:
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
Należy zaznaczyć, że z tlenków wodorem można redukować jedynie metale znajdujące się w szeregu standardowe potencjały dla manganu (Mn). Bardziej aktywne metale (w tym mangan (Mn)) nie są redukowane do metalu z tlenków.
Wodór może przyłączać podwójne lub potrójne wiązanie do wielu związków organicznych (są to tzw. reakcje uwodornienia). Na przykład w obecności katalizatora niklowego można przeprowadzić uwodornienie etylenu C2H4 i powstaje etan C2H6:
do 2 H. 4 + H. 2 = do 2 H. 6.
Metanol jest wytwarzany na skalę przemysłową w reakcji tlenku węgla (II) i wodoru:
2H2 + CO = CH3OH.
W związkach, w których atom wodoru jest połączony z atomem bardziej elektroujemnego pierwiastka E (E = F, Cl, O, N), pomiędzy cząsteczkami powstają wiązania wodorowe (dwa atomy E tego samego lub dwa różne elementy są ze sobą połączone poprzez atom H: E"... N... E"", a wszystkie trzy atomy leżą na tej samej linii prostej). Takie wiązania istnieją pomiędzy cząsteczkami wody, amoniaku, metanolu itp. i prowadzą do zauważalnego wzrostu temperatury wrzenia tych substancji, wzrostu ciepła parowania itp.
Paragon: Wodór można wytwarzać na wiele sposobów. W przemyśle wykorzystuje się do tego gazy ziemne, a także gazy uzyskiwane z rafinacji ropy naftowej, koksowania i zgazowania węgla i innych paliw. Podczas produkcji wodoru z gazu ziemnego (głównym składnikiem jest metan) ulega on katalitycznemu oddziaływaniu z parą wodną i niecałkowitemu utlenieniu tlenem (O):
CH 4 + H 2 O = CO + 3H 2 i CH 4 + 1/2 O 2 = CO 2 + 2H 2
Oddzielenie wodoru od gazu koksowniczego i gazów rafinacyjnych polega na ich upłynnieniu podczas głębokiego chłodzenia i usunięciu z mieszaniny gazów, które upłynniają się łatwiej niż wodór. Gdy dostępna jest tania energia elektryczna, wodór wytwarza się w procesie elektrolizy wody, przepuszczając prąd przez roztwory alkaliczne. W warunkach laboratoryjnych wodór można łatwo otrzymać w reakcji metali z kwasami, na przykład cynku (Zn) z kwasem solnym.
Aplikacja: wodór stosuje się w syntezie amoniaku NH3, chlorowodoru HCl, metanolu CH 3 OH, w hydrokrakingu (krakingu w atmosferze wodoru) naturalnych węglowodorów, jako środek redukujący w produkcji niektórych metali. W wyniku uwodornienia naturalnych olejów roślinnych otrzymuje się tłuszcz stały – margarynę. Ciekły wodór jest stosowany jako paliwo rakietowe, a także jako chłodziwo. Do spawania wykorzystuje się mieszaninę tlenu (O) i wodoru.
Swego czasu sugerowano, że w najbliższej przyszłości głównym źródłem produkcji energii będzie reakcja spalania wodoru, a energia wodorowa wyprze tradycyjne źródła produkcji energii (węgiel, ropa naftowa itp.). Zakładano, że elektroliza wody będzie możliwa do produkcji wodoru na dużą skalę. Elektroliza wody jest procesem dość energochłonnym i obecnie nieopłacalne jest wytwarzanie wodoru metodą elektrolizy na skalę przemysłową. Oczekiwano jednak, że elektroliza będzie opierać się na wykorzystaniu ciepła średniotemperaturowego (500-600°C), które występuje w dużych ilościach podczas pracy elektrowni jądrowych. Ciepło to ma ograniczone zastosowanie, a możliwość wytworzenia za jego pomocą wodoru pozwoliłaby na rozwiązanie problemu ekologicznego (przy spalaniu wodoru w powietrzu ilość powstającego w środowisku szkodliwe substancje minimalna) oraz problem wykorzystania ciepła średniotemperaturowego. Jednak po katastrofie w Czarnobylu rozwój energetyki jądrowej został wszędzie zahamowany, przez co to źródło energii stało się niedostępne. Dlatego perspektywy powszechnego wykorzystania wodoru jako źródła energii wciąż się zmieniają, co najmniej do połowy XXI wieku.
Cechy leczenia : wodór nie jest toksyczny, jednak przy obchodzeniu się z nim należy stale brać pod uwagę jego wysokie zagrożenie pożarem i wybuchem, a ryzyko wybuchu wodoru wzrasta ze względu na dużą zdolność gazu do dyfuzji nawet przez niektóre materiały stałe. Przed rozpoczęciem jakichkolwiek operacji grzewczych w atmosferze wodoru należy upewnić się, że jest ona czysta (przy zapalaniu wodoru w probówce odwróconej do góry nogami dźwięk powinien być głuchy, a nie szczekający).
27 Miejsce mikroorganizmów w systemie świata ożywionego. Różnorodność mikroorganizmów i ich podobieństwo do innych organizmów. Zasadnicze cechy mikroorganizmów: mały rozmiar komórek, duża aktywność metaboliczna, duża plastyczność ich metabolizmu (szybkie przystosowanie się do zmieniających się warunków środowiskowych, „wszędzie”), zdolność szybkiego rozmnażania się, słabe zróżnicowanie morfologiczne, różnorodność procesów metabolicznych.
Mikroorganizmy, (mikroby) to zbiorcza nazwa grupy organizmów żywych, które są zbyt małe, aby można je było zobaczyć gołym okiem (ich charakterystyczna wielkość jest mniejsza niż 0,1 mm). Do mikroorganizmów zalicza się zarówno bezjądrowe (prokarioty: bakterie, archeony), jak i eukarioty: niektóre grzyby, protisty, ale nie wirusy, które zwykle są izolowane w osobna grupa. Większość mikroorganizmów składa się z pojedynczej komórki, ale zdarzają się również mikroorganizmy wielokomórkowe, podobnie jak istnieją pewne makroorganizmy jednokomórkowe widoczne gołym okiem, jak np. Thiomargarita namibiensis, przedstawiciele rodzaju Caulerpa (są to gigantyczne polikariony). Mikrobiologia bada te organizmy.
Wszechobecność i całkowita siła potencjału metabolicznego mikroorganizmów determinuje ich najważniejszą rolę w obiegu substancji i utrzymaniu dynamicznej równowagi w biosferze Ziemi.
Krótkie badanie różnych przedstawicieli mikroświata zajmujących określone „piętra” wielkości pokazuje, że z reguły wielkość obiektów jest zdecydowanie powiązana z ich złożonością strukturalną. Dolną granicę wielkości wolno żyjącego organizmu jednokomórkowego wyznacza przestrzeń potrzebna do zmieszczenia w komórce aparatury niezbędnej do niezależnej egzystencji. Ograniczenie górnej granicy wielkości mikroorganizmów jest określone, zgodnie ze współczesnymi koncepcjami, na podstawie zależności między powierzchnią komórki a jej objętością. Wraz ze wzrostem rozmiarów komórek zwiększa się powierzchnia kwadratu i objętość sześcianu, zatem stosunek tych wielkości przesuwa się w stronę tej drugiej.
Mikroorganizmy żyją niemal wszędzie tam, gdzie jest woda, włączając gorące źródła, dno oceanów świata, a także głęboko we wnętrzu skorupy ziemskiej. Są ważnym ogniwem metabolizmu w ekosystemach, pełniąc głównie rolę rozkładających, jednak w niektórych ekosystemach są jedynymi producentami biomasy – producentami.
Mikroorganizmy żyjące w różnych środowiskach uczestniczą w obiegu siarki, żelaza, fosforu i innych pierwiastków, dokonują rozkładu substancji organicznych pochodzenia zwierzęcego, roślinnego i abiogennego (metan, parafiny) oraz zapewniają samooczyszczanie wody w zbiornikach.
Jednak nie wszystkie rodzaje mikroorganizmów przynoszą korzyści ludziom. Bardzo duża liczba gatunków mikroorganizmów ma charakter oportunistyczny lub chorobotwórczy dla ludzi i zwierząt. Niektóre mikroorganizmy powodują psucie się produktów rolnych, zubożanie gleby w azot, powodują zanieczyszczenie zbiorników wodnych i gromadzenie się substancji toksycznych w produktach spożywczych (na przykład toksyn mikrobiologicznych).
Mikroorganizmy charakteryzują się dobrą zdolnością adaptacji do działania czynników środowiskowych. Różne mikroorganizmy mogą rozwijać się w temperaturach od -6° do +50-75°. Rekord przeżycia w podwyższonych temperaturach ustanowiły archeony, których niektóre badane kultury rosną na pożywkach w temperaturze powyżej 110 °C, na przykład Methanopyrus kandleri (szczep 116) rośnie w temperaturze 122 °C, co jest rekordowo wysoką temperaturą dla wszystkich znanych organizmów.
W naturze siedliska o tej temperaturze występują pod ciśnieniem w gorących źródłach wulkanicznych na dnie oceanów (czarni palacze).
Wiadomo, że mikroorganizmy rozwijają się w ilościach, które są śmiertelne dla stworzeń wielokomórkowych. promieniowanie jonizujące w szerokim zakresie wartości pH, przy 25% stężeniu chlorku sodu, w warunkach zmiennej zawartości tlenu aż do jego całkowitego braku (mikroorganizmy beztlenowe).
Jednocześnie mikroorganizmy chorobotwórcze powodują choroby u ludzi, zwierząt i roślin.
Najszerzej akceptowane teorie na temat pochodzenia życia na Ziemi sugerują, że protomikroorganizmy były pierwszymi organizmami żywymi, które pojawiły się w procesie ewolucji.
Obecnie wszystkie mikroorganizmy dzielą się na 3 królestwa:
1. Prokarioty. To królestwo obejmuje wszystkie rodzaje bakterii, riketsje, chlamydie, mykoplazmy itp. Komórki mają jądro z jednym chromosomem. Jądro nie jest oddzielone od cytoplazmy komórki. Prosty cykl podziału przez zwężenie. Istnieje wiele unikalnych organelli, takich jak plazmidy i mezosomy. Nie ma zdolności do fotosyntezy.
2. Eukarioty. Przedstawicielami tego królestwa są grzyby i pierwotniaki. Komórka zawiera jądro, oddzielone od cytoplazmy błoną, z kilkoma chromosomami. Istnieje wiele organelli charakterystycznych dla zwierząt wyższych: mitochondria, retikulum endoplazmatyczne, aparat Golgiego. Niektórzy przedstawiciele tego królestwa mają chloroplasty i są zdolni do fotosyntezy. Mają złożony cykl życia.
3. Wira. Wirusy należą do tego królestwa. Charakterystyczną cechą wirionu jest obecność tylko jednego rodzaju kwasów nukleinowych: RNA lub DNA, zamkniętych w kapsydzie. Wirus może nie mieć wspólnej powłoki zewnętrznej. Powielanie wirusa może nastąpić dopiero po osadzenia w innej komórce, gdzie następuje replikacja.
Jeśli podgrzejesz azotan potasu lub sodu, stracą część tlenu i zamienią się w sole kwasu azotawego HNO 2. Rozkład jest łatwiejszy w obecności ołowiu, który wiąże uwolnione:
KNO3 + Pb = KNO2 + PbO
Sole kwasu azotawego – azotyny – są krystaliczne, dobrze rozpuszczalne w wodzie (z wyjątkiem soli srebra). NaNO 2 jest szeroko stosowany w produkcji różnych barwników.
Po wystawieniu roztworu azotynu na działanie rozcieńczonego kwasu siarkowego otrzymuje się wolny kwas azotawy:
2NaNO 2 + H 2 SO 4 = Na 2 SO 4 + 2HNO 2
Jest to jeden ze słabych kwasów (DO= 5 · 10 -4) i jest znany tylko w bardzo rozcieńczonych roztworach wodnych. Gdy roztwór jest zatężany lub podgrzewany, kwas azotawy rozkłada się, uwalniając tlenek i dwutlenek azotu:
2HNO2 = NO + NO2 + H2O
Kwas azotawy jest mocny, ale jednocześnie pod wpływem innych, bardziej energicznych utleniaczy może sam utlenić się do kwasu azotowego.
Czytasz artykuł na temat Kwas azotawy HNO2
Kwas azotawy występuje w roztworze lub w fazie gazowej. Jest niestabilny i po podgrzaniu rozpada się na pary:
2HNO 2 „NO+NO 2 +H 2 O
Wodne roztwory tego kwasu rozkładają się pod wpływem ogrzewania:
3HNO 2 „HNO 3 +H 2O+2NO
Reakcja ta jest zatem odwracalna, chociaż rozpuszczeniu NO 2 towarzyszy utworzenie dwóch kwasów: 2NO 2 + H 2 O = HNO 2 + HNO 3
Praktycznie w reakcji NO 2 z wodą otrzymuje się HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
Przez właściwości kwasowe Kwas azotawy jest tylko nieznacznie silniejszy od kwasu octowego. Jego sole nazywane są azotynami i w przeciwieństwie do samego kwasu są trwałe. Z roztworów jego soli roztwór HNO 2 można otrzymać dodając kwas siarkowy:
Ba(NO 2) 2 +H 2 SO 4 =2HNO 2 +BaSO 4 ¯
Na podstawie danych o jego związkach sugeruje się dwa typy budowy kwasu azotawego:
które odpowiadają azotynom i związkom nitrowym. Azotyny metali aktywnych mają strukturę typu I, a metale niskoaktywne mają strukturę typu II. Prawie wszystkie sole tego kwasu są dobrze rozpuszczalne, ale azotyn srebra jest najtrudniejszy. Wszystkie sole kwasu azotawego są trujące. Dla technologia chemiczna Ważne są KNO 2 i NaNO 2, które są niezbędne do produkcji barwników organicznych. Obie sole otrzymuje się z tlenków azotu:
NO+NO 2 +NaOH=2NaNO 2 +H 2 O lub podczas ogrzewania ich azotanów:
KNO 3 +Pb=KNO 2 +PbO
Pb jest niezbędny do wiązania uwolnionego tlenu.
Spośród właściwości chemicznych HNO 2 właściwości utleniające są bardziej wyraźne, podczas gdy on sam ulega redukcji do NO:

Można jednak podać wiele przykładów takich reakcji, w których kwas azotawy wykazuje właściwości redukujące:

Obecność kwasu azotawego i jego soli w roztworze można oznaczyć dodając roztwór jodku potasu i skrobi. Jon azotynowy utlenia anion jodowy. Ta reakcja wymaga obecności H +, tj. zachodzi w środowisku kwaśnym.
Kwas azotowy
W warunkach laboratoryjnych kwas azotowy można otrzymać przez działanie stężonego kwasu siarkowego na azotany:
NaNO 3 + H 2 SO 4(k) = NaHSO 4 + HNO 3 Reakcja zachodzi przy małym ogrzewaniu.
Produkcja kwasu azotowego na skalę przemysłową odbywa się poprzez katalityczne utlenianie amoniaku tlenem atmosferycznym:
1. Najpierw mieszaninę amoniaku i powietrza przepuszcza się przez katalizator platynowy w temperaturze 800°C. Amoniak utlenia się do tlenku azotu (II):
4NH3 + 5O2 = 4NO + 6H2O
2. Po ochłodzeniu następuje dalsze utlenianie NO do NO 2: 2NO+O2 =2NO2
3. Powstały tlenek azotu (IV) rozpuszcza się w wodzie w obecności nadmiaru O 2 tworząc HNO 3: 4NO 2 +2H 2 O+O 2 = 4HNO 3
Produkty wyjściowe – amoniak i powietrze – są dokładnie oczyszczane szkodliwe zanieczyszczenia, zatrucie katalizatora (siarkowodór, pył, oleje itp.).
Powstały kwas rozcieńcza się (40-60% kwasu). Stężony kwas azotowy (96-98%) otrzymuje się poprzez destylację rozcieńczonego kwasu w mieszaninie ze stężonym kwasem siarkowym. W tym przypadku odparowuje tylko kwas azotowy.
Właściwości fizyczne
Kwas azotowy jest bezbarwną cieczą o ostrym zapachu. Bardzo higroskopijny, „dymi” w powietrzu, ponieważ jego opary wraz z wilgocią z powietrza tworzą krople mgły. Miesza się z wodą w dowolnym stosunku. W temperaturze -41,6°C przechodzi w stan krystaliczny. Wrze w temperaturze 82,6°C.
W HNO 3 wartościowość azotu wynosi 4, stopień utlenienia +5. Formuła strukturalna kwas azotowy jest reprezentowany w następujący sposób:
Obydwa atomy tlenu, związane tylko z azotem, są równoważne: znajdują się w tej samej odległości od atomu azotu i każdy niesie połowę ładunku elektronu, tj. czwarta część azotu jest podzielona równo pomiędzy dwa atomy tlenu.
Struktura elektronowa kwas azotowy można otrzymać w następujący sposób:
1. Atom wodoru wiąże się z atomem tlenu wiązaniem kowalencyjnym:
2. Ze względu na niesparowany elektron atom tlenu tworzy wiązanie kowalencyjne z atomem azotu:
3. Tworzą się dwa niesparowane elektrony atomu azotu wiązanie kowalencyjne z drugim atomem tlenu:
4. Trzeci atom tlenu po wzbudzeniu tworzy wolny 2p- orbitalny poprzez parowanie elektronów. Oddziaływanie wolnej pary azotu z pustym orbitalem trzeciego atomu tlenu prowadzi do powstania cząsteczki kwasu azotowego:
Właściwości chemiczne
1. Rozcieńczony kwas azotowy wykazuje wszystkie właściwości kwasów. Odnosi się do mocne kwasy. Dysocjuje w roztworach wodnych:
HNO 3 „Н + +NO - 3 Częściowo rozkłada się pod wpływem ciepła i światła:
4HNO 3 =4NO 2 +2H 2 O+O 2 Dlatego przechowuj go w chłodnym i ciemnym miejscu.
2. Kwas azotowy charakteryzuje się wyłącznie właściwościami utleniającymi. Najważniejsze Właściwości chemiczne to interakcja z prawie wszystkimi metalami. Wodór nigdy nie jest uwalniany. Redukcja kwasu azotowego zależy od jego stężenia i rodzaju środka redukującego. Stopień utlenienia azotu w produktach redukcji mieści się w zakresie od +4 do -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Produkty redukcji powstałe w wyniku oddziaływania kwasu azotowego o różnym stężeniu z metalami o różnej aktywności przedstawiono na poniższym schemacie.

Stężony kwas azotowy w zwykłych temperaturach nie wchodzi w interakcję z aluminium, chromem i żelazem. Wprowadza je w stan pasywny. Na powierzchni tworzy się warstwa tlenków nieprzepuszczalna dla stężonego kwasu.

3. Kwas azotowy nie reaguje z Pt, Rh, Ir, Ta, Au. Platynę i złoto rozpuszcza się w wódce „regia” – mieszaninie 3 objętości stężonego kwasu solnego i 1 objętości stężonego kwasu azotowego:
Au+HNO 3 +3HCl= AuCl 3 +NO+2H 2O HCl+AuCl 3 =H
3Pt+4HNO 3 +12HCl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H2
Działanie wódki „regia” polega na tym, że kwas azotowy utlenia kwas solny do wolnego chloru:
HNO 3 +HCl=Cl 2 +2H 2 O+NOCl 2NOCl=2NO+Cl 2 Uwolniony chlor łączy się z metalami.
4. Niemetale utlenia się kwasem azotowym do odpowiednich kwasów i w zależności od stężenia redukuje do NO lub NO 2:
S+bHNO 3(stęż.) =H 2 SO 4 +6NO 2 +2H 2 OP+5HNO 3(stęż.) =H 3 PO 4 +5NO 2 +H 2 O Ja 2 +10HNO 3(stęż.) =2HIO 3 +10NO 2 +4H 2 O 3P+5HNO 3(p asb) +2H 2 O= 3H 3 PO 4 +5NO
5. Oddziałuje także ze związkami organicznymi.
Sole kwasu azotowego nazywane są azotanami i są substancje krystaliczne, dobrze rozpuszczalny w wodzie. Otrzymuje się je przez działanie HNO 3 na metale, ich tlenki i wodorotlenki. Azotany potasu, sodu, amonu i wapnia nazywane są azotanami. Azotan stosowany jest głównie jako mineralny nawóz azotowy. Dodatkowo KNO 3 wykorzystuje się do przygotowania czarnego proszku (mieszanina 75% KNO 3, 15% C i 10% S). Wybuchowy amonal składa się z NH 4 NO 3, proszku aluminiowego i trinitrotoluenu.
Sole kwasu azotowego rozkładają się pod wpływem ogrzewania, a produkty rozkładu zależą od pozycji metalu tworzącego sól w szeregu standardowych potencjały elektrod:

Rozkład pod wpływem ogrzewania (termoliza) jest ważną właściwością soli kwasu azotowego.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 = 2CuO + NO 2 + O 2
Sole metali znajdujące się w szeregu na lewo od Mg tworzą azotyny i tlen, od Mg do Cu - tlenek metalu, NO 2 i tlen, po Cu - wolny metal, NO 2 i tlen.
Aplikacja
Kwas azotowy jest najważniejszym produktem przemysłu chemicznego. Duże ilości przeznacza się na przygotowanie nawozów azotowych, materiały wybuchowe, barwniki, tworzywa sztuczne, włókna sztuczne i inne materiały. Palenie
Kwas azotowy stosowany jest w technologii rakietowej jako utleniacz paliwa rakietowego.