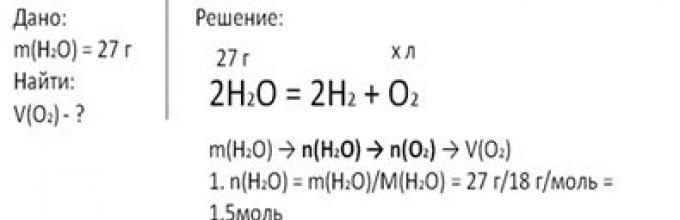Podczas rozwiązywania rozliczenia problemy chemiczne wymagana jest umiejętność wykonywania obliczeń z wykorzystaniem równania reakcji chemicznej. Lekcja poświęcona jest badaniu algorytmu obliczania masy (objętości, ilości) jednego z uczestników reakcji ze znanej masy (objętości, ilości) innego uczestnika reakcji.
Temat: Substancje i ich przemiany
Lekcja:Obliczenia z wykorzystaniem równania reakcji chemicznej
Rozważmy równanie reakcji tworzenia się wody proste substancje:
2H 2 + O 2 = 2H 2 O
Można powiedzieć, że z dwóch cząsteczek wodoru i jednej cząsteczki tlenu powstają dwie cząsteczki wody. Z drugiej strony ten sam wpis mówi, że do powstania każdych dwóch moli wody trzeba wziąć dwa mole wodoru i jeden mol tlenu.
Stosunek molowy uczestników reakcji pomaga w obliczeniach ważnych dla syntezy chemicznej. Spójrzmy na przykłady takich obliczeń.
ZADANIE 1. Wyznaczmy masę wody powstałej w wyniku spalenia wodoru w 3,2 g tlenu.
Aby rozwiązać to zadanie, należy najpierw utworzyć równanie reakcji chemicznej i zapisać nad nim dane warunki problemu.
Gdybyśmy znali ilość tlenu, która przereagowała, moglibyśmy określić ilość wody. Następnie obliczylibyśmy masę wody, znając jej zawartość i. Aby obliczyć ilość tlenu, należy podzielić masę tlenu przez jego masa cząsteczkowa.
Masa molowa jest liczbowo równa masie względnej. Dla tlenu wartość ta wynosi 32. Podstawmy ją do wzoru: ilość substancji tlenowej jest równa stosunkowi 3,2 g do 32 g/mol. Okazało się, że jest to 0,1 mola.
Aby obliczyć ilość substancji wodnej, zostawmy proporcję wykorzystując stosunek molowy uczestników reakcji:
Na każde 0,1 mola tlenu przypada nieznana ilość wody, a na każdy 1 mol tlenu przypada 2 mole wody.
Zatem ilość substancji wodnej wynosi 0,2 mola.
Aby wyznaczyć masę wody, należy pomnożyć znalezioną wartość ilości wody przez jej masę molową, tj. pomnóż 0,2 mola przez 18 g/mol, otrzymamy 3,6 g wody.
Ryż. 1. Zapisanie krótkiego warunku i rozwiązania problemu 1
Oprócz masy możesz obliczyć objętość gazowego uczestnika reakcji (w warunkach normalnych) korzystając ze znanego Ci wzoru, według którego objętość gazu w warunkach normalnych. równy iloczynowi ilości substancji gazowej i objętości molowej. Spójrzmy na przykład rozwiązania problemu.
ZADANIE 2. Obliczmy objętość tlenu (w normalnych warunkach) uwolnionego podczas rozkładu 27 g wody.
Zapiszmy równanie reakcji i dane warunki problemu. Aby obliczyć objętość wydzielonego tlenu, należy najpierw znaleźć ilość substancji wodnej przechodzącej przez masę, następnie korzystając z równania reakcji wyznaczyć ilość substancji tlenowej, po czym można obliczyć jej objętość na poziomie gruntu.
Ilość substancji wodnej jest równa stosunkowi masy wody do jej masy molowej. Otrzymujemy wartość 1,5 mola.
Zróbmy proporcję: z 1,5 mola wody powstaje nieznana ilość tlenu, z 2 moli wody powstaje 1 mol tlenu. Zatem ilość tlenu wynosi 0,75 mola. Obliczmy objętość tlenu w normalnych warunkach. Jest równy iloczynowi ilości tlenu i objętości molowej. Objętość molowa dowolnej substancji gazowej w warunkach otoczenia. równe 22,4 l/mol. Podstawiając wartości liczbowe do wzoru, otrzymujemy objętość tlenu równą 16,8 litra.
Ryż. 2. Zapisanie krótkiego warunku i rozwiązania problemu 2
Znając algorytm rozwiązywania takich problemów, można obliczyć masę, objętość lub ilość substancji jednego z uczestników reakcji z masy, objętości lub ilości substancji innego uczestnika reakcji.
1. Zbiór problemów i ćwiczeń z chemii: klasa VIII: do podręczników. rocznie Orżekowski i inni „Chemia. klasa 8” / P.A. Orżekowski, N.A. Titow, F.F. Hegel. - M.: AST: Astrel, 2006. (s. 40-48)
2. Ushakova O.V. Zeszyt ćwiczeń do chemii: klasa 8: do podręcznika P.A. Orżekowski i inni „Chemia. 8. klasa” / O.V. Ushakova, PI Bespałow, PA Orżekowski; pod. wyd. prof. rocznie Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (s. 73-75)
3. Chemia. 8 klasa. Podręcznik dla edukacji ogólnej instytucje / P.A. Orżekowski, L.M. Meshcheryakova, M.M. Szałaszowa. - M.: Astrel, 2013. (§23)
4. Chemia: klasa 8: podręcznik. dla edukacji ogólnej instytucje / P.A. Orżekowski, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§29)
5. Chemia: nieorganiczna. chemia: podręcznik. dla 8 klasy ogólne wykształcenie ustanowienie /GE Rudzitis, F.G. Feldmana. - M.: Edukacja, OJSC „Podręczniki moskiewskie”, 2009. (s. 45-47)
6. Encyklopedia dla dzieci. Tom 17. Chemia / Rozdział. wyd.V.A. Wołodin, wed. naukowy wyd. I.Leenson. - M.: Avanta+, 2003.
Dodatkowe zasoby internetowe
2. Pojedyncza kolekcja cyfrowa zasoby edukacyjne ().
1) s. 1 73-75 nr 2, 3, 5 z zeszyt ćwiczeń z chemii: klasa 8: do podręcznika P.A. Orżekowski i inni „Chemia. 8. klasa” / O.V. Ushakova, PI Bespałow, PA Orżekowski; pod. wyd. prof. rocznie Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
2) s. 135 nr 3,4 z podręcznika P.A. Orżekowski, L.M. Meshcheryakova, M.M. Shalashova „Chemia: 8 klasa”, 2013
Cokolwiek studiujesz, ty
studiujesz dla siebie.
Petroniusz
Cele Lekcji:
- zapoznanie uczniów z podstawowymi sposobami rozwiązywania problemów za pomocą równań chemicznych:
- znaleźć ilość, masę i objętość produktów reakcji z ilości, masy lub objętości substancji wyjściowych,
- dalsze rozwijanie umiejętności pracy z tekstem problemu, umiejętności rozsądnego wyboru sposobu rozwiązania problemu edukacyjnego, umiejętności pisania równań reakcje chemiczne.
- rozwinąć umiejętność analizowania, porównywania, podkreślania najważniejszej rzeczy, komponowania plan działania, wyciągać wnioski.
- kultywować tolerancję wobec innych, samodzielność w podejmowaniu decyzji i umiejętność obiektywnej oceny wyników swojej pracy.
Formy pracy: czołowa, indywidualna, w parach, grupowa.
Rodzaj lekcji: połączona z wykorzystaniem technologii ICT
I Moment organizacyjny.
Cześć chłopaki. Dzisiaj nauczymy się rozwiązywać problemy za pomocą równań reakcji chemicznych. Slajd 1 (zobacz prezentację).
Cele lekcji Slajd 2.
II.Aktualizacja wiedzy, umiejętności i zdolności.
Chemia jest nauką bardzo interesującą i jednocześnie złożoną. Aby poznać i zrozumieć chemię, trzeba nie tylko przyswoić sobie materiał, ale także umieć zastosować zdobytą wiedzę. Nauczyłeś się, jakie znaki wskazują na zajście reakcji chemicznych, nauczyłeś się pisać równania reakcji chemicznych. Mam nadzieję, że dobrze rozumiesz te tematy i będziesz mógł bez trudności odpowiedzieć na moje pytania.
Które zjawisko nie jest oznaką przemian chemicznych:
a) pojawienie się osadu; c) zmiana głośności;
b) uwolnienie gazu; d) pojawienie się zapachu. Slajd 3
Proszę podać cyfrowo:
a) równania reakcji złożonych
b) równania reakcji podstawienia
c) równania reakcji rozkładu Slajd 4
Aby nauczyć się rozwiązywać problemy należy stworzyć algorytm działań, tj. określić kolejność działań.
Algorytm obliczeń z wykorzystaniem równań chemicznych (na biurku każdego ucznia)
5. Zapisz odpowiedź.
Zacznijmy rozwiązywać problemy za pomocą algorytmu
Obliczanie masy substancji ze znanej masy innej substancji biorącej udział w reakcji
Oblicz masę tlenu uwolnionego w wyniku rozkładu
porcje wody o masie 9 g.
Znajdźmy masę molową wody i tlenu:
M(H2O) = 18 g/mol
M(02) = 32 g/mol Slajd 6
Zapiszmy równanie reakcji chemicznej:
2H 2 O = 2H 2 + O 2
Nad wzorem w równaniu reakcji piszemy to, co znaleźliśmy
wartość ilości substancji i pod wzorami substancji -
Wyświetlane współczynniki stechiometryczne
równanie chemiczne
0,5 mola x mol
2H 2 O = 2H 2 + O 2
2mol 1mol
Obliczmy ilość substancji, której masę chcemy znaleźć.
Aby to zrobić, tworzymy proporcję
0,5mol = hopmol
2mol 1mol
gdzie x = 0,25 mola Slajd 7
Dlatego n(O 2) = 0,25 mol
Znajdź masę substancji, którą należy obliczyć
m(O 2) = n(O 2)*M(O 2)
m(O2) = 0,25 mol 32 g/mol = 8 g
Zapiszmy odpowiedź
Odpowiedź: m(O 2) = 8 g Slajd 8
Obliczanie objętości substancji ze znanej masy innej substancji biorącej udział w reakcji
Oblicz objętość tlenu (nr) uwolnionego w wyniku rozkładu porcji wody o masie 9 g.

V(0 2)=?l(n.s.)
M(H2O) = 18 g/mol
Vm=22,4l/mol Slajd 9
Zapiszmy równanie reakcji. Uporządkujmy współczynniki
2H 2 O = 2H 2 + O 2
Nad wzorem w równaniu reakcji zapisujemy znalezioną wartość ilości substancji, a pod wzorami substancji - stosunki stechiometryczne wyświetlane w równaniu chemicznym
0,5 mola - x mol
2H 2 O = 2H 2 + O 2 Slajd 10
2mole - 1mol
Obliczmy ilość substancji, której masę chcemy znaleźć. Aby to zrobić, utwórzmy proporcję
![]()
gdzie x = 0,25 mola
Znajdźmy objętość substancji, którą należy obliczyć
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (liczba)
Odpowiedź: 5,6 l Slajd 11
III Konsolidacja badanego materiału.
Zadania do samodzielnego rozwiązania:
1. Po redukcji tlenków Fe 2 O 3 i SnO 2 węglem otrzymano 20 g Fe i Sn. Ile gramów każdego tlenku pobrano?
2. W takim przypadku powstaje więcej wody:
a) podczas redukcji 10 g tlenku miedzi (I) (Cu 2 O) wodorem lub
b) podczas redukcji 10 g tlenku miedzi(II) (CuO) wodorem? Slajd 12
Sprawdźmy rozwiązanie problemu 1

M(Fe2O3)=160 g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Odpowiedź: 28,6 g
Slajd 13
Sprawdźmy rozwiązanie problemu 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mola,
n(H2O)=0,07 mol
m(H2O) = 0,07 mol*18 g/mol = 1,26 g
Slajd 14
CuO + H2 = Cu + H2O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0,125 mol
Chmiel 0,125 mola
CuO + H2 = Cu + H2O
1mol 1mol
![]()
x mol = 0,125 mol, n(H2O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H2O) = 0,125mol*18g/mol=2,25g
Odpowiedź: 2,25 g Slajd 15
Zadanie domowe: przestudiuj materiał podręcznikowy s. 45-47, rozwiąż problem
Jaka jest masa tlenku wapnia i jaka jest objętość dwutlenku węgla (n.s.)
można otrzymać rozkładając węglan wapnia o masie 250 g?
CaCO3 = CaO + CO Slajd 16.
Literatura
1. Gabrielyan O.S. Program kursu chemii dla klas 8-11 instytucje edukacyjne. M. Drop 2006
2. Gabrielyan O.S. Chemia. 8 klasa. Podręcznik dla placówek oświaty ogólnokształcącej. Drop. M. 2005
3. Gorbuntsova S.V. Testy z głównych odcinków kursu szkolnego. Klasy 8 - 9. VAKO, Moskwa, 2006.
4. Gorkovenko M.Yu Rozwój lekcji z chemii. Do podręczników O.S. Gabrielyana, L.S. Guzeya, V.V. Sorokina, R.P. Surovtsevy i G.E. Rudzitisa, F.G. Feldmana. Klasa 8. VAKO, Moskwa, 2004.
5. Gabrielyan O.S. Chemia. Klasa 8: Testy i testy. – M.: Drop, 2003.
6. Radetsky A.M., Gorshkova V.P. Materiały dydaktyczne z chemii dla klas 8-9: Podręcznik dla nauczycieli. – M.: Edukacja, 2000
Aplikacja.
Obliczenia z wykorzystaniem równań chemicznych
Algorytm działań.
Aby rozwiązać zadanie obliczeniowe w chemii, możesz skorzystać z następującego algorytmu - wykonaj pięć kroków:
1. Napisz równanie reakcji chemicznej.
2. Nad wzorami substancji wpisz znane i nieznane wielkości wraz z odpowiednimi jednostkami miary (tylko dla substancji czystych, bez zanieczyszczeń). Jeśli zgodnie z warunkami problemu substancje zawierające zanieczyszczenia wchodzą w reakcję, najpierw należy określić zawartość czystej substancji.
3. Pod wzorami substancji o znanych i niewiadomych zapisz odpowiednie wartości tych wielkości znalezione w równaniu reakcji.
4. Ułóż i rozwiąż proporcję.
5. Zapisz odpowiedź.
Zależność między niektórymi wielkościami fizycznymi i chemicznymi oraz ich jednostkami
Masa (m): g; kg; mg
Ilość substancji (n): mol; kmol; mmol
Masa cząsteczkowa (M): g/mol; kg/kmol; mg/mmol
Objętość (V): l; m3/kmol; ml
Objętość molowa (Vm): l/mol; m3/kmol; ml/mmol
Liczba cząstek (N): 6 1023 (liczba Avagadro – N A); 6 1026 ; 6 1020
Ćwiczenia. Ile litrów tlenu (n.o.) przereaguje podczas spalania 4,8 g magnezu?
Prawo okresowości (PL) i układ okresowy (PS)
elementy D. I. Mendelejewa
Odkrycie PZ i konstrukcja PS były szczytem rozwoju chemii w XIX wieku (1869). DI. Mendelejew ułożył wszystkie znane wówczas pierwiastki (63) w rosnącej kolejności ich mas atomowych i jednocześnie odkrył związek między właściwościami pierwiastki chemiczne z ich masami atomowymi, co polegało na tym, że w pewnych odstępach czasu właściwości pierwiastków powtarzały się. Sformułowany przez D. I. Mendelejewa prawo okresowe Więc: Właściwości prostych substancji, a także formy i właściwości związków pierwiastków są okresowo zależne od wielkości mas atomowych pierwiastków.
Mimo ogromnej wagi takiego wniosku, PZ i PS stanowiły jedynie genialne empiryczne (eksperymentalne) uogólnienie faktów, a ich fizyczne znaczenie przez długi czas pozostawało niejasne. Powodem tego jest całkowity brak zrozumienia w XIX wieku złożoności budowy atomu.
Najczęściej używane są trzy opcje PS:
1. Krótki okres;
2. Półdługie (wszystkie elementy 4. i 5. okresu są rozciągnięte w jednej linii 18 elementów;
3. Długookresowy (wszystkie elementy s, p, d i f są narysowane w jednej linii.
Krótka forma PS składa się z 7 okresów i 8 grup.
Okres to seria pozioma rozpoczynająca się od metalu alkalicznego(z wyjątkiem pierwszego okresu) i kończy się elementem obojętnym(z wyjątkiem siódmego okresu).
Pierwszy, drugi i trzeci okres składają się z jednego rzędu i nazywane są małymi. Czwarty, piąty i szósty okres składają się z dwóch rzędów i nazywane są dużymi. Razem w układ okresowy 10 rzędów. Górny rząd jest parzysty, dolny rząd jest nieparzysty. Nawet rzędy zawierają tylko metale, a właściwości pierwiastków niewiele się zmieniają od lewej do prawej. Parzysta seria dużego okresu kończy się trzema elementami o podobnych właściwościach: triadami. Nieparzyste rzędy zawierają metale i niemetale, w nich od lewej do prawej następuje stopniowe przejście właściwości metaliczne na niemetalowe.
W szóstym okresie polantanowym La (nr 57) występuje 14 pierwiastków o podobnych właściwościach (nr 58 - 71): lantanowce. Wszystkie są metalami reaktywnymi, reagują z wodą i mają silną analogię poziomą.
W siódmym okresie po aktynie Ac (nr 89) podobnie zlokalizowanych jest 14 pierwiastków (nr 90 - 103) podobnych do aktynu: aktynowce. Jądra ich atomów są wyjątkowo niestabilne, to znaczy są radioaktywne.
Każda grupa składa się z dwóch podgrup: głównej i wtórnej.
Podgrupy zawierające elementy małych i dużych okresów nazywane są głównymi (A). Podgrupy zawierające elementy tylko dużych okresów nazywane są wtórnymi (B). Podgrupy łączą elementy, które są do siebie najbardziej podobne.
Elementy jednej grupy charakteryzują się następującymi wzorami:
1. Wszystkie pierwiastki, z wyjątkiem gazów szlachetnych, tworzą związki tlenu.
2. Wyższa wartościowość i najwyższa stopień pozytywny utlenianie zwykle odpowiada numerowi grupy. Wyjątki: 1) w grupie 8 jedynie ruten Ru i Os mają wartościowość VIII; Cu +1, Cu +2; O–2; F-1.
3. Pierwiastki głównej podgrupy z grup IV do VIII tworzą z wodorem lotne związki. Ich wartościowość w tych związkach jest równa różnicy między liczbą 8 a numerem grupy. Na przykład N jest w środku grupa V a jego wartościowość wynosi 8 – 5 = 3 w związku NH3.
Struktura atomowa
W 19-stym wieku wierzył, że atom jest niepodzielną cząstką, która nie zmienia się podczas reakcji chemicznych. Na przełomie XIX i XX w. Odkrył promieniowanie rentgenowskie (niemiecki naukowiec K. Roentgen, 1895), radioaktywność (francuski naukowiec A. Becquerel, 1896) i elektron (angielski naukowiec J. Thomson, 1897). Masa m(e)=9,109×10 –28 g i ładunek ujemny q(e)=1,602×10 –19 C. Wartość ładunku elektronu przyjmuje się jako jednostkę elementarnego ładunku elektrycznego.
W 1903 roku J. Thomson zaproponował model budowy atomu, zgodnie z którym ładunek dodatni rozkłada się równomiernie w całej objętości atomu i jest neutralizowany przez rozproszone w nim elektrony. Rozwijając te idee, E. Rutherford w 1911 r. zaproponował planetarny model budowy atomu. Według tej teorii w centrum atomu znajduje się dodatnio naładowane jądro, wokół którego poruszają się elektrony. Zbiór elektronów w atomie nazywa się jego skorupa elektroniczna. W 1913 roku angielski naukowiec D. Moseley odkrył, że wartość dodatniego ładunku jądra atomu jest równa liczbie atomowej pierwiastka w układzie okresowym pierwiastków D. I. Mendelejewa. Dlatego atom jest elektrycznie obojętny liczba elektronów w powłoka elektronowa atom jest równy ładunkowi jądra Z lub liczbie atomowej pierwiastka w układzie okresowym.
W 1932 roku radzieccy naukowcy D. D. Ivanenko i E. N. Gapon oraz niezależnie od nich niemiecki naukowiec W. Heisenberg stworzyli teoria budowy jądra protonowo-neutronowego. Proton p jest cząstką o masie równej 1 a. jeść.
(1,66 × 10 –24 g) i ładunek + 1. Neutron n jest cząstką elektrycznie obojętną o masie zbliżonej do masy protonu. Protony i neutrony nazywane są nukleonami.
Ładunek jądra atomu zależy od liczby protonów. Stąd, liczba protonów w jądrze atomu jest również równa liczbie atomowej pierwiastka w układzie okresowym. Całkowita liczba protonów i neutronów nazywana jest liczbą masową (A). Jest równa wartości względnej masy atomowej zaokrąglonej do najbliższej liczby całkowitej.
Ćwiczenia. Jaki jest ładunek jądrowy i ile elektronów, protonów i neutronów znajduje się w atomie cynku?
Z=+30, p=30, e=30, n = 65–30 = 35.
Izotopy
Odmiany atomów tego samego pierwiastka, które mają te same ładunki jądrowe, ale różne liczby masowe (tę samą liczbę protonów i różną liczbę neutronów), nazywane są izotopami. Właściwości chemiczne Wszystkie izotopy jednego pierwiastka są takie same.
Każdy izotop charakteryzuje się dwiema wielkościami: liczbą masową (wskazaną w lewym górnym rogu symbol chemiczny) I numer seryjny(umieszczony poniżej, po lewej stronie symbolu chemicznego) i jest oznaczony symbolem odpowiedniego pierwiastka. Na przykład pierwiastek wodór ma trzy izotopy. N – prot (1 p); D(H) - deuter (1p, 1n); T(H) - tryt (1 p, 2 n).
Podsumowanie lekcji „Obliczenia z wykorzystaniem równań chemicznych”
1. Sprawdzanie pracy domowej
Jako zadanie domowe poproszono Cię o umieszczenie współczynników w równaniach reakcji.Możesz zobaczyć pracę wykonaną podczas przerwy. Na pewno będą błędy.Czy wszystko się udało, czy ktoś ma jakieś pytania?Niech opowiedzą o swoich domowych doświadczeniach.
2. Ogłoszenie tematu i aktualizacja wiedzy
Tematem dzisiejszej lekcji są obliczenia z wykorzystaniem równań chemicznych. Najpierw pamiętajmy o wszystkim, co może nam się dzisiaj przydać. W zeszłym tygodniu napotkaliśmy już równania chemiczne. Praca laboratoryjna, w pracy domowej, jeszcze wcześniej - na temat związków binarnych. Przypomnijmy sobie definicję równania reakcji chemicznej.
(jest to konwencjonalny zapis reakcji chemicznej przy użyciu wzory chemiczne i współczynniki.)
Niesamowity.
Przy wytwarzaniu jakichkolwiek związków trzeba wiedzieć, ile materiału wyjściowego należy pobrać, aby uzyskać wymaganą masę produktu reakcji. Aby to zrobić, utwórz równanie dla trwającej reakcji chemicznej i podczas obliczeń masy uwzględniają masy molowe substancji i przy obliczaniu objętości gazów wziąć pod uwagę wartośćobjętość molowa gazy
Kto pamięta wartość objętości molowej gazów w normalnych warunkach? (22,4 l/mol)
I co to jest normalne warunki? (ciśnienie 101,3 kPa i temperatura 0 o C)
Oznacza to, że w tych warunkach 1 mol DOWOLNEGO gazu zajmuje objętość 22,4 litra.
Właściwie, aby rozwiązać problemy, musimy pamiętać o kilku wielkościach:
Masa molowa – M (g/mol)
Ilość substancji – n (mol)
Objętość – V (l)
Tak jest lepiej: pamiętasz, że masa molowa jest liczbowo równa względnej masie atomowej lub względnej masie cząsteczkowej substancji. Aby to zrobić, musisz skorzystać z układu okresowego, w którym na dole każdej „komórki” znajduje się krewny masa atomowa. Nie zapominając o zasadach zaokrąglania, w obliczeniach uwzględniamy całą wartość tej masy.
Chemia jest nauką bardzo przejrzystą, logiczną i spójną, dlatego do rozwiązywania problemów wygodnie będzie skorzystać z ALGORYTMU podanego w podręczniku. Jest to uniwersalna sekwencja działań, która służy do rozwiązania dowolnego problemu tego typu.
Proszę otworzyć podręcznik i zapoznać się wszyscy z algorytmem.
(tutaj wszyscy razem otwieramy nasze podręczniki, jedna osoba, być może ja, czyta algorytm, reszta podąża za nim, aby zrozumieć, co mają teraz zrobić)
Brzmi obszernie, ale mam nadzieję, że nie jest zbyt zagmatwane. Spróbujmy to rozgryźć na przykładzie.
Zadanie 1. Aby wytworzyć wodór, aluminium rozpuszcza się w kwasie siarkowym: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Pierwszy punkt naszego algorytmu). Do reakcji pobraliśmy 10,8 g aluminium. Oblicz masę zużytego kwasu siarkowego.
Dany: m(Al) = 10,8 g | Rozwiązanie: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27 g/mol M=98 g/mol Tutaj możemy wspomnieć, że tak naprawdę do reakcji nie wchodzą 2 atomy glinu i 3 cząsteczki kwasu, ale część atomów glinu i część cząsteczek kwasu. Ta część w chemii nazywa się krótkim słowem „mol”. n=2 mole n=3 mole m = M ∙ n m=54 g m=294 g Obliczanie według proporcji: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 g | |||||
54 gr | 294 gr | ||||
10,8 g ∙ 294 g | |||||
54 gr | |||||
X = 58,8 g Odpowiedź: m (H 2 SO 4 ) = 58,8 g |
|||||
To całe rozwiązanie problemu. Mieć pytania? Porozmawiajmy jeszcze raz o rozwiązaniu:
Ułożyłem równanie
Nad substancjami podpisaliśmy to, co WIEMY i co CHCEMY ZNALEŹĆ
Pod wzorami zapisaliśmy masę molową, ilość substancji istechiometryczny masa substancji ( lepiej podać „masę według układu okresowego”)
Ułożyłem proporcję
Rozwiązałem proporcję
Nagrałem odpowiedź
Rozwiążmy podobny problem, ale z substancjami gazowymi (tutaj nie będziemy posługiwać się masą molową substancji, ale jaką?...objętością molową)
Zadanie 2. 25 gramów cynk rozpuszcza się w kwasie solnym, podczas reakcji chemicznej wydziela się gaz – wodór. Oblicz objętość uwolnionego wodoru.
Dany: m(Zn) = 10,8 g | Rozwiązanie: m=25 g V - ? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Obliczanie według proporcji: |
||||
m(HCl) - ? |
|||||
25 gr | |||||
65 gr | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 gr | |||||
X = 8,61 l Odpowiedź: V(H 2 ) = 8,61 l |
|||||
Sprawdźmy, jak opanowałeś materiał. Używając tego samego algorytmu, rozwiąż problem:
NIE JEST FAKTEM, ŻE ODniesiesz sukces:
Kiedy reagujesz z stosując tlenki węgla Fe2O3 (wariant pierwszy) i SnO2 (wariant drugi) otrzymano po 20 g Fe i Sn. Ile gramów każdego tlenku pobrano?
Należy pamiętać, że teraz obliczamy masę substancji wyjściowych, a nie produktów reakcji)
(niech każdy rozwiąże w zeszycie i wybiórczo poprosi o pokazanie rozwiązania, napiszemy całe równanie na tablicy i każdy będzie próbował rozwiązać je samodzielnie)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Zadanie domowe: przestudiuj materiał podręcznikowy s. 146-150, rozwiąż problem
Jaka jest masa tlenku wapnia i jaka jest objętość dwutlenku węgla (n.s.)
można otrzymać rozkładając węglan wapnia o masie 250 g?NALEŻY DAWAĆ UCZNIOMGOTOWE RÓWNANIEABY WYKOŃCZYĆ TO ZADANIE
Szczegółowy zarys lekcji „Obliczenia z wykorzystaniem równań chemicznych”.
Podręcznik: OS Gabrielian.
Klasa: 8
Temat lekcji: Obliczenia z wykorzystaniem równań chemicznych.
Typ lekcji:łączny.
Cele edukacyjne: wprowadzić obliczenia z wykorzystaniem równań chemicznych; pogłębianie wiedzy studentów w zakresie obliczeń z wykorzystaniem równań chemicznych; rozpocząć rozwijanie umiejętności układania równań chemicznych i obliczania równań.
Zadania edukacyjne: kontynuować kształtowanie światopoglądu nauk przyrodniczych, idei jednostki i całości.
Zadania rozwojowe: nadal rozwijaj umiejętność obserwacji, analizowania, wyjaśniania i wyciągania wniosków.
Metody nauczania: werbalne (wyjaśnienia i opowieść nauczyciela), werbalne – wizualne (wyjaśnienia za pomocą notatek na tablicy).
Sprzęt: tablica, stół D.I. Mendelejewa.
Podczas zajęć:
1. Chwila organizacyjna (2-5 min.)
Witam państwa, usiądźcie. Dzisiaj na lekcji ty i ja będziemy musieli nauczyć się przeprowadzać obliczenia za pomocą równań chemicznych.
2. Sprawdzian wiedzy i umiejętności (10 – 15 min.)
Na poprzednich zajęciach przerabialiśmy równania reakcji chemicznych, przypomnijmy sobie, co to jest równanie chemiczne? (Równanie chemiczne to konwencjonalne przedstawienie reakcji chemicznej za pomocą wzorów chemicznych i symboli matematycznych).
Na podstawie jakiego prawa zapisywane są reakcje chemiczne? (Prawo zachowania masy substancji).
Jak to brzmi? (Masa substancji, które weszły w reakcję chemiczną, jest równa masie substancji, które w niej powstają).
3. Wyjaśnienie nowego materiału (20 – 30 min.)
Za pomocą równania chemicznego można określić, które substancje przereagowały i które powstały, a także można zastosować równanie chemiczne do obliczenia masy, objętości i ilości reagujących substancji.
Do obliczeń bardzo ważne jest, aby wybrać odpowiadające sobie jednostki masy, objętości i ilości substancji. Otwórzmy podręczniki na stronie 146 i znajdźmy tabelę nr 7. Korzystając z tej tabeli, rozważmy stosunek niektórych jednostek wielkości fizycznych i chemicznych.
Aby rozwiązać problemy obliczeniowe w chemii, możesz użyć algorytmu. Algorytm rozwiązywania problemów podano w podręczniku na stronie 147.
Korzystając z algorytmu rozwiązywania problemów, rozwiążmy następujący problem:
Zadanie: Oblicz objętość wodoru (nr), która będzie potrzebna do reakcji z 230 kg tlenku żelaza (III). Oblicz ilość wody powstałej w tym przypadku.
Biorąc pod uwagę: Rozwiązanie:
m(Fe 2 O 3) = 230 kg 1. Napisz równanie reakcji chemicznej:
V(H2) -?
n(H2O) -? 2. Zapisz znane i nieznane wartości liczbowe nad wzorami substancji w równaniu.
Ponieważ masę podaje się w kilogramach, objętość znajdujemy w metrach sześciennych, a ilość substancji w kilomolach. I wtedy:
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
gdzie x to objętość wodoru V(H2), y to ilość substancji wodnej n(H2O).
3. a) Znajdź masę 1 kmol Fe 2 O 3 określoną równaniem chemicznym i wynikową wartość zapisz pod jego wzorem:
Pan(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
M(Fe2O3) = 160 kg/kmol.
b) Znajdź objętość 3 kmol wodoru V = Vm*n określoną równaniem, znalezioną wartość zapisz pod wzorem na wodór: V(3H 2) = 22,4 m 3 /kmol * 3 kmol = 67,2 m 3.
c) Pod wzorem wody podajemy jej ilość, dane równaniem, - 3 kmol.
Równanie staje się
230kg x m 3 y kmol
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160kg 67,2 m 3 3 kmol
4. Skomponujmy i rozwiążmy proporcje:
a) 230 = x, x = 230*67,2 = 201,6 (m3) – objętość wodoru V(H2)
b) 230 = y, y = 230*3 = 9 (kmol) – ilość substancji wodnej n(H 2 O).
4.Podstawowe utrwalenie wiedzy (10 – 12 min.)
Rozwiąż problemy (jeśli to możliwe, na kilka sposobów):
Zadanie 1. 0,1 mol cynku reaguje z tlenem. Ile tlenu jest potrzebne? Ile powstaje tlenku cynku?
Zadanie 2. Cynk reaguje z tlenem w ilości 0,1 mola. Określ masę reagującego tlenu i masę powstałego tlenku cynku.
Zadanie 3. Aluminium o masie 6,3 g reaguje z tlenem. Określ masy tlenu i powstałego tlenku żelaza, jeśli aluminium zawiera 20% zanieczyszczeń.
Zadanie 4. Jaka objętość wodoru (n.o.) zostanie uwolniona podczas oddziaływania 2,7 g 25% kwasu solnego z ilością glinu potrzebną do reakcji? Jaka jest ta ilość substancji?
Zadanie 5. Jaka objętość dwutlenku węgla zostanie wydzielona podczas spalania 60 kg węgla?
Zadanie 6. Ile moli tlenku wapnia powstaje podczas spalania 8 g wapnia zawierającego 30% zanieczyszczeń w tlenie?
5. Podsumowanie lekcji (1-3 min.)
Dzisiaj na zajęciach po raz kolejny przypomnieliśmy sobie pisanie równań chemicznych i nauczyliśmy się przeprowadzać obliczenia za pomocą równań chemicznych.
6. Praca domowa (1 – 4 min.)
§28, zadanie w zeszytach ćwiczeń.
Jaka masa tlenku żelaza(III) powstanie podczas spalania 0,6 mola żelaza w powietrzu?
Oblicz masę siarczku glinu powstałego po stopieniu 5,4 g proszku aluminium z siarką. Ile gramów siarczku żelaza (II) powstaje, gdy 11,2 g sproszkowanego żelaza stopi się z siarką?
Określ masę magnezu potrzebną do otrzymania 19 g chlorku magnezu (na przykład poprzez spalenie magnezu w chlorze).
Ile litrów chlorowodoru powstaje w reakcji chloru z 5,5 litra wodoru?
Jaka objętość wodoru może przereagować ze 150 litrami tlenu?
Jaka objętość dwutlenku węgla powstanie podczas spalania 8 litrów metanu CH 4?
Jaka objętość dwutlenku węgla powstaje podczas spalania 480 g węgla?
Ile tlenu zostanie uwolnione podczas rozkładu? wstrząs elektryczny 100g wody?
Jaka objętość azotu powstaje podczas eksplozji 1 g jodku azotu:
2NJ 3 = N 2 + 3J 2
Ile gramów tlenku siarki (IV) powstaje podczas spalania siarki 12,8?
Jaka masa tlenku magnezu powstała podczas spalania 6 g wiórów magnezu w tlenie?
Ile gramów wody powstaje podczas spalania 9 g wodoru w tlenie?
Ile gramów aluminium należy pobrać, aby otrzymać 30,6 g tlenku glinu?
Ile gramów litu należy spalić w tlenie, aby otrzymać 15 g tlenku litu?
Ile gramów chlorku sodu powstaje podczas spalania 11,5 g sodu w chlorze?
Ile moli żelaza należy pobrać, aby otrzymać 32,5 g chlorku żelaza(III)?
Ile gramów glinu potrzeba, aby otrzymać 80,1 g chlorku glinu?
Ile moli tlenku wapnia powstaje podczas spalania 8 g wapnia w tlenie?
Ile gramów chlorku glinu powstaje podczas spalania 10,8 g folii aluminiowej w chlorze?