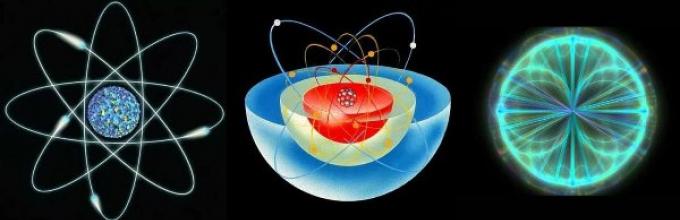
Skład atomu.
Atom składa się z jądro atomowe I powłoka elektronowa .
Jądro atomu składa się z protonów ( p+) i neutrony ( N 0). Większość atomów wodoru ma jądro składające się z jednego protonu.
Liczba protonów N(p+) jest równy ładunkowi jądrowemu ( Z) i numer porządkowy pierwiastka w naturalnym szeregu pierwiastków (oraz w układzie okresowym pierwiastków).
N(P +) = Z
Suma neutronów N(N 0), oznaczone po prostu literą N i liczbę protonów Z zwany Liczba masowa i jest oznaczony literą A.
A = Z + N
Powłoka elektronowa atomu składa się z elektronów poruszających się po jądrze ( mi -).
Liczba elektronów N(mi-) w powłoce elektronowej neutralnego atomu jest równa liczbie protonów Z w jego rdzeniu.
Masa protonu jest w przybliżeniu równa masie neutronu i 1840 razy większa więcej masy elektron, więc masa atomu jest praktycznie równa masie jądra.
Kształt atomu jest kulisty. Promień jądra jest około 100 000 razy mniejszy niż promień atomu.
Pierwiastek chemiczny- rodzaj atomów (zbiór atomów) o tym samym ładunku jądrowym (o tej samej liczbie protonów w jądrze).
Izotop- zbiór atomów tego samego pierwiastka o tej samej liczbie neutronów w jądrze (lub rodzaj atomu o tej samej liczbie protonów i tej samej liczbie neutronów w jądrze).
Różne izotopy różnią się między sobą liczbą neutronów w jądrach atomowych.
Oznaczenie pojedynczego atomu lub izotopu: (symbol pierwiastka E), np.: .
Budowa powłoki elektronowej atomu
Orbital atomowy- stan elektronu w atomie. Symbol orbitalu to . Każdemu orbitalowi odpowiada chmura elektronów.
Orbitale rzeczywistych atomów w stanie podstawowym (niewzbudzonym) są czterech typów: S, P, D I F.
Chmura elektroniczna- część przestrzeni, w której można znaleźć elektron z prawdopodobieństwem 90 (lub większym) procent.
Notatka: czasami nie rozróżnia się pojęć „orbital atomowy” i „chmura elektronów”, nazywając oba „orbitalem atomowym”.
Powłoka elektronowa atomu jest warstwowa. Warstwa elektroniczna utworzone przez chmury elektronów tej samej wielkości. Tworzą się orbitale jednej warstwy poziom elektroniczny („energia”), ich energie są takie same dla atomu wodoru, ale różne dla pozostałych atomów.
Orbitale tego samego typu są pogrupowane w elektroniczny (energia) podpoziomy:
S-podpoziom (składa się z jednego S-orbitale), symbol - .
P-podpoziom (składa się z trzech P
D-podpoziom (składa się z pięciu D-orbitale), symbol - .
F-podpoziom (składa się z siedmiu F-orbitale), symbol - .
Energie orbitali tego samego podpoziomu są takie same.
Przy wyznaczaniu podpoziomów do symbolu podpoziomu dodawany jest numer warstwy (poziomu elektronicznego), np.: 2 S, 3P, 5D oznacza S-podpoziom drugiego poziomu, P-podpoziom trzeciego poziomu, D-podpoziom piątego poziomu.
Całkowita liczba podpoziomów na jednym poziomie jest równa numerowi poziomu N. Całkowita liczba orbitali na jednym poziomie jest równa N 2. W związku z tym całkowita liczba chmur w jednej warstwie jest również równa N 2 .
Oznaczenia: - orbital swobodny (bez elektronów), - orbital z niesparowany elektron, - orbital z parą elektronów (z dwoma elektronami).
O kolejności, w jakiej elektrony wypełniają orbitale atomu, decydują trzy prawa natury (sformułowania podano w uproszczeniu):
1. Zasada najmniejszej energii - elektrony wypełniają orbitale w kolejności rosnącej energii orbitali.
2. Zasada Pauliego - na jednym orbicie nie mogą znajdować się więcej niż dwa elektrony.
3. Reguła Hunda - w podpoziomie elektrony najpierw wypełniają puste orbitale (pojedynczo), a dopiero potem tworzą pary elektronowe.
Całkowita liczba elektronów na poziomie elektronowym (lub warstwie elektronowej) wynosi 2 N 2 .
Rozkład podpoziomów według energii wyraża się w następujący sposób (w kolejności rosnącej energii):
1S, 2S, 2P, 3S, 3P, 4S, 3D, 4P, 5S, 4D, 5P, 6S, 4F, 5D, 6P, 7S, 5F, 6D, 7P ...
Sekwencję tę jasno wyraża diagram energii:
Rozkład elektronów atomu na poziomach, podpoziomach i orbitali (konfiguracja elektronowa atomu) można przedstawić jako wzór elektronowy, diagram energii lub, prościej, jako diagram warstw elektronów („schemat elektronów”).
Przykłady struktura elektroniczna atomy:
elektrony walencyjne- elektrony atomu, które mogą brać udział w tworzeniu wiązania chemiczne. W przypadku dowolnego atomu są to wszystkie elektrony zewnętrzne plus elektrony przedzewnętrzne, których energia jest większa niż elektrony zewnętrzne. Na przykład: atom Ca ma 4 zewnętrzne elektrony S 2, są także wartościowością; atom Fe ma 4 zewnętrzne elektrony S 2, ale on ma 3 D 6, zatem atom żelaza ma 8 elektronów walencyjnych. Elektroniczny wzór wartościowości atomu wapnia wynosi 4 S 2, a atomy żelaza - 4 S 2 3D 6 .
Układ okresowy pierwiastków chemicznych autorstwa D. I. Mendelejewa
(naturalny układ pierwiastków chemicznych)
Prawo okresowe pierwiastki chemiczne (nowoczesna formuła): właściwości pierwiastków chemicznych, a także proste i substancje złożone, przez nie utworzone, okresowo zależą od wartości ładunku z jąder atomowych.
Układ okresowy- graficzne wyrażenie prawa okresowości.
Naturalna seria pierwiastków chemicznych- szereg pierwiastków chemicznych ułożonych według wzrastającej liczby protonów w jądrach ich atomów, czyli, tym samym, według wzrastających ładunków jąder tych atomów. Liczba atomowa pierwiastka tego szeregu jest równa liczbie protonów w jądrze dowolnego atomu tego pierwiastka.
Tablicę pierwiastków chemicznych buduje się poprzez „przecięcie” naturalnego szeregu pierwiastków chemicznych okresy(poziome rzędy tabeli) i zgrupowania (pionowe kolumny tabeli) pierwiastków o podobnej budowie elektronowej atomów.
W zależności od sposobu łączenia elementów w grupy tabela może być długi okres(elementy o tej samej liczbie i typie elektronów walencyjnych są zbierane w grupy) i krótki okres(pierwiastki o tej samej liczbie elektronów walencyjnych gromadzą się w grupach).
Grupy tablic krótkookresowych są podzielone na podgrupy ( główny I strona), pokrywając się z grupami tabeli długoterminowej.
Wszystkie atomy pierwiastków tego samego okresu mają tę samą liczbę warstw elektronowych, równą liczbie okresu.
Liczba pierwiastków w okresach: 2, 8, 8, 18, 18, 32, 32. Większość pierwiastków okresu ósmego otrzymano sztucznie, ostatnie pierwiastki tego okresu nie zostały jeszcze zsyntetyzowane. Wszystkie okresy z wyjątkiem pierwszego rozpoczynają się od formowania elementu metal alkaliczny(Li, Na, K itp.) i kończą się pierwiastkiem tworzącym gaz szlachetny (He, Ne, Ar, Kr itp.).
W tabeli krótkiego okresu występuje osiem grup, z których każda jest podzielona na dwie podgrupy (główną i wtórną), w tabeli długiego okresu znajduje się szesnaście grup, które są ponumerowane cyframi rzymskimi literami A lub B, dla przykład: IA, IIIB, VIA, VIIB. Grupa IA tabeli długookresowej odpowiada głównej podgrupie pierwszej grupy tabeli krótkookresowej; grupa VIIB - podgrupa wtórna grupy siódmej: reszta - podobnie.
Charakterystyka pierwiastków chemicznych naturalnie zmienia się w grupach i okresach.
W okresach (w miarę zwiększania się numeru seryjnego)
- wzrasta ładunek jądrowy
- zwiększa się liczba elektronów zewnętrznych,
- promień atomów maleje,
- wzrasta siła wiązania między elektronami a jądrem (energia jonizacji),
- wzrasta elektroujemność,
- właściwości utleniające są wzmocnione proste substancje(„niemetaliczność”),
- osłabiają się właściwości redukcyjne prostych substancji („metaliczność”),
- osłabia zasadowy charakter wodorotlenków i odpowiadających im tlenków,
- zwiększa się kwasowy charakter wodorotlenków i odpowiednich tlenków.
W grupach (w miarę zwiększania się numeru seryjnego)
- wzrasta ładunek jądrowy
- zwiększa się promień atomów (tylko w grupach A),
- zmniejsza się siła wiązania między elektronami a jądrem (energia jonizacji; tylko w grupach A),
- elektroujemność maleje (tylko w grupach A),
- osłabiają się właściwości utleniające prostych substancji („niemetaliczność”; tylko w grupach A),
- wzmocnione są właściwości redukujące prostych substancji („metaliczność”; tylko w grupach A),
- wzrasta zasadowy charakter wodorotlenków i odpowiadających im tlenków (tylko w grupach A),
- osłabia kwasowy charakter wodorotlenków i odpowiadających im tlenków (tylko w grupach A),
- zmniejsza się stabilność związków wodorowych (wzrasta ich aktywność redukcyjna; tylko w grupach A).
Zadania i testy na temat „Temat 9. „Budowa atomu. Prawo okresowe i układ okresowy pierwiastków chemicznych D. I. Mendelejewa (PSHE) „.”
- Prawo okresowe - Prawo okresowości i budowa atomów klasy 8-9
Musisz znać: prawa wypełniania orbitali elektronami (zasada najmniejszej energii, zasada Pauliego, reguła Hunda), budowę układu okresowego pierwiastków.Musisz umieć: określić skład atomu na podstawie położenia pierwiastka w układzie okresowym i odwrotnie, znaleźć pierwiastek w układzie okresowym, znając jego skład; przedstawić schemat struktury, konfigurację elektronową atomu, jonu i odwrotnie, określić położenie pierwiastka chemicznego w PSCE na podstawie schematu i konfiguracji elektronicznej; scharakteryzować pierwiastek i tworzące się z niego substancje zgodnie z jego pozycją w PSCE; określać zmiany promienia atomów, właściwości pierwiastków chemicznych i substancji, które tworzą w obrębie jednego okresu i jednej głównej podgrupy układu okresowego.
Przykład 1. Określ liczbę orbitali na trzecim poziomie elektronowym. Co to za orbitale?
Aby określić liczbę orbitali, używamy wzoru N orbitale = N 2 gdzie N- numer poziomu. N orbitale = 3 2 = 9. Jeden 3 S-, trzy 3 P- i pięć 3 D-orbitale.Przykład 2. Określ, który atom pierwiastka ma wzór elektroniczny 1 S 2 2S 2 2P 6 3S 2 3P 1 .
Aby określić, jaki to pierwiastek, musisz znaleźć jego liczbę atomową, która jest równa całkowitej liczbie elektronów atomu. W tym przypadku: 2 + 2 + 6 + 2 + 1 = 13. To jest aluminium.Po upewnieniu się, że nauczyłeś się wszystkiego, czego potrzebujesz, przystąp do wykonywania zadań. Życzymy sukcesu.
Rekomendowane lektury:- O. S. Gabrielyan i inni Chemia 11 klasa. M., Drop, 2002;
- G. E. Rudzitis, F. G. Feldman. Chemia, klasa 11. M., Edukacja, 2001.
Jak wiadomo, wszystko co materialne we Wszechświecie składa się z atomów. Atom to najmniejsza jednostka materii, która niesie ze sobą swoje właściwości. Z kolei strukturę atomu tworzy magiczna trójca mikrocząstek: protony, neutrony i elektrony.
Co więcej, każda z mikrocząstek jest uniwersalna. Oznacza to, że na świecie nie można znaleźć dwóch różnych protonów, neutronów i elektronów. Wszystkie są do siebie absolutnie podobne. A właściwości atomu będą zależeć tylko od składu ilościowego tych mikrocząstek struktura ogólna atom.
Na przykład struktura atomu wodoru składa się z jednego protonu i jednego elektronu. Następny najbardziej złożony atom, hel, składa się z dwóch protonów, dwóch neutronów i dwóch elektronów. Atom litu - zbudowany z trzech protonów, czterech neutronów i trzech elektronów itp.
Budowa atomu (od lewej do prawej): wodór, hel, litAtomy łączą się, tworząc cząsteczki, a cząsteczki łączą się, tworząc substancje, minerały i organizmy. Cząsteczka DNA, będąca podstawą wszystkich żywych istot, jest strukturą złożoną z tych samych trzech magicznych cegieł wszechświata, co kamień leżący na drodze. Chociaż ta struktura jest znacznie bardziej złożona.
Nawet więcej niesamowite fakty ujawniają się, gdy staramy się bliżej przyjrzeć proporcjom i budowie układu atomowego. Wiadomo, że atom składa się z jądra i elektronów poruszających się wokół niego po trajektorii opisującej kulę. Oznacza to, że nie można go nawet nazwać ruchem w zwykłym tego słowa znaczeniu. Przeciwnie, elektron znajduje się wszędzie i bezpośrednio w tej sferze, tworząc chmurę elektronów wokół jądra i tworząc pole elektromagnetyczne.
 Schematyczne przedstawienie budowy atomu
Schematyczne przedstawienie budowy atomu Jądro atomu składa się z protonów i neutronów i prawie cała masa układu jest w nim skoncentrowana. Ale jednocześnie samo jądro jest tak małe, że jeśli jego promień zostanie zwiększony do skali 1 cm, wówczas promień całej struktury atomowej osiągnie setki metrów. Zatem wszystko, co postrzegamy jako gęstą materię, składa się z ponad 99% wiązań energetycznych pomiędzy samymi cząstkami fizycznymi i mniej niż 1% samych form fizycznych.
Ale czym są te formy fizyczne? Z czego są wykonane i z jakiego materiału są wykonane? Aby odpowiedzieć na te pytania, przyjrzyjmy się bliżej strukturze protonów, neutronów i elektronów. Schodzimy więc jeszcze jeden krok w głąb mikroświata - na poziom cząstek subatomowych.
Z czego składa się elektron?
Najmniejszą cząstką atomu jest elektron. Elektron ma masę, ale nie ma objętości. W koncepcji naukowej elektron nie składa się z niczego, ale jest punktem bez struktury.
Elektronu nie można zobaczyć pod mikroskopem. Widoczne jest to tylko w formie chmura elektroniczna, który wygląda jak rozmyta kula wokół jądra atomowego. Jednocześnie nie można dokładnie określić, gdzie w danym momencie znajduje się elektron. Przyrządy są w stanie uchwycić nie samą cząstkę, ale jedynie jej ślad energetyczny. Istota elektronu nie jest osadzona w pojęciu materii. To raczej jakaś pusta forma, która istnieje tylko w ruchu i dzięki ruchowi.

Nie odkryto jeszcze żadnej struktury elektronu. Jest to ta sama cząstka punktowa, co kwant energii. Tak naprawdę elektron jest energią, jest jednak jej bardziej stabilną formą niż ta, którą reprezentują fotony światła.
W tej chwili elektron uważany jest za niepodzielny. Jest to zrozumiałe, ponieważ nie da się podzielić czegoś, co nie ma objętości. Jednak teoria ma już rozwinięcia, zgodnie z którymi elektron zawiera trójcę takich kwazicząstek jak:
- Orbiton – zawiera informację o pozycji orbitalnej elektronu;
- Spinon – odpowiedzialny za rotację lub moment obrotowy;
- Holon – niesie informację o ładunku elektronu.
Jak jednak widzimy, kwazicząstki nie mają absolutnie nic wspólnego z materią i niosą jedynie informację.
 Zdjęcia atomów różne substancje V mikroskop elektronowy
Zdjęcia atomów różne substancje V mikroskop elektronowy
Co ciekawe, elektron może absorbować kwanty energii, takie jak światło lub ciepło. W tym przypadku atom przechodzi na nowy poziom energii, a granice chmury elektronów rozszerzają się. Zdarza się również, że energia pochłonięta przez elektron jest tak duża, że może on wyskoczyć z układu atomowego i kontynuować swój ruch jako niezależna cząstka. Jednocześnie zachowuje się jak foton światła, czyli wydaje się, że przestaje być cząstką, a zaczyna wykazywać właściwości fali. Zostało to udowodnione w eksperymencie.
Eksperyment Junga
Podczas eksperymentu strumień elektronów kierowano na ekran z wyciętymi dwiema szczelinami. Przechodząc przez te szczeliny elektrony zderzyły się z powierzchnią kolejnego ekranu projekcyjnego, zostawiając na niej swój ślad. W wyniku tego „bombardowania” elektronami na ekranie projekcyjnym pojawił się wzór interferencyjny, podobny do tego, który pojawiałby się, gdyby przez dwie szczeliny przechodziły fale, a nie cząstki.
Ten wzór występuje, ponieważ fala przechodząca między dwiema szczelinami dzieli się na dwie fale. W wyniku dalszego ruchu fale nakładają się na siebie, a w niektórych obszarach ulegają wzajemnemu zniesieniu. Rezultatem jest wiele linii na ekranie projekcyjnym, a nie tylko jedna, jak miałoby to miejsce, gdyby elektron zachowywał się jak cząstka.

Budowa jądra atomu: protony i neutrony
Protony i neutrony tworzą jądro atomu. I pomimo tego, że rdzeń zajmuje mniej niż 1% całkowitej objętości, to w tej strukturze skoncentrowana jest prawie cała masa układu. Ale fizycy są podzieleni co do struktury protonów i neutronów ten moment Istnieją dwie teorie na raz.
- Teoria nr 1 - Standard
Model Standardowy mówi, że protony i neutrony składają się z trzech kwarków połączonych chmurą gluonów. Kwarki są cząstkami punktowymi, podobnie jak kwanty i elektrony. A gluony to cząstki wirtualne, które zapewniają interakcję kwarków. Jednak w przyrodzie nigdy nie znaleziono ani kwarków, ani gluonów, dlatego model ten podlega ostrej krytyce.
- Teoria nr 2 – Alternatywa
Ale zgodnie z alternatywną, zunifikowaną teorią pola opracowaną przez Einsteina, proton, podobnie jak neutron, jak każda inna cząstka świat fizyczny, to pole elektromagnetyczne wirujące z prędkością światła.
 Pola elektromagnetyczne człowiek i planeta
Pola elektromagnetyczne człowiek i planeta Jakie są zasady budowy atomu?
Wszystko na świecie – cienkie i gęste, ciekłe, stałe i gazowe – to po prostu stany energetyczne niezliczonych pól, które przenikają przestrzeń Wszechświata. Im wyższy poziom energii w polu, tym jest ono cieńsze i mniej zauważalne. Im niższy poziom energii, tym jest ona bardziej stabilna i namacalna. Budowa atomu, podobnie jak budowa każdej innej jednostki Wszechświata, polega na oddziaływaniu takich pól - różniących się gęstością energii. Okazuje się, że materia jest tylko iluzją umysłu.
Elektrony
Pojęcie atomu powstało w starożytnym świecie i oznaczało cząstki materii. W tłumaczeniu z języka greckiego atom oznacza „niepodzielny”.

Irlandzki fizyk Stoney na podstawie eksperymentów doszedł do wniosku, że prąd przenoszą najmniejsze cząsteczki występujące w atomach wszystkich pierwiastków chemicznych. W 1891 roku Stoney zaproponował nazwanie tych cząstek elektronami, co po grecku oznacza „bursztyn”. Kilka lat po tym, jak elektron otrzymał swoją nazwę, angielski fizyk Joseph Thomson i francuski fizyk Jean Perrin udowodnili, że elektrony mają ładunek ujemny. Jest to najmniejszy ładunek ujemny, który w chemii przyjmuje się jako jeden (-1). Thomsonowi udało się nawet wyznaczyć prędkość elektronu (prędkość elektronu na orbicie jest odwrotnie proporcjonalna do numeru orbity n. Promienie orbit rosną proporcjonalnie do kwadratu liczby orbit. Na pierwszym orbicie orbity atom wodoru (n=1; Z=1) prędkość wynosi ≈ 2,2·106 m/s, czyli około sto razy mniej niż prędkość światła c = 3,108 m/s) i masa elektronu (jest prawie 2000 razy mniejsza od masy atomu wodoru).

Stan elektronów w atomie
Przez stan elektronu w atomie rozumie się zbiór informacji o energii konkretnego elektronu i przestrzeni, w której się on znajduje. Elektron w atomie nie ma trajektorii ruchu, czyli możemy tylko o niej mówić prawdopodobieństwo znalezienia go w przestrzeni wokół jądra.
 Może znajdować się w dowolnej części tej przestrzeni otaczającej jądro, a całość jego różnych pozycji jest uważana za chmurę elektronów o określonej gęstości ładunku ujemnego. Obrazowo można to sobie wyobrazić w ten sposób: gdyby można było sfotografować położenie elektronu w atomie po setnych lub milionowych części sekundy, jak w fotofiniszu, wówczas elektron na takich zdjęciach byłby przedstawiany jako kropki. Gdyby nałożyć na siebie niezliczoną ilość takich zdjęć, obraz przedstawiałby chmurę elektronów o największej gęstości tam, gdzie byłoby najwięcej tych punktów.
Może znajdować się w dowolnej części tej przestrzeni otaczającej jądro, a całość jego różnych pozycji jest uważana za chmurę elektronów o określonej gęstości ładunku ujemnego. Obrazowo można to sobie wyobrazić w ten sposób: gdyby można było sfotografować położenie elektronu w atomie po setnych lub milionowych części sekundy, jak w fotofiniszu, wówczas elektron na takich zdjęciach byłby przedstawiany jako kropki. Gdyby nałożyć na siebie niezliczoną ilość takich zdjęć, obraz przedstawiałby chmurę elektronów o największej gęstości tam, gdzie byłoby najwięcej tych punktów.
Przestrzeń wokół jądra atomowego, w której najprawdopodobniej znajduje się elektron, nazywa się orbitalem. Zawiera około Chmura elektroniczna w 90%., a to oznacza, że przez około 90% czasu elektron przebywa w tej części przestrzeni. Wyróżniają się kształtem 4 obecnie znane typy orbitali, które są oznaczone łaciną litery s, p, d i f. Obraz graficzny Na rysunku pokazano niektóre formy orbitali elektronowych.

Najważniejszą cechą ruchu elektronu na pewnym orbicie jest energię połączenia z jądrem. Elektrony o podobnych wartościach energii tworzą pojedynczą warstwę elektronową, czyli poziom energii. Poziomy energii są ponumerowane począwszy od jądra - 1, 2, 3, 4, 5, 6 i 7.
Liczba całkowita n, wskazująca numer poziomu energii, nazywana jest główną liczbą kwantową. Charakteryzuje energię elektronów zajmujących dany poziom energetyczny. Elektrony pierwszego poziomu energetycznego, najbliższego jądru, mają najniższą energię. W porównaniu do elektronów pierwszego poziomu, elektrony kolejnych poziomów będą charakteryzowały się dużym zapasem energii. W rezultacie elektrony poziomu zewnętrznego są najmniej ściśle związane z jądrem atomowym.
Największą liczbę elektronów na poziomie energetycznym określa wzór:
N = 2n 2 ,
gdzie N jest maksymalną liczbą elektronów; n jest liczbą poziomu lub główną liczbą kwantową. W konsekwencji na pierwszym poziomie energetycznym najbliższym jądra nie mogą znajdować się więcej niż dwa elektrony; na drugim - nie więcej niż 8; na trzecim - nie więcej niż 18; na czwartym - nie więcej niż 32.
Zaczynając od drugiego poziomu energetycznego (n = 2), każdy z poziomów dzieli się na podpoziomy (podwarstwy), nieznacznie różniące się od siebie energią wiązania z jądrem. Liczba podpoziomów jest równa wartości głównej liczby kwantowej: pierwszy poziom energii ma jeden podpoziom; drugi - dwa; trzeci - trzy; czwarty - cztery podpoziomy. Z kolei podpoziomy są utworzone przez orbitale. Każda wartośćn odpowiada liczbie orbitali równej n.
Podpoziomy są zwykle oznaczane literami łacińskimi, a także kształtem orbitali, z których się składają: s, p, d, f.

Protony i neutrony

Atom dowolnego pierwiastka chemicznego można porównać do małego układu słonecznego. Dlatego ten model atomu zaproponowany przez E. Rutherforda nazywa się planetarny.
Jądro atomowe, w którym skoncentrowana jest cała masa atomu, składa się z cząstek dwóch typów - protony i neutrony.
Protony mają ładunek równy ładunkowi elektronów, ale przeciwny znak (+1) i masę równa masie atom wodoru (w chemii przyjmuje się go jako jednostkę). Neutrony nie mają ładunku, są obojętne i mają masę równą masie protonu.
Protony i neutrony razem nazywane są nukleonami (od łacińskiego jądra - jądro). Suma liczby protonów i neutronów w atomie nazywana jest liczbą masową. Na przykład liczba masowa atomu glinu wynosi:

13 + 14 = 27
liczba protonów 13, liczba neutronów 14, liczba masowa 27
Ponieważ masę elektronu, która jest zaniedbywalnie mała, można pominąć, oczywiste jest, że cała masa atomu skupiona jest w jądrze. Elektrony są oznaczone jako e - .
Od atomu elektrycznie neutralny, to jest również oczywiste, że liczba protonów i elektronów w atomie jest taka sama. Jest równy numerowi seryjnemu przypisanego mu pierwiastka chemicznego Układ okresowy. Masa atomu składa się z masy protonów i neutronów. Znając liczbę atomową pierwiastka (Z), czyli liczbę protonów, oraz liczbę masową (A), równą sumie liczb protonów i neutronów, liczbę neutronów (N) można wyznaczyć ze wzoru :

N = A - Z
Na przykład liczba neutronów w atomie żelaza wynosi:
56 — 26 = 30
Izotopy
Nazywa się odmiany atomów tego samego pierwiastka, które mają ten sam ładunek jądrowy, ale różne liczby masowe izotopy. Pierwiastki chemiczne występujące w przyrodzie są mieszaniną izotopów. Zatem węgiel ma trzy izotopy o masach 12, 13, 14; tlen - trzy izotopy o masach 16, 17, 18 itd. Względna masa atomowa pierwiastka chemicznego podawana zwykle w układzie okresowym jest średnią wartością mas atomowych naturalnej mieszaniny izotopów danego pierwiastka, biorąc pod uwagę ich względną liczebność w przyrodzie. Właściwości chemiczne Izotopy większości pierwiastków chemicznych są dokładnie takie same. Jednakże izotopy wodoru znacznie różnią się właściwościami ze względu na dramatyczny wielokrotny wzrost ich względnej masy atomowej; otrzymują nawet indywidualne nazwy i symbole chemiczne.

Elementy pierwszego okresu
Schemat budowy elektronowej atomu wodoru:

Diagramy budowy elektronowej atomów pokazują rozkład elektronów w warstwach elektronowych (poziomach energii).

Graficzny wzór elektroniczny atomu wodoru (pokazuje rozkład elektronów według poziomów energii i podpoziomów):

Graficzne wzory elektroniczne atomów pokazują rozkład elektronów nie tylko pomiędzy poziomami i podpoziomami, ale także pomiędzy orbitalami.
W atomie helu pierwsza warstwa elektronowa jest kompletna - ma 2 elektrony. Wodór i hel są pierwiastkami S; Orbital s tych atomów jest wypełniony elektronami.

Dla wszystkich elementów drugiego okresu pierwsza warstwa elektroniczna jest wypełniona, a elektrony wypełniają orbitale s i p drugiej warstwy elektronowej zgodnie z zasadą najmniejszej energii (najpierw s, potem p) oraz regułami Pauliego i Hunda.
W atomie neonu druga warstwa elektronów jest kompletna - ma 8 elektronów.
Dla atomów pierwiastków trzeciego okresu kompletowana jest pierwsza i druga warstwa elektronowa, w związku z czym wypełniona zostaje trzecia warstwa elektronowa, w której elektrony mogą zajmować podpoziomy 3s, 3p i 3d.
Atom magnezu kończy swój orbital elektronowy 3s. Na i Mg są pierwiastkami s.
W aluminium i kolejnych pierwiastkach podpoziom 3p jest wypełniony elektronami.
Elementy trzeciego okresu mają niewypełnione orbitale 3d.
Wszystkie elementy od Al do Ar są elementami p. Pierwiastki s i p tworzą główne podgrupy w układzie okresowym.

Elementy okresu czwartego – siódmego
Czwarta warstwa elektronowa pojawia się w atomach potasu i wapnia, a podpoziom 4s jest wypełniony, ponieważ ma niższą energię niż podpoziom 3d.
K, Ca - pierwiastki s zaliczane do głównych podgrup. W przypadku atomów od Sc do Zn podpoziom 3d jest wypełniony elektronami. To są elementy 3d. Zaliczane są do podgrup wtórnych, ich najbardziej zewnętrzna warstwa elektronowa jest wypełniona i zaliczane są do elementów przejściowych.
Zwróć uwagę na strukturę powłok elektronicznych atomów chromu i miedzi. W nich jeden elektron „zawodzi” z podpoziomu 4s do podpoziomu 3d, co tłumaczy się większą stabilnością energetyczną powstałych konfiguracji elektronowych 3d 5 i 3d 10:

W atomie cynku trzecia warstwa elektronowa jest kompletna – wypełnione są w niej wszystkie podpoziomy 3s, 3p i 3d, łącznie 18 elektronów. W pierwiastkach następujących po cynku czwarta warstwa elektronów, podpoziom 4p, jest nadal wypełniona.
Elementy od Ga do Kr są elementami p.
Atom kryptonu ma kompletną warstwę zewnętrzną (czwartą), która zawiera 8 elektronów. Ale w czwartej warstwie elektronowej mogą znajdować się łącznie 32 elektrony; atom kryptonu ma jeszcze niewypełnione podpoziomy 4d i 4f. Dla elementów piątego okresu podpoziomy wypełniane są w następującej kolejności: 5s - 4d - 5p. Istnieją również wyjątki związane z „ awaria» elektrony, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
W szóstym i siódmym okresie pojawiają się elementy f, czyli elementy, w których wypełnione są odpowiednio podpoziomy 4f i 5f trzeciej zewnętrznej warstwy elektronicznej.
Pierwiastki 4f nazywane są lantanowcami.
Pierwiastki 5f nazywane są aktynowcami.
Kolejność wypełniania podpoziomów elektronicznych w atomach pierwiastków szóstego okresu: pierwiastki 55 Cs i 56 Ba - 6s; 57 La … 6s 2 5d x - element 5d; 58 Ce - 71 Lu - elementy 4f; 72 Hf - 80 Hg - elementy 5d; 81 T1 - 86 Rn - elementy 6d. Ale i tutaj zdarzają się elementy, w których „naruszana jest kolejność wypełniania orbitali elektronowych”, co wiąże się np. z większą stabilnością energetyczną podpoziomów f wypełnionych w połowie i całkowicie, czyli nf 7 i nf 14. W zależności od tego, który podpoziom atomu jest ostatnio wypełniony elektronami, wszystkie pierwiastki dzielą się na cztery rodziny elektronów, czyli bloki:
- elementy S. Podpoziom s zewnętrznego poziomu atomu jest wypełniony elektronami; pierwiastki s obejmują wodór, hel i pierwiastki głównych podgrup grup I i II.
- elementy p. Podpoziom p zewnętrznego poziomu atomu jest wypełniony elektronami; elementy p obejmują elementy głównych podgrup grup III-VIII.
- elementy d. Podpoziom d przedzewnętrznego poziomu atomu jest wypełniony elektronami; do elementów d zaliczają się elementy podgrup wtórnych grup I-VIII, czyli elementy dekad wtykowych o dużych okresach, umiejscowionych pomiędzy elementami s i p. Nazywa się je również elementami przejściowymi.
- elementy f. Podpoziom f trzeciego zewnętrznego poziomu atomu jest wypełniony elektronami; obejmują one lantanowce i antynoidy.

Szwajcarski fizyk W. Pauli w 1925 r. ustalił, że w atomie na jednym orbicie nie mogą znajdować się więcej niż dwa elektrony posiadające przeciwne (antyrównoległe) spiny (przetłumaczone z angielskiego jako „wrzeciono”), tj. posiadające takie właściwości, które warunkowo można sobie wyobrazić jako obrót elektronu wokół jego wyimaginowanej osi: zgodnie z ruchem wskazówek zegara lub przeciwnie do ruchu wskazówek zegara.

Zasada ta nazywa się Zasada Pauliego. Jeśli na orbicie znajduje się jeden elektron, to nazywa się go niesparowanym, jeśli są dwa, to są to elektrony sparowane, czyli elektrony o przeciwnych spinach. Na rysunku przedstawiono schemat podziału poziomów energii na podpoziomy oraz kolejność ich wypełniania.


Bardzo często strukturę powłok elektronicznych atomów obrazuje się za pomocą ogniw energetycznych lub kwantowych – pisze się tzw. graficzne wzory elektroniczne. W tym zapisie stosuje się następującą notację: każda komórka kwantowa jest oznaczona komórką odpowiadającą jednemu orbitalowi; Każdy elektron jest oznaczony strzałką odpowiadającą kierunkowi spinu. Pisząc graficzną formułę elektroniczną należy pamiętać o dwóch zasadach: Zasada Pauliego i reguła F. Hunda, zgodnie z którym elektrony zajmują wolne komórki najpierw pojedynczo i mają tę samą wartość spinu, a dopiero potem łączą się w parę, ale spiny zgodnie z zasadą Pauliego będą już skierowane przeciwnie.
Reguła Hunda i zasada Pauliego
Reguła Hunda- zasada chemii kwantowej określająca kolejność zapełniania orbitali danej podwarstwy, sformułowana następująco: całkowita wartość spinowej liczby kwantowej elektronów danej podwarstwy musi być maksymalna. Sformułowany przez Friedricha Hunda w 1925 roku.
Oznacza to, że w każdym z orbitali podwarstwy najpierw zostaje zapełniony jeden elektron, a dopiero po wyczerpaniu się niewypełnionych orbitali, do tego orbitalu dodawany jest drugi elektron. W tym przypadku na jednym orbicie znajdują się dwa elektrony o spinach półcałkowitych o przeciwnym znaku, które łączą się w pary (tworzą chmurę dwuelektronową) i w rezultacie całkowity spin orbitalu staje się równy zeru.
Inne sformułowanie: Niższy poziom energii leży w członie atomowym, dla którego spełnione są dwa warunki.
- Wielość jest maksymalna
- Kiedy wielokrotności pokrywają się, całkowity pęd orbitalny L jest maksymalny.
Przeanalizujmy tę regułę na przykładzie wypełniania orbitali podpoziomu p P-elementy drugiego okresu (czyli od boru do neonu (na poniższym schemacie linie poziome oznaczają orbitale, strzałki pionowe wskazują elektrony, a kierunek strzałki wskazuje orientację spinu).
Reguła Klechkowskiego
Reguła Klechkowskiego - w miarę wzrostu całkowitej liczby elektronów w atomach (w miarę wzrostu ładunków ich jąder, lub numer seryjny pierwiastki chemiczne) orbitale atomowe są zaludnione w taki sposób, że pojawienie się elektronów na orbicie o wyższej energii zależy tylko od głównej liczby kwantowej n i nie zależy od wszystkich innych liczb kwantowych, w tym l. Fizycznie oznacza to, że w atomie wodoropodobnym (przy braku odpychania międzyelektronowego) energia orbity elektronu jest określona jedynie przestrzenną odległością gęstości ładunku elektronowego od jądra i nie zależy od charakterystyki jego ruch w polu jądra.
Empiryczna reguła Klechkowskiego i wynikający z niej schemat uporządkowania są w pewnym stopniu sprzeczne z rzeczywistą sekwencją energii orbitali atomowych tylko w dwóch podobnych przypadkach: dla atomów Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au , następuje „awaria” elektronu z podpoziomem s warstwy zewnętrznej zostaje zastąpiony podpoziomem d poprzedniej warstwy, co prowadzi do bardziej stabilnego energetycznie stanu atomu, a mianowicie: po wypełnieniu orbitalu 6 dwoma elektrony S
Atom to najmniejsza cząsteczka substancji chemicznej, która może zachować swoje właściwości. Słowo „atom” pochodzi od starożytnego greckiego „atomos”, co oznacza „niepodzielny”. W zależności od tego, ile i jakie cząsteczki znajdują się w atomie, można określić pierwiastek chemiczny.
Krótko o budowie atomu
Jak można w skrócie wymienić podstawowe informacje o cząstce z jednym jądrem, która jest naładowana dodatnio. Wokół tego jądra znajduje się ujemnie naładowana chmura elektronów. Każdy atom w swoim normalnym stanie jest obojętny. Rozmiar tej cząstki można całkowicie określić na podstawie rozmiaru chmury elektronów otaczającej jądro.
Z kolei samo jądro składa się również z mniejszych cząstek - protonów i neutronów. Protony są naładowane dodatnio. Neutrony nie niosą żadnego ładunku. Jednakże protony i neutrony są łączone w jedną kategorię i nazywane są nukleonami. Jeśli na krótko potrzebne są podstawowe informacje o budowie atomu, informacje te można ograniczyć do wymienionych danych.

Pierwsza informacja o atomie
Starożytni Grecy podejrzewali, że materia może składać się z małych cząstek. Wierzyli, że wszystko, co istnieje, składa się z atomów. Pogląd taki miał jednak charakter czysto filozoficzny i nie może być interpretowany naukowo.
Pierwszym, który uzyskał podstawowe informacje na temat budowy atomu, był angielski naukowiec, który to właśnie temu badaczowi udało się odkryć, że dwa pierwiastek chemiczny mogą wchodzić w różne stosunki, a każda taka kombinacja będzie reprezentować nową substancję. Na przykład osiem części pierwiastka tlenu powoduje powstanie dwutlenku węgla. Czteroczęściowy tlen to tlenek węgla.
W 1803 roku Dalton odkrył w chemii tak zwane prawo wielokrotnych stosunków. Korzystając z pomiarów pośrednich (ponieważ pod ówczesnymi mikroskopami nie można było wówczas zbadać ani jednego atomu), Dalton wyciągnął wniosek na temat względnej masy atomów.

Badania Rutherforda
Niemal sto lat później podstawowe informacje o budowie atomów potwierdził inny angielski chemik – Naukowiec zaproponował model powłoki elektronowej najmniejszych cząstek.
W tamtym czasie „Planetarny model atomu” Rutherforda był jednym z najbardziej znanych najważniejsze kroki co chemia może zrobić. Podstawowe informacje o budowie atomu wskazywały, że jest on podobny do Układ Słoneczny: cząstki elektronów krążą wokół jądra po ściśle określonych orbitach, podobnie jak planety.
Elektronowa powłoka atomów i wzory atomów pierwiastków chemicznych
Powłoka elektronowa każdego atomu zawiera dokładnie tyle elektronów, ile jest protonów w jego jądrze. Dlatego atom jest neutralny. W 1913 roku inny naukowiec uzyskał podstawowe informacje o budowie atomu. Wzór Nielsa Bohra był podobny do wzoru otrzymanego przez Rutherforda. Według jego koncepcji elektrony krążą także wokół jądra znajdującego się w jego centrum. Bohr udoskonalił teorię Rutherforda i przywrócił harmonię jej faktom.
Nawet wtedy formuły dla niektórych substancje chemiczne. Na przykład schematycznie strukturę atomu azotu oznacza się jako 1s 2 2s 2 2p 3, strukturę atomu sodu wyraża się wzorem 1s 2 2s 2 2p 6 3s 1. Za pomocą tych wzorów można zobaczyć, ile elektronów porusza się po każdym z orbitali określonej substancji chemicznej.

Model Schrödingera
Jednak później ten model atomowy również stał się przestarzały. Podstawowe informacje o budowie atomu, znane dziś nauce, w dużej mierze stały się dostępne dzięki badaniom austriackiego fizyka
On zaoferował nowy model jego struktura jest falowa. Do tego czasu naukowcy udowodnili już, że elektron ma nie tylko naturę cząstki, ale także właściwości fali.
Jednak model Schrödingera i Rutherforda również to ma Postanowienia ogólne. Ich teorie są podobne, ponieważ elektrony istnieją na określonych poziomach.
Takie poziomy nazywane są również warstwami elektronicznymi. Za pomocą liczby poziomów można scharakteryzować energię elektronów. Im wyższa warstwa, tym więcej ma energii. Wszystkie poziomy liczone są od dołu do góry, więc numer poziomu odpowiada jego energii. Każda z warstw powłoki elektronowej atomu ma swoje własne podpoziomy. W takim przypadku pierwszy poziom może mieć jeden podpoziom, drugi - dwa, trzeci - trzy i tak dalej (patrz powyższe wzory elektroniczne dla azotu i sodu).

Jeszcze mniejsze cząstki
W tej chwili odkryto oczywiście jeszcze mniejsze cząstki niż elektron, proton i neutron. Wiadomo, że proton składa się z kwarków. Istnieją jeszcze mniejsze cząstki wszechświata - na przykład neutrino, które jest sto razy mniejsze od kwarka i miliard razy mniejsze od protonu.
Neutrino to tak mała cząstka, że jest 10 septylionów razy mniejsza niż na przykład tyranozaur rex. Sam tyranozaur jest wielokrotnie mniejszy niż cały obserwowalny Wszechświat.
Podstawowe informacje o budowie atomu: radioaktywność
Zawsze było wiadomo, że ani jednego Reakcja chemiczna nie może przekształcić jednego elementu w drugi. Ale w procesie promieniowania radioaktywnego dzieje się to spontanicznie.
Radioaktywność to zdolność jąder atomowych do przekształcania się w inne jądra - bardziej stabilne. Kiedy ludzie otrzymali podstawowe informacje o budowie atomów, izotopy w pewnym stopniu mogły służyć jako ucieleśnienie marzeń średniowiecznych alchemików.
Podczas rozpadu izotopów emitowane jest promieniowanie radioaktywne. Zjawisko to po raz pierwszy odkrył Becquerel. Główny widok Promieniowanie radioaktywne to rozpad alfa. Kiedy to nastąpi, uwalniana jest cząstka alfa. Istnieje również rozpad beta, podczas którego cząstka beta zostaje wyrzucona z jądra atomu.
Izotopy naturalne i sztuczne
Obecnie znanych jest około 40 naturalnych izotopów. Większość z nich dzieli się na trzy kategorie: uran-rad, tor i aktyn. Wszystkie te izotopy można znaleźć w przyrodzie - w skałach, glebie, powietrzu. Ale oprócz nich znanych jest również około tysiąca sztucznie otrzymanych izotopów, które powstają w reaktorach jądrowych. Wiele z tych izotopów znajduje zastosowanie w medycynie, zwłaszcza w diagnostyce..

Proporcje w atomie
Jeśli wyobrazimy sobie atom, którego wymiary są porównywalne z wymiarami międzynarodowego stadionu sportowego, to wizualnie możemy uzyskać następujące proporcje. Elektrony atomu na takim „stadionie” będą znajdować się na samym szczycie trybun. Każdy z nich będzie mniejszy niż główka szpilki. Wtedy rdzeń znajdzie się w środku tego pola, a jego rozmiar nie będzie większy niż rozmiar grochu.
Czasami ludzie pytają, jak właściwie wygląda atom. Tak naprawdę nie wygląda to dosłownie na nic - nie dlatego, że mikroskopy używane w nauce nie są wystarczająco dobre. Wymiary atomu znajdują się w tych obszarach, w których pojęcie „widzialności” po prostu nie istnieje.
Atomy są bardzo małe. Ale jak małe są naprawdę te rozmiary? Faktem jest, że najmniejsze ziarenko soli, ledwo widoczne dla ludzkiego oka, zawiera około jednego tryliona atomów.
Jeśli wyobrazimy sobie atom o takich rozmiarach, który zmieściłby się w ludzkiej dłoni, to obok niego znajdowałyby się wirusy o długości 300 metrów. Bakterie miałyby długość 3 km, a grubość ludzkiego włosa 150 km. W pozycji leżącej byłby w stanie wyjść poza granice ziemskiej atmosfery. A gdyby takie proporcje były zachowane, wówczas ludzki włos mógłby osiągnąć długość Księżyca. To tak złożony i interesujący atom, który naukowcy badają do dziś.
Atom- najmniejsza cząsteczka substancji niepodzielna chemicznie. W XX wieku odkryto to złożona struktura atom. Atomy składają się z ładunków dodatnich jądra oraz powłoka utworzona przez ujemnie naładowane elektrony. Całkowity ładunek wolnego atomu wynosi zero, ponieważ ładunki jądra i powłoka elektronowa zrównoważyć się nawzajem. W tym przypadku ładunek jądrowy jest równy numerowi pierwiastka w układzie okresowym ( Liczba atomowa) i jest równa całkowitej liczbie elektronów (ładunek elektronów wynosi -1).
Jądro atomowe składa się z ładunków dodatnich protony i cząstki neutralne - neutrony, bez opłat. Uogólnioną charakterystykę cząstek elementarnych w atomie można przedstawić w formie tabeli:
Liczba protonów jest równa ładunkowi jądra, a zatem równa liczbie atomowej. Aby obliczyć liczbę neutronów w atomie, należy od masy atomowej (składającej się z mas protonów i neutronów) odjąć ładunek jądra (liczbę protonów).
Przykładowo w atomie sodu 23 Na liczba protonów wynosi p = 11, a liczba neutronów wynosi n = 23 − 11 = 12
Liczba neutronów w atomach tego samego pierwiastka może być różna. Takie atomy nazywane są izotopy .
Powłoka elektronowa atomu ma również złożoną strukturę. Elektrony umiejscowione są na poziomach energetycznych (warstwach elektronowych).
Liczba poziomów charakteryzuje energię elektronu. Wynika to z faktu, że cząstki elementarne może przesyłać i odbierać energię nie w dowolnie małych ilościach, ale w określonych porcjach - kwantach. Im wyższy poziom, tym większą energię ma elektron. Ponieważ im niższa energia układu, tym jest on stabilniejszy (porównaj niską stabilność kamienia na szczycie góry, który ma dużą energia potencjalna, oraz stabilne położenie tego samego kamienia poniżej na równinie, gdy jego energia jest znacznie niższa), najpierw wypełniane są poziomy o niskiej energii elektronów, a dopiero potem te o wysokiej.
Maksymalną liczbę elektronów, jaką może pomieścić dany poziom, można obliczyć ze wzoru:
N = 2n 2, gdzie N jest maksymalną liczbą elektronów na poziomie,
n - numer poziomu.
Następnie dla pierwszego poziomu N = 2 1 2 = 2,
dla drugiego N = 2 2 2 = 8 itd.
Liczba elektronów na poziom zewnętrzny dla elementów podgrup głównych (A) jest równy numerowi grupy.
W większości nowoczesnych układów okresowych rozmieszczenie elektronów według poziomu jest wskazane w komórce z pierwiastkiem. Bardzo ważne zrozumieć, że poziomy są czytelne w dół w górę, co odpowiada ich energii. Dlatego kolumna liczb w komórce z sodem:
1
8
2
na pierwszym poziomie - 2 elektrony,
na drugim poziomie - 8 elektronów,
na 3. poziomie - 1 elektron
Uważaj, to bardzo częsty błąd!
Rozkład poziomu elektronów można przedstawić w postaci diagramu:
11 Na)))
2 8 1
Jeśli układ okresowy nie wskazuje rozkładu elektronów według poziomu, możesz użyć:
- maksymalna liczba elektronów: na pierwszym poziomie nie więcej niż 2 e − ,
drugiego - 8 mi − ,
na poziomie zewnętrznym - 8 e − ; - liczba elektronów na poziomie zewnętrznym (dla pierwszych 20 elementów pokrywa się z numerem grupy)
Wówczas dla sodu tok rozumowania będzie następujący:
- Całkowita liczba elektronów wynosi 11, zatem pierwszy poziom jest zapełniony i zawiera 2 e − ;
- Trzeci, zewnętrzny poziom zawiera 1 e - (I grupa)
- Drugi poziom zawiera pozostałe elektrony: 11 − (2 + 1) = 8 (całkowicie wypełnione)
* Wielu autorów, w celu wyraźniejszego odróżnienia wolnego atomu od atomu w związku, proponuje używanie terminu „atom” jedynie do określenia wolnego (neutralnego) atomu, a do określenia wszystkich atomów, także tych znajdujących się w związków chemicznych, proponują termin „cząstki atomowe”. Czas pokaże, jakie będą dalsze losy tych terminów. Z naszego punktu widzenia atom z definicji jest cząstką, dlatego wyrażenie „cząstki atomowe” można uznać za tautologię („olej”).
2. Zadanie. Obliczenie ilości substancji jednego z produktów reakcji, jeżeli znana jest masa substancji wyjściowej.
Przykład:
Jaka ilość substancji wodorowej zostanie uwolniona podczas reakcji cynku z kwasem solnym o masie 146 g?
Rozwiązanie:
- Piszemy równanie reakcji: Zn + 2HCl = ZnCl 2 + H 2
- Znaleźliśmy masa cząsteczkowa kwasu solnego: M (HCl) = 1 + 35,5 = 36,5 (g/mol)
(masę molową każdego pierwiastka, liczbowo równą względnej masie atomowej, podaje się w układzie okresowym pod znakiem pierwiastka i zaokrągla się do liczb całkowitych, z wyjątkiem chloru, który przyjmuje się jako 35,5) - Znajdź ilość kwasu solnego: n (HCl) = m / M = 146 g / 36,5 g/mol = 4 mol
- Dostępne dane zapisujemy nad równaniem reakcji, a pod równaniem - liczbę moli zgodnie z równaniem (równą współczynnikowi przed substancją):
4 mole x mol
Zn + 2HCl = ZnCl2 + H2
2 mole 1 mol - Zróbmy proporcję:
4 mole - X kret
2 mole - 1 mol
(lub z wyjaśnieniem:
z 4 moli kwasu solnego otrzymasz X mol wodoru,
i od 2 moli - 1 mol) - Znaleźliśmy X:
X= 4 mol 1 mol / 2 mol = 2 mol
Odpowiedź: 2 mole.