Kwas Siarkowy
H2SO4, masa cząsteczkowa 98,082; bezbarwny, oleisty, bezwonny. Bardzo mocny kwas dwuzasadowy, w temperaturze 18°C Ka 1 - 2,8, K 2 1,2 10 -2, pK A 2 1,92; długości wiązań w S=O 0,143 nm, S-OH 0,154 nm, kąt HOSOH 104°, OSO 119°; wrze z rozkładem, tworząc (98,3% H 2 SO 4 i 1,7% H 2 O o temperaturze wrzenia 338,8 ° C; patrz także Tabela 1). Kwas Siarkowy, odpowiadający 100% zawartości H 2 SO 4, ma skład (%): H 2 SO 4 99,5%, HSO 4 - 0,18%, H 3 SO 4 + 0,14%, H 3 O + 0,09%, H 2S2O7 0,04%, HS2O7 0,05%. Miesza się z SO 3 we wszystkich proporcjach. W roztworach wodnych Kwas Siarkowy prawie całkowicie dysocjuje na H +, HSO 4 - i SO 4 2-. Tworzy H2SO4 N H 2 O, gdzie N=1, 2, 3, 4 i 6,5.
roztwory SO 3 w kwasie siarkowym nazywane są oleum, tworzą dwa związki H 2 SO 4 ·SO 3 i H 2 SO 4 ·2SO 3. Oleum zawiera także kwas pirosiarkowy otrzymywany w reakcji: H 2 SO 4 + SO 3 = H 2 S 2 O 7.
Wytwarzanie kwasu siarkowego
Surowce do uzyskania Kwas Siarkowy służyć: S, siarczki metali, H 2 S, odpady z elektrowni cieplnych, siarczany Fe, Ca itp. Główne etapy produkcji Kwas Siarkowy: 1) surowce do produkcji SO 2; 2) SO2 do SO3 (konwersja); 3) TAK 3. W przemyśle stosuje się dwie metody otrzymywania Kwas Siarkowy, różniące się sposobem utleniania SO 2 - kontaktowy z wykorzystaniem katalizatorów stałych (kontaktów) i azotawy - z tlenkami azotu. Za zdobycie Kwas Siarkowy W nowoczesnych fabrykach metodą kontaktową stosuje się katalizatory wanadowe, które zastąpiły tlenki Pt i Fe. Czysty V 2 O 5 ma słabą aktywność katalityczną, która w obecności gwałtownie wzrasta metale alkaliczne, a największy wpływ mają sole K. Promotoryczna rola metali alkalicznych wynika z tworzenia niskotopliwych pirosulfonianów (3K 2 S 2 O 7 V 2 O 5, 2 K 2 S 2 O 7 V 2 O 5 i K2S2O7V2O5, rozkładające się odpowiednio w 315-330, 365-380 i 400-405°C). Składnik aktywny w warunkach katalizy występuje w stanie stopionym.
Schemat utleniania SO 2 do SO 3 można przedstawić w następujący sposób:
W pierwszym etapie osiągana jest równowaga, drugi etap jest powolny i determinuje szybkość procesu.
Produkcja Kwas Siarkowy z siarki metodą podwójnego kontaktu i podwójnej absorpcji (rys. 1) składa się z następujących etapów. Powietrze po oczyszczeniu z pyłu dostarczane jest za pomocą dmuchawy gazowej do wieży suszącej, gdzie zostaje osuszone do poziomu 93-98%. Kwas Siarkowy do zawartości wilgoci 0,01% obj. Osuszone powietrze trafia do pieca siarkowego po podgrzaniu w jednym z wymienników ciepła jednostki kontaktowej. Piec spala siarkę dostarczaną przez dysze: S + O 2 = SO 2 + 297,028 kJ. Gaz zawierający 10-14% obj. SO 2 schładza się w kotle i po rozcieńczeniu powietrzem do zawartości SO 2 wynoszącej 9-10% obj. w temperaturze 420°C trafia do aparatu kontaktowego pierwszego stopnia konwersji, który odbywa się na trzech warstwach katalizatora (SO 2 + V 2 O 2 = SO 3 + 96,296 kJ), po czym gaz jest schładzany w wymiennikach ciepła. Następnie gaz zawierający 8,5-9,5% SO 3 w temperaturze 200°C wchodzi w pierwszy etap absorpcji do absorbera, nawadniany i 98% Kwas Siarkowy: SO 3 + H 2 O = H 2 SO 4 + 130,56 kJ. Następnie gaz poddawany jest oczyszczaniu rozpryskowemu Kwas Siarkowy, nagrzewa się do temperatury 420°C i przechodzi do drugiego etapu konwersji, który zachodzi na dwóch warstwach katalizatora. Przed drugim etapem absorpcji gaz jest schładzany w ekonomizerze i kierowany do absorbera drugiego stopnia, przepłukiwanego 98% Kwas Siarkowy, a następnie po oczyszczeniu rozprysków jest uwalniany do atmosfery.
1 - piec siarkowy; 2 - kocioł na ciepło odpadowe; 3 - ekonomizer; 4 - uruchomienie paleniska; 5, 6 - wymienniki ciepła pieca rozruchowego; 7 - urządzenie kontaktowe; 8 - wymienniki ciepła; 9 - pochłaniacz oleum; 10 - wieża susząca; 11 i 12 - odpowiednio pierwszy i drugi absorber monohydratu; 13 - zbiory kwasów.
1 - podajnik dyskowy; 2 - piekarnik; 3 - kocioł na ciepło odpadowe; 4 - cyklony; 5 - elektrofiltry; 6 - wieże myjące; 7 - mokre elektrofiltry; 8 - wieża wydmuchowa; 9 - wieża susząca; 10 - pułapka rozbryzgowa; 11 - pierwszy absorber monohydratu; 12 - wymienniki ciepła; 13 - urządzenie kontaktowe; 14 - pochłaniacz oleum; 15 - drugi absorber monohydratu; 16 - lodówki; 17 - zbiory.
1 - wieża denitacyjna; 2, 3 - pierwsza i druga wieża produkcyjna; 4 - wieża utleniająca; 5, 6, 7 - wieże absorpcyjne; 8 - elektrofiltry.
Produkcja Kwas Siarkowy z siarczków metali (rys. 2) jest znacznie bardziej skomplikowany i składa się z następujących operacji. FeS 2 wypala się w piecu ze złożem fluidalnym za pomocą podmuchu powietrza: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 + 13476 kJ. Gaz prażony o zawartości SO 2 13-14% i temperaturze 900°C trafia do kotła, gdzie jest schładzany do temperatury 450°C. Odpylanie odbywa się w cyklonie i elektrofiltrze. Następnie gaz przechodzi przez dwie wieże płuczące, nawadniane 40% i 10% Kwas Siarkowy. W tym przypadku gaz jest ostatecznie oczyszczany z pyłów, fluoru i arsenu. Do oczyszczania gazów z aerozolu Kwas Siarkowy powstające w wieżach myjących, przewidziano dwa stopnie mokrych elektrofiltrów. Po wysuszeniu w wieży suszącej, przed którym gaz jest rozcieńczany do zawartości 9% SO 2, doprowadzany jest dmuchawą gazu do pierwszego stopnia konwersji (3 warstwy katalizatora). W wymiennikach ciepła gaz podgrzewany jest do temperatury 420°C dzięki ciepłu gazu pochodzącemu z pierwszego stopnia konwersji. SO 2 utleniony w 92-95% w SO 3 przechodzi do pierwszego etapu absorpcji w absorberach oleum i monohydratu, gdzie zostaje uwolniony od SO 3. Następnie gaz zawierający SO 2 ~ 0,5% wchodzi do drugiego etapu konwersji, który zachodzi na jednej lub dwóch warstwach katalizatora. Gaz podgrzewany jest w kolejnej grupie wymienników ciepła do temperatury 420°C dzięki ciepłu gazów pochodzących z drugiego etapu katalizy. Po oddzieleniu SO 3 w drugim etapie absorpcji gaz jest uwalniany do atmosfery.
Stopień konwersji SO 2 do SO 3 metodą kontaktową wynosi 99,7%, stopień absorpcji SO 3 wynosi 99,97%. Produkcja Kwas Siarkowy przeprowadza się w jednym etapie katalizy, przy czym stopień konwersji SO 2 do SO 3 nie przekracza 98,5%. Przed uwolnieniem do atmosfery gaz jest oczyszczany z pozostałego SO2 (patrz). Wydajność nowoczesnych instalacji wynosi 1500-3100 t/dobę.
Istota metody nitrozowej (rys. 3) polega na tym, że gaz prażenia po schłodzeniu i oczyszczeniu z pyłu poddaje się obróbce tzw. nitrozą – Kwas Siarkowy, w którym rozpuszczają się tlenki azotu. SO 2 jest absorbowany przez nitrozę, a następnie utleniany: SO 2 + N 2 O 3 + H 2 O = H 2 SO 4 + NO. Powstały NO jest słabo rozpuszczalny w nitrozie i jest z niej uwalniany, a następnie częściowo utleniany przez tlen w fazie gazowej do NO2. Mieszanina NO i NO2 zostaje ponownie wchłonięta Kwas Siarkowy itp. Tlenki azotu nie są zużywane w procesie azotowym i wracają do cyklu produkcyjnego ze względu na ich niepełną absorpcję Kwas Siarkowy są one częściowo porywane przez gazy spalinowe. Zalety metody nitrozowej: prostota oprzyrządowania, niższy koszt (10-15% niższy niż kontaktowy), możliwość 100% recyklingu SO2.
Konstrukcja sprzętu wieżowego procesu nitrozowego jest prosta: SO2 jest przetwarzany w 7-8 wyłożonych wieżach z wypełnieniem ceramicznym, jedna z wież (pusta) ma regulowaną objętość utleniania. Wieże wyposażone są w kolektory kwasu, lodówki i pompy dostarczające kwas do zbiorników ciśnieniowych nad wieżami. Wentylator tylny jest zainstalowany przed dwiema ostatnimi wieżami. Do oczyszczania gazów z aerozolu Kwas Siarkowy pełni funkcję elektrofiltra. Niezbędne w procesie tlenki azotu otrzymuje się z HNO 3 . Aby ograniczyć emisję tlenków azotu do atmosfery i 100% recykling SO 2, pomiędzy strefą produkcji i absorpcji instaluje się cykl przetwarzania SO 2 bez azotu w połączeniu z metodą wodno-kwasową głębokiego wychwytywania tlenków azotu. Wadą metody nitrozowej jest niska jakość produktu: stężenie Kwas Siarkowy 75%, obecność tlenków azotu, Fe i innych zanieczyszczeń.
Aby zmniejszyć możliwość krystalizacji Kwas Siarkowy standardy dla gatunków handlowych są ustalane podczas transportu i przechowywania Kwas Siarkowy, którego stężenie odpowiada najniższej temperaturze krystalizacji. Treść Kwas Siarkowy w gatunkach technicznych (%): wieża (nitrowa) 75, kontakt 92,5-98,0, oleum 104,5, oleum wysokoprocentowe 114,6, bateria 92-94. Kwas Siarkowy magazynowane w zbiornikach stalowych o pojemności do 5000 m 3, ich łączna pojemność magazynu jest przewidziana na dziesięciodniową produkcję. Oleuma i Kwas Siarkowy przewożone w stalowych cysternach kolejowych. Skoncentrowany i akumulatorowy Kwas Siarkowy przewożone w cysternach ze stali kwasoodpornej. Zbiorniki do transportu oleum są przykryte izolacją termiczną, a oleum przed napełnieniem jest podgrzewane.
Definiować Kwas Siarkowy kolorymetrycznie i fotometrycznie, w postaci zawiesiny BaSO 4 - fototurbidymetrycznie, a także metodą kulometryczną.
Zastosowanie kwasu siarkowego
Kwas siarkowy wykorzystywany jest do produkcji nawozów mineralnych, jako elektrolit w akumulatorach ołowiowych, do produkcji różnych kwasów i soli mineralnych, włókien chemicznych, barwników, substancji dymotwórczych i materiały wybuchowe w przemyśle naftowym, metalowym, tekstylnym, skórzanym i innych. Stosowany jest w przemysłowej syntezie organicznej w reakcjach odwodnienia (produkcja eteru dietylowego, estry), hydratację (etanol z etylenu), sulfonowanie (oraz produkty pośrednie przy produkcji barwników), alkilowanie (produkcja izooktanu, glikolu polietylenowego, kaprolaktamu) itp. Największy konsument Kwas Siarkowy- produkcja nawozów mineralnych. Na 1 t nawozów fosforowych P 2 O 5 zużywa się 2,2-3,4 tony Kwas Siarkowy i dla 1 t (NH 4) 2 SO 4 - 0,75 t Kwas Siarkowy. Dlatego też mają tendencję do budowania zakładów kwasu siarkowego w połączeniu z fabrykami do produkcji nawozów mineralnych. Produkcja światowa Kwas Siarkowy w 1987 r. osiągnęło 152 mln ton.
Kwas Siarkowy i oleum to niezwykle agresywne substancje, które oddziałują na drogi oddechowe, skórę, błony śluzowe, powodują trudności w oddychaniu, kaszel, a często zapalenie krtani, tchawicy, oskrzeli itp. Maksymalne dopuszczalne stężenie aerozolu kwasu siarkowego w powietrzu obszaru pracy wynosi 1,0 mg/m 3, w atmosferze 0,3 mg/m 3 (maksymalnie jednorazowo) i 0,1 mg/m 3 (średnio dobowo). Niesamowite stężenie pary Kwas Siarkowy 0,008 mg/l (narażenie 60 min), śmiertelne 0,18 mg/l (60 min). Klasa zagrożenia 2. Aerozol Kwas Siarkowy mogą powstawać w atmosferze w wyniku emisji z przemysłu chemicznego i metalurgicznego, zawierających tlenki S i opadać w postaci kwaśnych deszczy.
Autor: Encyklopedia chemiczna N.S. ZefirowKWAS SIARKOWY H2SO4, masa cząsteczkowa 98,082; bezbarwny bezwonna oleista ciecz. Bardzo mocny kwas dwuzasadowy, w temperaturze 18°C pK a 1 - 2,8, K 2 1,2 10 -2, pK a 2 l,92; długości wiązań w cząsteczce S=O 0,143 nm, S-OH 0,154 nm, kąt HOSOH 104°, OSO 119°; wrze z różnymi, tworząc mieszaninę azeotropową (98,3% H2SO4 i 1,7% H2O o temperaturze wrzenia 338,8 ° C; patrz także tabela 1). KWAS SIARKOWY odpowiadający 100% zawartości H 2 SO 4 ma skład (%): H 2 SO 4 99,5, 0,18, 0,14, H 3 O + 0,09, H 2 S 2 O 7 0,04, HS 2 O 7 0,05 . Mieszalny z wodą i SO 3 we wszystkich proporcjach. W roztworach wodnych KWAS SIARKOWY prawie całkowicie dysocjuje na H + i. Tworzy hydraty H 2 SO 4 nH 2 O, gdzie n = 1, 2, 3, 4 i 6,5.
Roztwory SO 3 w KWASIE SIARKOWYM nazywane są oleum i tworzą dwa związki H 2 SO 4 SO 3 i H 2 SO 4 2SO 3. Oleum zawiera również kwas pirosiarkowy otrzymywany w reakcji: H 2 SO 4 + + SO 3 : H 2 S 2 O 7.


Temperatura wrzenia wodnych roztworów KWASU SIARKOWEGO wzrasta wraz ze wzrostem jego stężenia i osiąga maksimum przy zawartości 98,3% H 2 SO 4 (Tabela 2). Temperatura wrzenia oleum maleje wraz ze wzrostem zawartości SO3. Wraz ze wzrostem stężenia wodnych roztworów KWASÓW SIARKOWYCH całkowite ciśnienie pary nad roztworami maleje i osiąga minimum przy zawartości 98,3% H 2 SO 4. Wraz ze wzrostem stężenia SO 3 w oleum wzrasta całkowite ciśnienie pary nad nim. Prężność pary nad wodnymi roztworami KWASU SIARKOWEGO i oleum można obliczyć ze wzoru: logp(Pa) = A - B/T+ 2,126, wartości współczynników A i B zależą od stężenia KWASU SIARKOWEGO. roztwory KWASU SIARKOWEGO składają się z mieszaniny pary wodnej, H 2 SO 4 i SO 3, przy czym skład pary różni się od składu cieczy przy wszystkich stężeniach KWASU SIARKOWEGO, z wyjątkiem odpowiedniej mieszaniny azeotropowej.
Wraz ze wzrostem temperatury wzrasta dysocjacja H 2 SO 4 H 2 O + SO 3 - Q, równanie zależność od temperatury stałe równowagi lnК p = 14,74965 - 6,71464ln(298/T) - 8, 10161 10 4 T 2 -9643,04/T-9,4577 10 -3 T+2,19062 x 10 -6 T 2. Przy normalnym ciśnieniu stopień dysocjacji wynosi: 10 -5 (373 K), 2,5 (473 K), 27,1 (573 K), 69,1 (673 K). Gęstość 100% KWASU SIARKOWEGO można wyznaczyć z równania: d = 1,8517 - - 1,1 10 -3 t + 2 10 -6 t 2 g/cm 3 . Wraz ze wzrostem stężenia roztworów KWASÓW SIARKOWYCH ich pojemność cieplna maleje i osiąga minimum dla 100% KWASÓW SIARKOWYCH, natomiast pojemność cieplna oleum wzrasta wraz ze wzrostem zawartości SO 3.
Wraz ze wzrostem stężenia i spadkiem temperatury przewodność cieplna l maleje: l = 0,518 + 0,0016t - (0,25 + + t/1293) C/100, gdzie C jest stężeniem KWASU SIARKOWEGO, w%. Maks. Lepkość oleum H 2 SO 4 SO 3 zmniejsza się wraz ze wzrostem temperatury. Elektryczny odporność na KWAS SIARKOWY jest minimalna przy stężeniu 30 i 92% H 2 SO 4 i maksymalna przy stężeniu 84 i 99,8% H 2 SO 4. Dla oleum min. rw stężeniu 10% SO3. Wraz ze wzrostem temperatury wzrasta KWAS SIARKOWY. Dielektryk przepuszczalność 100% KWAS SIARKOWY k. 101 (298,15 K), 122 (281,15 K); krioskopowy stała 6,12, ebulioskopowa. stała 5,33; współczynnik dyfuzji par KWASÓW SIARKOWYCH w powietrzu zmienia się wraz z temperaturą; D = 1,67 · 10 -5 T 3/2 cm 2 /s.
KWAS SIARKOWY jest dość silnym utleniaczem, zwłaszcza po podgrzaniu; utlenia HI i częściowo HBr do wolnych halogenów, węgiel do CO 2, S do SO 2, utlenia wiele metali (Cu, Hg itp.). W tym przypadku KWAS SIARKOWY redukuje się do SO 2, a najsilniejsze środki redukujące są redukowane do S i H 2 S. Stęż. H 2 SO 4 jest częściowo redukowany przez H 2, dlatego nie można go stosować do suszenia. Razb. Oddziaływanie H 2 SO 4 ze wszystkimi metalami występującymi w szereg elektrochemiczny napięcia na lewo od wodoru, z uwolnieniem H2. Utleniać. właściwości rozcieńczonego H 2 SO 4 są nietypowe. KWAS SIARKOWY daje dwie serie soli: średnie siarczany i kwaśne wodorosiarczany (patrz Siarczany nieorganiczne), a także etery (patrz Siarczany organiczne). Znane są kwasy nadtlenosiarczkowe (kwas karo) H 2 SO 5 i nadtlenodisiarkowe H 2 S 2 O 8 (patrz Siarka).
Paragon. Surowcami do produkcji kwasu siarkowego są: S, siarczki metali, H 2 S, gazy odlotowe z elektrowni cieplnych, siarczany Fe, Ca itp. Zasadowy. etapy otrzymywania KWASÓW SIARKOWYCH: 1) prażenie surowców w celu wytworzenia SO 2; 2) utlenianie SO 2 do SO 3 (konwersja); 3) Absorpcja SO 3. W przemyśle stosuje się dwie metody produkcji KWASU SIARKOWEGO, różniące się metodą utleniania SO 2 - kontaktową z wykorzystaniem katalizatorów stałych (kontaktów) i azotawą - tlenkami azotu. Aby otrzymać kwas siarkowy metodą kontaktową, nowoczesne fabryki wykorzystują katalizatory wanadowe, które zastąpiły tlenki Pt i Fe. Czysty V 2 O 5 ma słabą aktywność katalityczną, która gwałtownie wzrasta w obecności soli metali alkalicznych, przy czym największy wpływ mają sole K. Promotoryczna rola metali alkalicznych wynika z tworzenia niskotopliwych pirosulfonianów (3K 2 S 2 O 7 V 2 O 5, 2K 2 S 2 O 7 V 2 O 5 i K 2 S 2 O 7 V 2 O 5, rozkładające się odpowiednio w 315-330, 365-380 i 400-405 ° C). Składnik aktywny w warunkach katalizy występuje w stanie stopionym.
Schemat utleniania SO 2 do SO 3 można przedstawić w następujący sposób:
W pierwszym etapie osiągana jest równowaga, drugi etap jest powolny i determinuje szybkość procesu.
Produkcja KWASÓW SIARKOWYCH z siarki metodą podwójnego kontaktu i podwójnej absorpcji (rys. 1) składa się z następujących etapów. Powietrze po oczyszczeniu z pyłu dostarczane jest za pomocą dmuchawy gazowej do wieży suszarniczej, gdzie jest suszone kwasem siarkowym 93-98% do zawartości wilgoci 0,01% obj. Osuszone powietrze wchodzi do pieca siarkowego po wstępnym podgrzaniu. ogrzewanie w jednym z wymienników ciepła jednostki kontaktowej. Piec spala siarkę dostarczaną przez dysze: S + O 2 : SO 2 + + 297,028 kJ. Gaz zawierający 10-14% obj. SO 2 schładza się w kotle i po rozcieńczeniu powietrzem do zawartości SO 2 wynoszącej 9-10% obj. w temperaturze 420°C wchodzi do aparatu kontaktowego w pierwszym etapie konwersji, co odbywa się na trzech warstwach katalizatora (SO 2 + V 2 O 2 :: SO 3 + 96,296 kJ), po czym gaz jest schładzany w wymiennikach ciepła. Następnie gaz zawierający 8,5-9,5% SO 3 w temperaturze 200 ° C wchodzi w pierwszy etap absorpcji do absorbera zwilżonego oleum i 98% KWASEM SIARKOWYM: SO 3 + H 2 O : H 2 SO 4 + + 130,56 kJ. Następnie gaz jest oczyszczany z rozprysków KWASU SIARKOWEGO, podgrzewany do temperatury 420°C i przechodzi do drugiego etapu konwersji, który zachodzi na dwóch warstwach katalizatora. Przed drugim etapem absorpcji gaz jest schładzany w ekonomizerze i kierowany do absorbera drugiego stopnia, przepłukiwany 98% KWASEM SIARKOWYM, a następnie po oczyszczeniu z rozprysków uwalniany do atmosfery. 
Ryż. 1. Schemat produkcji kwasu siarkowego z siarki: 1-piec siarkowy; 2-kocioł regeneracyjny; 3 - ekonomizer; Palenisko 4-startowe; 5, 6 - wymienniki ciepła pieca rozruchowego; urządzenie 7-pinowe; 8-wymienniki ciepła; absorber 9-oleum; 10-wieża suszarnicza; 11 i 12 to odpowiednio pierwszy i drugi absorber monohydratu; Kolektory 13-kwasowe.

Ryc.2. Schemat produkcji kwasu siarkowego z pirytu: podajnik 1-płytowy; 2-piekarnik; 3-kocioł regeneracyjny; 4-cyklony; 5-elektryczne elektrofiltry; 6-wieże myjące; 7-mokre elektrofiltry; 8-wieża wydechowa; 9-wieża suszarnicza; Pułapka na 10 rozprysków; 11-pierwszy absorber monohydratu; 12-wiki-wymiany ciepła; 13 - urządzenie kontaktowe; absorber 14-oleum; 15-sekundowy absorber monohydratu; 16-lodówki; 17 kolekcji.

Ryż. 3. Schemat produkcji kwasu siarkowego metodą nitrozową: 1 - denitrat. wieża; 2, 3 - pierwszy i drugi produkt. wieże; 4-tlenek. wieża; 5, 6, 7-absorpcja. wieże; 8 - elektrofiltry.
Produkcja KWASU SIARKOWEGO z siarczków metali (rys. 2) jest znacznie bardziej skomplikowana i składa się z następujących operacji. FeS 2 wypala się w piecu ze złożem fluidalnym za pomocą podmuchu powietrza: 4FeS 2 + 11O 2: 2Fe 2 O 3 + 8SO 2 + 13476 kJ. Gaz prażony o zawartości SO 2 13-14% i temperaturze 900°C trafia do kotła, gdzie jest schładzany do temperatury 450°C. Odpylanie odbywa się w cyklonie i elektrofiltrze. Następnie gaz przechodzi przez dwie wieże myjące, nawadniane 40% i 10% KWASEM SIARKOWYM, przy czym następuje ostateczne oczyszczenie go z pyłów, fluoru i arsenu. Do oczyszczenia gazu z aerozolu KWASÓW SIARKOWYCH powstającego w wieżach płuczących przewidziano dwa stopnie mokrych elektrofiltrów. Po wysuszeniu w wieży suszącej, przed którym gaz jest rozcieńczany do zawartości 9% SO 2, doprowadzany jest dmuchawą gazu do pierwszego stopnia konwersji (3 warstwy katalizatora). W wymiennikach ciepła gaz podgrzewany jest do temperatury 420°C dzięki ciepłu gazu pochodzącemu z pierwszego stopnia konwersji. SO 2 utleniony w 92-95% w SO 3 przechodzi do pierwszego etapu absorpcji w absorberach oleum i monohydratu, gdzie zostaje uwolniony od SO 3. Następnie gaz zawierający SO 2 ~ 0,5% wchodzi do drugiego etapu konwersji, który odbywa się na jednej lub dwóch warstwach katalizatora. Gaz podgrzewany jest w kolejnej grupie wymienników ciepła do temperatury 420°C pod wpływem ciepła gazów pochodzących z drugiego etapu katalizy. Po oddzieleniu SO 3 w drugim etapie absorpcji gaz jest uwalniany do atmosfery.
Stopień konwersji SO 2 do SO 3 metodą kontaktową wynosi 99,7%, stopień absorpcji SO 3 wynosi 99,97%. Produkcja KWASÓW SIARKOWYCH odbywa się w jednym etapie katalizy, a stopień konwersji SO 2 do SO 3 nie przekracza 98,5%. Przed uwolnieniem do atmosfery gaz jest oczyszczany z pozostałego SO 2 (patrz Oczyszczanie gazu). Wydajność nowoczesnych instalacji wynosi 1500-3100 t/dobę.
Istota metody nitrozowej (rys. 3) polega na tym, że gaz prażony po schłodzeniu i oczyszczeniu z pyłu poddaje się obróbce tzw. nitrozą-C. do., w którym sol. Tlenki azotu. SO 2 jest absorbowany przez nitrozę, a następnie utleniany: SO 2 + N 2 O 3 + H 2 O : H 2 SO 4 + NO. Powstały NO jest słabo rozpuszczalny w nitrozie i jest z niej uwalniany, a następnie częściowo utleniany przez tlen w fazie gazowej do NO2. Mieszanina NO i NO2 jest ponownie absorbowana przez KWAS SIARKOWY. itp. Tlenki azotu nie są zużywane w procesie azotowym i są zawracane do produkcji. cyklu, ze względu na niecałkowitą absorpcję przez KWAS SIARKOWY, są one częściowo usuwane przez gazy spalinowe. Zalety metody nitrozowej: prostota oprzyrządowania, niższy koszt (10-15% niższy niż kontaktowy), możliwość 100% recyklingu SO2.
Konstrukcja sprzętu procesu w wieży nitrozowej jest prosta: SO2 jest przetwarzany w 7-8 wieżach wyłożonych ceramiką. dysza, jedna z wież (pusta) to regulowany utleniacz. tom. Wieże wyposażone są w kolektory kwasu, lodówki i pompy dostarczające kwas do zbiorników ciśnieniowych nad wieżami. Wentylator tylny jest zainstalowany przed dwiema ostatnimi wieżami. Do oczyszczania gazu z aerozolu KWASÓW SIARKOWYCH służy elektrofiltr. Niezbędne w procesie tlenki azotu otrzymuje się z HNO 3 . Aby ograniczyć emisję tlenków azotu do atmosfery i 100% recykling SO 2, pomiędzy strefą produkcji i absorpcji instaluje się cykl przetwarzania SO 2 bez azotu w połączeniu z metodą wodno-kwasową głębokiego wychwytywania tlenków azotu. Wadą metody azotowej jest niska jakość produktu: stężenie KWASU SIARKOWEGO wynosi 75%, obecność tlenków azotu, Fe i innych zanieczyszczeń.
Aby ograniczyć możliwość krystalizacji KWASÓW SIARKOWYCH podczas transportu i przechowywania, ustalono standardy dla handlowych gatunków KWASÓW SIARKOWYCH, których stężenie odpowiada najniższej temperaturze krystalizacji. Spis treści KWAS SIARKOWY w tech. stopnie (%): wieża (nitrowa) 75, kontakt 92,5-98,0, oleum 104,5, oleum wysokoprocentowe 114,6, bateria 92-94. KWAS SIARKOWY magazynowany jest w zbiornikach stalowych o pojemności do 5000 m 3, których łączna pojemność magazynu przeznaczona jest na dziesięciodniową produkcję. Oleum i KWAS SIARKOWY przewożone są w stalowych cysternach kolejowych. stęż. i akumulator KWAS SIARKOWY transportujemy w cysternach wykonanych ze stali kwasoodpornej. Zbiorniki do transportu oleum są przykryte izolacją termiczną, a oleum przed napełnieniem jest podgrzewane.
KWAS SIARKOWY oznacza się kolorymetrycznie i fotometrycznie w postaci zawiesiny BaSO 4 - fototurbidymetrycznie i kulometrycznie. metoda.
Aplikacja. KWAS SIARKOWY stosowany jest do produkcji nawozów mineralnych, jako elektrolit w akumulatorach ołowiowych, do produkcji różnych kwasów i soli mineralnych, włókien chemicznych, barwników, substancji dymotwórczych i materiałów wybuchowych, w przemyśle naftowym, metalowym, tekstylnym, skórzanym i inne branże. Jest stosowany w przemyśle. synteza organiczna w reakcjach odwodnienia (wytwarzanie eteru dietylowego, estrów), hydratacji (etanol z etylenu), sulfonowania (syntetyczna. detergenty i półprodukty do produkcji barwników), alkilowanie (produkcja izooktanu, glikolu polietylenowego, kaprolaktamu) itp. Największym konsumentem KWASU SIARKOWEGO jest produkcja nawozów mineralnych. Na 1 t nawozów fosforowych P 2 O 5 zużywa się 2,2-3,4 t KWASÓW SIARKOWYCH, a na 1 t (NH 4) 2 SO 4 -0,75 t KWASÓW SIARKOWYCH, dlatego mają one tendencję do tworzenia kwasu siarkowego zakłady w kompleksie z fabrykami do produkcji nawozów mineralnych. Światowa produkcja KWASU SIARKOWEGO w 1987 roku osiągnęła 152 miliony ton.
KWAS SIARKOWY i oleum to substancje niezwykle agresywne, oddziałujące na drogi oddechowe, skórę, błony śluzowe, powodujące trudności w oddychaniu, kaszel, często zapalenie krtani, tchawicy, zapalenie oskrzeli itp. MPC aerozolu KWAS SIARKOWY w powietrzu miejsca pracy 1,0 mg/ m3, w atm. powietrze 0,3 mg/m 3 (maks. jednorazowo) i 0,1 mg/m 3 (średnio dziennie). Szkodliwe stężenie oparów KWASÓW SIARKOWYCH wynosi 0,008 mg/l (narażenie 60 min), śmiertelne 0,18 mg/l (60 min). Klasa zagrożenia 2. Aerozol KWAS SIARKOWY może powstawać w atmosferze w wyniku emisji chemicznych i metalurgicznych. gałęzie przemysłu zawierające tlenki siarki i opadają w postaci kwaśnych deszczy.
Literatura: Podręcznik kwasu siarkowego, wyd. K. M. Malina, wyd. 2, M., 1971; Amelin A.G., Technologia kwasu siarkowego, wyd. 2, M., 1983; Wasiliew B. T., Otvagina M. I., Technologia kwasu siarkowego, M., 1985. Yu.V. Filatow.
Encyklopedia chemiczna. Tom 4 >>
DEFINICJA
Bezwodny Kwas Siarkowy jest ciężką, lepką cieczą, która łatwo miesza się z wodą w dowolnej proporcji: oddziaływanie charakteryzuje się wyjątkowo dużym efektem egzotermicznym (~880 kJ/mol przy nieskończonym rozcieńczeniu) i może prowadzić do wybuchowego wrzenia i rozpryskiwania mieszaniny w przypadku dodania wody dodano do kwasu; Dlatego tak ważne jest, aby zawsze odwracać kolejność przygotowywania roztworów i dodawać kwas do wody, powoli i cały czas mieszając.
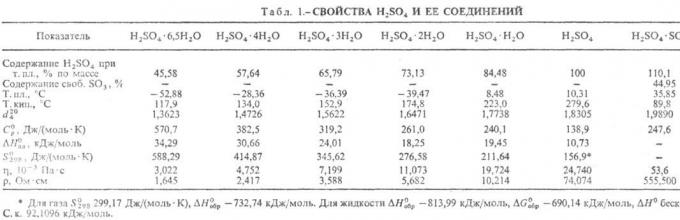
Niektóre właściwości fizyczne kwasu siarkowego podano w tabeli.
Bezwodny H 2 SO 4 to niezwykły związek o niezwykle wysokiej stałej dielektrycznej i bardzo wysokiej przewodności elektrycznej, co wynika z autodysocjacji jonowej (autoprotolizy) związku, a także mechanizmu przewodnictwa przekaźnikowego z przeniesieniem protonu, który zapewnia przepływ prąd elektryczny przez lepką ciecz z duża liczba wiązania wodorowe.
Tabela 1. Właściwości fizyczne Kwas Siarkowy.
Wytwarzanie kwasu siarkowego
Kwas siarkowy jest najważniejszą chemią przemysłową i najtańszym kwasem produkowanym w dużych ilościach na świecie.
Stężony kwas siarkowy („olej witriolu”) otrzymywano najpierw przez ogrzewanie „zielonego witriolu” FeSO 4 × nH 2 O i zużywano go w dużych ilościach do produkcji Na 2 SO 4 i NaCl.
W nowoczesny proces Do produkcji kwasu siarkowego stosuje się katalizator składający się z tlenku wanadu(V) z dodatkiem siarczanu potasu na nośniku w postaci dwutlenku krzemu lub ziemi okrzemkowej. Dwutlenek siarki SO2 powstaje w wyniku spalania czystej siarki lub prażenia rudy siarczkowej (głównie pirytu lub rud Cu, Ni i Zn) w procesie ekstrakcji tych metali.SO2 jest następnie utleniany do trójtlenku, a następnie przez rozpuszczenie w woda:
S + O 2 → SO 2 (ΔH 0 - 297 kJ/mol);
SO2 + ½ O2 → SO3 (ΔH0 - 9,8 kJ/mol);
SO 3 + H 2 O → H 2 SO 4 (ΔH 0 - 130 kJ/mol).
Właściwości chemiczne kwasu siarkowego
Kwas siarkowy jest mocnym kwasem dwuzasadowym. W pierwszym etapie, w roztworach o niskim stężeniu, dysocjuje prawie całkowicie:
H2SO4 ↔H + + HSO4 - .
Drugi etap dysocjacji
HSO 4 — ↔H + + SO 4 2-
występuje w mniejszym stopniu. Stała dysocjacji kwasu siarkowego w drugim etapie, wyrażona aktywnością jonów, K 2 = 10 -2.
Jako kwas dwuzasadowy kwas siarkowy tworzy dwie serie soli: średnią i kwaśną. Przeciętne sole kwasu siarkowego nazywane są siarczanami, a sole kwasowe nazywane są wodorosiarczanami.
Kwas siarkowy łapczywie pochłania parę wodną i dlatego często jest używany do suszenia gazów. Zdolność do wchłaniania wody wyjaśnia również zwęglenie wielu materia organiczna, szczególnie te należące do klasy węglowodanów (błonnik, cukier itp.), pod wpływem stężonego kwasu siarkowego. Kwas siarkowy usuwa wodór i tlen z węglowodanów, które tworzą wodę, a węgiel jest uwalniany w postaci węgla.
Stężony kwas siarkowy, zwłaszcza gorący, jest silnym środkiem utleniającym. Utlenia HI i HBr (ale nie HCl) do wolnych halogenów, węgla do CO 2, siarki do SO 2. Reakcje te wyrażają równania:
8HI + H2SO4 = 4I2 + H2S + 4H2O;
2HBr + H2SO4 = Br2 + SO2 + 2H2O;
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
S + 2H 2 SO 4 = 3SO 2 + 2H 2 O.
Oddziaływanie kwasu siarkowego z metalami zachodzi różnie w zależności od jego stężenia. Rozcieńczony kwas siarkowy utlenia się wraz z jonem wodorowym. Dlatego oddziałuje tylko z tymi metalami, które są w szeregu napięcia tylko do wodoru, na przykład:
Zn + H 2 SO 4 = ZnSO 4 + H 2.
Jednak ołów nie rozpuszcza się w rozcieńczonym kwasie, ponieważ powstała sól PbSO4 jest nierozpuszczalna.
Stężony kwas siarkowy jest utleniaczem ze względu na siarkę (VI). Utlenia metale w zakresie napięć do srebra włącznie. Produkty jego redukcji mogą się różnić w zależności od aktywności metalu i warunków (stężenie kwasu, temperatura). Podczas interakcji z małym metale aktywne, na przykład za pomocą miedzi, kwas redukuje się do SO 2:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O.
Podczas interakcji z bardziej aktywnymi metalami produktami redukcji mogą być zarówno dwutlenek, jak i wolna siarka i siarkowodór. Na przykład podczas interakcji z cynkiem mogą wystąpić następujące reakcje:
Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O;
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S↓ + 4H 2 O;
4Zn + 5H 2 SO 4 = 4ZnSO 4 + H 2 S + 4H 2 O.
Zastosowanie kwasu siarkowego
Stosowanie kwasu siarkowego różni się w zależności od kraju i dekady. Na przykład obecnie w USA główna strefa zużycie H 2 SO 4 - produkcja nawozów (70%), w dalszej kolejności produkcja chemiczna, metalurgia, rafinacja ropy naftowej (~5% w każdym obszarze). W Wielkiej Brytanii rozkład zużycia według gałęzi jest inny: tylko 30% wyprodukowanego H2SO4 wykorzystuje się do produkcji nawozów, ale 18% trafia do farb, pigmentów i półproduktów produkcji barwników, 16% do produkcji chemicznej, 12 % do produkcji mydeł i detergentów, 10 % do produkcji włókien naturalnych i sztucznych, a 2,5 % wykorzystuje się w hutnictwie.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Określ masę kwasu siarkowego, którą można otrzymać z tony pirytu, jeśli wydajność tlenku siarki (IV) w reakcji prażenia wynosi 90%, a tlenku siarki (VI) w katalitycznym utlenianiu siarki (IV) wynosi 95% teoretycznych. |
| Rozwiązanie | Zapiszmy równanie reakcji wypalania pirytu: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2. Obliczmy ilość substancji pirytowej: n(FeS2) = m(FeS2) / M(FeS2); M(FeS2) = Ar(Fe) + 2×Ar(S) = 56 + 2×32 = 120 g/mol; n(FeS 2) = 1000 kg / 120 = 8,33 kmol. Ponieważ w równaniu reakcji współczynnik dla dwutlenku siarki jest dwukrotnie większy niż współczynnik dla FeS 2, wówczas teoretycznie możliwa ilość substancji tlenku siarki (IV) jest równa: teoria n(SO 2) = 2 × n(FeS 2) = 2 × 8,33 = 16,66 kmol. A praktycznie uzyskana ilość moli tlenku siarki (IV) wynosi: n(SO 2) praktyk = η × n(SO 2) teoria = 0,9 × 16,66 = 15 kmol. Zapiszmy równanie reakcji utleniania tlenku siarki (IV) do tlenku siarki (VI): 2SO2 + O2 = 2SO3. Teoretycznie możliwa ilość tlenku siarki (VI) wynosi: n(SO 3) teoria = n(SO 2) praktyka = 15 kmol. A praktycznie uzyskana ilość moli tlenku siarki (VI) wynosi: n(SO 3) praktyk = η × n(SO 3) teoria = 0,5 × 15 = 14,25 kmol. Zapiszmy równanie reakcji wytwarzania kwasu siarkowego: SO 3 + H 2 O = H 2 SO 4. Znajdźmy ilość kwasu siarkowego: n(H 2 SO 4) = n(SO 3) praktyk = 14,25 kmol. Wydajność reakcji wynosi 100%. Masa kwasu siarkowego jest równa: m(H2SO4) = n(H2SO4) × M(H2SO4); M(H2SO4) = 2×Ar(H) + Ar(S) + 4×Ar(O) = 2×1 + 32 + 4×16 = 98 g/mol; m(H2SO4) = 14,25 × 98 = 1397 kg. |
| Odpowiedź | Masa kwasu siarkowego wynosi 1397 kg |
Właściwości kwasu siarkowego
Bezwodny kwas siarkowy (monohydrat) to ciężka oleista ciecz, która miesza się z wodą we wszystkich proporcjach, uwalniając duża ilość ciepło. Gęstość w temperaturze 0°C wynosi 1,85 g/cm3. Wrze w temperaturze 296°C i zamarza w temperaturze -10°C. Kwas siarkowy nazywany jest nie tylko monohydratem, ale także roztwory wodne it (), a także roztwory trójtlenku siarki w monohydracie (), zwane oleum. Oleum „dymi” w powietrzu na skutek desorpcji z niego. Czysty kwas siarkowy jest bezbarwny, natomiast techniczny kwas siarkowy zabarwia się na ciemno pod wpływem zanieczyszczeń.
Właściwości fizyczne kwasu siarkowego, takie jak gęstość, temperatura krystalizacji, temperatura wrzenia, zależą od jego składu. Na ryc. Rysunek 1 przedstawia schemat krystalizacji układu. Maksima w nim odpowiadają składowi związków lub obecność minimów tłumaczy się faktem, że temperatura krystalizacji mieszanin dwóch substancji jest niższa niż temperatura krystalizacji każdej z nich.
Ryż. 1
Bezwodny 100% kwas siarkowy ma stosunkowo wysoką temperaturę krystalizacji wynoszącą 10,7 °C. Aby ograniczyć możliwość zamrożenia produktu handlowego podczas transportu i przechowywania, stężenie technicznego kwasu siarkowego dobiera się tak, aby miało ono wystarczającą niska temperatura krystalizacja. Przemysł produkuje trzy rodzaje komercyjnego kwasu siarkowego.
Kwas siarkowy jest bardzo aktywny. Rozpuszcza tlenki metali i większość czystych metali, a w podwyższonych temperaturach wypiera z soli wszystkie inne kwasy. Kwas siarkowy łączy się szczególnie łapczywie z wodą ze względu na zdolność tworzenia hydratów. Odbiera wodę innym kwasom, krystalicznym hydratom soli, a nawet tlenowym pochodnym węglowodorów, które zawierają nie wodę jako taką, ale wodór i tlen w kombinacji H:O = 2. drewno i inne tkanki roślinne i zwierzęce zawierające celulozę, skrobia i cukier są niszczone w stężonym kwasie siarkowym; woda wiąże się z kwasem i z tkanki pozostaje jedynie drobno rozproszony węgiel. W rozcieńczonym kwasie celuloza i skrobia rozkładają się, tworząc cukry. Kontakt stężonego kwasu siarkowego z ludzką skórą powoduje oparzenia.
Wysoka aktywność kwasu siarkowego w połączeniu ze stosunkowo niskim kosztem produkcji przesądziła o ogromnej skali i ogromnej różnorodności jego zastosowań (ryc. 2). Trudno znaleźć branżę, w której kwas siarkowy lub produkty z niego powstałe nie byłyby spożywane w zróżnicowanych ilościach.

Ryż. 2
Największym konsumentem kwasu siarkowego jest produkcja nawozów mineralnych: superfosfatu, siarczanu amonu itp. wiele kwasów (na przykład fosforowy, octowy, solny) i soli wytwarza się głównie przy użyciu kwasu siarkowego. Kwas siarkowy jest szeroko stosowany w produkcji metali nieżelaznych i rzadkich. W przemyśle metalowym kwas siarkowy lub jego sole stosuje się do wytrawiania wyrobów stalowych przed malowaniem, cynowaniem, niklowaniem, chromowaniem itp. Znaczne ilości kwasu siarkowego zużywane są na rafinację produktów naftowych. Do produkcji wielu barwników (do tkanin), lakierów i farb (do budynków i maszyn), substancji leczniczych oraz niektórych tworzyw sztucznych również wykorzystuje się kwas siarkowy. Przy użyciu kwasu siarkowego, etylu i innych alkoholi produkowane są niektóre estry, syntetyczne detergenty i wiele pestycydów do zwalczania szkodników Rolnictwo i chwasty. Rozcieńczone roztwory kwasu siarkowego i jego soli stosuje się przy produkcji sztucznego jedwabiu, w przemyśle tekstylnym do obróbki włókien lub tkanin przed barwieniem, a także w innych gałęziach przemysłu lekkiego. W Przemysł spożywczy kwas siarkowy wykorzystywany jest do produkcji skrobi, melasy i wielu innych produktów. W transporcie wykorzystuje się akumulatory ołowiowo-kwasowo-siarkowe. Kwas siarkowy służy do suszenia gazów i zagęszczania kwasów. Wreszcie kwas siarkowy jest stosowany w procesach nitrowania i produkcji większości materiałów wybuchowych.