I. Według numeru grupy funkcyjne
Monoaminomono kwasy karboksylowe
najprostszy przedstawiciel:

Kwasy monoaminodikarboksylowe

Na przykład:

Kwasy diamimononokarboksylowe

Na przykład:

II. Zgodnie z względną pozycją grup karboksylowych i aminowych
-α-aminokwasy

- β-aminokwasy

- γ-aminokwasy

Wzory i nazwy niektórych α-aminokwasów, których reszty wchodzą w skład białek

Białka są naturalnymi polimerami, z których zbudowane są makrocząsteczki duża liczba reszty 20 różnych α-aminokwasów. W biochemii dla aminokwasów używa się zwykle krótkich, trywialnych nazw i trzyliterowych oznaczeń.
Kwasy monoaminomonokarboksylowe
|
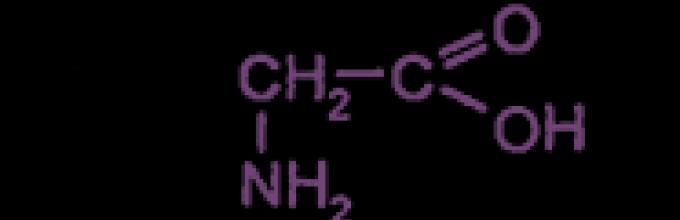
Kwas aminoetanowy lub aminooctowy lub glicyna (glikol) |
|
|
Kwas 2-aminopropanowy lub α-aminopropionowy lub alanina |
|
|
Kwas 2-amino-3-hydroksypropanowy lub α-amino-β-hydroksypropionowy lub seryna |
|
|
Kwas 2-amino-3-merkaptopropionowy lub β-merkaptoalanina lub cysteina |
|
|
Kwas 2-amino-3-fenylopropanowy lub β-fenyloalanina lub fenyloalanina |
|
|
Kwas 2-amino-3-(4-hydroksyfenylo)propanowy lub β-(n-hydroksyfenylo)-apanina lub tyrozyna |
|
|
Kwas 2-amino-3-metylobutanowy lub kwas α-aminoizowalerianowy lub walina |
Kwasy monoaminodikarboksylowe
Kwas diamimononokarboksylowy
Klasyfikacja aminokwasów naturalnych
I. Aminokwasy wymienne – mogą być syntetyzowane w organizmie człowieka. Należą do nich między innymi: glicyna, alanina, seryna, cysteina, tyrozyna, kwas asparaginowy i glutaminowy.
II. Niezbędne aminokwasy nie mogą być syntetyzowane w organizmie człowieka i muszą być dostarczane do organizmu w ramach białek pożywienia. Fenyloalanina, walina, lizyna nie są przedstawicielami aminokwasy nieistotne.
Właściwości fizyczne
Większość aminokwasów jest bezbarwna substancje krystaliczne, dobrze rozpuszczalny w wodzie. Wiele aminokwasów ma słodki smak. Temperatury topnienia różnych aminokwasów wahają się od 230-300°C.
Właściwości chemiczne
Aminokwasy są związkami amfoterycznymi, co wynika z obecności w ich cząsteczkach grup funkcyjnych o charakterze kwasowym (-COOH) i zasadowym (-NH 2).
1. Interakcja z bazami

2. Interakcja z kwasami

3. Tworzenie soli wewnętrznych (jonów bipolarnych)
W roztworach wodnych aminokwasy występują w postaci równowagowych mieszanin cząsteczek i jonów bipolarnych, które w środowisku kwaśnym przekształcają się w formę kationową, a w środowisku zasadowym w formę anionową.
a) Kwasy monoaminomonokarboksylowe

Kiedy tworzą się wewnętrzne sole kwasów monoaminomonokarboksylowych, charakter ośrodka nie zmienia się. Dlatego te aminokwasy nazywane są obojętnymi. Całkowity ładunek soli wewnętrznych takich kwasów wynosi zero.
Po dodaniu kwasu (H+) jon karboksylanowy ulega protonowaniu, pozostawiając jedynie dodatni ładunek w grupie -NH
b) Kwasy monoaminodikarboksylowe

Kiedy tworzą się wewnętrzne sole kwasów monoaminodikarboksylowych, powstaje zatem nadmiar jonów wodorowych roztwory wodne kwasy te mają pH
c) Kwasy diamimononokarboksylowe

Kiedy tworzą się sole wewnętrzne kwasów diaminomonokarboksylowych, powstaje nadmiar jonów wodorotlenkowych, przez co ich wodne roztwory mają pH > 7. Takie aminokwasy nazywane są zasadowymi. Całkowity ładunek soli wewnętrznych zasadowych aminokwasów jest dodatni.
4. Tworzenie peptydów
Kiedy grupa karboksylowa jednej cząsteczki aminokwasu oddziałuje z grupą aminową innej cząsteczki aminokwasu, powstają dipeptydy:

Kiedy oddziałują dwa różne aminokwasy, powstaje mieszanina czterech dipeptydów; Na przykład:

Dipeptyd może dodać kolejną cząsteczkę aminokwasu, tworząc tripeptyd. Podobnie tetrapeptyd można otrzymać z tripeptydu itp.
5. Tworzenie pochodnych na grupie karboksylowej
Podobnie jak kwasy karboksylowe, aminokwasy mogą tworzyć estry, chlorki kwasowe itp. Na przykład:

6. Polikondensacja kwasu ε-aminokapronowego

Metody uzyskiwania
1. Amonoliza kwasów α-halokarboksylowych
2. Hydroliza białek
Aminokwasy zawierają grupy aminowe i karboksylowe i wykazują wszystkie właściwości charakterystyczne dla związków z takimi grupami funkcyjnymi. Pisząc reakcje aminokwasów, stosuje się wzory z niezjonizowanymi grupami aminowymi i karboksylowymi.
1) reakcje na grupie aminowej. Grupa aminowa w aminokwasach wykazuje typowe właściwości amin: aminy są zasadami i działają jak nukleofile w reakcjach.
1. Reakcja aminokwasów w postaci zasad. Kiedy aminokwasy wchodzą w interakcję z kwasami, powstają sole amonowe:
chlorowodorek glicyny, sól chlorowodorku glicyny
2. Działanie kwasu azotawego. Kiedy kwas azotawy działa, powstają hydroksykwasy i uwalniany jest azot i woda:
Reakcja ta służy do ilościowego oznaczania wolnych grup aminowych w aminokwasach, a także w białkach.
3. Powstawanie pochodnych N-acylowych, reakcja acylowania.
Aminokwasy reagują z bezwodnikami i halogenkami kwasowymi tworząc N-acylowe pochodne aminokwasów:
Sól sodowa eteru benzylowego N karbobenzoksyglicyna - glicyna chloromrówkowa
Acylowanie jest jednym ze sposobów zabezpieczenia grupy aminowej. Pochodne N-acylowe mają bardzo ważne w syntezie peptydów, ponieważ pochodne N-acylowe łatwo ulegają hydrolizie, tworząc wolną grupę aminową.
4. Tworzenie zasad Schiffa. Kiedy a-aminokwasy oddziałują z aldehydami, na etapie tworzenia karbinoloamin powstają podstawione iminy (zasady Schiffa):
alanina formaldehyd N-metylolowa pochodna alaniny
5. Reakcja alkilowania. Grupa aminowa w a-aminokwasie jest alkilowana, tworząc pochodne N-alkilowe:
Najwyższa wartość reaguje z 2,4 - dinitrofluorobenzenem. Powstałe pochodne dinitrofenylowe (pochodne DNP) wykorzystywane są do ustalania sekwencji aminokwasowej peptydów i białek. Oddziaływanie a-aminokwasów z 2,4-dinitrofluorobenzenem jest przykładem reakcji podstawienia nukleofilowego w pierścieniu benzenowym. Ze względu na obecność w pierścieniu benzenowym dwóch silnych grup odciągających elektrony, halogen staje się mobilny i ulega reakcji podstawienia:
 |
2,4 – dinitro -
fluorobenzen N - 2,4 - dinitrofenylo - a - aminokwas
(DNPB) DNP – pochodne a – aminokwasów
6.Reakcja z izotiocyjanianem fenylu. Reakcja ta jest szeroko stosowana do określania struktury peptydów. Izotiocyjanian fenylu jest pochodną kwasu izotiocyjanowego H-N=C=S. Oddziaływanie a-aminokwasów z izotiocyjanianem fenylu przebiega poprzez mechanizm reakcji addycji nukleofilowej. Powstały produkt ulega następnie wewnątrzcząsteczkowej reakcji podstawienia, prowadzącej do powstania cyklicznego podstawionego amidu: fenylotiohydantoiny.
Związki cykliczne otrzymywane są z wydajnością ilościową i są fenylowymi pochodnymi tiohydantoiny (PTH - pochodne) - aminokwasów. Pochodne PTG różnią się budową rodnika R.
Oprócz zwykłych soli, a-aminokwasy mogą w pewnych warunkach tworzyć sole wewnątrzkompleksowe z kationami metale ciężkie. Wszystkie a-aminokwasy charakteryzują się pięknie krystalizującymi, intensywnie niebieskimi wewnątrzkompleksowymi (chelatowymi) solami miedzi):
Ester etylowy alaniny
Tworzenie estrów jest jedną z metod zabezpieczania grupy karboksylowej w syntezie peptydów.
3. Tworzenie halogenków kwasowych. Działając na a-aminokwasy z zabezpieczoną grupą aminową za pomocą tlenodichlorku siarki (chlorek tionylu) lub trójchlorku tlenku fosforu (tlenochlorek fosforu), powstają chlorki kwasowe:
Produkcja halogenków kwasowych jest jednym ze sposobów aktywacji grupy karboksylowej w syntezie peptydów.
4.Otrzymywanie bezwodników a-aminokwasów. Halogenki kwasowe mają bardzo wysoką zawartość reaktywność, co zmniejsza selektywność reakcji podczas ich stosowania. Dlatego częściej stosowaną metodą aktywacji grupy karboksylowej w syntezie peptydów jest przekształcenie jej w grupę bezwodnikową. Bezwodniki są mniej aktywne niż halogenki kwasowe. Kiedy a-aminokwas posiadający zabezpieczoną grupę aminową oddziałuje z kwasem etylowo-chloromrówkowym (chloromrówczanem etylu), powstaje wiązanie bezwodnikowe:
5. Dekarboksylacja. a - Aminokwasy posiadające dwie grupy odciągające elektrony przy tym samym atomie węgla łatwo ulegają dekarboksylacji. W warunkach laboratoryjnych odbywa się to poprzez ogrzewanie aminokwasów z wodorotlenkiem baru.Reakcja ta zachodzi w organizmie przy udziale enzymów dekarboksylazy z utworzeniem amin biogennych:
ninhydryna
Związek aminokwasów z ciepłem. Podczas ogrzewania a-aminokwasów powstają cykliczne amidy zwane diketopiperazynami:

Diketopiperazyna
g - i d - Aminokwasy łatwo oddzielają się od wody i cyklizują, tworząc wewnętrzne amidy, laktamy:
g - laktam (butyrolaktam)
W przypadkach, gdy grupy aminowe i karboksylowe są oddzielone pięcioma lub więcej atomami węgla, po podgrzaniu następuje polikondensacja z utworzeniem łańcuchów polimeru poliamidowego z eliminacją cząsteczki wody.
Aminokwasy są organiczne związki amfoteryczne. Zawierają w cząsteczce dwie grupy funkcyjne o przeciwstawnym charakterze: grupę aminową o właściwościach zasadowych i grupę karboksylową o właściwościach kwasowych. Aminokwasy reagują zarówno z kwasami, jak i zasadami:
H2N-CH2-COOH + HCl → Cl [H3N-CH2-COOH],
H2N-CH2-COOH + NaOH → H2N-CH2-COONa + H2O.
Kiedy aminokwasy rozpuszczają się w wodzie, grupa karboksylowa usuwa jon wodorowy, który może przyłączyć się do grupy aminowej. W tym przypadku powstaje sól wewnętrzna, której cząsteczką jest jon dwubiegunowy:
H2N-CH2-COOH + H3N-CH2-COO-.
Transformacje kwasowo-zasadowe aminokwasów w różnych środowiskach można przedstawić za pomocą następującego ogólnego diagramu:

Wodne roztwory aminokwasów mają środowisko obojętne, zasadowe lub kwaśne, w zależności od liczby grup funkcyjnych. Zatem kwas glutaminowy tworzy roztwór kwaśny (dwie grupy -COOH, jedna -NH2), lizyna tworzy roztwór zasadowy (jedna grupa -COOH, dwie grupy -NH2).
Tak jak aminy pierwszorzędowe, aminokwasy reagują z kwasem azotawym, a grupa aminowa przekształca się w grupę hydroksylową, a aminokwas w hydroksykwas:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Pomiar objętości uwolnionego azotu pozwala określić ilość aminokwasu ( Metoda Van Slyke’a).
Aminokwasy mogą reagować z alkoholami w obecności gazowego chlorowodoru, zamieniając się w ester(dokładniej w chlorowodorek eteru):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + H 2 O.
Estry aminokwasów nie mają struktury dwubiegunowej i są związkami lotnymi.
Najważniejszą właściwością aminokwasów jest ich zdolność do kondensacji, tworząc peptydy.
Reakcje jakościowe.
1) Wszystkie aminokwasy są utleniane przez ninhydrynę

z powstawaniem produktów w kolorze niebiesko-fioletowym. Iminokwas prolina daje żółty kolor z ninhydryną. Reakcję tę można wykorzystać do ilościowego oznaczania aminokwasów metodą spektrofotometryczną.
2) Podczas ogrzewania aminokwasów aromatycznych ze stężonym kwas azotowy następuje nitrowanie pierścienia benzenowego i powstają zabarwione związki żółty. Ta reakcja nazywa się ksantoproteina(od greckiego xanthos - żółty).
Który odgrywa ważną rolę funkcje biologiczne w organizmach żywych, uczestniczy w biosyntezie białek, odpowiada za prawidłową pracę układu nerwowego i reguluje procesy metaboliczne. Kwas aminooctowy, otrzymywany sztucznie, jest stosowany w farmacji, medycynie i Przemysł spożywczy.
Dodatek do żywności E640 łączy pod jednym numerem na etykiecie kwas aminooctowy (glicynę) i jego sól sodową – związki, które służą optymalizacji smaku i aromatu produktów. Suplement jest bezpieczny i oficjalnie zatwierdzony w większości krajów świata.
Glicyna i jej sól sodowa: informacje ogólne
Glicyna, znana również jako kwas aminooctowy lub aminoetanowy, należy do szeregu aminokwasów egzogennych – najprostszych struktur organicznych wchodzących w skład białek i ich związków. Substancja otrzymywana sztucznie jest bezbarwnym, bezwonnym proszkiem i ma słodkawy smak.
Na skalę przemysłową glicynę wytwarza się przez połączenie kwasu chlorooctowego i amoniaku. Kwas aminooctowy z kolei ma właściwość tworzenia kompleksowych soli (glicynianów) z jonami metali.
Glicynian sodu to sól sodu i kwasu aminooctowego, będąca jednocześnie substancją pochodzenia syntetycznego. Pomimo tego, że glicyna i jej sól to różne związki chemiczne, w przemyśle spożywczym pełnią identyczne funkcje jako modyfikatory smaku i aromatu, są łączone pod jednym numerem etykiety i uznawane są za dodatek E640.
| Nazwa | Glicyna |
|---|---|
| Synonimy | Kwas aminooctowy (aminoetanowy), glikokol (przestarzały) |
| Grupa | Aminokwasy nieistotne |
| Wzór chemiczny | NH2 – CH2 – COOH |
| Struktura | Drobne kryształy jednoskośne (krystaliczny proszek) |
| Kolor | Biały (bezbarwny) |
| Zapach | Nieobecny |
| Smak | Słodki |
| Rozpuszczalność | Całkowicie rozpuszczalny w, częściowo rozpuszczalny w. Nie rozpuszcza się w eterze |
| Kod dodatku | E640 (w tym sól sodowa) |
| Pochodzenie | Syntetyczny |
| Toksyczność | Bezpieczny przy spożyciu w normalnych granicach |
| Obszary zastosowań | Przemysł spożywczy, farmaceutyczny, medyczny, kosmetyczny |
Biologiczna rola glicyny i jej źródła
Glicyna występuje w cząsteczkach białek znacznie częściej niż inne aminokwasy i pełni ważne funkcje biologiczne. W organizmie człowieka aminokwas ten syntetyzowany jest poprzez transaminację (odwracalne przeniesienie grupy aminowej) glioksylanu lub enzymatyczne rozszczepienie choliny i seryny.
Kwas aminooctowy jest prekursorem porfiryn i puryn, których biosynteza zachodzi w żywych komórkach, jednak rola biologiczna To połączenie nie ogranicza się do tych funkcji. Glicyna jest także neuroprzekaźnikiem biorącym udział w przekazywaniu impulsów nerwowych, reguluje produkcję innych aminokwasów oraz działa „hamująco” na neurony i neurony ruchowe.
Organizm zdrowego człowieka samodzielnie syntetyzuje aminokwasy w wymaganej ilości, dlatego z reguły nie ma potrzeby ich stosowania w lekach i suplementach diety. Źródłami kwasu aminooctowego są produkty pochodzenia zwierzęcego (wątroba wołowa), orzechy i niektóre owoce.
Wpływ glicyny i jej soli sodowej na organizm człowieka
Kwas aminooctowy jako neuroprzekaźnik pełni funkcje regulacyjne i oddziałuje przede wszystkim na ośrodkowy i obwodowy układ nerwowy. Glicyna ma właściwości nootropowe, normalizuje metabolizm, aktywuje funkcje ochronne ośrodkowego układu nerwowego i działa łagodnie uspokajająco.
Pozytywny wpływ glicyny na organizm ludzki:
- redukcja napięcia emocjonalnego, lęku, stresu, agresywności;
- poprawa nastroju i normalizacja snu;
- rozluźnienie mięśni i złagodzenie skurczów;
- zwiększona wydajność;
- osłabiający skutki uboczne przyjmowanie leków psychotropowych;
- zmniejszenie nasilenia zaburzeń wegetatywno-naczyniowych;
- zmniejszenie ochoty na alkohol i słodycze.
W ramach suplementu E640 glicyna i jej sól nie mają powyższych właściwości i nie mają ani pozytywnego, ani negatywnego wpływu na organizm ludzki, jeśli są spożywane w normalnych granicach. Dodatek do żywności nie stwarza zagrożenia dla zdrowia, jednak w przypadku indywidualnej nietolerancji może wywołać reakcję alergiczną.
Potencjalne zagrożenia mogą wynikać z zanieczyszczeń w dodatkach oraz niskiej jakości produktów spożywczych, do produkcji których stosuje się optymalizatory smaku i aromatu.
Zastosowanie glicyny i jej soli sodowej
Zastosowanie glicyny i glicynianu sodu ogranicza się głównie do przemysłu spożywczego, medycyny i farmaceutyki. Kwas aminooctowy znalazł jednak zastosowanie także w przemyśle kosmetycznym ze względu na swoją hipoalergiczność i działanie antyoksydacyjne.
Kosmetyki zawierające dodatek E640:
- lecznicze szampony do włosów osłabionych i produkty przeciw łysieniu;
- kosmetyki przeciwstarzeniowe, kremy i maseczki nawilżające do każdego rodzaju skóry;
- Oczyszczające serum i toniki;
- szminki i balsamy.
Z pokruszonych tabletek glicyny można przygotować domowe produkty do pielęgnacji skóry oraz dodać je do nawilżających maseczek i kremów. Kwas aminooctowy sprzyja przenikaniu cennych składników odżywczych do głębokich warstw skóry właściwej i wzmacnia działanie kosmetyków leczniczych.
Dodatek E640 w przemyśle spożywczym
 Aktywnie wykorzystuje się glicynę i glicynian sodu procesy technologiczne produkcja napojów alkoholowych. W elitarnej wódce znajduje się zwłaszcza dodatek E640, który pomaga zneutralizować nieprzyjemny zapach i złagodzić ostry smak. Istnieje również opinia, że obecność glicyny w napojach alkoholowych pomaga zmniejszyć toksyczne działanie alkoholu na układ nerwowy i zapobiega kacowi.
Aktywnie wykorzystuje się glicynę i glicynian sodu procesy technologiczne produkcja napojów alkoholowych. W elitarnej wódce znajduje się zwłaszcza dodatek E640, który pomaga zneutralizować nieprzyjemny zapach i złagodzić ostry smak. Istnieje również opinia, że obecność glicyny w napojach alkoholowych pomaga zmniejszyć toksyczne działanie alkoholu na układ nerwowy i zapobiega kacowi.
Produkty spożywcze zawierające dodatek E640:
- mocne napoje alkoholowe;
- dżemy, konfitury, galaretki, ;
- soki pakowane z miąższem;
- wzbogacone gotowanie;
- napoje wzbogacane dla sportowców;
- sosy, przyprawy i przyprawy.
Kwas aminooctowy służy nie tylko optymalizacji smaku i transportu biologicznego substancje czynne ale także jako środek antybakteryjny. W szczególności stosuje się go do obróbki mięsa, ryb i owoców morza w celu neutralizacji niebezpiecznej bakterii E. coli.
Zastosowanie medyczne
Glicyna jest aktywnie stosowana w leczeniu i zapobieganiu chorobom związanym z ośrodkowym i obwodowym system nerwowy. Substancja ta wchodzi w skład preparatów farmaceutycznych o działaniu nootropowym, uspokajającym, przeciwdrgawkowym i nasennym oraz ma łagodne działanie przeciwdepresyjne i uspokajające.
Wskazania medyczne do stosowania kwasu aminooctowego jako leku:
- obniżona sprawność umysłowa, zaburzenia snu i pamięci;
- napięcie emocjonalne, sytuacje stresowe, nerwice;
- niestabilność emocjonalna i zwiększona pobudliwość;
- konsekwencje udaru niedokrwiennego, urazowego uszkodzenia mózgu i neuroinfekcji;
- dystonia wegetatywno-naczyniowa, niedokrwienie;
- zwiększone napięcie mięśni, skurcze mięśni;
- uzależnienie od alkoholu i narkotyków, toksyczne działanie leków hamujących centralny układ nerwowy.
Udowodniono, że spożywanie 3 g glicyny dziennie korzystnie wpływa na zdolności umysłowe i ogólny stan emocjonalny człowieka, łagodzi senność w ciągu dnia i normalizuje sen nocny. Lek przepisywany jest także kobietom w ciąży w celu zmniejszenia lęku, dzieciom i młodzieży doświadczającej trudności z adaptacją społeczną i koncentracją.
Dodatek E640 i ustawodawstwo
Optymalizator smaku i zapachu E640 jest stosowany w produkcji żywności w większości krajów świata, jednak w Kodeksie Żywnościowym nie ma informacji o dodatku. Nie odnotowano przypadków zatrucia glicyną i glicynianem sodu przy spożyciu w formie spożywczej, dlatego modyfikator E640 uznawany jest za bezpieczny.
Dodatek znajduje się na liście produktów oficjalnie dopuszczonych do stosowania w przemyśle spożywczym na terenie Unii Europejskiej, USA i Kanady. Ustawodawstwo Federacja Rosyjska i Białoruś dopuszcza także obecność E640 w produktach w ramach dopuszczalnych norm ustalonych przez SanPiN. Brak danych na temat stosowania E640 jako wzmacniacza smaku i środka aromatyzującego na Ukrainie.
Pomimo tego, że glicyna i jej sól nie działają toksycznie na organizm ludzki i są dopuszczone do stosowania, produkty zawierające E640 trudno nazwać użytecznymi. Większość środków aromatyzujących ma na celu zwrócenie uwagi kupującego na produkty niskiej jakości, których użycie należy minimalizować.
Glicyna (kwas aminooctowy, glikokol, Gly, G)
H2NCH2COOH
Masa cząsteczkowa 75,07; bezbarwne kryształy; topić się 232-236°C (z rozkładem); dobrze rozpuszczalny w wodzie, nierozpuszczalny w większości rozpuszczalników organicznych. W temperaturze 25°C str Ka 2,34 (COOH) i 9,6 (NH2); R I 5,97.
Pod względem właściwości chemicznych glicyna jest typowym alifatycznym α-aminokwasem. Oznaczenie ilościowe opiera się na tworzeniu barwnych produktów z aldehydem o-ftalowym (reakcja Zimmermanna). Występuje częściej w białkach niż w innych aminokwasach. Służy jako prekursor w biosyntezie związków porfirynowych i zasad purynowych. Glicyna jest kodowanym aminokwasem, nieistotnym; jego biosynteza odbywa się poprzez transaminację kwasu glioksylowego, enzymatyczne rozszczepienie seryny i treoniny. Licynę syntetyzuje się z kwasu chlorooctowego i NH3. W widmie NMR w D2O przesunięcie chemiczne protonów grupy CH2 wynosi 3,55 ppm. Wewnętrzna sól glicyny (CH 3) 3 + NCH 2 COO nazywa się betainą.
Glicyna stosowana jest do syntezy peptydów jako składnik roztwory buforowe zmieszany z innymi aminokwasami – do żywienia pozajelitowego.