Tak naprawdę autor RTCh w swoich „refleksjach” posunął się tak daleko, że czas sprowokować mocną kontrargumentację, a mianowicie dane z eksperymentu japońskich naukowców polegającego na fotografowaniu atomu wodoru, o którym zrobiło się głośno 4 listopada , 2010. Zdjęcie wyraźnie ukazuje kształt atomu, potwierdzając zarówno dyskretność, jak i okrągłość atomów: „Grupa naukowców i specjalistów z Uniwersytetu Tokijskiego po raz pierwszy na świecie sfotografowała pojedynczy atom wodoru – najlżejszy i najmniejszy ze wszystkich atomów, donoszą agencje informacyjne.
Zdjęcie zostało zrobione przy użyciu jednego z najnowsze technologie– skanowanie specjalne mikroskop elektronowy. Za pomocą tego urządzenia sfotografowano oddzielny atom wanadu wraz z atomem wodoru.
Średnica atomu wodoru wynosi jedną dziesięciomiliardową metra. Wcześniej sądzono, że zrobienie mu zdjęcia nowoczesny sprzęt Prawie niemożliwe. Wodór jest najpowszechniejszą substancją. Jego udział w całym Wszechświecie wynosi około 90%.
Zdaniem naukowców w ten sam sposób można wychwycić inne cząstki elementarne. „Teraz możemy zobaczyć wszystkie atomy tworzące nasz świat” – powiedział profesor Yuichi Ikuhara. „To przełom w kierunku nowych form produkcji, kiedy w przyszłości będzie można podejmować decyzje na poziomie pojedynczych atomów i cząsteczek”.

Atom wodoru, kolory względne
http://prl.aps.org/abstract/PRL/v110/i21/e213001
Grupa naukowców z Niemiec, Grecji, Holandii, USA i Francji wykonała zdjęcia atomu wodoru. Obrazy te, uzyskane za pomocą mikroskopu fotojonizacyjnego, pokazują rozkład gęstości elektronowej w pełni zgodny z wynikami obliczeń teoretycznych. Prace międzynarodowego zespołu prezentowane są na łamach Physical Review Letters.
Istotą metody fotojonizacji jest sekwencyjna jonizacja atomów wodoru, czyli usunięcie z nich elektronu w wyniku napromieniowania elektromagnetycznego. Oddzielone elektrony kierowane są do czułej matrycy poprzez dodatnio naładowany pierścień, a położenie elektronu w momencie zderzenia z matrycą odzwierciedla położenie elektronu w momencie jonizacji atomu. Naładowany pierścień, który odchyla elektrony na bok, działa jak soczewka i za jego pomocą obraz jest powiększany miliony razy.
Metodę tę, opisaną w 2004 roku, stosowano już do wykonywania „zdjęć” pojedynczych cząsteczek, jednak fizycy poszli dalej i wykorzystali mikroskop fotojonizacyjny do badania atomów wodoru. Ponieważ uderzenie jednego elektronu wytwarza tylko jeden punkt, badacze zgromadzili około 20 tysięcy pojedynczych elektronów z różnych atomów i stworzyli uśredniony obraz powłok elektronowych.
Zgodnie z prawami mechaniki kwantowej elektron w atomie sam w sobie nie zajmuje żadnego określonego położenia. Tylko wtedy, gdy atom oddziałuje ze środowiskiem zewnętrznym, elektron pojawia się z takim czy innym prawdopodobieństwem w pewnym sąsiedztwie jądra atomowego: obszar, w którym prawdopodobieństwo wykrycia elektronu jest największe, nazywa się powłoka elektronowa. Nowe obrazy pokazują różnice pomiędzy atomami o różnych stanach energetycznych; Naukowcom udało się wyraźnie zademonstrować kształt powłok elektronowych przewidywany przez mechanikę kwantową.
Za pomocą innych instrumentów, skaningowych mikroskopów tunelowych, poszczególne atomy można nie tylko zobaczyć, ale także przenieść do Właściwe miejsce. Około miesiąc temu technika ta umożliwiła inżynierom IBM narysowanie kreskówki, której każda klatka składa się z atomów: takie eksperymenty artystyczne nie mają żadnego praktycznego efektu, ale pokazują podstawową możliwość manipulowania atomami. Do celów użytkowych nie stosuje się już składania atomowego, lecz procesy chemiczne z samoorganizacją nanostruktur lub samoograniczeniem wzrostu warstw jednoatomowych na podłożu.
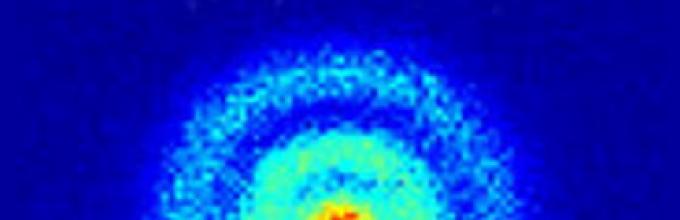
Na tym zdjęciu patrzysz na pierwszy bezpośredni obraz orbit elektronu wokół atomu - w rzeczywistości funkcję falową atomu!
Aby otrzymać zdjęcie struktura orbity atom wodoru badacze wykorzystali najnowszy mikroskop kwantowy – niesamowite urządzenie, które pozwala naukowcom zajrzeć w ten region Fizyka kwantowa.
Orbitalną strukturę przestrzeni w atomie zajmuje elektron. Jednak aby opisać te mikroskopijne właściwości materii, naukowcy opierają się na funkcjach falowych – matematycznych sposobach opisywania stanów kwantowych cząstek – a mianowicie na tym, jak zachowują się one w przestrzeni i czasie.
Z reguły w fizyce kwantowej do opisu stanów cząstek stosuje się wzory takie jak równanie Schrödingera.
Przeszkody na drodze badaczy
Do tej pory naukowcy tak naprawdę nigdy nie zaobserwowali funkcji falowej. Próba uchwycenia dokładnego położenia lub pędu pojedynczego elektronu była jak próba złapania roju much. Bezpośrednie obserwacje zostały zniekształcone przez bardzo nieprzyjemne zjawisko - spójność kwantową.
Aby zmierzyć wszystkie stany kwantowe, potrzebne jest narzędzie, które może dokonać wielokrotnych pomiarów stanów cząstki w czasie.
Ale jak zwiększyć i tak już mikroskopijny stan cząstki kwantowej? Odpowiedź znalazła grupa międzynarodowych badaczy. Korzystanie z mikroskopu kwantowego – urządzenia wykorzystującego fotojonizację do bezpośredniej obserwacji struktur atomowych.
W swoim artykule w popularnym czasopiśmie Physical Review Letters pracuje w instytucie Aneta Stodolna fizyka molekularna(AMOLF) w Holandii opisuje, w jaki sposób ona i jej zespół uzyskali struktury węzłowych orbitali elektronowych atomu wodoru umieszczonego w statycznym polu elektrycznym.

Metoda pracy
Po naświetleniu impulsami lasera zjonizowane elektrony opuściły swoje orbity i po zmierzonej trajektorii wpadły do detektora 2D (podwójnej płytki mikrokanałowej. Detektor jest umieszczony prostopadle do samego pola). Istnieje wiele trajektorii, po których elektrony mogą podróżować przed zderzeniem z detektorem. Zapewnia to badaczom zestaw wzorców interferencji – modeli odzwierciedlających strukturę węzłową funkcji falowej.
Naukowcy zastosowali soczewkę elektrostatyczną, która powiększa wychodzącą falę elektronów ponad 20 000 razy.

Trurl zaczął wyłapywać atomy, zdrapywać z nich elektrony, ugniatać protony, aż same palce migotały, przygotował ciasto protonowe, ułożył wokół niego elektrony i - dla następnego atomu; Nie minęło nawet pięć minut, jak trzymał w dłoniach blok czystego złota: podał go do pyska, a ona, przymierzając blok na zębie i kiwając głową, powiedziała:
- I rzeczywiście jest to złoto, ale ja nie umiem tak gonić za atomami. Jestem za duży.
- Nie ma problemu, damy Ci specjalne urządzenie! - Trurl go przekonał.
Stanisław Lem, Cyberiada
Czy można za pomocą mikroskopu zobaczyć atom, odróżnić go od innego atomu, zaobserwować rozpad lub powstawanie wiązania chemicznego i zobaczyć, jak jedna cząsteczka przekształca się w drugą? Tak, jeśli nie jest to zwykły mikroskop, ale mikroskop sił atomowych. I nie musisz ograniczać się do obserwacji. Żyjemy w czasach, gdy mikroskop sił atomowych nie jest już tylko oknem na mikroświat. Dziś tym urządzeniem można przenosić atomy, niszczyć wiązania chemiczne, badając granicę rozciągania pojedynczych cząsteczek, a nawet badając ludzki genom.
Litery wykonane z pikseli ksenonowych
Przyglądanie się atomom nie zawsze było takie łatwe. Historia mikroskopu sił atomowych rozpoczęła się w 1979 roku, kiedy Gerd Karl Binnig i Heinrich Rohrer pracujący w Centrum Badawczym IBM w Zurychu rozpoczęli tworzenie instrumentu, który umożliwiłby badanie powierzchni z rozdzielczością atomową. Aby wymyślić takie urządzenie, naukowcy postanowili wykorzystać efekt tunelowania – zdolność elektronów do pokonywania pozornie nieprzeniknionych barier. Pomysł polegał na określeniu położenia atomów w próbce poprzez pomiar siły prądu tunelowego powstającego pomiędzy sondą skanującą a badaną powierzchnią.
Binnigowi i Rohrerowi się to udało i przeszli do historii jako wynalazcy skaningowego mikroskopu tunelowego (STM), a w 1986 roku otrzymali Nagrodę Nobla w dziedzinie fizyki. Skaningowy mikroskop tunelowy dokonał prawdziwej rewolucji w fizyce i chemii.
W 1990 roku Don Eigler i Erhard Schweitzer pracujący w Centrum Badawczym IBM w Kalifornii wykazali, że STM można używać nie tylko do obserwacji atomów, ale także do manipulowania nimi. Za pomocą sondy skaningowego mikroskopu tunelowego stworzyli chyba najpopularniejszy obraz symbolizujący przejście chemików do pracy z pojedynczymi atomami - namalowali trzy litery na powierzchni niklu z 35 atomami ksenonu (ryc. 1).
Binnig nie spoczął na laurach – w roku, który otrzymał nagroda Nobla Razem z Christopherem Gerberem i Kelvinem Quaite, pracującym także w IBM Zurich Research Center, rozpoczął prace nad kolejnym urządzeniem do badania mikroświata, pozbawionym wad nieodłącznie związanych z STM. Faktem jest, że za pomocą skaningowego mikroskopu tunelowego nie można było badać powierzchni dielektrycznych, a jedynie przewodników i półprzewodników, a do analizy tych ostatnich konieczne było wytworzenie znacznej próżni między nimi a sondą mikroskopu. Zdając sobie sprawę, że stworzenie nowego urządzenia było łatwiejsze niż modernizacja istniejącego, Binnig, Gerber i Quaite wynaleźli mikroskop sił atomowych, w skrócie AFM. Zasada jego działania jest radykalnie inna: aby uzyskać informacje o powierzchni, mierzą nie siłę prądu powstającą między sondą mikroskopu a badaną próbką, ale wartość sił przyciągania powstających między nimi, czyli słabych oddziaływania niechemiczne - siły van der Waalsa.
Pierwszy działający model AFM był stosunkowo prosty. Badacze przesuwali po powierzchni próbki sondę diamentową połączoną z elastycznym czujnikiem mikromechanicznym - wspornikiem wykonanym ze złotej folii (przyciąganie powstaje pomiędzy sondą a atomem, wspornik ugina się w zależności od siły przyciągania i odkształca piezoelektryk). . Stopień wygięcia wspornika określono za pomocą czujników piezoelektrycznych – w podobny sposób, w jaki rowki i grzbiety płyty winylowej przetwarzane są na zapis audio. Konstrukcja mikroskopu sił atomowych umożliwiła wykrycie sił przyciągania o wartości do 10–18 niutonów. Rok po stworzeniu działającego prototypu badaczom udało się uzyskać obraz topografii powierzchni grafitu z rozdzielczością 2,5 angstremów.
W ciągu trzech dekad, jakie minęły od tego czasu, AFM zaczęto badać niemal każdy obiekt chemiczny – od powierzchni materiału ceramicznego po żywe komórki i pojedyncze cząsteczki, zarówno w stanie statycznym, jak i dynamicznym. Mikroskopia sił atomowych stała się głównym narzędziem chemików i materiałoznawców, a liczba badań wykorzystujących tę metodę stale rośnie (ryc. 2).
Na przestrzeni lat badacze wybrali warunki do kontaktowego i bezkontaktowego badania obiektów za pomocą mikroskopii sił atomowych. Metoda kontaktu została opisana powyżej i opiera się na interakcji van der Waalsa pomiędzy wspornikiem a powierzchnią. Podczas pracy w trybie bezdotykowym piezowibrator wzbudza oscylacje sondy z określoną częstotliwością (najczęściej rezonansową). Siła wywierana przez powierzchnię powoduje zmianę zarówno amplitudy, jak i fazy oscylacji sondy. Pomimo pewnych wad metody bezkontaktowej (przede wszystkim wrażliwości na hałas zewnętrzny), eliminuje ona wpływ sondy na badany obiekt, dlatego jest bardziej interesująca dla chemików.
Żywy na sondach, w pogoni za kontaktami
Mikroskopia sił atomowych stała się bezkontaktowa w 1998 roku dzięki pracom ucznia Binniga, Franza Josefa Gissibla. To on zaproponował zastosowanie jako wspornika kwarcowego oscylatora odniesienia o stabilnej częstotliwości. 11 lat później badacze z laboratorium IBM w Zurychu podjęli się kolejnej modyfikacji bezkontaktowego AFM: rolę sondy czujnikowej nie pełnił ostry kryształ diamentu, ale pojedyncza cząsteczka – tlenek węgla. Umożliwiło to przejście do rozdzielczości subatomowej, co wykazał Leo Gross z oddziału IBM w Zurychu. W 2009 roku za pomocą AFM uwidocznił nie atomy, a wiązania chemiczne, uzyskując w miarę wyraźny i jednoznacznie czytelny „obraz” cząsteczki pentacenu (ryc. 3; Nauka, 2009, 325, 5944, 1110–1114, doi: 10.1126/science.1176210).

Przekonany, że wiązania chemiczne można zobaczyć za pomocą AFM, Leo Gross zdecydował się pójść dalej i użyć mikroskopu sił atomowych do pomiaru długości i kolejności wiązań – parametrów kluczowych do zrozumienia struktura chemiczna, a co za tym idzie, właściwości substancji.
Przypomnijmy, że wskazuje na to różnica w kolejności połączeń różne znaczenia gęstość elektronów i różne odległości międzyatomowe między dwoma atomami (w uproszczeniu wiązanie podwójne jest krótsze niż wiązanie pojedyncze). W etanie kolejność wiązań węgiel-węgiel wynosi jeden, w etylenie dwa, a w klasycznej cząsteczce aromatycznej benzenie kolejność wiązań węgiel-węgiel jest większa niż jeden, ale mniejsza niż dwa i przyjmuje się, że wynosi 1,5.
Określenie kolejności wiązań jest znacznie trudniejsze w przypadku przejścia od prostych układów aromatycznych do płaskich lub masowych polikondensowanych układów cyklicznych. Zatem kolejność wiązań w fulerenach składających się ze skondensowanych pięcio- i sześcioczłonowych pierścieni węglowych może przyjmować dowolną wartość od jednego do dwóch. Ta sama niepewność jest teoretycznie nieodłączna w przypadku wielopierścieniowych związków aromatycznych.
W 2012 roku Leo Gross wraz z Fabianem Mohnem wykazali, że mikroskop sił atomowych z bezkontaktową sondą metalową modyfikowaną tlenkiem węgla może mierzyć różnice w rozkładzie ładunków atomów oraz odległości międzyatomowe – czyli parametry związane z porządkiem wiązań ( Nauka, 2012, 337, 6100, 1326–1329, doi: 10.1126/science.1225621).
W tym celu zbadali dwa rodzaje wiązań chemicznych w fulerenie – wiązanie węgiel-węgiel, wspólne dla dwóch sześcioczłonowych pierścieni zawierających węgiel fulerenu C60 oraz wiązanie węgiel-węgiel, wspólne dla pięcio- i sześcioczłonowych pierścieni -pierścienie członowe. Mikroskop sił atomowych wykazał, że kondensacja pierścieni sześcioczłonowych tworzy wiązanie krótsze i bardziej uporządkowane niż kondensacja cyklicznych fragmentów C6 i C5. Badanie cech wiązań chemicznych w heksabenzokoronenie, gdzie sześć kolejnych pierścieni C 6 jest symetrycznie rozmieszczonych wokół centralnego pierścienia C 6, potwierdziło wyniki kwantowego modelowania chemicznego, zgodnie z którym kolejność Połączenia CC pierścień centralny (na ryc. 4 litera I) musi być większa niż wiązania łączące ten pierścień z cyklami obwodowymi (na ryc. 4 litera J). Podobne wyniki uzyskano dla bardziej złożonego wielopierścieniowego węglowodoru aromatycznego zawierającego dziewięć pierścieni sześcioczłonowych.
Rządy wiązań i odległości międzyatomowe były oczywiście przedmiotem zainteresowania chemików organicznych, ale były ważniejsze dla tych, którzy pracowali nad teorią wiązań chemicznych, przewidywaniem reaktywność i badanie mechanizmów reakcji chemicznych. Jednak zarówno chemików syntetycznych, jak i specjalistów zajmujących się badaniem struktury związków naturalnych czekała niespodzianka: okazało się, że mikroskop sił atomowych można wykorzystać do określenia struktury cząsteczek w taki sam sposób, jak spektroskopia NMR czy IR. Co więcej, daje jasną odpowiedź na pytania, z którymi metody te nie są w stanie sobie poradzić.
Od fotografii do kina
W 2010 roku tym samym Leo Grossowi i Rainerowi Ebelowi udało się jednoznacznie ustalić strukturę naturalnego związku – cefalandolu A, wyizolowanego z bakterii Dermacoccus abyssi(Chemia Przyrody, 2010, 2, 821–825, doi: 10.1038/nchem.765). Skład cefalandolu A ustalono wcześniej za pomocą spektrometrii masowej, jednak analiza widm NMR tego związku nie dała jednoznacznej odpowiedzi na pytanie o jego strukturę: możliwe były cztery opcje. Za pomocą mikroskopu sił atomowych badacze natychmiast wyeliminowali dwie z czterech struktur i dwie pozostałe właściwy wybór dokonano poprzez porównanie wyników uzyskanych za pomocą symulacji AFM i chemii kwantowej. Zadanie okazało się trudne: w przeciwieństwie do pentacenu, fulerenów i koronenów, cefalandol A zawiera nie tylko atomy węgla i wodoru, dodatkowo cząsteczka ta nie ma płaszczyzny symetrii (ryc. 5) - ale i ten problem został rozwiązany.

Kolejne potwierdzenie możliwości wykorzystania mikroskopu sił atomowych jako narzędzia analitycznego uzyskano w grupie Oscara Kustanzy, pracującego wówczas w Szkoła inżynierska Uniwersytet w Osace. Pokazał, jak za pomocą AFM rozróżnić atomy różniące się od siebie znacznie mniej niż węgiel i wodór ( Natura, 2007, 446, 64–67, doi: 10.1038/nature05530). Kustant zbadał powierzchnię stopu składającego się z krzemu, cyny i ołowiu o znanej zawartości każdego pierwiastka. W wyniku licznych eksperymentów odkrył, że siła powstająca pomiędzy końcówką sondy AFM a różne atomy, jest różny (ryc. 6). Przykładowo najsilniejszą interakcję zaobserwowano podczas sondowania krzemu, a najsłabszą podczas sondowania ołowiu.

Zakłada się, że w przyszłości wyniki mikroskopii sił atomowych do rozpoznawania poszczególnych atomów będą przetwarzane w taki sam sposób, jak wyniki NMR – poprzez porównywanie wartości względnych. Ponieważ dokładny skład igły czujnika jest trudny do kontrolowania, wartość bezwzględna siły pomiędzy czujnikiem a różne atomy powierzchnia zależy od warunków eksperymentalnych i marki urządzenia, ale stosunek tych sił dla dowolnego składu i kształtu czujnika pozostaje stały dla każdego pierwiastek chemiczny.
W 2013 roku pojawiły się pierwsze przykłady wykorzystania AFM do uzyskiwania obrazów poszczególnych cząsteczek przed i po reakcjach chemicznych: z produktów i półproduktów reakcji tworzony jest „fotoset”, który można następnie osadzić w swego rodzaju film dokumentalny (Nauka, 2013, 340, 6139, 1434–1437; doi: 10.1126/science.1238187).
Felix Fischer i Michael Crommie z Uniwersytetu Kalifornijskiego w Berkeley nałożyli na powierzchnię srebro 1,2-bis[(2-etynylofenylo)etynylo]benzen, zobrazował cząsteczki i podgrzał powierzchnię, aby zainicjować cyklizację. Połowa oryginalnych cząsteczek przekształciła się w policykliczne struktury aromatyczne składające się ze skondensowanych pięciu pierścieni sześcioczłonowych i dwóch pięcioczłonowych. Kolejna czwarta cząsteczek utworzyła struktury składające się z czterech pierścieni sześcioczłonowych połączonych jednym pierścieniem czteroczłonowym i dwoma pierścieniami pięcioczłonowymi (ryc. 7). Pozostałe produkty to struktury oligomeryczne i, w mniejszych ilościach, izomery policykliczne.
Wyniki te dwukrotnie zaskoczyły badaczy. Po pierwsze, podczas reakcji powstały tylko dwa główne produkty. Po drugie, zaskakująca była ich konstrukcja. Fischer zauważa, że chemiczna intuicja i doświadczenie umożliwiły narysowanie dziesiątek możliwe produkty reakcje, ale żadna z nich nie odpowiadała związkom, które utworzyły się na powierzchni. Możliwe, że zachodzeniu nietypowych procesów chemicznych sprzyjało oddziaływanie substancji wyjściowych z podłożem.
Naturalnie, po pierwszych poważnych sukcesach w badaniu wiązań chemicznych, część badaczy zdecydowała się wykorzystać AFM do obserwacji słabszych i mniej zbadanych oddziaływań międzycząsteczkowych, w szczególności wiązań wodorowych. Jednak prace w tym obszarze dopiero się rozpoczynają, a wyniki są sprzeczne. Dlatego też niektóre publikacje podają, że mikroskopia sił atomowych umożliwiła obserwację wiązań wodorowych ( Nauka, 2013, 342, 6158, 611–614, doi: 10.1126/science.1242603), inni twierdzą, że są to jedynie artefakty wynikające z cech konstrukcyjnych urządzenia, a inni wyniki eksperymentalne należy interpretować ostrożniej ( Listy z przeglądu fizycznego, 2014, 113, 186102, doi: 10.1103/PhysRevLett.113.186102). Być może ostateczna odpowiedź na pytanie, czy wodór i inne oddziaływania międzycząsteczkowe można obserwować za pomocą mikroskopii sił atomowych, uzyskamy już w tej dekadzie. Aby to zrobić, należy przynajmniej kilkukrotnie zwiększyć rozdzielczość AFM i nauczyć się uzyskiwać obrazy bez zakłóceń ( Przegląd fizyczny B, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421).
Synteza pojedynczych cząsteczek
W w zdolnych rękach Zarówno STM, jak i AFM przekształcają się z urządzeń zdolnych do badania materii w urządzenia zdolne do celowej zmiany struktury materii. Za pomocą tych urządzeń udało się już uzyskać „najmniejsze”. laboratoria chemiczne", w którym zamiast kolby stosuje się nośnik, a zamiast moli lub milimoli reagentów stosuje się pojedyncze cząsteczki.
Na przykład w 2016 roku grupa międzynarodowa Naukowcy pod kierownictwem Takashiego Kumagai wykorzystali bezkontaktową mikroskopię sił atomowych do przekształcenia cząsteczki porficenu z jednej postaci w drugą ( Chemia Przyrody, 2016, 8, 935–940, doi: 10.1038/nchem.2552). Porficen można uznać za modyfikację porfiryny, której wewnętrzny pierścień zawiera cztery atomy azotu i dwa atomy wodoru. Wibracje sondy AFM przekazały cząsteczce porficenu wystarczającą ilość energii, aby przenieść te wodory z jednego atomu azotu na drugi, w wyniku czego powstało „odbicie lustrzane” tej cząsteczki (ryc. 8).

Zespół kierowany przez niestrudzonego Leo Grossa pokazał także, że możliwe jest zainicjowanie reakcji pojedynczej cząsteczki – przekształcił dibromomantracen w dziesięcioczłonowy cykliczny diyn (ryc. 9; Chemia Przyrody, 2015, 7, 623–628, doi: 10.1038/nchem.2300). W przeciwieństwie do Kumagai i wsp. do aktywacji cząsteczki użyli skaningowego mikroskopu tunelowego, a wynik reakcji monitorowano za pomocą mikroskopu sił atomowych.

Łączne zastosowanie skaningowego mikroskopu tunelowego i mikroskopu sił atomowych umożliwiło nawet otrzymanie cząsteczki, której nie da się zsyntetyzować klasycznymi technikami i metodami ( Nanotechnologia natury, 2017, 12, 308–311, doi: 10.1038/nnano.2016.305). Jest to triangulen, niestabilny dirodnik aromatyczny, którego istnienie przewidywano sześć dekad temu, ale wszelkie próby syntezy zakończyły się niepowodzeniem (ryc. 10). Chemicy z grupy Niko Pavliceka uzyskali pożądany związek poprzez usunięcie dwóch atomów wodoru z jego prekursora za pomocą STM i potwierdzenie wyniku syntezy za pomocą AFM.

Przyjmuje się, że liczba prac poświęconych wykorzystaniu mikroskopii sił atomowych w Chemia organiczna, nadal będzie rosnąć. Obecnie coraz więcej naukowców próbuje odtworzyć na powierzchni reakcje dobrze znane z „chemii roztworów”. Być może jednak chemicy zajmujący się syntezą zaczną odtwarzać w roztworze reakcje, które pierwotnie przeprowadzano na powierzchni za pomocą AFM.
Od nieożywionego do żywego
Wsporniki i sondy mikroskopów sił atomowych można wykorzystać nie tylko do badań analitycznych czy syntezy egzotycznych cząsteczek, ale także do rozwiązywania stosowane problemy. Znane są już przypadki wykorzystania AFM w medycynie np. do wczesnej diagnostyki nowotworów i tutaj pionierem jest ten sam Christopher Gerber, który miał swój udział w opracowaniu zasady mikroskopii sił atomowych i powstaniu AFM.
W ten sposób Gerberowi udało się nauczyć AFM wykrywania mutacji punktowych kwas rybonukleinowy na czerniaka (na materiale uzyskanym w wyniku biopsji). W tym celu złoty wspornik mikroskopu sił atomowych zmodyfikowano oligonukleotydami, które mogą wchodzić w interakcje międzycząsteczkowe z RNA, a siłę tego oddziaływania można również mierzyć dzięki efektowi piezoelektrycznemu. Czułość czujnika AFM jest na tyle wysoka, że już próbują go wykorzystać do badania skuteczności popularnej metody edycji genomu CRISPR-Cas9. Tutaj spotykają się technologie tworzone przez różne pokolenia badaczy.
Parafrazując klasyka jednej z teorii politycznych, można powiedzieć, że widzimy już nieograniczone możliwości i niewyczerpanie mikroskopii sił atomowych i nie jesteśmy w stanie sobie wyobrazić, co nas czeka w związku z dalszym rozwojem tych technologii. Jednak obecnie skaningowe mikroskopy tunelowe i mikroskopy sił atomowych dają nam możliwość zobaczenia i dotknięcia atomów. Można powiedzieć, że to nie tylko przedłużenie naszych oczu, pozwalające zajrzeć w mikrokosmos atomów i cząsteczek, ale także nowe oczy, nowe palce, zdolne dotykać i kontrolować ten mikrokosmos.
Jednak sfotografowanie samego atomu, a nie jakiejkolwiek jego części, wydawało się zadaniem niezwykle trudnym, nawet przy użyciu najnowocześniejszych urządzeń.
Faktem jest, że zgodnie z prawami mechaniki kwantowej nie da się równie dokładnie określić wszystkich właściwości cząstki subatomowej. Ta gałąź fizyki teoretycznej opiera się na zasadzie nieoznaczoności Heisenberga, która stwierdza, że nie da się zmierzyć współrzędnych i pędu cząstki z jednakową precyzją – dokładne pomiary jednej właściwości z pewnością zmienią dane o drugiej.
Dlatego zamiast określać lokalizację (współrzędne cząstek), teoria kwantowa proponuje pomiar tzw. funkcji falowej.
Funkcja falowa działa w podobny sposób jak fala dźwiękowa. Jedyna różnica polega na tym, że matematyczny opis fali dźwiękowej określa ruch cząsteczek powietrza w określonym miejscu, a funkcja falowa opisuje prawdopodobieństwo pojawienia się cząstki w określonym miejscu zgodnie z równaniem Schrödingera.
Pomiar funkcji falowej również jest trudny (bezpośrednie obserwacje prowadzą do jej zapadnięcia), ale fizycy-teoretycy potrafią z grubsza przewidzieć jej wartości.
Eksperymentalne zmierzenie wszystkich parametrów funkcji falowej jest możliwe tylko wtedy, gdy zostaną zebrane z oddzielnych pomiarów niszczących przeprowadzonych na zupełnie identycznych układach atomów lub cząsteczek.
Zaprezentowali to fizycy z holenderskiego instytutu badawczego AMOLF nowa metoda, która nie wymaga żadnej „restrukturyzacji”, a wyniki swoich prac opublikowali w czasopiśmie Physical Review Letters. Ich technika opiera się na hipotezie z 1981 roku trzy lata sowieccy fizycy teoretyczni, a także późniejsze badania.
Podczas eksperymentu zespół naukowców skierował dwie wiązki lasera na atomy wodoru umieszczone w specjalnej komorze. W wyniku tego uderzenia elektrony opuściły swoje orbity z prędkością i kierunkiem określonymi przez ich funkcje falowe. Silne pole elektryczne w komorze zawierającej atomy wodoru kierowało elektrony do określonych części planarnego (płaskiego) detektora.
Położenie elektronów uderzających w detektor zostało określone na podstawie ich prędkości początkowej, a nie ich położenia w komorze. Zatem rozkład elektronów w detektorze powiedział naukowcom o funkcji falowej tych cząstek, jaką miały, gdy opuszczały orbitę wokół jądra atomu wodoru.
Ruchy elektronów były wyświetlane na fosforyzującym ekranie w postaci ciemnych i jasnych pierścieni, które naukowcy sfotografowali aparatem cyfrowym o wysokiej rozdzielczości.
„Jesteśmy bardzo zadowoleni z naszych wyników. Mechanika kwantowa ma z tym niewiele wspólnego życie codzienne ludzi, że mało kto wpadł na pomysł zrobienia prawdziwej fotografii oddziaływań kwantowych w atomie” – mówi główna autorka badania Aneta Stodolna. Przekonuje też, że opracowana technika może mieć praktyczne użycie na przykład do tworzenia przewodników o grubości atomu, rozwijając technologię drutów molekularnych, która znacząco usprawni nowoczesne urządzenia elektroniczne.
"Warto zauważyć, że eksperyment przeprowadzono konkretnie na wodorze - jednocześnie najprostszej i najpowszechniejszej substancji w naszym Wszechświecie. Konieczne będzie zrozumienie, czy tę technikę można zastosować do bardziej złożonych atomów. Jeśli tak, to to duży przełom, który pozwoli nam rozwijać nie tylko elektronikę, ale także nanotechnologię” – mówi Jeff Lundeen z Uniwersytetu w Ottawie, który nie był zaangażowany w badania.
Jednak naukowcy, którzy sami przeprowadzili eksperyment, nie myślą o praktycznej stronie problemu. Wierzą, że ich odkrycie dotyczy przede wszystkim nauk podstawowych, co pomoże przekazać więcej wiedzy przyszłym pokoleniom fizyków.
PostScience obala mity naukowe i wyjaśnia powszechne nieporozumienia. Poprosiliśmy naszych ekspertów o komentarz na temat popularnych poglądów na temat struktury i właściwości atomów.
Model Rutherforda odpowiada współczesnym wyobrażeniom o budowie atomu
To prawda, ale częściowo. Planetarny model atomu, w którym lekkie elektrony krążą wokół ciężkiego jądra, podobnie jak planety wokół Słońca, zaproponował Ernest Rutherford w 1911 roku, po odkryciu samego jądra w jego laboratorium. Bombardując kawałek metalowej folii cząsteczkami alfa, naukowcy odkryli, że zdecydowana większość cząstek przeszła przez folię, podobnie jak światło przez szkło. Jednak niewielka ich część – około 1 na 8 000 – została odbita z powrotem do źródła. Rutherford wyjaśnił te wyniki faktem, że masa nie jest równomiernie rozłożona w materii, ale jest skoncentrowana w „grudkach” – jądrach atomowych niosących ładunek dodatni, który odpycha dodatnio naładowane cząstki alfa. Lekkie, ujemnie naładowane elektrony unikają „spadania” na jądro, wirując wokół nich, tak że siła odśrodkowa równoważy przyciąganie elektrostatyczne.
Mówi się, że po wynalezieniu tego modelu Rutherford wykrzyknął: „Teraz wiem, jak wygląda atom!” Jednak wkrótce, pod wpływem inspiracji, Rutherford zdał sobie sprawę z wadliwej natury swojego pomysłu. Obracając się wokół jądra, elektron wytwarza prąd elektryczny i pole magnetyczne. Pola te rozchodzą się w formie z prędkością światła fala elektromagnetyczna. A taka fala niesie ze sobą energię! Okazuje się, że krążąc wokół jądra, elektron będzie stale tracił energię i opadał na jądro w ciągu miliardowych części sekundy. (Można się zastanawiać, czy ten sam argument można zastosować do planet Układ Słoneczny: Dlaczego nie spadają na Słońce? Odpowiedź: fale grawitacyjne, jeśli w ogóle istnieją, są znacznie słabsze od fal elektromagnetycznych, a energia zgromadzona na planetach jest znacznie większa niż w elektronach, więc „rezerwa mocy” planet jest o wiele rzędów wielkości większa.)
Rutherford powierzył swojemu współpracownikowi, młodemu teoretykowi Nielsowi Bohrowi, zadanie rozwiązania tej sprzeczności. Po dwóch latach pracy Bohr znalazł częściowe rozwiązanie. Postulował, że wśród wszystkich możliwych orbit elektronu są takie, na których elektron może przebywać przez długi czas bez emisji. Elektron może przemieszczać się z jednej orbity stacjonarnej na drugą, absorbując lub emitując kwant pole elektromagnetyczne o energii równej różnicy energii między dwiema orbitami. Korzystając z odkrytych już wówczas początkowych zasad fizyki kwantowej, Bohr był w stanie obliczyć parametry orbit stacjonarnych i odpowiednio energie kwantów promieniowania odpowiadających przejściom. Do tego czasu energie te mierzono metodami spektroskopowymi, a przewidywania teoretyczne Bohra pokrywały się niemal idealnie z wynikami tych pomiarów!
Pomimo tego triumfalnego wyniku teoria Bohra z trudem rozjaśniła kwestię fizyki atomowej, ponieważ miała charakter półempiryczny: postulując istnienie orbit stacjonarnych, w żaden sposób ich nie wyjaśniała natura fizyczna. Dokładne wyjaśnienie zagadnienia wymagało co najmniej kolejnych dwóch dekad, podczas których mechanika kwantowa rozwijała się jako systematyczna, integralna teoria fizyczna.
W ramach tej teorii elektron podlega zasadzie nieoznaczoności i nie jest opisywany punkt materialny, jak planeta, ale funkcja falowa „rozmazana” po całej orbicie. W każdym momencie czasu znajduje się w superpozycji stanów odpowiadających wszystkim punktom orbity. Ponieważ gęstość rozkładu masy w przestrzeni, określona funkcją falową, nie zależy od czasu, wokół elektronu nie powstaje zmienne pole elektromagnetyczne; nie ma strat energii.
Zatem model planetarny daje prawdziwą wizualną reprezentację wyglądu atomu – Rutherford miał rację w swoim okrzyku. Nie wyjaśnia jednak, jak działa atom: struktura jest znacznie bardziej złożona i głębsza niż modelowana przez Rutherforda.
Podsumowując, zauważam, że „mit” modelu planetarnego znajduje się w samym centrum intelektualnego dramatu, który sto lat temu dał początek punktowi zwrotnemu w fizyce i w dużej mierze ukształtował tę naukę w jej nowoczesna forma.
Aleksander Lwowski
Doktor fizyki, profesor na Wydziale Fizyki Uniwersytetu w Calgary, kierownik grupy naukowej, członek rady naukowej Rosyjskiego Centrum Kwantowego, redaktor czasopisma naukowego Optics Express
Można kontrolować poszczególne atomy
To prawda. Oczywiście, że możesz, czemu nie? Można sterować różnymi parametrami atomu, a atom ma ich całkiem sporo: ma położenie w przestrzeni, prędkość, są też wewnętrzne stopnie swobody. Wewnętrzne stopnie swobody określają magnetyczne i właściwości elektryczne atomu, a także gotowość do emisji światła lub fal radiowych. W zależności od stanu wewnętrznego atomu może on być mniej lub bardziej aktywny w zderzeniach i reakcje chemiczne, zmienić właściwości otaczających atomów, jego reakcję na marginesy zewnętrzne. W medycynie na przykład do budowy tomogramów płuc używają tzw. gazów spolaryzowanych – w takich gazach wszystkie atomy znajdują się w tym samym stanie wewnętrznym, co pozwala im „zobaczyć” objętość, którą wypełniają swoją reakcją.
Kontrolowanie prędkości atomu lub jego położenia nie jest tak trudne; znacznie trudniej jest wybrać dokładnie jeden atom do kontroli. Ale to też można zrobić. Jedno z podejść do takiego rozdzielania atomów realizowane jest za pomocą chłodzenia laserowego. Do kontroli zawsze wygodnie jest mieć znaną pozycję początkową; całkiem dobrze jest, jeśli atom jeszcze się nie porusza. Chłodzenie laserowe pozwala osiągnąć jedno i drugie, zlokalizować atomy w przestrzeni i schłodzić je, czyli zmniejszyć ich prędkość niemal do zera. Zasada chłodzenia lasera jest taka sama jak w samolocie odrzutowym, z tą różnicą, że ten ostatni emituje strumień gazu w celu przyspieszenia, a w pierwszym przypadku atom, przeciwnie, pochłania strumień fotonów (cząstek światła) i zwalnia . Nowoczesne metody Chłodzenie laserowe może schłodzić miliony atomów do prędkości spaceru i niższych. Wtedy do gry wchodzą różnego rodzaju pułapki pasywne, na przykład pułapka dipolowa. Jeśli chłodzenie laserowe wykorzystuje pole świetlne, które atom aktywnie pochłania, to aby utrzymać je w pułapce dipolowej, częstotliwość światła wybiera się z dala od jakiejkolwiek absorpcji. Okazuje się, że silnie skupione światło lasera jest w stanie polaryzować małe cząstki i ziarna pyłu i wciągać je w obszar o największym natężeniu światła. Atom nie jest wyjątkiem i również jest wciągany w obszar najsilniejszego pola. Okazuje się, że jeśli skupimy światło tak mocno, jak to możliwe, w takiej pułapce można utrzymać tylko dokładnie jeden atom. Faktem jest, że jeśli drugi wpadnie w pułapkę, to okazuje się, że jest tak mocno dociśnięty do pierwszego, że tworzą cząsteczkę i jednocześnie wypadają z pułapki. Jednak tak ostre skupienie to nie jedyny sposób na wyizolowanie pojedynczego atomu, można też wykorzystać właściwości oddziaływania atomu z rezonatorem dla atomów naładowanych, jonów, można wykorzystać pola elektryczne do wychwytywania i zatrzymywania dokładnie jednego jonu, i tak dalej. Możliwe jest nawet wzbudzenie jednego atomu w dość ograniczonym zestawie atomów do bardzo silnie wzbudzonego, tak zwanego stanu Rydberga. Atom raz wzbudzony do stanu Rydberga blokuje możliwość wzbudzenia swoich sąsiadów do tego samego stanu i jeśli objętość zawierająca atomy jest wystarczająco mała, będzie jedynym.
Tak czy inaczej, gdy atom zostanie przechwycony, można go kontrolować. Stan wewnętrzny można zmieniać za pomocą pól świetlnych i częstotliwości radiowych, wykorzystując pożądane częstotliwości i polaryzację fali elektromagnetycznej. Możliwe jest przeniesienie atomu do dowolnego z góry określonego stanu, czy to określonego stanu - poziomu, czy ich superpozycji. Jedyną kwestią jest dostępność wymaganych częstotliwości i możliwość wytworzenia wystarczająco krótkich i mocnych impulsów sterujących. W ostatnim czasie możliwe stało się skuteczniejsze kontrolowanie atomów, utrzymywanie ich w sąsiedztwie nanostruktur, co pozwala nie tylko skuteczniej „rozmawiać” z atomem, ale także wykorzystać sam atom, a dokładniej jego stany wewnętrzne- do kontrolowania przepływu światła, a w przyszłości być może do celów obliczeniowych.
Kontrolowanie pozycji atomu trzymanego przez pułapkę jest znacznie węższe proste zadanie- wystarczy przesunąć samą pułapkę. W przypadku pułapki dipolowej należy przesuwać wiązkę światła, co można zrobić np. za pomocą ruchomych lusterek na potrzeby pokazu laserowego. Atomowi można ponownie nadać prędkość w sposób reaktywny - można go zmusić do pochłaniania światła, a jon można łatwo przyspieszyć pola elektryczne, tak jak to miało miejsce w lampach elektronopromieniowych. Zatem dzisiaj w zasadzie z atomem można zrobić wszystko, jest to tylko kwestia czasu i wysiłku.

Aleksiej Akimow
Atom jest niepodzielny
Częściowo prawda, częściowo nie. Wikipedia podaje następującą definicję: „Atom (od starożytnego greckiego ἄτομος – niepodzielny, niepocięty) to cząstka substancji o mikroskopijnych rozmiarach i masie, najmniejsza część pierwiastka chemicznego, będąca nośnikiem jego właściwości. Atom składa się z jądra atomowego i elektronów.”
Obecnie każda wykształcona osoba wyobraża sobie atom w modelu Rutherforda, który w skrócie przedstawia ostatnie zdanie tej ogólnie przyjętej definicji. Wydawałoby się, że odpowiedź na postawione pytanie/mit jest oczywista: atom jest obiektem złożonym i złożonym. Jednak sytuacja nie jest tak jednoznaczna. Starożytni filozofowie raczej w definicji atomu umieszczali znaczenie istnienia elementarnej i niepodzielnej cząstki materii i raczej nie wiązali problemu z budową pierwiastków układu okresowego. W atomie Rutherforda rzeczywiście znajdujemy taką cząstkę – jest to elektron.
Elektron wg nowoczesne pomysły, mieszczące się w tzw
„>Model standardowy to punkt, którego stan opisuje położenie i prędkość. Co ważne, jednoczesne określenie tych charakterystyk kinematycznych nie jest możliwe ze względu na zasadę nieoznaczoności Heisenberga, ale uwzględniając tylko jedną z nich, np. współrzędną, można ją wyznaczyć z dowolnie dużą dokładnością.
Czy można zatem, stosując nowoczesną technologię eksperymentalną, spróbować zlokalizować elektron w skali znacznie mniejszej niż wielkość atomu (~0,5 * 10-8 cm) i sprawdzić jego podobieństwo punktowe? Okazuje się, że jeśli spróbujemy zlokalizować elektron w skali tzw. długości fali Comptona – około 137 razy mniejszej od wielkości atomu wodoru – elektron będzie oddziaływać ze swoją antymaterią i układ stanie się niestabilny.
Punktowość i niepodzielność elektronu i inne cząstki elementarne materia jest kluczowym elementem zasady działania krótkiego zasięgu w teorii pola i jest obecna we wszystkich podstawowych równaniach opisujących przyrodę. Zatem starożytni filozofowie nie byli tak dalecy od prawdy, zakładając, że istnieją niepodzielne cząstki materii.

Dmitrij Kupriyanov
Doktor nauk fizycznych i matematycznych, profesor fizyki, Politechnika Państwowa w Petersburgu, kierownik. Katedra Fizyki Teoretycznej SPbSPU
Nauka jeszcze tego nie wie. Planetarny model atomu Rutherforda zakładał, że elektrony krążą wokół jądra atomowego, podobnie jak planety krążące wokół Słońca. Jednocześnie naturalne było założenie, że elektrony są stałymi, kulistymi cząstkami. Klasyczny model Rutherforda był wewnętrznie sprzeczny. Wyraźnie poruszające się, przyspieszone naładowane cząstki (elektrony) musiałyby tracić energię z powodu promieniowanie elektromagnetyczne i ostatecznie opadają na jądra atomów.
Niels Bohr zaproponował zakazanie tego procesu i wprowadzenie pewnych wymagań dotyczących promieni orbit, po których poruszają się elektrony. Fenomenologiczny model Bohra ustąpił miejsca kwantowemu modelowi atomu opracowanemu przez Heisenberga i kwantowemu, ale bardziej wizualnemu modelowi atomu zaproponowanemu przez Schrödingera. W modelu Schrödingera elektrony nie są już kulami krążącymi po orbicie, ale stojące fale które jak chmury wiszą nad nimi jądro atomowe. Kształt tych „chmur” opisano funkcją falową wprowadzoną przez Schrödingera.
Natychmiast pojawiło się pytanie: jakie jest fizyczne znaczenie funkcji falowej? Odpowiedź zaproponował Max Born: kwadratowy moduł funkcji falowej to prawdopodobieństwo znalezienia elektronu w danym punkcie przestrzeni. I tu zaczęły się trudności. Pojawiło się pytanie: co to znaczy znaleźć elektron w danym punkcie przestrzeni? Czy stwierdzenia Borna nie należy rozumieć jako przyznanie, że elektron jest małą kulką, która leci po określonej trajektorii i którą z pewnym prawdopodobieństwem można złapać w określonym punkcie tej trajektorii?
Taki właśnie punkt widzenia podzielają Schrödinger i Albert Einstein, którzy dołączyli do niego w tej kwestii. Sprzeciwiali się im fizycy szkoły kopenhaskiej – Niels Bohr i Werner Heisenberg, którzy argumentowali, że pomiędzy aktami pomiaru elektron po prostu nie istnieje, co oznacza, że nie ma sensu mówić o trajektorii jego ruchu. Dyskusja pomiędzy Bohrem i Einsteinem na temat interpretacji mechaniki kwantowej przeszła do historii. Bohr wydawał się zwycięzcą: udało mu się, choć niezbyt wyraźnie, obalić wszystkie paradoksy formułowane przez Einsteina, a nawet słynny paradoks„Kot Schrodingera” sformułowany przez Schrodingera w 1935 roku. Przez kilka dziesięcioleci większość fizyków zgadzała się z Bohrem, że materia nie jest obiektywną rzeczywistością daną nam w wrażeniach, jak nauczał Karol Marks, ale czymś, co powstaje dopiero w momencie obserwacji i nie istnieje bez obserwatora. Ciekawe, że w Czas sowiecki Wydziały filozofii na uniwersytetach uczyły, że taki punkt widzenia jest idealizmem subiektywnym, czyli nurtem sprzecznym z obiektywnym materializmem - filozofią Marksa, Engelsa, Lenina i Einsteina. Jednocześnie na wydziałach fizyki uczono studentów, że koncepcje szkoły kopenhaskiej są jedyne słuszne (być może dlatego, że do tej szkoły należał najsłynniejszy radziecki fizyk teoretyczny, Lew Landau).
W tej chwili zdania fizyków są podzielone. Z jednej strony nadal popularna jest kopenhaska interpretacja mechaniki kwantowej. Próbowanie weryfikacja eksperymentalna Trafność tej interpretacji (przykładowo udana weryfikacja tzw. nierówności Bella przez francuskiego fizyka Alaina Aspe) cieszy się niemal jednomyślną aprobatą środowiska naukowego. Z drugiej strony teoretycy całkiem swobodnie dyskutują o alternatywnych teoriach, takich jak teoria światy równoległe. Wracając do elektronu, można powiedzieć, że jego szanse na pozostanie kulą bilardową nie są jeszcze zbyt duże. Jednocześnie są różne od zera. W latach 20. XX wieku dopiero bilardowy model rozpraszania Comptona pozwolił wykazać, że światło składa się z kwantów – fotonów. W wielu zagadnieniach związanych z ważnymi i użytecznymi urządzeniami (diody, tranzystory) wygodnie jest myśleć o elektronie jak o kuli bilardowej. Falowa natura elektron jest ważny do opisu bardziej subtelnych efektów, takich jak ujemny magnetoopór metali.
Filozoficzne pytanie, czy pomiędzy aktami pomiaru istnieje elektron kulowy, nie ma znaczenia w zwykłym życiu. wielkie znaczenie. Jednak ten problem jest nadal jednym z najbardziej aktualnych poważne problemy współczesna fizyka.

Aleksiej Kawokin
Kandydat nauk fizycznych i matematycznych, profesor na Uniwersytecie w Southampton, kierownik Grupy Polarytoniki Kwantowej Rosyjskiego Centrum Kwantowego, Dyrektor Naukowy Śródziemnomorskiego Instytutu Fizyki Podstawowej (Włochy)
Atom można całkowicie zniszczyć
To prawda.Łamanie to nie budowanie. Możesz zniszczyć wszystko, łącznie z atomem, w dowolnym stopniu kompletności. W pierwszym przybliżeniu atom jest dodatnio naładowanym jądrem otoczonym ujemnie naładowanymi elektronami. Pierwszym niszczycielskim działaniem, jakie można wykonać na atomie, jest wyrwanie z niego elektronów. Można to zrobić na różne sposoby: możesz skupić na nim silne promieniowanie laserowe, możesz też napromieniować szybkimi elektronami lub innymi szybkimi cząsteczkami. Atom, który utracił część swoich elektronów, nazywa się jonem. To właśnie w tym stanie atomy istnieją na Słońcu, gdzie temperatury są tak wysokie, że praktycznie niemożliwe jest, aby atomy zatrzymały swoje elektrony podczas zderzeń.
Im więcej elektronów stracił atom, tym trudniej jest usunąć resztę. W zależności od liczby atomowej atom ma więcej lub mniej elektronów. Atom wodoru ma na ogół tylko jeden elektron i często traci go nawet w normalnych warunkach, i to wodór, który utracił swoje elektrony, decyduje o pH wody. Atom helu ma dwa elektrony i w stanie całkowicie zjonizowanym nazywany jest cząstką alfa – tego rodzaju cząstek można już spodziewać się po reaktorze jądrowym, a nie po zwykłej wodzie. Atomy zawierające wiele elektronów wymagają jeszcze więcej energii, aby usunąć wszystkie elektrony, niemniej jednak możliwe jest usunięcie wszystkich elektronów z dowolnego atomu.
Jeśli wszystkie elektrony zostaną oderwane, jądro pozostanie, ale może również zostać zniszczone. Jądro składa się z protonów i neutronów (zazwyczaj hadronów) i chociaż są one dość silnie powiązane, padająca cząstka o odpowiednio dużej energii może je rozbić. Ciężkie atomy, w których jest zbyt dużo neutronów i protonów, mają tendencję do samoistnego rozpadu, uwalniając dość dużo energii - na tej zasadzie działają elektrownie jądrowe.
Ale nawet jeśli rozbijesz jądro i oderwiesz wszystkie elektrony, oryginalne cząstki pozostaną: neutrony, protony, elektrony. Można je oczywiście również zniszczyć. Właściwie właśnie to robi, przyspieszając protony do ogromnych energii, całkowicie je niszcząc w zderzeniach. W tym przypadku rodzi się wiele nowych cząstek, które bada zderzacz. To samo można zrobić z elektronami i innymi cząstkami.
Energia zniszczonej cząstki nie znika, jest rozdzielana pomiędzy inne cząstki, a jeśli jest ich wystarczająco dużo, to szybkie wyśledzenie pierwotnej cząstki w morzu nowych przemian staje się niemożliwe. Wszystko można zniszczyć, nie ma wyjątków.

Aleksiej Akimow
Kandydat nauk fizycznych i matematycznych, kierownik grupy „Symulatory kwantowe” Rosyjskiego Centrum Kwantowego, nauczyciel w MIPT, pracownik Instytutu Fizycznego Lebiediewa, pracownik naukowy na Uniwersytecie Harvarda