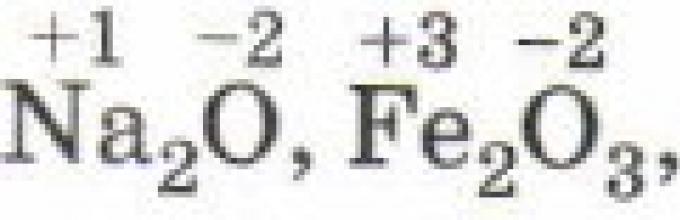Aby scharakteryzować stan pierwiastków w związkach, wprowadzono pojęcie stopnia utlenienia.
DEFINICJA
Liczba elektronów przesuniętych z atomu danego pierwiastka lub do atomu danego pierwiastka w związku nazywa się stan utlenienia.
Dodatni stopień utlenienia wskazuje liczbę elektronów wypartych z danego atomu, a ujemny stopień utlenienia wskazuje liczbę elektronów przesuniętych w kierunku danego atomu.
Z tej definicji wynika, że w związkach z wiązaniami niepolarnymi stopień utlenienia pierwiastków wynosi zero. Przykładami takich związków są cząsteczki składające się z identycznych atomów (N2, H2, Cl2).
Stopień utlenienia metali w stanie elementarnym wynosi zero, ponieważ rozkład gęstości elektronów w nich jest równomierny.
W prostych związkach jonowych stopień utlenienia ich pierwiastków składowych jest równy ładunek elektryczny, ponieważ podczas tworzenia tych związków następuje prawie całkowite przeniesienie elektronów z jednego atomu na drugi: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br - 1 4.
Przy określaniu stopnia utlenienia pierwiastków w związkach z polarnymi wiązaniami kowalencyjnymi porównuje się ich wartości elektroujemności. Ponieważ podczas tworzenia wiązania chemicznego elektrony są przemieszczane do atomów pierwiastków bardziej elektroujemnych, te ostatnie mają w związkach ujemny stopień utlenienia.
Najniższy stopień utlenienia
W przypadku pierwiastków, które w swoich związkach wykazują różne stopnie utlenienia, istnieją koncepcje najwyższego (maksymalnie dodatniego) i najniższego (minimalnie ujemnego) stopnia utlenienia. Najniższy stopień utlenienia pierwiastek chemiczny zwykle liczbowo równa różnicy między numerem grupy w układzie okresowym D.I. Mendelejewa, w której znajduje się pierwiastek chemiczny, a liczbą 8. Przykładowo azot należy do grupy VA, co oznacza, że jego najniższy stopień utlenienia to (-3): V-VIII = - 3; siarka należy do grupy VIA, co oznacza, że jej najniższy stopień utlenienia to (-2): VI-VIII = -2 itd.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
DEFINICJA
Stan utlenienia to ilościowa ocena stanu atomu pierwiastka chemicznego w związku na podstawie jego elektroujemności.
Akceptuje zarówno pozytywne, jak i wartości ujemne. Aby wskazać stopień utlenienia pierwiastka w związku, należy umieścić cyfrę arabską z odpowiednim znakiem („+” lub „-”) nad jego symbolem.
Należy pamiętać, że stopień utlenienia jest wielkością, która nie ma znaczenia fizycznego, ponieważ nie odzwierciedla rzeczywistego ładunku atomu. Jednak koncepcja ta jest bardzo szeroko stosowana w chemii.
Tabela stopni utlenienia pierwiastków chemicznych
Maksymalny dodatni i minimalny ujemny stopień utlenienia można określić za pomocą układu okresowego D.I. Mendelejew. Są one równe odpowiednio numerowi grupy, w której znajduje się pierwiastek i różnicy między wartością „najwyższego” stopnia utlenienia a liczbą 8.
Jeśli weźmiemy pod uwagę związki chemiczne dokładniej, w substancjach z wiązaniami niepolarnymi stopień utlenienia pierwiastków wynosi zero (N 2, H 2, Cl 2).
Stopień utlenienia metali w stanie elementarnym wynosi zero, ponieważ rozkład gęstości elektronów w nich jest równomierny.
W prostych związkach jonowych stopień utlenienia zawartych w nich pierwiastków jest równy ładunkowi elektrycznemu, ponieważ podczas tworzenia tych związków następuje prawie całkowite przejście elektronów z jednego atomu na drugi: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F - 1 3 , Zr +4 Br -1 4 .
Przy określaniu stopnia utlenienia pierwiastków w związkach z polarnymi wiązaniami kowalencyjnymi porównuje się ich wartości elektroujemności. Ponieważ podczas tworzenia wiązania chemicznego elektrony są przemieszczane do atomów pierwiastków bardziej elektroujemnych, te ostatnie mają w związkach ujemny stopień utlenienia.
Istnieją pierwiastki, które charakteryzują się tylko jednym stopniem utlenienia (fluor, metale z grup IA i IIA itp.). Fluor, charakteryzujący się najwyższa wartość elektroujemność, w związkach ma zawsze stały ujemny stopień utlenienia (-1).
Pierwiastki alkaliczne i ziem alkalicznych, które charakteryzują się stosunkowo niską wartością elektroujemności, zawsze mają dodatni stopień utlenienia równy odpowiednio (+1) i (+2).
Istnieją jednak również pierwiastki chemiczne charakteryzujące się kilkoma stopniami utlenienia (siarka - (-2), 0, (+2), (+4), (+6) itp.).
Aby ułatwić zapamiętanie, ile i jakie stopnie utlenienia charakteryzują dany pierwiastek chemiczny, skorzystaj z tabel stopni utlenienia pierwiastków chemicznych, które wyglądają następująco:
|
Numer seryjny |
rosyjski/angielski Nazwa |
Symbol chemiczny |
Stan utlenienia |
|
Wodór |
|||
|
Hel |
|||
|
Lit |
|||
|
Beryl |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
Węgiel |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
Azot / azot |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
Tlen |
(-2), (-1), 0, (+1), (+2) |
||
|
Fluor |
|||
|
Sód/sód |
|||
|
Magnez / Magnez |
|||
|
Aluminium |
|||
|
Krzem |
(-4), 0, (+2), (+4) |
||
|
Fosfor / Fosfor |
(-3), 0, (+3), (+5) |
||
|
Siarka/Siarka |
(-2), 0, (+4), (+6) |
||
|
Chlor |
(-1), 0, (+1), (+3), (+5), (+7), rzadko (+2) i (+4) |
||
|
Argon / Argon |
|||
|
Potas/Potas |
|||
|
Wapń |
|||
|
Skand / Skand |
|||
|
Tytan |
(+2), (+3), (+4) |
||
|
Wanad |
(+2), (+3), (+4), (+5) |
||
|
Chrom / Chrom |
(+2), (+3), (+6) |
||
|
Mangan / Mangan |
(+2), (+3), (+4), (+6), (+7) |
||
|
Żelazo |
(+2), (+3), rzadkie (+4) i (+6) |
||
|
Kobalt |
(+2), (+3), rzadko (+4) |
||
|
Nikiel |
(+2), rzadkie (+1), (+3) i (+4) |
||
|
Miedź |
+1, +2, rzadkie (+3) |
||
|
Gal |
(+3), rzadkie (+2) |
||
|
German / German |
(-4), (+2), (+4) |
||
|
Arsen/Arsen |
(-3), (+3), (+5), rzadko (+2) |
||
|
Selen |
(-2), (+4), (+6), rzadko (+2) |
||
|
Brom |
(-1), (+1), (+5), rzadko (+3), (+4) |
||
|
Krypton / Krypton |
|||
|
Rubid / Rubid |
|||
|
Stront / Stront |
|||
|
Itr / Itr |
|||
|
Cyrkon / Cyrkon |
(+4), rzadkie (+2) i (+3) |
||
|
Niob / Niob |
(+3), (+5), rzadkie (+2) i (+4) |
||
|
Molibden |
(+3), (+6), rzadkie (+2), (+3) i (+5) |
||
|
Technet / technet |
|||
|
Ruten / Ruten |
(+3), (+4), (+8), rzadkie (+2), (+6) i (+7) |
||
|
Rod |
(+4), rzadkie (+2), (+3) i (+6) |
||
|
Paladium |
(+2), (+4), rzadko (+6) |
||
|
Srebro |
(+1), rzadkie (+2) i (+3) |
||
|
Kadm |
(+2), rzadkie (+1) |
||
|
Ind |
(+3), rzadkie (+1) i (+2) |
||
|
Cyna/cyna |
(+2), (+4) |
||
|
Antymon / Antymon |
(-3), (+3), (+5), rzadko (+4) |
||
|
Tellur / Tellur |
(-2), (+4), (+6), rzadko (+2) |
||
|
(-1), (+1), (+5), (+7), rzadko (+3), (+4) |
|||
|
Xenon / Xenon |
|||
|
Cez |
|||
|
Bar / Bar |
|||
|
Lantan / Lantan |
|||
|
Cer |
(+3), (+4) |
||
|
Prazeodym / Prazeodym |
|||
|
Neodym / Neodym |
(+3), (+4) |
||
|
Promet / Promet |
|||
|
Samar / Samar |
(+3), rzadkie (+2) |
||
|
Europ |
(+3), rzadkie (+2) |
||
|
Gadolin / Gadolin |
|||
|
Terb / Terb |
(+3), (+4) |
||
|
Dysproz / Dysproz |
|||
|
Holm |
|||
|
Erb |
|||
|
Tul |
(+3), rzadkie (+2) |
||
|
Iterb / Iterb |
(+3), rzadkie (+2) |
||
|
Lutet / Lutet |
|||
|
Hafn / Hafn |
|||
|
Tantal / Tantal |
(+5), rzadkie (+3), (+4) |
||
|
Wolfram/wolfram |
(+6), rzadkie (+2), (+3), (+4) i (+5) |
||
|
Ren / Ren |
(+2), (+4), (+6), (+7), rzadkie (-1), (+1), (+3), (+5) |
||
|
Osm / Osm |
(+3), (+4), (+6), (+8), rzadkie (+2) |
||
|
Iryd / Iryd |
(+3), (+4), (+6), rzadko (+1) i (+2) |
||
|
Platyna |
(+2), (+4), (+6), rzadkie (+1) i (+3) |
||
|
Złoto |
(+1), (+3), rzadko (+2) |
||
|
Rtęć |
(+1), (+2) |
||
|
Tal / tal |
(+1), (+3), rzadko (+2) |
||
|
Ołów/ołów |
(+2), (+4) |
||
|
Bizmut |
(+3), rzadkie (+3), (+2), (+4) i (+5) |
||
|
Polon |
(+2), (+4), rzadko (-2) i (+6) |
||
|
Astat |
|||
|
Radon / Radon |
|||
|
Frans |
|||
|
Rad |
|||
|
Aktyn |
|||
|
Tor |
|||
|
Proaktyn / Protaktyn |
|||
|
Uran / Uran |
(+3), (+4), (+6), rzadkie (+2) i (+5) |
Przykłady rozwiązywania problemów
PRZYKŁAD 1
- Stopień utlenienia fosforu w fosfinie wynosi (-3), a w kwasie ortofosforowym - (+5). Zmiana stopnia utlenienia fosforu: +3 → +5, tj. opcja pierwszej odpowiedzi.
- Stopień utlenienia pierwiastka chemicznego w prostej substancji wynosi zero. Stopień utlenienia fosforu w tlenku kompozycji P 2 O 5 wynosi (+5). Zmiana stopnia utlenienia fosforu: 0 → +5, tj. trzecia opcja odpowiedzi.
- Stopień utlenienia fosforu w składzie kwasowym HPO 3 wynosi (+5), a H 3 PO 2 wynosi (+1). Zmiana stopnia utlenienia fosforu: +5 → +1, tj. piąta opcja odpowiedzi.
PRZYKŁAD 2
| Ćwiczenia | Stopień utlenienia (-3) węgla w związku to: a) CH3Cl; b) C2H2; c) HCOH; d) C2H6. |
| Rozwiązanie | Aby udzielić prawidłowej odpowiedzi na postawione pytanie, będziemy naprzemiennie określać stopień utlenienia węgla w każdym z proponowanych związków. a) stopień utlenienia wodoru wynosi (+1), a chloru (-1). Przyjmijmy stopień utlenienia węgla jako „x”: x + 3×1 + (-1) =0; Odpowiedź jest błędna. b) stopień utlenienia wodoru wynosi (+1). Przyjmijmy stopień utlenienia węgla jako „y”: 2×y + 2×1 = 0; Odpowiedź jest błędna. c) stopień utlenienia wodoru wynosi (+1), a tlenu (-2). Przyjmijmy stopień utlenienia węgla jako „z”: 1 + z + (-2) +1 = 0: Odpowiedź jest błędna. d) stopień utlenienia wodoru wynosi (+1). Przyjmijmy stopień utlenienia węgla jako „a”: 2×a + 6×1 = 0; Poprawna odpowiedź. |
| Odpowiedź | Opcja (d) |
Studiując jonowe i kowalencyjne polarne wiązania chemiczne, zapoznałeś się z nimi substancje złożone, składający się z dwóch pierwiastków chemicznych. Takie substancje nazywane są binarnymi (od łacińskiego bi - dwa) lub dwuelementowymi.
Przypomnijmy typowe związki binarne, które przytoczyliśmy jako przykład, aby rozważyć mechanizmy powstawania jonowych i kowalencyjnych polarnych wiązań chemicznych: NaCl - chlorek sodu i HCl - chlorowodór.
W pierwszym przypadku wiązanie jest jonowe: atom sodu przeniósł swój zewnętrzny elektron na atom chloru i zamienił się w jon o ładunku +1, a atom chloru przyjął elektron i zamienił się w jon o ładunku - 1. Schematycznie proces przekształcania atomów w jony można przedstawić w następujący sposób:
W cząsteczce chlorowodoru HC1 powstaje wiązanie chemiczne w wyniku parowania niesparowanych elektronów zewnętrznych i tworzenia wspólnej pary elektronów atomów wodoru i chloru:
Bardziej poprawne jest wyobrażenie sobie powstania wiązania kowalencyjnego w cząsteczce chlorowodoru jako nałożenia się jednoelektronowej chmury s atomu wodoru z jednoelektronową chmurą p atomu chloru:
Na interakcja chemiczna wspólna para elektronów jest przesunięta w stronę bardziej elektroujemnego atomu chloru: tj. elektron nie przeniesie się całkowicie z atomu wodoru na atom chloru, ale częściowo, określając w ten sposób częściowy ładunek atomów 5 (patrz § 12): . Jeśli wyobrazimy sobie, że w cząsteczce chlorowodoru HCl, a także chlorku sodu NaCl, elektron całkowicie przeszedł z atomu wodoru na atom chloru, wówczas otrzymałyby ładunki +1 i -1: . Takie konwencjonalne ładunki nazywane są stanami utlenienia. Definiując to pojęcie, tradycyjnie przyjmuje się, że w kowalencyjnych związkach polarnych elektrony wiążące są całkowicie przenoszone na atom bardziej elektroujemny, w związku z czym związki składają się wyłącznie z jonów naładowanych dodatnio i ujemnie.
Stopień utlenienia może mieć wartości ujemne, dodatnie lub zerowe, które zwykle umieszcza się nad symbolem pierwiastka na górze, na przykład:
Te atomy, które przyjęły elektrony z innych atomów lub do których przesunięto wspólne pary elektronów, tj. Atomy pierwiastków bardziej elektroujemnych, mają ujemny stopień utlenienia. We wszystkich związkach fluor zawsze ma stopień utlenienia -1. Tlen, drugi pierwiastek po fluorze pod względem elektroujemności, prawie zawsze ma stopień utlenienia -2, z wyjątkiem związków z fluorem, na przykład:
![]()
Dodatni stopień utlenienia przypisuje się tym atomom, które oddają swoje elektrony innym atomom lub z których pobierane są wspólne pary elektronów, tj. atomy pierwiastków mniej elektroujemnych. Metale w związkach zawsze mają dodatni stopień utlenienia. Dla metali głównych podgrup: grupa I (grupa IA) we wszystkich związkach stopień utlenienia wynosi +1, grupa II (grupa IIA) wynosi +2, grupa III (grupa IIIA) wynosi +3, na przykład:
![]()
![]()
ale w związkach z metalami wodór ma stopień utlenienia -1:
![]()
Atomy w cząsteczkach mają zerowy stopień utlenienia proste substancje i atomy w stanie wolnym, na przykład:
Bliskie pojęciu „stanu utlenienia” jest pojęcie „wartościowości”, z którym zapoznałeś się, rozważając kowalencyjne wiązanie chemiczne. Jednak to nie to samo.
Pojęcie „wartościowości” ma zastosowanie do substancji, które mają struktura molekularna. Zdecydowana większość materia organiczna, z którym zapoznasz się w 10. klasie, ma dokładnie taką strukturę. W szkole podstawowej uczysz się chemii nieorganicznej, której przedmiotem są substancje o budowie zarówno molekularnej, jak i niemolekularnej, np. jonowej. Dlatego preferowane jest stosowanie pojęcia „stanu utlenienia”.
Jaka jest różnica między wartościowością a stopniem utlenienia?
Często wartościowość i stopień utlenienia pokrywają się liczbowo, ale wartościowość nie ma znaku ładunku, ale stopień utlenienia tak. Na przykład wodór jednowartościowy ma następujące stopnie utlenienia w różne substancje Oh:
![]()
Wydawać by się mogło, że fluor jednowartościowy, pierwiastek najbardziej elektroujemny, powinien charakteryzować się całkowitą zbieżnością stopnia utlenienia i wartościowości. W końcu jego atom jest w stanie uformować tylko jeden wiązanie kowalencyjne, ponieważ brakuje mu jednego elektronu do uzupełnienia zewnętrznej warstwy elektronów. Jednak i tutaj jest różnica:
Wartościowość i stopień utlenienia różnią się jeszcze bardziej, jeśli nie pokrywają się liczbowo. Na przykład:
W związkach całkowity stopień utlenienia wynosi zawsze zero. Znając to i stopień utlenienia jednego z pierwiastków, możesz znaleźć stopień utlenienia innego pierwiastka za pomocą wzoru, na przykład związku binarnego. Znajdźmy więc stopień utlenienia chloru w związku C1 2 O 7.
Oznaczmy stopień utlenienia tlenu: . Dlatego siedem atomów tlenu będzie miało całkowity ładunek ujemny (-2) × 7 = -14. Wtedy całkowity ładunek dwóch atomów chloru będzie równy +14, a jednego atomu chloru: (+14): 2 = +7. Dlatego stopień utlenienia chloru wynosi.
Podobnie, znając stopnie utlenienia pierwiastków, można utworzyć wzór na związek, na przykład węglik glinu (związek aluminium i węgla).
Łatwo zauważyć, że podobnie pracowałeś z pojęciem „wartościowości”, wyprowadzając wzór związku kowalencyjnego lub określając wartościowość pierwiastka na podstawie wzoru jego związku.
Nazwy związków binarnych powstają z dwóch słów - nazw pierwiastków chemicznych wchodzących w ich skład. Pierwsze słowo oznacza elektroujemną część związku - niemetal; jego łacińska nazwa z przyrostkiem -id zawsze pojawia się w mianownik. Drugie słowo oznacza część elektrododatnią - pierwiastek metalowy lub mniej elektroujemny; jego nazwa zawsze pojawia się w dopełniacz:
Na przykład: NaCl – chlorek sodu, MgS – siarczek magnezu, KH – wodorek potasu, CaO – tlenek wapnia. Jeżeli pierwiastek elektrododatni wykazuje różne stopnie utlenienia, znajduje to odzwierciedlenie w nazwie, wskazując stopień utlenienia cyfrą rzymską, która jest umieszczona na końcu nazwy, np.: - tlenek żelaza (II) (czytaj „tlenek żelaza dwa”), - tlenek żelaza (III) (czytaj „tlenek żelaza trzy”).
Jeśli związek składa się z dwóch pierwiastków niemetalowych, wówczas do nazwy bardziej elektroujemnego z nich dodaje się przyrostek -id, a po nim w dopełniaczu umieszcza się drugi składnik. Na przykład: - fluorek tlenu (II), - tlenek siarki (IV) i - tlenek siarki (VI).
W niektórych przypadkach liczbę atomów pierwiastków podaje się za pomocą nazw cyfr w języku greckim - mono, di, tri, tetra, penta, hexa itp. Na przykład: - tlenek węgla lub tlenek węgla (II), - węgiel dwutlenek lub tlenek węgla (IV), - czterochlorek ołowiu lub chlorek ołowiu (IV).
Do chemików różne kraje się rozumieli, konieczne było stworzenie jednolitej terminologii i nazewnictwa substancji. Zasady nomenklatura chemiczna zostały po raz pierwszy opracowane przez francuskich chemików A. Lavoisiera, A. Fourcroix, L. Guiton de Mervo i C. Berthollet w 1785 r. Obecnie Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) koordynuje działania naukowców z różnych krajów i wydaje zalecenia w sprawie nazewnictwa substancji i terminologii stosowanej w chemii.
Słowa i wyrażenia kluczowe
- Związki binarne lub dwuelementowe.
- Stan utlenienia.
- Nomenklatura chemiczna.
- Oznaczanie stopni utlenienia pierwiastków za pomocą wzoru.
- Sporządzanie wzorów związków binarnych ze względu na stopnie utlenienia pierwiastków.
Pracuj z komputerem
- Zapoznaj się z wnioskiem elektronicznym. Zapoznaj się z materiałem lekcyjnym i wykonaj przydzielone zadania.
- Znajdź w Internecie adresy e-mail, które mogą posłużyć jako dodatkowe źródła ujawniające treść słów kluczowych i wyrażeń występujących w akapicie. Zaoferuj nauczycielowi pomoc w przygotowaniu nowej lekcji - sporządź raport na temat kluczowych słów i zwrotów z następnego akapitu.
Pytania i zadania
- Zapisz wzory tlenków azotu (II), (V), (I), (III), (IV).
- Podaj nazwy związków binarnych, których wzory to: a) C1 2 0 7, C1 2 O, C1O 2; b) FeCl2, FeCl3; c) MnS, MnO2, MnF4, MnO, MnCl4; r) Cu2O, Mg2Si, SiCl4, Na3N, FeS.
- Znajdź w podręcznikach i słownikach wszystkie możliwe nazwy substancji ze wzorami: a) CO 2 i CO; b) SO 2 i SO 3. Wyjaśnij ich etymologię. Podaj dwie nazwy tych substancji wg nomenklatura międzynarodowa zgodnie z zasadami określonymi w ust.
- Jaką inną nazwę można nadać amoniakowi H3N?
- Znajdź objętość, jaką mają w punkcie n. ty 17 g siarkowodoru.
- Ile cząsteczek znajduje się w tej objętości?
- Oblicz masę 33,6 m3 metanu CH 2 w powietrzu. ty i określ liczbę jego cząsteczek zawartych w tej objętości.
- Określ stopień utlenienia węgla i zapisz wzory strukturalne następujących substancji, wiedząc, że zawiera węgiel związki organiczne zawsze czterowartościowy: metan CH 4, czterochlorek węgla CC1 4, etan C 2 H 4, acetylen C 2 H 2.
Stopień utlenienia to warunkowy ładunek atomów pierwiastka chemicznego w związku, obliczony przy założeniu, że wszystkie wiązania mają typ jonowy. Stany utlenienia mogą mieć wartość dodatnią, ujemną lub zerową, dlatego algebraiczna suma stopni utlenienia pierwiastków w cząsteczce, biorąc pod uwagę liczbę ich atomów, jest równa 0, a w jonie - ładunek jonu .
Ta lista stopni utlenienia pokazuje wszystkie znane stopnie utlenienia pierwiastków chemicznych układu okresowego. Lista opiera się na tabeli Greenwooda ze wszystkimi dodatkami. Linie zaznaczone kolorem zawierają gazy obojętne, których stopień utlenienia wynosi zero.
| 1 | −1 | H | +1 | ||||||||||
| 2 | On | ||||||||||||
| 3 | Li | +1 | |||||||||||
| 4 | -3 | Być | +1 | +2 | |||||||||
| 5 | −1 | B | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | O | +1 | +2 | ||||||||
| 9 | −1 | F | +1 | ||||||||||
| 10 | Nie | ||||||||||||
| 11 | −1 | Nie | +1 | ||||||||||
| 12 | Mg | +1 | +2 | ||||||||||
| 13 | Glin | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | kl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ar | ||||||||||||
| 19 | K | +1 | |||||||||||
| 20 | Ok | +2 | |||||||||||
| 21 | sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ti | +2 | +3 | +4 | ||||||||
| 23 | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Kr | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | Współ | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Ni | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Ga | +1 | +2 | +3 | |||||||||
| 32 | −4 | Ge | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | Jak | +2 | +3 | +5 | ||||||||
| 34 | −2 | Se | +2 | +4 | +6 | ||||||||
| 35 | −1 | br | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | Kr | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | senior | +2 | |||||||||||
| 39 | Y | +1 | +2 | +3 | |||||||||
| 40 | Zr | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Uwaga | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Pon | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Ag | +1 | +2 | +3 | |||||||||
| 48 | Płyta CD | +2 | |||||||||||
| 49 | W | +1 | +2 | +3 | |||||||||
| 50 | −4 | sen | +2 | +4 | |||||||||
| 51 | −3 | Sb | +3 | +5 | |||||||||
| 52 | −2 | Te | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | I | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ba | +2 | |||||||||||
| 57 | La | +2 | +3 | ||||||||||
| 58 | Ce | +2 | +3 | +4 | |||||||||
| 59 | Pr | +2 | +3 | +4 | |||||||||
| 60 | Nd | +2 | +3 | ||||||||||
| 61 | Po południu | +3 | |||||||||||
| 62 | sm | +2 | +3 | ||||||||||
| 63 | UE | +2 | +3 | ||||||||||
| 64 | Bg | +1 | +2 | +3 | |||||||||
| 65 | Tb | +1 | +3 | +4 | |||||||||
| 66 | Dy | +2 | +3 | ||||||||||
| 67 | Ho | +3 | |||||||||||
| 68 | Er | +3 | |||||||||||
| 69 | Tm | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Lu | +3 | |||||||||||
| 72 | Hf | +2 | +3 | +4 | |||||||||
| 73 | −1 | Ta | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Odnośnie | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Au | +1 | +2 | +3 | +5 | |||||||
| 80 | Hg | +1 | +2 | +4 | |||||||||
| 81 | Tł | +1 | +3 | ||||||||||
| 82 | −4 | Pb | +2 | +4 | |||||||||
| 83 | −3 | Bi | +3 | +5 | |||||||||
| 84 | −2 | Po | +2 | +4 | +6 | ||||||||
| 85 | −1 | Na | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | ks | +1 | |||||||||||
| 88 | Ra | +2 | |||||||||||
| 89 | Ac | +3 | |||||||||||
| 90 | Cz | +2 | +3 | +4 | |||||||||
| 91 | Rocznie | +3 | +4 | +5 | |||||||||
| 92 | U | +3 | +4 | +5 | +6 | ||||||||
| 93 | Np | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Pu | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Jestem | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | Cm | +3 | +4 | ||||||||||
| 97 | Bk | +3 | +4 | ||||||||||
| 98 | Por | +2 | +3 | +4 | |||||||||
| 99 | Ez | +2 | +3 | ||||||||||
| 100 | FM | +2 | +3 | ||||||||||
| 101 | lekarz medycyny | +2 | +3 | ||||||||||
| 102 | NIE | +2 | +3 | ||||||||||
| 103 | Lr | +3 | |||||||||||
| 104 | Rf | +4 | |||||||||||
| 105 | śr | +5 | |||||||||||
| 106 | sierż | +6 | |||||||||||
| 107 | Bh | +7 | |||||||||||
| 108 | Hs | +8 |
Najwyższy stopień utlenienia pierwiastka odpowiada numerowi grupy układ okresowy, gdzie ten pierwiastek się znajduje (wyjątkami są: Au+3 (grupa I), Cu+2 (II), z grupy VIII stopień utlenienia +8 występuje jedynie w osmie Os i rutenie Ru.
Stany utlenienia metali w związkach
Stopnie utlenienia metali w związkach są zawsze dodatnie, ale jeśli mówimy o niemetalach, to ich stopień utlenienia zależy od atomu, z którym pierwiastek jest połączony:
- jeśli z atomem niemetalu, stopień utlenienia może być dodatni lub ujemny. Zależy to od elektroujemności atomów pierwiastka;
- jeśli z atomem metalu, wówczas stopień utlenienia jest ujemny.
Ujemny stopień utlenienia niemetali
Najwyższy ujemny stopień utlenienia niemetali można wyznaczyć odejmując od 8 numer grupy, w której znajduje się pierwiastek chemiczny, tj. najwyższy dodatni stopień utlenienia jest równy liczbie elektronów w warstwie zewnętrznej, co odpowiada numerowi grupy.
Należy pamiętać, że stopnie utlenienia prostych substancji wynoszą 0, niezależnie od tego, czy jest to metal, czy niemetal.
Źródła:
- Greenwood, Norman N.; Earnshaw, A. Chemia pierwiastków - wyd. 2. - Oksford: Butterworth-Heinemann, 1997
- Zielone stabilne związki magnezu(I) z wiązaniami Mg-Mg / Jones C.; Staś A.. - Magazyn Nauka, 2007. - grudzień (nr 318 (nr 5857)
- Magazyn naukowy, 1970. - tom. 3929. - nr 168. - s. 362.
- Journal of the Chemical Society, Chemical Communications, 1975. - s. 760b-761.
- Irving Langmuir Układ elektronów w atomach i cząsteczkach. - Magazyn J.Am Chem. Soc., 1919. - Wydanie. 41.
W procesach chemicznych główna rola grają atomy i cząsteczki, których właściwości determinują wynik reakcje chemiczne. Jedną z ważnych cech atomu jest stopień utlenienia, co upraszcza metodę obliczania przeniesienia elektronu w cząstce. Jak określić stopień utlenienia lub ładunek formalny cząstki i jakie zasady trzeba w tym celu znać?
Definicja
Każda reakcja chemiczna jest spowodowana oddziaływaniem atomów różnych substancji. Proces reakcji i jej wynik zależą od właściwości najmniejszych cząstek.
Termin utlenianie (utlenianie) w chemii oznacza reakcję, podczas której grupa atomów lub jeden z nich traci elektrony lub zyskuje, w przypadku przejęcia reakcję nazywa się „redukcją”.
Stopień utlenienia to wielkość mierzona ilościowo, charakteryzująca redystrybucję elektronów podczas reakcji. Te. Podczas procesu utleniania elektrony w atomie zmniejszają się lub zwiększają, rozdzielając się pomiędzy innymi oddziałującymi cząsteczkami, a poziom utlenienia dokładnie pokazuje, w jaki sposób są one reorganizowane. Koncepcja ta jest ściśle związana z elektroujemnością cząstek - ich zdolnością do przyciągania i odpychania wolnych jonów.
Określenie poziomu utlenienia zależy od charakterystyki i właściwości konkretnej substancji, dlatego procedury obliczeniowej nie można jednoznacznie nazwać łatwą lub złożoną, ale jej wyniki pomagają warunkowo zarejestrować procesy reakcji redoks. Należy rozumieć, że wynikowy wynik obliczeń jest wynikiem uwzględnienia przeniesienia elektronów i nie ma żadnego znaczenia fizycznego i nie jest prawdziwym ładunkiem jądra.
Ważne jest, aby wiedzieć! Chemia nieorganiczna często używa się określenia wartościowość zamiast stopnia utlenienia pierwiastków, nie jest to błąd, należy jednak mieć na uwadze, że to drugie pojęcie jest bardziej uniwersalne.
Podstawą klasyfikacji są pojęcia i zasady obliczania ruchu elektronów substancje chemiczne(nomenklatura), opisów ich właściwości i opracowania formuł komunikacyjnych. Ale najczęściej ta koncepcja jest używana do opisu reakcji redoks i pracy z nimi.
Zasady określania stopnia utlenienia
Jak sprawdzić stopień utlenienia? Pracując z reakcjami redoks, należy wiedzieć, że ładunek formalny cząstki będzie zawsze równy wartości elektronu wyrażonej wartością liczbową. Cecha ta wynika z założenia, że pary elektronów tworzące wiązanie są zawsze całkowicie przesunięte w stronę cząstek bardziej ujemnych. Należy rozumieć, o czym mówimy wiązania jonowe, a w przypadku reakcji na elektronach zostaną równo podzielone pomiędzy identyczne cząstki.
Stopień utlenienia może przyjmować zarówno wartości dodatnie, jak i ujemne. Rzecz w tym, że podczas reakcji atom musi stać się neutralny i w tym celu konieczne jest albo dodanie do jonu określonej liczby elektronów, jeśli jest dodatni, albo odebranie ich, jeśli jest ujemny. Aby oznaczyć tę koncepcję, podczas pisania formuły nad oznaczeniem elementu zwykle zapisuje się cyfrę arabską z odpowiednim znakiem. Na przykład lub itp.
Warto wiedzieć, że ładunek formalny metali zawsze będzie dodatni i w większości przypadków można go wyznaczyć za pomocą układu okresowego. Aby poprawnie określić wskaźniki, należy wziąć pod uwagę szereg cech.

Stopień utlenienia:
Pamiętając o tych cechach, określenie stopnia utlenienia pierwiastków będzie dość proste, niezależnie od złożoności i liczby poziomów atomowych.
Przydatne wideo: określanie stopnia utlenienia
Układ okresowy Mendelejewa zawiera prawie wszystkie informacje niezbędne do pracy z pierwiastkami chemicznymi. Na przykład dzieci w wieku szkolnym używają go wyłącznie do opisywania reakcji chemicznych. Aby więc określić maksymalne dodatnie i ujemne wartości stopnia utlenienia, należy sprawdzić oznaczenie pierwiastka chemicznego w tabeli:
- Maksymalna wartość dodatnia to numer grupy, w której znajduje się element.
- Maksymalny ujemny stopień utlenienia to różnica między maksymalną dodatnią granicą a liczbą 8.
Wystarczy więc po prostu znaleźć skrajne granice ładunku formalnego danego elementu. Czynność tę można wykonać za pomocą obliczeń opartych na układzie okresowym.
Ważne jest, aby wiedzieć! Jeden pierwiastek może mieć jednocześnie kilka różnych szybkości utleniania.
Istnieją dwie główne metody określania stopnia utlenienia, których przykłady przedstawiono poniżej. Pierwsza z nich to metoda wymagająca wiedzy i umiejętności stosowania praw chemii. Jak uporządkować stany utlenienia tą metodą?

Reguła wyznaczania stopni utlenienia
Aby to zrobić, potrzebujesz:
- Określ, czy dana substancja jest pierwiastkowa i czy znajduje się poza wiązaniem. Jeśli tak, to jej stopień utlenienia wyniesie 0, niezależnie od składu substancji (pojedyncze atomy lub wielopoziomowe związki atomowe).
- Ustal, czy dana substancja składa się z jonów. Jeśli tak, to stopień utlenienia będzie równy ich ładunkowi.
- Jeśli dana substancja jest metalem, spójrz na wskaźniki innych substancji we wzorze i oblicz odczyty metalu za pomocą operacji arytmetycznych.
- Jeśli cały związek ma jeden ładunek (w zasadzie jest to suma wszystkich cząstek reprezentowanych pierwiastków), wystarczy określić wskaźniki prostych substancji, następnie odjąć je od sumy i uzyskać dane dotyczące metalu.
- Jeśli relacja jest neutralna, suma całkowita musi wynosić zero.
Jako przykład rozważ połączenie z jonem glinu, którego ładunek netto wynosi zero. Zasady chemii potwierdzają, że jon Cl ma stopień utlenienia -1, a w tym przypadku w związku są ich trzy. Oznacza to, że jon Al musi wynosić +3, aby cały związek był obojętny.
Metoda ta jest bardzo dobra, ponieważ zawsze można sprawdzić poprawność rozwiązania, dodając do siebie wszystkie stopnie utlenienia.
Drugą metodę można zastosować bez znajomości praw chemicznych:
- Znajdź dane dotyczące cząstek, dla których nie ma ścisłych reguł i dokładna liczba ich elektronów jest nieznana (można to zrobić poprzez wykluczenie).
- Znajdź wskaźniki wszystkich innych cząstek, a następnie znajdź żądaną cząstkę od sumy, odejmując.
Rozważmy drugą metodę na przykładzie substancji Na2SO4, w której nie określa się atomu siarki S, wiadomo jedynie, że jest on różny od zera.
Aby dowiedzieć się, jakie są wszystkie stopnie utlenienia:
- Znajdź znane elementy, pamiętając o tradycyjnych zasadach i wyjątkach.
- Jon Na = +1, a każdy tlen = -2.
- Pomnóż liczbę cząstek każdej substancji przez ich elektrony, aby uzyskać stopnie utlenienia wszystkich atomów z wyjątkiem jednego.
- Na2SO4 zawiera 2 sód i 4 tlen, po pomnożeniu okazuje się, że: 2 X +1 = 2 to stopień utlenienia wszystkich cząstek sodu, a 4 X -2 = -8 - tlen.
- Dodaj otrzymane wyniki 2+(-8) =-6 - jest to całkowity ładunek związku bez cząstki siarki.
- Przedstaw zapis chemiczny jako równanie: suma znanych danych + nieznana liczba = całkowity ładunek.
- Na2SO4 przedstawia się następująco: -6 + S = 0, S = 0 + 6, S = 6.
Aby więc skorzystać z drugiej metody, wystarczy znać proste prawa arytmetyki.