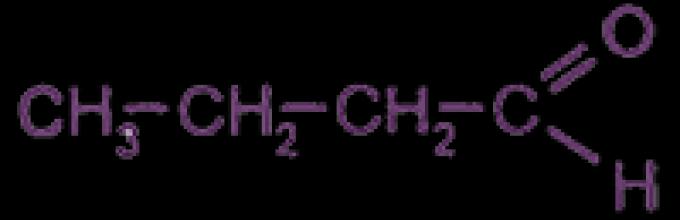(dla najprostszego aldehydu R=H)
Klasyfikacja aldehydów
Według struktury rodnika węglowodorowego:
Limit; Na przykład:

Bez limitu; Na przykład:

Aromatyczny; Na przykład:

Alicykliczny; Na przykład:

Wzór ogólny nasyconych aldehydów

Szereg homologiczny, izomeria, nazewnictwo

Aldehydy są izomerami z inną klasą związków, ketonami.

Na przykład:

Aldehydy i ketony zawierają grupę karbonylową ˃C=O i dlatego nazywane są związkami karbonylowymi.
Struktura elektronowa cząsteczek aldehydów
Atom węgla grupy aldehydowej znajduje się w stanie hybrydyzacji sp 2, dlatego wszystkie wiązania σ w tej grupie znajdują się w tej samej płaszczyźnie. Chmury elektronów p tworzących wiązanie π są prostopadłe do tej płaszczyzny i łatwo przemieszczają się w stronę bardziej elektroujemnego atomu tlenu. Dlatego wiązanie podwójne C=O (w przeciwieństwie do wiązania podwójnego C=C w alkenach) jest silnie spolaryzowane.
Właściwości fizyczne

Właściwości chemiczne
Aldehydy są związkami reaktywnymi, które podlegają licznym reakcjom. Najbardziej charakterystyczne dla aldehydów:
a) reakcje addycji przy grupie karbonylowej; Odczynniki typu HX dodaje się w następujący sposób:

b) reakcje utleniania Wiązania CH grupa aldehydowa, w wyniku czego powstają kwasy karboksylowe:
I. Reakcje addycji
1. Uwodornienie (powstają alkohole pierwszorzędowe

2. Dodatek alkoholi (powstają półacetale i acetale)

W nadmiarze alkoholu w obecności HCl półacetale przekształcają się w acetale:

II. Reakcje utleniania
1. Reakcja „srebrnego lustra”.

Uproszczony:

Reakcja ta jest reakcją jakościową na grupę aldehydową (na ściankach naczynia reakcyjnego tworzy się lustrzana powłoka metalicznego srebra).
2. Reakcja z wodorotlenkiem miedzi(II).

Reakcja ta jest również reakcją jakościową na grupę aldehydową y (wytrąca się czerwony osad Cu2O).
Formaldehyd jest utleniany za pomocą różnych utleniaczy zawierających O, najpierw do kwasu mrówkowego, a następnie do H 2 CO 3 (CO 2 + H 2 O):

III. Reakcje di-, tri- i polimeryzacji
1. Kondensacja aldolowa

2. Trimeryzacja aldehydu octowego

3. Polimeryzacja formaldehydu
Podczas długotrwałego przechowywania formaldehydu (40% wodny roztwór formaldehydu) zachodzi w nim polimeryzacja z utworzeniem białego osadu paraformy:

IV. Reakcja polikondensacji formaldehydu z fenolem

Wykład nr 11
ALDEHYDY I KETONY
Plan
1. Metody odbioru.
2. Właściwości chemiczne.
2.1. Reakcje nukleofilowe
przystąpienie.
2.2. Reakcje A -atom węgla.
2.3.
Wykład nr 11
ALDEHYDY I KETONY
Plan
1. Metody odbioru.
2. Właściwości chemiczne.
2.1. Reakcje nukleofilowe
przystąpienie.
2.2. Reakcje A -atom węgla.
2.3. Reakcje utleniania i redukcji.
Aldehydy i ketony zawierają grupę karbonylową
C=O. Ogólna formuła:
1. Metody otrzymywania.

2. Chemiczny
nieruchomości.
Aldehydy i ketony należą do najbardziej reaktywnych klas
związki organiczne. Ich Właściwości chemiczne zdeterminowana obecnością
grupa karbonylowa. Ze względu na dużą różnicę elektroujemności
węgiel i tlen oraz wysoka polaryzowalność p -wiązania Wiązanie C=O ma znaczną polarność
( m C=O =2,5-2,8 D). Karbonylowy atom węgla
grupa niesie efektywny ładunek dodatni i jest obiektem ataku
nukleofile. Głównym typem reakcji aldehydów i ketonów jest reakcje
addycja nukleofilowa Ad N. Ponadto wpływa grupa karbonylowa
reaktywność Połączenia S-N A -pozycja, zwiększając jej kwasowość.
Zatem cząsteczki aldehydów i ketonów
zawierają dwa główne centra reakcji - wiązanie C=O i Połączenie C-H V pozycja:

2.1. Reakcje nukleofilowe
przystąpienie.
Aldehydy i ketony łatwo dodają odczynniki nukleofilowe do wiązania C=O.
Proces rozpoczyna się od ataku nukleofila na atom węgla karbonylu. Następnie
Czworościenny związek pośredni utworzony w pierwszym etapie dodaje proton i
daje produkt dodawania:

Aktywność związków karbonylowych w
Ogłoszenie N –reakcje zależą od wielkości
efektywny ładunek dodatni na atomie węgla karbonylu i objętości
podstawniki w grupie karbonylowej. Podstawniki dostarczające elektrony i nieporęczne
komplikują reakcję, podstawniki odciągające elektrony zwiększają reakcję
zdolność związku karbonylowego. Dlatego aldehydy w
Ogłoszenie N -reakcje są bardziej aktywne niż
ketony.
Aktywność związków karbonylowych wzrasta w
obecność katalizatorów kwasowych, które zwiększają ładunek dodatni o
karbonylowy atom węgla:

Aldehydy i ketony dodają wodę, alkohole,
tiole, kwas cyjanowodorowy, wodorosiarczyn sodu, związki takie jak
N.H. 2 X. Wszystkie reakcje addycji
postępować szybko, w łagodnych warunkach, ale powstałe produkty z reguły
termodynamicznie niestabilny. Dlatego reakcje przebiegają odwracalnie, a zawartość
produkty dodawania w mieszaninie równowagowej mogą być niskie.
Podłączenie wody.
Aldehydy i ketony dodają wodę
tworzenie hydratów. Reakcja jest odwracalna. Tworzenie hydratów
termodynamicznie niestabilny. Bilans przesunięty jest w stronę produktów
dodatek tylko w przypadku aktywnych związków karbonylowych.

Produkt hydratacji aldehydu trójchlorooctowego
Wodzian chloralu jest stabilnym związkiem krystalicznym stosowanym w
lek jako środek uspokajający i nasenne.
Dodatek alkoholi i
tiole.
Aldehydy łączą się z alkoholami, tworząc półacetale. W nadmiarze alkoholu i w obecności katalizatora kwasowego
reakcja przebiega dalej - aż do powstania acetale

Reakcja tworzenia półacetalu przebiega jako
addycja nukleofilowa i jest przyspieszana w obecności kwasów lub
fusy.

Proces tworzenia acetalu przebiega następująco:
podstawienie nukleofilowe grupy OH w półacetalu i jest możliwe tylko pod pewnymi warunkami
kataliza kwasowa, gdy grupa OH jest przekształcana w dobrą grupę opuszczającą
(H 2O).

Tworzenie się acetali jest procesem odwracalnym. W
W środowisku kwaśnym półacetale i acetale łatwo ulegają hydrolizie. W środowisku zasadowym
hydroliza nie zachodzi. Reakcje tworzenia i hydrolizy acetali odgrywają ważną rolę
chemia węglowodanów.
Ketony w podobnych warunkach nie
dawać.
Tiole są silniejszymi nukleofilami niż alkohole
tworzą produkty addycji zarówno z aldehydami, jak i ketonami.
Dołączanie cyjanowodoru
kwasy
Kwas cyjanowodorowy dodaje się do związku karbonylowego w określonych warunkach
zasadowa kataliza z wytworzeniem cyjanohydryn.

Reakcja ma wartość preparatywną i
stosowany w syntezie a-hydroksy- i a -aminokwasy (patrz wykład nr 14). Owoce niektórych roślin
(np. gorzkie migdały) zawierają cyjanohydryny. Wyróżnia się, gdy oni
Po rozkładzie kwas cyjanowodorowy ma działanie trujące.
Dodatek wodorosiarczynu
sód
Aldehydy i ketony metylowe dodają wodorosiarczyn sodu NaHSO 3 z tworzeniem się pochodnych wodorosiarczynu.

Wodorosiarczynowe pochodne związków karbonylowych
– substancje krystaliczne, nierozpuszczalne w nadmiarze roztworu wodorosiarczynu sodu.
Reakcja służy do izolowania związków karbonylowych z mieszanin. Karbonyl
związek można łatwo zregenerować przez obróbkę pochodnej wodorosiarczynu
kwas lub alkaliczne.
Interakcja ze wspólnymi połączeniami
wzór NH 2 X.
Reakcje przebiegają wg ogólny schemat jako proces
eliminacja przywiązania. Addukt powstały w pierwszym etapie nie jest
stabilny i łatwo usuwa wodę.

Zgodnie z podanym schematem z karbonylem
związki reagują z amoniakiem, aminy pierwszorzędowe, hydrazyna, podstawione hydrazyny,
hydroksyloamina.

Powstałe pochodne są
substancje krystaliczne stosowane do izolacji i identyfikacji
związki karbonylowe.
Iminy (zasady Schiffa) są pośrednie
produktów w wielu procesach enzymatycznych (transaminacja pod wpływem
koenzym fosforan pirydoksalu; redukcyjne aminowanie ketokwasów w
udział koenzymu NADN). W wyniku katalitycznego uwodornienia imin powstaje
aminy Proces ten służy do syntezy amin z aldehydów i ketonów
zwane aminacją redukcyjną.
Redukcyjne aminowanie zachodzi in vivo
podczas syntezy aminokwasów (patrz wykład nr 16)
2.2. Reakcje wg A -atom węgla.
Tautomeria ketonowo-enolowa.
Wodór w A -pozycja do grupy karbonylowej jest kwasowa
właściwości, ponieważ anion powstający podczas jego eliminacji jest stabilizowany przez
rachunek rezonansowy.

Wynik ruchliwości protonów atomu wodoru
V A -pozycja
to zdolność związków karbonylowych do tworzenia form enolowych w wyniku
migracja protonów z A - pozycja względem atomu tlenu grupy karbonylowej.

Keton i enol są tautomery.
Tautomery to izomery, które mogą szybko i odwracalnie przekształcać się w siebie
w wyniku migracji grupy (w tym przypadku protonu). Równowaga pomiędzy
nazywane są ketonem i enolem tautomeryzm ketonowo-enolowy.
Proces enolizacji jest katalizowany przez kwasy i
powodów. Enolizację pod wpływem zasady można przedstawić jako
z następującym schematem:
Istnieje większość związków karbonylowych
głównie w formie ketonowej. Zawartość formy enolowej wzrasta wraz ze wzrostem
wzrost kwasowości związku karbonylowego, a także w przypadku
dodatkowa stabilizacja formy enolowej w wyniku wiązania wodorowego lub z powodu
łączenie w pary.
Tabela 8. Zawartość form enolowych i
kwasowość związków karbonylowych
Na przykład w związkach 1,3-dikarbonylowych
ruchliwość protonów grupy metylenowej gwałtownie wzrasta z powodu
efekt odciągania elektronów przez dwie grupy karbonylowe. Ponadto enol
forma jest ustabilizowana dzięki obecności w niej układu koniugatu P -wiązania i wewnątrzcząsteczkowe
wiązanie wodorowe.

Jeśli związek w postaci enolowej jest
jest układem sprzężonym o wysokiej energii stabilizacji, to forma enolowa
przeważa. Na przykład fenol występuje tylko w postaci enolowej.
Enolizacja i tworzenie anionów enolanowych
zachodzące pierwsze etapy reakcji związków karbonylowych A -atom węgla. Najważniejsze
z których są halogenowanie I aldolowo-krotonowy
kondensacja
.
Halogenowanie.
Aldehydy i ketony łatwo reagują z halogenami (Cl2,
Br 2, I 2 ) z edukacją
wyłącznie A -pochodne halogenowe.

Reakcja jest katalizowana przez kwasy lub
powodów. Szybkość reakcji nie zależy od stężenia i charakteru halogenu.
Proces przebiega poprzez utworzenie formy enolowej (etap powolny), która
następnie reaguje z halogenem (szybki etap). Zatem halogen nie jest
zaangażowany w prędkość—etap definiujący
proces.

Jeśli związek karbonylowy zawiera kilka A -wodór
atomów, wówczas wymiana każdego kolejnego następuje szybciej niż poprzedniego,
na skutek wzrostu ich kwasowości pod wpływem działania odciągającego elektrony
fluorowiec. W środowisku zasadowym dają aldehyd octowy i ketony metylowe
pochodne trihalogenowe, które są następnie rozkładane przez nadmiar alkaliów
powstawanie trihalometanów ( reakcja haloformowa)
.
W wyniku reakcji następuje rozkład trijodoacetonu
podstawienie nukleofilowe. Grupy CI 3 — anion wodorotlenkowy, jak S N -reakcje w grupie karboksylowej (patrz wykład nr 12).
Jodoform wytrąca się z mieszaniny reakcyjnej w postaci
jasnożółty krystaliczny osad o charakterystycznym zapachu. Jodoform
reakcję wykorzystuje się do celów analitycznych w celu wykrycia związków tego typu
CH 3 -CO-R, w tym
laboratoria kliniczne do diagnostyki cukrzycy.
Reakcje kondensacji.
W obecności katalitycznych ilości kwasów
lub alkalia zawierające związki karbonylowe A -atomy wodoru,
ulegają kondensacji i tworzą się B -związki hydroksykarbonylowe.

W edukacji Połączenia SS zaangażowany karbonyl
atom węgla jednej cząsteczki ( składnik karbonylowy) I A -atom węgla jest inny
Cząsteczki ( składnik metylenowy). Ta reakcja nazywa się kondensacja aldolowa(pod nazwą produktu kondensacji aldehydu octowego -
aldol).
Gdy mieszanina reakcyjna jest ogrzewana, produkt łatwo
odwadnia się, tworząc a, b -nienasycony karbonyl
znajomości.

Ten rodzaj kondensacji nazywa się kroton(pod nazwą produktu kondensacji aldehydu octowego - krotonu
aldehyd).
Rozważmy mechanizm kondensacji aldolowej w
środowisko alkaliczne. W pierwszym etapie anion wodorotlenkowy oddziela proton A -pozycja karbonylowa
związki tworzące anion enolanowy. Następnie anion enolanowy jako nukleofil
atakuje atom węgla karbonylu innej cząsteczki związku karbonylowego.
Powstały tetraedryczny związek pośredni (anion alkoholanowy) jest mocny
zasadą i dalej oddziela proton od cząsteczki wody.

Podczas kondensacji aldolowej dwóch różnych
możliwe związki karbonylowe (kondensacja krzyżowa aldolowa).
utworzenie 4 różnych produktów. Można tego jednak uniknąć, jeśli jeden z
nie zawiera związków karbonylowych A -atomy wodoru (na przykład aldehydy aromatyczne
lub formaldehyd) i nie może działać jako składnik metylenowy.

Jako składnik metylenowy w reakcjach
kondensacją mogą być nie tylko związki karbonylowe, ale także inne
Kwasy C-H. Reakcje kondensacji mają wartość preparatywną, ponieważ na to pozwalają
przedłużyć łańcuch atomów węgla. W zależności od rodzaju kondensacji aldolowej i
rozkład retroaldolu (proces odwrotny) zachodzi wiele reakcji biochemicznych
procesy: glikoliza, synteza kwasu cytrynowego w cyklu Krebsa, synteza kwasu neuraminowego
kwasy.
2.3. Reakcje utleniania i
powrót do zdrowia
Powrót do zdrowia
Związki karbonylowe są redukowane do
alkohole w wyniku uwodornienia katalitycznego lub pod wpływem
środki redukujące będące donorami anionów wodorkowych.

[H]: H2 /Kot kot. – Ni, Pt,
Pd;
LiAlH4; NaBH4.
Redukcja związków karbonylowych
złożone wodorki metali obejmują atak nukleofilowy grupy karbonylowej
anion wodorkowy. W wyniku hydrolizy powstaje alkohol.
Powrót do zdrowia następuje w ten sam sposób
grupę karbonylową in vivo pod wpływem koenzymu NADN., czyli
donor jonu wodorkowego (patrz wykład nr 19).
Utlenianie
Aldehydy bardzo łatwo się utleniają
wszelkie środki utleniające, nawet tak słabe, jak tlen i związki zawarte w powietrzu
srebro (I) i miedź(II).
Dwie ostatnie reakcje są używane jako
jakościowo dla grupy aldehydowej.
W obecności zasad, aldehydów, których nie zawierają A -atomy wodoru
nieproporcjonalne, tworząc alkohol i kwas (reakcja Cannizzaro).
2HCHO + NaOH® HCOONA + CH3OH
To jest powód, dla którego roztwór wodny
formaldehyd (formalina) podczas długotrwałego przechowywania staje się kwaśny
reakcja.
Ketony są odporne na środki utleniające
neutralne środowisko. W środowisku kwaśnym i zasadowym pod wpływem silnego
utleniacze(KMnO 4 ) Oni
utleniają się poprzez rozerwanie wiązania C-C. Szkielet węglowy jest rozkładany przez
podwójne wiązanie węgiel-węgiel form enolowych związku karbonylowego, podobne do
utlenianie wiązań podwójnych w alkenach. W ten sposób powstaje mieszanina produktów
zawierające kwasy karboksylowe lub kwasy karboksylowe i ketony.
Chemia organiczna jest bardzo złożoną, ale interesującą nauką. Przecież połączenia tych samych elementów, w różne ilości a sekwencja przyczynia się do powstawania różnych. Przyjrzyjmy się związkom z grupy karbonylowej zwanym „ketonami” (właściwości chemiczne, cechy fizyczne, metody ich syntezy). Porównamy je również z innymi substancjami tego samego rodzaju - aldehydami.
Ketony
Słowo to jest ogólną nazwą całej klasy substancji organicznych, w cząsteczkach których grupa karbonylowa (C=O) jest związana z dwoma rodnikami węglowymi.
W swojej strukturze ketony są zbliżone do aldehydów i kwasów karboksylowych. Zawierają jednak dwa atomy C (węgiel lub węgiel) połączone z C=O.
Formuła
Ogólny wzór substancji tej klasy jest następujący: R 1 -CO-R 2.
Aby było to bardziej zrozumiałe, z reguły jest to napisane w ten sposób.

W nim C=O oznacza grupę karbonylową. A R1 i R2 oznaczają rodniki węglowe. Na ich miejscu mogą pojawić się różne związki, jednak muszą one zawierać węgiel.
Aldehydy i ketony
Właściwości fizyczne i chemiczne tych grup substancji są do siebie dość podobne. Z tego powodu często rozważa się je łącznie.

Faktem jest, że aldehydy zawierają również w swoich cząsteczkach grupę karbonylową. Mają nawet bardzo podobne formuły do ketonów. Jeśli jednak w rozważanych substancjach C=O jest przyłączone do 2 rodników, to w aldehydach jest tylko jeden, zamiast drugiego - atom wodoru: R-CO-H.
Jako przykład możemy podać wzór substancji tej klasy - formaldehydu, lepiej znanego wszystkim jako formalina.

Na podstawie wzoru CH2O jasne jest, że jego grupa karbonylowa jest połączona nie z jednym, ale z dwoma atomami H jednocześnie.
Właściwości fizyczne
Zanim zrozumiemy właściwości chemiczne aldehydów i ketonów, warto przyjrzeć się ich właściwościom fizycznym.

- Ketony to topliwe lub lotne ciecze. Niżsi przedstawiciele tej klasy są dobrze rozpuszczalni w H2O i dobrze oddziałują ze swoim pochodzeniem.
Indywidualni przedstawiciele(na przykład CH 3 COCH 3) są wyjątkowo rozpuszczalne w wodzie i w absolutnie dowolnych proporcjach.
W przeciwieństwie do alkoholi i kwasów karboksylowych, ketony są bardziej lotne i mają tę samą masę cząsteczkową. Jest to ułatwione przez niezdolność tych związków do tworzenia wiązań z H, tak jak może to zrobić H-CO-R. - Różne rodzaje aldehydów mogą występować w różnych stany skupienia. Zatem wyższe R-CO-H są nierozpuszczalnymi ciałami stałymi. Dolne to ciecze, z których część doskonale miesza się z H 2 O, ale część z nich rozpuszcza się tylko w wodzie, ale nie więcej.
Najprostsza tego typu substancja, aldehyd mrówkowy, jest gazem o ostrym zapachu. Substancja ta jest dobrze rozpuszczalna w H2O.
Najbardziej znane ketony
Istnieje wiele substancji R1-CO-R2, ale niewiele z nich jest znanych. Przede wszystkim jest to keton dimetylowy, który wszyscy znamy jako aceton.

Jego rozpuszczalnikowym odpowiednikiem jest także butanon lub, jak się go poprawnie nazywa, keton metylowo-etylowy.
Inne ketony, których właściwości chemiczne są aktywnie wykorzystywane w przemyśle, obejmują acetofenon (keton metylofenylowy). W przeciwieństwie do acetonu i butanonu ma dość przyjemny zapach, dlatego wykorzystuje się go w przemyśle perfumeryjnym.
Na przykład cykloheksanon jest typowym przedstawicielem R1-CO-R2 i jest najczęściej stosowany do produkcji rozpuszczalników.
Nie sposób nie wspomnieć o diketonach. Nazwę tę nadano R1-CO-R2, które mają w swoim składzie nie jedną, ale dwie grupy karbonylowe. Zatem ich wzór wygląda następująco: R 1 -CO-CO-R 2. Jeden z najprostszych, ale powszechnie stosowany Przemysł spożywczy przedstawicielem diketonów jest diacetyl (2,3-butanodion).
Wymienione substancje to tylko niewielka lista ketonów syntetyzowanych przez naukowców (właściwości chemiczne omówiono poniżej). Tak naprawdę jest ich więcej, jednak nie wszystkie znalazły zastosowanie. Co więcej, warto wziąć pod uwagę, że wiele z nich jest toksycznych.
Właściwości chemiczne ketonów
- Ketony mają zdolność dodawania do siebie H (reakcja uwodornienia). Aby jednak ta reakcja zaszła konieczna jest obecność katalizatorów w postaci atomów metali niklu, kobaltu, miedzi, platyny, palladu i innych. W wyniku reakcji R1-CO-R2 przekształca się w alkohole drugorzędowe.
Również podczas interakcji z wodorem w obecności metale alkaliczne lub amalgamaty Mg, glikole otrzymuje się z ketonów. - Ketony, które mają co najmniej jeden atom alfa-wodoru, zazwyczaj ulegają tautomeryzacji keto-enolowej. Jest katalizowany nie tylko przez kwasy, ale także przez zasady. Zazwyczaj forma ketonowa jest bardziej stabilna niż forma enolowa. Ta równowaga umożliwia syntezę ketonów poprzez uwodnienie alkinów. Względna stabilizacja postaci ketonowej enolu przez sprzęganie prowadzi do dość silnej kwasowości R1-CO-R2 (w porównaniu z alkanami).
- Substancje te mogą reagować z amoniakiem. Jednakże postępują one bardzo powoli.
- Ketony oddziałują z powstałymi α-hydroksynitrylami, których zmydlanie przyczynia się do pojawienia się α-hydroksykwasów.
- Reakcja z halogenkami alkilomagnezu prowadzi do powstania alkoholi drugorzędowych.
- Dodatek do NaHSO 3 sprzyja tworzeniu się pochodnych wodorosiarczynu (wodorosiarczynu). Warto pamiętać, że w szeregi tłuszczowe mogą reagować jedynie ketony metylowe.
Oprócz ketonów aldehydy mogą w podobny sposób oddziaływać z wodorosiarczynem sodu.
Po podgrzaniu z roztworem NaHCO 3 (soda oczyszczona) lub kwasem mineralnym pochodne NaHSO 3 mogą się rozkładać, uwalniając wolny keton. - Podczas reakcji R1-CO-R2 z NH2OH (hydroksyloaminą) powstają ketoksymy, a produktem ubocznym jest H2O.
- W reakcjach z udziałem hydrazyny powstają hydrazony (stosunek przyjmowanych substancji wynosi 1:1) lub azyny (1:2).
Jeśli produkt otrzymany w wyniku reakcji (hydrazon) reaguje z żrącym potasem pod wpływem temperatury, N i węglowodory nasycone. Ten proces zwaną reakcją Kizhnera. - Jak wspomniano powyżej, aldehydy i ketony mają podobne właściwości chemiczne i procesy produkcyjne. W tym przypadku powstają acetale R1-CO-R2, które są bardziej złożone niż acetale R-CO-H. Powstają w wyniku działania estrów kwasów ortomrówkowego i ortokrzemowego na ketony.
- W warunkach wyższego stężenia zasad (na przykład po podgrzaniu stężonym H₂SO₄) R1-CO-R2 ulegają międzycząsteczkowemu odwodnieniu z utworzeniem nienasyconych ketonów.
- Jeśli w reakcji z R1-CO-R2 obecne są zasady, ketony ulegają kondensacji aldolowej. W efekcie powstają β-ketoalkohole, które z łatwością mogą utracić cząsteczkę H2O.
- Właściwości chemiczne ketonów są dość odkrywcze na przykładzie acetonu poddanego reakcji z tlenkiem mezytylu. W tym przypadku powstaje nowa substancja zwana „foronem”.
- Również do właściwości chemicznych przedmiotu materia organiczna można przypisać reakcji Leuckarta-Wallacha, która sprzyja redukcji ketonów.
Z czego otrzymuje się R1-CO-R2?
Po zapoznaniu się z właściwościami danych substancji warto poznać najpopularniejsze metody ich syntezy.
- Jedną z najbardziej znanych reakcji wytwarzania ketonów jest alkilowanie i acylowanie związki aromatyczne w obecności katalizatorów kwasowych (AlCl 3 , FeCl 3 , kwasy mineralne, tlenki, żywice kationowymienne itp.). Ta metoda znane jako reakcja Friedela-Craftsa.
- Ketony syntetyzowane są poprzez hydrolizę ketoimin i wic-dioli. W przypadku tego ostatniego konieczna jest obecność katalizatorów.
- Aby otrzymać ketony, stosuje się również hydratację homologów acetylenu, czyli jak to się nazywa, reakcję Kucherowa.
- Reakcje Guben-Gesch.
- Cyklizacja Ruzickiej nadaje się do syntezy cykloketonów.
- Substancje te ekstrahuje się również z trzeciorzędowych peroksoeterów za pomocą przegrupowania Krige'a.
- Istnieje kilka sposobów syntezy ketonów podczas reakcji utleniania alkoholi drugorzędowych. W zależności od substancji czynnej wyróżnia się 4 reakcje: Swerna, Kornbluma, Corey-Kima i Parika-Deringa.
Szereg zastosowań
Rozumiejąc właściwości chemiczne i produkcję ketonów, warto dowiedzieć się, gdzie substancje te są wykorzystywane.

Jak wspomniano powyżej, większość z nich znajduje zastosowanie w przemyśle chemicznym jako rozpuszczalniki do lakierów i emalii, a także do produkcji polimerów.
Ponadto, niektóre R1-CO-R2 sprawdziły się jako środki smakowo-zapachowe. W tym charakterze ketony (benzofenon, acetofenon i inne) są stosowane w przemyśle perfumeryjnym i gotowaniu.
Acetofenon stosowany jest także jako składnik do produkcji tabletek nasennych.

Benzofenon, ze względu na zdolność pochłaniania szkodliwego promieniowania, jest częstym składnikiem kosmetyków przeciwdziałających opalaniu i jednocześnie środkiem konserwującym.
Wpływ R1-CO-R2 na organizm
Dowiedziawszy się, jakie związki nazywane są ketonami (właściwości chemiczne, zastosowanie, synteza i inne dane na ich temat), warto zapoznać się z biologiczną charakterystyką tych substancji. Innymi słowy, dowiedz się, jak działają na organizmy żywe.
Pomimo dość częstego stosowania R1-CO-R2 w przemyśle, zawsze warto pamiętać, że takie związki są bardzo toksyczne. Wiele z nich ma właściwości rakotwórcze i mutagenne.
Specjalni przedstawiciele mogą powodować podrażnienie błon śluzowych, a nawet oparzenia. Alicykliczny R1-CO-R2 może działać na organizm jak narkotyki.
Jednak nie wszystkie tego typu substancje są szkodliwe. Faktem jest, że niektóre z nich biorą czynny udział w metabolizmie organizmów biologicznych.
Ketony są także unikalnymi markerami zaburzeń metabolizmu węgla i niedoboru insuliny. Analizując mocz i krew, obecność R1-CO-R2 wskazuje na różne zaburzenia metaboliczne, w tym hiperglikemię i kwasicę ketonową.
Aldehydy to związki, których cząsteczki zawierają grupę karbonylową połączoną z atomem wodoru, tj. ogólny wzór aldehydów można zapisać jako
gdzie R oznacza rodnik węglowodorowy, który może mieć różny stopień nasycenia, na przykład nasycony lub aromatyczny.
Grupa –CHO nazywana jest aldehydem.
Ketony – związki organiczne, którego cząsteczki zawierają grupę karbonylową połączoną z dwoma rodnikami węglowodorowymi. Ogólny wzór na ketony można zapisać jako:
gdzie R i R' oznaczają rodniki węglowodorowe, na przykład nasycone (alkilowe) lub aromatyczne.
Uwodornienie aldehydów i ketonów
Aldehydy i ketony można redukować wodorem w obecności katalizatorów i ogrzewając odpowiednio do alkoholi pierwszorzędowych i drugorzędowych:
Utlenianie aldehydów
Aldehydy można łatwo utlenić nawet za pomocą tak łagodnych utleniaczy, jak wodorotlenek miedzi i amoniakalny roztwór tlenku srebra.
Po podgrzaniu wodorotlenku miedzi i aldehydu początkowy niebieski kolor mieszaniny reakcyjnej znika i powstaje ceglasty osad tlenku miedziawego:
W reakcji z amoniakalnym roztworem tlenku srebra zamiast samego kwasu karboksylowego powstaje jego sól amonowa, ponieważ amoniak w roztworze reaguje z kwasami:
Ketony nie reagują z wodorotlenkiem miedzi (II) i amoniakalnym roztworem tlenku srebra. Z tego powodu reakcje te są jakościowe dla aldehydów. Tak więc reakcja z roztworem amoniaku tlenku srebra o godz prawidłowa technika jego wykonanie prowadzi do powstania charakterystycznego srebrnego lustra na wewnętrznej powierzchni naczynia reakcyjnego.
Oczywiście, jeśli łagodne środki utleniające mogą utleniać aldehydy, to silniejsze środki utleniające, na przykład nadmanganian potasu lub dichromian potasu, mogą naturalnie zrobić to samo. Gdy te środki utleniające stosuje się w obecności kwasów, powstają kwasy karboksylowe:
Właściwości chemiczne kwasów karboksylowych
Kwasy karboksylowe są pochodnymi węglowodorów zawierającymi jedną lub więcej grup karboksylowych.
Grupy karboksyloweA:
Jak widać, grupa karboksylowa składa się z grupy karbonylowej –C(O)- połączonej z grupą hydroksylową –OH.
Ze względu na to, że grupa karbonylowa jest bezpośrednio przyłączona do grupy hydroksylowej, co ma negatywny efekt indukcyjny Połączenie O-H jest bardziej polarny niż w alkoholach i fenolach. Z tego powodu kwasy karboksylowe są zauważalnie wyraźniejsze niż alkohole i fenole, właściwości kwasowe. W roztwory wodne wykazują właściwości słabych kwasów, tj. odwracalnie dysocjują na kationy wodoru (H+) i aniony reszt kwasowych:
Reakcje tworzenia soli
Tworząc sole, kwasy karboksylowe reagują z:
1) metale do wodoru w szeregu aktywności:
2) amoniak
3) podstawowe i tlenki amfoteryczne:
4) zasadowe i amfoteryczne wodorotlenki metali:
5) sole słabszych kwasów - węglany i wodorowęglany, siarczki i wodorosiarczki, sole wyższe (z duża liczba atomy węgla w cząsteczce) kwasy:
Systematyczne i trywialne nazwy niektórych kwasów i ich soli przedstawiono w poniższej tabeli:
| Formuła kwasowa | Nazwa kwasu banalna/systematyczna | Nazwa soli banalna/systematyczna |
| HCOOH | mrówkowy / metan | mrówczan/metanian |
| CH3COOH | oct/etan | octan/etanian |
| CH3CH2COOH | propionowy/propan | propionian/propanian |
| CH3CH2CH2COOH | olej/butan | maślan/butanian |
Należy też pamiętać o odwrotnej sytuacji: mocne kwasy mineralne wypierają ze swoich soli kwasy karboksylowe jako słabsze:
Reakcje z udziałem grupy OH
Kwasy karboksylowe wchodzić w reakcję estryfikacji z alkoholami jednowodorotlenowymi i wielowodorotlenowymi w obecności mocnych kwasy nieorganiczne, w tym przypadku powstają estry:
Ten typ reakcji jest odwracalny, a zatem ma na celu przesunięcie równowagi w stronę formacji ester należy je przeprowadzić poprzez oddestylowanie bardziej lotnego estru przez ogrzewanie.
Odwrotność reakcji estryfikacji nazywa się hydrolizą estrów:
Ta reakcja zachodzi nieodwracalnie w obecności zasad, ponieważ powstały kwas reaguje z wodorotlenkiem metalu, tworząc sól:
Reakcje podstawienia atomów wodoru w podstawniku węglowodorowym
Podczas przeprowadzania reakcji węglanów z chlorem lub bromem w obecności czerwonego fosforu, po podgrzaniu atomy wodoru przy atomie węgla α zastępuje się atomami halogenu:
W przypadku wyższego stosunku halogen/kwas może nastąpić głębsze chlorowanie:
Reakcje zniszczenia grupy karboksylowej (dekarboksylacja)
Specjalne właściwości chemiczne kwasu mrówkowego
Cząsteczka kwasu mrówkowego, pomimo niewielkich rozmiarów, zawiera dwa grupy funkcyjne:
Pod tym względem wykazuje nie tylko właściwości kwasów, ale także właściwości aldehydów:
Pod wpływem stężonego kwasu siarkowego kwas mrówkowy rozkłada się na wodę i tlenek węgla.
Aldehydy i ketony są pochodnymi węglowodorów, których cząsteczki zawierają grupę karbonylową. Aldehydy różnią się budową od ketonów w pozycji grupy karbonylowej. O właściwości fizyczne W artykule omówiono aldehydy i ketony, a także ich klasyfikację i nazewnictwo.
Właściwości fizyczne
W przeciwieństwie do alkoholi i fenoli, aldehydy i ketony nie charakteryzują się tworzeniem wiązań wodorowych, dlatego ich temperatury wrzenia i topnienia są znacznie niższe. Zatem formaldehyd jest gazem: aldehyd octowy wrze w temperaturze 20,8 stopnia, a metanol wrze w temperaturze 64,7 stopnia. Podobny do fenolu - substancja krystaliczna, a benzaldehyd jest cieczą.
Formaldehyd jest bezbarwnym gazem o ostrym zapachu. Pozostali członkowie szeregu aldehydów to ciecze, a wyższe aldehydy to ciecze ciała stałe. Dolne składniki tej serii (formaldehyd, aldehyd octowy) są rozpuszczalne w wodzie i mają ostry zapach. Wyższe aldehydy są dobrze rozpuszczalne w większości rozpuszczalników organicznych (alkohole, etery), aldehydy C3-C8 mają bardzo nieprzyjemny zapach, a wyższe aldehydy są stosowane w przemyśle perfumeryjnym ze względu na ich kwiatowy zapach.

Ryż. 1. Tabela klasyfikacji aldehydów i ketonów.
Ogólny wzór aldehydów i ketonów jest następujący:
- formuła aldehydowa – R-COH
- formuła ketonowa – R-CO-R
Klasyfikacja i nazewnictwo
Aldehydy i ketony różnią się rodzajem łańcucha węglowego zawierającego grupę karbonylową. Rozważmy związki tłuszczowe i aromatyczne:
- acykliczny, limit. Pierwszym członkiem homologicznej serii aldehydów jest aldehyd mrówkowy (formaldehyd, metanal) – CH 2 = O.
Aldehyd mrówkowy stosowany jest jako środek antyseptyczny. Służy do dezynfekcji pomieszczeń i zaprawiania nasion.
Drugim członkiem szeregu aldehydów jest aldehyd octowy (aldehyd octowy, etanal). Jest stosowany jako półprodukt w syntezie kwas octowy I alkohol etylowy z acetylenu.

Ryż. 2. Formuła: aldehyd octowy.
- Nieograniczony. Należy wspomnieć o takich nienasyconych aldehydach jak akroleina (propenal). Aldehyd ten powstaje podczas termicznego rozkładu gliceryny i tłuszczów, część integralna czyli gliceryna.
- aromatyczny. Pierwszym członkiem homologicznej serii aldehydów aromatycznych jest aldehyd benzenowy (benzaldehyd). Można również zauważyć aldehyd pochodzenia roślinnego, taki jak wanilina (3-metoksy-4-hydroksybenzaldehyd).

Ryż. 3. Formuła wanilinowa.
Ketony mogą być czysto aromatyczne lub tłuszczowo-aromatyczne. Na przykład keton difenylowy (benzofenon) jest czysto aromatyczny. Tłuszczowy aromat to np. keton metylofenylowy (acetofenon)
Czego się nauczyliśmy?
Na lekcjach chemii w 10. klasie najważniejszym zadaniem jest nauka aldehydów i ketonów. W aldehydach atom węgla grupy karbonylowej jest pierwszorzędowy, a w ketonach drugorzędny. Dlatego w aldehydach grupa karbonylowa jest zawsze związana z atomem wodoru. Grupa aldehydowa ma więcej aktywność chemiczna niż keton, zwłaszcza w reakcjach utleniania.
Testuj w temacie
Ocena raportu
Średnia ocena: 4.2. Łączna liczba otrzymanych ocen: 166.