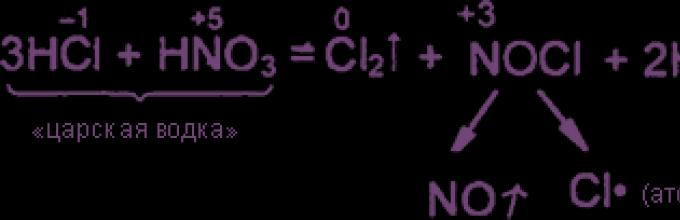Chlorowodór (HC I )klasa zagrożenia 3
Bezbarwny gaz o ostrym zapachu, cięższy od powietrza, skrapla się w temperaturze –85,1 0 C, a krzepnie w temperaturze –114,2 0 C. W powietrzu dymi w wyniku tworzenia się kropel mgły z parą wodną. Niepalny, wybuchowy po ogrzaniu pojemników. Dobrze rozpuszcza się w wodzie, gorzej w cieczach organicznych. W normalnych warunkach w jednej objętości wody rozpuszcza się 450-500 objętości gazu. 27,5-38% roztwór chlorowodoru w wodzie tworzy kwas solny, a 36% roztwór chlorowodoru w wodzie tworzy stężony kwas solny.
Stosuje się chlorowodór do produkcji kwasu solnego, chlorku winylu, chlorków alkilu, do chlorowania oksydacyjnego związki organiczne, otrzymywania chlorków metali, alkoholu hydrolitycznego, glukozy, cukru, żelatyny i kleju, w procesie barwienia tekstyliów, trawienia metali, w procesach hydrometalurgicznych i galwanizacji. Chlorowodór powstaje jako produkt uboczny chlorowania i odchlorowodorowanie związki organiczne, a także w oddziaływaniu chlorku sodu z kwasem siarkowym. Obecnie wytwarza się go syntetycznie poprzez spalanie wodoru w strumieniu chloru.
Transportowany jest chlorowodór w cysternach, kontenerach i butlach kolejowych i drogowych, które mają charakter tymczasowy przechowywane. Zazwyczaj przechowywany jest chlorowodór w stanie skroplonym w temperaturze otoczenia pod ciśnieniem własnych oparów wynoszącym 6–18 kgf/cm 2 w naziemnych cylindrycznych zbiornikach poziomych. Maksymalna objętość składowania wynosi 1,98 tony.
Maksymalne dopuszczalne stężenie (MPC) chlorowodór w powietrzu osady: średnio dobowo - 0,02 mg/m 3 , maksymalnie jednorazowo - 0,05 mg/m 3 , w powietrzu obszaru roboczego obiektów przemysłowych - 5 mg/m3.Chlorowodór działa silnie drażniąco na układ oddechowy. Długotrwałe narażenie na niskie stężenia powoduje katar górnych dróg oddechowych i szybkie niszczenie szkliwa zębów. Stężenia 50-75 mg/m3 są trudne do tolerowania, ostremu zatruciu towarzyszy chrypka, dławienie się i kaszel. Stężenia 75-150 mg/m 3 są nie do tolerowania, powodują podrażnienie błon śluzowych, zapalenie spojówek, uczucie uduszenia i utratę przytomności.
Podczas eliminowania wypadków związane z wyciekiem (emisją) chlorowodoru, należy odizolować niebezpieczny obszar, usunąć z niego ludzi, pozostać od strony nawietrznej, unikać niskie miejsca wchodź na teren wypadku wyłącznie w pełnym ubraniu ochronnym. Bezpośrednio na miejscu wypadku oraz w odległości do 50 metrów od źródła skażenia prowadzone są prace w maskach gazowych izolacyjnych IP-4M, IP-5, IP-6 (przy użyciu tlenu związanego chemicznie), aparatach oddechowych ASV-2, DASV (przy użyciu sprężonego powietrza) 8, KIP-9 (na sprężonym tlenie) i środki ochrony skóry (L-1, OZK, KIH-4, KIH-5 itp.). W odległości większej niż 50 metrów od źródła, gdzie stężenie chlorowodoru gwałtownie maleje, nie ma konieczności stosowania środków ochrony skóry, a do ochrony układu oddechowego stosuje się środki filtrujące: wielkogabarytowe przemysłowe maski przeciwgazowe z pudełkami klasy B i BKF, małe z pudełkiem klasy B, cywilne maski przeciwgazowe GP-5, GP-7, PDF-2D, PDF-2Sh w komplecie z DPG-3 lub respiratorami RPG-67, RU-60M z pudełkiem marka V.
|
Środki ochrony |
Czas ochronnydziałanie (godzina) w stężeniach(mg/m3) |
||||
|
Nazwa |
Marka pudełka |
5000 |
|||
|
Przemysłowy Maski gazowe: duży rozmiar mały rozmiar |
BKF |
||||
|
Cywilne maski gazowe: GP-5, GP-7, PDF-2Sh, PDF-2D |
|||||
|
Respiratory: RPG-67, RU-60M |
|||||
Oznacza się obecność chlorowodoru:
W powietrzu strefy przemysłowej z analizatorem gazu OKA-T-N kl , wykrywacz gazu IGS-98-N kl , uniwersalny analizator gazów UG-2 o zakresie pomiarowym 0-100 mg/m 3 , detektor gazów przemysłowych emisji chemicznych GPHV-2 w zakresie 5-500 mg/m 3 .
W otwartej przestrzeni – z urządzeniami SIP „CORSAR-X”.
Wewnątrz - z urządzeniami SIP „VEGA-M”
Zneutralizować chlorowodór następujące roztwory alkaliczne
5% wodny roztwór sody kaustycznej (na przykład 50 kg sody kaustycznej na 950 litrów wody);
5% wodny roztwór sody w proszku (na przykład 50 kg sody trochę proszku na 950 litrów wody);
5% wodny roztwór wapna gaszonego (na przykład 50 kg wapna gaszonego na 950 litrów wody);
5% wodny roztwór sody kaustycznej (na przykład 50 kg sody kaustycznej na 950 litrów wody);
Przy neutralizacji chlorowodoru jego pary wytrąca się za pomocą kurtyny wodnej (zużycie wody nie jest znormalizowane), przy neutralizacji wytrąconych oparów stosuje się wodę lub 5% wodne roztwory sody kaustycznej, sody w proszku, wapna gaszonego i sody kaustycznej. Do rozpylania wody lub roztworów stosuje się wozy pojeniowe, strażackie, stacje automatycznego napełniania (ATs, PM-130, ARS-14, ARS-15), a także hydranty i specjalne systemy dostępne w obiektach chemicznie niebezpiecznych.
W celu usunięcia zanieczyszczonej gleby na miejscu wycieku po neutralizacji chlorowodoru, wierzchnia warstwa gleby jest rozcinana do głębokości skażenia, zbierana i transportowana do utylizacji za pomocą pojazdów do robót ziemnych (buldożery, zgarniarki, równiarki, wywrotki). Wycięte miejsca przykrywa się świeżą warstwą gleby i w celach kontrolnych przemywa wodą.
Działania lidera: odizolować strefę niebezpieczną w promieniu co najmniej 50 metrów, usunąć z niej osoby, trzymać się strony nawietrznej, unikać nisko położonych miejsc. Na teren wypadku należy wchodzić wyłącznie w pełnym ubraniu ochronnym.
Udzielenie pierwszej pomocy:
Na obszarze skażonym: przemyć oczy i twarz obficie wodą, nałożyć anty-vogaza, pilne wycofanie się (usunięcie) z ogniska.
Po ewakuacji skażonego obszaru: rozgrzewanie, odpoczynek, zmywanie kwasu powstałego w wyniku oddziaływania chlorowodoru z wodą z otwartych obszarów skóry i odzieży wodą, obficie przemywanie oczu wodą, w przypadku trudności w oddychaniu, zastosowanie ciepła w okolicy szyi, podskórnie - 1 ml 0,1% roztwór siarczanu atropiny. Natychmiastowa ewakuacja do placówki medycznej.
3. Zastosowanie
Chlorowodór, chlorowodór bezbarwny, termicznie stabilny gaz o ostrym zapachu, dymi w wilgotnym powietrzu, łatwo rozpuszcza się w wodzie tworząc kwas solny. W temperaturze -85,1 ° C skrapla się w bezbarwną, ruchliwą ciecz. W temperaturze -114,22 ° C HCl przechodzi w stan stały. W stanie stałym chlorowodór występuje w postaci dwóch modyfikacji krystalicznych: rombowej, stabilnej poniżej -174,75 ° C i sześciennej.
Nieruchomości
Nazywa się wodnym roztworem chlorowodoru kwas chlorowodorowy. Po rozpuszczeniu w wodzie zachodzą następujące procesy:
HCl g + H 2 O l ⇌ H 3 O l + Cl l
Proces rozpuszczania jest silnie egzotermiczny. Z wodą HCl tworzy mieszaninę azeotropową zawierającą 20,24% HCl.
Kwas solny jest mocnym kwasem jednozasadowym, silnie oddziałuje ze wszystkimi metalami w szeregu napięcia na lewo od wodoru, z zasadami i tlenki amfoteryczne, zasady i sole tworzące sole chlorki:
Mg + 2 HCl → MgCl 2 + H 2 FeO + 2 HCl → FeCl 2 + H 2 O
Chlorki są niezwykle powszechne i mają najszersze zastosowanie. Większość z nich jest dobrze rozpuszczalna w wodzie i całkowicie dysocjuje na jony. Słabo rozpuszczalne są chlorek ołowiu, chlorek srebra, chlorek rtęci i chlorek miedzi.
Pod wpływem silnych utleniaczy lub podczas elektrolizy chlorowodór wykazuje właściwości redukujące:
MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O
Po podgrzaniu chlorowodór utlenia się tlenem CuCl 2):
4 HCl + O 2 → 2 H 2 O +2 Cl 2
Jednakże stężony kwas solny reaguje z miedzią, tworząc jednowartościowy kompleks miedzi:
2 Cu + 4 HCl → 2 H + 2 H 2
Mieszanina 3 części objętościowych stężonego kwasu solnego i 1 części objętościowej stężonego kwasy azotowe zwana „wódką królewską”. Aqua regia może nawet rozpuścić złoto i platynę. Wysoka aktywność oksydacyjna wody królewskiej wynika z obecności w niej chlorku nitrozylu i chloru, które są w równowadze z substancjami wyjściowymi:
4 H 3 O + 3 Cl + NO 3 ⇌ NOCl + Cl 2 + 6 H 2 O
Ze względu na wysokie stężenie jonów chlorkowych w roztworze metal wiąże się w kompleks chlorkowy, co sprzyja jego rozpuszczaniu.
Cl 2 w obj. T - żółto-zielony gaz o ostrym, duszącym zapachu, 2,5 razy cięższy od powietrza, słabo rozpuszczalny w wodzie (~ 6,5 g/l); X. R. w niepolarnych rozpuszczalnikach organicznych. Występuje w postaci wolnej tylko w gazach wulkanicznych.
Metody uzyskiwania
Oparty na procesie utleniania anionów Cl
2Cl - - 2e - = Cl 2 0
Przemysłowy
Elektroliza wodnych roztworów chlorków, częściej NaCl:
2NaCl + 2H 2 O = Cl 2 + 2NaOH + H 2
Laboratorium
Utlenianie stęż. HCl z różnymi utleniaczami:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
16HCl + 2KMnO 4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
6HCl + KClO3 = 3Cl2 + KCl + 3H2O
14HCl + K 2 Cr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Właściwości chemiczne
Chlor jest bardzo silnym utleniaczem. Utlenia metale, niemetale i substancje złożone, zamieniając się w bardzo stabilne aniony Cl -:
Cl 2 0 + 2e - = 2Cl -
Reakcje z metalami
Aktywne metale w atmosferze suchego chloru gazowego zapalają się i palą; w tym przypadku tworzą się chlorki metali.
Cl2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Metale o niskiej aktywności łatwiej utleniają się za pomocą mokrego chloru lub jego roztworów wodnych:
Cl2 + Cu = CuCl2
3Cl2 + 2Au = 2AuCl3
Reakcje z niemetalami
Chlor nie oddziałuje bezpośrednio tylko z O 2, N 2, C. Reakcje z innymi niemetalami zachodzą w różnych warunkach.
Tworzą się halogenki niemetali. Najważniejszą reakcją jest interakcja z wodorem.
Cl2 + H2 = 2HC1
Cl 2 + 2S (stop) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (lub РCl 5 - powyżej Cl 2)
2Cl2 + Si = SiCl4
3Cl 2 + Ja 2 = 2ICl 3
Wypieranie wolnych niemetali (Br 2, I 2, N 2, S) z ich związków
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
3Cl2 + 2NH3 = N2 + 6HCl
Dysproporcja chloru w wodzie i wodnych roztworach zasad
W wyniku samoutleniania-samoredukcji część atomów chloru przekształca się w aniony Cl, a inne w stopień pozytywny utlenianie są częścią anionów ClO - lub ClO 3 -.
Cl2 + H2O = HCl + HClO kwas podchlorawy
Cl2 + 2KOH = KCl + KClO + H2O
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
3Cl 2 + 2Ca(OH) 2 = CaCl 2 + Ca(ClO) 2 + 2H 2 O
Reakcje te są ważne, ponieważ prowadzą do związki tlenu chlor:
KClO 3 i Ca(ClO) 2 - podchloryn; KClO 3 - chloran potasu (sól Bertholleta).
Oddziaływanie chloru z substancjami organicznymi
a) zamiana atomów wodoru w cząsteczkach OM
b) przyłączenie cząsteczek Cl 2 w miejscu zerwania wielokrotnych wiązań węgiel-węgiel
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-dichloroetan
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl2 1,1,2,2-tetrachloroetan
Chlorowodór i kwas solny
Chlorowodór gazowy
Fizyczne i chemiczne właściwości
HCl - chlorowodór. Przy obr. T - bezbarwny. gaz o ostrym zapachu, dość łatwo ulegający skropleniu (t.t. -114°C, temperatura wrzenia -85°C). Bezwodny HCl, zarówno w stanie gazowym, jak i ciekłym, nie przewodzi prądu elektrycznego i jest chemicznie obojętny w stosunku do metali, tlenków i wodorotlenków metali oraz wielu innych substancji. Oznacza to, że w przypadku braku wody chlorowodór nie wykazuje właściwości kwasowe. Dopiero w bardzo wysokich temperaturach gazowy HCl reaguje z metalami, nawet tak mało aktywnymi jak Cu i Ag.
W niewielkim stopniu pojawiają się także właściwości redukujące anionu chlorkowego w HCl: jest on utleniany przez fluor obj. T, a także w wysokiej T (600°C) w obecności katalizatorów reaguje odwracalnie z tlenem:
2HCl + F2 = Cl2 + 2HF
4HCl + O 2 = 2Сl 2 + 2H 2 O
Gazowy HCl jest szeroko stosowany w syntezie organicznej (reakcje chlorowodorowania).
Metody uzyskiwania
1. Synteza z proste substancje:
H2 + Cl2 = 2HCl
2. Powstały jako produkt uboczny podczas chlorowania węglowodorów:
R-H + Cl2 = R-Cl + HCl
3. W laboratorium otrzymuje się go przez działanie stęż. H 2 SO 4 dla chlorków:
H 2 SO 4 (stężony) + NaCl = 2HCl + NaHSO 4 (przy niskim ogrzewaniu)
H 2 SO 4 (stężony) + 2 NaCl = 2 HCl + Na 2 SO 4 (przy bardzo wysokim ogrzewaniu)
Wodny roztwór HCl - mocny kwas (chlorowodorowy lub solny)
HCl jest bardzo dobrze rozpuszczalny w wodzie: przy obj. W 1 litrze H 2 O rozpuszcza się ~ 450 litrów gazu (rozpuszczaniu towarzyszy wydzielenie znacznej ilości ciepła). Nasycony roztwór ma ułamek masowy HCl równy 36-37%. Roztwór ten ma bardzo ostry, duszący zapach.
Cząsteczki HCl w wodzie niemal całkowicie rozpadają się na jony, tj. roztwór wodny HCl jest mocnym kwasem.
Właściwości chemiczne kwasu solnego
1. HCl rozpuszczony w wodzie ujawnia wszystko właściwości ogólne kwasy ze względu na obecność jonów H +
HCl → H + + Cl -
Interakcja:
a) z metalami (do H):
2HCl2 + Zn = ZnCl2 + H2
b) z tlenkami zasadowymi i amfoterycznymi:
2HCl + CuO = CuCl2 + H2O
6HCl + Al 2 O 3 = 2 AlCl 3 + ZN 2 O
c) z zasadami i wodorotlenkami amfoterycznymi:
2HCl + Ca(OH) 2 = CaCl 2 + 2H 2 O
3HCl + Al(OH) 3 = AlCl3 + ZH2O
d) z solami słabszych kwasów:
2HCl + CaCO3 = CaCl2 + CO2 + H3O
HCl + C 6 H 5 ONa = C 6 H 5 OH + NaCl
e) z amoniakiem:
HCl + NH3 = NH4Cl
Reakcje z silnymi utleniaczami F 2, MnO 2, KMnO 4, KClO 3, K 2 Cr 2 O 7. Anion Cl - utlenia się do wolnego halogenu:
2Cl - - 2e - = Cl 2 0
Równania reakcji można znaleźć w artykule „Produkcja chloru”. Szczególne znaczenie ma ORR między kwasem chlorowodorowym i azotowym:

Reakcje ze związkami organicznymi
Interakcja:
a) z aminami (jako zasady organiczne)
R-NH2 + HCl → + Cl -
b) z aminokwasami (jako związki amfoteryczne)

Tlenki chloru i oksokwasy
Tlenki kwasowe

Kwasy

Sole
Właściwości chemiczne
1. Wszystkie oksokwasy chloru i ich sole są silnymi utleniaczami.
2. Prawie wszystkie związki rozkładają się pod wpływem ogrzewania w wyniku wewnątrzcząsteczkowej redukcji utleniania lub dysproporcjonowania.

Proszek wybielający
Wapno chlorowe (wybielające) jest mieszaniną podchlorynu i chlorku wapnia, ma działanie wybielające i dezynfekujące. Czasami uważany za przykład soli mieszanej zawierającej jednocześnie aniony dwóch kwasów:

Woda Javela
Wodny roztwór chlorku potasu i hapochlorynu KCl + KClO + H 2 O
Chlorki są niezwykle powszechne w przyrodzie i mają najszersze zastosowanie (halit, sylwin). Większość z nich jest dobrze rozpuszczalna w wodzie i całkowicie dysocjuje na jony. Słabo rozpuszczalne są chlorek ołowiu (PbCl2), chlorek srebra (AgCl), (Hg2Cl2, kalomel) i chlorek miedzi(I) (CuCl).
Chlorowodór charakteryzuje się także reakcjami addycji do wiązań wielokrotnych (addycja elektrofilowa):
Paragon
W warunkach laboratoryjnych chlorowodór otrzymuje się w reakcji stężonego kwasu siarkowego z chlorkiem sodu (solą kuchenną) przy niskim ogrzewaniu:
W przemyśle chlorowodór otrzymywano dotychczas głównie metodą siarczanową (metoda Leblanc), opartą na oddziaływaniu chlorku sodu ze stężonym kwasem siarkowym. Obecnie w celu otrzymania chlorowodoru zwykle stosuje się bezpośrednią syntezę z prostych substancji:
W warunkach produkcyjnych synteza odbywa się w specjalnych instalacjach, w których wodór spala się w sposób ciągły równomiernym płomieniem w strumieniu chloru, mieszając się z nim bezpośrednio w palniku. Zapewnia to spokojną (bez eksplozji) reakcję. Wodór dostarczany jest w nadmiarze (5 - 10%), co pozwala na całkowite wykorzystanie cenniejszego chloru i otrzymanie niezanieczyszczonego chlorem kwasu solnego.
Kwas solny otrzymuje się przez rozpuszczenie gazowego chlorowodoru w wodzie.
Aplikacja
Roztwór wodny ma szerokie zastosowanie do produkcji chlorków, do wytrawiania metali, oczyszczania powierzchni naczyń i studni z węglanów, do obróbki rud, do produkcji kauczuków, glutaminianu sodu, sody, chloru i innych produktów. Stosowany także w syntezie organicznej. Roztwór kwasu solnego znajduje szerokie zastosowanie w produkcji drobnoczęściowych wyrobów betonowych i gipsowych: płyt chodnikowych, wyrobów żelbetowych itp.
Bezpieczeństwo
Wdychanie chlorowodoru może prowadzić do kaszlu, uduszenia, zapalenia nosa, gardła i górnych dróg oddechowych, a w ciężkich przypadkach obrzęku płuc, dysfunkcji układ krążenia, a nawet śmierć. Kontakt ze skórą może powodować zaczerwienienie, ból i poważne oparzenia. Chlorowodór może powodować poważne oparzenia oczu i trwałe uszkodzenie.
Napisz recenzję o artykule „Chlorowodór”
Notatki
Literatura
- Levinsky M.I., Mazanko A.F., Novikov I.N. „Chlorowodór i kwas solny” M.: Chemia 1985
Spinki do mankietów
Fragment charakteryzujący chlorowodór
Następnego dnia księżniczka wyjechała wieczorem, a jego główny menadżer przyszedł do Pierre'a z wiadomością, że pieniędzy potrzebnych na wyposażenie pułku nie uda się zdobyć, chyba że sprzeda się jedną posiadłość. Dyrektor generalny ogólnie przedstawił Pierre'owi, że wszystkie te przedsięwzięcia pułku miały go zrujnować. Słuchając słów menedżera, Pierre z trudem ukrywał uśmiech.„No cóż, sprzedaj to” – powiedział. - Co mogę zrobić, nie mogę teraz odmówić!
Im gorszy był stan rzeczy, a zwłaszcza jego spraw, tym przyjemniejszy był dla Pierre'a, tym bardziej oczywiste było, że zbliża się katastrofa, na którą czekał. Prawie żaden ze znajomych Pierre'a nie był w mieście. Julia odeszła, księżniczka Marya odeszła. Z bliskich znajomych pozostali tylko Rostowie; ale Pierre do nich nie poszedł.
Tego dnia Pierre, aby się dobrze bawić, udał się do wsi Woroncowo, aby obejrzeć duży mecz balon, który Leppich budował w celu zniszczenia wroga, oraz balon testowy, który miał zostać wystrzelony jutro. Ta piłka nie była jeszcze gotowa; ale, jak dowiedział się Pierre, został zbudowany na prośbę władcy. Cesarz napisał do hrabiego Rastopchina następujące słowa na temat tego balu:
„Aussitot que Leppich sera pret, composez lui un ekwipage pour sa nacelle d”hommes surs et intelligence et depechez un courrier au general Koutousoff pour l”en prevenir. Je l'ai instruit de la wybrałem.
Polecaj, je vous prie, a Leppich d'etre bien attentif sur l'endroit ou il divera la premiere fois, pour ne pas se tromper et ne pas tomber dans les mains de l'ennemi. Il est niezbędny do łączenia tych ruchów avec le general en szef kuchni.”
[Jak tylko Leppich będzie gotowy, zbierz załogę na jego łódź spośród wiernych i mądrzy ludzie i wyślij kuriera do generała Kutuzowa, aby go ostrzec.
Poinformowałem go o tym. Proszę, poinstruuj Leppicha, aby zwracał szczególną uwagę na miejsce, w którym schodzi po raz pierwszy, aby nie popełnić błędu i nie wpaść w ręce wroga. Konieczne jest, aby koordynował swoje ruchy z ruchami naczelnego wodza.]
Wracając do domu z Woroncowa i jadąc placem Bołotnym, Pierre zauważył tłum na Łobnoje Mesto, zatrzymał się i wysiadł z dorożki. Była to egzekucja francuskiego kucharza oskarżonego o szpiegostwo. Egzekucja właśnie się skończyła, a kat odwiązywał od klaczy żałośnie jęczącego grubasa w czerwonych bakach, niebieskich pończochach i zielonej staniku. Stał tam inny przestępca, chudy i blady. Obaj, sądząc po twarzach, byli Francuzami. Z przerażonym, bolesnym wyrazem twarzy, podobnym do chudego Francuza, Pierre przepchnął się przez tłum.
- Co to jest? Kto? Po co? - on zapytał. Ale uwaga tłumu – urzędników, mieszczan, kupców, mężczyzn, kobiet w płaszczach i futrach – była tak zachłannie skupiona na tym, co działo się w Łobnoje Mesto, że nikt mu nie odpowiedział. Grubas wstał marszcząc brwi, wzruszył ramionami i najwyraźniej chcąc wyrazić stanowczość, zaczął zakładać kaftan, nie rozglądając się; ale nagle usta mu zadrżały i zaczął płakać, zły na siebie, tak jak płaczą dorośli, optymistyczni ludzie. Tłum mówił głośno, jak wydawało się Pierre'owi, aby zagłuszyć w sobie uczucie litości.
- Czyjś książęcy kucharz...
„No cóż, monsieur, jasne jest, że rosyjski sos galaretkowy zdenerwował Francuza… to go zdenerwowało” – powiedział pomarszczony urzędnik stojący obok Pierre'a, podczas gdy Francuz zaczął płakać. Sprzedawca rozejrzał się wokół, najwyraźniej spodziewając się oceny jego żartu. Niektórzy się śmiali, inni nadal ze strachem patrzyli na kata, który rozbierał innego.
Pierre pociągnął nosem, zmarszczył nos, szybko się odwrócił i ruszył z powrotem do dorożki, nie przestając mamrotać coś do siebie, chodząc i siadając. Jadąc dalej, zadrżał kilka razy i krzyknął tak głośno, że woźnica zapytał go:
- Co zamawiasz?
-Gdzie idziesz? - krzyknął Pierre do woźnicy jadącego na Łubiankę.
„Rozkazali mi udać się do naczelnego wodza” – odpowiedział woźnica.
- Głupiec! bestia! – krzyknął Pierre, co mu się rzadko zdarzało, przeklinając woźnicę. - Zamówiłem do domu; i pospiesz się, idioto. „Nadal musimy dzisiaj wyjechać” – powiedział sobie Pierre.
Pierre, widząc ukaranego Francuza i tłum otaczający Miejsce Egzekucji, tak w końcu zdecydował, że nie może już dłużej pozostać w Moskwie i idzie tego dnia do wojska, że wydało mu się, że albo powie o tym woźnicy, albo że sam woźnica powinien był o tym wiedzieć.
Po powrocie do domu Pierre wydał rozkaz swojemu woźnicy Jewstafiewiczowi, który wiedział wszystko, mógł wszystko i był znany w całej Moskwie, że tej nocy jedzie do Mozhaisk do wojska i że należy tam wysłać jego konie wierzchnie. Tego wszystkiego nie można było zrobić tego samego dnia, dlatego według Evstafievicha Pierre musiał odłożyć swój wyjazd na inny dzień, aby dać bazom czas na wyruszenie w drogę.
24-go przejaśniło się po złej pogodzie i tego popołudnia Pierre opuścił Moskwę. W nocy, po zmianie koni w Perchuszkowie, Pierre dowiedział się, że tego wieczoru odbyła się wielka bitwa. Mówili, że tu, w Perchuszkowie, ziemia zatrzęsła się od strzałów. Nikt nie był w stanie odpowiedzieć na pytania Pierre'a dotyczące tego, kto wygrał. (To była bitwa pod Szewardinem 24.) O świcie Pierre zbliżył się do Mozhaiska.
Wszystkie domy Mozhaiska były zajęte przez wojsko, a w gospodzie, gdzie Pierre'a spotkał jego pan i woźnica, w górnych pokojach nie było miejsca: wszystko było pełne oficerów.
W Mozhaisku i poza nim żołnierze stali i maszerowali wszędzie. Ze wszystkich stron widać było kozaków, żołnierzy pieszych i konnych, wozy, skrzynie, działa. Pierre'owi spieszyło się, aby jak najszybciej ruszyć naprzód, a im dalej od Moskwy i głębiej zanurzał się w tym morzu żołnierzy, tym bardziej ogarniał go niepokój i nowe radosne uczucie, że jeszcze nie doświadczył. Było to uczucie podobne do tego, którego doświadczył w Pałacu Słobodskich podczas przybycia cara – poczucie konieczności zrobienia czegoś i poświęcenia czegoś. Doznał teraz przyjemnego uczucia świadomości, że wszystko, co stanowi ludzkie szczęście, wygodę życia, bogactwo, a nawet samo życie, to nonsens, który przyjemnie jest odrzucić w porównaniu z czymś... Z czym, Pierre nie mógł sobie rachunek i rzeczywiście próbowała sama zrozumieć, dla kogo i dla czego uważa za szczególnie urocze poświęcić wszystko. Nie interesowało go, za co chce się poświęcić, ale samo poświęcenie stanowiło dla niego nowe, radosne uczucie.
Chlor– element III okresu i VII grupy A Układ okresowy, numer seryjny 17. Wzór elektronowy atomu [ 10 Ne]3s 2 3p 5, charakterystyczne stopnie utlenienia 0, -I, +I, +V i +VII. Najbardziej stabilnym stanem jest Cl-I. Skala stopnia utlenienia chloru:
Chlor ma wysoką elektroujemność (2,83) i wykazuje właściwości niemetaliczne. Jest częścią wielu substancji - tlenków, kwasów, soli, związków binarnych.
W naturze - dwunasty pierwiastek pod względem liczebności chemicznej (piąty wśród niemetali). Występuje wyłącznie w postaci związanej chemicznie. Trzeci najbardziej treściwy element w wody naturalne(po O i H), szczególnie dużo chloru woda morska(do 2% wagowo). Niezbędny ważny element dla wszystkich organizmów.
Chlor Cl2. Prosta substancja. Żółto-zielony gaz o ostrym, duszącym zapachu. Cząsteczka Cl 2 jest niepolarna i zawiera wiązanie CI – Cl σ. Termostabilny, niepalny na powietrzu; mieszanina z wodorem eksploduje pod wpływem światła (wodór spala się w chlorze):
Jest dobrze rozpuszczalny w wodzie, ulega w niej 50% dysmutacji i całkowicie w roztworze zasadowym:
Nazywa się roztworem chloru w wodzie woda chlorowana, w świetle kwaśny HClO rozkłada się na HCl i tlen atomowy O 0, dlatego „wodę chlorowaną” należy przechowywać w ciemnej butelce. Obecność kwaśnego HClO w „wodzie chlorowanej” i powstawanie tlenu atomowego wyjaśniają jego silne właściwości utleniające: na przykład wiele barwników ulega odbarwieniu pod wpływem mokrego chloru.
Chlor jest bardzo silnym utleniaczem metali i niemetali:
Reakcje ze związkami innych halogenów:
a) Cl2 + 2KBr (p) = 2KCl + Br2 (wrzenie)
b) Cl 2 (tydzień) + 2KI (p) = 2КCl + I 2 ↓
3Cl 2 (g) + ZN 2 O + KI = 6НCl + KIO 3 (80 °C)
Reakcja jakościowa – interakcja niedoboru Cl 2 z KI (patrz wyżej) i wykrycie jodu za pomocą niebieskiego zabarwienia po dodaniu roztworu skrobi.
Paragon chlor w przemysł:
i w laboratoria:
4HCl (stężony) + MnO2 = kl 2 + MnCl2 + 2H2O
(podobnie z udziałem innych utleniaczy; więcej szczegółów w reakcjach dla HCl i NaCl).
Chlor jest jednym z głównych produktów produkcja chemiczna stosowany do produkcji bromu i jodu, chlorków i pochodnych zawierających tlen, do wybielania papieru, jako środek dezynfekcyjny do woda pitna. Trujący.
Chlorowodór HCl. Kwas beztlenowy. Bezbarwny gaz o ostrym zapachu, cięższy od powietrza. Cząsteczka zawiera kowalencyjne wiązanie σ H – Cl. Stabilny termicznie. Bardzo dobrze rozpuszczalny w wodzie; rozcieńczone roztwory nazywane są kwas chlorowodorowy, oraz stężony roztwór do palenia (35–38%) - kwas chlorowodorowy(nazwę nadali alchemicy). Mocny kwas w roztworze, zobojętniony alkaliami i hydratem amoniaku. Silny środek redukujący w stężonym roztworze (dzięki Cl-I), słaby utleniacz w rozcieńczonym roztworze (dzięki HI). Część„wódka królewska”
Jakościową reakcją na jon Cl – jest powstawanie białych osadów AgCl i Hg 2 Cl 2, które nie ulegają przeniesieniu do roztworu pod wpływem rozcieńczonego kwasu azotowego.
Chlorowodór służy jako surowiec do produkcji chlorków, produktów chloroorganicznych, a także jest stosowany (w postaci roztworu) do trawienia metali oraz rozkładu minerałów i rud.
Równania najważniejszych reakcji:
HCl (rozcieńczony) + NaOH (rozcieńczony) = NaCl + H2O
HCl (rozcieńczony) + NH 3 H 2 O = NH 4 Cl + H 2 O
4HCl (stężony, poziomy) + MO 2 = MCl 2 + Cl 2 + 2H 2 O (M = Mn, Pb)
16HCl (stężony, poziomy) + 2KMnO 4 (t) = 2MnCl 2 + 5Cl 2 + 8H 2O + 2KCl
14HCl (stęż.) + K 2 Cr 2 O 7 (t) = 2CrCl 3 + 3Cl 2 + 7H 2 O + 2KCl
6HCl (stęż.) + KClO 3 (t) = KCl + 3Cl 2 + 3H 2 O (50–80 °C)
4HCl (stęż.) + Ca(ClO) 2(t) = CaCl 2 + 2Cl 2 | + 2H 2O
2HCl (rozcieńczony) + M = MCl 2 + H 2 (M = Fe, Zn)
2HCl (rozcieńczony) + MSO 3 = MCl 2 + CO 2 + H 2 O (M = Ca, Ba)
HCl (rozcieńczony) + AgNO 3 = HNO 3 + AgCl↓
Paragon HCl w przemyśle - spalanie H 2 do Cl 2 (patrz), w laboratorium - wypieranie chlorków kwasem siarkowym:
NaCl (t) + H2SO4 (stężony) = NaHSO4+ HCl(50°C)
2NaCl (t) + H 2 SO 4 (stęż.) = Na 2 SO 4 + 2HCl(120°C)