Nauczyciel:
Instytucja edukacyjna: liceum zawodowe metra w Petersburgu
Dyscyplina akademicka: chemia
Temat: „Związki organiczne zawierające tlen i azot”
Grupy docelowej: 1 kurs
Typ lekcji: uogólnienie materiału, 1 akademicki. godzina.
Cele Lekcji:
Wiedza: znać wzory i właściwości substancji organicznych zawierających tlen i azot
Zrozumienie: rozumieć zależność właściwości substancji od struktury cząsteczki, od grupy funkcyjnej
Aplikacja: wykorzystywać informacje o właściwościach substancji do układania równań reakcji chemicznych.
Analiza: analizować wzajemny wpływ grupy atomów w cząsteczkach substancji organicznych.
Synteza: podsumowywać informacje o właściwościach substancji organicznych w postaci łańcucha przemian
Stopień: Przeprowadź samoocenę, korzystając z proponowanych rubryk.
Sprzęt: tablica interaktywna, prezentacja multimedialna.
Plan lekcji:
1. Org. za chwilę
2. Powtórzenie wcześniej przestudiowanych.
3. Występy studenckie.
4. Samookreślenie uczniów według poziomu samooceny.
5. Niezależna praca studenci.
6. Podsumowanie systemu zorientowanego kryterialnie.
7. Praca domowa.
Podczas zajęć
1. Organizowanie czasu.
Utworzenie grupy, raport lidera grupy o liczbie obecnych uczniów.
2. Powtórzenie wcześniej poznanych
Informacja o grupy funkcyjne ach, klasy substancji zawierających tlen i azot, o najprostszych przedstawicielach tych klas z wykorzystaniem tablicy interaktywnej i prezentacji multimedialnej.
Określa, która grupa atomów, koniecznie obecna w cząsteczkach substancji danej klasy funkcja chemiczna substancje, tj. jego Właściwości chemiczne?
Odpowiedź: grupa funkcyjna atomów
Podaj nazwę grupy funkcyjnej – OH
Odpowiedź: grupa hydroksylowa atomów.
Jaką klasę substancji określa grupa hydroksylowa atomów?
Odpowiedź: Alkohole, jeśli 1 grupa to OH, alkohole jednowodorotlenowe, jeśli więcej niż jedna grupa to OH, alkohole wielowodorotlenowe.
Nadaj grupie funkcyjnej nazwę - SON. Jaką klasę substancji definiuje?
Odpowiedź: grupa aldehydowa definiuje klasę aldehydów.
Nadaj grupie nazwę funkcji - SLEEP. Jaką klasę definiuje?
Odpowiedź: grupa karboksylowa, określa klasę kwasów karboksylowych.
Nadaj grupie nazwę funkcji - NH2. Jaką klasę definiuje?
Odpowiedź: Grupa aminowa definiuje klasę amin lub klasę aminokwasów.
Słuchamy wiadomości uczniów z prezentacjami multimedialnymi o najprostszych przedstawicielach różne zajęcia substancje zawierające tlen i azot.
3.Występy studenckie.
Wiadomość 1.
Etanol C2H5OH, klasa alkoholi jednowodorotlenowych, grupa funkcyjna – grupa hydroksylowa atomów – OH. Reakcja jakościowa - interakcja z tlenkiem miedzi (II) z wytworzeniem aldehydu. Właściwości chemiczne (rozróżniamy 2 reakcje) - spalanie i oddziaływanie z metalami (Na).
Wiadomość 2.
Propanotriol (glicerol) C3H7(OH)3. Klasa – alkohole wielowodorotlenowe, grupy funkcyjne – kilka grup hydroksylowych – OH. Reakcja jakościowa - interakcja z wodorotlenkiem miedzi (II). Właściwości chemiczne - oddziaływanie z halogenkami sodu i wodoru.
Doświadczenie laboratoryjne:
Do probówki wlać około 1 ml roztworu sumoranu miedzi (II) i dodać trochę roztworu wodorotlenku sodu, aż wytrąci się niebieski osad wodorotlenku miedzi (II). Do powstałego osadu dodawać kropla po kropli roztwór gliceryny. Wstrząśnij mieszaniną. Zauważamy przemianę niebieskiego osadu w niebieski roztwór.
(glicerol + Cu(OH)2 ----- niebieski rozwiązanie)
Wiadomość 3.
Fenol C6H5OH jest najprostszym przedstawicielem klasy fenoli.
Grupą funkcyjną jest grupa hydroksylowa –OH. Reakcja jakościowa - tworzenie fioletowego roztworu podczas interakcji z chlorkiem żelaza (III) lub tworzenie się białego osadu podczas interakcji z bromem. Właściwości chemiczne: fenol jest słabym kwasem, reaguje z metalami (Na) z zasadami (NaOH) i bromem.
Wiadomość 4.
Etanol lub aldehyd octowy CH3-COH Grupa funkcyjna – grupa aldehydowa COH. Klasa – aldehydy. Reakcja jakościowa to reakcja „srebrnego lustra”. Właściwości chemiczne: reakcja redukcji i reakcja utleniania.
Doświadczenie laboratoryjne: doświadczenie demonstracyjne.
W probówce zawierającej 1 ml aldehydu ( roztwór wodny) dodać kilka kropel amoniakalnego roztworu tlenku srebra. Ogrzewamy probówkę. Obserwujemy wydzielanie się srebra na ściankach probówki, powierzchnia szkła staje się lustrzana.
Wiadomość 5.
Kwas etanowy CH3-COOH (kwas octowy). Klasa – kwasy karboksylowe. Grupa funkcyjna – grupa karboksylowa COOH. Reakcja jakościowa – wskaźnik lakmusowy zmienia kolor na czerwony.
Właściwości chemiczne: jak dowolny kwas oddziałuje z metalami (Na), zasadowymi tlenkami (Na2O), zasadami (NaOH).
Doświadczenie laboratoryjne:
Wlać odrobinę do suchej, czystej probówki ze wskaźnikiem uniwersalnym. kwas octowy. Wskaźnik zmieni kolor na czerwony.
Wiadomość 6.
Glukoza C6H12O6. Klasa – węglowodany. Grupy funkcyjne: 5-OH i 1-COH, czyli aldehydoalkohol. Reakcje jakościowe: reakcja z wodorotlenkiem miedzi, w wyniku której powstaje niebieski roztwór. Reakcja „srebrnego lustra” polegająca na uwolnieniu srebra na ściankach probówki. Właściwości chemiczne: redukcja do alkoholu sześciowodorotlenowego, utlenianie do kwasu glukonowego, reakcja fermentacji.
Wiadomość 7.
Anilina C6H5-NH2.
Grupa funkcyjna – grupa aminowa NH2. Klasa - aminy. Reakcja jakościowa: interakcja z wodą bromową z wytworzeniem białego osadu. Właściwości chemiczne: interakcja z kwas chlorowodorowy i z bromem.
Wiadomość 8.
Kwas aminoetanowy NH2-CH2-COOH lub kwas aminooctowy.
Klasa – aminokwasy. Grupy funkcyjne: - grupa aminowa NH2 i grupa karboksylowa –COOH. Właściwości chemiczne: AK – związki amfoteryczne; - NH2 nadaje właściwości zasadowe, - COOH nadaje właściwości kwasowe. Dlatego aminokwasy mogą łączyć się ze sobą, tworząc cząsteczki białka, a białko jest podstawą życia na naszej planecie.
4. Samookreślenie uczniów według poziomu samooceny.
Tablica interaktywna: uczniowie na zajęciach zapoznają się z kartą samooceny rozwoju i zaznaczają swój poziom.
1. Przy pomocy nauczyciela i notatek potrafię zidentyfikować grupę funkcyjną i najprostszego przedstawiciela klasy substancji organicznych (6-7 punktów).
2. Potrafię wskazać grupę funkcyjną, najprostszego przedstawiciela klasy substancji organicznych, bez pomocy nauczyciela i bez pomocy notatki (8-10 punktów).
3. Potrafię określić odczyn jakościowy i właściwości chemiczne substancji przy pomocy nauczyciela i notatek (11-14 pkt).
4. Potrafię określić odczyn jakościowy i właściwości chemiczne substancji bez pomocy nauczyciela i bez notatki (15-18 punktów).
Klasa | Grupy funkcjonalne | Najprostszy przedstawiciel | Reakcje jakościowe | Właściwości chemiczne |
Monatomowy alkohole | ||||
Alkohole wielowodorotlenowe | ||||
Fenole | ||||
Aldehydy | ||||
Kwasy karboksylowe | ||||
Węglowodany | ||||
Aminy | ||||
Aminokwasy |
Studenci zapoznają się z systemem oceniania zorientowanym na kryteria.
Kryteria:
18 – 15 punktów – „doskonały”
punkty – „dobrze”
10 – 6 punktów – „dostateczny”
5 lub mniej – „niezadowalający”
5. Samodzielna praca studentów.
6. Podsumowanie wyników według systemu kryterialnego (poinformowanie studentów o liczbie punktów).
7. Praca domowa: wypełnienie tabeli.
Klikając przycisk „Pobierz archiwum”, pobierzesz potrzebny plik całkowicie bezpłatnie.
Przed pobraniem tego pliku pamiętaj o tych dobrych esejach, testach, pracach semestralnych, tezy, artykuły i inne dokumenty, które nie zostały odebrane na Twoim komputerze. To jest Twoja praca, powinna uczestniczyć w rozwoju społeczeństwa i przynosić korzyści ludziom. Znajdź te prace i prześlij je do bazy wiedzy.
Zarówno my, jak i wszyscy studenci, doktoranci, młodzi naukowcy, którzy korzystają z bazy wiedzy w swoich studiach i pracy, będziemy Państwu bardzo wdzięczni.
Aby pobrać archiwum z dokumentem należy w polu poniżej wpisać pięciocyfrową liczbę i kliknąć przycisk „Pobierz archiwum”
Podobne dokumenty
- - aminy pierwszorzędowe NMN 2;
- - aminy drugorzędowe KI/UN;
- - aminy trzeciorzędowe KK"K"Y.
Nazewnictwo pochodnych benzenu, ich odmiany oraz metody, zasady i kierunki wytwarzania praktyczne użycie. Budowa benzenu i jego aromatyczność. Reguła Hückela i cechy jej zastosowania. Niebenzenoidowe związki aromatyczne.
streszczenie, dodano 08.05.2013
Aromatyczne węglowodory: ogólna charakterystyka. Nazewnictwo i izomeria, właściwości fizyczne i chemiczne węglowodorów aromatycznych. Mechanizm reakcji podstawienia elektrofilowego i nukleofilowego w szeregu aromatycznym. Zastosowanie arenów, ich toksyczność.
streszczenie, dodano 12.11.2011
Alkany to nasycone węglowodory zawierające tylko proste wiązania węglowe. Otrzymywanie alkanów: metoda przemysłowa, nitrowanie i utlenianie. Węglowodory zawierające podwójne wiązanie węgla to alkeny lub węglowodory etylenowe. Węglowodory dienowe.
wykład, dodano 02.05.2009
Związki nienasycone posiadające dwa wiązania podwójne w cząsteczce to węglowodory dienowe. Zależność pomiędzy strukturą węglowodorów dienowych a ich właściwościami. Metody wytwarzania dewinylu, izoprenu, kauczuku syntetycznego. Halogenki organiczne i ich klasyfikacja.
wykład, dodano 19.02.2009
Budowa, nazewnictwo alkenów. Węglowodory nienasycone, których cząsteczki zawierają jedno podwójne wiązanie CC. Hybrydyzacja orbitali. Obraz strukturę przestrzenną atomy. Izomeria przestrzenna szkieletu węglowego. Właściwości fizyczne alkenów.
prezentacja, dodano 08.06.2015
Rozwój pomysłów na temat organicznego pochodzenia oliwy. Parafiny, węglowodory naftenowe i aromatyczne. Ciśnienie nasycenia gazem olejowym. Temperatura krystalizacji, zmętnienie, zamarzania. Różnice we właściwościach ropy w obrębie złoża roponośnego.
tutorial, dodano 05.02.2014
Pojęcie alkanów (węglowodory nasycone, parafiny, związki alifatyczne), ich systematyczne i racjonalna nomenklatura. Właściwości chemiczne alkanów, reakcje podstawienia rodnikowego i utleniania. Produkcja i odzysk węglowodorów nienasyconych.
Substancje organiczne to klasa związków zawierających węgiel (z wyłączeniem węglików, węglanów, tlenków węgla i cyjanków). Nazwa „związki organiczne” pojawiła się już na wczesnym etapie rozwoju chemii, a naukowcy mówią sami za siebie… Wikipedia
Jeden z najważniejszych typów związki organiczne. Zawierają azot. Zawierają w cząsteczce wiązania węgiel-wodór i azot-węgiel. Olej zawiera heterocykl zawierający azot, pirydynę. Azot jest zawarty w białka, kwasy nukleinowe i... ...Wikipedia
Związki germanoorganiczne to związki metaloorganiczne zawierające wiązanie german-węgiel. Czasami odnoszą się one do wszelkich związków organicznych zawierających german. Pierwszym związkiem organogermanicznym, tetraetylogermanem, była... ... Wikipedia
Związki krzemoorganiczne to związki, w cząsteczkach których występuje bezpośrednie wiązanie krzem-węgiel. Związki krzemoorganiczne są czasami nazywane silikonami, od łacińskiej nazwy krzemu, krzemu. Związki krzemoorganiczne... ... Wikipedia
Związki organiczne, materia organiczna Klasa związki chemiczne, które zawierają węgiel (z wyjątkiem węglików, kwas węglowy, węglany, tlenki węgla i cyjanki). Spis treści 1 Historia 2 Zajęcia... Wikipedia
Związki metaloorganiczne (MOC) to związki organiczne, w których cząsteczkach występuje wiązanie pomiędzy atomem metalu i atomem/atomami węgla. Spis treści 1 Rodzaje związków metaloorganicznych 2 ... Wikipedia
Związki organohalogenowe to substancje organiczne zawierające co najmniej jedno wiązanie halogenowe z węglem C Hal. Związki organohalogenowe, w zależności od charakteru halogenu, dzielą się na: Związki organofluorowe; ... ... Wikipedia
Związki metaloorganiczne (MOC) to związki organiczne, w których cząsteczkach występuje wiązanie pomiędzy atomem metalu i atomem/atomami węgla. Spis treści 1 Rodzaje związków metaloorganicznych 2 Metody wytwarzania ... Wikipedia
Związki organiczne zawierające wiązanie cyna-węgiel mogą zawierać zarówno cynę dwuwartościową, jak i czterowartościową. Spis treści 1 Metody syntezy 2 Rodzaje 3 ... Wikipedia
- (heterocykle) związki organiczne zawierające cykle, które wraz z węglem obejmują także atomy innych pierwiastków. Można je uważać za związki karbocykliczne z heteropodstawnikami (heteroatomami) w pierścieniu. Większość... ...Wikipedia
Azot, podobnie jak tlen, często występuje w materii organicznej, a jego związki są niezbędne dla organizmów żywych.
Związki zawierające azot różnią się wielka różnorodność niż te zawierające tlen. Wynika to z faktu, że azot ma wyższą wartościowość i jednocześnie posiada trzy stany hybrydowe, podobnie jak atom węgla. Połączenia z singlem połączenie S-Y nazywane są aminami, z wiązaniem podwójnym C=N - iminy, z wiązaniem potrójnym C=K - nitryle.
Istotna różnica między azotem a tlenem polega na tym, że azot może przedostawać się do związków organicznych zarówno w stanie zredukowanym, jak i utlenionym. Elektroujemność azotu (x = 3,0) jest wyższa niż węgla (x = 2,5) i niższa niż tlenu (x = 3,5). Jeśli azot jest związany z węglem i wodorem, wówczas jego stopień utlenienia wynosi -3. W związkach zawierających grupę nitrową -G) 2 azot jest związany z tlenem i węglem i znajduje się na stopniu utlenienia +3. Związki organiczne z utlenionym azotem zawierają wewnętrzne źródło środka utleniającego. Jeśli w cząsteczce znajduje się kilka grup nitrowych, związek staje się wybuchowy. Do substancji tego typu zalicza się 2,4,6-trinitrotoluen (TNT).
Zredukowany azot nadaje związkom organicznym takie same właściwości jak tlen: polarność, zasadowość i kwasowość, zdolność
tworzą wiązania wodorowe. Jednakże polarność związków zawierających azot jest mniejsza, a wiązania wodorowe są słabsze niż w przypadku związków zawierających tlen. Dlatego zdaniem niektórych właściwości fizyczne aminy znajdują się pomiędzy węglowodorami i alkoholami. Chociaż w normalnych warunkach wszystkie alkohole są cieczami, niektóre aminy są gazami:
Azot jest w stanie wr Hybrydyzacja 3 jest dobrym dawcą par elektronów. Dlatego, jak już wiemy, aminy wykazują dość silne właściwości zasadowe. W mniejszym stopniu właściwości donorowe wyrażają się w azocie w stanie hybrydyzacji $p2. Właściwości kwasowe związków organicznych zawierających azot są znacznie słabsze niż związków zawierających tlen. Ale przy udziale elektronów azotu w koniugacji z elektronami i węglem pojawiają się właściwości kwasowe.
Jedna z klas substancji zawierających azot - aminy Tak nazywa się substancje organiczne zawierające azot, w których atom azotu jest połączony z rodnikami węglowodorowymi i odpowiednią liczbą atomów wodoru. W zależności od liczby rodników wyróżnia się:
Należy zauważyć, że pojęcia amin pierwszorzędowych, drugorzędowych i trzeciorzędowych nie pokrywają się z odpowiednimi koncepcjami alkoholi.
Istnieją homologiczne serie amin nasyconych, nienasyconych i aromatycznych. Istnieje również różnica w terminologii przy porównywaniu alkoholi i amin. W alkoholach aromatycznych grupa hydroksylowa musi być związana z atomem węgla w rodniku, a nie w pierścieniu aromatycznym. W przypadku związków zawierających azot za aminę uważa się także substancję z grupą NH2 związaną z pierścieniem aromatycznym.
Aminy o niskiej masie cząsteczkowej to substancje ciekłe lub gazowe, które są dobrze rozpuszczalne w wodzie. Mają nieprzyjemny zapach przypominający amoniak. Specyficzny zapach ryb związany jest także z obecnością amin. Wyższe aminy wykazują te same cechy, które zaobserwowano dla alkoholi i kwasów - zmniejsza się rozpuszczalność w wodzie i pojawia się aktywność powierzchniowa.
Wytwarzanie amin. Jedna z metod wytwarzania amin jest podobna do produkcji alkoholi. Są to reakcje węglowodorów halogenowanych z amoniakiem, przebiegające poprzez mechanizm podstawienia nukleofilowego:
Amina nie może być tutaj bezpośrednim produktem reakcji, ponieważ powstały chlorowodór reaguje z nią jako zasadą.
dając sól aminową. Podkreślić bezpłatny aminy, powstałą sól traktuje się zasadą:
Halogenowa pochodna węglowodoru reaguje nie tylko z amoniakiem, ale także z amina pierwszorzędowa. W tym przypadku powstaje amina drugorzędowa, a w kolejnym etapie - amina trzeciorzędowa:
Aminy otrzymuje się również przez uwodornienie nitryli:
Aminy aromatyczne otrzymuje się przez redukcję związków nitrowych. Metale są stosowane jako środki redukujące w środowisku kwaśnym:
Ta aromatyczna amina nazywa się aniliną. Reakcję redukcji nitrozwiązków odkrył N. N. Zinin w 1842 roku. W przemyśle nitrobenzen redukuje się wodorem na katalizatorze niklowym w temperaturze ~300°C. Anilina stała się bardzo ważnym półproduktem wykorzystywanym do produkcji barwników, polimerów, leków itp. Światowa produkcja aniliny wynosi ponad 1 milion ton rocznie.
Właściwości chemiczne amin. Aminy należą do substancji, które mogą spalić się, tworząc C0 2, H 2 0 i azot N 2.
Jako zasady aminy są podobne do amoniaku, z którego powstają poprzez zastąpienie wodoru rodnikami węglowodorowymi. Rodniki te wpływają na siłę zasad. Skutki efektów indukcyjnych i mezomerycznych na właściwości zasadowe są na ogół przeciwne do ich wpływu na właściwości kwasowe. Alkohole nasycone Przez właściwości kwasowe słabsze niż woda, a nasycone aminy są silniejsze niż amoniak; fenole mają znacznie silniejsze właściwości kwasowe niż alkohole, a anilina o właściwościach zasadowych jest znacznie słabsza niż nasycone aminy.
W ekstremalne aminy Efekt +/- rodnika zwiększa gęstość elektronów na azocie, zwiększając w ten sposób zdolność azotu do oddawania pary elektronów w celu utworzenia wiązanie dawca-akceptor. W anilinie para elektronów azotu uczestniczy w koniugacji z aromatycznymi elektronami TT i staje się mniej dostępna dla utworzenia wiązania donor-akceptor. Dlatego substancje ułożone są w następującym rzędzie według osłabienia ich podstawowych właściwości:
aminy nasycone > NH3 > aminy aromatyczne.
Przykład 22.15. W jakim kierunku przesunięta jest równowaga reakcji etyloaminy z chlorowodorkiem aniliny?
Rozwiązanie. Etyloamina jest mocniejszą zasadą niż anilina. Dlatego równowaga zostaje przesunięta w kierunku tworzenia aniliny:
Aminy jako zasady reagują z jonami metali, tworząc związki złożone. Jon metalu pełni rolę akceptora pary elektronów azotu, podobnie jak w przypadku reakcji z amoniakiem. Wiele wiadomo złożone związki metale (/-blok z różnymi aminami. Podczas mieszania roztworów siarczanu miedzi i metyloaminy powstaje intensywnie zabarwiony roztwór o czystszym niebieskim odcieniu niż w przypadku reakcji z amoniakiem (pkt 210):
diaminy typu rIII 2CH 2 CH 2 1H 2 dają silniejsze kompleksy niż monoaminy, ponieważ każda cząsteczka ma dwa atomy azotu donora i jest przyłączona dwoma wiązaniami donor-akceptor.
Aminy pierwszorzędowe w działaniu kwas azotowy(lub azotyn sodu w środowisku kwaśnym) dezaminowany, zamieniając się w alkohole:
W aminach pierwszorzędowych i drugorzędowych wodór grupy aminowej zastępuje się rodnikami węglowodorowymi podczas reakcji z pochodnymi halogenowymi (patrz wytwarzanie amin). Amina z halogenkiem kwasowym daje amid kwasowy zawierający rodnik związany z azotem:
Aminy trzeciorzędowe dodają halogenowe pochodne węglowodorów, tworząc tetrapodstawione (czwartorzędowe) sole amoniowe:
Są to substancje krystaliczne, które są dobrze rozpuszczalne w wodzie. W odróżnieniu od zwykłych soli amonowych nie ulegają hydrolizie i nie ulegają rozkładowi pod wpływem zasad.
W anilinie i innych aminach aromatycznych grupa NH 2 wykazuje dodatnie działanie mezomeryczne, przyspieszając reakcje podstawienia elektrofilowego w rodniku aromatycznym. Anilina odbarwia wodę bromową, tworząc biały osad tribromoaniliny.
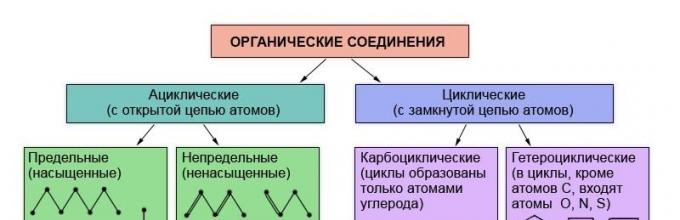
Wiadomo, że o właściwościach substancji organicznych decyduje ich skład i struktura chemiczna. Nic więc dziwnego, że klasyfikacja związków organicznych opiera się na teorii struktury - teorii L. M. Butlerowa. Substancje organiczne klasyfikuje się według obecności i kolejności połączeń atomów w cząsteczkach. Najtrwalszą i najmniej zmienną częścią cząsteczki substancji organicznej jest jej szkielet – łańcuch atomów węgla. W zależności od kolejności łączenia atomów węgla w tym łańcuchu substancje dzielą się na acykliczne, które nie zawierają zamkniętych łańcuchów atomów węgla w cząsteczkach, oraz karbocykliczne, które zawierają takie łańcuchy (cykle) w cząsteczkach.
Oprócz atomów węgla i wodoru cząsteczki substancji organicznych mogą zawierać atomy innych pierwiastki chemiczne. Substancje, w których cząsteczkach znajdują się tzw. heteroatomy tworzące zamknięty łańcuch, zaliczane są do związków heterocyklicznych.
Heteroatomy (tlen, azot itp.) mogą być częścią cząsteczek i związków acyklicznych, tworząc w nich grupy funkcyjne, na przykład hydroksyl - OH, karbonyl, karboksyl, grupa aminowa -NH2.
Grupa funkcyjna- grupa atomów określająca najbardziej charakterystyczne właściwości chemiczne substancji i jej przynależność do określonej klasy związków. 
Węglowodory- Są to związki składające się wyłącznie z atomów wodoru i węgla.
W zależności od budowy łańcucha węglowego związki organiczne dzielą się na związki o otwartym łańcuchu - acykliczny (alifatyczny) i cykliczny- z zamkniętym łańcuchem atomów.
Cykliczne dzielą się na dwie grupy: związki karbocykliczne(cykle tworzą tylko atomy węgla) i heterocykliczny(cykle obejmują także inne atomy, takie jak tlen, azot, siarka).
Do związków karbocyklicznych zalicza się z kolei dwie serie związków: alicykliczny i aromatyczny.
Związki aromatyczne, ze względu na strukturę swoich cząsteczek, posiadają płaskie pierścienie zawierające węgiel ze specjalnym zamkniętym układem p-elektronów, tworzących wspólny układ π (pojedynczą chmurę π-elektronów). Aromatyczność jest również charakterystyczna dla wielu związków heterocyklicznych.
Wszystkie inne związki karbocykliczne należą do szeregu alicyklicznego.
Zarówno acykliczne (alifatyczne), jak i cykliczne węglowodory mogą zawierać wiązania wielokrotne (podwójne lub potrójne). Takie węglowodory nazywane są nienasyconymi (nienasyconymi) w przeciwieństwie do nasyconych (nasyconych), zawierających tylko wiązania pojedyncze.
Nasycone węglowodory alifatyczne zwany alkany, mają ogólny wzór C n H 2 n +2, gdzie n jest liczbą atomów węgla. Dziś często używa się ich starej nazwy - parafiny.
Zawierający jedno wiązanie podwójne, mam to imię alkeny. Mają ogólny wzór C n H 2 n.
Nienasycone węglowodory alifatycznez dwoma wiązaniami podwójnymi zwany alkadieny
Nienasycone węglowodory alifatycznez jednym potrójnym wiązaniem zwany alkiny. Ich ogólny wzór to C n H 2 n - 2.
Nasycone węglowodory alicykliczne - cykloalkany, ich ogólny wzór to C n H 2 n.
Specjalna grupa węglowodorów, aromatyczny, Lub areny(z zamkniętym wspólnym π -układ elektroniczny), znanego z przykładu węglowodorów o ogólnym wzorze C n H 2 n -6.
Zatem, jeśli ich cząsteczki zawierają jeden lub większa liczba atomy wodoru są zastępowane przez inne atomy lub grupy atomów (halogeny, grupy hydroksylowe, grupy aminowe itp.), powstają pochodne węglowodorów: pochodne halogenowe, związki zawierające tlen, azot i inne związki organiczne.
Pochodne halogenowe węglowodory można uważać za produkty zastąpienia jednego lub większej liczby atomów wodoru w węglowodorach atomami halogenu. Zgodnie z tym mogą istnieć nasycone i nienasycone mono-, di-, tri- (w ogólnym przypadku poli-) pochodne halogenowe.
Wzór ogólny jednohalogenowych pochodnych węglowodorów nasyconych:
a skład wyraża się wzorem
CnH2n+1G,
gdzie R oznacza resztę nasyconego węglowodoru (alkanu), rodnika węglowodorowego (oznaczenie to jest stosowane dalej przy rozważaniu innych klas substancji organicznych), G oznacza atom halogenu (F, Cl, Br, I).
Alkohole- pochodne węglowodorów, w których jeden lub więcej atomów wodoru zastąpiono grupami hydroksylowymi.
Alkohole nazywane są jednoatomowy, jeśli mają jedną grupę hydroksylową, i ograniczające, jeśli są pochodnymi alkanów.
Wzór ogólny nasyconych alkoholi jednowodorotlenowych:
a ich skład wyraża ogólny wzór:
C n H 2 n +1 OH lub C n H 2 n +2 O
Znane są przykłady alkoholi wielowodorotlenowych, czyli posiadających kilka grup hydroksylowych.
Fenole- pochodne węglowodorów aromatycznych (szereg benzenowy), w których jeden lub więcej atomów wodoru w pierścieniu benzenowym zastąpiono grupami hydroksylowymi.
Najprostszy przedstawiciel o wzorze C 6 H 5 OH nazywa się fenolem.
Aldehydy i ketony- pochodne węglowodorów zawierające grupę atomową karbonylową (karbonyl).
W cząsteczkach aldehydu jedno wiązanie karbonylowe łączy się z atomem wodoru, drugie z rodnikiem węglowodorowym.
W przypadku ketonów grupa karbonylowa jest związana z dwoma (zazwyczaj różnymi) rodnikami.
Skład nasyconych aldehydów i ketonów wyraża się wzorem C n H 2l O.
Kwasy karboksylowe- pochodne węglowodorów zawierające grupy karboksylowe (-COOH).
Jeśli w cząsteczce kwasu znajduje się jedna grupa karboksylowa, wówczas kwas karboksylowy jest jednozasadowy. Ogólny wzór nasyconych kwasów jednozasadowych (R-COOH). Ich skład wyraża wzór C n H 2 n O 2.
Etery to substancje organiczne zawierające dwa rodniki węglowodorowe połączone atomem tlenu: R-O-R lub R 1 -O-R 2.
Rodniki mogą być takie same lub różne. Skład eterów wyraża się wzorem C n H 2 n +2 O
Estry- związki powstałe w wyniku zastąpienia atomu wodoru grupy karboksylowej kwasy karboksylowe do rodnika węglowodorowego.
Związki nitrowe- pochodne węglowodorów, w których jeden lub więcej atomów wodoru zastąpiono grupą nitrową -NO2.
Ogólny wzór nasyconych związków mononitro:
a skład wyraża się wzorem ogólnym
C n H 2 n +1 NO 2 .
Aminy- związki uważane za pochodne amoniaku (NH3), w których atomy wodoru zastąpiono rodnikami węglowodorowymi.
W zależności od charakteru rodnika, mogą to być aminy alifatycznyi aromatyczny.
W zależności od liczby atomów wodoru zastąpionych rodnikami wyróżnia się:
Aminy pierwszorzędowe o wzorze ogólnym: R-NNH 2
Wtórny - o ogólnym wzorze: R 1 -NН-R 2
Trzeciorzędowy – według ogólnego wzoru:
W szczególnym przypadku aminy drugorzędowe i trzeciorzędowe mogą mieć te same rodniki.
Aminy pierwszorzędowe można również uznać za pochodne węglowodorów (alkanów), w których jeden atom wodoru zastąpiono grupą aminową -NH2. Skład nasyconych amin pierwszorzędowych wyraża się wzorem C n H 2 n +3 N.
Aminokwasy zawierają dwie grupy funkcyjne połączone z rodnikiem węglowodorowym: grupę aminową -NH2 i grupę karboksylową -COOH.
Skład nasyconych aminokwasów zawierających jedną grupę aminową i jeden karboksyl wyraża się wzorem C n H 2 n +1 NO 2.
Znane są inne ważne związki organiczne, które mają kilka różnych lub identycznych grup funkcyjnych, długie liniowe łańcuchy połączone z pierścieniami benzenowymi. W takich przypadkach ścisłe określenie, czy substancja należy do określonej klasy, jest niemożliwe. Związki te często dzieli się na określone grupy substancji: węglowodany, białka, kwasy nukleinowe, antybiotyki, alkaloidy itp.

Do nazywania związków organicznych stosuje się dwie nomenklatury: racjonalną i systematyczną (IUPAC) oraz trywialną.
Kompilacja nazw według nomenklatury IUPAC
1) Podstawą nazwy związku jest rdzeń słowa oznaczającego nasycony węglowodór z tą samą liczbą atomów co łańcuch główny.
2) Do rdzenia dodaje się przyrostek charakteryzujący stopień nasycenia:
An (ostateczny, bez wielokrotnych połączeń);
-en (w obecności wiązania podwójnego);
-in (w obecności wiązania potrójnego).
Jeżeli wiązań wielokrotnych jest kilka, to przyrostek wskazuje liczbę takich wiązań (-dien, -trien itp.), a po przyrostku należy podać numerycznie położenie wiązania wielokrotnego, np.:
CH 3 –CH 2 –CH=CH 2 CH 3 –CH=CH–CH 3
buten-1 buten-2
CH2 =CH–CH=CH2
butadien-1,3
Grupy takie jak nitro-, halogeny, rodniki węglowodorowe, które nie wchodzą w skład głównego łańcucha, są umieszczane w przedrostku. Są one wymienione w kolejności alfabetycznej. Pozycję podstawnika wskazuje liczba znajdująca się przed przedrostkiem.
Kolejność nazewnictwa jest następująca:
1. Znajdź najdłuższy łańcuch atomów C.
2. Ponumeruj atomy węgla głównego łańcucha sekwencyjnie, zaczynając od końca najbliższego rozgałęzieniu.
3. Nazwa alkanu składa się z nazw rodników bocznych, wymienionych w kolejności alfabetycznej, wskazujących pozycję w łańcuchu głównym oraz nazwę łańcucha głównego.
Nazewnictwo niektórych substancji organicznych (trywialne i międzynarodowe)