4. Natura i rodzaje wiązań chemicznych. Wiązanie kowalencyjne
Aplikacja. Struktura przestrzenna Cząsteczki
Każda cząsteczka (na przykład CO 2, H 2 O, NH 3) lub jon molekularny (na przykład CO 3 2 -, H 3 O +, NH 4 +) ma określony skład jakościowy i ilościowy, a także strukturę ( geometria). Geometria cząsteczki powstaje w wyniku stałego względne położenie atomy i wartości kąta wiązania.
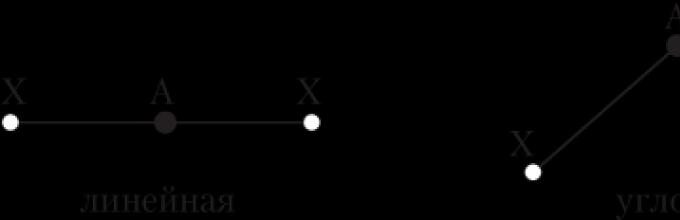
Kąt wiązania to kąt pomiędzy wyimaginowanymi liniami prostymi przechodzącymi przez jądra atomów związanych chemicznie. Można również powiedzieć, że jest to kąt między dwiema liniami wiązań, które mają wspólny atom.
Linia wiązania to linia łącząca jądra dwóch chemicznie związanych atomów.
Jedynie w przypadku cząsteczek dwuatomowych (H 2, Cl 2 itp.) nie pojawia się kwestia ich geometrii - są one zawsze liniowe, tj. jądra atomów znajdują się na tej samej linii prostej. Struktura bardziej złożonych cząsteczek może przypominać inną figury geometryczne, Na przykład:
- cząsteczki trójatomowe i jony typu AX 2 (H 2 O, CO 2, BeCl 2)

- cząsteczki tetraatomowe i jony typu AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) lub A 4 (P 4, As 4)

- cząsteczki pentaatomowe i jony typu AX 4 (CH 4, XeF 4, GeCl 4)

Są cząsteczki i nie tylko złożona struktura(ośmiościan, bipiramida trójkątna, płaski sześciokąt foremny). Ponadto cząsteczki i jony mogą mieć kształt zniekształconego czworościanu, nieregularnego trójkąta; w cząsteczkach o budowie kątowej wartości α mogą być różne (90°, 109°, 120°).
Strukturę cząsteczek można wiarygodnie ustalić eksperymentalnie, stosując różne metody fizyczne. Aby wyjaśnić przyczyny powstawania określonej struktury i przewidzieć geometrię cząsteczek, opracowano różne modele teoretyczne. Najłatwiejsze do zrozumienia są model odpychania par elektronów walencyjnych (model OVEP) i model hybrydyzacji orbitali atomowych walencyjnych (model GVAO).
Podstawą wszystkich (w tym dwóch wymienionych) modeli teoretycznych wyjaśniających budowę cząsteczek jest następujące twierdzenie: stan stabilny cząsteczki (jonu) odpowiada przestrzennemu układowi jąder atomowych, w którym następuje wzajemne odpychanie elektronów w wartościowości warstwa jest minimalna.
Uwzględnia to odpychanie elektronów zarówno uczestniczących w tworzeniu wiązania chemicznego (elektrony wiążące), jak i tych, które nie uczestniczą (samotne pary elektronów). Bierze się pod uwagę, że orbital wiążącej pary elektronów jest zwarty skupiony pomiędzy dwoma atomami i dlatego zajmuje mniej miejsca niż orbital wolnej pary elektronów. Z tego powodu odpychający efekt niewiążącej (samotnej) pary elektronów i jej wpływ na kąty wiązania jest bardziej wyraźny niż w przypadku pary wiążącej.
model OWEP. Teoria ta opiera się na następujących podstawowych zasadach (wyrażonych w uproszczeniu):
- o geometrii cząsteczki decydują tylko wiązania σ (ale nie π-);
- Kąty między wiązaniami zależą od liczby wolnych par elektronów w atomie centralnym.
Przepisy te należy rozpatrywać łącznie, ponieważ zarówno elektrony wiązania chemicznego, jak i samotne pary elektronów odpychają się, co ostatecznie prowadzi do powstania struktury molekularnej, w której to odpychanie jest minimalne.
Rozważmy geometrię niektórych cząsteczek i jonów z punktu widzenia metody OVEP; elektrony wiązania σ będą oznaczone dwiema kropkami (:), pojedyncze pary elektronów symbolem konwencjonalnym ( lub ) lub myślnikiem.
Zacznijmy od pięcioatomowej cząsteczki metanu CH 4. W tym przypadku atom centralny (ten węgiel) całkowicie wyczerpał swoje możliwości walencyjne i nie zawiera samotnych par elektronów walencyjnych, tj. wszystkie cztery elektrony walencyjne tworzą cztery wiązania σ. Jak powinny być ustawione względem siebie elektrony wiązania σ, aby odpychanie między nimi było minimalne? Oczywiście pod kątem 109°, tj. wzdłuż linii skierowanych do wierzchołków wyimaginowanego czworościanu, w środku którego znajduje się atom węgla. W tym przypadku elektrony biorące udział w tworzeniu wiązania są jak najbardziej od siebie oddalone (dla konfiguracji kwadratowej odległość między tymi elektronami wiązania jest większa, a odpychanie międzyelektronowe mniejsze). Z tego powodu cząsteczka metanu, a także cząsteczki CCl 4, CBr 4, CF 4 mają postać regularny czworościan(mówi się, że ma strukturę czworościenną):

Kation amonowy NH + 4 i anion BF 4 - mają tę samą budowę, ponieważ atomy azotu i boru tworzą każdy po cztery wiązania σ i nie mają wolnych par elektronów.
Rozważmy strukturę tetraatomowej cząsteczki amoniaku NH 3. Cząsteczka amoniaku ma trzy pary elektronów wiążących i jedną samotną parę elektronów na atomie azotu, tj. także cztery pary elektronów. Czy jednak kąt wiązania pozostanie na poziomie 109°? Nie, gdyż samotna para elektronów, zajmująca większą objętość w przestrzeni, działa silnie odpychająco na elektrony wiązania σ, co powoduje nieznaczne zmniejszenie kąta wiązania, w tym przypadku kąt ten wynosi około 107°. Cząsteczka amoniaku ma kształt piramidy trygonalnej (struktura piramidalna):

Czteratomowy jon hydroniowy H 3 O + ma również strukturę piramidalną: atom tlenu tworzy trzy wiązania σ i zawiera jedną samotną parę elektronów.
W czteroatomowej cząsteczce BF 3 liczba wiązań σ również wynosi trzy, ale atom boru nie ma samotnych par elektronów. Oczywiście odpychanie międzyelektronowe będzie minimalne, jeśli cząsteczka BF 3 będzie miała kształt regularnego płaskiego trójkąta o kącie wiązania 120°:

Cząsteczki BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 mają tę samą strukturę i z tych samych powodów.
Jaką strukturę będzie miała cząsteczka wody?
Trójatomowa cząsteczka wody ma cztery pary elektronów, ale tylko dwie z nich to elektrony z wiązaniem σ, pozostałe dwie to wolne pary elektronów atomu tlenu. Działanie odpychające dwóch wolnych par elektronów w cząsteczce H 2 O jest silniejsze niż w cząsteczce amoniaku z jedną wolną parą, dlatego kąt wiązania H–O–H jest mniejszy niż kąt H–N–H w cząsteczce amoniaku : w cząsteczce wody kąt wiązania wynosi około 105° :

Cząsteczka CO 2 (O=C=O) również posiada dwie pary elektronów wiążących (rozważamy tylko wiązania σ), jednakże w przeciwieństwie do cząsteczki wody, atom węgla nie posiada wolnych par elektronów. Oczywiście odpychanie między parami elektronów w tym przypadku będzie minimalne, jeśli będą one ustawione pod kątem 180°, tj. Na forma liniowa Cząsteczki CO2:
Cząsteczki BeH 2, BeF 2, BeCl 2 mają podobną strukturę i z tych samych powodów. W trójatomowej cząsteczce SO 2 atom centralny (atom siarki) również tworzy dwa wiązania σ, ale ma wolną parę elektronów, dlatego cząsteczka tlenku siarki(IV) ma budowę kątową, ale kąt w niej wiązania jest większy niż w cząsteczce wody (atom tlenu dwie wolne pary elektronów, a atom siarki tylko jedną):

Niektóre cząsteczki trójatomowe składu ABC (na przykład H–C≡N, Br–C≡N, S=C=Te, S=C=O) również mają strukturę liniową, w której centralny atom nie ma samotnego pary elektronów. Ale cząsteczka HClO ma strukturę kątową (α ≈ 103°), ponieważ atom centralny, atom tlenu, zawiera dwie wolne pary elektronów.
Korzystając z modelu OVEP, można również przewidzieć strukturę cząsteczek materia organiczna. Na przykład w cząsteczce acetylenu C2H2 każdy atom węgla tworzy dwa wiązania σ, a atomy węgla nie mają wolnych par elektronów; dlatego cząsteczka ma strukturę liniową H – C≡C – H.
W cząsteczce etenu C 2 H 4 każdy atom węgla tworzy trzy wiązania σ, co przy braku wolnych par elektronów na atomach węgla prowadzi do trójkątnego układu atomów wokół każdego atomu węgla:
W tabeli 4.2 podsumowuje niektóre dane dotyczące struktury cząsteczek i jonów.
Tabela 4.2
Zależność pomiędzy strukturą cząsteczek (jonów) a liczbą σ -wiązania i wolne pary elektronów atomu centralnego
| Rodzaj cząsteczki (jon) | Liczba wiązań σ utworzonych przez atom centralny | Liczba wolnych par elektronów | Struktura, kąt wiązania | Przykłady cząstek (podświetlony atom centralny) |
|---|---|---|---|---|
| AB 2 | 2 | 0 | Liniowy, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , CS 2 |
| 1 | Kątowy, 90°< α < 120° | SnCl 2, S O 2, N O 2 - | ||
| 2 | Kątowy, α< 109° | H. 2 O , O fa 2 , H 2 S , H 2 Se , S fa 2 , Xe O 2 , - | ||
| AB 3 | 3 | 0 | Trójkątny, α ≈ 120° | B fa 3, b H 3, B Cl 3, Al F 3, S O 3, do O 3 2 -, N O 3 - |
| 1 | Piramida trygonalna, α< 109° | N H. 3 , H. 3 O + , N fa 3 , S O 3 2 - , P. fa 3 , P. Cl 3 , As H 3 | ||
| AB 4 | 4 | 0 | Czworościan, α = 109° | N H. 4 + , CH 4 , Si H. 4 , b fa 4 , b H. 4 - , S O 4 2 - , ZA l H. 4 - |
model GVAO. Głównym stanowiskiem tego modelu jest to, że w tworzeniu wiązań kowalencyjnych nie biorą udziału „czyste” orbitale walencyjne s -, p - i d - ale tzw. orbitale hybrydowe. Następnie rozważa się hybrydyzację obejmującą tylko 2p- i 2s-AO.
Hybrydyzacja to zjawisko mieszania się orbitali walencyjnych, w wyniku czego wyrównują się one pod względem kształtu i energii.
Pojęcie hybrydyzacji stosuje się zawsze wtedy, gdy w tworzeniu wiązań chemicznych biorą udział elektrony o różnych podpoziomach energii, które nie różnią się zbytnio energią: 2s i 2p, 4s, 4p i 3d itp.
Orbital hybrydowy nie ma kształtu podobnego do oryginalnych 2p- i 2s-AO. Ma kształt nieregularnej trójwymiarowej ósemki:
Jak widać, hybrydowe AO są bardziej wydłużone, dzięki czemu mogą lepiej się nakładać i tworzyć silniejsze wiązania kowalencyjne. Kiedy orbitale hybrydowe nakładają się, powstają tylko wiązania σ; Ze względu na swój specyficzny kształt, hybrydowe AO nie biorą udziału w tworzeniu wiązań π (tylko niehybrydowe AO tworzą wiązania π). Liczba orbitali hybrydowych jest zawsze równa liczbie początkowych AO uczestniczących w hybrydyzacji. Orbitale hybrydowe muszą być zorientowane w przestrzeni w taki sposób, aby zapewnić ich maksymalną odległość od siebie. W takim przypadku odpychanie znajdujących się na nich elektronów (wiążących i niewiążących) będzie minimalne; energia całej cząsteczki również będzie minimalna.
Model GVAO zakłada, że hybrydyzacja obejmuje orbitale o podobnych wartościach energii (tj. orbitali walencyjnych) i odpowiednio dużej gęstości elektronowej. Gęstość elektronowa orbitalu maleje wraz ze wzrostem jego rozmiaru, dlatego rola w hybrydyzacji jest szczególnie znacząca w przypadku cząsteczek pierwiastków o małych okresach.
Należy pamiętać, że GVAO nie jest realne zjawisko fizyczne, ale wygodna koncepcja (model matematyczny), która pozwala opisać strukturę niektórych cząsteczek. Tworzenie się hybrydowych AO nie jest wykrywane żadnymi metodami fizycznymi. Niemniej jednak teoria hybrydyzacji ma pewne uzasadnienie fizyczne.
Rozważmy strukturę cząsteczki metanu. Wiadomo, że cząsteczka CH4 ma kształt czworościanu foremnego z atomem węgla w środku, wszystkie cztery wiązania C–H powstają na zasadzie mechanizmu wymiany i mają tę samą energię i długość, tj. są równoważne. Dość prosto wytłumaczyć obecność czterech niesparowanych elektronów w atomie węgla, zakładając jego przejście do stanu wzbudzonego:

Jednak proces ten w żaden sposób nie wyjaśnia równoważności wszystkich czterech wiązań C–H, gdyż zgodnie z powyższym schematem trzy z nich powstają z udziałem 2p-AO atomu węgla, jedno z udziałem 2s-AO, a kształt i energia 2p i 2s-AO są różne.
Aby wyjaśnić ten i inne podobne fakty, L. Pauling opracował koncepcję GVAO. Zakłada się, że mieszanie orbitali następuje w momencie tworzenia się wiązań chemicznych. Ten proces wymaga wydatku energetycznego na parowanie elektronów, który jednak jest kompensowany przez uwolnienie energii, gdy hybrydowe AO tworzą silniejsze (w porównaniu do niehybrydowych) wiązania.
W oparciu o charakter i liczbę AO biorących udział w hybrydyzacji wyróżnia się kilka typów.
W przypadku hybrydyzacji sp 3 mieszane są orbitale jeden s i trzy p (stąd nazwa rodzaju hybrydyzacji). W przypadku atomu węgla proces można przedstawić w następujący sposób:
1 s 2 2 s 2 2 p x 1 2 p y 1 → przejście elektronu 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → hybrydyzacja 1 s 2 2 (s p 3) 4
lub używając konfiguracje elektroniczne:

Cztery hybrydowe AO sp 3 zajmują pozycję pośrednią pod względem energii pomiędzy AO 2p i 2s.
Schemat hybrydyzacji sp 3 można przedstawić za pomocą obrazów kształtu AO atomu węgla:

Zatem w wyniku hybrydyzacji sp 3 powstają cztery orbitale hybrydowe, z których każdy zawiera niesparowany elektron. Orbitale te rozmieszczone są w przestrzeni pod kątem 109°28′, co zapewnia minimalne odpychanie znajdujących się na nich elektronów. Jeśli połączysz wierzchołki orbitali hybrydowych, otrzymasz trójwymiarową figurę - czworościan. Z tego powodu cząsteczki o składzie AX 4 (CH 4, SiH 4, CCl 4 itp.), w których realizowany jest tego typu hybrydyzacja, mają kształt czworościanu.
Koncepcja hybrydyzacji sp 3 AO dobrze wyjaśnia również strukturę cząsteczek H 2 O i NH 3. Zakłada się, że w hybrydyzacji biorą udział 2s - i 2p -AO atomów azotu i tlenu. W tych atomach liczba elektronów walencyjnych (odpowiednio 5 i 6) przekracza liczbę hybrydowych AO sp 3 (4), dlatego niektóre hybrydowe AO zawierają niesparowane elektrony, a niektóre zawierają wolne pary elektronów:

Widzimy, że w atomie azotu samotna para elektronów znajduje się na jednym hybrydowym AO, a w atomie tlenu - na dwóch. W tworzeniu wiązań z atomami wodoru uczestniczą tylko AO z niesparowanymi elektronami, a samotne pary elektronów będą działać odpychająco (ryc. 4.5) na siebie (w przypadku tlenu) i na wiążące elektrony (dla tlenu i azotu) ).

Ryż. 4,5. Schemat odpychającego działania orbitali wiążących i niewiążących w cząsteczce amoniaku (a) i wody (b)
Odpychanie jest silniejsze w przypadku cząsteczki wody. Ponieważ atom tlenu ma dwie wolne pary elektronów, odchylenie od idealnego kąta wiązania dla tego typu hybrydyzacji (109°28′) w cząsteczce wody jest większe niż w cząsteczce amoniaku (w cząsteczkach H2O i NH3 kąt wiązania wynosi 104, odpowiednio 5° i 107°).
Model hybrydyzacji sp 3 służy do wyjaśnienia budowy diamentu, krzemu, jonów NH 4 + i H 3 O +, alkanów, cykloalkanów itp. W przypadku węgla ten rodzaj hybrydyzacji stosuje się zawsze, gdy atom tego pierwiastek tworzy tylko wiązania σ.
W przypadku hybrydyzacji sp 2, miesza się jeden orbital s i dwa p. Rozważmy ten typ hybrydyzacji na przykładzie atomu boru. Proces jest reprezentowany za pomocą diagramów energetycznych


Zatem w wyniku hybrydyzacji sp 2 orbitali walencyjnych atomu boru powstają trzy hybrydowe AO, skierowane pod kątem 120°, a jeden z orbitali 2p nie bierze udziału w hybrydyzacji. Orbitale hybrydowe zawierają po jednym niesparowanym elektronie, znajdują się w tej samej płaszczyźnie, a jeśli połączymy ich wierzchołki, otrzymamy zwykły trójkąt. Z tego powodu cząsteczki o składzie AX 3 z hybrydyzacją sp 2 orbitali atomu A mają budowę trójkątną, co pokazano dla cząsteczki BF 3:

Niehybrydowy 2p-AO atomu boru jest wolny (niezajęty) i zorientowany prostopadle do płaszczyzny wiązań B–F, dlatego cząsteczka BF 3 jest akceptorem elektronów podczas tworzenia wiązania kowalencyjnego zgodnie z mechanizmem donor-akceptor, gdy interakcji z cząsteczką amoniaku.
Pojęcie hybrydyzacji sp 2 służy do wyjaśnienia natury podwójnego wiązania węgiel-węgiel w alkenach, budowy benzenu i grafitu, tj. w przypadkach, gdy atom węgla tworzy trzy wiązania σ i jedno π.
Przestrzenny układ orbitali atomu węgla dla hybrydyzacji sp 2 wygląda następująco: niehybrydowy 2p AO jest zorientowany prostopadle do płaszczyzny, w której znajdują się orbitale hybrydowe (zarówno hybrydowe, jak i niehybrydowe AO zawierają niesparowany elektron) .

Rozważmy tworzenie wiązań chemicznych w cząsteczce etylenu H 2 C=CH 2. W nim hybrydowe AO nakładają się na siebie oraz na 1s-AO atomu wodoru, tworząc pięć wiązań σ: jedno C – C i cztery C – H. Niehybrydowe 2p-AO nakładają się bocznie i tworzą wiązanie π pomiędzy atomami węgla (ryc. 4.6).

Ryż. 4.6. Schemat tworzenia wiązań σ (a) i wiązania π (b) w cząsteczce etylenu
W przypadku hybrydyzacji sp, jeden orbital s i jeden p są mieszane. Rozważmy ten typ hybrydyzacji na przykładzie atomu berylu. Wyobraźmy sobie proces hybrydyzacji za pomocą diagramu energii:

oraz z obrazem kształtu orbitali
Zatem w wyniku hybrydyzacji sp powstają dwa hybrydowe AO, każdy zawierający jeden niesparowany elektron. Dwa 2p-AO nie biorą udziału w hybrydyzacji i w przypadku berylu pozostają wolne. Orbitale hybrydowe są zorientowane pod kątem 180°, dlatego cząsteczki typu AX 2 z hybrydyzacją sp orbitali atomu A mają strukturę liniową (ryc. 4.7).

Ryż. 4.7. Struktura przestrzenna cząsteczki BeCl 2
Wykorzystując model sp-hybrydyzacji orbitali atomu węgla, wyjaśniono naturę potrójnego wiązania w cząsteczkach alkinów. W tym przypadku dwa hybrydowe i dwa niehybrydowe 2p-AO (pokazane poziomymi strzałkami →, ←) zawierają niesparowany elektron:

W cząsteczce acetylenu HC≡CH dzięki hybrydowym AO powstają wiązania σ C–H i C–C:

Hybrydowe 2p-AO nakładają się na siebie w dwóch prostopadłych płaszczyznach i tworzą dwa wiązania π pomiędzy atomami węgla (ryc. 4.8).

Ryż. 4.8. Schematyczne przedstawienie wiązań π (a) i płaszczyzn wiązań π (b) w cząsteczce acetylenu (falista linia pokazuje boczne nakładanie się 2p-AO atomu węgla)
Koncepcja sp-hybrydyzacji orbitali atomu węgla pozwala wyjaśnić powstawanie wiązań chemicznych w cząsteczkach karbinu, CO i CO 2, propadienu (CH 2 = C = CH 2), tj. we wszystkich przypadkach, w których atom węgla tworzy dwa wiązania σ i dwa wiązania π.
Główne cechy rozważanych typów hybrydyzacji oraz konfiguracje geometryczne cząsteczek odpowiadające niektórym typom hybrydyzacji orbitali centralnego atomu A (z uwzględnieniem wpływu niewiążących par elektronów) przedstawiono w tabeli. 4.3 i 4.4.
Tabela 4.3
Główna charakterystyka różne rodzaje hybrydyzacja
Porównanie danych w tabeli. 4.2 i 4.4 możemy stwierdzić, że oba modele – OVEP i GVAO – prowadzą do tych samych wyników dotyczących struktury cząsteczek.
Tabela 4.4
Rodzaje konfiguracji przestrzennej cząsteczek odpowiadające określonym typom hybrydyzacji
Wiązanie chemiczne
Wszelkie oddziaływania prowadzące do połączenia cząstek chemicznych (atomów, cząsteczek, jonów itp.) w substancje dzielą się na wiązania chemiczne i wiązania międzycząsteczkowe (oddziaływania międzycząsteczkowe).
Wiązania chemiczne- wiązania bezpośrednio pomiędzy atomami. Istnieją wiązania jonowe, kowalencyjne i metaliczne.
Wiązania międzycząsteczkowe- połączenia między cząsteczkami. Są to wiązania wodorowe, wiązania jonowo-dipolowe (w wyniku powstania tego wiązania następuje na przykład utworzenie powłoki hydratacyjnej jonów), dipol-dipol (w wyniku powstania tego wiązania cząsteczki substancji polarnych są łączone na przykład w ciekłym acetonie) itp.
Wiązanie jonowe- wiązanie chemiczne powstałe w wyniku przyciągania elektrostatycznego przeciwnie naładowanych jonów. W związkach binarnych (związkach dwóch pierwiastków) powstaje, gdy rozmiary połączonych atomów bardzo się od siebie różnią: niektóre atomy są duże, inne małe - to znaczy, że niektóre atomy łatwo oddają elektrony, a inne mają tendencję do zaakceptować je (zwykle są to atomy pierwiastków tworzących typowe metale i atomy pierwiastków tworzących typowe niemetale); elektroujemność takich atomów jest również bardzo różna.
Wiązanie jonowe jest bezkierunkowe i nienasycalne.
Wiązanie kowalencyjne- wiązanie chemiczne powstające w wyniku utworzenia wspólnej pary elektronów. Wiązanie kowalencyjne powstaje pomiędzy małymi atomami o tym samym lub podobnym promieniu. Warunkiem koniecznym jest obecność niesparowanych elektronów w obu związanych atomach ( mechanizm wymiany) lub samotna para na jednym atomie i wolny orbital na drugim (mechanizm donor-akceptor):
| A) | H· + ·H H:H | H-H | H 2 | (jedna wspólna para elektronów; H jest jednowartościowy); |
| B) | NN | N 2 | (trzy wspólne pary elektronów; N jest trójwartościowy); | |
| V) | H-F | HF | (jedna wspólna para elektronów; H i F są jednowartościowe); | |
| G) | NH4+ | (cztery wspólne pary elektronów; N jest czterowartościowy) |
- W zależności od liczby wspólnych par elektronów dzielimy wiązania kowalencyjne
- prosty (pojedynczy)- jedna para elektronów,
- podwójnie- dwie pary elektronów,
- potrójne- trzy pary elektronów.
Wiązania podwójne i potrójne nazywane są wiązaniami wielokrotnymi.
Zgodnie z rozkładem gęstości elektronów pomiędzy związanymi atomami wiązanie kowalencyjne podzielony przez niepolarny I polarny. Wiązanie niepolarne powstaje pomiędzy identycznymi atomami, a polarne - pomiędzy różnymi.
Elektroujemność- miara zdolności atomu substancji do przyciągania wspólnych par elektronów.
Pary elektronów wiązań polarnych są przesunięte w stronę elementów bardziej elektroujemnych. Samo przemieszczenie par elektronów nazywa się polaryzacją wiązania. Ładunki częściowe (nadmiarowe) powstałe podczas polaryzacji oznacza się + i -, na przykład: .
W oparciu o charakter nakładania się chmur elektronów („orbitali”) wiązanie kowalencyjne dzieli się na wiązanie - i -wiązanie.
-Wiązanie powstaje w wyniku bezpośredniego nakładania się chmur elektronów (wzdłuż linii prostej łączącej jądra atomowe), -wiązanie powstaje w wyniku bocznego nakładania się (po obu stronach płaszczyzny, w której leżą jądra atomowe).
Wiązanie kowalencyjne jest kierunkowe i nasycające się, a także polaryzowalne.
Model hybrydyzacji służy do wyjaśniania i przewidywania wzajemnego kierunku wiązań kowalencyjnych.
Hybrydyzacja orbitali atomowych i chmur elektronowych- rzekome wyrównanie orbitali atomowych w energii i kształt chmur elektronowych, gdy atom tworzy wiązania kowalencyjne.
Trzy najczęstsze typy hybrydyzacji to: sp-, sp 2 i sp 3 -hybrydyzacja. Na przykład:
sp-hybrydyzacja - w cząsteczkach C 2 H 2, BeH 2, CO 2 (struktura liniowa);
sp 2-hybrydyzacja - w cząsteczkach C 2 H 4, C 6 H 6, BF 3 (płaski trójkątny kształt);
sp 3-hybrydyzacja - w cząsteczkach CCl 4, SiH 4, CH 4 (postać czworościenna); NH3 (kształt piramidy); H 2 O (kształt kątowy).
Połączenie metalowe- wiązanie chemiczne utworzone przez współdzielenie elektronów walencyjnych wszystkich związanych atomów kryształu metalu. W efekcie powstaje pojedyncza chmura elektronowa kryształu, która łatwo przemieszcza się pod wpływem napięcia elektrycznego – stąd wysoka przewodność elektryczna metali.
Wiązanie metaliczne powstaje, gdy łączone atomy są duże i dlatego mają tendencję do oddawania elektronów. Proste substancje z wiązaniem metalicznym to metale (Na, Ba, Al, Cu, Au itp.), Substancje złożone to związki międzymetaliczne (AlCr 2, Ca 2 Cu, Cu 5 Zn 8 itp.).
Wiązanie metaliczne nie ma kierunkowości ani nasycenia. Konserwuje się go także w stopionych metalach.
Wiązanie wodorowe- wiązanie międzycząsteczkowe powstałe w wyniku częściowego przyjęcia pary elektronów z atomu silnie elektroujemnego przez atom wodoru o dużym dodatnim ładunku cząstkowym. Powstaje w przypadkach, gdy jedna cząsteczka zawiera atom z wolną parą elektronów i dużą elektroujemnością (F, O, N), a druga zawiera atom wodoru związany silnie polarnym wiązaniem z jednym z takich atomów. Przykłady międzycząsteczkowych wiązań wodorowych:
H-O-H OH 2 , H-O-H NH 3 , H-O-H F-H, H-F H-F.
Wewnątrzcząsteczkowe wiązania wodorowe występują w cząsteczkach polipeptydów, kwasy nukleinowe, białka itp.
Miarą siły każdego wiązania jest energia wiązania.
Energia komunikacji- energia potrzebna do rozerwania danego wiązania chemicznego w 1 molu substancji. Jednostką miary jest 1 kJ/mol.
Energie wiązań jonowych i kowalencyjnych są tego samego rzędu, energia wiązań wodorowych jest o rząd wielkości mniejsza.
Energia wiązania kowalencyjnego zależy od wielkości połączonych atomów (długości wiązania) i od krotności wiązania. Im mniejsze atomy i większa krotność wiązań, tym większa jest jego energia.
Energia wiązania jonowego zależy od wielkości jonów i ich ładunków. Im mniejsze jony i im większy ładunek, tym większa energia wiązania.
Struktura materii
Według rodzaju struktury wszystkie substancje są podzielone na molekularny I niemolekularny. Wśród substancji organicznych przeważają substancje molekularne, wśród substancji nieorganicznych przeważają substancje niemolekularne.
Ze względu na rodzaj wiązania chemicznego substancje dzielą się na substancje z wiązaniami kowalencyjnymi, substancje z wiązaniami jonowymi (substancje jonowe) i substancje z wiązaniami metalicznymi (metale).
Substancje z wiązaniami kowalencyjnymi mogą być molekularne lub niemolekularne. Ma to istotny wpływ na ich właściwości fizyczne.
Substancje molekularne składają się z cząsteczek połączonych ze sobą słabymi wiązaniami międzycząsteczkowymi, są to między innymi: H 2, O 2, N 2, Cl 2, Br 2, S 8, P 4 i inne proste substancje; CO 2, SO 2, N 2 O 5, H 2 O, HCl, HF, NH 3, CH 4, C 2 H 5 OH, polimery organiczne i wiele innych substancji. Substancje te nie mają wysokiej wytrzymałości, mają niskie temperatury topienia i wrzenia, nie przeprowadzać Elektryczność niektóre z nich są rozpuszczalne w wodzie lub innych rozpuszczalnikach.
Substancje niemolekularne z wiązaniami kowalencyjnymi lub substancje atomowe (diament, grafit, Si, SiO 2, SiC i inne) tworzą bardzo mocne kryształy (z wyjątkiem grafitu warstwowego), są nierozpuszczalne w wodzie i innych rozpuszczalnikach, mają wysoką temperaturę topnienia i temperatury wrzenia, większość z nich nie przewodzi prądu elektrycznego (z wyjątkiem grafitu, który przewodzi prąd elektryczny i półprzewodników - krzemu, germanu itp.)
Wszystkie substancje jonowe są z natury niemolekularne. Są to stałe, ogniotrwałe substancje, roztwory i stopy, które przewodzą prąd elektryczny. Wiele z nich jest rozpuszczalnych w wodzie. Należy zaznaczyć, że w substancje jonowe ah, których kryształy składają się z jonów złożonych, istnieją również wiązania kowalencyjne, na przykład: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)( NO 3-) itp. Atomy tworzące jony złożone są połączone wiązaniami kowalencyjnymi.
Metale (substancje z wiązaniami metalicznymi) bardzo zróżnicowane pod względem właściwości fizycznych. Wśród nich znajdują się metale ciekłe (Hg), bardzo miękkie (Na, K) i bardzo twarde (W, Nb).
Charakterystyka właściwości fizyczne metale to ich wysoka przewodność elektryczna (w przeciwieństwie do półprzewodników maleje ona wraz ze wzrostem temperatury), duża pojemność cieplna i plastyczność (w przypadku czystych metali).
W stanie stałym prawie wszystkie substancje składają się z kryształów. Ze względu na rodzaj struktury i rodzaj wiązania chemicznego dzielimy kryształy („sieci krystaliczne”) atomowy(kryształy substancji niemolekularnych z wiązaniami kowalencyjnymi), joński(kryształy substancji jonowych), molekularny(kryształy substancji molekularnych z wiązaniami kowalencyjnymi) i metal(kryształy substancji z wiązaniem metalicznym).
Zadania i sprawdziany na temat „Temat 10. „Wiązania chemiczne. Struktura materii.”
- Rodzaje wiązań chemicznych - Struktura materii stopień 8-9
Lekcje: 2 Zadania: 9 Testy: 1
- Zadania: 9 Testów: 1
Po pracy nad tym tematem powinieneś zrozumieć następujące pojęcia: wiązanie chemiczne, wiązanie międzycząsteczkowe, wiązanie jonowe, wiązanie kowalencyjne, połączenie metalowe, wiązanie wodorowe, wiązanie pojedyncze, wiązanie podwójne, wiązanie potrójne, wiązania wielokrotne, wiązanie niepolarne, wiązanie polarne, elektroujemność, polaryzacja wiązania, wiązanie - i -, hybrydyzacja orbitali atomowych, energia wiązania.
Musisz znać klasyfikację substancji według rodzaju struktury, rodzaju wiązania chemicznego, zależności właściwości prostych i substancje złożone od rodzaju wiązania chemicznego i rodzaju „sieci krystalicznej”.
Należy umieć: określić rodzaj wiązania chemicznego w substancji, rodzaj hybrydyzacji, sporządzić diagramy tworzenia wiązań, posługiwać się pojęciem elektroujemności, liczbą elektroujemności; wiedzieć, jak zmienia się elektroujemność pierwiastki chemiczne jeden okres i jedna grupa w celu określenia polarności wiązania kowalencyjnego.
Po upewnieniu się, że nauczyłeś się wszystkiego, czego potrzebujesz, przystąp do wykonywania zadań. Życzymy sukcesu.
Rekomendowane lektury:
- O. S. Gabrielyan, G. G. Lysova. Chemia, klasa 11. M., Drop, 2002.
- G. E. Rudzitis, F. G. Feldman. Chemia, klasa 11. M., Edukacja, 2001.
Opcja 2
Część A:
1. Para pierwiastków, pomiędzy którymi tworzy się jonowe wiązanie chemiczne:
a) węgiel i siarka, b) wodór i azot, c) potas i tlen, d) krzem i wodór.
2.Wzór substancji z wiązaniem kowalencyjnym:
a) NaCl, b) HCl, c) BaO, d) Ca 3 N 2.
3.Najmniej polarne wiązanie to:
a) C – H, b) C – Cl, c) C – F, d) C – Br.
4. Stwierdzenie, że δ jest wiązaniem, w przeciwieństwie do π, jest prawdziwe:
a) słabszy, b) powstający, gdy orbitale atomowe nakładają się bocznie,
c) nie jest kowalencyjny, d) powstaje w wyniku osiowego nakładania się orbitali atomowych.
5.Substancja, w cząsteczce której nie ma wiązania π:
a) etylen, b) benzen, c) amoniak, d) azot.
6. Najsilniejszą cząsteczką jest:
a) H 2, b) N 2, c) F 2, d) O 2.
7. W jonie CO 3 2- atom węgla znajduje się w stanie hybrydowym sp 2, zatem jon ma postać:
a) liniowy, b) czworościan, c) trójkąt, d) ośmiościan.
8. Atom węgla ma stopień utlenienia -3 i wartościowość 4 w połączeniu ze wzorem:
a) CO 2, b) C 2 H 6, c) CH 3 Cl, d) CaC 2.
9. Sieć krystaliczna atomu ma:
a) soda, b) woda, c) diament, d) parafina.
10. Substancja pomiędzy cząsteczkami, w której występuje wiązanie wodorowe:
a) etan, b) fluorek sodu, c) tlenek węgla (4), d) etanol.
11. Wybierz grupę pierwiastków uszeregowanych według rosnącej elektroujemności:
a) Cl, Si, N, O, b) Si, P, N, F, c) F, Cl, O, Si, d) O, N, F, Cl.
12. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
13.
14.Powstawanie wiązań wodorowych można wytłumaczyć:
a) rozpuszczalność kwas octowy w wodzie, b) właściwości kwasowe etanol,
c) wysoka temperatura topnienia wielu metali, d) nierozpuszczalność metanu w wodzie.
15.Wzór substancji z polarnym wiązaniem kowalencyjnym:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
Część B:
B 1. Spośród zaproponowanych wybierz substancję, której cząsteczka zawiera wiązania π: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Napisz nazwę tej substancji.
B 2. Proces oddziaływania orbitali elektronowych prowadzący do ich wyrównania pod względem kształtu i energii nazywa się......
B 3. Jak nazywa się zjawisko powiększania się cząstek koloidalnych i ich wytrącania z roztworu koloidalnego?
B 4. Podaj przykład substancji, której cząsteczka zawiera trzy wiązania δ i jedno π. Nazwij substancję w mianowniku.
B 5. W których z poniższych substancji wiązania są najbardziej polarne: chlorowodór, fluor, woda, amoniak, siarkowodór. Zapisz wybraną substancję za pomocą wzoru.
Część C:
Od 1. Pisać wzory strukturalne wszystkie substancje izomeryczne o składzie C 4 H 8. Nazwij każdą substancję.
C 2. Utwórz wzory strukturalne substancji: CHF 3, C 2 H 2 Br 2, O 2.
Komponować formuły graficzne: Mg3N2, Na2SO4, KHCO3.
C 3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
Test Nr 2 „STRUKTURA MATERII”.
Opcja 3
Część A:
1. Wiązania chemiczne w substancjach, których wzory to odpowiednio CH 4 i CaCl 2:
a) jonowo-kowalencyjny polarny, b) kowalencyjnie polarny i jonowy,
c) kowalencyjne niepolarne i jonowe, d) kowalencyjne polarne i metaliczne.
2.Polaryzacja wiązania jest większa w substancji o wzorze:
a) Br2, b) LiBr, c) HBr, d) KBr
3.Jonowy charakter wiązania w szeregu związków Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) rośnie, b) maleje, c) nie zmienia się, d) najpierw maleje, potem rośnie.
4. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) Al(OH) 3, b) [CH 3NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
5.Kilka wzorów substancji, których cząsteczki zawierają tylko wiązania δ:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
6. Najsilniejsze połączenie z nich:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
7. Grupa wzorów związków, w których występuje podobny kierunek wiązań, ze względu na sp 3 - hybrydyzację orbitali elektronowych:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
8. Wartościowość i stopień utlenienia atomu węgla w cząsteczce metanolu są odpowiednio równe:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
9. Substancje posiadające jonową sieć krystaliczną charakteryzują się:
a) słaba rozpuszczalność w wodzie, b) wysoka temperatura wrzenia, c) topliwość, d) lotność.
10. Powstawanie wiązania wodorowego pomiędzy cząsteczkami prowadzi do:
a) w celu obniżenia temperatury wrzenia substancji, b) w celu zmniejszenia rozpuszczalności substancji w wodzie,
c) do wzrostu temperatury wrzenia substancji, d) do wzrostu lotności substancji.
11. Wzór substancji z wiązaniem jonowym:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
12. W cząsteczce występuje tylko wiązanie δ –:
a) azot, b) etanol, c) etylen, d) tlenek węgla (4).
13. Struktura molekularna ma substancję o wzorze:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
14.Wiązanie wodorowe powstaje pomiędzy:
a) cząsteczki wody, b) cząsteczki wodoru,
c) cząsteczki węglowodorów, d) atomy metali i atomy wodoru.
15.Jeśli energicznie wstrząśniesz mieszaniną oleju roślinnego i wody, otrzymasz:
a) zawiesina, b) emulsja, c) piana, d) aerozol.
Część B:
B 1. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce Br2 wynosi…
B 2. Jakie wiązania tworzą wiązanie potrójne w cząsteczce N 2 (odpowiedź przedstaw w mianowniku).
B 3. W węzłach metalowej sieci krystalicznej znajdują się…….. .
B 4. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i dwa π. Nazwij substancję w mianowniku.
B 5. Jaka jest maksymalna liczba wiązań π, które mogą utworzyć się pomiędzy dwoma atomami w cząsteczce? (przedstaw odpowiedź jako liczbę)
Część C:
Od 1. Zapisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 5 H 10 O. Nazwij każdą substancję.
C 2. Utwórz wzory strukturalne substancji: CHCl 3, C 2 H 2 Cl 2, F 2.
Utwórz formuły graficzne: AlN, CaSO 4, LiHCO 3.
C 3. Określ stopień utlenienia w związki chemiczne i jony:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Powiązana informacja.
Badanie nr 2 DKR „STRUKTURA SUBSTANCJI”.
1. Wiązania chemiczne w substancjach, których wzory to odpowiednio CH 4 i CaCl 2:
a) jonowo-kowalencyjny polarny, b) kowalencyjnie polarny i jonowy,
c) kowalencyjne niepolarne i jonowe, d) kowalencyjne polarne i metaliczne.
2. Polaryzacja wiązania jest większa w substancji o wzorze:
a) Br2, b) LiBr, c) HBr, d) KBr
3. Jonowy charakter wiązania w szeregu związków Li 2 O - Na 2 O - K 2 O - Rb 2 O:
a) rośnie, b) maleje, c) nie zmienia się, d) najpierw maleje, potem rośnie.
4. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) Al(OH) 3, b) [CH 3NH 3 ]Cl, c) C 2 H 5 OH, d) C 6 H 12 O 6.
5. Kilka wzorów substancji, których cząsteczki zawierają tylko wiązania δ:
a) CH 4 i O 2, b) C 2 H 5 OH i H 2 O, c) N 2 i CO 2, d) HBr i C 2 H 4.
6. Najsilniejsze połączenie z nich:
a) C - Cl, b) C - F, c) C - Br, d) C - I.
7. Grupa wzorów związków, w których występuje podobny kierunek wiązań, ze względu na sp 3 - hybrydyzację orbitali elektronowych:
a) CH 4, C 2 H 4, C 2 H 2, b) NH 3, CH 4, H 2 O, c) H 2 O, C 2 H 6, C 6 H 6, d) C 3 H 8, BCl 3, BeCl 2.
8. Wartościowość i stopień utlenienia atomu węgla w cząsteczce metanolu są odpowiednio równe:
a) 4 i +4, b) 4 i -2, c) 3 i +2, d) 4 i -3.
9. Substancje posiadające jonową sieć krystaliczną charakteryzują się:
a) słaba rozpuszczalność w wodzie, b) wysoka temperatura wrzenia, c) topliwość, d) lotność.
10. Powstawanie wiązania wodorowego pomiędzy cząsteczkami prowadzi do:
a) w celu obniżenia temperatury wrzenia substancji, b) w celu zmniejszenia rozpuszczalności substancji w wodzie,
c) do wzrostu temperatury wrzenia substancji, d) do wzrostu lotności substancji.
11. Wzór substancji z wiązaniem jonowym:
a) NH 3, b) C 2 H 4, c) KH, d) CCl 4.
12
A13. Struktura molekularna ma substancję o wzorze:
14. Wiązanie wodorowe powstaje pomiędzy:
a) cząsteczki wody, b) cząsteczki wodoru,
c) cząsteczki węglowodorów, d) atomy metali i atomy wodoru.
15. Jeśli energicznie wstrząśniesz mieszaniną oleju roślinnego i wody, otrzymasz:
a) zawiesina, b) emulsja, c) piana, d) aerozol.
16. Wzór substancji z polarnym wiązaniem kowalencyjnym:
a) Cl 2, b) KCl, c) NH 3, d) O 2.
17. Substancja pomiędzy cząsteczkami, w której występuje wiązanie wodorowe:
a) etanol, b) metan, c) wodór, d) benzen.
18. Liczba wspólnych par elektronów w cząsteczce wodoru:
a) jeden, b) dwa, c) trzy, d) cztery.
19. Polaryzacja wiązania chemicznego wzrasta w wielu związkach, których wzory są następujące:
a) NH 3, HI, O 2, b) CH 4, H 2 O, HF, c) PH 3, H 2 S, H 2, d) HCl, CH 4, CL 2.
20. Sieć krystaliczna chlorku sodu:
a) atomowy, b) jonowy, c) metaliczny, d) molekularny.
21. Liczba wiązań δ i π w cząsteczce acetylenu:
a) 5 δ i π - nie, b) 2 δ i 3 π, c) 3 δ i 2 π, d) 4 δ i 1 π.
22. Substancje o wzorach: CH 3 – CH 2 – OH i CH 3 – O – CH 3 to:
a) homologi, b) izomery, c) ta sama substancja, d) zarówno homologi, jak i izomery.
23. Homolog substancji o wzorze CH 2 = CH – CH 3 to:
a) butan, b) buten – 1, c) buten – 2, d) butyna – 1.
24. Pomiędzy atomami powstaje kowalencyjne wiązanie niepolarne:
a) wodór i tlen, b) węgiel i wodór, c) chlor, d) magnez.
25. W cząsteczce występuje tylko wiązanie δ –:
a) azot, b) etanol, c) etylen, d) tlenek węgla (4).
26. Atom azotu ma wartościowość 3 i stopień utlenienia 0 w cząsteczce substancji o wzorze:
a) NH 3, b) N 2, c) CH 3 NO 2, d) N 2 O 3.
27. Struktura molekularna ma substancję o wzorze:
a) CH 4, b) NaOH, c) SiO 2, d) Al.
A28. Wiązanie C–H jest silniejsze niż wiązanie Si–H, ponieważ:
a) długość wiązania jest krótsza, b) długość wiązania jest dłuższa,
c) polaryzacja wiązania jest mniejsza, d) polaryzacja wiązania jest większa.
29. Pomiędzy atomami istnieje wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor w substancji, którego wzór to:
a) CH 3 NO 2, b) NH 4 NO 2, c) C 5 H 8, d) H 2 O.
30. Najmniej polarne wiązanie to:
a) C – H, b) C – Cl, c) C – F, d) C – Br
Część B:
B 1. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce Br2 wynosi…
B 2. Jakie wiązania tworzą wiązanie potrójne w cząsteczce N 2 (odpowiedź przedstaw w mianowniku).
B 3. W węzłach metalowej sieci krystalicznej znajdują się…….. .
B 4. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i dwa π. Nazwij substancję w mianowniku.
B 5.
B 6. Liczba wspólnych par elektronów pomiędzy atomami bromu w cząsteczce N2 wynosi…
B 7. Jakie wiązania tworzą wiązanie potrójne w cząsteczce C 2 H 2 (odpowiedź przedstaw w mianowniku).
B 8. W węzłach jonowej sieci krystalicznej znajdują się............
B 9. Podaj przykład substancji, której cząsteczka zawiera pięć wiązań δ i jedno π. Nazwij substancję w mianowniku.
B 10. Jaka jest maksymalna liczba wiązań π, które mogą utworzyć się pomiędzy dwoma atomami w cząsteczce? (przedstaw odpowiedź jako liczbę)
Część C:
Od 1. Zapisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 5 H 10 O. Nazwij każdą substancję.
C 2 .
Utwórz wzory strukturalne substancji: CHCl 3, C 2 H 2 Cl 2, F 2.
Utwórz formuły graficzne: AlN, CaSO 4, LiHCO 3.
C 3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
C 4. Napisz wzory strukturalne wszystkich substancji izomerycznych o składzie C 4 H 8 O 2. Nazwij każdą substancję.
C 5 .
Utwórz wzory strukturalne substancji: CHBr 3, C 2 H 2 Br 2, Br 2.
Utwórz wzory graficzne: Al 2 S 3, MgSO 4, Li 2 CO 3.
Od 6. Określ stopień utlenienia związków chemicznych i jonów:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Strona 1
Nowikowa Olesia Władimirowna
Nauczyciel chemii i biologii
Miejska placówka oświatowa – szkoła średnia im. Prokudino
Dzielnica Atkarska
Obwód Saratowski.
Test nr 1 na temat: „Struktura substancji”.
Opcja I .
a) chlorowodór
b) wodorotlenek sodu
c) tlenek węgla (II)
d) tlenek węgla (IV)
2. W cząsteczce występuje polarne wiązanie kowalencyjne
a) tlen
b) siarka rombowa
d) wodór
3. Wiązanie chemiczne w cząsteczce dwutlenku węgla
a) kowalencyjny niepolarny
b) kowalencyjny polarny
c) metal
d) jonowy
4. Najsilniejsza cząsteczka to:
A) H 2 ;
B) N 2 ;
V) F 2 ;
G) O 2 .
5. Substancja pomiędzy cząsteczkami, w której występuje wiązanie wodorowe:
b) fluorek sodu;
c) tlenek węgla(II);
d) etanol.
6. Substancje posiadające jonową sieć krystaliczną charakteryzują się:
a) słaba rozpuszczalność w wodzie; c) topliwość;
b) wysoka temperatura wrzenia; d) zmienność.
7. Powstawanie wiązania wodorowego między cząsteczkami prowadzi do:
a) do obniżenia temperatury wrzenia;
b) w celu zmniejszenia rozpuszczalności substancji w wodzie;
c) zwiększyć temperaturę wrzenia;
d) w celu zwiększenia lotności substancji.
8. Która substancja zawiera więcej tlenu w Na 2CO 3 lub w Ca(HCO 3 ) 2?
9. :
A) SO 2 + H 2 O͢͢ →
B) Na+H2O →
B) Na 2O+H 2O →
D) S+H 2O →
10. Rozwiąż problem :
Ile wody i wodorotlenku sodu potrzeba do przygotowania 180 g 15% roztworu?
11 . Rozwiąż problem :
Jaka jest masa tlenu otrzymanego w wyniku destylacji frakcyjnej 200 m 3 (n.s.) powietrze, jeśli udział objętościowy tlenu wynosi 0,21?
Test nr 1 na temat „Struktura substancji”.
Opcja II .
Jonowe wiązanie chemiczne występuje w
a) siarka krystaliczna
b) stały jod
c) jodek wapnia
d) tlenek fosforu (v)
2. W cząsteczce występuje kowalencyjne wiązanie polarne
a) kwas siarkowy
b) siarka plastyczna
d) siarczek rubidu
3. Wiązanie chemiczne w cząsteczce wodoru
a) kowalencyjny niepolarny
b) kowalencyjny polarny
c) metal
d) jonowy
4. Najsilniejsze wiązania w cząsteczce substancji o wzorze:
A) H 2 S ;
B) H 2 Se ;
V) H 2 O ;
G) H 2 Te .
5. Struktura molekularna ma substancje o wzorze:
A) CH 4 ;
B) NaOH ;
V) SiO 2 ;
G) Glin .
6. Wiązanie wodorowe powstaje pomiędzy:
a) cząsteczki wody; c) cząsteczki węglowodorów;
b) cząsteczki wodoru; d) atomy metali i atomy wodoru.
7. Tworzenie wiązań wodorowych można wytłumaczyć:
a) rozpuszczalność kwasu octowego w wodzie;
b) właściwości kwasowe etanolu;
c) wysoka temperatura topnienia wielu metali;
d) nierozpuszczalność metanu w wodzie.
8. Porównaj zawartość siarki w Mg(HSO 4) 2 i CuSO4?
9. Uzupełnij równania możliwych reakcji :
A) CO 2 + H 2 O͢͢ →
B) Al+H2O →
B) Fe+H 2O →
D) C+H 2O →
10. Rozwiąż problem:
Konieczne jest przygotowanie 540 g 12% roztworu kwas azotowy. Oblicz, ile wody i kwasu należy zużyć, aby przygotować taki roztwór.
11. Rozwiąż problem:
Jaka jest masa azotu otrzymana ze 143,6 litrów powietrza zawierającego 78% azotu objętościowo?