I informacje historyczne.
1) M.V. Łomonosow, po przeprowadzeniu harmonijnego rozumowania i prostych eksperymentów, doszedł do wniosku, że „przyczyna ciepła leży w wewnętrznym ruchu cząstek związanej materii… Powszechnie wiadomo, że ciepło jest wzbudzane przez ruch: ręce rozgrzewają się od wzajemnego tarcie, drewno zapala się, wylatują iskry, gdy krzem uderza w stal, żelazo nagrzewa się, gdy jego cząstki są kute silnymi uderzeniami”
2) B. Rumfoord, pracując w fabryce armat, zauważył, że podczas wiercenia lufy armaty zrobiło się bardzo gorąco. Na przykład umieścił metalowy cylinder o wadze około 50 kg w skrzynce z wodą i po wierceniu w cylindrze wiertłem doprowadził wodę w skrzynce do wrzenia w ciągu 2,5 godziny.
3) Davy przeprowadził ciekawy eksperyment w 1799 roku. Dwa kawałki lodu pocierane o siebie zaczęły się topić i zamieniać w wodę.
4) Lekarz okrętowy Robert Mayer w 1840 roku, płynąc na wyspę Jawa, zauważył, że po sztormie woda w morzu jest zawsze cieplejsza niż przed.
Obliczanie pracy.
W mechanice pracę definiuje się jako iloczyn modułów siły i przemieszczenia: A=FS. Rozważając procesy termodynamiczne ruch mechaniczny makrociała jako całość nie są brane pod uwagę. Pojęcie pracy wiąże się tutaj ze zmianą objętości ciała, tj. ruch części makrociała względem siebie. Proces ten prowadzi do zmiany odległości pomiędzy cząsteczkami, a często także do zmiany prędkości ich ruchu, a co za tym idzie, do zmiany energii wewnętrznej ciała.
Niech w cylindrze z ruchomym tłokiem będzie gaz o temperaturze T 1 (rys.). Powoli podgrzewamy gaz do temp T 2. Gaz będzie się rozszerzał izobarycznie, a tłok przesunie się z położenia 1 na pozycję 2 na odległość Δ l. Siła ciśnienia gazu wykona pracę na ciałach zewnętrznych. Ponieważ P= const, następnie siła nacisku F = PS również stała. Dlatego pracę tej siły można obliczyć za pomocą wzoru A=F Δ l=PS Δ l=P Δ V, A= str Δ V
gdzie Δ V- zmiana objętości gazu. Jeżeli objętość gazu nie zmienia się (proces izochoryczny), wówczas praca wykonana przez gaz wynosi zero.
Dlaczego energia wewnętrzna ciała zmienia się, gdy się kurczy lub rozszerza? Dlaczego gaz nagrzewa się po sprężeniu i ochładza się podczas rozszerzania?
Przyczyna zmiany temperatury gazu podczas sprężania i rozprężania jest następująca: podczas sprężystych zderzeń cząsteczek z poruszającym się tłokiem zmienia się ich energia kinetyczna.
- Jeśli gaz jest sprężany, to podczas zderzenia zbliżający się do niego tłok przekazuje część swojej energii mechanicznej cząsteczkom, w wyniku czego gaz się nagrzewa;
- Jeśli gaz rozszerza się, to po zderzeniu z cofającym się tłokiem prędkość cząsteczek maleje. W rezultacie gaz się ochładza.
Wraz z kompresją i rozszerzaniem średnia również się zmienia energia potencjalna interakcja cząsteczek, ponieważ zmienia to średnią odległość między cząsteczkami.
Praca sił zewnętrznych działających na gaz
- Kiedy gaz jest sprężany, kiedyΔ V= V2 – V1 < 0 , A>0, kierunki siły i przemieszczenia pokrywają się;
- Kiedy się rozszerza, kiedyΔ V= V2 – V1 > 0, A<0, направления силы и перемещения противоположны.
Zapiszmy równanie Clapeyrona-Mendelejewa dla dwóch stanów gazowych:
pV 1 = m/M*RT 1 ; pV 2 =m/M* CZ 2 ⇒
P(V 2 − V 1 )= m/m*R(T 2 − T 1 ).
Dlatego w procesie izobarycznym
A= m/m*RΔ T.
Jeśli M = M(1 mol gazu doskonałego), następnie przy Δ Τ = 1 K otrzymujemy R = A. Z tego wynika fizyczne znaczenie uniwersalnej stałej gazowej: jest liczbowo równa pracy wykonanej przez 1 mol gazu doskonałego podczas ogrzewania izobarycznego w temperaturze 1 K.
Geometryczna interpretacja dzieła:
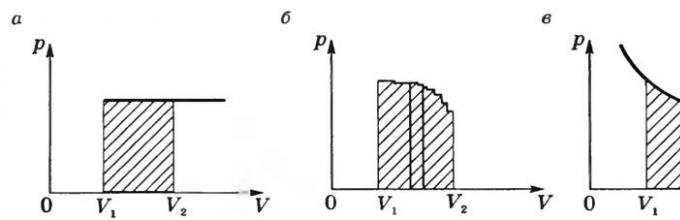
Na wykresie p = f(V) dla procesu izobarycznego praca jest równa powierzchni zacieniowanego prostokąta na rysunku a).
Jeśli proces nie jest izobaryczny (ryc. b), to krzywa P = F(V) można przedstawić jako linię przerywaną składającą się z dużej liczby izochor i izobar. Praca na przekrojach izochorycznych wynosi zero, a całkowita praca na wszystkich przekrojach izobarycznych będzie równa powierzchni zacieniowanej figury. W procesie izotermicznym ( T= const) praca jest równa powierzchni zacieniowanej figury pokazanej na rysunku c.

>>Fizyka: Praca w termodynamice
W wyniku jakich procesów może zmienić się energia wewnętrzna? Wiesz już, że istnieją dwa rodzaje takich procesów: praca i wymiana ciepła. Zacznijmy od pracy. Ile wynosi podczas sprężania i rozszerzania gazu i innych ciał?
Zajmuję się mechaniką i termodynamiką. W mechanika pracę definiuje się jako iloczyn modułu siły, modułu przemieszczenia punktu jej przyłożenia i cosinusa kąta między nimi. Kiedy na poruszające się ciało działa siła, praca jest równa zmianie jego energii kinetycznej.
W ruch ciała jako całości nie jest brany pod uwagę, mówimy o ruchu części ciała makroskopowego względem siebie. W rezultacie objętość ciała może się zmienić, ale jego prędkość pozostaje równa zeru. Praca w termodynamice jest definiowana tak samo jak w mechanice, z tym że jest równa nie zmianie energii kinetycznej ciała, ale zmianie jego energii wewnętrznej.
Zmiana energii wewnętrznej podczas wykonywania pracy. Dlaczego energia wewnętrzna ciała zmienia się, gdy ciało kurczy się lub rozszerza? Dlaczego w szczególności powietrze nagrzewa się podczas pompowania opony rowerowej?
Przyczyna zmiany temperatury gazu podczas jego sprężania jest następująca: podczas sprężystych zderzeń cząsteczek gazu z poruszającym się tłokiem zmienia się ich energia kinetyczna. Tak więc, zbliżając się do cząsteczek gazu, tłok przekazuje im część swojej energii mechanicznej podczas zderzeń, w wyniku czego gaz się nagrzewa. Tłok zachowuje się jak piłkarz, który kopnięciem uderza nadlatującą piłkę. Stopa nadaje piłce prędkość znacznie większą niż ta, którą posiadała przed uderzeniem.
I odwrotnie, jeśli gaz się rozszerza, to po zderzeniu z cofającym się tłokiem prędkości cząsteczek maleją, w wyniku czego gaz się ochładza. Podobnie postępuje piłkarz, aby zmniejszyć prędkość lecącej piłki lub ją zatrzymać – noga piłkarza odsuwa się od piłki, jakby ustępując jej miejsca.
Kiedy następuje ściskanie lub rozszerzanie, zmienia się również średnia energia potencjalna interakcji między cząsteczkami, ponieważ zmienia się również średnia odległość między cząsteczkami.
Obliczanie pracy. Obliczmy pracę w zależności od zmiany objętości na przykładzie gazu w cylindrze pod tłokiem ( Ryc.13.1).
Najłatwiej jest najpierw obliczyć nie pracę siły działającej na gaz z korpusu zewnętrznego (tłoka), ale pracę wykonaną przez siłę ciśnienia gazu działającą na tłok o sile . Zgodnie z trzecim prawem Newtona  . Moduł siły działającej od gazu na tłok jest równy
. Moduł siły działającej od gazu na tłok jest równy ![]() , Gdzie P- ciśnienie gazu i S- powierzchnia tłoka. Pozwól, aby gaz rozprężył się izobarycznie, a tłok przesunął się w kierunku siły na niewielką odległość
, Gdzie P- ciśnienie gazu i S- powierzchnia tłoka. Pozwól, aby gaz rozprężył się izobarycznie, a tłok przesunął się w kierunku siły na niewielką odległość ![]() . Ponieważ ciśnienie gazu jest stałe, praca wykonana przez gaz wynosi:
. Ponieważ ciśnienie gazu jest stałe, praca wykonana przez gaz wynosi:
Pracę tę można wyrazić w postaci zmiany objętości gazu. Jego początkowa objętość V 1 = Sh 1 i finał V 2 = Sh 2. Dlatego
gdzie jest zmiana objętości gazu.
Podczas rozszerzania gaz wykonuje pracę dodatnią, ponieważ kierunek siły i kierunek ruchu tłoka pokrywają się.
Jeżeli gaz jest sprężony, wówczas wzór (13.3) na pracę gazową pozostaje ważny. Ale teraz ![]() , i dlatego
, i dlatego ![]() (Ryc.13.2).
(Ryc.13.2).

Stanowisko A praca wykonywana przez ciała zewnętrzne nad gazem różni się od pracy wykonanej przez sam gaz A` tylko znajomy: ![]() , ponieważ siła działająca na gaz jest skierowana przeciwnie do siły, a ruch tłoka pozostaje taki sam. Zatem praca sił zewnętrznych działających na gaz jest równa:
, ponieważ siła działająca na gaz jest skierowana przeciwnie do siły, a ruch tłoka pozostaje taki sam. Zatem praca sił zewnętrznych działających na gaz jest równa:
Kiedy gaz jest sprężany, gdy , praca siły zewnętrznej okazuje się dodatnia. Tak właśnie powinno być: przy sprężaniu gazu kierunki działania siły i przemieszczenie punktu jej przyłożenia pokrywają się.
Jeśli ciśnienie nie jest utrzymywane na stałym poziomie, wówczas podczas rozprężania gaz traci energię i przekazuje ją otaczającym ciałom: wznoszącemu się tłokowi, powietrzu itp. Gaz ochładza się. Przeciwnie, gdy gaz jest sprężany, ciała zewnętrzne przekazują mu energię i gaz się nagrzewa.
Geometryczna interpretacja dzieła. Praca A gazu w przypadku stałego ciśnienia można podać prostą interpretację geometryczną.
Skonstruujmy wykres zależności ciśnienia gazu od zajmowanej przez niego objętości ( Ryc.13.3). Oto obszar prostokąta abdc, ograniczone harmonogramem str. 1=stała, oś V i segmenty ok I płyta CD, równe ciśnieniu gazu, jest liczbowo równe pracy (13.3):

Ogólnie rzecz biorąc, ciśnienie gazu nie pozostaje stałe. Na przykład podczas procesu izotermicznego zmniejsza się odwrotnie proporcjonalnie do objętości ( Ryc.13.4). W tym przypadku, aby obliczyć pracę, należy podzielić całkowitą zmianę objętości na małe części i obliczyć pracę elementarną (małą), a następnie je wszystkie dodać. Praca wykonana przez gaz jest nadal liczbowo równa polu powierzchni figury ograniczonej wykresem zależności P z V, oś V i segmenty ok I płyta CD, równy ciśnieniu str. 1, p2 w stanie początkowym i końcowym gazu.

???
1. Dlaczego gazy nagrzewają się po sprężeniu?
2. Czy siły zewnętrzne wykonują pracę dodatnią czy ujemną podczas procesu izotermicznego pokazanego na rysunku 13.2?
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, fizyka 10. klasa
Treść lekcji notatki z lekcji ramka wspomagająca prezentację lekcji metody przyspieszania technologie interaktywne Ćwiczyć zadania i ćwiczenia autotest warsztaty, szkolenia, case'y, zadania prace domowe dyskusja pytania retoryczne pytania uczniów Ilustracje pliki audio, wideo i multimedia fotografie, obrazy, grafiki, tabele, diagramy, humor, anegdoty, dowcipy, komiksy, przypowieści, powiedzenia, krzyżówki, cytaty Dodatki streszczenia artykuły sztuczki dla ciekawskich szopki podręczniki podstawowy i dodatkowy słownik terminów inne Udoskonalanie podręczników i lekcjipoprawianie błędów w podręczniku aktualizacja fragmentu podręcznika, elementy innowacji na lekcji, wymiana przestarzałej wiedzy na nową Tylko dla nauczycieli doskonałe lekcje planie kalendarza przez rok wytyczne programy dyskusyjne Zintegrowane LekcjeJeśli masz uwagi lub sugestie dotyczące tej lekcji,
Podstawowe wzory termodynamiki i fizyki molekularnej, które będą Ci przydatne. Kolejny wspaniały dzień na praktyczne ćwiczenia z fizyki. Dzisiaj zestawimy wzory, które są najczęściej używane do rozwiązywania problemów z termodynamiki i fizyki molekularnej.
Więc chodźmy. Spróbujmy pokrótce przedstawić prawa i wzory termodynamiki.
Gaz doskonały
Gaz doskonały jest idealizacją, podobnie jak punkt materialny. Cząsteczki takiego gazu są punkty materialne, a zderzenia cząsteczek są całkowicie sprężyste. Zaniedbujemy oddziaływanie cząsteczek na odległość. W zagadnieniach termodynamiki często przyjmuje się, że gazy rzeczywiste są idealne. Dużo łatwiej jest tak żyć i nie trzeba zajmować się mnóstwem nowych terminów w równaniach.
Co więc dzieje się z cząsteczkami gazu doskonałego? Tak, poruszają się! I rozsądne jest pytanie, z jaką prędkością? Oczywiście oprócz prędkości cząsteczek interesuje nas także ogólny stan naszego gazu. Jakie ciśnienie P wywiera na ścianki naczynia, jaką objętość zajmuje V, jaką ma temperaturę T.
Aby się tego wszystkiego dowiedzieć, istnieje równanie stanu gazu doskonałego, czyli Równanie Clapeyrona-Mendelejewa
Tutaj M – masa gazu, M – jego masę cząsteczkową (znaleziemy ją z układu okresowego), R – uniwersalna stała gazowa równa 8,3144598(48) J/(mol*kg).
Uniwersalną stałą gazową można wyrazić w postaci innych stałych ( Stała Boltzmanna i liczba Avogadro )

MasaNa z kolei można obliczyć jako iloczyn gęstość I tom .

Podstawowe równanie teorii kinetyki molekularnej (MKT)
Jak już powiedzieliśmy, cząsteczki gazu poruszają się, a im wyższa temperatura, tym szybciej. Istnieje związek pomiędzy ciśnieniem gazu a średnią energią kinetyczną E jego cząstek. To połączenie nazywa się podstawowe równanie teorii kinetyki molekularnej i ma postać:

Tutaj N – stężenie cząsteczek (stosunek ich liczby do objętości), mi – średnia energia kinetyczna. Można je znaleźć, a także odpowiednio średnią kwadratową prędkość cząsteczek, korzystając ze wzorów:

Podstawiamy energię do pierwszego równania i otrzymujemy inną postać równania podstawowego MKT

Pierwsza zasada termodynamiki. Wzory na izoprocesy
Przypomnijmy, że pierwsza zasada termodynamiki mówi: ilość ciepła przekazanego gazowi zmienia energię wewnętrzną gazu U i wykonuje przez gaz pracę A. Wzór pierwszej zasady termodynamiki zapisuje się jako następująco:

Jak wiadomo, coś się dzieje z gazem, możemy go sprężyć, możemy go ogrzać. W tym przypadku interesują nas procesy, które zachodzą przy jednym stałym parametrze. Przyjrzyjmy się, jak w każdym z nich wygląda pierwsza zasada termodynamiki.
Przy okazji! Dla wszystkich naszych czytelników dostępna jest teraz zniżka 10% NA każdy rodzaj pracy.
Izotermiczny proces zachodzi w stałej temperaturze. Obowiązuje tu prawo Boyle'a-Mariotte'a: w procesie izotermicznym ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości. W procesie izotermicznym:

przebiega ze stałą objętością. Proces ten charakteryzuje się prawem Charlesa: przy stałej objętości ciśnienie jest wprost proporcjonalne do temperatury. W procesie izochorycznym całe ciepło dostarczone do gazu zmienia jego energię wewnętrzną.

pracuje pod stałym ciśnieniem. Prawo Gay-Lussaca mówi, że przy stałym ciśnieniu gazu jego objętość jest wprost proporcjonalna do temperatury. W procesie izobarycznym ciepło służy zarówno do zmiany energii wewnętrznej, jak i do wykonania pracy gazu.

. Proces adiabatyczny to proces, który zachodzi bez wymiany ciepła z środowisko. Oznacza to, że wzór pierwszej zasady termodynamiki dla procesu adiabatycznego wygląda następująco:

Energia wewnętrzna jednoatomowego i dwuatomowego gazu doskonałego

Pojemność cieplna
Ciepło właściwe równa ilości ciepła potrzebnej do ogrzania jednego kilograma substancji o jeden stopień Celsjusza.

Oprócz właściwej pojemności cieplnej istnieje molowa pojemność cieplna (ilość ciepła potrzebna do ogrzania jednego mola substancji o jeden stopień) przy stałej objętości, oraz molowa pojemność cieplna przy stałym ciśnieniu. W poniższych wzorach i jest liczbą stopni swobody cząsteczek gazu. Dla gazu jednoatomowego i=3, dla gazu dwuatomowego – 5.

Maszyny termiczne. Wzór na efektywność w termodynamice
Silnik cieplny w najprostszym przypadku składa się z grzejnika, lodówki i płynu roboczego. Grzejnik przekazuje ciepło do płynu roboczego, działa, następnie jest chłodzony przez lodówkę i wszystko się powtarza. O w. Typowym przykładem silnika cieplnego jest silnik spalinowy.
Współczynnik przydatna akcja silnik cieplny oblicza się ze wzoru

Zebraliśmy więc podstawowe wzory termodynamiki, które będą przydatne w rozwiązywaniu problemów. Nie są to oczywiście wszystkie wzory z zakresu termodynamiki, ale ich znajomość naprawdę może się przydać. A jeśli masz jakieś pytania, pamiętaj obsługa studentów, którego specjaliści są gotowi w każdej chwili przyjść z pomocą.
Praca z termodynamiki
W termodynamice, w przeciwieństwie do mechaniki, nie bierze się pod uwagę ruchu ciała jako całości, ale jedynie względną zmianę części układu termodynamicznego, w wyniku czego zmienia się jego objętość.
Rozważmy pracę gazu podczas ekspansji izobarycznej.
Obliczmy pracę wykonaną przez gaz, gdy działa on na tłok z siłą $(F")↖(→)$ o wartości równej i przeciwnej do siły $(F")↖(→)$ działającej na gazie z tłoka: $ (F")↖(→)=-(F")↖(→)$ (zgodnie z trzecim prawem Newtona), $F"=pS$, gdzie $p$ to ciśnienie gazu a $S$ jest polem powierzchni tłoka.Jeżeli przemieszczenie tłoka $∆h$ w wyniku rozszerzania jest małe, to ciśnienie gazu można uznać za stałe, a praca gazu jest równa:
$A"=F"∆h=pS∆h=p∆V$
Jeżeli gaz się rozszerza, to wykonuje pracę dodatnią, gdyż ruch tłoka pokrywa się w kierunku z siłą $(F")↖(→)$. Jeżeli gaz jest sprężony, to praca gazu jest ujemna, gdyż ruch tłoka jest przeciwny do siły $(F")↖ (→)$. We wzorze $A"=F"∆h=pS∆h=p∆V$ pojawi się znak minus: $∆V

Natomiast działanie sił zewnętrznych $A$ jest dodatnie, gdy gaz jest sprężany, i ujemne, gdy gaz się rozszerza:
Wykonując dodatnią pracę nad gazem, ciała zewnętrzne przekazują mu część swojej energii. Kiedy gaz się rozszerza, ciała zewnętrzne odbierają mu część energii – działanie sił zewnętrznych jest ujemne.

Na wykresie ciśnienia w funkcji objętości $p(V)$ praca jest zdefiniowana jako obszar ograniczony krzywą $p(V)$, osią $V$ oraz odcinkami $ab$ i $cd$ równymi ciśnienie $p_1$ w stanach początkowych ($V_1 $) i $р_2$ w stanach końcowych ($V_2$), zarówno dla procesów izobarycznych, jak i izotermicznych.
Pierwsza zasada termodynamiki
Pierwszą zasadą (pierwszą zasadą) termodynamiki jest prawo zachowania i transformacji energii dla układu termodynamicznego.
Zgodnie z pierwszą zasadą termodynamiki pracę można wykonać wyłącznie za pomocą ciepła lub innej formy energii. W związku z tym pracę i ilość ciepła mierzy się w tych samych jednostkach - dżulach (i energii).
Pierwsza zasada termodynamiki została sformułowana przez niemieckiego naukowca J. L. Mayera w 1842 r. i potwierdzona eksperymentalnie przez angielskiego naukowca J. Joule'a w 1843 r.
Pierwsza zasada termodynamiki jest sformułowany w następujący sposób:
Zmiana energii wewnętrznej układu podczas jego przejścia z jednego stanu do drugiego jest równa sumie pracy sił zewnętrznych i ilości ciepła przekazanego układowi:
gdzie $∆U$ to zmiana energii wewnętrznej, $A$ to praca sił zewnętrznych, $Q$ to ilość ciepła przekazanego do układu.
Z $∆U=A+Q$ wynika prawo zachowania energii wewnętrznej. Jeśli system jest odizolowany od wpływów zewnętrznych, $A=0$ i $Q=0$, a zatem $∆U=0$.
Podczas wszelkich procesów zachodzących w układzie izolowanym jego energia wewnętrzna pozostaje stała.
Jeżeli pracę wykonuje układ, a nie siły zewnętrzne, wówczas równanie ($∆U=A+Q$) zapisuje się w postaci:
gdzie $A"$ to praca wykonana przez system ($A"=-A$).
Ilość ciepła przekazana do układu ulega zmianie jego energii wewnętrznej i wykonaniu przez układ pracy nad ciałami zewnętrznymi.
Pierwszą zasadę termodynamiki można sformułować jako niemożność istnienia Maszyna ruchu wiecznego pierwszego rodzaju, które wykonywałyby pracę bez pobierania energii z jakiegokolwiek źródła, czyli jedynie kosztem energii wewnętrznej.
Istotnie, jeśli do ciała nie zostanie dostarczone ciepło ($Q=0$), to praca $A"$, zgodnie z równaniem $Q=∆U+A"$, zostanie wykonana jedynie w wyniku spadku energii wewnętrznej $A"=-∆U$ Po wyczerpaniu się rezerwy energii silnik przestaje pracować.
Należy pamiętać, że zarówno praca, jak i ilość ciepła są charakterystykami procesu zmiany energii wewnętrznej, zatem nie można powiedzieć, że w układzie zawarta jest określona ilość ciepła lub pracy. Układ w dowolnym stanie ma tylko określoną energię wewnętrzną.
Zastosowanie pierwszej zasady termodynamiki do różnych procesów
Rozważmy zastosowanie pierwszej zasady termodynamiki do różnych procesów termodynamicznych.
Proces izochoryczny. Przedstawiono zależność $p(T)$ na wykresie termodynamicznym izochora.
Proces izochoryczny (izochoryczny) jest procesem termodynamicznym zachodzącym w układzie o stałej objętości.
Proces izochoryczny można prowadzić w gazach i cieczach zamkniętych w naczyniu o stałej objętości.
Podczas procesu izochorycznego objętość gazu nie zmienia się ($∆V=0$) i zgodnie z pierwszą zasadą termodynamiki $Q=∆U+A"$
tj. zmiana energii wewnętrznej jest równa ilości przekazanego ciepła, ponieważ praca ($A=p∆V=0$) nie jest wykonywana przez gaz.

Jeśli gaz zostanie ogrzany, to $Q > 0$ i $∆U > 0$, jego energia wewnętrzna wzrasta. Podczas chłodzenia gazu $Q
Proces izotermiczny przedstawione graficznie izoterma.
Proces izotermiczny jest procesem termodynamicznym zachodzącym w układzie o stałej temperaturze.
Ponieważ podczas procesu izotermicznego energia wewnętrzna gazu nie ulega zmianie ($T=const$), to cała ilość ciepła przekazanego gazowi idzie na wykonanie pracy:
Kiedy gaz otrzymuje ciepło ($Q > 0$), wykonuje pracę dodatnią ($A" > 0$). Jeśli gaz oddaje ciepło do otoczenia, $Q
Proces izobaryczny Pokazuje to diagram termodynamiczny izobara.
Proces izobaryczny (izobaryczny) jest procesem termodynamicznym zachodzącym w układzie pod stałym ciśnieniem $p$.
Przykładem procesu izobarycznego jest rozprężanie gazu w cylindrze ze swobodnie poruszającym się, obciążonym tłokiem.
W procesie izobarycznym, zgodnie ze wzorem $Q=∆U+A"$, ilość ciepła przekazana gazowi zmienia jego energię wewnętrzną $∆U$ i wykonuje pracę $A"$ pod stałym ciśnieniem:
Pracę gazu doskonałego wyznacza się z wykresu $p(V)$ dla procesu izobarycznego ($A"=p∆V$).
W przypadku gazu doskonałego w procesie izobarycznym objętość jest proporcjonalna do temperatury, w gazach rzeczywistych część ciepła jest wydawana na zmianę średniej energii oddziaływania cząstek.
Proces adiabatyczny
Proces adiabatyczny (proces adiabatyczny) jest procesem termodynamicznym zachodzącym w układzie bez wymiany ciepła z otoczeniem ($Q=0$).
Adiabatyczną izolację układu osiąga się w przybliżeniu w naczyniach Dewara, w tzw. powłokach adiabatycznych. Na układ izolowany adiabatycznie nie wpływają zmiany temperatury otaczających ciał. Jego energia wewnętrzna może się zmienić jedynie w wyniku pracy wykonanej przez ciała zewnętrzne nad układem lub samym układem.
Zgodnie z pierwszą zasadą termodynamiki ($∆U=A+Q$) w układzie adiabatycznym
gdzie $A$ jest pracą sił zewnętrznych.
Podczas adiabatycznego rozprężania gazu $A
Stąd,
$∆U=(i)/(2)·(m)/(M)R∆T
co oznacza spadek temperatury podczas rozprężania adiabatycznego. Prowadzi to do tego, że ciśnienie gazu spada gwałtowniej niż podczas procesu izotermicznego.

Na rysunku adiabat $1-2$ przechodzący pomiędzy dwiema izotermami wyraźnie ilustruje to, co zostało powiedziane. Pole powierzchni pod adiabazą jest liczbowo równe pracy wykonanej przez gaz podczas jego adiabatycznego rozprężania od objętości $V_1$ do $V_2$.
Sprężanie adiabatyczne prowadzi do wzrostu temperatury gazu, ponieważ w wyniku sprężystych zderzeń cząsteczek gazu z tłokiem wzrasta ich średnia energia kinetyczna, w przeciwieństwie do rozszerzania, gdy maleje (w pierwszym przypadku zwiększają się prędkości cząsteczek gazu , w drugim maleją).
W silnikach Diesla stosowane jest ostre ogrzewanie powietrza podczas sprężania adiabatycznego.
Zasada działania silników cieplnych
Silnik cieplny to urządzenie, które zamienia energię wewnętrzną paliwa na energię mechaniczną.
Zgodnie z drugą zasadą termodynamiki silnik cieplny może w sposób ciągły wykonywać cykl okresowy Praca mechaniczna na skutek chłodzenia otaczających ciał, jeśli nie tylko odbiera ciepło od ciała cieplejszego (grzejnik), ale jednocześnie oddaje ciepło ciału mniej nagrzanemu (lodówka). W związku z tym do wykonania pracy wykorzystywana jest nie cała ilość ciepła otrzymanego z grzejnika, a jedynie jego część.
Zatem głównymi elementami każdego silnika cieplnego są:
- płyn roboczy (gaz lub para) wykonujący pracę;
- grzejnik, który przekazuje energię płynowi roboczemu;
- lodówka, która pochłania część energii z płynu roboczego.

Sprawność silnika cieplnego
Zgodnie z zasadą zachowania energii praca wykonana przez silnik jest równa:
$A"=|K_1|-|K_2|$
gdzie $Q_1$ to ilość ciepła otrzymanego z grzejnika, $Q_2$ to ilość ciepła oddanego do lodówki.
Współczynnik wydajności(Sprawność) silnika cieplnego to stosunek pracy $A"$ wykonanej przez silnik do ilości ciepła otrzymanego od grzejnika:
$η=(A")/(|Q_1|)=(|Q_1|-|Q_2|)/(|Q_1|)=1-(|Q_2|)/(|Q_1|)$
Ponieważ wszystkie silniki przekazują pewną ilość ciepła do lodówki, wówczas $η
Sprawność silnika cieplnego jest proporcjonalna do różnicy temperatur między grzejnikiem a lodówką. Gdy $T_1 - T_2=0$ silnik nie może działać.
Cykl Carnota
Cykl Carnota jest kołowym procesem odwracalnym, składającym się z dwóch procesów izotermicznych i dwóch adiabatycznych.
Proces ten został po raz pierwszy omówiony przez francuskiego inżyniera i naukowca N. L. S. Carnota w 1824 r. w książce „Refleksje na temat siła napędowa ogień i maszyny zdolne do rozwinięcia tej siły.”
Celem badań Carnota było poznanie przyczyn niedoskonałości ówczesnych silników cieplnych (miały one sprawność rzędu $< 5%$)и поиски путей их усовершенствования.
Wybór dwóch procesów izotermicznych i dwóch adiabatycznych wynikał z faktu, że praca gazu podczas rozprężania izotermicznego realizowana jest dzięki energii wewnętrznej grzejnika, a w procesie adiabatycznym dzięki energii wewnętrznej rozprężającego się gazu. W tym cyklu wykluczony jest kontakt ciał o różnych temperaturach, dlatego wykluczone jest przenoszenie ciepła bez pracy.
Cykl Carnota jest najbardziej efektywny ze wszystkich. Jego wydajność jest maksymalna.

Rysunek przedstawia procesy termodynamiczne zachodzące w cyklu. W procesie rozszerzania izotermicznego ($1-2$) w temperaturze $T_1$ praca wykonywana jest poprzez zmianę energii wewnętrznej grzejnika, czyli dostarczenie do gazu ilości ciepła $Q_1$:
$A_(12)=Q_1.$ Chłodzenie gazu przed sprężaniem (3-4$) następuje podczas rozprężania adiabatycznego (2-3$). Zmiana energii wewnętrznej $∆U_(23)$ podczas procesu adiabatycznego ($Q=0$) zostaje całkowicie zamieniona na pracę mechaniczną:
$A_(23)=-∆U_(23)$
Temperatura gazu w wyniku rozprężania adiabatycznego (2-3$) spada do temperatury lodówki $T_2
Cykl kończy się procesem sprężania adiabatycznego (4-1$), podczas którego gaz podgrzewany jest do temperatury $T_1$.
Maksymalna wartość sprawności silników cieplnych na gaz doskonały według cyklu Carnota:
$η=(T_1-T_2)/(T_1)=1-(T_2)/(T_1)$
Istota wzoru $η=(T_1-T_2)/(T_1)=1-(T_2)/(T_1)$ wyraża się w udowodnionym przez S. Carnota twierdzeniu, że sprawność żaden silnik cieplny nie może przekroczyć wydajności cyklu Carnota przeprowadzonego w tej samej temperaturze grzejnika i lodówki.
Przyłożenie obciążenia do dowolnej konstrukcji powoduje jej odkształcenie. W takim przypadku części konstrukcji opuszczają stan spoczynku i uzyskują określone prędkości i przyspieszenia. Jeśli obciążenie rośnie powoli, to przyspieszenia te są małe, dlatego siły bezwładności powstające podczas przejścia układu do stanu odkształconego można pominąć. Takie płynne (stopniowe) przyłożenie obciążenia nazywa się statycznym.
Wyznaczmy pracę obciążenia zewnętrznego, np. siły P, przyłożonej statycznie do jakiegoś układu sprężystego (rys. 1.11), którego materiał spełnia prawo Hooke’a.
W przypadku małych odkształceń w tym układzie obowiązuje zasada niezależnego działania sił, dlatego też przemieszczenia poszczególnych punktów i odcinków konstrukcji są wprost proporcjonalne do wielkości wywołującego je obciążenia. W ogólna perspektywa zależność tę można wyrazić równością
Tutaj A jest przemieszczeniem w kierunku siły P; a jest pewnym współczynnikiem zależnym od materiału, konstrukcji i wielkości konstrukcji.
Zwiększmy siłę P o nieskończenie małą wartość.Przyrost ten spowoduje zwiększenie przemieszczenia o tę wartość
Ułóżmy wyrażenie na elementarną pracę siły zewnętrznej przy przemieszczeniu, odrzucając nieskończenie małe wielkości drugiego rzędu małości:
Wartość z wzoru (1.11) zastępujemy wyrażeniem
Integracja tego wyrażenia w obrębie całkowita zmiana siły od zera do jej wartości końcowej, otrzymujemy wzór na obliczenie pracy wykonanej przez przyłożoną statycznie siłę zewnętrzną P:

Ponieważ wynikową formułę można przedstawić w formie
Ogólnie rzecz biorąc, kierunek siły P może nie pokrywać się z kierunkiem wywołanego przez nią ruchu. Ponieważ o wielkości pracy decyduje iloczyn siły i drogi przebytej w kierunku tej siły, wartość A należy rozumieć jako rzut rzeczywistego (całkowitego) przemieszczenia punktu przyłożenia siły na kierunek siły. Na przykład, gdy siła P jest przyłożona pod kątem do osi poziomej (rys. 2.11), przemieszczenie A mierzone jest segmentem (reprezentującym rzut rzeczywistego przemieszczenia na kierunek siły P).


W przypadku przyłożenia do układu pary sił z momentem obrotowym (momentem skupionym), w podobny sposób można uzyskać wyrażenie na pracę. W takim przypadku konieczne jest wybranie rodzaju ruchu odpowiadającego momentowi skupionemu; będzie to kąt obrotu Przekrój belka, do której przykładany jest moment.
Przykładowo praca momentu statycznego przyłożonego do belki pokazana na rys. 3.11,
gdzie O jest kątem obrotu (w radianach) przekroju belki, do którego przyłożony jest moment Ш.
Zatem praca siły zewnętrznej podczas jej statycznego działania na dowolną konstrukcję sprężystą jest równa połowie iloczynu wartości tej siły i wartości odpowiedniego przemieszczenia.
Uogólniając uzyskany wniosek, przez siłę rozumiemy każde uderzenie przyłożone do układu sprężystego, czyli nie tylko siłę skupioną, ale także moment, równomiernie rozłożone obciążenie itp.; Przez ruch rozumiemy rodzaj ruchu, w którym dana moc wykonuje pracę. Siła skupiona P odpowiada przemieszczeniu liniowemu, momentowi – kątowemu i równomiernemu obciążenie rozproszone- obszar wykresu przemieszczeń w obszarze obciążenia.
Kiedy grupa sił zewnętrznych działa statycznie na konstrukcję, praca tych sił jest równa połowie sumy iloczynów każdej siły i wielkości odpowiadającego jej przemieszczenia spowodowanego działaniem całej grupy sił.
I tak, przykładowo, działając na belkę pokazaną na ryc. 4.11, siły skupione i momenty skupione, praca sił zewnętrznych

Przyjmuje się znak minus przed ostatnim wyrazem wyrażenia, ponieważ kierunek kąta obrotu przekroju belki, w której przykładany jest moment, jest przeciwny do kierunku tego momentu.
Działanie sił zewnętrznych na powodowane przez nie przemieszczenia można wyrazić inaczej, a mianowicie: poprzez momenty zginające, siły wzdłużne i poprzeczne powstające w przekrojach prętów konstrukcyjnych.


Wybierzmy z pręta prostoliniowego o dwóch odcinkach prostopadłych do jego osi (rys. 5.11) nieskończenie mały element długości (element ). Pręt składa się z nieskończoności duża liczba takie elementy. Do elementu w przypadku ogólnym problem z samolotem przykładana jest siła wzdłużna N, moment zginający M i siła poprzeczna
Siły N, M, Q są siłami wewnętrznymi działającymi na cały pręt. Jednakże dla wybranego elementu są to siły zewnętrzne, dlatego pracę A można otrzymać jako sumę pracy wykonanej przez statycznie rosnące siły N, M, Q na odpowiednich odkształceniach elementów. Rozważmy osobno wpływ każdego z nich te siły działające na element
Element podlegający wyłącznie siłom wzdłużnym N pokazano na rys. 6.11. Jeśli jego lewy odcinek uznamy za nieruchomy, to prawy odcinek pod wpływem siły podłużnej przesunie się w prawo o wartość.Przy tym ruchu statycznie rosnąca siła N wykona pracę
Element podlegający jedynie momentom zginającym M pokazano na rys. 7.11.


Jeśli jego lewa sekcja nie jest nieruchoma, wówczas będzie wzajemny kąt obrotu końcowych sekcji elementu równy kątowi zwróć się do jego prawej części [zob. wzór (16.7) i ryc. 33,7]:
![]()
Przy tym przemieszczeniu kątowym, statycznie rosnący moment M wykona pracę
Element podlegający wyłącznie siłom ścinającym Q pokazano na rys. 8.11, o. Po ustaleniu jego lewej części (ryc. 8.11, b) przykładamy siły styczne do prawej, których wypadkową jest siła poprzeczna
Załóżmy, że naprężenia styczne rozkładają się równomiernie na całej powierzchni F przekroju, czyli wówczas przemieszczenie (rys. 8.11b) spowodowane działaniem siły poprzecznej Q, będące przesunięciem końcowych odcinków przekroju element względem siebie, na podstawie wzoru (3.4) zostanie wyznaczony z wyrażenia
oraz praca statycznie rosnącej siły Q na tym przemieszczeniu