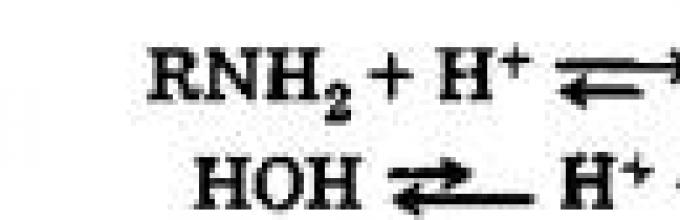TEMAT WYKŁADU: AMINY I AMINALKOLE
Pytania:
ogólna charakterystyka: struktura, klasyfikacja, nazewnictwo.
Metody odbioru
Właściwości fizyczne
Właściwości chemiczne
Indywidualni przedstawiciele. Metody identyfikacji.
Ogólna charakterystyka: struktura, klasyfikacja, nazewnictwo
Aminy są pochodnymi amoniaku, których cząsteczka ma atomy wodoru zastąpione rodnikami węglowodorowymi.
Klasyfikacja
1– Aminy rozróżnia się w zależności od liczby podstawionych atomów wodoru w amoniaku:
– podstawowy zawierają grupę aminową grupę aminową (–NH2), wzór ogólny: R–NH2,
– wtórny zawierają grupę iminową (–NH),
wzór ogólny: R 1 –NH–R 2
– trzeciorzędowy zawierają atom azotu, wzór ogólny: R3 –N
Znane są również związki z czwartorzędowym atomem azotu: czwartorzędowy wodorotlenek amonu i jego sole.
2– W zależności od budowy rodnika wyróżnia się aminy:
– alifatyczne (nasycone i nienasycone)
– alicykliczny
– aromatyczne (zawierające grupę aminową lub łańcuch boczny w rdzeniu)
– heterocykliczny.
Nazewnictwo, izomeria amin
1. Nazwy amin zgodnie z racjonalną nomenklaturą pochodzą zwykle od nazw wchodzących w ich skład rodników węglowodorowych z dodatkiem końcówki -amina : metyloamina CH 3 –NH 2, dimetyloamina CH 3 –NH – CH 3, trimetyloamina (CH 3) 3 N, propyloamina CH 3 CH 2 CH 2 –NH 2, fenyloamina C 6 H 5 – NH 2 itp.
2. Według nomenklatury IUPAC za grupę aminową uważa się grupę funkcyjną i jej nazwę amino umieszczone przed nazwą głównego łańcucha:
Izomeria amin zależy od izomerii rodników.
Metody wytwarzania amin
Aminy można wytwarzać na różne sposoby.
A) Działanie na amoniak przez haloalkile
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
B) Katalityczne uwodornienie nitrobenzenu wodorem cząsteczkowym:
C 6 H 5 NO 2 ––® C 6 H 5 NH 2 + H 2 O
anilina nitrobenzenowa
B) Wytwarzanie niższych amin (C1 – C4) poprzez alkilowanie alkoholami:
350 0 C, Al 2 O 3
R–OH + NH 3 ––––––––––® R–NH 2 +H 2 O
350 0 C, Al 2 O 3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al 2 O 3
3R–OH + NH 3 ––––––––––® R 3 –N + 3H 2 O
Właściwości fizyczne amin
Metyloamina, dimetyloamina i trimetyloamina są gazami, środkowe elementy szeregu amin są cieczami, wyższe - ciała stałe. Wraz ze wzrostem masy cząsteczkowej amin wzrasta ich gęstość, wzrasta temperatura wrzenia i maleje ich rozpuszczalność w wodzie. Wyższe aminy są nierozpuszczalne w wodzie. Niższe aminy mają nieprzyjemny zapach, przypominający nieco zapach zepsutej ryby. Wyższe aminy są albo bezwonne, albo mają bardzo delikatny zapach. Aminy aromatyczne to bezbarwne ciecze lub ciała stałe, mają nieprzyjemny zapach i są trujące.
Właściwości chemiczne amin
Chemiczne zachowanie amin zależy od obecności grupy aminowej w cząsteczce. Na zewnątrz powłoka elektronowa Atom azotu ma 5 elektronów. W cząsteczce aminy, a także w cząsteczce amoniaku, atom azotu spędza na tworzeniu trzech wiązania kowalencyjne trzy elektrony, a dwa pozostają wolne.
Obecność wolnej pary elektronów na atomie azotu daje mu możliwość przyłączenia protonu, dlatego aminy są podobne do amoniaku, wykazują właściwości zasadowe, tworzą wodorotlenki i sole.
Tworzenie się soli. Aminy z kwasami dają sole, które pod wpływem mocnej zasady ponownie dają wolne aminy:
Aminy dają sole nawet przy słabych kwas węglowy:
Podobnie jak amoniak, aminy mają zasadowe właściwości wynikające z wiązania protonów w słabo dysocjujący podstawiony kation amoniowy:
| |
Kiedy amina rozpuszcza się w wodzie, część protonów wody jest zużywana, tworząc kation; Tym samym w roztworze pojawia się nadmiar jonów wodorotlenkowych, który ma właściwości zasadowe wystarczające do zabarwienia roztworów błękitu lakmusowego i szkarłatu fenoloftaleiny. Zasadowość amin seria limitowana waha się w bardzo małych granicach i jest zbliżony do zasadowości amoniaku.
Działanie grup metylowych nieznacznie zwiększa zasadowość metylu i dimetyloaminy. W przypadku trimetyloaminy grupy metylowe już utrudniają solwatację powstałego kationu i zmniejszają jego stabilizację, a tym samym zasadowość.
Sole amin należy uważać za związki złożone. Centralnym atomem w nich jest atom azotu, którego liczba koordynacyjna wynosi cztery. Atomy wodoru lub alkilu są związane z atomem azotu i znajdują się w wewnętrznej sferze; reszta kwasowa znajduje się w sferze zewnętrznej.
Acylowanie amin. Kiedy niektóre pochodne kwasów organicznych (halogenki kwasowe, bezwodniki itp.) Działają na aminy pierwszorzędowe i drugorzędowe, powstają amidy:
Aminy drugorzędowe z kwas azotowy dawać nitrozoaminy- żółtawe ciecze, słabo rozpuszczalne w wodzie:
Aminy trzeciorzędowe są odporne na działanie rozcieńczonego kwasu azotawego na zimno (tworzą sole kwasu azotawego), w trudniejszych warunkach następuje odszczepienie jednego z rodników i utworzenie nitrozoaminy.
Diaminy
Diaminy odgrywają ważną rolę w procesach biologicznych. Z reguły są łatwo rozpuszczalne w wodzie, mają charakterystyczny zapach, mają odczyn silnie zasadowy i oddziałują z CO 2 z powietrza. Diaminy tworzą trwałe sole z dwoma równoważnikami kwasu.
Etylenodiamina (1,2-etanodiamina) H2NCH2CH2NH2. Jest to najprostsza diamina; można otrzymać przez działanie amoniaku na bromek etylenu:
Tetrametylenodiamina (1,4-butanodiamina) lub putrescyna, NH 2 CH 2 CH 2 CH 2 CH 2 NH 2 i pentametylenodiamina (1,5-pentanodiamina) NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2 lub kadaweryna. Odkryto je w produktach rozkładu substancji białkowych; powstają w wyniku dekarboksylacji diaminokwasów i nazywane są ptomainy(z greckiego - zwłoki), wcześniej uważano je za „trucizny zwłok”. Obecnie odkryto, że toksyczność gnijących białek nie jest spowodowana ptomamenami, ale obecnością innych substancji.
Putrescyna i zwłoki powstają w wyniku życiowej aktywności wielu mikroorganizmów (na przykład czynników wywołujących tężec i cholerę) i grzybów; występują w serze, sporyszu, muchomorze i drożdżach piwnych.
Niektóre diaminy wykorzystywane są jako surowce do produkcji włókien poliamidowych i tworzyw sztucznych. W ten sposób z heksa-metylenodiaminy NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2 otrzymano bardzo cenne włókno syntetyczne - nylon(USA) lub anid(Rosja).
Aminoalkohole
Aminoalkohole- związki o mieszanych funkcjach, których cząsteczka zawiera grupy aminowe i hydroksylowe.
Aminoetanol(etanoloamina) HO-CH2CH2-NH2 lub kolamina.
Etanoloamina jest gęstą oleistą cieczą, pod każdym względem mieszalną z wodą i ma silne właściwości alkaliczne. Oprócz monoetanoloaminy otrzymuje się także dietanoloaminę i trietanoloaminę:
Cholina jest zawarta w lecytyny- substancje tłuszczopodobne, bardzo powszechne w organizmach zwierzęcych i roślinnych i można z nich izolować. Cholina jest krystaliczną, silnie higroskopijną masą, która łatwo rozpuszcza się w powietrzu. Ma silne właściwości alkaliczne i łatwo tworzy sole z kwasami.
Kiedy cholina jest acylowana bezwodnikiem octowym, tworzy się octan choliny, nazywane również acetylocholina:
 |
Acetylocholina pełni niezwykle ważną rolę biochemiczną, gdyż jest mediatorem (mediatorem) przekazującym wzbudzenie z receptorów nerwowych do mięśni.
Najczęstszą właściwością wszystkich związków organicznych jest ich zdolność do spalania. Sam amoniak pali się i ogólnie łatwo, ale podpalenie nie zawsze jest łatwe. Natomiast aminy łatwo się zapalają i najczęściej palą się płomieniem bezbarwnym lub lekko zabarwionym. W tym przypadku azot amin jest tradycyjnie utleniany do azotu cząsteczkowego, ponieważ tlenki azotu są niestabilne.
Aminy zapalają się łatwiej w powietrzu niż amoniak.
4NH3 + 3O2 = 2N2 + 6H2O;
4C 2 H 5 NH 2 + 15O 2 = 8CO 2 + 14H 2 O + 2N 2.
Podstawowe właściwości
Aminy pierwszorzędowe, drugorzędowe i trzeciorzędowe koniecznie zawierają wolną parę elektronów, jak przystało na azot trójwartościowy. Oznacza to, że aminy w roztworze wykazują właściwości zasadowe lub ich roztwory są zasadami. Dlatego aminy w roztworze wodnym zmieniają kolor na błękit lakmusowy, a fenoloftaleinę na szkarłat. Ryż. 12.
Ryż. 1 .
Ryż. 2 .

Dzięki tej parze elektronów może powstać wiązanie donor-akceptor z jonem wodorowym:
C 2 H 5 NH 2 + H + = C 2 H 5 NH 3 +.
Zatem, podobnie jak amoniak, aminy wykazują właściwości zasad:
NH3 + H2O NH4OH;
C 2 H 5 NH 2 + H 2 O C 2 H 5 NH 3 OH.
Amoniak tworzy sole z kwasami amon, a aminy to alkiloamon :
NH3 + HBr = NH4Br ( bromek amonu)
C 2 H 5 NH 2 + HBr = C 2 H 5 NH 3 Br ( bromek etyloamoniowy)
Tak jak amoniak tworzy sole amonowe z kwasami, tak aminy tworzą odpowiednie sole. Sole te mogą tworzyć się, podobnie jak w przypadku amoniaku, nie tylko podczas reakcji roztworów wodnych, ale także w fazie gazowej, jeśli aminy są wystarczająco lotne.
Oznacza to, że jeśli umieścisz naczynia ze skoncentrowanym kwas chlorowodorowy lub nawet z organiczną substancją lotną, taką jak kwas octowy, i naczyniem z lotną aminą, to wkrótce w przestrzeni między nimi pojawi się coś przypominającego dym bez ognia, czyli utworzą się kryształy odpowiadające soli alkiloaminowej. Ryż. 3.

Ryż. 3 .
Alkalia wypierają aminy , które podobnie jak amoniak słaby zasady z soli alkiloamoniowych:
NH4Cl + KOH = NH3 - + KCl + H2O;
CH3NH3Cl + KOH = CH3NH2 - + KCl + H2O.
Podstawowe właściwości amin są wyższe niż amoniaku. Dlaczego? Tworzenie wiązania donor-akceptor z jonem wodorowym zachodzi tym łatwiej, im większa jest gęstość elektronowa na atomie azotu. Rodniki węglowodorowe zawierają wiele elektronów i chętnie „dzielą się” nimi z atomem azotu (rys. 4).

Ryż. 4. Więź dawca-akceptor z jonem wodorowym
Jednak podstawowe właściwości amin trzeciorzędowych są mniejsze niż właściwości drugorzędowych (porównaj stałe zasadowości). Dlaczego? W aminie trzeciorzędowej atom azotu jest otoczony ze wszystkich stron rodnikami węglowodorowymi, co utrudnia jego zdolność do reagowania.
Aminy, podobnie jak amoniak, mogą reagować z haloalkanami, zastępując atom halogenu:
CH3Br + NH3 = CH3NH2 + HBr;
CH3NH2 + CH3Br = (CH3)2NH + HBr;
(CH 3) 2NH + CH 3Br = (CH 3) 3N + HBr.
Aminy trzeciorzędowe mogą również zastąpić halogen, dzięki czemu reakcja może przebiegać dalej. Tworzy się czwartorzędowa sól amoniowa - bromek tetrametyloamoniowy (CH 3) 4 NBr:
(CH 3) 3 N + CH 3 Br = (CH 3) 4 N+ + Br-.
Podsumowanie lekcji
Ta lekcja dotyczyła tematu „Związki aminowe. Klasyfikacja, izomeria, nazwy i właściwości fizyczne" Powtórzyłeś genezę związków organicznych zawierających tlen i przypomniałeś sobie niektóre właściwości ogólne amoniak i woda. Następnie przyjrzeliśmy się, jak otrzymać związki aminowe. Zbadaliśmy ich klasyfikację, izomerię, nazwy i nieodłączne właściwości fizyczne. .
Bibliografia
- Rudzitis G.E., Feldman F.G. Chemia: Chemia organiczna. Klasa 10: podręcznik dla instytucje edukacyjne: poziom podstawowy/G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
- Chemia. klasa 10. Poziom profilu: podręcznik dla edukacji ogólnej instytucje/V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, AA Drozdow, V.I. Terenina. - M.: Drop, 2008. - 463 s.
- Chemia. Klasa 11. Poziom profilu: akademicki. dla edukacji ogólnej instytucje/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin, AA Drozdow, V.I. Terenina. - M.: Drop, 2010. - 462 s.
- Chomczenko G.P., Chomczenko I.G. Zbiór problemów z chemii dla osób rozpoczynających naukę na uniwersytetach. - 4. wyd. - M .: RIA „Nowa fala”: Wydawca Umerenkov, 2012. - 278 s.
- strona internetowa ().
- Chemia.ssu.samara.ru ().
- Khimik.ru ().
- Promobud.ua ().
- nr 3, 4 (s. 14) Rudzitis G.E., Feldman F.G. Chemia: Chemia organiczna. klasa 10: podręcznik dla placówek kształcenia ogólnego: poziom podstawowy/G. E. Rudzitis, F.G. Feldmana. - edycja 14. - M.: Edukacja, 2012.
- Porównaj właściwości amin ograniczających i alkoholi.
- Napisz równania reakcji potwierdzające zasadowość amin.
Ze względu na charakter podstawników węglowodorowych aminy dzielą się na
Ogólne cechy strukturalne amin
Podobnie jak w cząsteczce amoniaku, w cząsteczce dowolnej aminy atom azotu posiada samotną parę elektronów skierowaną w stronę jednego z wierzchołków zniekształconego czworościanu:
Z tego powodu aminy, podobnie jak amoniak, mają znacząco wyrażone podstawowe właściwości.
Zatem aminy, podobnie jak amoniak, reagują odwracalnie z wodą, tworząc słabe zasady:
Wiązanie pomiędzy kationem wodoru i atomem azotu w cząsteczce aminy realizowane jest za pomocą mechanizmu donor-akceptor, dzięki wolnej parze elektronów atomu azotu. Nasycone aminy są silniejszymi zasadami w porównaniu do amoniaku, ponieważ w takich aminach podstawniki węglowodorowe mają dodatni efekt indukcyjny (+I). Pod tym względem wzrasta gęstość elektronów na atomie azotu, co ułatwia jego oddziaływanie z kationem H +.
Aminy aromatyczne, jeśli grupa aminowa jest bezpośrednio połączona z pierścieniem aromatycznym, wykazują słabsze właściwości zasadowe w porównaniu do amoniaku. Dzieje się tak dlatego, że samotna para elektronów atomu azotu zostaje przesunięta w stronę aromatycznego układu π pierścienia benzenowego, w wyniku czego zmniejsza się gęstość elektronów na atomie azotu. To z kolei prowadzi do pogorszenia podstawowych właściwości, w szczególności zdolności do interakcji z wodą. Na przykład anilina reaguje tylko z mocne kwasy i praktycznie nie reaguje z wodą.
Właściwości chemiczne amin nasyconych
Jak już wspomniano, aminy reagują z wodą odwracalnie:
Wodne roztwory amin mają odczyn zasadowy w wyniku dysocjacji powstałych zasad:
Nasycone aminy reagują z wodą lepiej niż amoniak ze względu na ich silniejsze właściwości zasadowe.
Podstawowe właściwości nasycone aminy wzrost w serii.
Wtórny ograniczające aminy są silniejszymi zasadami niż podstawowe zasady ograniczające, które z kolei są silniejszymi zasadami niż amoniak. Jeśli chodzi o podstawowe właściwości amin trzeciorzędowych, to jeśli mówimy o reakcjach w roztwory wodne, wówczas podstawowe właściwości amin trzeciorzędowych wyrażają się znacznie gorzej niż amin drugorzędowych, a nawet nieco gorzej niż amin pierwszorzędowych. Dzieje się tak za sprawą przeszkód sterycznych, które znacząco wpływają na szybkość protonowania aminy. Inaczej mówiąc, trzy podstawniki „blokują” atom azotu i zakłócają jego oddziaływanie z kationami H+.
Interakcja z kwasami
Zarówno wolne, nasycone aminy, jak i ich roztwory wodne reagują z kwasami. W tym przypadku powstają sole:
Ponieważ podstawowe właściwości amin nasyconych są wyraźniejsze niż amoniaku, aminy takie reagują nawet ze słabymi kwasami, takimi jak kwas węglowy:
Sole amin to ciała stałe, które są dobrze rozpuszczalne w wodzie i słabo rozpuszczalne w niepolarnych rozpuszczalnikach organicznych. Oddziaływanie soli amin z zasadami prowadzi do uwolnienia wolnych amin, podobnie jak wypieranie amoniaku, gdy zasady działają na sole amonowe:
2. Pierwszorzędowe nasycone aminy reagują z kwasem azotawym, tworząc odpowiednie alkohole, azot N2 i wodę. Na przykład:
Cechą charakterystyczną tej reakcji jest powstawanie gazowego azotu, dlatego jest ona jakościowa dla amin pierwszorzędowych i służy do odróżnienia ich od amin drugorzędowych i trzeciorzędowych. Należy zauważyć, że najczęściej tę reakcję prowadzi się przez zmieszanie aminy nie z roztworem samego kwasu azotawego, ale z roztworem soli kwasu azotawego (azotyn), a następnie dodanie do tej mieszaniny mocnego kwasu mineralnego. Kiedy azotyny oddziałują z mocnymi kwasami mineralnymi, powstaje kwas azotawy, który następnie reaguje z aminą:
Aminy drugorzędowe dają w podobnych warunkach ciecze oleiste, tak zwane N-nitrozoaminy, ale reakcja ta w rzeczywistości Zadania z egzaminu jednolitego stanu nie spotykane w chemii. Aminy trzeciorzędowe nie reagują z kwasem azotawym.
Całkowite spalanie jakichkolwiek amin prowadzi do powstania dwutlenku węgla, wody i azotu:
Oddziaływanie z haloalkanami
Warto zauważyć, że dokładnie tę samą sól otrzymuje się przez działanie chlorowodoru na bardziej podstawioną aminę. W naszym przypadku, gdy chlorowodór reaguje z dimetyloaminą:
Przygotowanie amin:
1) Alkilowanie amoniaku haloalkanami:
W przypadku niedoboru amoniaku zamiast aminy otrzymuje się jego sól:
2) Redukcja metalami (do wodoru w szeregu aktywności) w środowisku kwaśnym:
następnie traktowanie roztworu zasadą w celu uwolnienia wolnej aminy:
3) Reakcja amoniaku z alkoholami podczas przepuszczania ich mieszaniny przez ogrzany tlenek glinu. W zależności od proporcji alkohol/amina powstają aminy pierwszorzędowe, drugorzędowe lub trzeciorzędowe:
Właściwości chemiczne aniliny
Anilina - trywialna nazwa aminobenzenu, mająca wzór:
Jak widać na ilustracji, w cząsteczce aniliny grupa aminowa jest bezpośrednio połączona z pierścieniem aromatycznym. Takie aminy, jak już wspomniano, mają znacznie mniej wyraźne właściwości zasadowe niż amoniak. Zatem w szczególności anilina praktycznie nie reaguje z wodą i słabymi kwasami, takimi jak kwas węglowy.
Reakcja aniliny z kwasami
Anilina reaguje z dużą i średnią siłą kwasy nieorganiczne. W tym przypadku powstają sole fenyloamoniowe:
Reakcja aniliny z halogenami
Jak już powiedziano na samym początku tego rozdziału, w aminach aromatycznych grupa aminowa jest wciągana do pierścienia aromatycznego, co z kolei zmniejsza gęstość elektronową na atomie azotu, a w efekcie zwiększa ją w pierścieniu aromatycznym. Wzrost gęstości elektronowej w pierścieniu aromatycznym powoduje, że reakcje podstawienia elektrofilowego, w szczególności reakcje z halogenami, przebiegają znacznie łatwiej, szczególnie w pozycjach orto i para względem grupy aminowej. Zatem anilina łatwo reaguje z wodą bromową, tworząc biały osad 2,4,6-tribromoaniliny:
Reakcja ta ma charakter jakościowy dla aniliny i często pozwala na jej identyfikację spośród innych związków organicznych.
Reakcja aniliny z kwasem azotawym
Anilina reaguje z kwasem azotawym, ale ze względu na specyfikę i złożoność tej reakcji prawdziwy ujednolicony egzamin państwowy nie pojawia się w chemii.
Reakcje alkilowania aniliny
Stosując sekwencyjne alkilowanie aniliny przy atomie azotu chlorowcowanymi węglowodorami, można otrzymać aminy drugorzędowe i trzeciorzędowe:
Właściwości chemiczne aminokwasów
Aminokwasy to związki, których cząsteczki zawierają dwa rodzaje grup funkcyjnych - amino (-NH2) i karboksy- (-COOH).
Innymi słowy, aminokwasy można uznać za pochodne kwasy karboksylowe, w cząsteczkach, w których jeden lub więcej atomów wodoru zastąpiono grupami aminowymi.
Zatem ogólny wzór aminokwasów można zapisać jako (NH 2) x R(COOH) y, gdzie x i y są najczęściej równe jeden lub dwa.
Ponieważ cząsteczki aminokwasów zawierają zarówno grupę aminową, jak i grupę karboksylową, wykazują one Właściwości chemiczne podobne do amin i kwasów karboksylowych.
Kwasowe właściwości aminokwasów
Tworzenie soli z alkaliami i węglanami metali alkalicznych
Estryfikacja aminokwasów
Aminokwasy mogą reagować podczas estryfikacji z alkoholami:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Podstawowe właściwości aminokwasów
1. Tworzenie soli podczas interakcji z kwasami
NH 2 CH 2 COOH + HCl → + Cl —
2. Interakcja z kwasem azotawym
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Uwaga: interakcja z kwasem azotawym przebiega w taki sam sposób, jak z aminami pierwszorzędowymi
3. Alkilowanie
NH 2 CH 2 COOH + CH 3 I → + I —
4. Oddziaływanie aminokwasów między sobą
Aminokwasy mogą reagować ze sobą tworząc peptydy – związki zawierające w swoich cząsteczkach wiązanie peptydowe–C(O)-NH-
Jednocześnie należy zaznaczyć, że w przypadku reakcji pomiędzy dwoma różnymi aminokwasami, bez zachowania określonych warunków syntezy, następuje jednoczesne powstawanie różnych dipeptydów. Tak więc, na przykład, zamiast powyższej reakcji glicyny z alaniną, prowadzącej do glicylananiny, może nastąpić reakcja prowadząca do alanyloglicyny:
Ponadto cząsteczka glicyny niekoniecznie reaguje z cząsteczką alaniny. Reakcje pptyzacji zachodzą również pomiędzy cząsteczkami glicyny:
I alanina:
Ponadto, ponieważ cząsteczki powstałych peptydów, podobnie jak oryginalne cząsteczki aminokwasów, zawierają grupy aminowe i grupy karboksylowe, same peptydy mogą reagować z aminokwasami i innymi peptydami w wyniku tworzenia nowych wiązań peptydowych.
Poszczególne aminokwasy wykorzystywane są do produkcji syntetycznych polipeptydów, czyli tzw. włókien poliamidowych. Zatem w szczególności, stosując polikondensację kwasu 6-aminoheksanowego (ε-aminokapronowego), nylon syntetyzuje się w przemyśle:
Powstałą żywicę nylonową wykorzystuje się do produkcji włókien tekstylnych i tworzyw sztucznych.
Tworzenie soli wewnętrznych aminokwasów w roztworze wodnym
W roztworach wodnych aminokwasy występują głównie w postaci soli wewnętrznych – jonów dwubiegunowych (jonów obojnaczych).
Aminy- Ten związki organiczne, w którym atom wodoru (może więcej niż jeden) zastępuje się rodnikiem węglowodorowym. Wszystkie aminy dzielą się na:
- aminy pierwszorzędowe;
- aminy drugorzędowe;
- aminy trzeciorzędowe.
Istnieją również analogi soli amonowych - sole czwartorzędowe, takie jak [ R 4 N] + kl - .
W zależności od rodzaju rodnika aminy może być:
- aminy alifatyczne;
- aminy aromatyczne (mieszane).
Alifatyczne aminy nasycone.
Ogólna formuła CnH 2 N +3 N.
Struktura amin.
Atom azotu znajduje się w hybrydyzacji sp 3. Czwarty orbital niehybrydowy zawiera samotną parę elektronów, która określa podstawowe właściwości amin:

Podstawniki będące donorami elektronów zwiększają gęstość elektronów na atomie azotu i poprawiają podstawowe właściwości amin, dlatego aminy drugorzędowe są silniejszymi zasadami niż pierwszorzędowe, ponieważ 2 rodniki na atomie azotu tworzą większą gęstość elektronową niż 1.
W atomach trzeciorzędowych ważną rolę odgrywa czynnik przestrzenny: ponieważ 3 rodniki zasłaniają samotną parę azotu, do której inne odczynniki trudno „zbliżyć się”; zasadowość takich amin jest mniejsza niż pierwszorzędowa lub drugorzędna.
Izomeria amin.
Aminy charakteryzują się izomerią szkieletu węglowego i izomerią pozycji grupy aminowej:

Jak nazywają się aminy?
Nazwa zwykle wymienia rodniki węglowodorowe (w kolejności alfabetycznej) i dodaje końcówkę -amine:

Właściwości fizyczne amin.
Pierwsze 3 aminy to gazy, środkowe człony szeregu alifatycznego to ciecze, a wyższe to ciała stałe. Temperatura wrzenia amin jest wyższa niż odpowiednich węglowodorów, ponieważ w fazie ciekłej w cząsteczce powstają wiązania wodorowe.
Aminy są dobrze rozpuszczalne w wodzie; wraz ze wzrostem rodnika węglowodorowego rozpuszczalność maleje.
Wytwarzanie amin.
1. Alkilowanie amoniaku (metoda główna), które zachodzi podczas ogrzewania halogenku alkilu amoniakiem:
Jeśli halogenek alkilu jest w nadmiarze, amina pierwszorzędowa może ulec reakcji alkilowania, stając się aminą drugorzędową lub trzeciorzędową:
2. Redukcja związków nitrowych:
Stosuje się siarczek amonu ( Reakcja Zinina), cynk lub żelazo w środowisku kwaśnym, aluminium w środowisku zasadowym lub wodór w fazie gazowej.
3. Redukcja nitryli. Używać LiAlH4:
4. Enzymatyczna dekarboksylacja aminokwasów:

Właściwości chemiczne amin.
Wszystko aminy- mocne zasady i alifatyczne są silniejsze niż amoniak.

Roztwory wodne mają charakter zasadowy.
Aminy
Klasyfikacja i nazewnictwo
Aminy to organiczne pochodne amoniaku, w cząsteczce których jeden, dwa lub trzy atomy wodoru zastąpiono rodnikami. Na tej podstawie rozróżniają podstawowy (RNH2), wtórny (R2NH) i trzeciorzędowy (R3N) aminy
W zależności od charakteru rodnika, aminy mogą być nasycone lub aromatyczne, a także nasycone aromatyczne (odpowiednio metyloamina, anilina i metyloanilina). Rozgałęziony rodnik może być również związany z atomem azotu (np. pociera butyloamina) i polikondensowana, jak pokazano na przykładzie adamantylaminy (aminoadamantanu), która ma działanie biologiczne i jest stosowana w medycynie


Zgodnie z zasadami racjonalnej nomenklatury nazwa tej klasy substancji składa się z nazwy rodników przy atomie azotu, zwanych amina. W nazwach amin pierwszorzędowych nomenklatura międzynarodowa nadano nazwę atomowi azotu aminy Jestem-Ale, używany poprzez wskazanie jego lokalizacji przed nazwą łańcucha węglowodorowego. Jednak wiele amin zachowało swoje trywialne nazwy, np. anilina".
Oprócz grupy aminowej cząsteczki substancji organicznych mogą zawierać inne podstawniki, jak ma to miejsce na przykład w przypadku kwasu sulfanilowego. Aminowy atom azotu może być także zawarty w nasyconym pierścieniu. Wśród nasyconych amin heterocyklicznych występuje struktura trójczłonowa zbudowana pod wpływem napięcia etylenoimina, wykazujący silne działanie mutagenne. Pierścień etylenoiminowy jest częścią cząsteczek niektórych leków. Pierścienie tetrahydropirolowe i piperydynowe obecne w cząsteczkach wielu alkaloidów (w tym nikotyny i anabazyny, patrz sekcja 20.4) są zbudowane bez napięcia. Przy ich udziale, a także przy pomocy pierścienia morfolinowego budowane są cząsteczki wielu leków.




Heterocyklicznymi aminami aromatycznymi są na przykład pirol i pirydyna. Wreszcie grupę aminową można również powiązać z heterocyklem, co ilustruje przykład adeniny (6-aminopuryny), niezbędnego fragmentu kwasów nukleinowych.


Pochodne amoniaku obejmują materia organiczna, który można zbudować z soli amonowych lub ich wodorotlenków, zastępując wszystkie cztery atomy wodoru różnymi rodnikami węglowodorowymi, jak widać na przykładzie wodorotlenku tetrametyloamoniowego:

Innym przykładem czteropodstawionych pochodnych amoniowych – czwartorzędowych zasad amoniowych lub ich soli – są neuron, substancja toksyczna powstająca podczas rozkładu tkanek zwierzęcych.
Czwartorzędowy atom azotu może być częścią heterocykli, na przykład odpowiedniej soli z szeregu pirydynowego - soli N-alkilopirydyniowej. Takie sole czwartorzędowe obejmują pewne alkaloidy. Ponadto czwartorzędowy atom azotu występuje w wielu substancjach leczniczych i niektórych biocząsteczkach.
Powyższe przykłady ukazują różnorodność związków aminowych oraz ich ogromne znaczenie medyczne i biologiczne. Należy do tego dodać, że grupa aminowa wchodzi w skład takich klas biomolekuł jak aminokwasy i białka, kwasy nukleinowe i występuje w szeregu naturalnych pochodnych węglowodanów zwanych aminocukrami. Grupa aminowa jest najważniejszą grupą funkcyjną alkaloidów i licznych leków o różnym przeznaczeniu. Poniżej podano kilka przykładów takich substancji.
24.3.2. Aminy jako zasady organiczne

 Obecność wolnej pary elektronów azotu nadaje aminom właściwości zasad. Dlatego cecha charakterystyczna aminy to reakcja z kwasami, w wyniku której powstają odpowiednie sole amonowe, jak widać z reakcji dla pierwszorzędowej nasyconej aminy:
Obecność wolnej pary elektronów azotu nadaje aminom właściwości zasad. Dlatego cecha charakterystyczna aminy to reakcja z kwasami, w wyniku której powstają odpowiednie sole amonowe, jak widać z reakcji dla pierwszorzędowej nasyconej aminy:
Podobnie anilina powstaje z aniliny, sól pirydyniowa powstaje z pirydyny itp. Podobnie jak amoniak, aminy w roztworach wodnych tworzą środowisko zasadowe, zgodnie z równaniem:
Ilościowo zasadowość zasad zawierających azot w środowisku wodnym znajduje odzwierciedlenie w wartości stałej równowagi (DO B ) (częściej używają wartości rK B ) yl/С а (ВН +), charakteryzujący kwasowość sprzężonego kwasu danej zasady.

Najsilniejszymi zasadami będą związki zawierające atom azotu, w których wolna para azotu znajduje się na samotnym orbicie hybrydowym 5p 3 (aminy alifatyczne, amoniak, aminokwasy), a najsłabszymi będą te, w których ta para bierze udział w p ,n koniugacja (amidy, pirol, pirydyna).
Podstawniki dostarczające elektrony, do których należą grupy alkilowe, powinny zwiększać zasadowość amin, ponieważ zwiększają gęstość elektronów przy atomie azotu. Tak, metyloamina (pK B = 3.27) jest silniejszą zasadą niż amoniak (pK B = 4,75) i dimetyloamina (pK B = 3.02) jest mocniejszą zasadą niż metyloamina. Jednak po przejściu na trimetyloaminę, wbrew oczekiwaniom, zasadowość nieznacznie spada (pK B = 4,10). Dzieje się tak dlatego, że wraz ze wzrostem liczby podstawników na atomie azotu podejście protonu staje się coraz trudniejsze. Zatem tutaj nie mówimy o wpływie elektronicznym, ale przestrzennym wpływie podstawników. Ten efekt podstawników nazywa się steryczny czynnik.
Aminy aromatyczne są słabszymi zasadami niż nasycone ze względu na efekt odciągania elektronów przez pierścień aromatyczny. Dlatego zasadowość pirydyny jest również niska. Nagromadzenie podstawników fenylowych zauważalnie tłumi aktywność pary elektronów atomu azotu. Więc, rK, difenyloamina wynosi 13,12, a trifenyloamina w ogóle nie wykazuje właściwości zasady.
Niezwykle niska zasadowość pirolu wynika z faktu, że w jego cząsteczce para elektronów atomu azotu bierze udział w tworzeniu wiązania aromatycznego b-elektron. Jego wiązanie z protonem wymaga znacznych dodatkowych nakładów energetycznych. W wyniku powstania soli pirolu zanika wiązanie aromatyczne, a co za tym idzie stabilność cząsteczki. Wyjaśnia to fakt, że pirol szybko staje się żywiczny w środowisku kwaśnym.
Warto zauważyć, że silny efekt odciągania elektronów, wywierany przez pierścień pirolu na atomie azotu, prowadzi do osłabienia Połączenia N-H, dzięki czemu pirol może wykazywać właściwości słabego kwasu (pK A = 17,5).
![]()
Pod wpływem takich aktywny metal, podobnie jak potas, można wytworzyć jego sól potasową, pirol-potas.
Właściwości kwasowe wiązania N-H pierścienia pirolu wyjaśniają w szczególności zdolność porfiny i jej naturalnych pochodnych do tworzenia soli z kationami metali. Dwa pierścienie pirolowe cząsteczki porfiryny są skoordynowane z kationem ze względu na pary elektronów ich atomów azotu, a pozostałe dwa są skoordynowane poprzez zastąpienie atomów wodoru, podobnie jak sama cząsteczka pirolu podczas tworzenia pirolu-potasu. Sole te to chlorofil i hemoglobina.