Test na temat „Alkany” 2016
1. Która cząsteczka węglowodoru może mieć rozgałęziony łańcuch węglowy?
1) metan CH 4 2) etan C 2 N 6 3) propan C 3 N 8 4) butan C 4 N 10
2. Wzór strukturalny propanu C 3 N 8
1)CH 2 -CH 3 -CH 3 2)CH 3 -CH 2 -CH 3 3) CH 3 -CH-CH 4 4) CH 2 -CH 4 -CH 2
3. Główna część gazu ziemnego
1) metan 2) etan 3) propan 4) butan
4. Cząsteczka metanu ma wiązanie węgiel-węgiel
1) proste 2) podwójne 3) potrójne 4) brak takiego połączenia
5.Wzór homologu metanu 1) C 3 N 6 2) C 4 N 8 3) C 6 N 12 4) C 5 N 12
6.Wskaż właściwy wyrok
A. alkany charakteryzują się reakcjami addycji
B. alkany charakteryzują się reakcjami podstawienia
7. Izomery są różne
1) skład jakościowy 2) skład ilościowy 3) struktura 4) różnica homologiczna
8. Izomer heptanu jest
1) 2,3-dimetyloheptan 2) 2,3-dimetylopentan 3) 2,3-dimetylobutan 4) 2,3-dimetyloheksan
9. Wzór nitroetanu
1) CH 3 -CH 2 - O NIE 2 2) CH 3 -CH 2 - NIE 2
3) CH 3 -CH 2 - NN 2 4) CH 3 -CH 2 -CH 2 -CH 2 - NIE 2
10. Jakiej substancji brakuje w gazie ziemnym?
1) metan 2) etan 3) pentan 4) butan
11. Określ, który z wymienionych związków ma maksymalny stopień utlenienia atomu węgla?
1)CH 2 O 2) CH 3 O 3) SSl 4 4) C 2 N 4
12. Tworzy się każdy atom węgla w cząsteczce etanu
1) dwa wiązania σ i dwa wiązania π 2) trzy wiązania σ i jedno wiązanie π
3) cztery wiązania σ 4) jedno σ i trzy wiązania
13. Głównym składnikiem jest metan
1) ropa naftowa 2) gaz ziemny 3) gaz syntezowy 4) gaz koksowniczy
14.Wskaż właściwy wyrok
A. alkany charakteryzują się reakcjami podstawienia
B. etan odbarwia roztwór nadmanganianu potasu
1) tylko A jest prawdziwe 2) tylko B jest prawdziwe 3) oba sądy są prawidłowe 4) oba sądy są błędne
15. Jakie produkty można otrzymać w reakcji bromoetanu i bromopropanu z metalicznym sodem?
1) butan 2) heksan
3) mieszanina butanu i heksanu 4) mieszanina heksanu, butanu, pentanu
16.Wskaż nazwę rodnika – CH 3
1) butyl 2) metan 3) etyl 4) metyl
17. Podaj wzór rodnika etylowego
1) -C 2 H 6 2b) -C 3 H 7 3) –C 2 H 5 4d) –C 4 H 9
18.Długość Połączenia SS w cząsteczkach alkanów
1) 0,109 nm 2) 0,154 nm 3) 0,120 nm 4) 0,134 nm
19. W wyniku reakcji odwodornienia alkanów wydzielają się:
1) woda 2) wodór 3) węgiel 4) tlen
20. Jakie warunki są niezbędne, aby zaszła reakcja metanu z chlorem?
1) chłodzenie 2) ogrzewanie 3) zwiększanie ciśnienia 4) oświetlenie
21. Do stan skupienia alkany:
1) gazy, ciecze, 3B) ciecze, ciała stałe
2) gazy, ciecze, ciała stałe. 4) gazy, ciała stałe
22. Cząsteczka metanu ma postać:
1) piramida czworokątna 2) czworościan 3) ośmiościan 4) kwadrat
23. Izomer 2,3-dimetylobutanu to:
1) heksan 2) 2,3 – dimetylocykloheksan 3) cykloheksan 4) 2-metylobutan
24. NIE dotyczy reakcji podstawienia
1) odwodornienie 2) bromowanie 3) nitrowanie 4) chlorowanie
25. Na drugim etapie chlorowania metanu
1) czterochlorek węgla 2) trichlorometan 3) dichlorometan 4) 1,2 – dichloroetan
26. Etan oddziałuje z każdą z par substancji:
1) I 2 oraz n 2 2 ) HBr i H 2 O 3)kl 2 i O 2 4) N 2 i NaOH
27. W wyniku reakcji można otrzymać chlorek metanu
A) metan z chlorowodorem B) metan z kwas chlorowodorowy
B) metan z chlorem pod oświetleniem D) metan z roztworem chloru w wodzie
28. W wyniku termicznego rozkładu metanu w temperaturze 1500 °C,
1) C 2 N 2 oraz n 2 2) CO i H 2 3) C i N 2 4) CO 2 oraz n 2 O
29. W reakcji bromowania propanu warunkiem koniecznym jest:
1) oświetlenie światłem słonecznym 3) obecność katalizatora
2) reakcja zachodzi w normalnych warunkach 4) ogrzewanie
30.Jak utleniają się alkany w procesie spalania?
1) wodór w powietrzu 2) tlen w powietrzu 3) nadmanganian potasu 4) alkany nie palą się
31. Reakcja Wurtza to reakcja….
A) nitrowanie alkanów B) oddziaływanie pochodnej monohalogenowej zNie
B) bromowanie D) brak takiej reakcji
32. Reakcją prowadzącą do wydłużenia łańcucha węglowego jest
1) izomeryzacja alkanów 3) uwodornienie alkenów
2) dekarboksylacja sole sodowe kwasy karboksylowe 4) Reakcja Wurtza
33.Co nie powstaje podczas odwodornienia alkanów? 1) areny 2) alkiny 3) alkeny 4) adkadieny
34.Wymień „najbliższe homologi” propanu.
1) C 4 N 10 2) CH 4 3) C 6 N 12 4) C 2 N 6
35Alkany w laboratorium otrzymuje się:
A) podczas krakingu oleju B) uwodornienia węgla
B) Reakcja Wurtza. D) Reakcja Kucherowa
36. Podaj wzór alkanu, który w normalnych warunkach jest cieczą
1) C 4 N 10 2) C 16 N 34 3) C 7 N 16 4) CH 4
37. Wraz ze wzrostem liczby atomów węgla w cząsteczkach węglowodorów temperatura wrzenia tych węglowodorów
1) nie zmienia się 2) maleje
3) rośnie 4) najpierw rośnie, potem maleje
38.Podczas termicznego rozkładu metanu w temperaturze 1000 0 Tworzą się C
1) sadza i wodór 2) tlenek węgla i wodór
3) dwutlenek węgla i wodór 4) acetylen i wodór
39.Podczas stopienia octanu potasu i wodorotlenku potasu wydziela się produkt gazowy
1) wodór 2) dwutlenek węgla 3) metan 4) etan
40. Heksan nie reaguje z chlorowodorem, ponieważ
1) w jego cząsteczce nie ma wiązań π 2) heksan jest węglowodorem
3) cząsteczka heksanu jest niepolarna 4) pomiędzy atomami nie występują wiązania wodorowe
41. Produktem reakcji (przeważającym) 2-bromopropanu z sodem jest
1) 2,3-dimetylobutan 2) heksan 3) cykloheksan 4) propen
43. Ile różne substancje pokazane na obrazku: 1) 7 2) 4 3) 3 4) 2
44. Podczas reformowania metylocykloheksan w wyniku reakcji izomeryzacji i odwodornienia zamienia się w
1) etylocyklopentan 2) heksen 3) benzen 4) toluen
45. Alkany podlegają następującym reakcjom: a) podstawienie; b) przystąpienie; c) utlenianie; d) polimeryzacja; e) izomeryzacja
1)a,b,c 2)a,c,e 3)a,b,c,d,e 4)b,d,e
46. Etan wchodzi w interakcję
1) halogeny 2) wodór3) kwasy karboksylowe 4)halogenowodory
47. Konwersja butanu do butenu odnosi się do reakcji
1) polimeryzacja 2) odwodornienie 3) odwodnienie 4) izomeryzacja
48. Izomer strukturalny normalnego n-heksanu to
1) 3-etylopentan 2) 2-metylopropan 3) 2,2-dimetylopropan 4)2,2-dimetylobutan
49. Oddziaływanie metanu z chlorem jest reakcją
1) związki egzotermiczne 2) podstawienie endotermiczne
3) związki endotermiczne 4) podstawienie egzotermiczne
50. Czy są one prawdziwe? następujące wyroki o węglowodorach?
A. Wszystkie alkany są gazowe.
B. Metan odbarwia wodny roztwór nadmanganianu potasu.
1) tylko A jest prawdziwe 2) tylko B jest prawdziwe 3) oba sądy są prawidłowe 4) oba sądy są błędne
51. Butan można otrzymać w reakcji Wurtza, której schemat jest następujący
1) C 4 H 8 T°"cat → 2) C 4 H 9 C1 + KOH (alkohol) → 3) C 2 H 5 C1 + Na → 4) 2 C 2 H 4 T°"kot →
Test na temat „Alkany” 2016
52. Izobutan reaguje z
1) kwas solny 2) wodór 3) bromowodór 4) kwas azotowy
53. Oddziaływanie metanu z chlorem jest reakcją
1) substytucja, nieodwracalna 3) wymiana, nieodwracalna
2) substytucja, odwracalna 4) wymiana, odwracalna
54. Podczas ogrzewania mieszaniny 2-chloropropanu i chloroetanu z metalicznym sodem powstaje chlorek sodu i mieszanina
1) 2,3-dimetylobutan, butan, 2-metylobutan 2) heksan, 2-metylobutan, 1,2-dichloroetan
3) 2,3-dimetylobutan, butan, 2-metylobutan 4) 2,3-dimetylobutan, 2-metylobutan, buten
55 Które z poniższych stwierdzeń jest prawdziwe?
A. W wyniku dehydrocyklizacji n-heptanu powstaje benzen.
B. Metan nie ulega reakcjom addycji.
1) tylko A jest prawdziwe 2) tylko B jest prawdziwe 3) oba zdania są prawdziwe 4) oba zdania są fałszywe
56.Nazwa alkanu CH 3 -CH (CH 3 ) -CH 2 -C (CH 3 ) 2 -CH 3
57. W reakcji powstaje głównie 2-chlorobutan
1) buten-1 i chlor 2) butyn-1 i chlorowodór
3) butan i chlor 4) butyna-2 i chlorowodór
58. Metan reaguje
1) z chlorowodorem 2) z parą wodną na katalizatorze
3) izomeryzacja 4) wodą bromową
59. Zawiera sześć atomów węgla
1)2-metylobutan2)2,2-
dimetylobutan 3) 2-metylopropan 4) 3-metyloheksan
60. 2-metylopentan i 2-metyloheksan są względem siebie zależne
1) analogi 2) rodniki 3) homologi 4) izomery
61. Można wytworzyć etan
1) odwodnienie etanolu 2) elektroliza roztworu octanu potasu
3) uwodornienie etanolu 4) odwodnienie kwasu etanowego
62. Izomery są
1)3-metyloheksan i oktan 2)3-etylopentan i 3-metylopentan
3)2,2-dimetylopentan i 2,2-dimetyloheksan 4)2-metylopentan i heksan
64.Numer materia organiczna, które powstają podczas ogrzewania bromometanu i bromoetanu metalicznym sodem, jest równe 1) 1 2)2 3)3 4)4
Zadania wyższy poziom trudności
66. Wszystkie alkany mogą reagować z:
1) wodór 2) tlen 3) woda
4) chlor 5) chlorowodór 6) kwas azotowy Odpowiedź____________
67 Metan charakteryzuje się:
1) reakcja uwodornienia 2) czworościenny kształt cząsteczki
3) dostępność π -wiązania w cząsteczce 5) reakcje z halogenowodorami
4) sp 3 -hybrydyzacja orbitali atomu węgla w cząsteczce
6) spalanie w powietrzu Odpowiedź: ________
68. Następuje reakcja propanu z chlorem
1) poprzez mechanizm rodnikowy łańcuchowy2) z pośrednim utworzeniem cząstki CH 3 -CH + -CH 3
3) bez katalizatora 4) w roztwór wodny
5) z utworzeniem propenu 6) z pęknięciemσ -wiązania w cząsteczce propanuOdpowiedź____________
69 Reakcja propanu i bromu
3) prowadzi do preferencyjnego tworzenia 2-bromopropanu
4) prowadzi do preferencyjnego tworzenia 1-bromopropanu
5) zwykle występuje w ciemności
6) jest procesem katalitycznym Odpowiedź: _______
69.Chlorowanie metanu
1) konsekwentnie prowadzi do powstawania różnych metanów podstawionych chlorem
2) rozpoczyna się od procesu zerwania wiązania w cząsteczce metanu
3) odnosi się do reakcji radykalnych
4)przeprowadzane w ciemności
5) jest typowym procesem katalitycznym
6) odnosi się do procesów egzotermicznych Odpowiedź: _________
70.Chlorowanie metanu
1) przepływa mechanizm jonowy 2) odnosi się do reakcji radykalnych
3) rozpoczyna się od procesu zerwania wiązania w cząsteczce chloru. 5) odnosi się do procesów endotermicznych
4) przechodzi przez reakcję pośrednią: CH 4 →C + 4H 6) prowadzi do powstania chlorometanu
Odpowiedź: __________
71. Mechanizm reakcji chlorowania metanu obejmuje następujące etapy:
1)CH 4 → CH 3 + H 2)C1 2 → 2C1
3)C1 + CH 4 → CH 3 C1 + H 4)CH 4 → C + 4H
5) C1 2 + CH 4 → CH 3 C1 + HC1 6) H + Cl → HC1
Odpowiedź: __________
72. Reakcja 2-metylopropanu i bromu
1) odnosi się do reakcji podstawienia
2) przebiega poprzez radykalny mechanizm
3) prowadzi do preferencyjnego tworzenia 1-bromo-2-metylopropanu
4) prowadzi do preferencyjnego tworzenia 2-bromo-2-metylopropanu
5) zwykle występuje w ciemności
6) jest procesem katalitycznym Odpowiedź: __________
73. 2-metylobutan charakteryzuje się tym, że
1) używany do produkcji izoprenu
2) oddziałuje z chlorem w obecności A1C1 3
3) po chlorowaniu tworzy głównie 2-chloro-2-metylobutan
4) jest izomerem dimetylopropanu
5) podczas interakcji z wodorotlenkiem miedzi (II) tworzy 2-metylobutanal
6) nie tworzy mieszanin wybuchowych z powietrzem
Odpowiedź:__________
74. Ethan charakteryzuje się tym, że
1) można otrzymać przez elektrolizę propionianu potasu 2) oddziałuje z bromem pod wpływem światła
3) podczas odwodornienia ulega sukcesywnej przemianie w etylen i acetylen
4) ulega reakcji Wurtza 5) ulega utlenieniu w powietrzu w warunkach otoczenia.
6) jest homologiem oktanu Odpowiedź: ______________
75. Postępuje reakcja bromowania metanu
1) metodą radykalną 2) w jednym etapie
3) z utworzeniem różnych pochodnych bromowych 4) w ciemności i bez ogrzewania
5) z wydzielaniem ciepła
6) zgodnie z regułą V.V. Markownikowa Odpowiedź: _____.
76. Do produkcji metanu można zastosować następujące reakcje:
1) ogrzewanie octanu potasu z wodorotlenkiem potasu 2) rozkład etanu podczas ogrzewania
3) hydroliza węglika glinu 4) chlorometan sodem
5) redukcja metanu 6) wodór węglem Odpowiedź: _________
77. Interakcja przebiega według radykalnego mechanizmu
1) propen i woda bromowa 2) propen i bromowodór
3) propen i chlor (w roztworze wodnym) 4) propen i chlor (w temperaturze 500°C)
5) etan i tlen 6) metan i chlor
Odpowiedź: ________
78. Metan powstaje, gdy
1) hydroliza węglika wapnia CaC 2 2) hydroliza węglika glinu A1 4 Z 3
3) uwodornienie etylenu 4) kalcynacja octanu sodu wodorotlenkiem sodu
5) rozkład benzenu 6) odwodnienie alkohol etylowy Odpowiedź: ____________ .
79. Butan charakteryzuje się:
1) izomeryzacja 4) interakcja z sodem
2) hydratacja 5) uwodornienie
3) oddziaływanie z halogenami 6) utlenianie katalityczne
Odpowiedź: ____________
80. Wybierz cechy charakterystyczne etanu:
A) substancja gazowa B) pali się bladoniebieskim płomieniem
C) ma ostry zapach. D) 1,5 razy cięższy od wodoru
E) rozpuszczalny w wodzie E) ulega reakcjom addycji
Odpowiedź: _____________________
– są to nasycone (lub nasycone) węglowodory niecykliczne, w których wszystkie wiązaniapojedynczy.
Ogólna formuła:
C n H 2 n +2
Wszystkie atomy węgla w alkanach mają sp 3 - hybrydyzacja.
Pierwszych czterech członków homologicznej serii alkanów to gazy, C5 – C17 to ciecze, a począwszy od C18 to ciała stałe. Wszystkie alkany są lżejsze od wody, nierozpuszczalne w wodzie i nie mieszają się z nią.
Właściwości chemiczne.
1) Wiązanie węgla z wodorem w alkanach jest niskopolarne.
2) Dlatego jego pęknięcie w reakcjach jest możliwe tylko poprzez mechanizm homolityczny:
Jest to możliwe tylko w trudnych warunkach.
3) Nasycone (nasycone) węglowodory nie mają zdolności do wchodzenia w reakcje addycji. Charakteryzują się reakcje substytucji atomy wodoru i rozdzielać. Reakcje te zachodzą pod wpływem ciepła, światła lub przy użyciu katalizatorów.
Alkany nie reaguj Z stężone kwasy, zasady, nadmanganian potasu, woda bromowa.
I. Reakcje podstawienia.
1) Halogenowanie: podstawienie rodnikowe.
Chlor i brom pod wpływem światła lub ciepła.
A) chlorowanie: proces jest szybki, dlatego przebiega masowo, powstaje mieszanina produktów podstawienia:
CH 3 - CH 2 - CH 3 + Cl 2 – (jasny) CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl
B) bromowanie:
CH 3 CH 3
CH 3 -CH 2 -CH -CH 3 +Br 2 – (światło) CH3-CH2-C-CH3 + HBr
Bromowanie jest procesem wolniejszym i bardziej selektywnym.
Selektywność bromowania:
trzeciorzędowy > drugorzędowy > pierwszorzędowy atom węgla.
Mechanizm radykalnej wymiany:Łańcuchowy wolny rodnik.
Wolny rodnik R ∙ jest BARDZO AKTYWNĄ cząstką, która niesie jeden niesparowany elektron i ma tendencję do tworzenia wiązania z jakimś innym atomem.
1) Inicjacja obwodu (start): Cząsteczka chloru zostaje rozbita na dwa rodniki pod wpływem kwantu światła. kl · :
2) Rozwój łańcucha: Rodnik chlorowy oddziela atom wodoru od alkanu. W tym przypadku powstaje cząstka pośrednia - rodnik alkilowy, który z kolei oddziela atom chloru od cząsteczki Cl2. W tym przypadku ponownie otrzymuje się rodnik chloru i proces się powtarza - łańcuch jest kontynuowany:
3) Otwarty obwód: połączenie dwóch rodników w cząsteczkę.
2) Nitrowanie
(reakcja M.I. Konovalov):
Mechanizm reakcji jest również radykalny.
Ogrzewanie do 140°C rozcieńczonym (10%) kwasem azotowym:
CH 3 CH 3
CH 3-CH 2-CH-CH 3 + HNO 3 CH 3-CH 2-C-CH 3 + H 2O
Selektywność nitrowania: NIE 2
trzeciorzędowy > drugorzędowy > pierwszorzędowy atom węgla.
3) Kraking - przemiana alkanów pod wpływem ciepła.
a) W przypadku alkanów długołańcuchowych w wyniku krakingu powstają alkan i alken. Co więcej, przy długości większej niż 5 atomów C powstaje mieszanina węglowodorów o różnej długości.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3-CH 3 + CH 2 = CH 2
B) Kraking metanu dzieje się na dwa możliwe sposoby:
1. długotrwałe ogrzewanie metanu: CH 4 - 1500° C C+2H2
2. błyskawiczne nagrzanie do 1500 stopni i natychmiastowe schłodzenie:
2CH 4 - 1500° C H–C ≡ C –H + 3H 2
Acetylen
4) Izomeryzacja - przegrupowanie szkieletu węglowego z utworzeniem innych izomerów: po ogrzaniu z katalizatorem AlCl3.
CH 3 -CH 2 -CH 2 -CH 3 -(100 o, AlCl 3) CH3-CH-CH3
5) Utlenianie:
1) Spalanie:
CH 4 + 2O 2 ⇆ CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆ 5CO 2 + 6H 2 O
2) Utlenianie katalityczne:
Metan: CH 4 + O 2 - (katalizator) mieszanina CH3OH, HSON i HCOOH
Butan: C 4 H 10 + O 2 - (katalizator) 2CH3COOH ( kwas octowy)
6) Odwodornienie i cyklizacja.
1) Krótkie alkany ulegają odwodornieniu do alkenów lub dienów:
C 2 H 6 – (kat., t) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 – (kat. Cr 2 O 3, t) butadien + H2
2) W obecności katalizatora heksan i heptan przekształca się odpowiednio w benzen i toluen.
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 – (kat.Pt, t) + 4H 2
Paragon:
1) Reakcja Wurtza: wpływ metalicznego sodu na jednohalogenowe pochodne węglowodorów:
2CH 3 –CH 2 Br + 2Na CH 3 –CH 2 –CH 2 –CH 3 +2NaBr
Szkielet węglowy podwaja się. Reakcja nadaje się do wytwarzania symetrycznych alkanów.
2) Dekarboksylacja soli kwasów karboksylowych(Reakcja Dumasa): fuzja soli kwasów karboksylowych z zasadami.
W ten sposób powstaje metan poprzez ogrzewanie octanu sodu z wodorotlenkiem sodu.
CH 3 COONa + NaOH( połączenie) CH 4 +Nie 2 WSPÓŁ 3
3) Elektroliza roztworów soli kwasów karboksylowych(Reakcja Kolbego):
2CH 3 COONa + 2H 2 O – (prąd elektryczny) 2CO2 + H2 + C2H6 + 2NaOH
katoda:
woda wypływa: 2H 2 O + 2e N 2 + 2OH -
anoda:
wyładowanie anionów kwasowych: 2CH 3 TAK - -2e 2CO 2 + CH 3 -CH 3
4) Hydroliza węglika glinu– produkcja metanu.
Glin 4 C 3 +12H 2 O 3CH 4 + 4Al(OH) 3
5) Uwodornienie węglowodorów nienasyconych lub cyklicznych w obecności katalizatorów (platyna, pallad, nikiel).
R–CH=CH–R’ + H 2 – kat R–CH 2 –CH 2 -R'
(cyklopropan) + H 2 – Pd CH 3 –CH 2 –CH 3 (propan)
6) Alkany można otrzymać z ropy naftowej w drodze krakingu lub destylacji frakcyjnej.
Przygotowujemy się do Unified State Exam Alkany.
ALKAN (węglowodory nasycone, parafiny)
Alkany to alifatyczne (acykliczne) węglowodory nasycone, w których atomy węgla są połączone prostymi (pojedynczymi) wiązaniami w prostych lub rozgałęzionych łańcuchach, przy czym według ogólnego wzoru C n H 2n+2, gdzie n ≥1.
Alkany – nazwa węglowodorów nasyconych wg nomenklatura międzynarodowa.
Parafiny – historycznie ustalona nazwa odzwierciedlająca właściwości tych związków (od łac. parrum affinis – o małym powinowactwie, małej aktywności).
Ekstremalne lub nasycone nazwy tych węglowodorów wynikają z całkowitego nasycenia łańcucha węglowego atomami wodoru.
Szereg homologiczny alkanów
Alkany, mające ogólny wzór CnH2n+2 , to szereg pokrewnych związków o tej samej budowie, w których każdy kolejny człon różni się od poprzedniego stałą grupą atomów (-CH 2 -). Ta sekwencja połączeń nazywa sięszereg homologiczny(z greckiego homologu - podobne), poszczególni członkowie tej serii - homologi , a grupa atomów, którymi różnią się sąsiednie homologi, toróżnica homologiczna.
- CH 4 – pierwszy członek szeregu homologicznego – metan (zawiera 1 atom C);
- CH 3 -CH 3 lub CH 3 -CH 3 – etan (2 atomy C);
- CH 3 -CH 2 -CH 3 lub CH 3 -CH 2 -CH 3 – propan (3 atomy C);
- CH 3 -CH 2 -CH 2 -CH 3 lub CH 3 -CH 2 -CH 2 -CH 3 – butan (4 atomy C).
Przyrostek -an jest charakterystyczny dla nazw wszystkich alkanów. Począwszy od piątego homologu, nazwa alkanu jest utworzona z cyfry greckiej, wskazującej liczbę atomów węgla w cząsteczce, oraz przyrostka-an: pentan C5H12, heksan C6H14, heptan C7H16, oktan C8H18, nonan C9H20, dekan C10H22 itp.
Homologi różnią się masą cząsteczkową, a co za tym idzie, właściwościami fizycznymi. Wraz ze wzrostem liczby atomów węgla w cząsteczce alkanu w szeregu homologicznym obserwuje się naturalną zmianę właściwości fizycznych homologów: wzrasta temperatura wrzenia i topnienia oraz wzrasta gęstość. Wszystkie alkany są lżejsze od wody i są w niej nierozpuszczalne, ale są rozpuszczalne w rozpuszczalnikach niepolarnych (na przykład benzenie) i same w sobie są dobrymi rozpuszczalnikami. Alkany z CH 4 do C 4 H 10 – gazy, od C 5 H 12 do C 17 H 36 – ciecze, następnie – ciała stałe. Mając to samo wysokiej jakości skład i tego samego rodzaju wiązań chemicznych, homologi mają podobne właściwości chemiczne. Dlatego wiedząc Właściwości chemiczne jednym z członków szeregu homologicznego, można przewidzieć zachowanie chemiczne innych członków tego szeregu.
Struktura alkanów
Alkany mają dwa rodzaje wiązań chemicznych:
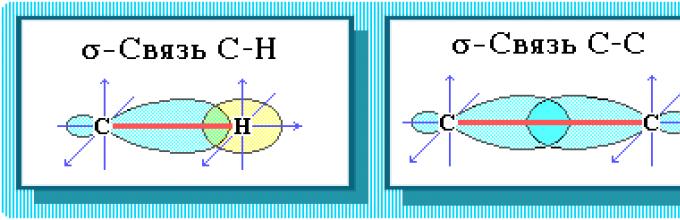
C–C i C–H.
Wiązanie C – C jest kowalencyjne niepolarne. Wiązanie C–H jest kowalencyjne, słabo polarne, ponieważ węgiel i wodór mają zbliżoną elektroujemność).
Wszystkie atomy węgla w alkanach są w stanie sp 3-hybrydyzacja.
Cztery wiązania węgla σ są skierowane w przestrzeni pod kątem 109 O 28", co odpowiada najmniejszemu odpychaniu elektronów. Dlatego cząsteczka najprostszego przedstawiciela alkanów - metanu CH 4 – ma kształt czworościanu, w środku którego znajduje się atom węgla, a na wierzchołkach atomy wodoru.
Izomeria alkanów
Izomeria to zjawisko istnienia związków o tym samym składzie (takim samym formuła molekularna), ale inną strukturę. Takie połączenia nazywane są izomery.
Do tego prowadzą różnice w kolejności łączenia atomów w cząsteczkach (tj. strukturze chemicznej).izomeria strukturalna (izomeria szkieletu węglowego). W szeregu alkanów izomeria strukturalna objawia się, gdy łańcuch zawiera 4 lub więcej atomów węgla, tj. zaczynając od butanu C 4 N 10 . Na przykład alkan o składzie C 4H 10 może występować w formie dwa izomery strukturalne:
CH 3 –CH 2 –CH 2 –CH 3 (butan) i CH 3 –CH(CH 3 ) –CH 3 (2-metylopropan).
Izomery strukturalne różnią się właściwościami fizycznymi. Alkany o rozgałęzionej strukturze, ze względu na mniej gęste upakowanie cząsteczek i odpowiednio mniej oddziaływań międzycząsteczkowych, wrzą w niższej temperaturze niż ich nierozgałęzione izomery.
Właściwości chemiczne alkanów
Trywialna (historyczna) nazwa alkanów – „parafiny” – oznacza „niemający powinowactwa”. Alkany w normalne warunki chemicznie nieaktywny. Niski reaktywność alkany wynikają z bardzo niskiej polarności wiązań C-C i C-H w ich cząsteczkach, ze względu na prawie identyczną elektroujemność atomów węgla i wodoru. Nasycone węglowodory w normalnych warunkach nie wchodzą w interakcje ze stężonymi kwasami, zasadami, a nawet z tak aktywnym odczynnikiem jak nadmanganian potasu. Alkany na ogół nie są zdolne do reakcji addycji ze względu na skrajne nasycenie wszystkich wiązań atomów węgla.
I. Reakcje podstawienia
W pewnych warunkach (pod wpływem ogrzewania, światła lub przy użyciu katalizatorów) wiązania C-H ulegają rozerwaniu, a atomy wodoru zostają zastąpione innymi atomami lub grupami atomów. W reakcjach tych dochodzi do homolitycznego rozszczepienia wiązań kowalencyjnych, czyli zachodzą one na zasadzie mechanizmu wolnorodnikowego (łańcuchowego).
1) Halogenowanie
Halogenowanie alkanów to reakcja zastąpienia jednego lub więcej atomów wodoru w cząsteczce alkanu halogenem. Produkty reakcji nazywane są haloalkanami lub halogenowymi pochodnymi alkanów R-Cl lub C n H 2n+1 – Cl.
Reakcja alkanów z chlorem i bromem zachodzi pod wpływem światła lub po podgrzaniu.
Chlorowanie metanu:
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1. etap)
(hν - kwant światła; CH 3 Cl - chlorometan)
Jeśli jest wystarczająca ilość chloru, reakcja przebiega dalej:
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (etap 2)
(CH 2Cl 2 – dichlorometan)
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3. etap)
(CHCl3 – trichlorometan lub chloroform)
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4. etap)
(CCl 4 - tetrachlorek węgla)
Reakcja halogenowania alkanów zachodzi poprzez rodnikowy mechanizm łańcuchowy. W rozwoju teorii reakcji łańcuchowych prace akademika, laureata nagroda Nobla N. N. Semenova.
Szybkość reakcji zastąpienia wodoru atomem halogenu jest większa w przypadku haloalkanów niż w przypadku odpowiedniego alkanu, wynika to z: wzajemny wpływ atomy w cząsteczce. Wraz ze wzrostem rodnika węglowodorowego najbardziej ruchliwe atomy wodoru pozostają przy atomie węgla najbliżej podstawnika:
CH 3 –CH 2 –Cl + Cl 2 hν → CH 3 – CHCl 2 + HCl
(CH 3 – CHCl 2 – 1,1-dichloroetan)
Chlorując lub bromując alkan z drugorzędowymi lub trzeciorzędowymi atomami węgla, najłatwiej jest zastąpić wodór przy atomie trzeciorzędowym, trudniej przy atomie wtórnym, a jeszcze trudniej przy pierwotnym. Tłumaczy się to większą stabilnością trzeciorzędowych i wtórnych rodników węglowodorowych w porównaniu z pierwotnymi, w wyniku delokalizacji niesparowanego elektronu. Dlatego na przykład podczas bromowania propanu głównym produktem reakcji jest 2-bromopropan:
Z fluorem reakcja zachodzi wybuchowo.
2) Nitrowanie (reakcja Konovalova)
Pomimo tego, że w normalnych warunkach alkany nie reagują ze stężonym kwasem azotowym, to po podgrzaniu do temperatury 140°C rozcieńczonym (10%) kwasem azotowym pod ciśnieniem następuje reakcja nitrowania - zastąpienie atomu wodoru grupą nitrową NO2. Produkty reakcji – nitroalkany R-NO 2 lub C n H 2n+1 – NO 2.
Schemat reakcji:
CH 4 + HNO 3 t˚С,Р → CH 3 NO 2 + H 2 O (nitrowanie metanu powoduje powstanie nitrometanu).
W reakcjach atomy wodoru najłatwiej zastąpić trzeciorzędowymi atomami węgla, następnie drugorzędowymi i wreszcie pierwszorzędowymi.
3) Sulfonowanie
Kwas siarkowy w zwykłych temperaturach nie ma wpływu na alkany, ale w niskich temperaturach ulega stężeniuKwas Siarkowypotrafi działać do granic możliwościwęglowodoryprowadząc do zastąpienia atomu wodoru grupą sulfo SO 3H
II. Reakcje utleniania alkanów
W zwykłych temperaturach alkany nie reagują nawet z silnymi utleniaczami (H 2 Cr 2 O 7, KMnO 4 itp.).
1) Alkany wprowadzone do otwartego płomienia palą się. W tym przypadku w nadmiarze tlenu ulegają całkowitemu utlenieniu do CO 2 i woda. Spalaniu węglowodorów towarzyszy wydzielanie dużej ilości ciepła (reakcja egzotermiczna).
CH 4 + 2O 2 →CO 2 + 2H 2 O+ Q
C 5H 12 + 8O 2 →5CO 2 + 6H 2O + Q
Równanie reakcji spalania alkanów w ogólnej postaci:
Z tego równania wynika, że wraz ze wzrostem liczby atomów węgla ( N ) w alkanie wzrasta ilość tlenu potrzebna do jego całkowitego utlenienia. Podczas spalania wyższych alkanów ( N >>1) tlen zawarty w powietrzu może nie wystarczyć do ich całkowitego utlenienia do CO 2
. Powstają wówczas produkty częściowego utleniania: tlenek węgla CO,
sadza (drobny węgiel, stopień zerowy utlenianie). Dlatego wyższe alkany palą się w powietrzu dymiącym płomieniem, a wydzielający się po drodze toksyczny tlenek węgla (bezwonny i bezbarwny) stanowi zagrożenie dla człowieka.
Spalanie metanu przy braku tlenu następuje według równań:
2CH 4 + 3O 2 →2CO +4H 2O
CH 4 + O 2 →C +2H 2 O
2) Utlenianie katalityczne tlenem atmosferycznym.
Częściowemu utlenianiu alkanów w stosunkowo niskiej temperaturze i przy użyciu katalizatorów towarzyszy rozerwanie tylko części wiązań C-C i C-H i pozwala uzyskać cenne produkty: kwasy karboksylowe, ketony, aldehydy i alkohole.
2CH 4 + O 2 →2CH 3OH (CH 3OH - metanol)
CH 4 + O 2 →HCOH +H 2 O (HCOH - metanal)
2CH 4 + 3O 2 →2HCOOH +2H 2 O (HCOOH – kwas metanowy)
Gdy butan zostanie niecałkowicie utleniony, otrzymuje się kwas octowy:
2C 4 H 10 + 5O 2 → 4СH 3 COOH + 2H 2 O
III.Przemiany termiczne alkanów
1) Kraking alkanów– proces termicznego rozkładu węglowodorów, który polega na reakcjach rozszczepienia łańcucha węglowego dużych cząsteczek z utworzeniem cząsteczek alkanów i alkenów o krótszym łańcuchu.
Kraking alkanów jest podstawą rafinacji ropy naftowej w celu uzyskania produktów o mniejszej masie cząsteczkowej, które wykorzystywane są jako paliwa silnikowe, oleje smarowe itp., a także surowce dla przemysłu chemicznego i petrochemicznego.
Istnieją dwa sposoby przeprowadzenia tego procesu:pękanie termiczne(po podgrzaniu bez dostępu powietrza) ikraking katalityczny(bardziej umiarkowane ogrzewanie w obecności katalizatora).
C 10 H 22 t°С → C 5 H 12 + C 5 H 10
2) Odwodornienie alkanów
Podczas ogrzewania alkanów w obecności katalizatorów (Pt, Pd, Ni, Cr 2O3, Al2O3 ) ich katalizator odwodornienie – abstrakcja atomów wodoru w wyniku zerwania wiązań C-H.
3) Izomeryzacja alkanów.
Alkany o normalnej budowie pod wpływem katalizatorów i po ogrzaniu potrafią przekształcić się w rozgałęzione alkany bez zmiany składu cząsteczek, tj. wchodzić w reakcje izomeryzacji. W reakcjach tych biorą udział alkany, których cząsteczki zawierają co najmniej 4 atomy węgla.
Na przykład izomeryzacja n-pentanu do izopentanu (2-metylobutanu) zachodzi w temperaturze 100°C w obecności katalizatora chlorku glinu:
4) Reakcja dehydrocyklizacji lub aromatyzacji
Alkany o łańcuchu głównym składającym się z 6 lub więcej atomów węgla wchodzą w reakcję dehydrocyklizacji, ale zawsze tworzą pierścień 6-członowy (cykloheksan i jego pochodne). W warunkach reakcji cykl ten ulega dalszemu odwodornieniu i przekształca się w energetycznie bardziej stabilny pierścień benzenowy węglowodoru aromatycznego (arenu). Na przykład:
Reakcje te leżą u podstaw procesu reformingu – przetwarzania produktów naftowych w celu wytworzenia arenów (aromatyzacja węglowodorów nasyconych) i wodoru. Przekształcenie n-alkanów w areny prowadzi do poprawy odporności benzyny na spalanie stukowe.
5) Rozkład termiczny do substancji prostych
CH 4 t → C + 2H 2
6) Piroliza metanu.
Przy 1500°C następujeodwodornienie międzycząsteczkowe metan
z tworzeniem się acetylenu:
2CH 4 1500°С → C 2 H 2 + 3H 2
Reakcja ta służy do produkcja przemysłowa acetylen.
IV Konwersja metanu
Ważna jest reakcja oddziaływania metanu z parą wodną, w wyniku której powstaje mieszanina tlenku węgla (II) z wodorem – „gaz syntezowy”:
Reakcja ta wykorzystywana jest do produkcji wodoru. Gaz syntezowy służy jako surowiec do produkcji różnych węglowodorów.
Wytwarzanie alkanów
Alkany są izolowane ze źródeł naturalnych (gazów naturalnych i pochodnych, ropy naftowej). Gaz ziemny składa się aż w 95% z metanu. Gaz bagienny powstający w wyniku bakteryjnego przetwarzania (gnicia) węglowodanów ma ten sam skład. Powiązane gazy ropopochodne składają się głównie z etanu, propanu, butanu i częściowo pentanu. Są one oddzielane od oleju w specjalnych zakładach uzdatniania oleju. W przypadku braku stacji kondensatu gazowego towarzyszące gazy ropopochodne spalane są w pochodniach, co jest wyjątkowo nierozsądną i marnotrawną praktyką przy wydobyciu ropy. Równolegle z gazami olej jest oczyszczany z wody, brudu i piasku, po czym trafia do rury w celu transportu. Z oleju podczas jego destylacji otrzymuje się go
ponad 100 pojedynczych związków, proste i rozgałęzione alkany, cykloalkany i węglowodory aromatyczne.
Stosuje się także metody syntetyczne.
- Kraking alkanów (metoda przemysłowa)
- Uwodornienie węglowodorów nienasyconych:
C n H 2n + H 2 t˚С, Ni lub Pd → C n H 2n+2
Synteza bardziej złożonych alkanów poprzez działanie metalicznego sodu na monohaloalkany o mniejszej liczbie atomów węgla:
2CH3–CH2Br+2Na → CH3–CH2–CH2–CH3+2NaBr
Reakcja Wurtza ma sens tylko w przypadku wytwarzania z jednego halogenku alkilu, ponieważ w przeciwnym razie mieszanina alkanów jest trudna do rozdzielenia w warunkach laboratoryjnych.
Na przykład:
Oprócz propanu C 3 H 8 powstaje butan C 4 H 10 (z 2 cząsteczek C 2 H 5 Br) i etan C 2 H 6 (z 2 cząsteczek CH 3 Br).
- Dekarboksylacja termiczna. Fuzja soli kwasów karboksylowych z zasadami (reakcja Dumasa):
lub ogólnie
R-COONa + NaOH R-H + Na2CO3
- Elektroliza soli kwasów karboksylowych (reakcja Kolbego):
- Izomeryzacja. Pod wpływem katalizatorów po podgrzaniu alkany o normalnej budowie ulegają izomeryzacji - przegrupowaniu szkieletu węglowego z utworzeniem alkanów o rozgałęzionej strukturze
- Węglowodory ciekłe stanowią znaczną część paliw silnikowych i rakietowych i są stosowane jako rozpuszczalniki.
- Olejek wazelinowy (mieszanina ciekłych węglowodorów zawierających do 15 atomów węgla) to przezroczysta, bezwonna i pozbawiona smaku ciecz, stosowana w medycynie, perfumerii i kosmetyce.
- Wazelina (mieszanina ciekłych i stałych węglowodorów nasyconych o liczbie atomów węgla do 25) służy do sporządzania maści stosowanych w medycynie.
- Parafina (mieszanina stałych alkanów C 19 -C 35 ) - biała stała masa bez zapachu i smaku (t.t. 50-70°C) - stosowana do wyrobu świec, impregnacji zapałek i papieru do pakowania, do zabiegów termicznych w medycynie. Służy jako surowiec do produkcji kwasów organicznych i alkoholi, detergenty i środki powierzchniowo czynne.
- Zwykłe węglowodory nasycone o średniej masie cząsteczkowej stosowane są jako substrat odżywczy w mikrobiologicznej syntezie białka z oleju.
- Duże znaczenie mają halogenowe pochodne alkanów, które wykorzystuje się jako rozpuszczalniki, chłodziwa i surowce do dalszych syntez.
- We współczesnym przemyśle petrochemicznym węglowodory nasycone są podstawą do otrzymywania różnorodnych związki organiczne, ważny surowiec w procesach otrzymywania półproduktów do produkcji tworzyw sztucznych, gumy, włókien syntetycznych, detergentów i wielu innych substancji.
Źródła
- G.I. Deryabina, G.V. Kantaria. Chemia organiczna. Zasób elektroniczny.
- I.I.Novoshinsky, N.S.Novoshinskaya. Chemia organiczna: podręcznik dla uczniów szkół średnich i kandydatów. – M.: OOO „Wydawnictwo ONICS XXI wiek”, 2004
- Kuzmenko N.E., Eremin V.V., Popkov V.A. Początek chemii. Nowoczesny kurs dla osób rozpoczynających naukę na uniwersytetach. M.: Egzamin, 2002.
Alkany Struktura alkanów
Alkany (parafiny)– alifatyczne (niecykliczne) węglowodory nasycone, w których atomy węgla są połączone ze sobą wiązaniami prostymi (pojedynczymi) w łańcuchy proste lub rozgałęzione.
Alkany mają wzór ogólny C N H 2 N +2 , Gdzie N– liczba atomów węgla.
Struktura chemiczna. Valkany mają dwa rodzaje wiązań chemicznych:
SS I CII.
Wiązanie C – C jest kowalencyjne niepolarne. Wiązanie C–H jest kowalencyjne, słabo polarne, ponieważ węgiel i wodór mają bliską elektroujemność (2,5 dla węgla i 2,1 dla wodoru). Edukacja wiązania kowalencyjne w alkanach ze względu na wspólne pary elektronowe atomów węgla i wodoru można wykazać za pomocą wzorów elektronicznych:
Elektroniczne i wzory strukturalne odbijać struktura chemiczna, ale nie dawaj o tym pojęcia struktura przestrzenna cząsteczek, co znacząco wpływa na właściwości substancji.
Struktura przestrzenna , tj. wzajemne porozumienie atomów cząsteczki w przestrzeni zależy od orientacji orbitali atomowych (AO) tych atomów. W węglowodorach główna rola Przestrzenna orientacja orbitali atomowych węgla odgrywa rolę, ponieważ sferyczny 1s-AO atomu wodoru nie ma określonej orientacji.
Z kolei układ przestrzenny węgla AO zależy od rodzaju jego hybrydyzacji. Nasycony atom węgla w alkanach jest związany z czterema innymi atomami. Dlatego jego stan odpowiada hybrydyzacji sp 3. W tym przypadku każdy z czterech hybrydowych atomów węgla sp 3 AO uczestniczy w osiowym (-) nakładaniu się z s-AO wodoru lub z sp 3 -AO innego atomu węgla, tworząc wiązania -CH lub CC.

Cztery wiązania węgla są skierowane w przestrzeń pod kątem czworościennym 109 o 28”. Dlatego cząsteczka najprostszego przedstawiciela alkanów - metanu CH 4 - ma kształt czworościanu, w środku którego znajduje się atom węgla, a na wierzchołkach atomy wodoru:

Kąt wiązania N-C-H jest równe 109 lub 28'. Strukturę przestrzenną metanu można przedstawić za pomocą modeli wolumetrycznych (w skali) i kulowo-kijowych.

Do nagrywania wygodnie jest zastosować wzór przestrzenny (stereochemiczny).

W cząsteczce kolejnego homologu - etanu C 2 H 6 - dwa czworościenne sp 3 - atomy węgla tworzą bardziej złożoną strukturę przestrzenną:

Cząsteczki alkanów zawierające więcej niż 2 atomy węgla charakteryzują się zakrzywionymi kształtami.

Nomenklatura
Zgodnie z nomenklaturą IUPAC nazwy węglowodorów nasyconych charakteryzują się przyrostkiem -jakiś. Pierwsze cztery węglowodory mają historycznie ustalone nazwy, począwszy od piątego, nazwa węglowodoru opiera się na greckiej nazwie odpowiadającej liczbie atomów węgla.
Węglowodory o normalnym łańcuchu atomów węgla mają następujące nazwy:
| CH 4 - metan | CH 3 - (CH 2) 5 - CH 3 - heptan |
Nazwy węglowodorów o rozgałęzionych łańcuchach są zbudowane w następujący sposób:
1. Podstawa nazwy tego połączenia przyjąć nazwę węglowodoru odpowiadającą liczbie atomów węgla w łańcuchu głównym.
Za główny łańcuch atomów węgla uważa się:
a) najdłuższy;
b) najbardziej złożony (z maksymalną liczbą odgałęzień). Jeżeli w węglowodorze można wyróżnić dwa lub więcej jednakowych łańcuchów, wówczas jako główny wybierany jest ten, który ma najdłuższy łańcuch. większa liczba gałęzie:

2. Po ustaleniu łańcucha głównego należy przenumerować atomy węgla. Numeracja rozpoczyna się od końca łańcucha, któremu którykolwiek z alkilów jest najbliższy. Jeżeli różne alkile znajdują się w równych odległościach od obu końców łańcucha, to numeracja rozpoczyna się od tego końca, do którego bliżej jest rodnik z mniejszą liczbą atomów węgla (metyl, etyl, propyl itp.). Na przykład:


Jeżeli identyczne pierwiastki wyznaczające początek numeracji znajdują się w jednakowej odległości od obu końców łańcucha, ale jest ich więcej po jednej stronie niż po drugiej, to numerację rozpoczyna się od końca, gdzie liczba odgałęzień jest większa: 
2,2,4-trimetylopentan

2,3,6-trimetyloheptan
Nazywając związek, najpierw wymienia się podstawniki w kolejności alfabetycznej (cyfry nie są brane pod uwagę), a przed nazwą rodnika umieszcza się liczbę odpowiadającą numerowi atomu węgla głównego łańcucha, przy którym ten rodnik się znajduje . Następnie nazywa się węglowodór odpowiadający głównemu łańcuchowi atomów węgla, oddzielając słowo od liczb łącznikiem.
Jeżeli węglowodór zawiera kilka identycznych rodników, to ich liczbę oznacza się cyfrą grecką (di, tri, tetra itp.) i umieszcza się przed nazwą tych rodników, a ich położenie wskazuje się jak zwykle liczbami, z liczbami oddzielonymi przecinkami, ułożonymi w kolejności ich zwiększania się i umieszczanymi przed nazwą tych rodników, oddzielając je od niej łącznikiem.
CYKLOALKANY
Nazwy cykloalkanów tworzy się przez dodanie przedrostka cyklo- do nazwy odpowiedniego nierozgałęzionego węglowodoru nasyconego o tej samej liczbie atomów węgla:
Podstawniki numeruje się według ich pozycji w cyklu w taki sposób, aby suma liczb była minimalna:
Izomeria
Izomery- są to substancje, które mają ten sam skład i ten sam wzór cząsteczkowy i masę, ale inną budowę chemiczną, a zatem mają różne właściwości fizykochemiczne.
Izomeria strukturalna
Przyczyną manifestacji izomerii strukturalnej w szeregu alkanów jest zdolność atomów węgla do tworzenia łańcuchów o różnych strukturach. Ten typ izomerii strukturalnej nazywany jest izomerią szkieletu węglowego.
Izomery strukturalne mają ten sam skład, ale różnią się budową chemiczną, natomiast właściwości chemiczne izomerów są podobne, ale właściwości fizyczne są różne. Alkany o rozgałęzionej strukturze, ze względu na mniej gęste upakowanie cząsteczek i odpowiednio mniej oddziaływań międzycząsteczkowych, wrzą w niższej temperaturze niż ich nierozgałęzione izomery.
W cząsteczkach metanu CH 4, etanu C 2 H 6 i propanu C 3 H 8 może występować tylko jeden porządek łączenia atomów, to znaczy pierwsi trzej członkowie homologicznej serii alkanów nie mają izomerów. W przypadku butanu C4H10 możliwe są dwie struktury:

Jeden z tych izomerów (n-butan) zawiera prosty łańcuch węglowy, a drugi, izobutan, zawiera łańcuch rozgałęziony (izostruktura).
Wraz ze wzrostem liczby atomów węgla w cząsteczkach zwiększają się możliwości rozgałęziania łańcuchów, tj. liczba izomerów wzrasta wraz z liczbą atomów węgla.

W szeregu rodników spotykamy także zjawisko izomerii. Ponadto liczba izomerów w rodnikach jest znacznie większa niż w odpowiadających im alkanach. Na przykład propan, jak wiadomo, nie ma izomerów, a rodnik propylowy ma dwa izomery: n-propyl i izopropyl:
|
CH 3 -CH 3 -CH 2 - i H 3 C-CH-CH 3
Izomeria rotacyjna alkanów
Rotacja atomów wokół wiązania s nie doprowadzi do jego zerwania. W wyniku wewnątrzcząsteczkowej rotacji wzdłuż wiązań C – C cząsteczki alkanów, począwszy od etanu C 2 H 6, mogą przyjmować różne figury geometryczne.
Nazywa się różne formy przestrzenne cząsteczki, które przekształcają się w siebie poprzez obrót wokół wiązań C – C konformacje Lub izomery rotacyjne(konformiści).
Izomery rotacyjne cząsteczki to jej stany nierówne energetycznie. Ich wzajemna konwersja następuje szybko i stale w wyniku ruchu termicznego. Dlatego nie można izolować izomerów obrotowych forma indywidualna, ale ich istnienie zostało udowodnione metodami fizycznymi. Niektóre konformacje są bardziej stabilne (korzystne energetycznie) i cząsteczka pozostaje w takich stanach przez dłuższy czas.
W normalnych warunkach pierwszymi czterema członkami homologicznego szeregu alkanów są gazy, C5-C17 to ciecze, a począwszy od C18 to ciała stałe. Temperatury topnienia i wrzenia alkanów o ich gęstości rosną wraz ze wzrostem masy cząsteczkowej. Wszystkie alkany są lżejsze od wody i są w niej nierozpuszczalne, ale są rozpuszczalne w rozpuszczalnikach niepolarnych (na przykład benzenie) i same w sobie są dobrymi rozpuszczalnikami.
Właściwości fizyczne niektórych alkanów przedstawiono w tabeli.
| Nazwa | Formuła | Tpl°C | Tbela°C | D 20 4 |
| Metan | CH 4 | (przy -164°C) |
||
| Etan | Z 2 N 6 | (przy -100°C) |
||
| Propan | Z 3 N 8 | (przy -44,5°C) |
||
| Butan | Z 4 N 10 | (w 0°C) |
||
| Pentan | C 5 H 12 | |||
| Heksan | Z 6 N 14 | |||
| Heptan | Z 7 H 16 | |||
| Oktan | C 8 H 18 | |||
| Nonana | Z 9 N 20 | |||
| Dziekan | C 10 H 22 | |||
| Pentadekan | C 15 H 32 | |||
| Eikosan | Z 20 N 42 | (w 37°C) |
||
| Pentakozan | C 25 H 52 | |||
| Triakontan | Z 30 N 62 | |||
| *
D 4
20
– gęstość względna, tj. |
||||
Właściwości chemiczne
Trywialna (historyczna) nazwa alkanów – „parafiny” – oznacza „niemający powinowactwa”. Alkany są chemicznie nieaktywne. Niska reaktywność alkanów wynika z bardzo niskiej polarności wiązań C-C i C-H w ich cząsteczkach, ze względu na prawie identyczną elektroujemność atomów węgla i wodoru. Nasycone węglowodory w normalnych warunkach nie wchodzą w interakcje ze stężonymi kwasami, zasadami, a nawet z tak aktywnym odczynnikiem jak nadmanganian potasu.
Charakteryzują się reakcjami podstawienia atomów wodoru i rozszczepienia.
W reakcjach tych dochodzi do homolitycznego rozszczepienia wiązań kowalencyjnych, czyli zachodzą one na zasadzie mechanizmu wolnorodnikowego (łańcuchowego).
Ze względu na siłę wiązań C–C i C–H reakcje zachodzą albo przy ogrzewaniu, albo przy świetle, albo przy użyciu katalizatorów.
Przyjrzyjmy się kilku przykładom reakcji tego typu.
Halogenowanie. Jest to jedna z charakterystycznych reakcji węglowodorów nasyconych. Halogenowanie alkanów zachodzi etapami - w jednym etapie zastępuje się nie więcej niż jeden atom wodoru:
CH 4 + Cl 2 → CH 3 Cl + HCl (chlorometan)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (dichlorometan)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (trichlorometan)
CHCl 3 + Cl 2 → CCl 4 + HCl (czterochlorek węgla).
Nitrowanie. Pomimo tego, że w normalnych warunkach alkany nie oddziałują ze stężonym kwasem azotowym, to po podgrzaniu ich do temperatury 140°C rozcieńczonym (10%) kwasem azotowym pod ciśnieniem następuje reakcja nitrowania - zastąpienie atomu wodoru grupą nitrową (Reakcja M.I. Konovalova). Wszystkie alkany biorą udział w podobnej reakcji nitrowania w fazie ciekłej, ale szybkość reakcji i wydajność nitrozwiązków są niskie. Najlepsze wyniki obserwuje się w przypadku alkanów zawierających trzeciorzędowe atomy węgla.
Pękanie. W wysokich temperaturach w obecności katalizatorów węglowodory nasycone ulegają rozszczepieniu, co nazywa się krakingiem. Podczas krakingu wiązania węgiel-węgiel rozpadają się homolitycznie, tworząc nasycone i nienasycone węglowodory o krótszych łańcuchach.
CH 3 –CH 2 –CH 2 –CH 3 (butan) –– 400°C CH 3 –CH 3 (etan)+ CH 2 =CH 2 (etylen)
Wzrost temperatury procesu prowadzi do głębszego rozkładu węglowodorów, a w szczególności do odwodornienia, tj. do rozstania
wodór. Zatem metan w temperaturze 1500 ° C prowadzi do acetylenu.
2CH 4 –– 1500°C H–C =
C–H(acetylen) + 3H 2
Izomeryzacja. Pod wpływem katalizatorów po podgrzaniu węglowodory o normalnej budowie ulegają izomeryzacji - przegrupowaniu szkieletu węglowego z utworzeniem rozgałęzionych alkanów.
Utlenianie. W normalnych warunkach alkany są odporne na tlen i środki utleniające. Po zapaleniu w powietrzu alkany palą się, zamieniając się w dwutlenek węgla i wodę, które następnie uwalniają się duża liczba ciepło.
CH 4 + 2O 2 – płomień CO 2 + 2H 2 O
C 5 H 12 + 8O 2 –– płomień 5CO 2 + 6H 2 O
Bycie w naturze i otrzymywanie
Głównymi źródłami alkanów są ropa naftowa i gaz ziemny. 

Metan stanowi większość gazu ziemnego; zawiera również niewielkie ilości etanu, propanu i butanu. Metan występuje w emisjach z bagien i pokładów węgla. Oprócz lekkich homologów metan występuje w towarzyszących gazach ropopochodnych. Gazy te rozpuszczają się w oleju pod ciśnieniem i również znajdują się nad nim. Alkany stanowią znaczną część produktów naftowych. Olej zawiera także cykloalkany – nazywane są naftenami (z gr. ropa- olej). W przyrodzie szeroko rozpowszechnione są także gazowe hydraty alkanów, głównie metanu, które występują w skałach osadowych na kontynentach i na dnie oceanów. Ich zasoby prawdopodobnie przewyższają znane zasoby gazu ziemnego i w przyszłości mogą stać się źródłem metanu i jego najbliższych homologów. Alkany otrzymuje się także metodą pirolizy (koksowania) węgiel i jego uwodornienie (produkcja syntetycznego paliwa ciekłego). Alkany stałe występują w przyrodzie w postaci osadów wosku górskiego – ozokerytu, w woskowych powłokach liści, kwiatów i nasion roślin oraz są częścią wosku pszczelego. 
W przemyśle alkany otrzymuje się przez katalityczne uwodornienie tlenków węgla CO
Wosk górski
i CO2 (metoda Fischera-Tropscha). W laboratorium metan można otrzymać poprzez ogrzewanie octanu sodu ze stałą zasadą: CH 3 COONa + NaOH → CH 4 + Na 2 CO 3, a także przez hydrolizę niektórych węglików: Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3. Homologie metanu można otrzymać w reakcji Wurtza, np.: 2CH 3 Br + 2Na → CH 3 –CH 3 + 2NaBr. W przypadku dihaloalkanów otrzymuje się cykloalkany, np.: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na → cykl-C6H12 + 2NaBr. Alkany powstają także podczas dekarboksylacji kwasów karboksylowych i podczas ich elektrolizy.
Zastosowania alkanów
Węglowodory nasycone są szeroko stosowane w wielu różnych obszarach życia i działalności człowieka.
Alkany gazowe (metan i mieszanina propan-butan) są wykorzystywane jako cenne paliwo. 
Węglowodory ciekłe stanowią znaczną część paliw silnikowych i rakietowych i są stosowane jako rozpuszczalniki.
Olejek wazelinowy (mieszanina ciekłych węglowodorów zawierających do 15 atomów węgla) to przezroczysta, bezwonna i pozbawiona smaku ciecz, stosowana w medycynie, perfumerii i kosmetyce. 
Wazelina (mieszanina ciekłych i stałych węglowodorów nasyconych zawierająca do 25 atomów węgla) służy do przygotowania maści stosowanych w medycynie.
Parafina (mieszanina stałych alkanów C 19 - C 35) - biała stała masa bez zapachu i smaku (t.t. 50-70°C) - stosowana do wyrobu świec, impregnacji zapałek i papieru do pakowania, do zabiegów termicznych w medycynie. Służy jako surowiec do produkcji kwasów organicznych i alkoholi, detergentów i środków powierzchniowo czynnych. 
Normalne węglowodory nasycone o średniej masie cząsteczkowej stosowane są jako substrat odżywczy w mikrobiologicznej syntezie białka z oleju.
Duże znaczenie mają halogenowe pochodne alkanów, które wykorzystuje się jako rozpuszczalniki, chłodziwa i surowce do dalszych syntez. We współczesnym przemyśle petrochemicznym węglowodory nasycone są podstawą do produkcji różnorodnych związków organicznych, ważnym surowcem w procesach otrzymywania półproduktów do produkcji tworzyw sztucznych, gumy, włókien syntetycznych, detergentów i wielu innych substancji.
Struktura alkanów
Alkany to węglowodory, w których atomy są połączone wiązania pojedyncze i które odpowiadają wzorowi ogólnemu CnH2n+2. W cząsteczkach alkanów wszystkie atomy węgla znajdują się w stanie sp 3 -hybrydyzacja.
Oznacza to, że wszystkie cztery orbitale hybrydowe atomu węgla mają identyczny kształt, energię i są skierowane w stronę narożników piramidy trójkątnej równobocznej - czworościan. Kąty między orbitalami wynoszą 109° 28′. Możliwa jest prawie swobodna rotacja wokół pojedynczego wiązania węgiel-węgiel, a najwięcej mogą pozyskać cząsteczki alkanów różne kształty z kątami przy atomach węgla bliskimi czworościennym (109° 28′), na przykład w cząsteczce n-pentanu.

Szczególnie warto przypomnieć wiązania w cząsteczkach alkanów. Wszystkie wiązania w cząsteczkach węglowodorów nasyconych są pojedyncze. Nakładanie się następuje wzdłuż osi łączącej jądra atomów, czyli tzw wiązania σ. Wiązania węgiel-węgiel są niepolarne i słabo polaryzowalne. Długość wiązania CC w alkanach wynosi 0,154 nm (1,54 · 10 · 10 m). Wiązania CH są nieco krótsze. Gęstość elektronów jest nieznacznie przesunięta w stronę bardziej elektroujemnego atomu węgla, tj. Połączenie C-H Jest słabo polarny.
Seria homologiczna metanu
Homologi- substancje o podobnej budowie i właściwościach oraz różniące się między sobą jedną lub więcej grup CH 2 .


Węglowodory nasycone stanowią homologiczną serię metanu.
Izomeria i nazewnictwo alkanów
Alkany charakteryzują się tzw izomeria strukturalna. Izomery strukturalne różnią się między sobą budową szkieletu węglowego. Najprostszym alkanem, który charakteryzuje się izomerami strukturalnymi, jest butan.

Rozważmy bardziej szczegółowo podstawową nomenklaturę alkanów IUPAC.
1. Wybór obwodu głównego. Tworzenie nazwy węglowodoru rozpoczyna się od zdefiniowania głównego łańcucha - najdłuższego łańcucha atomów węgla w cząsteczce, który jest niejako jego podstawą.
2. Numeracja atomów łańcucha głównego. Atomy głównego łańcucha mają przypisane numery. Numeracja atomów łańcucha głównego rozpoczyna się od końca, do którego podstawnik jest najbliższy (struktury A, B). Jeżeli podstawniki znajdują się w równej odległości od końca łańcucha, to numerację rozpoczyna się od końca, na którym jest ich więcej (struktura B). Jeżeli różne podstawniki znajdują się w równych odległościach od końców łańcucha, to numerację rozpoczyna się od końca, do którego najbliżej jest starszy (struktura D). Starszeństwo podstawników węglowodorowych określa kolejność, w jakiej litera, od której zaczyna się ich nazwa, pojawia się w alfabecie: metyl (-CH 3), następnie propyl (-CH 2 -CH 2 -CH 3), etyl (-CH 2 -CH3) itd.
Należy pamiętać, że nazwę podstawnika tworzy się poprzez zastąpienie przyrostka -ane przyrostkiem -yl w nazwie odpowiedniego alkanu.
3. Tworzenie imienia. Na początku nazwy wskazane są liczby - liczby atomów węgla, przy których znajdują się podstawniki. Jeżeli przy danym atomie jest kilka podstawników, to odpowiadająca im liczba w nazwie powtarza się dwukrotnie, oddzielona przecinkiem (2,2-). Po liczbie łącznik wskazuje liczbę podstawników (di - dwa, trzy - trzy, tetra - cztery, penta - pięć) i nazwę podstawnika (metyl, etyl, propyl). Następnie bez spacji i myślników nazwa głównego łańcucha. Główny łańcuch nazywa się węglowodorem - członkiem homologicznej serii metanu (metan, etan, propan itp.).




Nazwy substancji, których wzory strukturalne podano powyżej, są następujące:
Struktura A: 2-metylopropan;
Struktura B: 3-etyloheksan;
Struktura B: 2,2,4-trimetylopentan;
Struktura D: 2-metylo-4-etyloheksan.
Brak nasyconych węglowodorów w cząsteczkach wiązania polarne prowadzi do nich słabo rozpuszczalny w wodzie, nie oddziałują z naładowanymi cząsteczkami (jonami). Najbardziej charakterystycznymi reakcjami dla alkanów są reakcje z udziałem wolne rodniki.
Właściwości fizyczne alkanów
Pierwsi czterej przedstawiciele homologicznej serii metanu to gazy. Najprostszym z nich jest metan - bezbarwny, pozbawiony smaku i zapachu gaz (zapach „gazu”, gdy go poczujesz, należy zadzwonić pod numer 04, określa zapach merkaptanów - związków zawierających siarkę specjalnie dodawanych do metanu używanego w domowych i przemysłowych urządzeniach gazowych, aby osoby znajdujące się w ich pobliżu mogły wykryć wyciek po zapachu).
Węglowodory o składzie z Z 5 N 12 zanim Z 15 N 32 - płyny; cięższe węglowodory są ciałami stałymi. Temperatury wrzenia i topnienia alkanów stopniowo rosną wraz ze wzrostem długości łańcucha węglowego. Wszystkie węglowodory są słabo rozpuszczalne w wodzie; ciekłe węglowodory są powszechnymi rozpuszczalnikami organicznymi.


Właściwości chemiczne alkanów
Reakcje podstawienia.
Najbardziej charakterystycznymi reakcjami dla alkanów są substytucja wolnych rodników, podczas którego atom wodoru zostaje zastąpiony atomem halogenu lub jakąś grupą.
Przedstawmy równania charakterystyczne reakcje halogenowania:
W przypadku nadmiaru halogenu chlorowanie może postępować dalej, aż do całkowitego zastąpienia wszystkich atomów wodoru chlorem:

Powstałe substancje są szeroko stosowane jako rozpuszczalniki i materiały wyjściowe w syntezach organicznych.
Reakcja odwodornienia(pobieranie wodoru).
Kiedy alkany przepuszcza się przez katalizator (Pt, Ni, Al 2 O 3, Cr 2 O 3) w wysokich temperaturach (400-600 °C), cząsteczka wodoru zostaje wyeliminowana, a alken:
Reakcje, którym towarzyszy zniszczenie łańcucha węglowego. Wszystkie węglowodory nasycone płoną z utworzeniem dwutlenku węgla i wody. Węglowodory gazowe zmieszane z powietrzem w określonych proporcjach mogą eksplodować.
1. Spalanie węglowodorów nasyconych jest wolnorodnikową reakcją egzotermiczną, która ma bardzo bardzo ważne w przypadku stosowania alkanów jako paliwa:
Ogólnie reakcję spalania alkanów można zapisać w następujący sposób:
2. Rozszczepianie termiczne węglowodorów.
Proces przebiega wg mechanizm wolnorodnikowy. Wzrost temperatury prowadzi do homolitycznego rozerwania wiązania węgiel-węgiel i powstania wolnych rodników.
Rodniki te oddziałują ze sobą, wymieniając atom wodoru, tworząc cząsteczkę cząsteczka alkanu i alkenu:
Reakcje rozkładu termicznego stanowią podstawę procesu przemysłowego - kraking węglowodorów. Proces ten jest najważniejszym etapem rafinacji ropy naftowej.
3. Piroliza. Gdy metan zostanie podgrzany do temperatury 1000°C, piroliza metanu- rozkład na substancje proste:
Po podgrzaniu do temperatury 1500°C tworzy się acetylen:
4. Izomeryzacja. Gdy liniowe węglowodory ogrzewa się za pomocą katalizatora izomeryzacji (chlorku glinu), substancje z rozgałęziony szkielet węglowy:

5. Aromatyzacja. Alkany zawierające sześć lub więcej atomów węgla w łańcuchu cyklizują w obecności katalizatora, tworząc benzen i jego pochodne:

Alkany wchodzą w reakcje, które przebiegają zgodnie z mechanizmem wolnorodnikowym, gdyż wszystkie atomy węgla w cząsteczkach alkanów znajdują się w stanie hybrydyzacji sp 3. Cząsteczki tych substancji zbudowane są przy użyciu kowalencji niepolarne C-C wiązania (węgiel - węgiel) i słabo polarne wiązania C-H (węgiel - wodór). Nie zawierają obszarów o zwiększonej lub zmniejszonej gęstości elektronowej, wiązań łatwo spolaryzowanych, czyli takich, w których gęstość elektronowa może się przesuwać pod wpływem czynniki zewnętrzne(pola elektrostatyczne jonów). W konsekwencji alkany nie będą reagować z naładowanymi cząstkami, ponieważ wiązania w cząsteczkach alkanów nie są przerywane przez mechanizm heterolityczny.