ogólna charakterystyka elementy grupy IV, głównej podgrupy układu okresowego D. I. Mendelejewa
Do pierwiastków głównej podgrupy grupy IV zalicza się węgiel, krzem, german, cynę i ołów. Właściwości metaliczne są ulepszone, właściwości niemetaliczne są zmniejszone. Warstwa zewnętrzna ma 4 elektrony.
Właściwości chemiczne(na bazie węgla)
· Interakcja z metalami
4Al+3C = Al 4 C 3 (reakcja zachodzi w wysokiej temperaturze)
· Oddziaływać z niemetalami
2H2+C = CH4
· Interakcja z tlenem
· Interakcja z wodą
C+H2O = CO+H2
· Oddziaływać z tlenkami
2Fe 2 O 3 +3C = 3CO 2 +4Fe
· Oddziaływać z kwasami
3C+4HNO3 = 3CO2 +4NO+2H2O
Węgiel. Charakterystyka węgla ze względu na jego położenie w układzie okresowym, alotropię węgla, adsorpcję, rozmieszczenie w przyrodzie, produkcję, właściwości. Najważniejsze związki węgla
Węgiel ( symbol chemiczny- C, łac. Carboneum) to pierwiastek chemiczny z czternastej grupy (według przestarzałej klasyfikacji - główna podgrupa czwartej grupy), drugiego okresu układu okresowego pierwiastki chemiczne. numer seryjny 6, masa atomowa- 12.0107. Węgiel występuje w różnych odmianach alotropowych o bardzo różnorodnych właściwościach fizycznych. Różnorodność modyfikacji wynika ze zdolności węgla do tworzenia wiązania chemiczne różne rodzaje.
Węgiel naturalny składa się z dwóch stabilnych izotopów - 12C (98,93%) i 13C (1,07%) oraz jednego izotop radioaktywny 14C (β-emiter, Т½= 5730 lat), skoncentrowany w atmosferze i górnej części skorupy ziemskiej.
Głównymi i dobrze zbadanymi alotropowymi modyfikacjami węgla są diament i grafit. Na normalne warunki Tylko grafit jest stabilny termodynamicznie, podczas gdy diament i inne formy są metastabilne. Ciekły węgiel istnieje tylko pod pewnym ciśnieniem zewnętrznym.
Przy ciśnieniach powyżej 60 GPa zakłada się powstawanie bardzo gęstej odmiany C III (gęstość 15-20% większa od gęstości diamentu), która ma przewodność metaliczną.
Krystaliczna modyfikacja węgla o układzie sześciokątnym o strukturze łańcuchowej cząsteczek nazywana jest zwykle karbynem. Znanych jest kilka form karbynu, różniących się liczbą atomów w komórce elementarnej.
Carbyne to drobnokrystaliczny czarny proszek (gęstość 1,9-2 g/cm3) o właściwościach półprzewodnikowych. Otrzymywany w sztucznych warunkach z długich łańcuchów atomów węgla ułożonych równolegle do siebie.
Carbyne jest liniowym polimerem węgla. W cząsteczce karbinu atomy węgla są połączone łańcuchami naprzemiennie lub potrójnie i wiązania pojedyncze(struktura polienowa) lub trwałe wiązania podwójne (struktura polikumulenowa). Carbyne ma właściwości półprzewodnikowe, a jego przewodność znacznie wzrasta pod wpływem światła. Pierwszy opiera się na tej właściwości praktyczne użycie- w fotokomórkach.
Grafen to dwuwymiarowa alotropowa modyfikacja węgla, utworzona przez warstwę atomów węgla o grubości jednego atomu, połączonych wiązaniami sp² w sześciokątną dwuwymiarową sieć krystaliczną.
W zwykłych temperaturach węgiel jest chemicznie obojętny, w odpowiednio wysokich temperaturach łączy się z wieloma pierwiastkami i wykazuje silne właściwości redukujące. Aktywność chemiczna Różne formy węgiel maleje w szeregach: węgiel amorficzny, grafit, diament, w powietrzu zapalają się w temperaturach odpowiednio powyżej 300-500°C, 600-700°C i 850-1000°C.
Produkty spalania węgla to CO i CO2 (odpowiednio tlenek i dwutlenek węgla). Znane są również niestabilny podtlenek węgla C3O2 (temperatura topnienia -111 °C, temperatura wrzenia 7 °C) i niektóre inne tlenki (na przykład C12O9, C5O2, C12O12). Grafit i węgiel amorficzny zaczynają reagować z wodorem w temperaturze 1200°C, z fluorem w temperaturze 900°C.
Dwutlenek węgla reaguje z wodą tworząc słaby kwas węglowy – H2CO3, który tworzy sole – węglany. Najbardziej rozpowszechnione na Ziemi są węglany wapnia (formy mineralne - kreda, marmur, kalcyt, wapień itp.) i magnez (forma mineralna dolomit).
Grafit z halogenami, metalami alkalicznymi itp.
Opublikowano na ref.rf
substancje tworzą związki inkluzyjne. Kiedy wyładowanie elektryczne przepływa pomiędzy elektrodami węglowymi w atmosferze azotu, powstaje cyjan. W wysokich temperaturach reakcja węgla z mieszaniną H2 i N2 powoduje powstanie kwasu cyjanowodorowego:
W wyniku reakcji węgla z siarką powstaje dwusiarczek węgla CS2; znane są również CS i C3S2. W przypadku większości metali węgiel tworzy węgliki, na przykład:
Reakcja węgla z parą wodną jest istotna w przemyśle:
Po podgrzaniu węgiel redukuje tlenki metali do metali. Właściwość ta jest szeroko stosowana w przemyśle metalurgicznym.
Grafit jest używany w przemyśle ołówkowym, ale miesza się go z gliną, aby zmniejszyć jego miękkość. Diament ze względu na swoją wyjątkową twardość jest niezbędnym materiałem ściernym. Różne związki węgla – pochodne – znajdują szerokie zastosowanie w farmakologii i medycynie. kwas węglowy I kwasy karboksylowe, różne heterocykle, polimery i inne związki. Węgiel odgrywa ogromną rolę w życiu człowieka. Jego zastosowania są tak różnorodne, jak sam ten wieloaspektowy element. W szczególności węgiel jest integralnym składnikiem stali (do 2,14% mas.) i żeliwa (ponad 2,14% mas.)
Węgiel jest częścią aerozoli atmosferycznych, dzięki czemu regionalny klimat może się zmieniać, a liczba dni słonecznych może się zmniejszać. Wchodzi węgiel środowisko w postaci sadzy w spalinach pojazdów podczas spalania węgla w elektrowniach cieplnych, podczas odkrywkowych kopalń węgla, podziemnego zgazowania, produkcji koncentratów węglowych itp.
Opublikowano na ref.rf
Stężenie węgla nad źródłami spalania wynosi 100-400 μg/m3, główne miasta 2,4-15,9 µg/m3, obszary wiejskie 0,5 - 0,8 µg/m3. Wraz z emisją aerozoli gazowych z elektrowni jądrowych, (6-15)·109 Bq/dzień 14СО2 przedostaje się do atmosfery.
Wysoka zawartość węgla w aerozolach atmosferycznych prowadzi do zwiększonej zachorowalności populacji, szczególnie na górne drogi oddechowe i płuca. Choroby zawodowe - głównie antrakoza i pyłowe zapalenie oskrzeli. W powietrzu obszaru roboczego, MPC, mg/m3: diament 8,0, antracyt i koks 6,0, węgiel 10,0, sadza i pył węglowy 4,0; V powietrze atmosferyczne maksymalnie jednorazowo 0,15, średnio dziennie 0,05 mg/m3.
Najważniejsze połączenia. Tlenek węgla (II) (tlenek węgla) CO. W normalnych warunkach jest to gaz bezbarwny, bezwonny i pozbawiony smaku. Toksyczność tłumaczy się tym, że łatwo łączy się z hemoglobiną we krwi Tlenek węgla (IV) CO2. W normalnych warunkach jest to bezbarwny gaz o lekko kwaśnym zapachu i smaku, półtora razy cięższy od powietrza, nie pali się i nie podtrzymuje spalania. Kwas węglowy H2CO3. Słaby kwas. Cząsteczki kwasu węglowego istnieją tylko w roztworze. Fosgen COCl2. Bezbarwny gaz o charakterystycznym zapachu, temperatura wrzenia = 8°C, temperatura topnienia = -118°C. Bardzo trujący. Słabo rozpuszczalny w wodzie. Reaktywny. Stosowany w syntezach organicznych.
Ogólna charakterystyka pierwiastków grupy IV, głównej podgrupy układu okresowego D.I. Mendelejewa – pojęcie i rodzaje. Klasyfikacja i cechy kategorii „Ogólna charakterystyka pierwiastków grupy IV, głównej podgrupy układu okresowego D. I. Mendelejewa” 2017, 2018.
Początki francuskiej rzeźby gotyckiej powstały w Saint-Denis. Trzy portale zachodniej fasady słynnego kościoła wypełniły rzeźbiarskie obrazy, w których po raz pierwszy objawiła się chęć ściśle przemyślanego programu ikonograficznego, zrodziło się pragnienie…
We wczesnym średniowieczu nie budowano prawie żadnych nowych miast. Ciągłe wojny spowodowały konieczność budowy ufortyfikowanych osad, zwłaszcza na terenach przygranicznych. Ośrodkiem wczesnośredniowiecznej kultury materialnej i duchowej były klasztory. Budowano je....
ROZWIĄZANIA DO ZABAWY KOSMICZNEJ Wspólna decyzja budynki i kompleksy W składzie wyższym instytucja edukacyjna zgodnie ze strukturą architektoniczno-planistyczną, w skład wchodzą następujące zakłady: instytut ogólny i katedry wydziałowe z biurami i laboratoriami; ...
Układ okresowy pierwiastków chemicznych to klasyfikacja pierwiastków chemicznych stworzona przez D. I. Mendelejewa na podstawie prawa okresowości odkrytego przez niego w 1869 roku.
DI Mendelejew
Według nowoczesna formuła Prawo to stanowi, że w ciągłym szeregu pierwiastków, ułożonych według rosnącej wielkości ładunku dodatniego jąder ich atomów, okresowo powtarzają się pierwiastki o podobnych właściwościach.
Układ okresowy pierwiastków chemicznych, przedstawiony w formie tabeli, składa się z okresów, serii i grup.
Na początku każdego okresu (z wyjątkiem pierwszego) pierwiastek ma wyraźne właściwości metaliczne (metal alkaliczny).

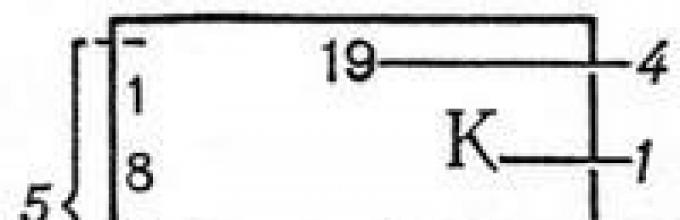
Legenda do tabeli kolorów: 1 - znak chemiczny element; 2 - imię; 3 - masa atomowa (masa atomowa); 4 - numer seryjny; 5 - rozkład elektronów w warstwach.
Wraz ze wzrostem numeru seryjnego elementu, równa wartości dodatni ładunek jądra atomu, właściwości metaliczne stopniowo słabną, a właściwości niemetaliczne rosną. Przedostatni pierwiastek w każdym okresie to pierwiastek o wyraźnych właściwościach niemetalicznych (), a ostatni to gaz obojętny. W okresie I występują 2 elementy, w II i III – 8 elementów, w IV i V – 18, w VI – 32, a w VII (okres nieskończony) – 17 elementów.
Pierwsze trzy okresy nazywane są małymi okresami, każdy z nich składa się z jednego poziomego rzędu; reszta - w dużych okresach, z których każdy (z wyjątkiem okresu VII) składa się z dwóch poziomych rzędów - parzystego (górnego) i nieparzystego (dolnego). Tylko metale występują w równych rzędach dużych okresów. Właściwości elementów tych szeregów zmieniają się nieznacznie wraz ze wzrostem liczby porządkowej. Zmieniają się właściwości pierwiastków w nieparzystych rzędach dużych okresów. W okresie VI po lantanie następuje 14 pierwiastków o bardzo podobnych właściwościach chemicznych. Pierwiastki te, zwane lantanowcami, są wymienione osobno poniżej głównej tabeli. Aktynowce, pierwiastki następujące po aktynie, przedstawiono w tabeli w podobny sposób.

Tabela ma dziewięć grup pionowych. Numer grupy, z nielicznymi wyjątkami, jest równy najwyższej dodatniej wartościowości elementów tej grupy. Każda grupa, z wyjątkiem zera i ósmej, jest podzielona na podgrupy. - główny (znajdujący się po prawej stronie) i wtórny. W głównych podgrupach wraz ze wzrostem liczby atomowej właściwości metaliczne pierwiastków stają się silniejsze, a właściwości niemetaliczne słabną.
Zatem chemia i seria właściwości fizyczne o pierwiastkach decyduje miejsce, jakie zajmuje dany pierwiastek w układzie okresowym.
Elementy biogenne, czyli elementy tworzące organizmy i pełniące w nich określoną funkcję rola biologiczna, zajmują górną część układu okresowego. Komórki zajmowane przez pierwiastki stanowiące większość (ponad 99%) żywej materii są zabarwione na niebiesko kolor różowy- komórki zajęte przez mikroelementy (patrz).
Największym osiągnięciem jest układ okresowy pierwiastków chemicznych nowoczesne nauki przyrodnicze i żywy wyraz najbardziej ogólnych dialektycznych praw natury.
Zobacz także: Masa atomowa.
Układ okresowy pierwiastków chemicznych to naturalna klasyfikacja pierwiastków chemicznych stworzona przez D. I. Mendelejewa na podstawie prawa okresowości odkrytego przez niego w 1869 roku.
W swoim pierwotnym sformułowaniu okresowe prawo D.I. Mendelejewa stwierdzało: właściwości pierwiastków chemicznych, a także formy i właściwości ich związków są okresowo zależne od mas atomowych pierwiastków. Następnie, wraz z rozwojem doktryny budowy atomu, wykazano, że dokładniejszą cechą każdego pierwiastka nie jest masa atomowa (patrz), ale wartość dodatniego ładunku jądra atomu pierwiastka, równy numerowi seryjnemu (atomowemu) tego pierwiastka w układzie okresowym D. I. Mendelejewa . Liczba ładunków dodatnich w jądrze atomu jest równa liczbie elektronów otaczających jądro atomu, ponieważ atomy jako całość są elektrycznie obojętne. W świetle tych danych prawo okresowości formułuje się w następujący sposób: właściwości pierwiastków chemicznych, a także formy i właściwości ich związków są okresowo zależne od wielkości dodatniego ładunku jąder ich atomów. Oznacza to, że w ciągłym szeregu pierwiastków ułożonych według rosnących ładunków dodatnich jąder ich atomów, okresowo będą się powtarzać pierwiastki o podobnych właściwościach.
Tabelaryczna forma układu okresowego pierwiastków chemicznych jest przedstawiona w jego nowoczesna forma. Składa się z okresów, serii i grup. Okres reprezentuje kolejny poziomy szereg pierwiastków ułożonych w kolejności rosnącego ładunku dodatniego jąder ich atomów.
Na początku każdego okresu (z wyjątkiem pierwszego) występuje pierwiastek o wyraźnych właściwościach metalicznych (metal alkaliczny). Następnie wraz ze wzrostem numeru seryjnego właściwości metaliczne elementów stopniowo słabną, a właściwości niemetaliczne rosną. Przedostatnim pierwiastkiem w każdym okresie jest pierwiastek o wyraźnych właściwościach niemetalicznych (halogen), a ostatnim jest gaz obojętny. Pierwszy okres składa się z dwóch elementów: roli metal alkaliczny i halogen są tutaj jednocześnie wykonywane przez wodór. Okresy II i III obejmują po 8 elementów, zwanych przez Mendelejewa typowymi. Okresy IV i V zawierają po 18 elementów każdy, VI-32. Okres VII nie został jeszcze zakończony i jest uzupełniany sztucznie stworzonymi elementami; Obecnie w tym okresie występuje 17 elementów. Okresy I, II i III nazywane są małymi, każdy z nich składa się z jednego poziomego rzędu, IV-VII są duże: (z wyjątkiem VII) obejmują dwa poziome rzędy - parzysty (górny) i nieparzysty (dolny). W równych rzędach dużych okresów znajdują się tylko metale, a zmiana właściwości pierwiastków w rzędzie od lewej do prawej jest słabo wyrażona.
W nieparzystych szeregach dużych okresów właściwości elementów szeregu zmieniają się w taki sam sposób, jak właściwości pierwiastków typowych. W parzystym rzędzie okresu VI, po lantanie, znajduje się 14 pierwiastków [zwanych lantanowcami (patrz), lantanowce, pierwiastki ziem rzadkich], które mają podobne właściwości chemiczne do lantanu i do siebie nawzajem. Ich wykaz znajduje się osobno pod tabelą.
Pierwiastki następujące po aktynie - aktynowce (aktynoidy) - są wymienione osobno i wymienione poniżej tabeli.
W układzie okresowym pierwiastków chemicznych dziewięć grup znajduje się pionowo. Numer grupy jest równy najwyższej dodatniej wartościowości (patrz) elementów tej grupy. Wyjątkami są fluor (może być tylko ujemnie jednowartościowy) i brom (nie może być siedmiowartościowy); ponadto miedź, srebro, złoto mogą wykazywać wartościowość większą niż +1 (Cu-1 i 2, Ag i Au-1 i 3), a z pierwiastków grupy VIII tylko osm i ruten mają wartościowość +8 . Każda grupa, z wyjątkiem ósmej i zerowej, jest podzielona na dwie podgrupy: główną (umieszczoną po prawej stronie) i drugorzędną. Do głównych podgrup zaliczają się pierwiastki typowe i pierwiastki długie, podgrupy drugorzędne obejmują jedynie pierwiastki długie, a ponadto metale.
Pod względem właściwości chemicznych pierwiastki każdej podgrupy danej grupy różnią się znacznie od siebie, a jedynie najwyższa dodatnia wartościowość jest taka sama dla wszystkich pierwiastków danej grupy. W głównych podgrupach, od góry do dołu, właściwości metaliczne pierwiastków ulegają wzmocnieniu, a osłabieniu niemetaliczne (np. frans jest pierwiastkiem o najbardziej wyraźnych właściwościach metalicznych, a fluor jest niemetaliczny). Zatem miejsce pierwiastka w układzie okresowym Mendelejewa (liczba porządkowa) określa jego właściwości, które są średnią właściwości sąsiadujących elementów w pionie i poziomie.
Niektóre grupy elementów mają specjalne nazwy. Zatem pierwiastki głównych podgrup grupy I nazywane są metalami alkalicznymi, grupa II - metale ziem alkalicznych, grupa VII – halogeny, pierwiastki znajdujące się za uranem – transuran. Elementy tworzące organizmy biorą udział w procesach metabolicznych i mają wyraźny wpływ rola biologiczna, nazywane są elementami biogennymi. Wszystkie zajmują górną część tabeli D.I. Mendelejewa. Są to przede wszystkim O, C, H, N, Ca, P, K, S, Na, Cl, Mg i Fe, które stanowią większość żywej materii (ponad 99%). Miejsca zajmowane przez te pierwiastki w układzie okresowym są zaznaczone kolorem jasnoniebieskim. Elementy biogenne, których jest bardzo mało w organizmie (od 10 -3 do 10 -14%), nazywane są mikroelementami (patrz). Komórki układu okresowego, zabarwione na żółto, zawierają mikroelementy, których istotne znaczenie dla człowieka zostało udowodnione.
Zgodnie z teorią budowy atomu (patrz Atom) Właściwości chemiczne elementy zależą głównie od liczby elektronów na zewnątrz powłoka elektronowa. Okresowa zmiana właściwości pierwiastków o rosnącym ładunku dodatnim jąder atomowych tłumaczy się okresowym powtarzaniem struktury zewnętrznej powłoki elektronowej ( poziom energii) atomy.
W małych okresach, wraz ze wzrostem dodatniego ładunku jądra, liczba elektronów w powłoce zewnętrznej wzrasta z 1 do 2 w okresie I i od 1 do 8 w okresach II i III. Stąd zmiana właściwości pierwiastków w okresie od metalu alkalicznego do gazu obojętnego. Zewnętrzna powłoka elektronowa, zawierająca 8 elektronów, jest kompletna i stabilna energetycznie (pierwiastki grupy zerowej są chemicznie obojętne).
W długich okresach w równych rzędach, w miarę wzrostu dodatniego ładunku jąder, liczba elektronów w powłoce zewnętrznej pozostaje stała (1 lub 2), a druga powłoka zewnętrzna jest wypełniona elektronami. Stąd powolna zmiana właściwości elementów w rzędach parzystych. W nieparzystych seriach dużych okresów, w miarę wzrostu ładunku jąder, zewnętrzna powłoka wypełnia się elektronami (od 1 do 8), a właściwości pierwiastków zmieniają się w taki sam sposób, jak właściwości typowych pierwiastków.
Liczba powłok elektronowych w atomie jest równa liczbie okresu. Atomy pierwiastków głównych podgrup mają na swoich zewnętrznych powłokach liczbę elektronów równą liczbie grup. Atomy pierwiastków podgrup bocznych zawierają jeden lub dwa elektrony na swoich zewnętrznych powłokach. To wyjaśnia różnicę we właściwościach elementów podgrupy głównej i drugorzędnej. Numer grupy wskazuje możliwą liczbę elektronów, które mogą brać udział w tworzeniu wiązań chemicznych (walencyjnych) (patrz Cząsteczka), dlatego takie elektrony nazywane są wartościowością. W przypadku elementów podgrup bocznych wartościowością są nie tylko elektrony powłok zewnętrznych, ale także elektrony przedostatnich. Liczbę i strukturę powłok elektronowych podano w załączonym układzie okresowym pierwiastków chemicznych.
Prawo okresowe D.I. Mendelejew i oparty na nim system mają wyłącznie bardzo ważne w nauce i praktyce. Prawo i układ okresowości były podstawą do odkrycia nowych pierwiastków chemicznych, precyzyjna definicja ich masy atomowe, rozwój doktryny o budowie atomów, ustalenie geochemicznych praw rozkładu pierwiastków w skorupa Ziemska oraz rozwój współczesnych idei dotyczących żywej materii, której skład i związane z nim wzorce są zgodne z układem okresowym. O aktywności biologicznej pierwiastków i ich zawartości w organizmie w dużej mierze decyduje także miejsce, jakie zajmują w układzie okresowym Mendelejewa. Zatem wraz ze wzrostem numeru seryjnego w wielu grupach wzrasta toksyczność pierwiastków, a ich zawartość w organizmie maleje. Prawo okresowości jest jasnym wyrazem najogólniejszych dialektycznych praw rozwoju przyrody.
Grupa układu okresowego pierwiastków chemicznych to ciąg atomów tego samego typu o rosnącym ładunku jądrowym struktura elektroniczna. Numer grupy zależy od liczby elektronów na zewnętrznej powłoce atomu (elektronów walencyjnych)… Wikipedia
Czwarty okres układu okresowego obejmuje elementy czwartego rzędu (lub czwartego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) ... ... Wikipedia
Pierwszy okres układu okresowego obejmuje elementy pierwszego rzędu (lub pierwszego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy w... ...Wikipedii
Drugi okres układu okresowego obejmuje elementy drugiego rzędu (lub drugiego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy w… Wikipedii
Piąty okres układu okresowego obejmuje elementy piątego rzędu (lub piątego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy w... ...Wikipedii
Trzeci okres układu okresowego obejmuje elementy trzeciego rzędu (lub trzeciego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy... Wikipedia
Siódmy okres układu okresowego obejmuje elementy siódmego rzędu (lub siódmego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy... Wikipedia
Szósty okres układu okresowego obejmuje elementy szóstego rzędu (lub szóstego okresu) układu okresowego pierwiastków chemicznych. Struktura układu okresowego opiera się na wierszach, aby zilustrować powtarzające się (okresowe) trendy w... ...Wikipedii
Krótka forma układu okresowego opiera się na równoległości stopni utlenienia pierwiastków głównej i podgrupy podrzędnej: na przykład maksymalny stopień utlenienia wanadu wynosi +5, podobnie jak fosfor i arsen, maksymalny stopień utlenienia chromu wynosi + 6... Wikipedia
Żądanie „Grupowanie” zostało przekierowane tutaj. Potrzebny jest na ten temat osobny artykuł... Wikipedia
aktywny nieaktywny; b) podczas interakcji z metalami tworzą sole; d) typowe metale; 2. Metal, z którego można uzyskać wodór (w reakcji z kwasem): a) Zn; b) Pt; c) Au; d) Hg; e) Cu; 3. Zasadowe tlenki i wodorotlenki oddziałują z: a) kwasami; b) powody; c) zarówno kwasy, jak i zasady; 4. Od góry do dołu w głównych podgrupach właściwości niemetaliczne: a) wzrost b) osłabienie c) pozostają niezmienione 5. Pierwiastek głównej podgrupy grupy IV: a) siarka b) tytan c) krzem d) chrom 6 Liczbę elektronów na ostatnim poziomie energetycznym określa się: a) numerem seryjnym b) numerem okresu c) numerem grupy 7. Budowa atomów pierwiastków o numerach seryjnych 19 i 32 jest identyczna: a) suma liczba elektronów; c) liczba poziomów elektronicznych; d) liczba elektronów na ostatnim poziomie energetycznym; b) liczba neutronów; 8. Element o wzorze elektronicznym 1s22s22p6: a) neon; b) brom; c) wapń; d) beryl; 9. Atom sodu ma wzór elektroniczny: a) 1s22s22р1 b) 1s22s22p63s1 c) 1s22s22p63s2 10. Atom którego pierwiastka ma następującą budowę ostatniego poziomu energetycznego…3s23p2: a) węgiel; b) brom; c) krzem; d) fosfor; 11. Liczba niesparowanych elektronów zawiera powłokę elektronową pierwiastka nr 16 (siarka): a) 1; b) 2; o 3; d) 4; 12. Numer porządkowy pierwiastka, którego atomy mają zdolność tworzenia wyższego tlenku typu RO: a) nr 11 (sód); b) nr 12 (magnez); c) nr 14 (krzem); 13. Pierwiastek o wzorze elektronicznym 1s22s22p3 tworzy lotny związek wodoru typu: a) RH4; b) RH3; c) RH2; d) PRAWA; 14. Objętość 4 moli wodoru w warunkach normalnych: b) 44,8 l; c) 67,2 l; d) 89,6 l; e) 112 l; 15. Pierwiastek znajduje się w II okresie. Wartościowość wyższego tlenku i wodorotlenku wynosi I. Związek wykazuje podstawowe właściwości. Pierwiastek ten... a) beryl b) magnez c) lit d) fluor 16. Maksymalna wartościowość chloru (nr 17): a) IV b) V c) VII d) VIII 17. Minimalna wartościowość arsenu (nr 17): 33): a) IV b) III c) V d) VII 18. Masa cząsteczkowa soli otrzymanej w wyniku oddziaływania dwóch wyższych tlenków pierwiastków o konfiguracji atomowej odpowiednio 1s22s22p3 i 1s22s22p63s1: a) 85; b) 111; c) 63; d) 101; e) 164; 19. Określ wzór substancji „X”, która powstaje w wyniku przemian: N2 → N2O5 A; Ba → BaO B; A + B → X + D; a) HNO3 b) Ba(OH)2 c) Ba (NO3)2 d) BaSO4 e) BaOHNO3 20. Suma współczynników w równaniu reakcji, którego schemat to KMnO4 → K2MnO4 + MnO2 + O2 a) 2 ; b) 3; o 4; d) 5; e) 6; 21. Masa cząsteczkowa tlenek potasu (w g/mol): a) 55; b) 56; c) 74; d) 94; e) 112; 22. Liczba moli tlenku glinu wchodzących w skład 204 g tego połączenia: a) 1; b) 2; o 3; d) 4; e) 5; 23. Ilość ciepła wydzielonego podczas spalania 2 g węgla (równanie termochemiczne reakcji C + O2 = CO2 + 402,24 kJ): a) 67,04 kJ; b) 134,08 kJ; c) 200 kJ; d) 201,12 kJ; e) 301,68 kJ; 24. W normalnych warunkach 44,8 litra tlenu ma masę: a) 8 g; b) 16 g; c) 32 g; d) 64 g; e) 128 g; 25. Ułamek masowy wodór w związku o pH 3 wynosi: a) 5,4%; b) 7,42%; c) 8,82%; d) 78,5%; e) 82,2%; 26. Udział masowy tlenu w związku EO3 wynosi 60%. Nazwa pierwiastka E w związku: a) azot; b) fosfor; c) siarka; d) krzem; e) selen; 27. Kiedy sód oddziałuje z 72 g wody, uwalnia się wodór w objętości (n.s.): a) 11,2 l; b) 22,4 l; c) 44,8 l; d) 67,2 l; e) 112 l; 28. Masa kwasu solnego potrzebna do otrzymania 224 litrów wodoru (n.s.): (Ba + 2HCl = BaCl2 + H2): a) 219 g; b) 109,5 g; c) 730 g; d) 64 g; e) 365 g; 29. Masa wodorotlenku sodu zawarta w 200 g 30% roztworu: a) 146 g; b) 196 g; c) 60 g; d) 6 g; e) 200 g; 30. Masa soli powstała w wyniku oddziaływania wodorotlenku sodu z 400 g 75% roztworu kwasu siarkowego: a) 146 g; b) 196 g; c) 360 g; d) 435 g; e) 200 g;
) Pozycja pierwiastka litu w układzie okresowym D.I. Mendelejewa1) Pozycja pierwiastka aluminium w układzie okresowym D.I. Mendelejewa i budowa jego atomów 2) Charakter prostej substancji (metal, niemetal) 3) Porównanie właściwości prostej substancji z właściwościami proste substancje, utworzone przez pierwiastki sąsiadujące z podgrupą 4) Porównanie właściwości substancji prostej z właściwościami substancji prostych utworzonych przez pierwiastki sąsiadujące w okresie 5) Skład wyższego tlenku, jego charakter (zasadowy, kwasowy, amfoteryczny) 6) Skład wyższego wodorotlenku i jego natura (kwas zawierający tlen, zasada, wodorotlenek amfoteryczny) 7)skład lotnego związku wodoru (dla niemetali)
1. Właściwości metaliczne pierwiastków grupy II wraz ze wzrostem numeru seryjnego 1) zmniejszają się 2) zwiększają się 3) nie zmieniają się 4) zmieniają się okresowo 2.Fosfor jest utleniaczem w reakcji: 1) 3Mg+2H3PO4=Mg3(PO4)2+3H2 2) P2O3+O2=P2O5 3) 3Mg+2P=Mg3P2 4) 2P+3Cl2=2PCl3 3. Gdy temperatura pokojowa Obydwa metale nie oddziałują z wodą: 1) cynk i żelazo 2) miedź i złoto 3) sód i rtęć 4) potas i wapń 4. W wyniku reakcji 1) tlenku sodu powstają jony Na+ i wydziela się gazowy wodór i woda 2) tlenek sodu z kwas chlorowodorowy 3) chlorek sodu z wodą 4) sód z kwasem solnym. 5. Podczas interakcji z tlenem wszystkie metale z grupy 1) lit, sód 2) wapń, stront 3) bar, potas 4) potas, magnez tworzą tlenki 6. Współczynnik przed wzorem utleniającym w równaniu sodu z chlor 1) 1 2) 2 3) 3 4) 4 7. Jeśli produktami reakcji są siarczan żelaza (II) i woda, to reagentami są 1) tlenek żelaza (II) i tlenek siarki (IV) 2) miedź (II) ) siarczan i chlorek żelaza (II) 3) żelazo i Kwas Siarkowy 4) wodorotlenek żelaza(II) i kwas siarkowy 8. Lit nie służy do wypierania sodu z roztwór wodny jego sole, ponieważ 1) oddziałuje z wodą 2) należy do szeregu aktywności na lewo od miedzi 3) jest słabszym środkiem redukującym niż sód 4) łatwo utlenia się na powietrzu.
Okresowość właściwości pierwiastków i
ich połączenia.
Istnieje zgodność jeden do jednego pomiędzy pozycją pierwiastka w układzie okresowym a budową atomu tego pierwiastka, tj. współrzędne pierwiastka w układzie okresowym określają budowę atomu i odwrotnie, na podstawie budowy atomu można określić jego położenie w układzie okresowym.
Dla każdego pierwiastka układu okresowego istnieje pięć cech: numer seryjny Z, masa atomowa A, numer okresu, numer grupy i podgrupy (głównej lub wtórnej). Z punktu widzenia budowy atomu liczba atomowa pokazuje liczbę protonów w jądrze. Masa atomowa to suma mas wszystkich cząstek atomu: protonów, neutronów i elektronów. Biorąc pod uwagę, że masa elektronu jest mała w porównaniu z masą protonu i neutronu, w zaokrągleniu masę atomową można określić jako sumę mas protonów i neutronów. Stąd łatwo obliczyć liczbę neutronów w jądrze jako różnicę między masą atomową a liczbą protonów: A – Z. Atom jest elektrycznie obojętny, dlatego liczba elektronów w powłoce elektronowej jest równa liczba protonów w jądrze, tj. numer seryjny elementu – Z.
Numer okresu pokazuje liczbę poziomów energii elektronowej w atomie.
Numer grupy pokazuje całkowitą liczbę elektronów „walencyjnych”, tj. elektrony, które mogą brać udział w tworzeniu wiązań chemicznych. O pozycji pierwiastka w podgrupie (głównej lub bocznej) decyduje rozkład elektronów „walencyjnych”: jeśli element znajduje się w podgrupie głównej, wówczas wszystkie jego elektrony walencyjne znajdują się na ostatnim poziomie elektronowym energii, a wszystkie poprzednie poziomy są wypełnione. Jeśli pierwiastek znajduje się w bocznej podgrupie, wówczas wszystkie pozostałe elektrony walencyjne znajdują się na przedostatnim poziomie energetycznym.
Istnieje forma zapisu stanów energetycznych elektronów w atomie, która nazywa się wzorem elektronowym. W tym Główna rzeczLiczba kwantowa oznaczone cyfrą (1, 2, 3, 4...), orbitalny- list (s-, p-, d-, f-), a liczbę elektronów na każdym podpoziomie pokazuje indeks u góry, na przykład wzór elektronowy atomu azotu.W rzeczywistości wzór elektroniczny to rozkład elektronów na dwie liczby kwantowe. Jeżeli konieczne jest podanie rozkładu elektronów na czterech liczbach kwantowych, należy zastosować zapis w ogniwach energetycznych lub orbitali atomowych. Orbital atomowy to zbiór stanów energetycznych elektronów charakteryzujący się pewnym zbiorem trzech liczb kwantowych: głównej, orbitalnej i magnetycznej  . Na przykład dla atomu azotu wzór elektronowo-graficzny wygląda następująco:
. Na przykład dla atomu azotu wzór elektronowo-graficzny wygląda następująco:
Stan podstawowy lub normalny atomu to stan odpowiadający minimalnej rezerwie energii, tj. elektrony zajmują stany energetyczne o niższej energii. Przy niewielkim wydatku energii (na przykład pod wpływem promieniowania świetlnego) elektrony mogą przenieść się w obrębie jednego poziomu energetycznego na wyższy podpoziom energetyczny. Atom przechodzi w stan „wzbudzony”, na przykład dla atomu berylu:
|
Stan podstawowy |
Stan podniecenia |
||||||||||||||
|
|
1s 2 2s 1 2p 1 | ||||||||||||||
Struktura zewnętrznych poziomów elektronowych determinuje formy i właściwości jej związków. Przykładowo dla atomu nr 22 Ti mamy wzór elektroniczny, jest to element d.
Ti ma tylko cztery elektrony walencyjne, więc najwyższy stopień utlenianie +4.
Tlenek odpowiadający temu stopniowi utlenienia, TiO2, ma charakter amfoteryczny(z przewagą właściwości zasadowych), dlatego odpowiedni wodorotlenek można zapisać w dwóch postaciach: odpowiednio Ti(OH) 4 lub H 2 TiO 3, tworzy sole podczas interakcji zarówno z kwasami, jak i zasadami:
Ti(OH) 4 + 2H 2 SO 4  Ti (SO 4) 2 + 4H 2 O i H 2 TiO 3 + 2NaOH
Ti (SO 4) 2 + 4H 2 O i H 2 TiO 3 + 2NaOH  Na2TiO3 + 2H2O
Na2TiO3 + 2H2O
Ti(OH) 4 + 2 Cl  TiCl 2 + 4H 2 O i H 2 TiO 3 + K 2 O
TiCl 2 + 4H 2 O i H 2 TiO 3 + K 2 O  K2TiO3 + H2O
K2TiO3 + H2O
Najniższy stopień utlenienia Ti (jak większość pierwiastków D) wynosi +2. Tlenek TiO jest zasadowy, wodorotlenek Ti(OH) 2 tworzy sole tylko z kwasami, na przykład TiSO 4 lub TiCl 2.
Aby scharakteryzować dowolny element, należy wykonać następujące kroki:
Określ skład atomu, tj. wskaż liczbę protonów, neutronów i elektronów.
Podaj wzór elektronowy atomu i rozkład elektronów zewnętrznych poziomów energii pomiędzy orbitalami atomowymi.
Określ najwyższy i najniższy stopień utlenienia oraz podaj wzory i nazwy związków odpowiadających tym stopniom utlenienia.
Przykładowo element nr 34 Se.
Skład atomowy: (34 p, 46 n) 34 e.
Wzór elektroniczny: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 – to jest element p.
Elektroniczna formuła graficzna:
Najwyższy stopień utlenienia to +6, tlenek selenu (VI) SeO 3 ma charakter kwasowy, wodorotlenek H 2 SeO 4 to kwas selenowy, sole: Na 2 SeO 4 - selenian sodu, K 2 SeO 4 - selenian potasu.
Najniższy stopień utlenienia to -2, H 2 S - selenowodór, K 2 Se - selenek potasu, Na 2 Se - selenek sodu.
Właściwości pierwiastków, zdeterminowane budową zewnętrznych warstw elektronowych atomów, w naturalny sposób zmieniają się w zależności od okresów i grup układu okresowego. Co więcej, podobieństwo struktury elektroniczne generuje podobieństwo właściwości elementów analogicznych, ale nie identyczność tych właściwości. Dlatego przy przechodzeniu od jednego elementu do drugiego w grupach i podgrupach obserwuje się nie proste powtarzanie właściwości, ale ich mniej lub bardziej wyraźną naturalną zmianę. W szczególności zachowanie chemiczne atomów pierwiastków objawia się ich zdolnością do utraty i zyskania elektronów, tj. w ich zdolności do utleniania i redukcji. Ilościowa miara zdolności atomu stracić elektrony są potencjał jonizacyjny (E I ) i miarę ich zdolności ponownie zdobyć– powinowactwo elektronowe (E Z ). Charakter zmian tych wielkości podczas przejścia z jednego okresu do drugiego powtarza się, a zmiany te polegają na zmianie konfiguracji elektronowej atomu. Zatem gotowe warstwy elektroniczne odpowiadające atomom gazów obojętnych wykazują zwiększoną stabilność i zwiększoną wartość potencjałów jonizacyjnych w okresie. Jednocześnie s-elementy pierwszej grupy (Li, Na, K, Rb, Cs) mają najniższe wartości potencjału jonizacyjnego.
Elektroujemność jest miarą zdolności atomu danego pierwiastka do przyciągania do siebie elektronów w porównaniu z atomami innych pierwiastków w związku. Według jednej z definicji (Mullikena) elektroujemność atomu  można wyrazić jako połowę sumy jego energii jonizacji i powinowactwa elektronowego:
można wyrazić jako połowę sumy jego energii jonizacji i powinowactwa elektronowego:  =(E i + Ec).
=(E i + Ec).
W okresach występuje ogólna tendencja do wzrostu elektroujemności pierwiastka, a w podgrupach maleje. Najniższe wartości elektroujemności mają pierwiastki s z grupy I, a najwyższe z pierwiastków p z grupy VII.
Elektroujemność tego samego pierwiastka może się różnić w zależności od stanu wartościowości, hybrydyzacji, stopnia utlenienia itp. Elektroujemność znacząco wpływa na charakter zmian właściwości związków pierwiastków. Przykładowo kwas siarkowy wykazuje silniejsze właściwości kwasowe niż jego chemiczny odpowiednik – kwas selenowy, gdyż w tym ostatnim centralny atom selenu, ze względu na niższą elektroujemność w porównaniu z atomem siarki, nie polaryzuje tak silnie wiązań H–O w kwasie , co oznacza osłabienie kwasowości.
Inny przykład: wodorotlenek chromu(II) i wodorotlenek chromu(VI). Wodorotlenek chromu (II), Cr(OH) 2, wykazuje podstawowe właściwości w przeciwieństwie do wodorotlenku chromu (VI), H 2 CrO 4, ponieważ stopień utlenienia chromu +2 determinuje słabość oddziaływania kulombowskiego Cr 2+ z jon wodorotlenkowy i łatwość eliminacji tego jonu, tj. przejaw podstawowych właściwości. Jednocześnie wysoki stopień utlenienia chromu +6 w wodorotlenku chromu (VI) determinuje silne przyciąganie kulombowskie pomiędzy jonem wodorotlenkowym a centralnym atomem chromu i niemożność dysocjacji wzdłuż wiązania  -OH. Z drugiej strony wysoki stopień utlenienia chromu w wodorotlenku chromu(VI) zwiększa jego zdolność do przyciągania elektronów, tj. elektroujemność, która powoduje wysoki stopień polaryzacji wiązań H–O w tym związku, będący warunkiem wzrostu kwasowości.
-OH. Z drugiej strony wysoki stopień utlenienia chromu w wodorotlenku chromu(VI) zwiększa jego zdolność do przyciągania elektronów, tj. elektroujemność, która powoduje wysoki stopień polaryzacji wiązań H–O w tym związku, będący warunkiem wzrostu kwasowości.
Następną ważną cechą atomów jest ich promień. W okresach promienie atomów metali zmniejszają się wraz ze wzrostem liczby atomowej pierwiastka, ponieważ wraz ze wzrostem liczby atomowej pierwiastka w danym okresie wzrasta ładunek jądra, a tym samym całkowity ładunek elektronów, które go równoważą; w konsekwencji wzrasta również przyciąganie kulombowskie elektronów, co ostatecznie prowadzi do zmniejszenia odległości między nimi a jądrem. Najbardziej wyraźny spadek promienia obserwuje się w elementach o krótkich okresach, w których zewnętrzny poziom energii jest wypełniony elektronami.
W dużych okresach pierwiastki d i f wykazują płynniejszy spadek promieni wraz ze wzrostem ładunku jądra atomowego. W każdej podgrupie pierwiastków promienie atomowe mają tendencję do zwiększania się od góry do dołu, ponieważ takie przesunięcie oznacza przejście na wyższy poziom energii.
Wpływ promieni jonów pierwiastków na właściwości tworzących się przez nie związków można zobrazować na przykładzie wzrostu kwasowości kwasów halogenowodorowych w fazie gazowej: HI > HBr > HCl > HF.
W tych związkach siła przyciągania kulombowskiego zależy od promienia kulombowskiego, który jest sumą promieni jonów halogenowych i wodorowych. Oczywiście wraz ze wzrostem promienia halogenu siła przyciągania Coulomba maleje, co sprawia, że abstrakcja protonów jest bardziej korzystna.
Przykłady rozwiązywania typowych problemów.
Przykład 1.Zestawienie elektronicznych i elektronowo-graficznych wzorów atomów pierwiastków, wzorów cząsteczkowych odpowiednich tlenków i wodorotlenków według numeru pierwiastka w układzie okresowym.
Zadanie. Konstruuj wzory elektroniczne i elektronograficzne atomów pierwiastków nr 35 i nr 73 oraz podaj wzory cząsteczkowe tworzących się przez nie tlenków, wodorotlenków i soli.
Rozwiązanie.
Wzory elektroniczne pokazują rozkład elektronów w atomie na poziomach energii i podpoziomach. Formułę elektroniczną oznaczono symbolami  , Gdzie
, Gdzie  – główna liczba kwantowa,
– główna liczba kwantowa,  – orbitalna liczba kwantowa (zamiast tego należy podać odpowiednie oznaczenie literowe –
– orbitalna liczba kwantowa (zamiast tego należy podać odpowiednie oznaczenie literowe –  ),
), – liczba elektronów w danym podpoziomie. Kolejność napełniania atomu wieloelektronowego opiera się na zasadzie najmniejszej energii, zgodnie z którą w pierwszej kolejności zapełniane są orbitale o najniższym poziomie energii. Realizacja tej zasady odbywa się w oparciu o reguły Klechkowskiego i zgodnie z pierwszą zasadą orbitale atomowe są wypełniane elektronami w kolejności rosnącej sumy
– liczba elektronów w danym podpoziomie. Kolejność napełniania atomu wieloelektronowego opiera się na zasadzie najmniejszej energii, zgodnie z którą w pierwszej kolejności zapełniane są orbitale o najniższym poziomie energii. Realizacja tej zasady odbywa się w oparciu o reguły Klechkowskiego i zgodnie z pierwszą zasadą orbitale atomowe są wypełniane elektronami w kolejności rosnącej sumy  ; według drugiego - jeśli suma jest równa
; według drugiego - jeśli suma jest równa  dla różnych poziomów energii w pierwszej kolejności zapełniane są orbitale o niższej głównej liczbie kwantowej P.
dla różnych poziomów energii w pierwszej kolejności zapełniane są orbitale o niższej głównej liczbie kwantowej P.
Zastosowanie tych zasad do atomu wieloelektronowego prowadzi do następującej sekwencji wypełniania jego poziomów i podpoziomów energetycznych:
1s2s2p3s3p4s3d4p5s4d5p6s(5d 1)4f
5d6p7s (6d 3-2)5f6d7p.
Położenie pierwiastków w układzie okresowym nadaje mu następujące cechy: numer seryjny pierwiastka, numer okresu, numer grupy, podgrupy (głównej lub drugorzędnej). Każda z tych cech jest jednoznacznie powiązana ze strukturą atomową pierwiastka.
Liczba atomowa pierwiastka wskazuje liczbę elektronów, liczba okresu wskazuje liczbę poziomów energii. Numer grupy pierwiastków głównych podgrup wskazuje liczbę elektronów na zewnętrznym poziomie energii i najwyższym dodatnim stopniu utlenienia. Dla elementów podgrup bocznych numer grupy wskazuje jedynie najwyższy dodatni stopień utlenienia, natomiast liczba elektronów na zewnętrznym poziomie energetycznym może wynosić 1 lub 2.
W związku z powyższym wzory elektroniczne dla pierwiastków nr 35 (Br) i nr 73 (Ta) mają następującą postać:
35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
73 Ta 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 3 6s 2
Strukturę elektronową atomu można również przedstawić graficznie za pomocą komórek energetycznych lub kwantowych, które są schematycznym przedstawieniem orbitali atomowych (AO).
DO

Zgodnie z regułą Hunda orbitale danego podpoziomu zapełniane są najpierw przez jeden elektron o tych samych spinach, a następnie przez drugi elektron o przeciwnych spinach.
Schemat graficzny tych elementów przedstawia się następująco:
Br jest w grupie VIIA ponieważ wszystkie jego elektrony walencyjne znajdują się na zewnętrznym poziomie energii. W związku z tym Br jest niemetalem, tlenek bromu (VII) Br 2 O 7 wykazuje właściwości tlenku kwasowego, jego odpowiednim wodorotlenkiem jest kwas bromowy HBrO 4, nadbromian sodu NaBrO 4. Ponieważ na zewnętrznym poziomie energii znajduje się 7 elektronów, zdobywając jeden elektron, brom ma niski stopień utlenienia –1. Połączenia odpowiadające  :HBr, KBr.
:HBr, KBr.
Tantal jest pierwiastkiem D, dlatego może wykazywać zmienne stopnie utlenienia i tworzyć kilka tlenków i wodorotlenków, których charakter zależy od stopnia utlenienia. Najbardziej typowymi związkami tantalu są te, których stopień utlenienia wynosi +5. Tlenek tantalu (V) wykazuje właściwości tlenku kwasowego, jego wzór to Ta 2 O 5, odpowiadający mu wodorotlenek to kwas tantalowy HTaO 3, sól KTaO 3. Najniższy stopień utlenienia tantalu wynosi +2. Tlenek i wodorotlenek Ta(II) wykazują podstawowe właściwości. Połączenia odpowiadające  : TaO, Ta(OH) 2, Ta(NO 3) 2.
: TaO, Ta(OH) 2, Ta(NO 3) 2.
Przykład 2.Wyznaczanie położenia pierwiastka w układzie okresowym pierwiastków chemicznych za pomocą jego wzoru elektronicznego.
Zadanie. Określ pierwiastek, jego położenie w układzie okresowym, jeśli jego wzór elektroniczny jest następujący: ...5S 2 5 P 2 .
Rozwiązanie. Istnieją dwa sposoby identyfikacji pierwiastka i znalezienia jego położenia w układzie okresowym.
Pierwszy sposób: określ liczbę elektronów i wskaże liczbę atomową pierwiastka. Formuła elektroniczna odpowiadająca temu elementowi jest następująca:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 2,
ponieważ liczba elektronów wynosi 50, zatem jest to cyna. Znajduje się w piątym okresie, czwartej grupie, głównej podgrupie.
Drugi sposób: ten element znajduje się w piątym okresie, ponieważ ma strukturę zewnętrznego poziomu energii 5s 2 5p 2. Na zewnętrznym poziomie energii znajdują się 4 elektrony, stąd znajduje się w grupie IVA. Pierwiastkiem odpowiadającym tym współrzędnym jest cyna.
Przykład 3. Sporządzanie wzorów elektronicznych atomów pierwiastków na podstawie wartości liczb kwantowych elektronów w warstwie zewnętrznej.
Zadanie. Zapisz wzór elektroniczny atomu pierwiastka i nazwij go, jeśli liczby kwantowe pierwiastków w zewnętrznej warstwie elektronowej są następujące: N=4, l=1, M l =-1, M S =+1/2; N=4, l=1, M l =0, M S =+1/2; N=4, l=1, M l =1, M S =+1/2.
Rozwiązanie. Stan każdego elektronu na zewnętrznym poziomie energii jest określony przez następujący zestaw liczb kwantowych:
Główną liczbą kwantową jest cztery, dlatego elektrony znajdują się na 4. poziomie energetycznym. Orbitalna liczba kwantowa określa kształt orbitalu. Jeśli l=1 , wówczas orbital nazywa się orbitalem p, dlatego trzy elektrony znajdują się na podpoziomie p 4. poziomu energii. Magnetyczna liczba kwantowa M l(-1, 0, +1) określa orientację orbity w przestrzeni. Wszystkie trzy orbitale p (p x, p y, p z) zawierają jeden elektron ( M S=+1/2). Zewnętrzny poziom energii atomu tego pierwiastka zawiera pięć elektronów: ...4s 2 4p 3. Atom arsenu Podobnie jak ta elektroniczna konfiguracja zewnętrznego poziomu energii, której wzór elektroniczny jest następujący: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3.
Przykład 4.Sporządzanie elektronicznych receptur substancji na podstawie wartości numeru seryjnego elementu.
Zadanie. Utwórz wzory elektroniczne na atom pierwiastka o numerze seryjnym 40. Podaj rozkład elektronów atomu tego pierwiastka pomiędzy ogniwami kwantowymi (energetycznymi).
Rozwiązanie. Element o numerze seryjnym 40 – cyrkon Zr. W związku z tym 40 elektronów należy umieścić na poziomach elektronowych i odpowiadających im podpoziomach (orbitale).
Zgodnie z zasadami wypełniania atomu wieloelektronowego, umieszczanie na nim elektronów zaczynamy od najniższego poziomu energii, N=1 . Odpowiada pojedynczej wartości liczby orbitalnej l=0, określenie sferycznego kształtu orbitalu (podpoziomu s). Magnetyczna liczba kwantowa określona przez wartość l (-l, ...0,…+l) również przyjmuje w tym przypadku jedną wartość M l =0 , co wskazuje na obecność pojedynczego orbitalu (s-orbitalu) na tym podpoziomie. Zgodnie z regułą Pauliego na jednym orbitalu (i odpowiednio podpoziomie s) mogą zmieścić się maksymalnie dwa elektrony o spinowych liczbach kwantowych M S =+1/2 I M S =-1/2. Od omawianego poziomu (N=1) i odpowiedni podpoziom s po umieszczeniu na nim dwóch elektronów zostanie wyczerpany (1s 2), przechodzimy na kolejny poziom energii N=2. Poziom ten odpowiada dwóm podpoziomom, charakteryzującym się wartościami l=0 I l=1 . Jak wspomniano powyżej, wartość l=0 definiuje podpoziom s, który może pomieścić maksymalnie dwa elektrony 2s 2. Następny podpoziom zdefiniowany przez wartość l=1 nazywany jest podpoziomem p. Odpowiada orbitalowi w kształcie hantli (orbital p). Dla l=1 magnetyczna liczba kwantowa przyjmuje trzy wartości -1, 0 i +1. Te trzy wartości określają obecność trzech orbitali na podpoziomie p, z których każdy może przyjąć maksymalnie dwa elektrony. Oznacza to, że na podpoziomie p ( l=1) można umieścić maksymalnie sześć elektronów (2p 6). Zatem na pierwszych dwóch poziomach energii (n=1, n=2) umieścimy 10 elektronów: 1s 2 2s 2 2p 6. Przejdźmy do następnego poziomu, n=3. Na tym poziomie istnieją trzy podpoziomy, które odpowiadają wartościom l: 0, 1, 2 (l=0,1…..n-1). Podpoziom 3s ( l=0) tego poziomu, jak każdy podpoziom s, zawiera maksymalnie 2 elektrony (3s 2). Podpoziom 3p ( l=1) – 6 elektronów (3p 6). Wraz z dalszym zapełnianiem atomu wieloelektronowego pojawia się dylemat: gdzie umieścić kolejne elektrony – na 3d ( l=2) lub 4s ( l=0) podpoziom? Tutaj kierujemy się pierwszą zasadą Klechkowskiego, zgodnie z którą najpierw wypełniany jest podpoziom odpowiadający mniejszej wartości sumy n+ l. Dla podpoziomu 3d suma ta wynosi 3+2=5, a dla poziomu 4d 4+0=4. Dlatego wypełniamy podpoziom 4s 4s 2 . Następnie należy rozwiązać dylemat, w którym podpoziomie umieścić kolejne elektrony: 3d czy 4p. Obydwa te podpoziomy odpowiadają tej samej wartości n+ l=5. Tutaj kierujemy się drugą zasadą Klechkowskiego, zgodnie z którą, jeśli suma n+ jest równa l Najpierw wypełniany jest podpoziom odpowiadający mniejszej wartości n. Wypełnia zatem podwarstwę 3d. Dowolny podpoziom d ( l=2) zawiera 5 orbitali, które odpowiadają zbiorowi wartości m: -2, -1, 0, +1, +2. Maksymalna liczba elektronów znajdujących się na tym podpoziomie wynosi 5,2=10 (3d 10). Doszliśmy zatem do sytuacji, w której trzy pierwsze poziomy (n=1, n=2, n=3) zostają całkowicie wyczerpane i zapełniony zostaje podpoziom s poziomu 4: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2. Do wypełnienia wykorzystano 30 elektronów, pozostawiając kolejnych 10. Kolejnym podpoziomem do wypełnienia jest podpoziom 4p (ale nie 5s – patrz druga zasada Klechkowskiego). Odpowiada to orbitalom 3p, na których umieszczamy sześć elektronów. Następnie wypełniamy podpoziom 5s (dwa elektrony) i dochodzimy do sytuacji 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 . Pozostałe dwa elektrony umieszczamy (kierując się pierwszą regułą Klechkowskiego) na podpoziomie 4d i dochodzimy do wzoru elektronicznego atomu cyrkonu: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 . Odpowiada to graficznej formule elektronicznej
Przy umieszczaniu ostatnich elektronów na podpoziomie 4d zastosowano regułę Hunda, zgodnie z którą orbitale odpowiedniego podpoziomu zapełniane są najpierw jednym elektronem o tym samym spinie na różnych orbitali, a następnie drugim elektronem o przeciwnym spinie w tych orbitale.
Przykład 5. Określanie pierwiastków na podstawie budowy zewnętrznych i przedostatnich warstw elektronowych ich atomów.
Zadanie. Atomy, których pierwiastki mają następującą budowę zewnętrznej i przedostatniej warstwy elektronowej:
A) 2s 2 P 6 3s 2 15:00 1 ;
B) 3s 2 15:00 6 3d 3 4s 2 ;
V) 4s 2 16:00 6 4d 10 5s 0 .
Rozwiązanie. Gdy A Mamy do czynienia z niewypełnionym podpoziomem p 3. poziomu energetycznego, który zawiera jeden elektron i odpowiada pierwszemu elementowi p 3. poziomu energetycznego. To jest 13 Al. Jego w pełni elektroniczny wzór to 1s 2 2s 2 p 6 3s 2 p 1.
Wydarzenie B odpowiada niewypełnionemu podpoziomowi d trzeciego poziomu energii. Ponieważ warstwa zewnętrzna zawiera maksymalną liczbę s-elektronów (4s 2), to biorąc pod uwagę 3 elektrony w niewypełnionym podpoziomie 3d, odpowiada to 3. elementowi d 4. okresu, czyli 23 V. Jego suma wzór na elektron: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2.
Wydarzenie V odpowiada całkowicie wypełnionemu podpoziomowi 4d (10 elektronów), ale zewnętrzny podpoziom 5s jest pusty. Oznacza to, że doszło do awarii 2 elektronów z podpoziomu 5s- do podpoziomu 4d, co odpowiada ósmemu elementowi d (10-2=8) w piątym okresie. Ten element ma 46 Pd. Jego w pełni elektroniczny wzór to: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 0.
Przykład 6.Określanie rodzaju rozpadu promieniotwórczego na podstawie bilansu mas i ładunków cząstek początkowych i produktów końcowych.
Zadanie. Jaki rodzaj przemiany radioaktywnej nastąpił w następujących przejściach jądrowych:
A) 111 Pd → 111 AgB) 222 Rn → 218 Po
Rozwiązanie . Gdy A masa jądra zostaje zachowana, ale numer seryjny, a zatem ładunek jądra atomowego, wzrasta o 1. Sytuacja ta odpowiada rozpadowi β, ponieważ zgodnie z prawem zachowania ładunku wzrost ładunku jądra atomowego o 1 musi być zrównoważony jednostkowym ładunkiem ujemnym, którego nośnikiem jest elektron (cząstka ß). Jednocześnie masa elektronu jest pomijalnie mała w porównaniu z masą któregokolwiek z nukleonów (protonu lub neutronu), a rozpad ß nie prowadzi do zmiany w jądrze atomowym:
 Pd
→
Pd
→
 Ag+ ß -
Ag+ ß -
Gdy B masa atomu polonu powstająca w wyniku reakcji jądrowej więcej masy pierwotnego radonu o 4 jednostki, a ładunek jądrowy w wyniku reakcji jądrowej zmniejsza się o 2. Ta różnica masy i ładunku odpowiada uwolnieniu  -cząsteczki:
-cząsteczki:

Przykład 7. Zmiany właściwości pierwiastków w długich okresach układu okresowego.
Zadanie. Jaki jest charakter zmiany właściwości pierwiastków w czwartym okresie układu okresowego?
Rozwiązanie. Czwarty okres zawiera 18 elementów od K (z=19) do Kr (z=36). W atomach pierwiastków trzeciego okresu tylko orbitale s i p trzeciego poziomu energetycznego są wypełnione elektronami, dziesięć orbitali d pozostaje wolnych. Ale atomy pierwiastków czwarty okres Orbital 4s zaczyna być wypełniony elektronami (w obecności wolnych orbitali d), ponieważ jądro jest ekranowane przez gęstą warstwę elektronów 3s 2 3p 6. Wypełnianie powłoki d trzeciego poziomu rozpoczyna się w Sc (z=21) i 3d 1, a kończy w Cu (z=29) 3d 10. Stopniowe wypełnianie elektronami orbitali d trzeciego poziomu zostaje zakłócone w atomach Cr i Cu, w wyniku czego elektron „zawodzi” w stanie s (od czwartego) zewnętrznego poziomu energii do przedostatniego (trzeciego). Dziesięć pierwiastków czwartego okresu (Sc-Zn), w których atomach zbudowana jest powłoka d trzeciego (przedostatniego) poziomu, nazywa się przejściowymi. Po cynku do kryptonu trwa wypełnianie orbitali p czwartego poziomu energetycznego.
W czwartym okresie pomiędzy typowym metalem (K) a typowym niemetalem (Br) znajduje się 15 pierwiastków (a nie pięć, jak np. w trzecim okresie), z czego 10 to pierwiastki przejściowe. Elementy przejściowe, w których atomach wypełnione są powłoki d przedostatniego poziomu, mniej różnią się między sobą właściwościami niż elementy o małych okresach. W dużych okresach, zwłaszcza w czwartym, osłabienie właściwości metalicznych pierwiastków następuje wolniej niż w małych okresach (dopiero pod koniec okresu stwierdza się niemetale). W dużych okresach większość pierwiastków to metale.
Przykład 8. Zmiany właściwości pierwiastków podgrup głównych i drugorzędnych układu okresowego.
Zadanie. Jak zmieniają się właściwości metaliczne pierwiastków z głównej i podgrupy układu okresowego wraz ze wzrostem ładunku jądra atomowego pierwiastka?
Rozwiązanie. Główne podgrupy w grupach układu okresowego są utworzone przez pierwiastki s i p, a podgrupy drugorzędne są utworzone przez pierwiastki d.
W głównych podgrupach wraz ze wzrostem ładunku jądra atomu pierwiastka zwiększa się promień atomu pierwiastka, ponieważ w tym kierunku zwiększa się liczba warstw elektronowych w atomie pierwiastka. Dlatego w podgrupie głównej właściwości metaliczne (redukujące) pierwiastków rosną od góry do dołu.
W podgrupach bocznych przy przejściu od pierwszego elementu do drugiego promień atomu pierwiastka wzrasta, a przy przejściu od drugiego elementu do trzeciego następuje nawet nieznaczny spadek. Wyjaśnia to kompresja f- (lantanowca). Dlatego w podgrupach bocznych, wraz ze wzrostem ładunku jądrowego, właściwości metaliczne maleją (z wyjątkiem podgrupy bocznej trzeciej grupy).
Dlatego w ramach jednej grupy właściwości elementów podgrupy głównej i drugorzędnej są różne. Różnice we właściwościach pierwiastków podgrupy głównej i drugorzędnej są znaczne dla pierwszej grupy, następnie słabną. Zatem elementy głównej i drugorzędnej podgrupy trzeciej grupy mają stosunkowo podobne właściwości. Następnie ta różnica właściwości ponownie się zwiększa i staje się bardzo znacząca w siódmej grupie, gdzie pierwiastki podgrupy Mn bardzo różnią się od halogenów.
Przykład 9. Prognozowanie zmian właściwości związków pierwiastków na podstawie zmian elektroujemności tych pierwiastków.
Zadanie. Jak zmieni się moc kwasów w szeregu?HOCl → HOBr → HOI? Jak zmienią się właściwości utleniające tych kwasów?
Rozwiązanie. Właściwością określającą siłę kwasów tej serii jest elektroujemność atomów halogenu. Im większa elektroujemność halogenu, tym bardziej stabilizowany jest anion kwasowy (O–Hal) – powstający w wyniku aktu oddania protonu, czyli wprowadzenia kwasowości. Ponieważ elektroujemność atomów halogenu zmienia się w kolejności Cl > Br > I, kwasowość kwasów zmienia się symbatycznie: HOCl > HOBr > HOI. Realizacja właściwości utleniających HOHal opiera się również na elektroujemności, ponieważ akt przyjmowania elektronów jest ułatwiony przez zdolność atomu do przyciągania elektronów. Dlatego właściwości utleniające tych kwasów są zgodne z szeregiem: HOCl > HOBr > HOI.
Przykład 10.Przewidywanie zmian właściwości połączeń elementów na podstawie zmian promieni tych elementów.
Zadanie. Jak zmieniają się w szeregu podstawowe właściwości i rozpuszczalność wodorotlenków metali alkalicznych w wodzieLiOH → CsOH?
Rozwiązanie. Zasadowość wodorotlenków polega na ich zdolności do eliminowania anionu wodorotlenkowego. Im silniej ten anion jest związany z kationem metalu, tym mniej zasadowy jest wodorotlenek. Ponieważ promień kationu wzrasta w szeregu LiOH → CsOH, zwiększa się również odległość między środkami ładunku kationu metalu a anionem wodorotlenkowym (promień Coulomba). Prowadzi to do osłabienia sił przyciągania Coulomba pomiędzy przeciwnie naładowanymi cząstkami i zwiększenia zdolności wodorotlenku do wytwarzania anionu wodorotlenkowego. Dlatego w szeregu LiOH → CsOH zasadowość wzrasta.
Jednocześnie wraz ze wzrostem promienia Coulomba wzrasta stopień polaryzacji pary kation metalu – anion wodorotlenkowy, a w konsekwencji zdolność tej pary do hydratacji i późniejszej dysocjacji. Prowadzi to do wzrostu rozpuszczalności wodorotlenków w szeregu LiOH → CsOH.