Ферменты, Фермент-субстратный комплекс и Энергия активации
Важнейшей функцией белков является каталитическая, ее выполняет определенный класс белков – ферменты. В организме выявлено более 2000 ферментов. Ферменты – это биологические катализаторы белковой природы, которые значительно ускоряют биохимические реакции. Так, ферментативная реакция происходит в 100-1000 раз быстрее, чем без ферментов. Многими свойствами они отличаются от катализаторов, использующихся в химии. Ферменты ускоряют реакции при обычных условиях, в отличие от химических катализаторов.
В организме человека и животных за несколько секунд происходит сложная последовательность реакций, для проведения которой с применением обычных химических катализаторов требуется продолжительное время (дни, недели или даже месяцы). В отличие от реакций без ферментов, в ферментативных не образуются побочные продукты (выход конечного продукта – почти 100 %). В процессе преобразований ферменты не разрушаются, поэтому небольшое их количество способно катализировать химические реакции большого количества веществ. Все ферменты – белки и имеют характерные для них свойства (чувствительность к изменениям pH среды, денатурация при высоких температурах и т. п.).
Ферменты по химической природе разделяют на однокомпонентные (простые) и двухкомпонентные (сложные) .
Однокомпонентные (простые)
Однокомпонентные ферменты состоят только из белков. К простым принадлежат преимущественно ферменты, которые осуществляют реакции гидролиза (пепсин, трипсин, амилаза, папаин и т. п.).
Двухкомпонентные (сложные)
В отличие от простых, сложные ферменты содержат небелковую часть – низкомолекулярный компонент. Белковая часть называется апоферментом (носителем фермента), небелковая – коферментом (активной или простетичной группой). Небелковая часть ферментов может быть представлена или органическими веществами (например, производными витаминов, НАД, НАДФ, уридиновыми, цитидиловыми нуклеотидами, флавинами), или неорганическими (например, атомами металлов – железа, магния, кобальта, меди, цинка, молибдена и т. п.).
Не все необходимые коферменты могут синтезироваться организмами и потому должны поступать с пищей. Отсутствие витаминов в пище человека и животных служит причиной потери или снижения активности тех ферментов, в состав которых они входят. В отличие от белковой части органические и неорганические коферменты очень стойкие к неблагоприятным условиям (высокой или низкой температурам, излучению и т.п.) и могут отделяться от апофермента.
Характеризуются ферменты высокой специфичностью: могут превращать лишь соответствующие субстраты и катализировать лишь определенные реакции одного типа. Определяет ее белковый компонент, но не вся его молекула, а лишь ее небольшой участок – активный центр . Структура его отвечает химическому строению веществ, которые вступают в реакцию. Для ферментов характерно пространственное соответствие между субстратом и активным центром. Они подходят друг другу, как ключ замку. Активных центров может быть несколько в одной молекуле фермента. Активный центр, то есть место соединения с другими молекулами, есть не только у ферментов, а и у некоторых других белков (гем в активных центрах миоглобина и гемоглобина). Протекают ферментативные реакции в виде последовательных этапов – от нескольких до десятков.
Активность сложных ферментов проявляется лишь тогда, когда белковая часть соединяется с небелковой. Также их активность проявляется лишь при определенных условиях: температуры, давления, pH среды и т. п. Ферменты разных организмов наиболее активны при температуре, к которой приспособлены эти существа.
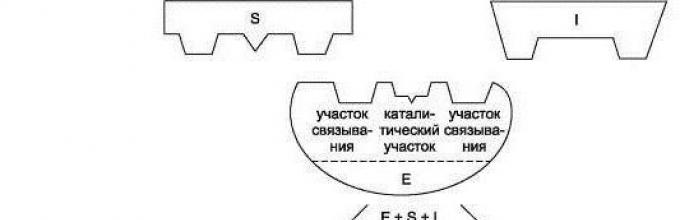
Фермент-субстратный комплекс
Связи субстрата с ферментом образуют фермент-субстратный комплекс.
При этом он изменяет не только собственную конформацию, а и конформацию субстрата. Ферментативные реакции могут тормозиться собственными продуктами реакции – при накоплении продуктов скорость реакции снижается. Если продуктов реакции мало, то фермент активируется.
Вещества, проникающие в область активного центра и блокирующие каталитические группы ферментов, называются ингибиторами (от лат. inhibere – сдерживать, останавливаться). Активность ферментов снижают ионы тяжелых металлов (свинец, ртуть и т.п.).
Ферменты уменьшают энергию активации, то есть уровень энергии, необходимый для придания реакционной способности молекулам.
Энергия активации
Энергия активации – это энергия, которая расходуется на разрыв определенной связи для химического взаимодействия двух соединений. Ферменты имеют определенное расположение в клетке и организме в целом. В клетке ферменты содержатся в определенных ее частях. Многие из них связаны с мембранами клеток или отдельных органелл: митохондрий, пластид и т. п.
Биосинтез ферментов организмы способны регулировать. Это позволяет поддерживать относительно постоянный их состав при значительных изменениях условий окружающей среды и частично видоизменять ферменты в ответ на такие изменения. Действие разных биологически активных веществ–гормонов, лекарственных препаратов, стимуляторов роста растений, ядов и т. п. – заключается в том, что они могут стимулировать или подавлять тот или иной ферментативный процесс.
Некоторые ферменты принимают участие в активном транспорте веществ через мембраны.
Для названий большинства ферментов характерен суффикс -аз- . Его прибавляют к названию субстрата, с которым взаимодействует фермент. Например, гидролазы – катализируют реакции расщепления сложных соединений на мономеры за счет присоединения молекулы воды в месте разрыва химической связи молекулах белков, полисахаридов, жиров; оксидредуктазы – ускоряют окислительно-восстановительные реакции (перенесение электронов или протонов); изомеразы – способствуют внутренней молекулярной перестройке (изомеризации), преобразованию изомеров и т. п.
Как сказал один студент на экзамене по биологической химии, «фермент - это когда чего-то совсем мало, а оно может гору своротить». Студента за такое определение не похвалили, а ведь суть вещей была им уловлена правильно - ферменты ускоряют во много раз реакцию между веществами, которая без них либо вообще не происходит, либо происходит во много раз медленнее.
Первым ферментом, обладающим литическим действием на клеточные стенки бактерий, был лизоцим, открытый в 1922 году знаменитым английским микробиологом Александром Флемингом, который впервые обнаружил лизоцим во многих тканях и выделениях животных организмов и предположил, что он является защитным средством, позволяющим бороться высшим организмам с имеющимися в среде их обитания патогенными бактериями. Интересно отметить, что это открытие Флеминга сделано почти на 10 лет раньше его второго, более знаменитого научного достижения - обнаружения и расшифровки структуры (совместно с Х.У. Флори и Э.Б. Чейном) пенициллина, первого и наиболее широко используемого впоследствии антибиотика. Первые сообщения о том, что и бактерии обладают способностью вырабатывать бактериолитические ферменты, начали появляться уже в начале 50-х годов. К настоящему времени они обнаружены у всех исследованных бактерий.
При этом фермента, по сравнению с количеством взаимодействующих веществ, может быть ничтожно мало - по весу в миллионы раз меньше. И, что особенно интересно, фермент не убывает в количестве: одна его молекула может много раз обслужить реакцию и снова быть готовой к работе (так хорошая мельница будет вновь и вновь смалывать новые зерна без заметного износа жерновов).
Значит, эти особые соединения относятся к числу катализаторов - ускорителей химических реакций. Такие катализаторы известны и в неживой природе, поэтому те, которые есть только у живых существ, называются биокатализаторами. По составу они - белки. Для каждой реакции нужен свой фермент: он подходит к ней, как ключ к замку. Поэтому таких белков-катализаторов у растений, животных и микробов великое множество.
Пока, правда, не вполне изучен еще механизм, с помощью которого происходит реакция. Некоторые ученые считают, что крупные молекулы фермента - это нечто вроде площадки для встреч молекул веществ, участвующих в реакции. Есть и другие предположения. Мы не будем их разбирать, а сделаем общий вывод: для жизнедеятельности любого организма нужно много ферментов, и от их набора заннгит в том числе и способ питания микроорганизма.
Те микробы, для питания которых нужны лишь неорганические соединения - кислород, растворы некоторых солей, сера, - называются аутотрофами (в переводе на русский язык это название означает: те, кто сами себя кормят).
Аутотрофы строят свои белки и нуклеиновые кислоты, можно сказать, из ничего - из азотистых соединений, воды, кислорода... Это все равно, что построить пирамиду Хеопса из крохотных кирпичиков (а не из многотонных каменных блоков, из которых она сложена на самом деле). Можно даже подсчитать, во сколько раз вся «пирамида» (скажем, огромная, молекула дезоксирибонуклеиновой кислоты - и название-то какое длинное!) больше одного «кирпичика» - молекулы углекислого газа или аммиака.
Молекулярный вес дезоксирибонуклеиновой кислоты (ее обычно называют сокращенно - ДНК) у бактерий равен 1000 миллионам; молекулярный вес углекислого газа - 44. Значит, вся «постройка» больше «кирпича» в 20 миллионов раз (можно напомнить, что на многоэтажный дом сейчас тратят около 100 тысяч кирпичей). И «возводится» вся молекулярная постройка за какие-нибудь полчаса (срок, нужный, чтобы бактериальная клетка произвела себе подобную).
Если говорить о месте нахождения бактериолитических ферментов в бактериальной культуре, то следует в первую очередь разделить их в этом отношении на три группы.
Первую группу составляют автолизины - бактериолитические ферменты, присутствующие всегда (в активном или неактивном состоянии) в самой клеточной стенке. Они принимают участие в процессе роста и дифференцировки бактериальных клеток. В клетке бактерий, по-видимому, в норме имеется взаимосвязь между активностями ферментов, разрушающих и синтезирующих компоненты клеточной стенки. Действительно, встраивание вновь синтезированных материалов в клеточную стенку не может происходить без предварительного расщепления определенных химических связей.
Процессы лизиса и биосинтеза стенки происходят одновременно с ростом и развитием бактериальной клетки и только на поздних стадиях развития, когда биосинтетические процессы затихают, а активность литических ферментов остается на прежнем уровне, происходит лизис клетки бактерий.
Ко второй группе можно отнести литические ферменты бактериальных спор. Они активируются наряду с другими ферментами, участвующими в деградации биополимеров в период споруляции (образования спор) и при прорастании спор бактерий. Данные ферменты принимают участие в процессах разрушения оболочки и как автолизины в процессах роста и морфогенеза бактериальной клетки.
Наконец, третья группа - это внеклеточные литические ферменты. Биологическая роль их заключается, по-видимому, в том, что бактерии, синтезирующие и секретирующие такие ферменты в среду, имеют преимущество перед другими бактериями, прежде всего в источниках питания. Разрушая клетки других бактерий, бактерия - продуцент литических ферментов использует аминокислоты, углеводы и другие компоненты лизированной клетки для собственных нужд. Кроме того, данная группа бактериолитических ферментов играет безусловно важную роль для защиты клеток, секретирующих эти ферменты в среду, от других бактерий, обитающих в той же экологической нише.
В клетке любого живого организма протекают миллионы химических реакций. Каждая из них имеет большое значение, поэтому важно поддерживать скорость биологических процессов на высоком уровне. Почти каждая реакция катализируется своим ферментом. Что такое ферменты? Какова их роль в клетке?
Ферменты. Определение
Термин "фермент" происходит от латинского fermentum - закваска. Также они могут называться энзимами от греческого en zyme - "в дрожжах".
Ферменты - биологически активные вещества, поэтому любая реакция, протекающая в клетке, не обходится без их участия. Эти вещества выполняют роль катализаторов. Соответственно, любой фермент обладает двумя основными свойствами:
1) Энзим ускоряет биохимическую реакцию, но при этом не расходуется.
2) Величина константы равновесия не меняется, а лишь ускоряется достижение этого значения.
Ферменты ускоряют биохимические реакции в тысячу, а в некоторых случаях в миллион раз. Это значит, что при отсутствии ферментативного аппарата все внутриклеточные процессы практически остановятся, а сама клетка погибнет. Поэтому роль ферментов как биологически активных веществ велика.
Разнообразие энзимов позволяет разносторонне регулировать метаболизм клетки. В любом каскаде реакций принимает участие множество ферментов различных классов. Биологические катализаторы обладают большой избирательностью благодаря определенной конформации молекулы. Т. к. энзимы в большинстве случаев имеют белковую природу, они находятся в третичной или четвертичной структуре. Объясняется это опять же специфичностью молекулы.
Функции энзимов в клетке
Главная задача фермента - ускорение соответствующей реакции. Любой каскад процессов, начиная с разложения пероксида водорода и заканчивая гликолизом, требует присутствия биологического катализатора.
Правильная работа ферментов достигается высокой специфичностью к определенному субстрату. Это значит, что катализатор может ускорять только определенную реакцию и никакую больше, даже очень похожую. По степени специфичности выделяют следующие группы энзимов:
1) Ферменты с абсолютной специфичностью, когда катализируется только одна-единственная реакция. Например, коллагеназа расщепляет коллаген, а мальтаза расщепляет мальтозу.
2) Ферменты с относительной специфичностью. Сюда входят такие вещества, которые могут катализировать определенный класс реакций, к примеру, гидролитическое расщепление.
Работа биокатализатора начинается с момента присоединения его активного центра к субстрату. При этом говорят о комплементарном взаимодействии наподобие замка и ключа. Здесь имеется в виду полное совпадение формы активного центра с субстратом, что дает возможность ускорять реакцию.
Следующий этап заключается в протекании самой реакции. Ее скорость возрастает благодаря действию ферментативного комплекса. В конечном итоге мы получаем энзим, который связан с продуктами реакции.
Заключительный этап - отсоединение продуктов реакции от фермента, после чего активный центр вновь становится свободным для очередной работы.
Схематично работу фермента на каждом этапе можно записать так:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P , где S - это субстрат, E - фермент, а P - продукт.

Классификация ферментов
В организме человека можно найти огромное количество ферментов. Все знания об их функциях и работе были систематизированы, и в итоге появилась единая классификация, благодаря которой можно легко определить, для чего предназначен тот или иной катализатор. Здесь представлены 6 основных классов энзимов, а также примеры некоторых подгрупп.
- Оксидоредуктазы.
Ферменты этого класса катализируют окислительно-восстановительные реакции. Всего выделяют 17 подгрупп. Оксидоредуктазы обычно имеют небелковую часть, представленную витамином или гемом.
Среди оксидоредуктаз часто встречаются следующие подгруппы:
а) Дегидрогеназы. Биохимия ферментов-дегидрогеназ заключается в отщеплении атомов водорода и переносе их на другой субстрат. Эта подгруппа чаще всего встречается в реакциях дыхания, фотосинтеза. В составе дегидрогеназ обязательно присутствует кофермент в виде НАД/НАДФ или флавопротеидов ФАД/ФМН. Нередко встречаются ионы металлов. Примерами могут служить такие энзимы, как цитохромредуктазы, пируватдегидрогеназа, изоцитратдегидрогеназа, а также многие ферменты печени (лактатдегидрогеназа, глутаматдегидрогеназа и т. д.).
б) Оксидазы. Ряд ферментов катализирует присоединение кислорода к водороду, в результате чего продуктами реакции могут быть вода или пероксид водорода (H 2 0, H 2 0 2). Примеры ферментов: цитохромоксидаза, тирозиназа.
в) Пероксидазы и каталазы - энзимы, катализирующие распад H 2 O 2 на кислород и воду.
г) Оксигеназы. Эти биокатализаторы ускоряют присоединение кислорода к субстрату. Дофамингидроксилаза - один из примеров таких энзимов.
2. Трансферазы.
Задача ферментов этой группы состоит в переносе радикалов от вещества-донора к веществу-реципиенту.
а) Метилтрансферазы. ДНК-метилтрансферазы - основные ферменты, контролирующие процесс репликации нуклеотидов играет большую роль в регуляции работы нуклеиновой кислоты.
б) Ацилтрансферазы. Энзимы этой подгруппы транспортируют ацильную группу с одной молекулы на другую. Примеры ацилтрансфераз: лецитинхолестеринацилтрансфераза (переносит функциональную группу с жирной кислоты на холестерин), лизофосфатидилхолинацилтрансфераза (ацильная группа переносится на лизофосфатидилхолин).
в) Аминотрансферазы - ферменты, которые участвуют в превращении аминокислот. Примеры ферментов: аланинаминотрансфераза, которая катализирует синтез аланина из пирувата и глутамата путем переноса аминогруппы.
г) Фосфотрансферазы. Ферменты этой подгруппы катализируют присоединение фосфатной группы. Другое название фосфотрансфераз, киназы, встречается намного чаще. Примерами могут служить такие энзимы, как гексокиназы и аспартаткиназы, которые присоединяют фосфорные остатки к гексозам (чаще всего к глюкозе) и к аспарагиновой кислоте соответственно.
3. Гидролазы - класс энзимов, которые катализируют расщепление связей в молекуле с последующим присоединением воды. Вещества, которые относятся к этой группе, - основные ферменты пищеварения.
а) Эстеразы - разрывают эфирные связи. Пример - липазы, которые расщепляют жиры.
б) Гликозидазы. Биохимия ферментов этого ряда заключается в разрушении гликозидных связей полимеров (полисахаридов и олигосахаридов). Примеры: амилаза, сахараза, мальтаза.
в) Пептидазы - энзимы, катализирующие разрушение белков до аминокислот. К пептидазам относятся такие ферменты, как пепсины, трипсин, химотрипсин, карбоиксипептидаза.
г) Амидазы - расщепляют амидные связи. Примеры: аргиназа, уреаза, глутаминаза и т. д. Многие ферменты-амидазы встречаются в
4. Лиазы - ферменты, по функции схожие с гидролазами, однако при расщеплении связей в молекулах не затрачивается вода. Энзимы этого класса всегда имеют в составе небелковую часть, например, в виде витаминов В1 или В6.
а) Декарбоксилазы. Эти ферменты действуют на С-С связь. Примерами могут служить глутаматдекарбоксилаза или пируватдекарбоксилаза.
б) Гидратазы и дегидратазы - ферменты, которые катализируют реакцию расщепления связей С-О.
в) Амидин-лиазы - разрушают С-N связи. Пример: аргининсукцинатлиаза.
г) Р-О лиазы. Такие ферменты, как правило, отщепляют фосфатную группу от вещества-субстрата. Пример: аденилатциклаза.

Биохимия ферментов основана на их строении
Способности каждого энзима определяются индивидуальным, только ему свойственным строением. Любой фермент - это, прежде всего, белок, и его структура и степень сворачивания играют решающую роль в определении его функции.
Для каждого биокатализатора характерно наличие активного центра, который, в свою очередь, делится на несколько самостоятельных функциональных областей:
1) Каталитический центр - это специальная область белка, по которой происходит присоединение фермента к субстрату. В зависимости от конформации белковой молекулы каталитический центр может принимать разнообразную форму, которая должна соответствовать субстрату так же, как замок ключу. Такая сложная структура объясняет то, что находится в третичном или четвертичном состоянии.
2) Адсорбционный центр - выполняет роль «держателя». Здесь в первую очередь происходит связь между молекулой фермента и молекулой-субстратом. Однако связи, которые образует адсорбционный центр, очень слабые, а значит, каталитическая реакция на этом этапе обратима.
3) Аллостерические центры могут располагаться как в активном центре, так и по всей поверхности фермента в целом. Их функция - регулирование работы энзима. Регулирование происходит с помощью молекул-ингибиторов и молекул-активаторов.

Активаторные белки, связываясь с молекулой фермента, ускоряют его работу. Ингибиторы же, напротив, затормаживают каталитическую активность, причем это может происходить двумя способами: либо молекула связывается с аллостерическим центром в области активного центра фермента (конкурентное ингибирование), либо она присоединяется к другой области белка (неконкурентное ингибирование). считается более действенным. Ведь при этом закрывается место для связывания субстрата с ферментом, причем этот процесс возможен только в случае практически полного совпадения формы молекулы ингибитора и активного центра.
Энзим зачастую состоит не только из аминокислот, но и из других органических и неорганических веществ. Соответственно, выделяют апофермент - белковую часть, кофермент - органическую часть, и кофактор - неорганическую часть. Кофермент может быть представлен улгеводами, жирами, нуклеиновыми кислотами, витаминами. В свою очередь, кофактор - это чаще всего вспомогательные ионы металлов. Активность ферментов определяется его строением: дополнительные вещества, входящие в состав, меняют каталитические свойства. Разнообразные виды ферментов - это результат комбинирования всех перечисленных факторов образования комплекса.

Регуляция работы ферментов
Энзимы как биологически активные вещества не всегда необходимы организму. Биохимия ферментов такова, что они могут в случае чрезмерного катализа навредить живой клетке. Для предотвращения пагубного влияния энзимов на организм необходимо каким-то образом регулировать их работу.
Т. к. ферменты имеют белковую природу, они легко разрушаются при высоких температурах. Процесс денатурации обратим, однако он может существенно повлиять на работу веществ.
pH также играет большую роль в регуляции. Наибольшая активность ферментов, как правило, наблюдается при нейтральных значениях pH (7,0-7,2). Также есть энзимы, которые работают только в кислой среде или только в щелочной. Так, в клеточных лизосомах поддерживается низкий pH, при котором активность гидролитических ферментов максимальна. В случае их случайного попадания в цитоплазму, где среда уже ближе к нейтральной, их активность снизится. Такая защита от «самопоедания» основана на особенностях работы гидролаз.
Стоит упомянуть о значении кофермента и кофактора в составе ферментов. Наличие витаминов или ионов металла существенно влияет на функционирование некоторых специфических энзимов.

Номенклатура ферментов
Все ферменты организма принято называть в зависимости от их принадлежности к какому-либо из классов, а также по субстрату, с которым они вступают в реакцию. Иногда по используют в названии не один, а два субстрата.
Примеры названия некоторых энзимов:
- Ферменты печени: лактат-дегидроген-аза, глутамат-дегидроген-аза.
- Полное систематическое название фермента: лактат-НАД+-оксидоредукт-аза.
Сохранились и тривиальные названия, которые не придерживаются правил номенклатуры. Примерами являются пищеварительные ферменты: трипсин, химотрипсин, пепсин.
Процесс синтеза ферментов
Функции ферментов определяются еще на генетическом уровне. Т. к. молекула по большому счету - белок, то и ее синтез в точности повторяет процессы транскрипции и трансляции.
Синтез ферментов происходит по следующей схеме. Вначале с ДНК считывается информация о нужном энзиме, в результате чего образуется мРНК. Матричная РНК кодирует все аминокислоты, которые входят в состав энзима. Регуляция ферментов может происходить и на уровне ДНК: если продукта катализируемой реакции достаточно, транскрипция гена прекращается и наоборот, если возникла потребность в продукте, активизируется процесс транскрипции.
После того как мРНК вышла в цитоплазму клетки, начинается следующий этап - трансляция. На рибосомах эндоплазматической сети синтезируется первичная цепочка, состоящая из аминокислот, соединенных пептидными связями. Однако молекула белка в первичной структуре еще не может выполнять свои ферментативные функции.
Активность ферментов зависит от структуры белка. На той же ЭПС происходит скручивание протеина, в результате чего образуются сначала вторичная, а потом третичная структуры. Синтез некоторых ферментов останавливается уже на этом этапе, однако для активизации каталитической активности зачастую необходимо присоединение кофермента и кофактора.
В определенных областях эндоплазматической сети происходит присоединение органических составляющих энзима: моносахаридов, нуклеиновых кислот, жиров, витаминов. Некоторые ферменты не могут работать без наличия кофермента.
Кофактор играет решающую роль в образовании Некоторые функции ферментов доступны только при достижении белком доменной организации. Поэтому для них очень важно наличие четвертичной структуры, в которой соединяющим звеном между несколькими глобулами белка является ион металла.

Множественные формы ферментов
Встречаются ситуации, когда необходимо наличие нескольких энзимов, катализирующих одну и ту же реакцию, но отличающихся друг от друга по каким-либо параметрам. Например, фермент может работать при 20 градусах, однако при 0 градусов он уже не сможет выполнять свои функции. Что делать в подобной ситуации живому организму при низких температурах среды?
Эта проблема легко решается наличием сразу нескольких ферментов, катализирующих одну и ту же реакцию, но работающих в разных условиях. Существуют два типа множественных форм энзимов:
- Изоферменты. Такие белки кодируются разными генами, состоят из разных аминокислот, однако катализируют одну и ту же реакцию.
- Истинные множественные формы. Эти белки транскрибируются с одного и того же гена, однако на рибосомах происходит модификация пептидов. На выходе получают несколько форм одного и того же фермента.
В результате первый тип множественных форм сформирован на генетическом уровне, когда второй - на посттрансляционном.
Значение ферментов
В медицине сводится к выпуску новых лекарственных средств, в составе которых вещества уже находятся в нужных количествах. Ученые еще не нашли способ стимулирования синтеза недостающих энзимов в организме, однако сегодня широко распространены препараты, которые могут на время восполнить их недостаток.
Различные ферменты в клетке катализируют большое количество реакций, связанных с поддержанием жизнедеятельности. Одними из таких энизмов являются представители группы нуклеаз: эндонуклеазы и экзонуклеазы. Их работа заключается в поддержании постоянного уровня нуклеиновых кислот в клетке, удалении поврежденных ДНК и РНК.
Не стоит забывать о таком явлении, как свертывание крови. Являясь эффективной мерой защиты, данный процесс находится под контролем ряда ферментов. Главным из них является тромбин, который переводит неактивный белок фибриноген в активный фибрин. Его нити создают своеобразную сеть, которая закупоривает место повреждения сосуда, тем самым препятствуя излишней кровопотере.
Ферменты используются в виноделии, пивоварении, получении многих кисломолочных продуктов. Для получения спирта из глюкозы могут использоваться дрожжи, однако для удачного протекания этого процесса достаточно и экстракта из них.

Интересные факты, о которых вы не знали
Все ферменты организма имеют огромную массу - от 5000 до 1000000 Да. Это связано с наличием белка в составе молекулы. Для сравнения: молекулярная масса глюкозы - 180 Да, а углекислого газа - всего 44 Да.
На сегодняшний день открыто более чем 2000 ферментов, которые были обнаружены в клетках различных организмов. Однако большинство из этих веществ до конца еще не изучено.
Активность ферментов используется для получения эффективных стиральных порошков. Здесь энзимы выполняют ту же роль, что и в организме: они разрушают органические вещества, и это свойство помогает в борьбе с пятнами. Рекомендуется использовать подобный стиральный порошок при температуре не выше 50 градусов, иначе может пойти процесс денатурации.
По статистике, 20% людей по всему миру страдает от недостатка какого-либо из ферментов.
О свойствах энзимов знали очень давно, однако только в 1897 году люди поняли, что для сбраживания сахара в спирт можно использовать не сами дрожжи, а экстракт из их клеток.
Ферменты микробиального синтеза, расщепляющие белки и углеводы
Амилоризин Ш1Х и П10Х. Высушенная культуральная масса гриба Aspergillus avamori. Содержит пектинэстеразу, декстриназу, глюкоамилазу, кислую протеазу, целлюлазу, гемицеллюлазу. Добавляют в корм из расчета 0,015 % сухой массы.
Пектаваморин ПХ, ПЗХ, П10Х (Аваморин П). Высушенная культуральная масса гриба Aspergillus avamori. Содержит пектинэстеразу, полиметилгалактэроназу, кислую протеазу, целлюлазу, гемицеллюлазу. Добавляют в корм из расчета 0,015 % сухой массы.
Протосубтилин ГЗХ. Бактериальная протеаза. Добавляют в корм крупному рогатому скоту с целью лучшего усвоения белков, углеводов и жиров из расчета 0,01 % сухой массы.
Кислая протеаза Г10Х. Протеолитический ферментный препарат, получаемый при глубинном культивировании гриба Aspergillus fostidus OV-208 путем фильтрации культуральной жидкости, осаждения фильтрата ацетоном и вакуумной сушкой. В
1 г содержится 100 ЕД. Добавляют в корм телятам из расчета
0,2 г/корм. ед.
При лечении животных с инфекционными болезнями используют ферментные препараты, лизирующие компоненты стенки микроорганизмов, которая состоит в основном из гетероизомо-пептидогликана, которого в стенке грамположительных микроорганизмов (стафилококков и стрептококков) содержится 95 %, а в стенке грамнегативных бактерий - всего 10 %. Лизис стенки микроорганизмов осуществляют три вида ферментов: амилазы, глико-зидазы, протеазы. Протеазы одновременно с лизисом белковых компонентов стенки активизируют внутриклеточные бактериальные ферменты, вызывающие внутриклеточный лизис, что усиливает противомикробный эффект.
В гинекологической практике для лечения больных фолликулярным вестибулитом, эндометритом, трихомонозом используют лизоцим. При инфекционной патологии, где этиологическим фактором являются стафилококки, применяют ферментный препарат лизостатин, а при микозных поражениях родовых путей (кандидамикоз, аспергиллез и др.) назначают копран, болбит, полученные из низших грибов. Протеолитические ферменты животного (трипсин, химотрипсин, пепсин и др.) и растительного происхождения действуют кратковременно при лечении гнойно-некротических процессов. Поскольку жизнеспособные клетки содержат много противоферментных соединений, то они не подвергаются лизису.
Более эффективны иммобилизованные ферменты. Профензим иммобилизован на водорастворимых гранулах целлюлозы, а комплексный протеолитический препарат имозин - на водорастворимом полимере.
Лизосубтилин Г10Х (Lysosubtilinum Г10Х). Светло-желтый мелкий порошок, хорошо растворимый в воде. Литическая активность его измеряется в ЕД (в 1 г 1 млн ЕД). Выпускают порошок в стеклянных пробирках по 10 г и в пакетах по 500, 1000 и 2000 г.
Применяют при лечении эндометритов у коров. Для этого
2 млн ЕД растворяют в 100 мл дистиллированной воды и вводят в
матку. Для профилактики диареи у телят препарат добавляют в
молозиво (молоко) по 20 г/л 2 раза в день на протяжении 8-10 сут. С лечебной целью добавляют в молоко 2 раза в день по 25 г до выздоровления.
Лизоцим ГЗХ (Lysocimum). Светло-серый порошок без запаха, хорошо растворяется в воде. Ферментный препарат, получаемый высушиванием культуральной жидкости продуцентов лизоцима. Содержит протеолитические ферменты.
Выпускают порошок, расфасованный в пакеты по 15 кг. Вводят внутрь. У грампозитивных и грамнегативных микроорганизмов лизирует стенку, построенную из полиаминосахаридов. Улучшает расщепление и резорбцию питательных веществ. Усиливает фагоцитарную активность нейтрофилов и стимулирует пролифератив-ные процессы.
Применяют при откорме цыплят-бройлеров, добавляя в корм из расчета 0,3 % сухой массы.
Телятам назначают в комплексной терапии при бронхопневмониях, диарее, остеодистрофии в дозе 0,15-0,2 г/кг массы животного в течение 5-20 сут. При лечении телят, больных дистрофией, препарат добавляют в молоко по 2-4 г/л 3 раза в день.
Пепсинорм. Ферментно-бактериальный препарат.
Выпускают в двух формах: пепсинорм-1- серовато-желтая жидкость со специфическим запахом, и пепсинорм-2 - порошкообразная масса кремового цвета, частично растворимая в воде с образованием гомогенных взвесей.
Нормализует пищеварение и устраняет дисбактериоз благодаря наличию бактериолитических и протеолитических ферментов.
Применяют для лечения и профилактики острых желудочно-кишечных болезней новорожденных телят. С лечебной целью 50- " 100 мл жидкого или 0,5-1 г сухого пепсинорма смешивают с 0,5 л молозива (молока) и выпаивают в подогретом виде. Одновременно можно назначать специфические терапевтические средства.