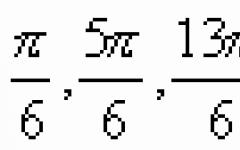(заситени јаглеводороди)
Покрај разгледувањето на хемијата на заситените јаглеводороди, ова поглавје, исто така, наведува некои основни принципи кои се клучни за практичната употреба на реакциите на сите класи на органски соединенија.
Јаглеводородите се соединенија на два вида елементи: јаглерод и водород. Тие се разликуваат во структурата на јаглеродниот скелет и во природата на врските помеѓу атомите на јаглеродот.
Класификација на јаглеводороди


2.1. Хомологни серии на алкани
Алканите– јаглеводороди со отворен ланец (алифатични), во чии молекули јаглеродните атоми се во прва валентна состојба ( сп 3) и се поврзани со едноставна (единечна) -врска едни со други и со атоми на водород, заситени или заситени јаглеводороди(СО n H 2 n +2).
Нивниот наједноставен претставник е метанот CH4. Серија (серија) соединенија кои се разликуваат едни од други по една или повеќе групи - CH 2 - се нарекува хомологни серии, а членовите на оваа серија се хомолози. Групата – CH 2 – се нарекува хомолошка разлика.
Концептот на хомологија овозможи да се систематизира огромен број соединенија и во голема мера го поедностави проучувањето на органската хемија. Хомолозите се соединенија со иста структура, слични хемиски својства и редовно различни физички својства (Табела 4).
Хомологната серија на алкани се нарекува метана серија со името на нејзиниот прв претставник. Имињата на првите четири термини од серијата се тривијални: почнувајќи од петтиот (пентан), нивните имиња се формираат од грчки бројки:
1 – моно 5 – пента 9 – нона (лат.)
Табела 4
Хомологни серии на метан (C n H 2 n+2) со нормален (неразгранет) синџир
|
Име |
Број на изомери |
|||||
|
Триаконтан |
CH 3 - CH 3 CH 3 - CH 2 - CH 3 CH 3 - (CH 2) 2 - CH 3 CH 3 - (CH 2) 3 - CH 3 CH 3 - (CH 2) 4 - CH 3 CH 3 - (CH 2) 5 - CH 3 CH 3 - (CH 2) 6 - CH 3 CH 3 - (CH 2) 7 - CH 3 CH 3 - (CH 2) 8 - CH 3 CH 3 - (CH 2) 18 - CH 3 CH 3 - (CH 2) 28 - CH 3 |
2.2. Изомеризам и номенклатура на алканите
Во зависност од неговата положба во синџирот, јаглеродниот атом може да биде примарен (поврзан со еден C, „терминален“), секундарен (поврзан со две C), терцијарен (поврзан со три C) и кватернерен (поврзан со четири Cs):

Формулата означува јаглеродни атоми: I – примарни, II – секундарни, III – терциерни, IV – кватернерни.
А атомите на водород поврзани со овие јаглероди се нарекуваат и примарни, секундарни и терциерни (нема кватернерни H).
Оваа позиција е многу важна за органската хемија, бидејќи различните јачини на C-H врските (за I, II и III, соодветно, 410, 395 и 380 kJ/mol) во голема мера ја одредуваат насоката на елиминација и замена. Ова објаснува Правило на А.М Заицева (1841–1910):
Првиот што се елиминира (заменува) е терциерниот водород, потоа секундарниот и на крајот примарниот.
Можноста за постоење на разгранети структури најпрво се јавува во случај на бутан ( n= 4) (види страница 9 - A1a), и со дополнително зголемување nбројот на можни изомери се зголемува многу брзо (види Табела 4). Јаглеводородните синџири со нормална структура содржат само примарни и секундарни јаглероди. Разгранетите синџири содржат најмалку еден терцијарен (или кватернерен) јаглерод:
CH 3 – CH 2 – CH 2 – CH 2 – CH 3


изо-пентан неопентан
Префиксот „iso“ се користи за именување соединенија во кои две метил групи се на крајот од синџирот; префиксот „нео“ укажува на присуство на три метил групи на крајот од синџирот.
Класификација
а) По базичност (т.е., бројот на карбоксилни групи во молекулата):
Монобазен (монојаглероден) RCOOH; На пример:
CH 3 CH 2 CH 2 COOH;
NOOS-CH 2 -COOH пропандиоична (малонска) киселина

Трибазичен (трикарбоксилен) R(COOH) 3 итн.
б) Според структурата на јаглеводородниот радикал:
Алифатичен
ограничување; на пример: CH 3 CH 2 COOH;
незаситени; на пример: CH 2 = CHCOOH пропеноична (акрилна) киселина

Алициклици, на пример:

Ароматични, на пример:

Заситени монокарбоксилни киселини
(монобазни заситени карбоксилни киселини) - карбоксилни киселини во кои заситен јаглеводороден радикал е поврзан со една карбоксилна група -COOH. Сите тие ја имаат општата формула C n H 2n+1 COOH (n ≥ 0); или CnH 2n O 2 (n≥1)
Номенклатура
Систематските имиња на монобазните заситени карбоксилни киселини се дадени со името на соодветниот алкан со додавање на суфиксот - ова и зборот киселина.
1. HCOOH метан (мравја) киселина
2. CH 3 COOH етаноична (оцетна) киселина
3. CH 3 CH 2 COOH пропаноична (пропионска) киселина
Изомеризам
Скелетниот изомеризам во јаглеводородниот радикал се манифестира, почнувајќи со бутаноична киселина, која има два изомери:

Меѓукласниот изомеризам се појавува почнувајќи со оцетна киселина:
CH3-COOH оцетна киселина;
H-COO-CH3 метил формат (метил естер на мравја киселина);
HO-CH2-COH хидроксиетанал (хидроксиацетични алдехид);
HO-CHO-CH2 хидроксиетилен оксид.
Хомологни серии
Тривијално име |
Име на IUPAC |
|
Мравја киселина |
Метанска киселина |
|
Оцетна киселина |
Етаноична киселина |
|
Пропионска киселина |
Пропанска киселина |
|
Бутирна киселина |
Бутаноична киселина |
|
Валеринска киселина |
Пентаноична киселина |
|
Капроична киселина |
Хексаноична киселина |
|
Енантска киселина |
Хептанска киселина |
|
Каприлна киселина |
Октанска киселина |
|
Пеларгонска киселина |
Ненаноична киселина |
|
Капринска киселина |
Деканоична киселина |
|
Недецилна киселина |
Недеканоична киселина |
|
Палмитинска киселина |
Хексадеканоична киселина |
|
Стеаринска киселина |
Октадеканоична киселина |
Киселински остатоци и киселински радикали
Остатоци од киселина |
Киселински радикал (ацил) |
|
UNDC |
НСО- |
|
CH 3 COOH |
CH 3 COO- |
|
CH 3 CH 2 COOH |
CH 3 CH 2 COO- |
|
CH 3 (CH 2) 2 COOH |
CH 3 (CH 2) 2 COO- |
|
CH 3 (CH 2) 3 COOH |
CH 3 (CH 2) 3 COO- |
|
CH 3 (CH 2) 4 COOH |
CH 3 (CH 2) 4 COO- |
Електронска структура на молекулите на карбоксилна киселина

Поместувањето на густината на електроните кон карбонилниот кислороден атом прикажан во формулата предизвикува силна поларизација O-N врски, како резултат на што се олеснува апстракцијата на атом на водород во форма на протон - во водени растворисе јавува процесот на киселинска дисоцијација:
RCOOH ↔ RCOO - + H +
Во карбоксилатниот јон (RCOO -) постои p, π-конјугација на единствениот пар електрони на кислородниот атом од хидроксилната група со p-облаци кои формираат π-врска, што резултира со делокализација на π-врската и униформа дистрибуција на негативен полнеж помеѓу двата атоми на кислород:

Во овој поглед, карбоксилните киселини, за разлика од алдехидите, не се карактеризираат со реакции на додавање.
Физички својства

Точките на вриење на киселините се значително повисоки од точките на вриење на алкохолите и алдехидите со ист број јаглеродни атоми, што се објаснува со формирањето на циклични и линеарни соработници помеѓу киселинските молекули поради водородните врски:
Хемиски својства
I. Киселински својства
Јачината на киселините се намалува по следниот редослед:
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Реакции на неутрализација
CH 3 COOH + KOH → CH 3 COOC + n 2 O
2. Реакции со основни оксиди
2HCOOH + CaO → (HCOO) 2 Ca + H 2 O
3. Реакции со метали
2CH 3 CH 2 COOH + 2Na → 2CH 3 CH 2 COONa + H 2
4. Реакции со соли на послаби киселини (вклучувајќи карбонати и бикарбонати)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2СO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Реакции со амонијак
CH 3 COOH + NH 3 → CH 3 COONH 4
II. Замена на -OH групата
1. Интеракција со алкохоли (реакции на естерификација)

2. Интеракција со NH 3 при загревање (се формираат киселински амиди)

Киселински амиди  хидролизираат за да формираат киселини:
хидролизираат за да формираат киселини:

или нивните соли:

3. Формирање на киселински халиди
Киселините хлориди се од најголемо значење. Реагенси за хлорирање - PCl 3, PCl 5, тионил хлорид SOCl 2.

4. Формирање на киселински анхидриди (интермолекуларна дехидрација)

Киселините анхидриди се формираат и со реакција на киселинските хлориди со безводни соли на карбоксилни киселини; во овој случај можно е да се добијат мешани анхидриди на различни киселини; На пример:

III. Реакции на замена на атоми на водород кај α-јаглеродниот атом

Карактеристики на структурата и својствата на мравја киселина
Структура на молекулата

Молекулата на мравја киселина, за разлика од другите карбоксилни киселини, содржи алдехидна група во својата структура.
Хемиски својства
Мравја киселина се подложува на реакции карактеристични и за киселините и за алдехидите. Прикажувајќи ги својствата на алдехидот, тој лесно се оксидира до јаглеродна киселина:
Особено, HCOOH се оксидира со раствор на амонијак од Ag 2 O и бакар (II) хидроксид Cu (OH) 2, т.е. квалитативни реакциипо алдехидна група:

Кога се загрева со концентриран H 2 SO 4 мравја киселинасе распаѓа на јаглерод моноксид (II) и вода:

Мравјата киселина е значително посилна од другите алифатични киселини бидејќи карбоксилната група во неа е поврзана со атом на водород наместо со алкил радикал кој донира електрони.
Методи за добивање на заситени монокарбоксилни киселини
1. Оксидација на алкохоли и алдехиди
Општа шема на оксидација на алкохоли и алдехиди:
KMnO 4, K 2 Cr 2 O 7, HNO 3 и други реагенси се користат како оксидирачки агенси.
На пример:
5C 2 H 5 OH + 4KMnO 4 + 6H 2 S0 4 → 5CH 3 COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2. Хидролиза на естри

3. Оксидативно расцепување на двојни и тројни врски кај алкените и алкините

Методи за добивање HCOOH (специфични)
1. Реакција на јаглерод моноксид (II) со натриум хидроксид
CO + NaOH → HCOONa натриум формат
2HCOONa + H 2 SO 4 → 2HCOON + Na 2 SO 4
2. Декарбоксилација на оксална киселина

Методи за производство на CH 3 COOH (специфични)
1. Каталитичка оксидација на бутан

2. Синтеза од ацетилен

3. Каталитичка карбонилација на метанол

4. Ферментација на етанол со оцетна киселина
Така се добива оцетна киселина за јадење.
Подготовка на повисоки карбоксилни киселини
Хидролиза на природни масти

Незаситени монокарбоксилни киселини
Најважните претставници
Општа формула на алкенските киселини: C n H 2n-1 COOH (n ≥ 2)
CH 2 = CH-COOH пропеноична (акрилна) киселина

Високи незаситени киселини
Радикалите на овие киселини се дел од растителните масла.
C 17 H 33 COOH - олеинска киселина, или цис-октадиен-9-оична киселина

Транс-Изомерот на олеинската киселина се нарекува елаидинска киселина.
C 17 H 31 COOH - линолова киселина, или цис, цис-октадиен-9,12-оична киселина

C 17 H 29 COOH - линоленска киселина, или цис, цис, цис-октадекатриен-9,12,15-оична киселина
Освен општи својствакарбоксилните киселини, незаситените киселини се карактеризираат со реакции на додавање на повеќе врски во јаглеводородниот радикал. Така, незаситените киселини, како алкените, се хидрогенизираат и ја обезбојуваат бромната вода, на пример:

Избрани претставници на дикарбоксилни киселини
Заситени дикарбоксилни киселини HOOC-R-COOH
HOOC-CH 2 -COOH пропандиоична (малонска) киселина, (соли и естери - малонати)
HOOC-(CH 2) 2 -COOH бутадиоична (сукцинска) киселина, (соли и естри - сукцинати)
HOOC-(CH 2) 3 -COOH пентадиоична (глутарична) киселина, (соли и естри - глуторати)
HOOC-(CH 2) 4 -COOH хексадиоична (адипична) киселина, (соли и естри - адипати)
Карактеристики на хемиски својства
Дикарбоксилните киселини се на многу начини слични на монокарбоксилните киселини, но се посилни. На пример, оксалната киселина е речиси 200 пати посилна од оцетната киселина.
Дикарбоксилните киселини се однесуваат како двобазни киселини и формираат две серии на соли - кисели и неутрални:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
Кога се загреваат, оксалната и маланската киселина лесно се декарбоксилираат:

1) Именувајте ги соединенијата според супститутивната номенклатура на IUPAC (a-p):
(CH3)2CH-C(CH3)2-CH(CH3)-C2H5; CH3-CH=C(CH3)2;
CH3-CH(OH)-CH(OH)-CH3; (CH3) 2 CH-CH=O;
CH3-CH2-O-C3H7; C6H5-CH2-CH2-COOH;
(CH3) 2CH-CH=C(CH3)2; CH3-C C-CH(CH3)2;
(CH3) 2 CH-CO-CH=CH2; CH3CH-C(OH)(CH3)-CH2-CH2C1;
CH3-CH(OH)-CH2-COOH; OHC-CH=CH-O-CH2-CH3;
(CH3)2C=CH-C(CH3)-C2H5; NOOC-CH2-CH(NH2)-COOH;
CH3-CHCI-CH2-CH=O; CH≡C-C(CH3)2-CO-CH3;
CH2 =CH-C(CH3)=CH2; C6H5CH=C(CH3)2;
CH2OH-(CH2)2-COOH; (CH3)2C=C(CH3)-CO-CH2-OSH3;
CH3CH=C(CH3)-C≡CH; (CH 3) 3 C-CCI 2 -CH 2 -CH 2 OH;
(CH3) 2 CH-CH(OH) –CH2-CO-C(CH3)3; ;
NOOS-C(CH 3) 2 -COOH; H2C=CH-CHO;
C3H7-(CH2)2-CH=CH-C3H7; (CH3) 3 C-CH(OH) – C(CH3) 3;
H3C-CO-CH (CH3) - CH (OH) - CH2 - CH (C2H5) - CH2OH;
(CH3) 3C-CO-H2C-CHO; H3C - CH (OH) - CH (CH3) - COOH;
C2H5-CO-CH2-CO-COOH; H2C=CH-(CH2)3-C≡CH;
H3C-O-C3H7; ![]() ;
;
CH3-CH (NH2) -CH2-COOH; CHBr2-CH=C(CH3)2;
OHC-(CH2)4-CO-CH3; HC≡С-С(СН 3) 2 -С≡СН;
![]() ; CH2OH-CH(OH)-CH2-CH2OH;
; CH2OH-CH(OH)-CH2-CH2OH;
![]() ; (C2H5)2CH-CH (C2H5)2;
; (C2H5)2CH-CH (C2H5)2;
CH2 =CH-CH=CH2; CH2 =C(C3H7)-COOH;
H3C-CO-CH (C2H5) - CH3; C2H5-O-CH2-(CH2)3-CHO;
H3C-CO –(CH2)2-CH=CH2; CH2 (OH)-CH (OH)-C2H5;
NH2-CH2-CH2-CHO; (CH3)2C(OH)-CH2-CH2-COOH;
CH C-CH2-C C-CH3; ![]() ;
;
CH2 (OH) - CH2-COOH; (CH3) 3C-C C-CH=C(CH3)2;
OSN-CH 2 - CH 2 - CHO; H3C-CH(OH)-CH=CH2;
C2H5-CH2-O-C (CH3)2-CH3; ![]() ;
;
CH2 =C=CH2; (CH3)2C = C (CH3) - C3H7;
CH3-C(CH3)2-COOH; CH2 (OH)-CH(OH)-CHO;
CH3-CH2-C C-CO-CH3; ;
CH3-CO-C(CH3)3; (CH3)3C-CO-CH2-CH(CH3)-CH(CH3)2;
CH2 =CH-CH2-CH2-COOH; CH C-CH2-OSH3;
CH2NO2-CH2-CH=CH-CH2CI; ![]() ;
;
CH3-O-C(CH3)3; CH3-CH (OH) -CH (CH3) 2;
C2H5-CO-CHO; HOCH2-CH2-CO-CH2-CH2CI;
(CH3) 2 CH-COOH; ;
ONS-SNO; NS ≡ S-S ≡ CH;
CH2 = C(CH3)-COOH; CH2 (OH)-CH(OH)-CH2-CH2OH;
CH3-CO-CH2-CH2-CH3; ;
стр)
(CH3)3C-OH; SVg3-CH(OH)-SVg3;
ONS-CH2-CH2-CHO; CH(COOH) 3;
CH3-CH=CH-C C-CH3; .
2. Напиши структурни формулиследните врски (a-p):
а) етанедијал, 2-метилбутен-1; з) 2-метилциклохексанол, 1-пентенин-4;
б) 2-пропанол, бутанедиоична киселина, j) 2-карбоксипентандиоична киселина, 3-фенилпропанол-1;
в) 3-оксопентанал, 1,3-хексадиен; л) сек – пропилбензен, 2-аминохексаноична киселина;
г) 3-хидроксипропаноична киселина, 3-хептин; л) бутанедион, хексатриен-1,3,5;
д) 2-бутеноична киселина, 2-хидроксихексанон-3; n) 1,4-пентадиин, 3-хидроксибутаноична киселина;
ѓ) 1,2-диметилбензен, метилпропанал; o) 2-метилциклохексанол, пропеноична киселина;
е) хидроксиетаноична киселина, циклохексанон; n) 4-фенил-2-бутеноична киселина; 2-терц-бутилпентадиен-1,4.
ж) 1,3-пропанедиол, 3-бутенал;
Домашна задача 2. Хемиска врска. Взаемно влијаниеатоми во молекулите на органските соединенија
1. Определете ги видовите на хибридизација на атомите на јаглерод, кислород и азот во молекулите на соединенијата подолу. Графички прикаже, земајќи ја предвид формата и просторната ориентација на атомските орбитали на атомите, дијаграм електронска структура- и - врски (атомско-орбитален модел) во овие соединенија (a-p):
а) бутен-1-во-3; ѓ) бутанал; л) пропен-2-ол-1;
б) 1-хлоробутанол-2; е) пропадиен-1,2; л) 2-хлоропропен;
в) пентадиен-1,4; ж) хексен-1-он-3; m) 2-аминопропанал;
г) пентен-1-ол-3; з) бутанедион; љ) метоксиетен;
д) пропанон; ѕ) 2-метилпропен; н) пентен-4-ал.
2. Графички означете ги електронските ефекти во конекциите подолу. Користејќи го примерот на едно соединение, разгледајте ги видовите на конјугација и напишете ја неговата мезоформула (a-p):
а) CC13 - C(CH3)3; CH2 =CH-CH=O; з) CH3-CH=CH-C2H5; CH2 =CH-O-CH3;
б) CH3-CHON-CH2-CH=CH2; CH≡C-C≡N; ѕ) CF3-CH=CH2; CH2 = CH-NH-CH3;
в) CH2NH2 - CH2COOH; CH 2 = CH –NH 2; л) CF3-CH2-CH=CH2; CH2 =CH-Br;
г) CH3-CH (OH)-CO-CH3; CH3-CH=CH-C1; л) VgCH2-CH=CH2; CH3-(CH=CH)2-CH3;
д) CH2 =CH-CH2-CHO; CH2 =CH-OH; m) CH3O-CH2-C CH; CH2 =CH-C≡N;
д) CH3-C C-C2H5; ; o) CH3-CO-CH2-CH=CH2; ;
е) CF3-COOH; ; n) CH 2 OH - CH 2 COOH; .
ж) CH 2 NO 2 - CH 2 COOH; CH2 =CH-CH=CH2;
Домашна задача 3. Изомеризам на органски соединенија
1. За наведените соединенија дајте 2-3 примери на структурни изомери од различни типови (a-p). Наведете ги изомерите користејќи ја номенклатурата за замена на IUPAC. Наведете на кои класи на соединенија припаѓаат овие изомери.
а) бромпентин; ѓ) циклопентанол; ј) етилциклопентан;
б) бутенол; е) циклохексан; к) хексен;
в) хексанол; ж) хексанон; n) хексен;
г) јодопентанол; з) бутанал; o) хидроксипентаноична киселина;
д) хептадиен; ѕ) октен; n) циклохексанон.
Напишете ги проекциските формули на геометриските изомери (cis-, trans- или Z-, E-) за наведените соединенија (a-p). Споредете ги својствата на геометриските изомери (стабилност, поларитет, точка на вриење).
а) 3-метилпентен -2; д) 2-хлорохексен-2; л) 3-бромо-2-хлорохексен-2;
б) хексен-3; е) пентен-2; m) 2-пентенол-1;
в) 3-нитрохексен-3; ж) 4-метилциклохексанол; m) 1,2-дихлоропропен;
г) 1-хлоробутен-1; з) 2,3-дихлорохексен-2; o) 1,2-дихлороциклохексан;
д) 4-бромохептен-3; ѕ) хептен-2; n) 1,3-диметилциклобутан.
Определи во каква форма на оптички изомери постојат претставените соединенија (енантиомери, диастереомери, мезоформи) (a-p). Дајте формули за проекција на Фишер за овие изомери. Наведете ги изомерите (R, S –изомери); укажуваат кои изомери се оптички неактивни.
а) 2-бромопронанол-1; ѓ) 1,4-пентанедиол; л) 2,2,3-трихлоробутан;
б) 1,2,3-бутанетриол; е) 1,2-дихлоробутан; л) 2,3-пентанедиол;
в) 3-метилпентанол-2; ж) 2,3-дихидроксибутаноична киселина; n) 2-аминобутаноична киселина;
г) 3,4-дихлорохексан; з) 2,3-бутанедиол; o) 2-аминопропаноична киселина;
д) 3-бромобутен-1; ѕ) 2,3-диаминопентан; n) 2-метилбутанал.
а) CH3-CH2-CH2-CH2-CH3
б) CH3-CH2-C(CH3)H-CH2-CH2-CH3
в) CH2=CH-CH2-CH2-CH2-CH3
г) CH3-CH2-CH=C(CH2-CH3)H-CH-CH2-CH3
д) CH≡C-CH2-CH2-C(CH3)H-CH3
д) CH3-C(CH3)2-CH3
Задача 2. Направете формули за супстанциите:
а) пропан б) етен в) циклопентан
г) бензен д) 2-метилоктан ѓ) 3-етилхексен-1
Опција 2
Задача 1. Наведете ги супстанциите:
а) CH3-CH2-CH2-CH2-CH2-CH3
б) CH3-CH2-C(CH2-CH3)H-CH2-CH2-CH3
в) CH3-CH=CH-CH2-CH3
г) CH3-C≡C-C(CH3)H-CH2-CH3
д) CH3-CH2-C(CH3)2H-CH2-CH-CH2-CH3
Задача 2. Направете формули за супстанциите:
а) пентан б) пропен в) циклохексан
г) 4-метилпентен-2 д) 3-етилнонан ѓ) метилбензен
Тест работа „Изомеризам на јаглеводороди“
· Што е изомеризам? Кои супстанции се изомери?
· Броеви кои се корени во формирањето на имињата на јаглеводородните молекули.
· Суфикси кои покажуваат присуство на едноставни, двојни, тројни врски помеѓу јаглеродните атоми и нивната локација во молекулата на јаглеводородот.
· Што е радикал и како се прикажува во името на супстанцијата?
Опција 1
Задача 1
а) CH3-CH2-CH=CH2
б) CH3-CH2-CH2-CH3
в) CH3-CH2-C(CH3)=CH2
г) CH3-C(CH3)=CH2
д) CH2=C(CH3)-CH3
Задача 2.Напишете ги формулите за сите можни изомери на пентанот. Именувајте ги.
Опција 2
Задача 1. Кои од прикажаните супстанции се изомери? Запишете ги нивните формули и именувајте ги. Дали има други изомери од овој состав?
а) CH3-CH2-CH2-CH2-CH3
б) CH3-CH=CH-CH2-CH3
в) CH3-C(CH3)=CH-CH3
г) CH3-CH=C(CH3)-CH3
д) CH3-C(CH3)H-CH=CH2
д) CH3-C≡C-CH2-CH3
Задача 2.Напиши формули за сите можни изомери на бутен. Именувајте ги.
Тест работа „Хомологија на јаглеводороди“.
Кога се подготвувате за работа, мора да повторите:
- Што е хомологија? Кои супстанции се нарекуваат хомолози? Која е хомолошката разлика? Општи формули на хомологни серии на јаглеводороди. Што е изомеризам? Кои супстанции се изомери?
- Броеви кои се корени во формирањето на имињата на јаглеводородните молекули. Суфикси кои покажуваат присуство на едноставни, двојни, тројни врски помеѓу јаглеродните атоми и нивната локација во молекулата на јаглеводородот. Што е радикал и како се прикажува во името на супстанцијата?
Опција 1
Задача 1. Кои од прикажаните супстанции се хомолози? Запишете ги нивните формули и именувајте ги.
а) CH3-CH2-CH=CH2
б) CH3-CH2-CH2-CH3
в) CH3-CH2-C(CH3)=CH2
г) CH3-C(CH3)=CH2
д) CH2=C(CH3)–CH2-CH2-CH3
Задача 2.Напишете ги формулите за четири хомолози на пентан. Именувајте ги.
Опција 2
Задача 1. Кои од прикажаните супстанции се изомери? Запишете ги нивните формули и именувајте ги. Дали има други изомери од овој состав?
а) CH3-CH2-CH2-CH2-CH3
б) CH3-CH=CH-CH2-CH3
в) CH3-C(CH3)=CH-CH3
г) CH3-CH=C(CH3)-CH3
д) CH3-CH=CH-CH3
ѓ) CH3-CH=CH-CH2-CH2-CH3
Задача 2.Напишете формули за четири хомолози на пентен. Именувајте ги.
ХЕМИСКИ РЕАКЦИИ ВО ОРГАНИКАТА. 10-то одделение
Работете во добро расположение
б) CH3 - CH2 - CH2 - CH3 + H2 "
в) CH3-CH2-CH2-CH = CH2 + HCl"
г) CH3-CH2-CH2-CH2-CH3 + HCl“
д) CH3 - C º C - CH2 - CH2 - CH3 + Cl2 "
д) CH2 = CH - CH3 + H2O "
е) CH2 = C = CH - CH3 + H2"
ж) CH3-CH2-CH3 + Cl2"
з) CH3-CH2-CH2-CH2-CH2-OH „H2O +…
ѕ) CH3 - CH2 – CH3 „H2 +…
ј) CH3 – CH2 – CH2 – CH2 – CH3“
Видови хемиски реакции.
https://pandia.ru/text/78/654/images/image022_57.gif" width="87" height="10 src=">2. CH3 – CH2 – CH2 – OH H2SO4, °t CH3 – CH2 = CH2 + H2O
3. CH º C - CH2 – CH3 +2 H2 ® CH3 – CH2 – CH2 –CH3
 |
4. + Cl2 ® + HCl.
5. CH2 = CH2 + Cl2 ® CH2Cl – CH2Cl.
Каков тип на реакција е оваа:
1. CH2 = CH – CH3 + HCl ® CH3 – CHCl - CH3
https://pandia.ru/text/78/654/images/image026_61.gif" width="75" height="10 src=">5. CH3 – CH2 – CH2 – CH2 –CH3 Al Cl3, 450 °C CH3 – CH2 – CH –CH3
Каков тип на реакција е оваа:
https://pandia.ru/text/78/654/images/image028_58.gif" width="51" height="50">1.
2.CH3 – CH2 – CH2 – CH2 –CH2 –CH3 Al Cl3, 450 °C CH3 –CH2 –CH2 –CH –CH3
https://pandia.ru/text/78/654/images/image030_54.gif" width="106" height="51 src="> N C H2- OH CH3 H
6 . HO-CH2CH2CH CH2CH2 - OH
 7
. CH3CH2CH2 CH2CH2 CH2CH2OH
7
. CH3CH2CH2 CH2CH2 CH2CH2OH
Тест на тема „Алкохоли“
Решете го синџирот на трансформации, именете X и Y. пропанол-1 → X → Y → 2,3-диметилбутан Наведете го алкенот што ги задоволува условите на задачата. Напишете равенка за реакцијата. алкен + H2O → 3-метилбутанол-2 Напиши ги структурните формули на алкохолите: бутил, изобутил, сек-бутил, терц-бутил. Колку изомерни терциерни алкохоли можат да имаат состав C6H13OH? Направете равенки за реакција во согласност со синџирот на трансформации, наведете ги условите за реакциите, наведете ги сите супстанции во синџирот:CaC2 → C2H2 → CH3CH= О
Al4C3→ CH4→ CH3Cl→ C2H6→ C2H4 →C2H5OH → C2H5ONa
↓
C2H5Br → Видете задача бр. 5 пропанол-1 → 1-бромопропан → n-хексан → бензен → изопропилбензен. Монохидричниот алкохол содржи 52,2% јаглерод и 13% водородпо тежина. Воспоставете ја молекуларната формула на алкохолот и докажете дека е примарен. 12 g заситен монохидричен алкохол се загреани со концентрирана сулфурна киселина и се добиваат 6,3 g алкен. Приносот на алкен беше 75% од теоретски возможниот. Одредете ја формулата на почетниот алкохол. Колкава маса од 1,3 бутадиен може да се добие од 230 литри етанол (густина 80 kg/m3), ако масен уделетанол во раствор е 95%, а приносот на производот е 60% од теоретски возможниот. Согорување 76 гр полихидричен алкохолДобиени се 67,2 литри јаглерод моноксид (IV) и 72 g вода. Одреди ја молекуларната формула на алкохолот.
Опција број 1 Напиши ги равенките на реакцијата: 1. CH3 – CH 2 - COOH + CH3 CH 2 - OH ↔ 2. CH3 - CH - COOH + CH3 CH 2 CH 2 CH 2 - OH ↔ |
Опција бр. 2 Напиши ги равенките на реакцијата: 1. CH3 - COOH + CH3 CH 2 CH 2 - OH ↔ 2. CH3 - CH - CH2 - COOH + C 3H7 - OH ↔ Која од овие реакции се случува со најбрза брзина? Зошто? |
Опција бр. 3 Напиши ги равенките на реакцијата: 1. CH3 – CH 2 – CH 2 - COOH + CH3 CH 2 CH 2 - OH ↔ 2. CH3 - CH 2 – CH 2 - COOH + CH3 - CH – CH 2 - CH3 ↔ Која од овие реакции се случува со најбрза брзина? Зошто? |
Опција бр. 4 Напиши ги равенките на реакцијата: 1. CH3 - COOH + CH3 CH 2 CH 2 CH 2 CH 2 - OH ↔ 2. CH3- CH 2 - CH 2 - CH – COOH + CH3 - OH ↔ Која од овие реакции се случува со најбрза брзина? Зошто? |
Изведете ја молекуларната формула на супстанцијата ако C е 40%, H е 6,7%, O е 53,3%. Релативната молекуларна тежина на супстанцијата е 180. Изведете ја молекуларната формула на јаглеводородот, масениот удел на водородот е 17,25%, јаглеродот е 82,75%. Релативна густинана оваа супстанца со воздух - 22. Изведете ја молекуларната формула на јаглеводородот, масен удел на водород - 14,3%, јаглерод - 85,7%. Релативната густина на оваа супстанца во однос на водородот е 28. Изведете ја молекуларната формула на супстанцијата ако C е 52,17%, H е 13,05%, O е 34,78%. Релативната молекуларна тежина на супстанцијата е –23. Изведете ја молекуларната формула на јаглеводородот, масениот удел на јаглеродот е 80%. Релативната густина на оваа супстанца во однос на водородот е 15. Изведете ја молекуларната формула на јаглеводородот масениот удел на водородот е 20%. Релативната густина на оваа супстанца во воздухот е 1,035. Изведете ја молекуларната формула на јаглеводородот, масениот удел на водородот е 7,69%, јаглеродот е 92,31%. Релативната густина на оваа супстанца во однос на водородот е 39. Изведете ја молекуларната формула на јаглеводород во кој масениот удел на водородот е 14,3%.
Задача 2.
Алармниот феромон на столарски мравки содржи јаглеводород. Каква е структурата на јаглеводородот ако со неговото напукнување се добиваат пентан и пентен, а од неговото согорување се добиваат 10 mol јаглерод диоксид.
Решавање проблеми
1. При хлорирање на 4 g алкан во првата фаза се ослободени 5,6 литри водород хлорид. Кој алкан е земен за хлорирање?
2. За согорување на 1 литар алкан биле потребни 6,5 литри кислород. Каков алкан е ова?
3. Со дехидрогенизација на 11 g алкан се добива алкен и 0,5 g водород. Изведете ја формулата на алканот.
Задачи на арената.
1. Ацетиленот бил префрлен преку активен јаглен на температура од 6000 C. Добиената течност реагирала со бром во присуство на катализатор FeBr3. Органскиот производ потоа реагирал со бромометан и натриум метал. Добиеното соединение беше оксидирано со раствор од калиум перманганат. Напишете ги равенките за сите реакции. Дефинирај финален производ. Во вашиот одговор наведете ја моларната маса на финалниот производ.
2. Со реакција на попилен со волумен од 11,2 литри (n.o.) со водород хлорид и дополнително реагирање на добиениот производ со бензен во присуство на катализатор AlCl3, се добива органско соединение со тежина од 45 g Пресметајте го неговиот принос како процент од теоретски.
Задачи
№1. Кога се согорува органска материја со тежина од 12 g, се добива CO2 со тежина од 26,4 g и H2O со тежина од 14,4 g Релативната густина на супстанцијата во воздухот е 2,07. Одреди ја формулата.
№2. Колкав волумен на ацетилен ќе се добие од 200 g калциум карбид ако содржи 5% нечистотии?
ПРОБЛЕМИ 10 ОДДЕЛЕНИЕ
1. Пресметај го приносот на Вурцовата реакција ако од 21 g бромометан се формираат 2 литри етан.
2. Кога се хидрогенизирале 20 литри бутадиен, се формирале 14 литри бутан. Пресметајте го приносот на реакцијата на хидрогенизација. Кој волумен на водород реагирал?
3.Колкав волумен на воздух е потребен за согорување на 1 кг бензин? Составот на бензинот одговара на формулата C8H18.
4. Колкав волумен на кислород ќе биде потребен за согорување на 100 литри природен гас кој содржи 90% метан и 10% етан по волумен?
Проблеми 10-то одделение
Најдете ги масените фракции на секој елемент во молекулата :
Етил алкохол
Оцетна киселина
Ацеталдехид
Одреди молекуларна формула органско соединение, ако содржи 40% јаглерод, 6,7% водород и 53,3% кислород по маса, а моларна масаеднакво на 60 g/mol.
ПРОБЛЕМИ 10 ОДДЕЛЕНИЕ
Кога 100 g технички калциум карбид реагирале со вода, биле ослободени 31,4 литри ацетилен. Пресметајте го масениот удел на нечистотии во калциум карбид. За реакцијата Вурц, користена е мешавина на гасови со волумен од 200 ml, составена од етан и хлороетан во сооднос 1: 3, соодветно. Каков јаглеводород и во која количина (по тежина) ќе се добие? Која маса на водородбромид може да се додаде на 15 g мешавина од бутан и бутен-1, во однос 1:2, соодветно?
Задача 1.
Задача 2.Густината на водородот на супстанција со состав од јаглерод - 54,55%, водород - 9,09% и кислород - 36,36% е 22. Изведете ја молекуларната формула на супстанцијата.
Задача 3.Мешавина од бензен и циклохексан со тежина од 4,39 g ја обезбојува бромната вода со тежина од 125 g со бром масен удел од 3,2%. Одредете го процентот на бензен во смесата.
Проблеми со производи за согорување на органски материи
Проблем 1в.Со согорување на органска материја со тежина од 4,8 g се произведени 3,36 литри CO2 (n.o.) и 5,4 g вода. Густината на пареа на органска супстанција за водород е 16. Одреди ја молекуларната формула на супстанцијата што се проучува.
Проблем 2в.Согорувањето на органска материја со тежина од 6,9 g произведе 13,2 CO2 (n.s.) и 8,1 g вода. Густината на пареа на органската материја во воздухот е 1,59. Одреди ја молекуларната формула на супстанцијата што се проучува.
Проблем 3в.Согорувањето на органска материја со тежина од 4,8 g произведе 6,6 g CO2 (n.o.) и 5,4 g вода. Густината на пареа на органска супстанција за водород е 16. Определи ја молекуларната формула на супстанцијата што се проучува.
Проблем 4в.При согорување на органска супстанција со тежина од 2,3 g, се формирале 4,4 g CO2 (n.s.) и 2,7 g вода. Густината на пареа на органската материја во воздухот е 1,59. Определете ја молекуларната формула на супстанцијата што се проучува.
Проблем 5в.Со согорување на органска материја со тежина од 1,3 g се добиваат 4,4 g CO2 (n.o.) и 0,9 g вода. Густината на пареата на органската супстанција за водород е 39. Определи ја молекуларната формула на супстанцијата што се проучува.
Проблем 6в.Со согорување на органска материја со тежина од 4,2 g се добиваат 13,2 CO2 (n.o.) и 5,4 g вода. Густината на пареа на органската материја во воздухот е 2,9. Одреди ја молекуларната формула на супстанцијата што се проучува.
Задачи за составување на вистински формули на супстанции.
1. Најдете наједноставната формулајаглеводород, ако се знае дека јаглеводородот содржи 80% јаглерод и 20% водород.
2. . Најдете ја вистинската формула на јаглеводород ако се знае дека јаглеводородот содржи 82,76% јаглерод и 1 литар од неговата пареа има маса од 2,59 g.
3. Органската материја содржи 84,5% јаглерод и 15,49% водород. Одреди ја формулата на оваа супстанца ако нејзината густина на пареа во воздухот е 4,9.
4. Масовниот дел на јаглеродот во јаглеводородот е 83,3%. Релативната густина на пареа на оваа супстанца во однос на водородот е 36.
5. Јаглеводород, масениот дел на јаглеродот во кој е 85,7%, има густина на пареа за водород од 28. Најдете ја вистинската формула на супстанцијата.
6. Јаглеводород, масениот удел на водородот во кој е 14,3%, има густина на водородот 21. Најдете ја вистинската формула на супстанцијата.
7. Масовниот удел на водородот во јаглеводородот е 11,1%. Релативната густина на пареа на оваа супстанца во воздухот е 1,863. Најдете ја вистинската формула на супстанцијата.
8. Органската материја содржи 52,17% јаглерод и 13,04% водород. Густината на пареата за водородот е 23. Најдете ја вистинската формула на супстанцијата.
Задачи (да се извлечат формули на супстанции)
1. За силни студенти (ниво А)
1. Воспоставете ја формулата на гасовит јаглеводород ако при целосно согорување на 0,7 g од него се добиени 1,12 литри јаглерод моноксид (IV) и 0,9 g вода. Густината на пареата за водород е 42.
2. При согорување на 28 ml гас се добиваат 84 ml јаглерод моноксид (IV) и 67,5 ml вода. Што е молекуларна формулагас, ако се знае дека неговата релативна густина за водород е 21?
3. При согорување на органска супституција супституирана со хлор, која содржи атоми на јаглерод, водород и халоген, добиени се 0,22 g јаглерод моноксид (IV) и 0,09 g вода. За одредување на хлорот, од истиот примерок е добиен среброхлорид, чија маса била 1,435 g.
4. Кога се согоруваат 3,3 g органска материја што содржи хлор, се добиваат 1,49 l јаглерод моноксид (IV) и 1,2 g вода. По претворањето на целиот хлор содржан во дадена количина на супстанција во сребрен хлорид, се добиваат 9,56 g сребро хлорид. Густината на пареа на супстанцијата за водород е 49,5. Одреди ја вистинската формула на супстанцијата што се проучува.
5. Кога се изгореле 5,76 g од супстанцијата, се формирале 2,12 g сода; 5,824 l јаглерод моноксид (IV) и 1,8 g вода. Одреди ја молекуларната формула на супстанцијата.
2. За средношколци (ниво Б)
1. Соединение кое се состои од јаглерод и водород е изгорено и се добиваат 55 g јаглерод диоксид и 27 g вода. Која е формулата на соединението ако неговата густина на пареа во воздухот е 2,48?
2. При согорување на органска супстанција со тежина од 6,2 g, се формирале јаглерод моноксид (IV) со тежина од 8,8 g и вода со тежина од 5,4 g Релативната густина на пареа на оваа супстанца во однос на водородот е 31. Која е молекуларната формула на оваа супстанца. ?
3. Запален кислород кој содржи органска материјасо тежина од 4,81 О2. Со помош на квантитативна анализа, беше утврдено дека се формирани јаглерод моноксид (IV) со тежина од 6,613 g и вода со тежина од 5,411 g Релативната густина на пареа на оваа супстанца во воздухот е 1,103. Изведете ја молекуларната формула на супстанцијата.
4. Кога ќе се согорат 4,6 g супстанција, се формираат 8,8 g јаглерод моноксид (IV) и 5,4 g вода. Густината на пареа на оваа супстанца во воздухот е 1,59. Одреди ја молекуларната формула на оваа супстанца.
Кога се изгореле 4,4 g јаглеводород, се добиваат 13,2 g јаглерод моноксид (IV). Релативната густина на супстанцијата во воздухот е 1,52. Одреди ја молекуларната формула на оваа супстанца.
3. За слаби студенти (ниво Ц)
1. Масените фракции на јаглерод, водород и флуор во супстанцијата се соодветно: 0,6316; 0,1184; 0,2500. Релативната густина на супстанцијата во воздухот е 2,62. Изведете ја молекуларната формула на супстанцијата.
2. Густината на водородот на супстанција со состав на јаглерод - 54,55%, водород - 9,09% и кислород - 36,36% е 22. Изведете ја молекуларната формула на супстанцијата.
3. Воспоставете ја молекуларната формула на заситен јаглеводород ако неговата густина на пареа за водород е 22, а масениот удел на јаглеродот е 0,82.
4. Најдете ја молекуларната формула на јаглеводородот од етиленската серија, ако се знае дека масениот удел на јаглеродот во него е 85,7%, а неговата густина на пареа за водород е 28.
5. Мајкл Фарадеј во 1825 година откри јаглеводород со состав: C - 92,3%; N - 7,7%. Неговата густина на пареа во воздухот е 2,69. Која е молекуларната формула на супстанцијата?
Задачи. Јаглехидрати.
Секој - 10 поени.
1. Колку зашеќерена материја со масен удел на сахароза од 0,2 /20%/ била подложена на хидролиза ако се добие 1 kg гликоза?
2. W скроб во компирот е 20%. Колкава е масата на гликоза што може да се добие со преработка на 1600 кг компири, имајќи предвид дека приносот на гликоза како процент од теоретски возможниот е 75% г.
/елемент за врска со скроб /=162/.
3. Со алкохол ферментација 2 молови на гликоза произведоа јаглерод моноксид /1U/, кој потоа беше пролеан во 602 ml алкален раствор со масен удел на калиум хидроксид од 1,33 g/ml. Пресметајте ја масата на сол што се формирала во растворот. Која супстанца останува во вишок? Пресметајте ја нејзината количина.
4. При ферментација на 200 g техничка гликоза, се добива масовна фракција на супстанци без шеќер во која изнесува 10%, 96% алкохол. Густината на растворот на алкохол е 0,8 g/ml. Пресметајте ја масата и волуменот на добиениот раствор на алкохол.
5. Пресметајте ја масата на 63% раствор азоткиселина потребна за производство на 50 g тринитроцелулоза.
6. Пресметајте го волуменот на CO2 добиен од согорувањето на 1620 kg скроб, Mr / елемент. Скроб единици/=162
7. Во текот на дневните часови, лист од репка со површина од 1 dm2 може да апсорбира јаглерод моноксид /1U/ со волумен од 44,8 ml/n. у./. Која маса на гликоза се формира како резултат на фотосинтезата?
8. Масен удел на целулоза во дрво = 50%. Која маса на алкохол може да се добие од ферментација на гликоза, која се формира при хидролиза на струготини со тежина од 810 kg? Ве молиме имајте предвид дека алкохолот се ослободува од систем за реакцијаво форма на раствор со масена фракција на вода од 8%. Приносот на етанол поради загубите во производството е 70%.
9. Гликозата во медицината често се користи во форма на раствори со различни концентрации, кои служат како извор на течен и хранлив материјал, а исто така помагаат во неутрализирање и отстранување на отровите од телото. Пресметајте во која маса на раствор на гликоза со масен удел од 5% треба да се растворат 120 g од него за да се добие раствор со масен удел на гликоза од 8%.
3. Колку изомерни тетраметилбензени има?
Еден три четири шест
4. Колку најблиски хомолози има толуенот?
Еден четири пет осум
5 . Напишете ја општата формула на ароматични јаглеводороди кои содржат два бензенски прстени кои немаат заеднички темиња:
(СО n H2 n-6) 2 C n H2 n-14 C n H2 n-2 C n H2 n(C6H5)2
6. Ароматичните јаглеводороди горат со зачаден пламен бидејќи...
1. содржат мал масен удел на водород
3. тие се токсични
4. не содржат атоми на кислород.
7. Најдете ја грешката во својствата на бензенот:
Безбојна испарлива течност, токсична, има пријатен мирис, раствора масти.