1. Во согласност со супстанциите што треба да се идентификуваат, мора да се наведат познати квалитативни реакции, реагенси и карактеристики за идентификација.
Во нашиот случај, можеме да ги користиме следниве реакции:
| Сите r-my протеини | Реакција на биурет | Cu(OH) 2 ↓ свежо депониран. | Прстен во виолетова боја |
| Протеини со вкус. амино киселини | Ксантопротеинска реакција | Конц. HNO3, конц. раствор на амонијак, t° | Боење со портокал |
| Протеини и сите амино киселини | Реакција на нинхидрин | Нинхидрин во ацетон, t° | Виолетова боја (пролин – жолта) |
| Амино киселини | Образование комплексни соединенија | Cu(OH) 2 ↓ свежо депониран. | Темно сина боја |
| Сите јаглени хидрати (моно-, ди- и полисахариди) | Молишка реакција | Конц. H2SO4, раствор на α-нафтол | Темно виолетова прстен на границата од два слоја |
| Моносахариди и дисахариди (било кои) | Формирање на сахарати | Cu(OH) 2 ↓ свежо депониран. | Разредување на талог, боја на cornflower сина боја |
| (намалување на моно- и дисахариди) | Тромерска реакција на „бакарно огледало“ Реакција на „сребрено огледало“ | Cu(OH) 2, t° свежо депониран. | Ag 2 O, раствор на амонијак, t° |
2. Цигла-црвен талог Cu 2 O Сребрени наслаги на ѕидовите на епрувета
3. Предложете ја во форма на дијаграм најефективната низа за одредување на овие соединенија.
Наведете ја постапката на реакција, условите и напишете ја равенката на реакцијата што ја означува карактеристиката за идентификација.
Како прелиминарен тест за растворливи протеини, можете да користите реагенси кои предизвикуваат денатурација (преклопување): термички или хемиски.
При решавање на овој проблем, можни се опции за анализа.Опција 1.
1. Редоследот за идентификување на содржината на шишињата може да биде како што следува:
2. Ние спроведуваме прелиминарен тест за присуство на протеини. Ние ги загреваме примероците од секое од 4-те шишиња во пламенот на ламба за алкохол. Во епруветите со протеински раствори се забележува денатурација (протеинот се коагулира и ја губи растворливоста). Во епруветите со примероци од други супстанции, не се забележани промени.
3. Содржината на шишињата ја идентификуваме со гликоза и амино киселина користејќи реакција со нинхидрин. Карактеристична виолетова боја се појавува во епрувета која содржи глицин.
4. Потврдете го присуството на гликоза во преостанатото шише. Гликозата е редуцирачки моносахарид, па за да го идентификувате, можете да ја користите или реакцијата „сребрено огледало“ (кога се загрева во водена бања, на ѕидовите на епрувета се појавува карактеристична огледална обвивка од сребро) или реакцијата „бакарно огледало“ (кога се загрева во пламен на алкохолна ламба, карактеристичниот оксиден талог се појавува бакар (I) цигла-црвена боја).
Опција 2.
1. Ние одредуваме дали соединението припаѓа на групата протеини користејќи ја реакцијата на биурет со свежо преципитираниот бакар (II) хидроксид. Карактеристичен виолетов прстен се појавува во епруветите кои содржат примероци од протеински раствори. Во епрувета со гликоза, исто така, се забележува растворање на син талог од бакар (II) хидроксид и појава на сина боја на пченкарно цвеќе поради формирање на сложено соединение - бакар сахароза - во епрувета со амино; киселина, се појавува темно сина боја поради формирање на сложено соединение - бакар глицинат.
2. Потврдете го присуството на гликоза. Двете епрувети ги загреваме во пламен на алкохолна ламба. Во епрувета со гликоза, се формира карактеристичен тули-црвен талог од бакар (II) оксид, бидејќи гликозата спаѓа во групата на редукциони моносахариди.
3. Ние ги идентификуваме протеините користејќи ги нивните разлики во составот на аминокиселините. Ние спроведуваме ксантопротеинска реакција со нови примероци на протеински раствори (види верзија 1).
За попрецизно да ја идентификувате амино киселината, можете да земете нов примерок и да извршите реакција со раствор од нинхидрин.
Не може да се исклучат други опции кои се разликуваат по редоследот на реакции и реагенси.
Насоки за наставниците
2. Прашањата за хемија за подготовка за семинарот мора да им се дадат на студентите најдоцна две недели пред лекцијата.
4. Наставникот по хемија дава мотивација за часот, го разгледува составот и својствата на протеините. Наставник по биологија го генерализира и ажурира знаењето за структурата на протеинските молекули, нивните функции и апликации.
5. На крајот од часот, наставниците ја оценуваат работата на учениците на овој час. Опрема:филмови со кодови, надземен проектор, екран, проектор за слајдови, слајдови, хемикалии, демонстрациона табела, табели.
План за час (напишан на табла)
1. Состав и структура на протеинот.
2. Својства на протеини (денатурација, ренатурација, хидролиза, реакции на боја).
3. Функции на протеинот и неговата синтеза во клетката.
4. Примена на протеини, вештачка синтеза на пептиди.
Наставник по хемија.Денес водиме необична лекција - ги опфаќа проблемите на хемијата и биологијата во исто време. Целта на нашата лекција е систематизирање и продлабочување на знаењата на тема „Протеини“. Посебно внимание посветуваме на проучувањето на протеините, бидејќи протеините се главни составен делод целиот живот на Земјата. Запомнете ја изјавата на Ф. Енгелс за тоа што е животот: „Каде и да го сретнеме животот, откриваме дека тој е поврзан со некој вид на протеинско тело, и секаде каде што наоѓаме протеинско тело што не е во процес на распаѓање, ние, без исклучок , средба со феномените на животот. Животот е начин на постоење на протеински тела“. Ниту една супстанција не врши толку специфични и разновидни функции во телото како протеинот.
Да се потсетиме кои соединенија се нарекуваат протеини. ( Природни полимери чии мономери се амино киселини.)
Студијата за тоа кој процес помогна да се утврди структурата на протеините? ( Студија за хидролиза на протеини.)
Кој процес се нарекува хидролиза?
Кои соединенија се формираат при хидролиза на протеините?
Кои соединенија се нарекуваат амино киселини?
Колку аминокиселини се познати во природата?
Колку амино киселини се наоѓаат во протеините?
Наставник по хемија демонстрира филм со код.

Наставник по хемија.Обрнете внимание на положбата на амино групата во амино киселините. Во согласност со положбата на амино групата, амино киселините кои ги сочинуваат протеините се нарекуваат а-амино киселини. Општата формула на која било од овие амино киселини може да се напише на следниов начин:
На кодниот филм гледате две амино киселини, од кои едната содржи две карбоксилни групи - COOH, а другата - две амино групи - NH2. Таквите киселини се нарекуваат аминодикарбоксилни или диаминокарбоксилни киселини, соодветно.
Од вашиот курс по хемија знаете за оптички изомери на природни соединенија. Речиси сите протеини содржат само L-амино киселини.
Амино киселините се мономери на протеините. Тие можат да се поврзат едни со други преку амидна (пептидна) врска, која се формира со ослободување на вода - ова е реакција на кондензација.
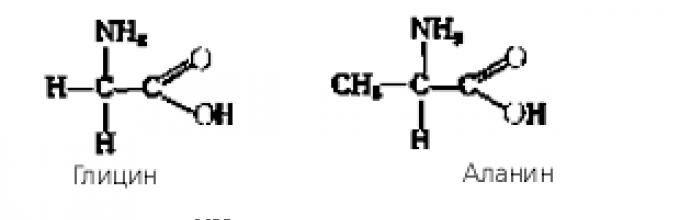
Ајде да создадеме равенка за реакцијата помеѓу амино киселините глицин и аланин.
(Учениците работат самостојно и потоа ги споредуваат нивните резултати со пишувањето на табла или лента.)
Добиената структура се нарекува дипептид. Полимер од многу амино киселини се нарекува полипептид.
Наставник по биологија.Ајде да продолжиме да ги проучуваме својствата на протеините, но прво ќе одговориме на следните прашања.
1. Како можеме да ја објасниме разновидноста на протеините што постојат во природата? ( Разлики во составот на амино киселините и нивната различна низа во полипептидниот синџир.)
2. Кои се нивоата на организација на протеинската молекула? ( Примарна – аминокиселинска секвенца; секундарно -а -спирала илиб - преклопена структура на делови од синџир; терцијарно - просторна структурапротеин формиран поради интеракцијата на остатоците од аминокиселини на оддалечените делови на синџирот: топче во топчести протеини, филаментозна структура во фибриларни протеини; кватернерна - соединување на две или повеќе одделни протеински молекули.)
3. Каков тип на врска се јавува помеѓу аминокиселините во примарната структура? Кое е другото име за оваа врска? ( Ковалентна врска.)
Амидна или пептидна врска. 4. Кои врски главно ја обезбедуваат секундарната структура на протеинската молекула? (.)
Водородни врски, дисулфхидрилни мостови 5. Кои врски обезбедуваат терцијарна структура? (.)
Водородни врски, хидрофобни и јонски интеракции 6. Кои врски ја обезбедуваат кватернарната структура на протеинската молекула? (.)
Електростатски, хидрофобни и јонски интеракции 7. Наведете пример за протеин кој ви е познат кој има кватернарна структура. (.)
АТП-аза, хемоглобин Сега да го решиме следниот проблем ().
состојбата на задачата се проектира преку надземен проектор, прикажан е слајд со крвни размаски на здраво лице и пациент со српеста анемија Болеста српеста анемија е придружена со замена на аминокиселинскиот остаток глутаминска киселина во полипептидниот синџир на молекулата на хемоглобинот со остаток на валин. Фрагмент од синџирот на нормален хемоглобин: -–Болеста српеста анемија е придружена со замена на аминокиселинскиот остаток глутаминска киселина во полипептидниот синџир на молекулата на хемоглобинот со остаток на валин. Фрагмент од синџирот на нормален хемоглобин: -–gluЛиз –.–Болеста српеста анемија е придружена со замена на аминокиселинскиот остаток глутаминска киселина во полипептидниот синџир на молекулата на хемоглобинот со остаток на валин. Фрагмент од синџирот на нормален хемоглобин: -–glu–
(Болеста српеста анемија е придружена со замена на аминокиселинскиот остаток глутаминска киселина во полипептидниот синџир на молекулата на хемоглобинот со остаток на валин. Фрагмент од синџирот на нормален хемоглобин: -Фрагмент од абнормален синџир на хемоглобин: - gluвратило –.- глутаминска киселина;
- лизин;.
– валин). Нацртајте ги овие фрагменти како хемиски формули.
Решение
Фрагмент од синџир на нормален хемоглобин:
Фрагмент од абнормален синџир на хемоглобин: Од горенаведениот пример следува дека примарната структура на протеинската молекула може да ги одреди сите нејзини последователни нивоа на организација. Промените во структурната организација на протеинот можат да ги нарушат неговите функции, што во некои случаи доведува до развој на патологија - болест.Структурата на протеинот го одредува тоа
физички и хемиски својства
, на пример, растворливост.

Наставник по хемија.Наставник по хемија демонстрира филм со код.
Нарушувањата во примарната организација, кои доведуваат до прекин на амидната врска со додавање на молекула на вода, се нарекуваат протеинска хидролиза. Со целосна хидролиза, протеинот се распаѓа на неговите составни амино киселини.
Повреда на секундарните и терциерни структури s протеин, т.е. губењето на нејзината матична структура се нарекува денатурација на протеини.
Се предизвикува денатурација на протеини различни фактори: значителни промени во температурата, зголемување и намалување на рН на околината, изложеност на јони на тешки метали, некои хемиски соединенија, на пример, феноли.
Наставник по хемија покажува експерименти.
Искуство 1.Протеини + топлина -->
Искуство 2. Протеин + фенол --> денатурација (врнежи).
Искуство 3.Протеин + Pb или CH 3 COOH --> денатурација (врнежи).
Искуство 4.Протеин + CuSO4 --> денатурација (врнежи).
Наставник по биологија.Денатурацијата се јавува како резултат на уништување на водород и дисулфид ковалентни врски(но не и пептидни врски, јонски и хидрофобни интеракции), кои обезбедуваат формирање и одржување на секундарните и терциерните структури на протеинот. Во овој случај, протеинот ги губи своите вродени биолошки својства.
Реакциите што се користат за одредување на составот на супстанцијата се нарекуваат квалитативни.
Кои реакции се квалитативни на протеините?
Наставник по хемија ги демонстрира следните експерименти.
Искуство 1.Ксантопротеинска реакција (нитрација на бензенски прстени на ароматични протеински амино киселини):
протеин (изладен) + HNO 3 (кон.) + топлина --> жолта боја
Искуство 2.Реакција на биурет (ви овозможува да го одредите бројот на пептидни врски):
протеин + CuSO 4
+ NaOH --> виолетова боја (уреата ја дава оваа реакција);
CuSO 4
+ NaOH --> Cu(OH) 2
+ На 2
ПА 4
;
протеин + Cu (OH) 2
--> виолетова боја.
Дали е можно да се препознаат глицерол, протеини и гликоза со помош на еден реагенс? Може! Овој реагенс е бакар хидроксид, дава различни бои на растворите од овие супстанции:
а) глицерол + Cu(OH) 2
--> светло сино решение;
б) гликоза + Cu(OH) 2
+ греење --> црвен талог;
в) протеин + Cu(OH) 2
--> виолетова боја.
Наставник по биологија.Наведете ги функциите на полипептидите што ги знаете. ( Градежништво.
Протеините ги обезбедуваат и сите видови биолошка мобилност. Покрај тоа, протеините вршат транспортни, хормонски или регулаторни, рецепторни, хемостатички, токсигени, заштитни и енергетски функции.)
Дефинирајте ги ензимите. ( Ензимите се протеини кои имаат каталитичка активност, т.е..)
забрзување на реакциите Сите ензими се многу специфични за нивниот супстрат и, по правило, катализираат само една многу специфична реакција. Погледнете го дијаграмскиот приказ на структурата на ензимот. (Наставник по биологија демонстрира филм со код со шематски приказ на ензим.
) Секој ензим има активно место во кое се случува хемиската трансформација на супстратот на реакцијата. Понекогаш може да има неколку места за врзување на подлогата. Структурата на местото за врзување е комплементарна со структурата на подлогата, т.е. тие се вклопуваат заедно „како што клучот одговара на бравата“. Работата на ензимите е под влијание на бројни фактори: pH, температура, јонскасоставот на животната средина 6
, присуство на мали органски молекули кои се врзуваат за ензимот или се дел од неговата структура и инаку се нарекуваат кофактори (коензими). Некои витамини, како што е пиридоксин (Б 12
).
) и кобаламин (Б Наставникот по биологија ги запознава учениците сопрактична примена.
ензими
Клиничко значење на ензимите
1. Надалеку се познати болестите предизвикани од ензимски дефицит. Примери: несварливост на млекото (без ензим на лактаза); хиповитаминоза (недостаток на витамини) - недостатокот на коензими ја намалува ензимската активност (хиповитаминоза на витамин Б1 доведува до бери-бери болест);фенилкетонурија (предизвикана од нарушување на ензимската конверзија на аминокиселината фенилаланин во тирозин).
2. Определување на ензимската активност во биолошките течности има
голема вредност
за дијагностицирање на болести. На пример, вирусниот хепатитис се одредува со активноста на ензимите во крвната плазма.
3. Ензимите се користат како реагенси во дијагнозата на одредени болести. 4. Ензимите се користат за лекување на одредени болести. Примери на некои лекови базирани на ензими: панкреатин, фестал, лидаза.Употреба на ензими во индустријата
1. Б
прехранбената индустрија
4. Ензимите се користат во преработката на лен и коноп.
5. Ензимите се користат за омекнување на кожата во кожарската индустрија.
6. Ензимите се дел од прашоци за перење.
Наставник по биологија.Да ги погледнеме другите функции на протеините. Моторните функции се вршат со специјални контрактилни протеини, кои вклучуваат, на пример, актин и миозин, кои се дел од мускулните влакна.
Друга важна функција на протеините е транспортот.
Протеините, на пример, носат јони на калиум, амино киселини, шеќери и други соединенија низ клеточната мембрана во клетката. Протеините се исто така интерстицијални носители.
Со регулирање на метаболизмот во клетките и помеѓу клетките и ткивата на целото тело, протеините вршат хормонална или регулаторна функција. На пример, хормонот инсулин е вклучен во регулирањето на метаболизмот на протеините и мастите.
На површината на клеточните мембрани има протеински рецептори кои селективно ги врзуваат хормоните и медијаторите, а со тоа вршат рецепторска функција.
Хомеостатската функција на протеините е да формираат згрутчување при запирање на крварењето.
Некои протеини и пептиди ослободени од организми, како што се патогени или некои отровни животни, се токсични за другите живи организми - ова е токсикогената функција на протеините.
Заштитната функција на протеините е многу важна. Антителата се протеини кои се произведуваат од имунолошкиот систем на телото кога е нападнат од туѓ протеин, бактерии или вируси. Тие го идентификуваат „странецот“ и учествуваат во неговото уништување.
Протеините кои служат како енергетска резерва вклучуваат, на пример, казеин, главниот протеин во млекото.
Одговорете на следните прашања. 2. Што предизвикува отфрлање на трансплантирани органи и ткива кај пациентите? ()
Антителата, извршувајќи заштитна функција, го препознаваат туѓиот протеин на трансплантираните органи и предизвикуваат реакции на неговото отфрлање. 3. Зошто од варените јајца никогаш не се добива пиле? (.)
Белките од јајца неповратно ја изгубиле својата матична структура поради топлинска денатурација 4. Зошто тежината на месото и рибата се намалува по готвењето? (.)
За време на термичка обработка, се јавува денатурација на протеини од месо или риба. Протеините стануваат практично нерастворливи во вода и се откажуваат од значителен дел од водата што ја содржат, додека тежината на месото се намалува за 20-40% Ако месото се потопува во ладна вода и се загрева, растворливите протеини од надворешните слоеви на месото се префрлаат во водата. За време на готвењето, тие денатурираат, што резултира со формирање на снегулки, пена што плови на површината на водата или фина суспензија што го прави растворот заматен..)
Сите протеински молекулиимаат конечен животен век - тие се распаѓаат со текот на времето.
Затоа, протеините постојано се обновуваат во телото. Во овој поглед, да се потсетиме на основите на биосинтезата на протеините. Одговорете на следните прашања. 1. Каде се случува синтезата на протеини во клетката?.)
( На рибозомите 2. Во што клеточна органела.)
се чуваат информации за примарната структура на протеинот. ( Во хромозомите, носител на информации е ДНК.)
3. Што се подразбира под поимот „ген“? ( Нуклеотидна секвенца која ја кодира синтезата на еден протеин.)
4. Како се нарекуваат главните фази на биосинтезата на протеините? ( Транскрипција, емитување.)
5. Од што се состои транскрипцијата? ( Ова е читање информации од ДНК со синтетизирање на гласник РНК што е комплементарна на ДНК регионот што се чита.)
6. Во кој дел од клетката се одвива транскрипцијата? ( Во јадрото.)
7. Од што се состои емитувањето? ( Ова е синтеза на протеин од амино киселини во низата снимена во mRNA; се јавува со учество на транспортни tRNA кои ги испорачуваат соодветните амино киселини до рибозомот.)
8. Во кој дел од клетката се одвива преводот?
( Во цитозолот, на рибозомите, во митохондриитеБиосинтезата на протеините се случува во телото во текот на животот, најинтензивно во детството. Интензитетот на синтезата на протеините во некои случаи може да се прилагоди. Дејството на многу антибиотици се заснова на супресија на синтезата на протеините, вклучително и кај бактериите кои ја предизвикуваат болеста. На пример, антибиотикот тетрациклин спречува tRNA да се врзе за рибозомите.
Ајде да слушаме
кратки пораки
за протеинските препарати кои се користат во современата медицина.
Во процесот на еволуција, во борбата против вирусите, животните развија механизам за синтеза на заштитниот протеин интерферон. Програмата за формирање на интерферон, како и секој протеин, е кодирана во ДНК во клеточното јадрои се вклучува откако клетките се заразени со вирус. Ладењето, нервниот шок и недостатокот на витамини во храната доведуваат до намалување на способноста за производство на интерферон. Во моментов, подготовката на интерферон за медицински цели се прави од леукоцити на донаторска крв или употреба генетски инженеринг. Интерферон се користи за спречување и лекување на вирусни инфекции - грип, херпес, како и за малигни неоплазми.
Инсулин
Инсулинот е протеин кој се состои од 51 аминокиселина. Се ослободува како одговор на зголеменото ниво на гликоза во крвта. Инсулинот го контролира метаболизмот на јаглени хидрати и ги предизвикува следниве ефекти:
– зголемување на стапката на конверзија на гликозата во гликоген;
– забрзување на трансферот на гликоза преку клеточните мембрани во мускулите и масното ткиво;
- зголемена синтеза на протеини и липиди;
– зголемување на брзината на синтеза на АТП, ДНК и РНК.
Инсулинот е неопходен за живот, бидејќи е единствениот хормон кој ја намалува концентрацијата на гликоза во крвта. Недоволното лачење на инсулин доведува до метаболичко нарушување познато како дијабетес мелитус. Инсулинските препарати се добиваат од панкреасот на говедата или преку генетски инженеринг.
Наставник по хемија.Инсулинот беше првиот протеин чија примарна структура беше дешифрирана. Беа потребни речиси 10 години за да се утврди низата на амино киселини во инсулинот. Во моментов, дешифрирана е примарната структура на многу голем број протеини, вклучувајќи ги и оние со многу посложена структура.
Синтезата на протеинските супстанции за прв пат беше спроведена со пример на два хипофизни хормони (вазопресин и окситоцин).
Конечно, наставниците им даваат оценки на учениците за нивната работа на часот по хемија и биологија.
Значењето на реакциите во боја е што тие овозможуваат да се открие присуството на протеини во биолошките течности, растворите и да се утврди составот на аминокиселините на различни природни протеини. Овие реакции се користат и за квалитативно и за квантитативно определување на протеинот и аминокиселините што ги содржи. Некои реакции се својствени не само за протеините, туку и за други супстанции, на пример, фенолот, како тирозин, дава розово-црвена боја со Милоновиот реагенс, така што спроведувањето на една реакција не е доволно за да се утврди присуството на протеин.
Постојат два типа на реакции на боја: 1) универзална - биурет (за сите протеини) и нинхидрин (за сите А-амино киселини и протеини); 2) специфичен - само за одредени аминокиселини и во протеинската молекула и во раствори на поединечни амино киселини, на пример, реакцијата Фол (за амино киселини кои содржат слабо врзан сулфур), реакцијата Милон (за тирозин), реакцијата Сакагучи ( за аргинин) итн.
Кога вршите реакции на боја за протеини и амино киселини, прво мора да ја составите следната табела:
Реакции на боја на протеини (квалитативни реакции)
Реакции на боја на протеини Експеримент 1. Реакција на биурет.
Реакција на биурет– квалитет за се без исклучок верверички, како и производи од нивните нецелосни хидролиза, кои содржат најмалку две пептидни врски.
Принцип на методот. Реакцијата на биурет е предизвикана од присуството во протеините пептидни врски(- CO – NH -), кои во алкална средина формираат црвено-виолетови обоени бакарни соли со бакар (II) сулфат комплекси. Реакцијата на биурет е исто така произведена од некои непротеински супстанции, на пример биурет(NH 2 -CO-NH-CO-NH 2), оксамид(NH 2 CO-CO-NH 2), серија амино киселини (хистидин, серин, треонин, аспарагин).
Реакција на биурет со глицин
Редоследот на работа.
Еднаков волумен од 10% раствор се додава на 1 ml од тестот 1% протеински раствор. натриум хидроксид(NaOH) алкали и потоа 2-3 капки 1% раствор бакар сулфат(CuSO 4). разреден, речиси безбоен раствор на бакар сулфат.
Ако реакцијата е позитивна, се појавува виолетова боја со црвена или сина нијанса.
Искуство 2.Реакцијадо „лабаво врзан сулфур“.
Принцип на методот. Ова е реакција на цистеин и цистин. За време на алкалната хидролиза, „слабо врзаниот сулфур“ во цистеинот и цистинот прилично лесно се разделува, што резултира со формирање на водороден сулфид, кој, реагирајќи со алкали, произведува натриум или калиум сулфиди. Кога се додава олово(II) ацетат, се формира сиво-црн талог од олово(II) сулфид.
Редоследот на работа.
1 ml неразреден пилешки протеин се истура во епрувета, се додава 2 ml од 20% раствор на натриум хидроксид. Смесата внимателно се вари (за смесата да не се фрли).
Во овој случај, се ослободува амонијак, кој се открива со синилото на влажната лакмус хартија донесена до отворот на епрувета (не допирајте го ѕидот). Малиот талог што се формира се раствора при вриење, а потоа се додава 0,5 ml раствор на олово(II) ацетат. Забележан е сиво-црн талог од олово(II) сулфид:


Хемија на реакцијата:

|
црн талог |
1 ml се истура во епрувета. додадете 2 ml неразреден пилешки протеин. концентриран алкален раствор, ставете неколку котли. Во врелиот раствор се додава раствор од натриум плумбит - се формира жолто-кафеава или црна боја. (Натриумскиот пломбит се подготвува на следниов начин: алкален раствор се додава по капка во 1 ml олово ацетат додека не се раствори талогот од олово хидроксид кој првично формира талог).
Ако протеинската молекула содржи аминокиселини што содржат сулфур (цистин, цистеин), сулфурот постепено се одвојува од овие амино киселини во форма на јон во оксидациона состојба - 2, чие присуство го открива оловниот јон, кој формира црна боја. нерастворлив олово сулфид со јон на сулфур:
Pb(CH 3 COO) 2 + 2NaOH Pb(OH) 2 + 2 CH 3 COONa,
Pb(OH) 2 + 2NaOH Na 2 PbO 2 + H 2 O,
Na 2 S + Na 2 PbO 2 + 2H 2 O PbS + 4NaOH.
Експеримент 3. Ксантопротеинска реакција на протеините.
Принцип на методот. Оваа реакција се користи за откривање на а-амино киселини кои содржат ароматични радикали. Тирозин, триптофан, фенилаланин, при интеракција со концентрирана азотна киселина, формираат нитро деривати кои имаат жолта боја. Во алкална средина, нитро дериватите на овие а-амино киселини даваат соли со портокалова боја. Желатин, на пример, кој не содржи ароматични амино киселини, не дава тест за ксантопротеин.
Редоследот на работа.
На 1 ml од 10% раствор на белка од пилешко јајце додадете 0,5 ml концентриран азотна киселина. Како резултат на коагулацијата на протеините, во содржината на епрувета се формира бел талог или заматување. Кога се загреваат, растворот и талогот добиваат светло жолта боја. Во овој случај, талогот е речиси целосно растворен како резултат на хидролиза. По ладењето, додадете 1–2 ml 20% раствор на натриум хидроксид (додека растворот не стане портокалов).
Да го разгледаме механизмот на реакцијата на ксантопротеин кај тирозин радикалот:


Реакциона хемија:

Дизајн на експериментот: извлечете заклучок и напишете ја равенката на реакцијата.
Експеримент 4. Реакција на Адамкевич (на присуството на триптофан во протеините).
Принцип на методот. Протеините кои содржат триптофан даваат црвено-виолетова боја во присуство на глиоксилна и сулфурна киселина. Реакцијата се заснова на способноста на триптофанот да реагира во кисела средина со алдехиди на глиоксилна киселина (што е нечистотија во концентрирана оцетна киселина) за да формира обоени производи за кондензација. Реакцијата се одвива според равенката:

Желатин не ја дава оваа реакција, бидејќи. не содржи триптофан. Бојата се јавува поради реакцијата на триптофан со глиоксилна киселина, која секогаш е присутна во оцетната киселина како нечистотија.
Истата реакција на триптофан може да се изврши со користење наместо тоа оцетна киселинаформалдехид 2,5% раствор на концентриран H 2 SO 4. Промешајте го растворот и по 2-3 минути. додајте 10 капки 5% натриум нитрит додека тресете. Се развива интензивна виолетова боја, што е основа за принципот на методотреакции.
Редоследот на работа.
Истурете неколку капки неразреден протеин во епрувета и додадете 2 ml. глацијална оцетна киселина и неколку капки глиоксилна киселина. Смесата малку се загрева додека не се раствори талогот што се формира, се лади и, силно навалувајќи ја епрувета, концентрираниот H 2 SO 4 внимателно се истура по ѕидот за да не се измешаат двете течности.
По 5-10 минути, се забележува формирање на црвено-виолетовиот прстен на интерфејсот помеѓу двата слоја.
Експеримент 5. Нинхидринска реакција.
Принцип на методот. а-Амино киселините реагираат со нинхидрин, формирајќи сино-виолетовиот комплекс (Ruemann виолетова), чиј интензитет на боја е пропорционален на количината на амино киселина. Реакцијата се одвива според следнава шема:

Хемија на реакции :


Реакцијата со нинхидрин се користи за визуелно откривање на а-амино киселини во хроматограми (на хартија, во тенок слој), како и за колориметриско определување на концентрацијата на амино киселините врз основа на интензитетот на бојата на производот од реакцијата.
Производот од оваа реакција го содржи радикалот (R) на оригиналната аминокиселина, која предизвикува различни бои: сина, црвена, итн. соединенија кои произлегуваат од реакцијата на амино киселините со нинхидрин.
Во моментов, реакцијата на нинхидрин е широко користена и за откривање на поединечни амино киселини и за одредување на нивната количина.
Редоследот на работа.
1 ml од 1-10% разреден раствор од белка од пилешко јајце и 1-2 ml од 1% раствор на нинхидрин во ацетон се истураат во епрувета. Содржината на епрувета се меша и внимателно се загрева во водена бања 2-3 минути додека не се појави сино-виолетова боја, што укажува на присуство на протеини. α - амино киселини.
Дизајн на експериментот: извлечете заклучок и напишете ја равенката на реакцијата.
Експеримент 6. Реакција на Сакагучи.
Принцип на методот. Оваа реакција на аминокиселината аргинин се заснова на интеракцијата на аргинин со а-нафтол во присуство на оксидирачки агенс. Неговиот механизам сè уште не е целосно разјаснет. Очигледно, реакцијата се изведува според следнава равенка:

Бидејќи дериватите на хинонски имини (во овој случај, нафтахинон), во кои водородот од имино групата –NH– се заменува со алкил или арил радикал, секогаш се обоени жолто-црвена, тогаш, очигледно, портокалово-црвената боја на растворот за време на реакцијата на Сакагучи се објаснува со појавата на дериват на нафтахинонеимин. Сепак, не може да се исклучи можноста за формирање на уште покомплексно соединение поради понатамошна оксидација на преостанатите NH групи на остаток од аргинин и бензенскиот прстен на а-нафтолот:
Редоследот на работа.
До 2 ml. Додадете 2 ml од 1% разреден раствор од белка од пилешко јајце. 10% натриум хидроксид (NaOH) и неколку капки 0,2% раствор на алкохол α -нафтол. Содржината на епрувета добро се меша. Потоа додадете 0,5 ml. натриум хипобромит (NaBrO) или натриум хипохлорит (натриум хипохлорит - NaOCl), измешајте. Веднаш се појавува црвена боја, која постепено се интензивира.
Веднаш додадете 1 ml 40% раствор на уреа за да ја стабилизирате портокалово-црвената боја што брзо се развива.
Оваа реакција е типична за соединенија кои содржат остаток од гванидин
NH = C -NH 2,
и укажува на присуство на амино киселина аргинин во протеинската молекула:
NH = C –NH – (CH 2) 3 –CH –COOH
Дизајн на експериментот: извлечете заклучок и напишете ја равенката на реакцијата.
Лабораториска работа 15 „Верверички“
Амино киселини се нарекуваат што содржат азот органски соединенија, чии молекули содржат амино групи и карбоксилни групи.
Во зависност од релативна положбасе разликуваат карбоксилни и амино групи -, b-, g- итн. амино киселини. На пример,
Терминот „амино киселина“ најчесто се користи за да се однесува карбоксилни киселини, чија амино група е во - позиција, т.е. за - амино киселини. Општата формула на аминокиселините може да се претстави на следниов начин:
Во зависност од природата на радикалот (R), аминокиселините се делат на алифатични, ароматични и хетероциклични.
Амино киселините реагираат едни со други преку реакција на поликондензација, што доведува до киселински амиди. Производите од таквата кондензација се нарекуваат пептиди. Кога две аминокиселини комуницираат, се формира дипептид:
Групата што се појавува -CO-NH- повика пептидна врска.
Кога дипептид е во интеракција со нова молекула на аминокиселина, се добива трипептид итн.
Примери за наједноставните амино киселини
Верверички - тие содржат азот висока молекуларна тежина органска материјасо комплексен состави структурата на молекулите. Тие се природни полимери (комплексни полипептиди), чии молекули се изградени од остатоци од аминокиселини поврзани едни со други со амидна (пептидна) врска.
Ова се природни полипептиди со вредности со висока молекуларна тежина (од 5-10 илјади до 1 милион или повеќе). Тие се дел од клетките и ткивата на сите живи организми и се главната компонента на нашата храна.
Протеините содржат јаглерод, водород, кислород и азот. Во многу помали количини, нивниот состав може да вклучува и сулфур, фосфор и други елементи. Протеините се многу нестабилни соединенија, што го отежнува проучувањето на нивните физички и хемиски својства. Крајните производи на разградувањето на протеините се
б- амино киселини. Нивната молекуларна тежина е многу голема.
Сите животни процеси се поврзани со протеини. Тие служат како хранливи материи, го регулираат метаболизмот, играат улога на ензими - метаболички катализатори, го промовираат преносот на кислород низ телото и неговата апсорпција, играат важна улогаво функционирањето нервниот систем, се механичка основа на мускулната контракција, учествуваат во преносот генетски информацииитн.
Експеримент 1. Коагулација на протеини кога се загрева.
Виткање на протеини, т.е. денатурација - процес на губење на природната (матична) конформација на протеинот, обично придружен со губење на неговата биолошка функција.При денатурирање под влијание надворешни фактори(температура, механички стрес, дејство хемиски реагенсии ред други фактори) настанува уништување на секундарните, терциерните и кватернерните структури на протеинската макромолекула. Примарната структура, и затоа хемиски составпротеините не се менуваат. Се менуваат физички својства: растворливост, способноста за хидратација се намалува, биолошката активност се губи. Обликот на протеинската макромолекула се менува и доаѓа до зголемување.
За работа, користете белка од пилешко јајце растворена во вода (една белка од јајце на 150 ml вода).
Опис на искуството. Загрејте мала количина протеински раствор на горилник додека не зоврие. Се забележува заматеност на течноста. Добиениот талог не се раствора ниту при ладење ниту при разредување со вода, т.е. реакцијата е неповратна.
Експеримент 2. Ксантопротеинска реакција
Реакцијата на ксантопротеин укажува на присуство на ароматични аминокиселински остатоци (фенилаланин, тирозин, триптофан) во протеините. Кога се изложени на концентрирана азотна киселина, реакцијата на нитрација на ароматичните јадра се јавува со формирање на жолто обоени нитро соединенија. Кога се изложени на амонијак, нитро-соединенијата се изомеризираат за да формираат интензивно обоени производи слични на сол.
Опис на искуството. Додадете 5-6 капки концентриран HNO3 во 1 ml протеински раствор додека не се појави бел талог (или заматување од протеинот коагулиран под влијание на киселина). Кога ќе се загреат, растворот и талогот ќе добијат светло жолта боја (талогот речиси целосно ќе се хидролизира и раствори).
Изладете ја смесата, додадете (внимателно, без тресење) вишок концентриран воден амонијак (или каустична алкали) капка по капка додека не се појави алкална реакција. Талогот од киселински албумин што ќе испадне прво ќе се раствори, а течноста ќе добие светло портокалова боја.
Реакцијата на биурет укажува на присуство на повторувачки пептидни групи -CO-NH- во протеинот. Ова се потврдува со фактот дека протеините даваат виолетова боја кога се изложени на мала количина раствор на бакар сулфат во присуство на алкали. Бојата се должи на формирањето на бакарни комплекси.
Експеримент 3. Реакција на биурет
Опис на искуството. Ставете 1 ml раствор од белка од јајце, 1 ml раствор на натриум хидроксид и 1-2 капки раствор на бакар (II) сулфат во епрувета. Течноста ќе стане црвено-виолетова (ако содржината на протеини е мала, внимателно додадете 0,5-1 ml раствор на CuSO4 во растворот во алкали; бојата ќе се појави на границата на слоевите). Равенка на реакција:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
2R - CH - COOH + Cu(OH)2 > (R- CH-COO) 2Cu + 2H2O
Експеримент 4. Таложење на протеини со соли тешки метали
Опис на искуството. Земете две епрувети и ставете 1 ml раствор од белка од јајце во нив и полека, додека тресете, капка по капка, додадете заситен раствор од бакар (II) сулфат во едната епрувета, а во другата 20% раствор од олово ацетат. . Се формираат талог од слабо растворливи протеински соединенија слични на сол. Искуството ја илустрира употребата на протеини како противотров за труење со соли на тешки метали. Равенки за реакција:
- 2R - CH - COOH + CuSO4 > (R- CH-COO) 2Cu + H2SO4
- 2R-CH-COOH + (CH3COO)2Pb> (R-CH-COO)2Pb + CH3COOH
Експеримент 4. Откривање на сулфур во протеините
Опис на искуството. Околу 0,5 ml раствор од олово ацетат се истура во епрувета и се додава раствор од калиум хидроксид додека добиениот талог од олово хидроксид не се раствори. Околу 2-3 ml протеински раствор се истура во друга епрувета и се додава истиот волумен на добиениот раствор на водовод. Загрејте ја смесата да зоврие 2-3 минути. Појавата на темна боја укажува на формирање на олово сулфит. Напиши ги равенките на реакцијата.
1) Реакција на биурет(за сите протеини)
Протеин + CuSO 4 + NaOH светла виолетова боја
СuSO 4 + 2NaOH Cu(OH) 2 + Na 2 SO 4
син талог
C = O: Cu: O = C C = O: N
NHOHN:O=C
растворлив комплекс
светло виолетова
2) Ксантопротеинска реакција(за протеини кои содржат АА со ароматичен радикал)
протеин + HNO 3 (k) седимент жолта
| || -- H 2 O | ||
N CH C─ + HONO 2 N CH C─
|
жолта
Ако додадете концентриран раствор на амонијак, се појавува портокалова боја бидејќи густината на електроните се менува во нитробензен.
3) Реакција на цистеин- реакција на остаток од АК што содржи С
Протеин + NaOH + Pb(CH 3 COO) 2 PbS + протеин
Црното
| Pb + PbS
БИОКАТАЛИЗА
Еден од важни карактеристикихемиските реакции што се случуваат во живите организми е нивната каталитичка природа. Живата клетка може да се смета како минијатурен каталитички реактор. Разликата помеѓу клетката и хемичарската колба е во тоа што ако во колбата сите реакции се одвиваат независно (се спроведува основниот принцип на независност на реакциите), тогаш во ќелијата сè се случува меѓусебно поврзано.
Тоа не се случува затоа што тие се прекршени физички закониили дали клетката се покорува на други закони - не, само законите функционираат во живата материја. Едноставно, во процесот на еволуција, природата создаде ефективен апарат за регулирање на сите клеточни реакции, што и овозможува на целата клетка да го контролира односот на производите така што сите реакции функционираат оптимално.
Значи се е био хемиски реакции- ова се реакции каталитички.
Биолошките катализатори се нарекуваат ензими или ензими.
Во принцип, во клетката се случуваат истите хемиски реакции како и во хемиска лабораторија, но се наметнуваат строги ограничувања за условите за реакции во клетката, имено T = 37 ◦ C и P = 1 atm.
Затоа, често процесите што се случуваат во една фаза во лабораторијата се изведуваат во неколку фази во живите клетки.
Суштината на каталитичките реакции, и покрај нивната разновидност, се сведува на фактот дека почетните материјали се формираат со катализаторот средна врска, кој релативно брзо се претвора во реакциони производи, регенерирајќи го катализаторот.
Понекогаш посредниците може да се изолираат во чиста форма, но обично тие се состојат од нестабилни молекули кои можат да се откријат само со помош на многу чувствителни спектрални инструменти.
Процесот кој вклучува катализатор е цикличен или кружен.

Мерка за ензимска активност - брзина(број на молови од супстратот што претрпува промена за 1 минута на 1 мол ензим)
Бројот на вртежи може да достигне 10 8.
Доста често, циклусите на неколку катализатори се комбинираат заедно, формирајќи кружен процес.

Супстанциите S1 и S2 се претвораат во производи P1 и P2. За време на оваа трансформација, S1 прво реагира со трета супстанција X и катализаторот E1, формирајќи среден производМ1, кој пак со помош на катализаторот Е2 се претвора во среден производ М2 итн.
Забрзувачкиот ефект на катализаторот е поврзан со намалувањето на енергијата за активирање (ова е дополнителна енергија што мора да се пренесе на еден мол од супстанцијата со цел честичките на супстанцијата да станат реактивни и способни да ја надминат енергетската бариера на реакција).
Главните својства на ензимите вклучуваат:
Ефикасност, која лежи во степенот на забрзување (забрзување за 100 милиони пати).
Зголемена специфичност на подлогата. Ензимите го разликуваат супстратот преку биолошкото препознавање (комплементарност).
Зголемена специфичност на катализираната реакција. Повеќето ензими забрзуваат еден вид реакција.
Зголемена специфичност за оптички изомери (може да препознае левораки и десни изомери).
Причина за се уникатни својстваензими - нивната просторна структура. Обично тоа се глобуларни протеини, многу поголеми од подлогата по големина. Оваа околност води до фактот дека во процесот на еволуција се формирал активен центар на површината на ензимот, кој е комплементарен на подлогата. Ова е брава и клуч.
Условно активните центри се делат на: врзувачки и каталитички.
Центарот за врзување ја врзува подлогата и оптимално ја ориентира во однос на катализираната група, додека сите активни групи се концентрирани во каталитичкиот центар.
Ако е неопходна хидролиза (на протеини, липиди) за да се спроведе реакција, тогаш катализираниот центар се формира од страничните радикали на остатоците од АА.
Во овој случај, ензимот се состои само од полипептидни синџири. Меѓутоа, покрај хидролитичките реакции, се јавуваат и други: редокс реакции, преносни реакции на која било група.
Во овие случаи, ензимите содржат непротеински дел. Овој дел е коензим(r-фактор, протетска група). Протеинскиот дел обезбедува врзувачки ефект, а коензимот обезбедува каталитички ефект. Протеински дел - апоензим.
Апоензим + коензим ↔холоензим