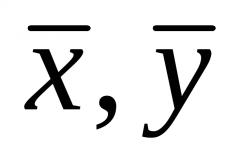Формулите за ковалентни врски се фундаментално различни од формулите за јонски врски. Факт е дека најмногу може да се формираат ковалентни соединенија на различни начини, затоа, како резултат на реакцијата, може да се појават различни соединенија.
1. Емпириска формула
Емпириската формула ги специфицира елементите што ја сочинуваат молекулата во нивните најмали соодноси на цел број.
На пример, C 2 H 6 O - соединението содржи два атоми на јаглерод, шест атоми на водород и еден атом на кислород.
2. Молекуларна формула
Молекуларната формула покажува од кои атоми се состои соединението и во колкави количини се присутни овие атоми во него.
На пример, за соединението C 2 H 6 O, молекуларните формули можат да бидат: C 4 H 12 O 2; C6H18O3...
За целосен описМолекуларната формула на ковалентно соединение не е доволна:
Како што можете да видите, двете врски имаат исти молекуларна формула- C 2 H 6 O, но тие се сосема различни супстанции:
- диметил етер се користи во единиците за ладење;
- етил алкохолот е основа на алкохолните пијалоци.
3. Структурна формула
Структурната формула служи за прецизна дефиницијаковалентно соединение, бидејќи покрај елементите во соединението и бројот на атомите покажува и дијаграм за поврзувањеврски.
Се користи структурната формула формула електрон-точкаИ Луис формула.
4. Структурна формула за вода (H 2 O)
Да ја разгледаме постапката за конструирање на структурна формула користејќи го примерот на молекула на вода.
I Градење на рамката за поврзување
Атомите на соединението се распоредени околу централниот атом. Централните атоми се обично: јаглерод, силициум, азот, фосфор, кислород, сулфур.

II Најдете го збирот на валентни електрони на сите атоми на соединението
За вода: H 2 O = (2 1 + 6) = 8
Атомот на водород има еден валентен електрон, а атом на кислород има 6. Бидејќи во соединението има два атоми на водород, вкупниот број на валентни електрони во молекулата на водата ќе биде 8.
III Да се определи бројот на ковалентни врски во молекулата на водата
Утврдено со формулата: S = N - A, Каде
С- бројот на електрони споделени во молекулата;
Н- збирот на валентни електрони што одговараат на пополнетиот надворешен ниво на енергијаатоми во соединение:
N=2- за водородниот атом;
N=8- за атоми на други елементи
А- збирот на валентни електрони на сите атоми во соединението.
N = 2 2 + 8 = 12
A = 2 1 +6 = 8
S = 12 - 8 = 4
Во молекулата на водата има 4 заеднички електрони Бидејќи ковалентна врска се состои од пар електрони, добиваме две ковалентни врски.
IV Дистрибуција на споделени електрони
Мора да има барем една врска помеѓу централниот атом и атомите што го опкружуваат. За молекула на вода ќе има две такви врски за секој водороден атом:

V Дистрибуирајте ги преостанатите електрони
Од осумте валентни електрони, четири се веќе распределени. Каде да се „стават“ преостанатите четири електрони?
Секој атом во соединението мора да има целосен октет електрони. За водород тоа е два електрони; за кислород - 8.

Споделените електрони се нарекуваат поврзување.

Формулата електрон-точка и формулата Луис јасно ја опишуваат структурата ковалентна врска, но се гломазни и заземаат многу простор. Овие недостатоци може да се избегнат со употреба компресирана структурна формула , што го означува само редоследот на врските.
Пример за кондензирана структурна формула:
- диметил етер - CH 3 OCH 3
- етил алкохол - C 2 H 5 OH
ДЕФИНИЦИЈА
Вода (водороден оксид)– бинарно неорганско соединение.
Хемиска формула: H2O
Структурна формула:
Моларна маса: 18,01528 g/mol.
Алтернативни имиња: оксид, водород хидроксид, хидроксилна киселина, дихидроген моноксид, оксидан, дихидромоноксид.
Во молекулата на водата, атомот на кислород е во состојба на хибридизација sp 3, бидејќи не само валентни електрони, туку и осамени електронски парови учествуваат во формирањето на хибридни орбитали. Хибридните орбитали се насочени кон темињата на тетраедарот:

Поради големата разлика во електронегативноста на кислородот и водородот, врските во молекулата се многу поларизирани, а електронот се поместува кон . Молекулата на водата има голем диполен момент бидејќи поларни врскилоцирани асиметрично.
Силната поларизација на O-H врската е поврзана со формирањето на водородни врскипомеѓу молекулите на водата. Секоја молекула на вода може да формира до четири водородни врски - две од нив се формираат од атом на кислород, а уште две од атоми на водород:

Со формирањето на водородни врски се одредува повисока точка на вриење, вискозност и површински напонвода во споредба со хидриди на аналози (селен и телуриум).
Изотопски модификации на водата
Во зависност од видот на водородните изотопи вклучени во молекулата, се разликуваат следниве: изотопски модификации на водата:
Имајќи го предвид фактот дека кислородот има три стабилни изотопи (16 O, 17 O и 18 O), можно е да се создадат 18 формули за молекули на вода кои се разликуваат во изотопскиот состав. Вообичаено, природната вода ги содржи сите овие типови на молекули.
Примери за решавање проблеми на тема „формула за вода“
ПРИМЕР 1
| Вежбајте | Во радијаторот на автомобилот се истури 9 литри вода и се додадени 2 литри метил со густина од 0,8 g/ml. На која минимална температура сега можете да го оставите автомобилот на отворено без страв дека водата во радијаторот ќе замрзне (криоскопската константа на водата е 1,86 K kg/mol)? |
| Решение | Според законот на Раул, намалувањето на температурата на кристализација на разредените раствори на неелектролити е еднакво на: каде што: – намалување на температурата на замрзнување на растворот; К cr – криоскопска константа на растворувачот; Cm е молалната концентрација на растворот; m B е масата на растворената супстанција; m A е масата на растворувачот; M B – моларна маса на растворената супстанција. Масата на метил алкохолот е: Масата на вода е еднаква на: Моларната маса на метил алкохолот е 32 g/mol Да ја пресметаме промената на температурата на замрзнување: |
| Одговори | Автомобилот може да се остави надвор на температури над -10,3°C |
ПРИМЕР 2
| Вежбајте | Колку грама Na 2 SO 4 10H 2 O треба да се растворат во 250 g вода за да се добие раствор кој содржи 5% безводен? |
| Решение | Моларната маса на Na 2 SO 4 е: Моларна маса на кристален хидрат: Количеството (мол) растворена сол да го означиме со x. Тогаш решението ќе биде еднакво на: Масата на безводна сол во готовиот раствор ќе биде еднаква на: |
Позната е формулата за основата на животот - водата. Нејзината молекула се состои од два атоми на водород и еден кислород, кој се пишува како H2O. Ако има двојно повеќе кислород, тогаш ќе се добие сосема друга супстанција - H2O2. Што е тоа и како ќе се разликува добиената супстанција од нејзината „релативна“ вода?
H2O2 - што е оваа супстанца?
Ајде да го разгледаме подетално. H2O2 е формулата на водород пероксид, Да, истата што се користи за лекување гребнатини, бела. Водород пероксид H2O2 - научен.
За дезинфекција, користете трипроцентен раствор на пероксид. Во чиста или концентрирана форма предизвикува хемиски изгореници на кожата. Триесет проценти раствор на пероксид инаку се нарекува перхидрол; Претходно се користеше во фризерите за избелување на косата. И кожата изгорена од него побелува.
Хемиски својства на H2O2
Водород пероксид е безбојна течност со „метален“ вкус. Тој е добар растворувач и лесно се раствора во вода, етер и алкохоли.
Растворите на пероксид од три и шест проценти обично се подготвуваат со разредување на триесет проценти раствор. При складирање на концентриран H2O2, супстанцијата се распаѓа со ослободување на кислород, па затоа не треба да се чува во цврсто затворени садови за да се избегне експлозија. Како што се намалува концентрацијата на пероксид, неговата стабилност се зголемува. Исто така, за да го забавите распаѓањето на H2O2, можете да додадете разни супстанции на него, на пример, фосфорна или салицилна киселина. За складирање на раствори со висока концентрација (повеќе од 90 проценти), натриум пирофосфат се додава во пероксид, кој ја стабилизира состојбата на супстанцијата, а се користат и алуминиумски садови.

H2O2 во хемиски реакцииможе да биде и оксидирачки и редукционен агенс. Сепак, почесто пероксид експонати оксидирачки својства. Пероксидот се смета за киселина, но многу слаба; солите на водород пероксид се нарекуваат пероксиди.
како метод за производство на кислород
Реакцијата на распаѓање на H2O2 се јавува кога супстанцијата е изложена на висока температура (повеќе од 150 степени Целзиусови). Како резултат на тоа, се формираат вода и кислород.
Формула за реакција - 2 H2O2 + t -> 2 H2O + O2
Оксидационата состојба на H во H 2 O 2 и H 2 O = +1.
Состојба на оксидација на O: во H 2 O 2 = -1, во H 2 O = -2, во O 2 = 0
2 O -1 - 2e -> O2 0
О -1 + е -> О -2
2 H2O2 = 2 H2O + O2
Распаѓањето на водород пероксид може да се случи и кога собна температура, ако користите катализатор ( хемиска супстанција, забрзување на реакцијата).
Во лабораториите, еден од методите за добивање кислород, заедно со распаѓање бертолет солили калиум перманганат, е реакција на распаѓање на пероксид. Во овој случај, манган (IV) оксид се користи како катализатор. Други супстанции кои го забрзуваат распаѓањето на H2O2 се бакар, платина и натриум хидроксид.
Историја на откривањето на пероксид
Првите чекори кон откривањето на пероксидот ги направил во 1790 година Германецот Александар Хумболт, кога ја открил трансформацијата на бариум оксидот во пероксид кога се загрева. Тој процес беше проследен со апсорпција на кислород од воздухот. Дванаесет години подоцна, научниците Тенард и Геј-Лусак спроведоа експеримент за согорување алкални металисо вишок кислород, што резултира со натриум пероксид. Но, водород пероксид бил добиен подоцна, дури во 1818 година, кога Луј Тенард го проучувал ефектот на киселините врз металите; мала количина на кислород беше неопходна за нивната стабилна интеракција. Спроведувајќи потврден експеримент со бариум пероксид и сулфурна киселина, научникот им додаде вода, водород хлорид и мраз. По кратко време, Тенар открил мали замрзнати капки на ѕидовите на контејнерот со бариум пероксид. Стана јасно дека тоа е H2O2. Потоа на добиениот H2O2 му го дадоа името „оксидирана вода“. Ова беше водороден пероксид - безбојна, без мирис, тешко испарувачка течност која добро ги раствора другите супстанции. Резултатот од интеракцијата на H2O2 и H2O2 е реакција на дисоцијација, пероксидот е растворлив во вода.

Интересен факт е дека својствата на новата супстанција беа брзо откриени, што ѝ овозможи да се користи во реставраторски работи. Самиот Тенард, користејќи пероксид, ја обновил сликата на Рафаел која се затемнила со текот на времето.
Водород пероксид во 20 век
По внимателно проучување на добиената супстанција, таа почна да се произведува на индустриско ниво. На почетокот на дваесеттиот век беше воведена електрохемиска технологија за производство на пероксид, базирана на процесот на електролиза. Но, рокот на траење на супстанцијата добиена со овој метод беше краток, околу неколку недели. Чистиот пероксид е нестабилен и во најголем дел се произведувал во триесет проценти концентрација за избелување ткаенини и во три или шест проценти концентрација за потребите на домаќинствата.
Научниците фашистичка Германијакористел пероксид за да создаде ракетен мотор со течно гориво кој се користел за одбранбени цели во Втората светска војна. Како резултат на интеракцијата на H2O2 и метанол/хидразин, добиено е моќно гориво, на кое леталото достигнува брзина поголема од 950 km/h.
Каде се користи сега H2O2?
- во медицината - за лекување на рани;
- во индустријата за целулоза и хартија се користат својствата за белење на супстанцијата;
- во текстилната индустрија, природните и синтетичките ткаенини, крзната и волната се белеат со пероксид;
- Како погонско горивоили негов оксидирачки агенс;
- во хемијата - за производство на кислород, како средство за пенење за производство на порозни материјали, како катализатор или средство за хидрогенизација;
- за производство на средства за дезинфекција или средства за чистење, избелувачи;
- за белење на косата (ова е застарен метод, бидејќи косата е сериозно оштетена од пероксид);

Водород пероксид може успешно да се користи за решавање на разни проблеми во домаќинството. Но, за овие цели може да се користат само три проценти водород пероксид. Еве неколку начини:
- За чистење на површините, треба да истурете пероксид во контејнер со шише со распрскувач и да го испрскате на контаминирани места.
- За да се дезинфицираат предметите, тие треба да се избришат со неразреден раствор H2O2. Ова ќе помогне да се исчистат од штетните микроорганизми. Сунѓерите за перење може да се натопат во вода со пероксид (сооднос 1:1).
- За да ги избелите ткаенините, додадете чаша пероксид кога миете бели предмети. Белите ткаенини можете да ги исплакнете и во вода измешана со чаша H2O2. Овој метод ја враќа белината, ги штити ткаенините од пожолтување и помага да се отстранат тврдоглавите дамки.
- За борба против мувла и мувла, измешајте пероксид и вода во сооднос 1:2 во контејнер со шише со распрскувач. Добиената смеса испрскајте ја на контаминирани површини и по 10 минути исчистете ги со четка или сунѓер.
- Можете да ја обновите затемнетата инјекциска смеса во плочки со прскање со пероксид на саканите области. По 30 минути, треба темелно да ги истриете со цврста четка.
- За миење садови, додадете половина чаша H2O2 во полн слив со вода (или мијалник со затворен одвод). Чашите и чиниите измиени во овој раствор ќе блескаат чисто.
- За да ја исчистите четката за заби, треба да ја потопите во неразреден трипроцентен раствор на пероксид. Потоа исплакнете под силна проточна вода. Овој метод добро ги дезинфицира хигиенските предмети.
- За да го дезинфицирате купениот зеленчук и овошје, треба да попрскате со раствор од 1 дел пероксид и 1 дел вода врз нив, а потоа темелно да ги исплакнете со вода (може да е ладно).
- Во вашата летна куќа, користејќи H2O2 можете да се борите со растителните болести. Потребно е да ги испрскате со раствор од пероксид или да ги натопите семето кратко пред садењето во 4,5 литри вода измешана со 30 ml четириесет проценти водород пероксид.
- За да ги оживеете аквариумските риби, доколку се отруени со амонијак, задушени кога аерацијата е исклучена или поради друга причина, можете да се обидете да ги ставите во вода со водород пероксид. Треба да измешате три проценти пероксид со вода со брзина од 30 ml на 100 литри и да ставите безживотна риба во добиената мешавина 15-20 минути. Ако тие не оживеат во ова време, тогаш лекот не помогна.

Дури и како резултат на енергично тресење на шише со вода, во него се формира одредена количина пероксид, бидејќи водата е заситена со кислород за време на ова дејство.
Свежото овошје и зеленчук исто така содржат H2O2 додека не се сварат. При загревање, вриење, пржење и други процеси со придружна висока температура се уништува. голем бројкислород. Ова е причината зошто готвената храна се смета за не толку здрава, иако некои витамини остануваат во нив. Свежо цедените сокови или коктели со кислород што се служат во санаториуми се корисни од истата причина - поради заситеноста со кислород, што му дава на телото нова сила и го чисти.
Опасност од пероксид при внесување
По горенаведеното, може да изгледа дека пероксидот може посебно да се зема орално, а тоа ќе му користи на телото. Но, тоа воопшто не е точно. Во водата или соковите, соединението се наоѓа во минимални количинии е тесно поврзан со други супстанции. Внатрешното земање „неприроден“ водороден пероксид (и целиот пероксид купен во продавница или произведен како резултат на хемиски експерименти независно не може да се смета за природен, а згора на тоа, има превисока концентрација во споредба со природниот) може да доведе до опасност по животот и здравствените последици. . За да разбереме зошто, треба повторно да се свртиме кон хемијата.
Како што веќе споменавме, под одредени услови, водородниот пероксид се распаѓа и ослободува кислород, кој е активен оксидирачки агенс. може да се случи кога H2O2 ќе се судри со пероксидаза, интрацелуларен ензим. Употребата на пероксид за дезинфекција се заснова на неговите оксидирачки својства. Значи, кога раната се третира со H2O2, ослободениот кислород ги уништува живите патогени микроорганизми кои влегле во неа. Истиот ефект го има и врз другите живи клетки. Ако ја третирате недопрената кожа со пероксид, а потоа ја избришете третираната површина со алкохол, ќе почувствувате чувство на печење, што го потврдува присуството на микроскопско оштетување по пероксид. Но, кога пероксид со мала концентрација се користи надворешно, нема да има забележителна штета на телото.

Друга работа е ако се обидете да го земате орално. Таа супстанца, која може да ја оштети дури и релативно густата кожа однадвор, завршува на слузокожата на дигестивниот тракт. Тоа е, се случуваат хемиски мини-изгореници. Се разбира, ослободениот оксидирачки агенс - кислородот - исто така може да убие штетни микроби. Но, истиот процес ќе се случи и со клетките на прехранбениот тракт. Доколку се повторат изгорениците како резултат на дејството на оксидирачкиот агенс, тогаш можна е атрофија на мукозните мембрани, а тоа е првиот чекор на патот кон ракот. Смртта на цревните клетки доведува до неспособност на телото да ги апсорбира хранливите материи, што објаснува, на пример, губење на тежината и исчезнување на запек кај некои луѓе кои практикуваат „третман“ со пероксид.
Одделно, неопходно е да се каже за овој метод на употреба на пероксид, како што се интравенски инјекции. Дури и ако поради некоја причина тие биле препишани од лекар (ова може да се оправда само во случај на труење на крвта, кога нема други соодветни лекови на располагање), тогаш под медицински надзор и со строги пресметки на дозата, сè уште постојат ризици. Но, во такви екстремна ситуацијаова ќе биде шанса за закрепнување. Во никој случај не треба да си препишувате инјекции со водород пероксид. H2O2 претставува голема опасност за крвните зрнца - црвените крвни зрнца и тромбоцитите, бидејќи ги уништува кога ќе влезе во крвотокот. Покрај тоа, може да дојде до фатална блокада на крвните садови од ослободениот кислород - гасна емболија.
Безбедносни мерки на претпазливост при ракување со H2O2
- Да се чува подалеку од дофат на деца и лица со посебни потреби. Недостатокот на мирис и посебен вкус го прави пероксидот особено опасен за нив, бидејќи може да се земаат големи дози. Ако растворот влезе внатре, последиците од употребата може да бидат непредвидливи. Веднаш треба да се консултирате со лекар.
- Растворите на пероксид со концентрација поголема од три проценти предизвикуваат изгореници доколку дојдат во контакт со кожата. Местото со изгореници треба да се измие со многу вода.

- Не дозволувајте растворот на пероксид да влезе во вашите очи, бидејќи тоа ќе предизвика оток, црвенило, иритација, а понекогаш и болка. Прва помош пред да се јавите на лекар е обилно миење на очите со вода.
- Чувајте ја супстанцијата на таков начин што ќе биде јасно дека е H2O2, односно во сад со налепница за да избегнете случајна употреба за други цели.
- Условите за складирање кои го продолжуваат неговиот животен век се темно, суво, ладно место.
- Водород пероксид не треба да се меша со други течности освен чиста вода, вклучително и хлорирана вода од чешма.
- Сето горенаведено се однесува не само на H2O2, туку и на сите препарати што го содржат.
Водата, според својата формула - H2O, треба да се состои само од мешавина од два гасови - водород и кислород, сепак, ова не е ништо повеќе од лабораториски стандард. Всушност, тоа е мешавина од повеќето разни материи, лоциран во широк спектар на физички и хемиски состојби. Хемискиот состав на природната вода е многу, многу разновиден.
Фактори кои влијаат на формирањето на хемискиот состав
Хемиската анализа на водата спроведена во лабораторија ни овозможува да го одредиме составот на сите нечистотии од органско и минерално потекло кои се во течноста во форма на молекули, јони, суспензии, колоиди и емулзии. Вклучено хемиски состави површни и подземните водиЗначително влијаат географската положба, геолошката структура и климатските услови на подрачјето во кое се наоѓаат.
💦 Да го разгледаме накратко хемискиот состав на природната вода, кој е прилично сложен дисперзивен систем, каде што водата е дисперзиран медиум, а органските, минералните материи, гасовите и живите микроорганизми се дисперзирана фаза.
Околу 90 до 95 проценти од компонентите кои се наоѓаат растворени во вода се соли, кои постојат таму во форма на јони. Природната вода секогаш содржи „множество“ од три анјони и четири катјони (HCO3-, SO42-, Cl-, Ca2+, Mg2+, Na+, K+), кои обично се нарекуваат главни јони.
Некои од нив се без вкус, додека други и даваат на течноста горчлив и солен вкус. Тие влегуваат во вода главно од почвата, карпите и минералите. Некои од овие јони потекнуваат од производствени активностилице. Овие макрокомпоненти се содржани во вода во различни концентрации.

Природната вода, покрај главните јони, содржи и разни гасови, се разбира, во растворена форма. Еден од најважните е кислородот, кој на течноста и дава свеж вкус. Овој гас може да се содржи во вода различни количини, се зависи од природни услови. Освен кислород, водата содржи гасови како што се азот и метан, кои немаат ниту вкус ниту мирис, како и токсичен водороден сулфид, кој на течноста и дава исклучително непријатен мирис. Концентрацијата на овие гасови во водата се определува главно од нејзината температура.
Покрај тоа, водата содржи хранливи материи кои го сочинуваат мнозинството од сите постоечки живи организми. Тие главно вклучуваат соединенија на фосфор и азот. Што се однесува до азот, тој може да се содржи во природна вода и во органски и неоргански форми. Концентрацијата на хранливи материи во таква течност може да биде во многу различни граници - од само траги до 10 милиграми на литар. Главните извори на овие супстанции се атмосферските врнежи, површинското истекување, како и земјоделските, индустриските и домашните отпадни води.
Составни компоненти на водата се микроелементи, кои се содржани во течноста во помалку од еден милиграм на литар. Тие ги вклучуваат практично сите познати метали, со исклучок на железото и главните јони и некои неметали. Многу важни од нив се флуорот и јодот, кои обезбедуваат нормално функционирање на човечкото тело.
Меѓу другото, водата содржи и растворени органска материја. Овие се суштински органски форми на хранливите материи споменати погоре. Тие вклучуваат: јаглени хидрати, органски киселини, феноли, алдехиди, алкохоли, ароматични соединенија, етери и така натаму.
Хемискиот состав на водата, покрај наведените, вклучува и токсични соединенија и супстанции - нафтени деривати, тешки метали, сурфактанти, органохлорни пестициди, феноли и така натаму.
Природна вода поради присуството во неа голем бројмеурчиња од гас и разни суспендирани честички се смета за нехомогена средина.
1.000 g/cm3 (3,98°C), точка на топење 0°C, точка на вриење 100°C; Кога е замрзнат, формира мраз. Едно од најчестите соединенија во природата (количината на вода на површината на Земјата е 1,39?1018 тони, во атмосферата 1,3?1013 тони); Познати се изотопски видови (види Тешка вода). Водата е дел од многу минерали и карпи, сите живи организми (45 - 98%, вклучително и околу 60% од телесната тежина во човечкото тело) и е присутна во почвата. Задолжителна компонента за речиси секого технолошки процесиво индустријата и земјоделството. Водата со висока чистота е потребна во производството на храна, полупроводници, фосфори, нуклеарна технологија, хемиска анализаитн. Како се користат медицинските третмани? природни води, кои содржат зголемени количини на минерални соли, гасови, некои хемиски елементи(види Минерални води).
Модерна енциклопедија. 2000 .
Погледнете што е „WATER, H2O“ во другите речници:
Вода - добијте тековен промотивен код за попуст на Perekrestok на Академика или купете вода со попуст на распродажба во Perekrestok
H2O: Само додадете вода... Википедија
Вода- ВОДА, H2O, течност без мирис, вкус и боја; густина 1.000 g/cm3 (3.98°C), точка на топење 0°C, точка на вриење 100°C; Кога е замрзнат, формира мраз. Едно од најчестите соединенија во природата (количеството на вода на површината на Земјата е 1,39´1018 тони, во атмосферата ... Илустриран енциклопедиски речник
вода- вода, H2O, без мирис, без вкус, безбојна течност (сина во дебели слоеви). Наједноставно стабилно соединение на водород и кислород (11,19% H и 88,81% O по маса). Густина 1000 g/cm3 (3,98ºC), точка на топење 0ºC, точка на вриење 100ºC. Најчестата супстанца... Земјоделство. Голем енциклопедиски речник
Содржина 1 епизоди 2 Преглед на сезони 3 Список на епизоди 3.1 ... Википедија
Chem. соединение од водород и кислород. Неговиот тежински состав: 11,19% H и 88,81% O. Молекуларна тежина 18,0153. Во молекулата на кислородот има 10 електрони (5 пара): еден пар внатрешни електрони се наоѓа во близина на јадрото на кислородот, два пара надворешни електрони... ... Геолошка енциклопедија
ВОДА- вода, водороден оксид, H2O, наједноставната стабилна во нормални услови хемиско соединениеводород со кислород (11,19% H и 88,81% O по маса). Молекуларна тежина 18,0160, точка на замрзнување 0°C (на 1 atm), точка на вриење 100ºC (на 1 atm), густина на... ... Ветеринарен енциклопедиски речник
вода (супстанција)- - EN вода (супстанција) Заедничка течност (H2O) која формира дожд, реки, море итн., а која сочинува голем дел од телата на организмите. (Извор: ПЗЗ)…… Водич за технички преведувач
водата се адсорбира- адсорпциона вода за адсорпција на вода Адсорпција на молекули H2O, кои се привлекуваат од минерали под прилив на површинска енергија... Енциклопедиски речник Гирниши
ВОДА- H2O, без мирис, без вкус, безбојна течност (сина во дебели слоеви). Наједноставно стабилно соединение на водород и кислород (11,19% H и 88,81% O по маса). Сплав. 1000 g/cm3 (3,98 °C), точка на топење 0 °C, точка на вриење 100 °C. Најчеста работа во природата... Земјоделски енциклопедиски речник
Водород оксид, H20, наједноставното хемиско соединение на водород и кислород кое е стабилно во нормални услови (11,19% водород и 88,81% кислород по маса), молекуларна тежина 18,0160; безбојна течност, без мирис и вкус (во дебели слоеви... ... Голема советска енциклопедија