Наука до технологија. Водата, која е толку распространета во природата, секогаш содржи растворени материи. ВО свежа водаИма малку реки и езера, додека морската вода содржи околу 3,6% растворени соли.
Во исконскиот океан (за време на појавата на животот на Земјата) масен уделсе претпоставуваше дека солите се ниски, околу 1%.
Токму во овој раствор најпрвин се развиле живите организми, а од овој раствор ги добивале материите и молекулите неопходни за нивниот раст и живот... Со текот на времето живите организми клоцале и се менувале. ШТО им дозволило да ја напуштат водната средина и да се преселат на копно, а потоа да се издигнат во воздухот. Тие ја стекнале оваа способност, а нивните организми задржале воден раствор во форма на течности кои ги содржат потребните резерви на јони и молекули“ – вака познатиот американски хемичар, лауреат ја оценува улогата на растворите во појавата и развојот на животот на Земјата. Нобелова наградаЛинус Полинг Внатре во нас, во секоја ваша клетка, има сеќавање на исконскиот океан во кој настанал животот - водениот раствор кој обезбедува самиот живот.
Во секој жив организам, магично решение кое ја формира основата на крвта бескрајно тече низ садовите - артерии, вени и капилари; масениот удел на соли во него е ист како во примарниот океан. - 0,0%. Сложените физички и хемиски процеси кои се случуваат во човечките и животинските тела се случуваат и во растворите. Апсорпцијата на храната е поврзана со трансферот на хранливи материи во растворот. Природните водени раствори учествуваат во процесите на формирање на почвата и ги снабдуваат растенијата со хранливи материи. Многумина технолошки процесиво хемиските и другите индустрии, на пример, производството на сода, ѓубрива, киселини, метали, хартија, се јавуваат во раствори. Изучувањето на својствата на растворите зазема многу важно место во модерната наука. Значи, што е решение?
Разликата помеѓу растворот и другите мешавини е оваа. дека честичките компонентисе распределуваат рамномерно во него, а во секој микроволумен од таквата смеса составот е ист.
Затоа решенија значеше хомогени смеси кои се состојат од два или повеќе хомогени делови. Овој поднесок дојде од физичка теоријарешенија.
Поддржувачите на физичката теорија на решенија, која беше развиена Вант Хоф, Lrenius и Ostwald, верувале дека процесот на растворање е резултат на дифузија, односно пенетрација на растворената супстанција во просторите помеѓу молекулите на водата.
За разлика од идеите на физичката теорија на решенија. Д.И. Менделеев и поддржувачите на хемиската теоријарастворите докажаа дека растворувањето е резултат на хемиската интеракција на растворената супстанција со молекулите на водата. Затоа, поточно (поточно) е да се дефинира растворот како хомоген систем кој се состои од честички на растворена супстанција, растворувач и производи од нивната интеракција.
Како резултат на хемиската интеракција на растворена супстанција со вода, се формираат хидратни соединенија. ЗА хемиска интеракцијазнаци на хемиски реакции како што се термички феноменикога се раствораат. На пример, запомнете дека растворањето на сулфурна киселина во вода продолжува со ослободување на таква големо количествозагрејте, така што растворот може да зоврие и затоа истурете киселина во вода (а не обратно). Распуштањето на други супстанции, како што се натриум хлорид и амониум нитрат, е придружено со апсорпција на топлина.
Содржина на лекцијата белешки за лекцијатаподдршка на рамка лекција презентација методи забрзување интерактивни технологии Вежбајте задачи и вежби работилници за самотестирање, обуки, случаи, потраги прашања за дискусија за домашни задачи реторички прашања од ученици Илустрации аудио, видео клипови и мултимедијафотографии, слики, графики, табели, дијаграми, хумор, анегдоти, шеги, стрипови, параболи, изреки, крстозбори, цитати Додатоци апстрактистатии трикови за љубопитните креветчиња учебници основни и дополнителен речник на поими друго Подобрување на учебниците и лекциитекорекција на грешки во учебникотажурирање фрагмент во учебник, елементи на иновација во лекцијата, замена на застарените знаења со нови Само за наставници совршени лекции календарски планза една година насокипрограми за дискусија Интегрирани лекцииВо обична неповрзана течност, како што е бензинот, молекулите слободно се лизгаат една околу друга. Во вода, тие се тркалаат наместо да се лизгаат. Познато е дека молекулите на водата се поврзани едни со други со водородни врски, така што пред да се случи какво било поместување, мора да се прекине барем една од овие врски. Оваа карактеристика ја одредува вискозноста на водата.
Диелектричната константа на водата е нејзината способност да ја неутрализира привлечноста што постои помеѓу електрични полнежи. Распуштањето на цврсти материи во вода е сложен процес кој се одредува со интеракцијата на честичките на растворената супстанција и честичките на водата.
При проучување на структурата на супстанциите со користење на Х-зраци, беше откриено дека повеќето цврсти материиима кристална структура, односно честичките на супстанцијата се наоѓаат во просторот во одреден редослед. Честичките на некои супстанции се наоѓаат како да се во аглите на мала коцка, честички на други - во аглите, центарот и средината на страните на тетраедарот, призмата, пирамидата итн. Секоја од овие форми е најмалата клетка од поголеми кристали со слична форма. Некои супстанции имаат свои јазли кристална решеткаима молекули (повеќето органски соединенија), за други (на пример, неоргански соли) - јони, т.е. честички кои се состојат од еден или повеќе атоми со позитивни или негативни полнежи. Силите кои ги задржуваат јоните во одреден просторно ориентиран редослед на кристалната решетка се силите на електростатско привлекување на спротивно наелектризираните јони кои ја сочинуваат кристалната решетка.
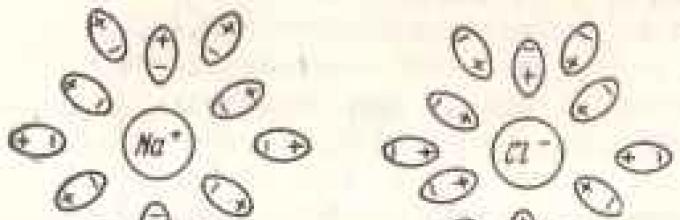
Ако, на пример, натриум хлорид се раствори во вода, тогаш позитивно наелектризираните натриумови јони и негативно наелектризираните јони на хлор ќе се одвратат еден со друг.
Ова одбивање се случува затоа што водата има висока диелектрична константа, односно повисока од онаа на која било друга течност. Ја намалува силата на взаемно привлекување помеѓу спротивно наелектризираните јони за 100 пати. Причината за силниот неутрализирачки ефект на водата мора да се бара во распоредот на нејзините молекули. Водородниот атом во нив не го дели својот електрон подеднакво со атомот на кислород за кој е прикачен. Овој електрон е секогаш поблиску до кислородот отколку до водородот. Затоа, атомите на водород се позитивно наелектризирани, а атомите на кислород се негативно наелектризирани.
Кога супстанцијата се раствора во јони, атомите на кислород се привлекуваат кон позитивни јони, а атомите на водород се привлекуваат кон негативни јони. Молекулите на водата што го опкружуваат позитивниот јон ги испраќаат своите атоми на кислород кон него, а молекулите што го опкружуваат негативниот јон ги испраќаат своите атоми на водород кон него. Така, молекулите на водата формираат еден вид решетка, која ги одделува јоните едни од други и ја неутрализира нивната привлечност (сл. 12). За да се одделат јоните кои се наоѓаат во кристалната решетка еден од друг и да се пренесат во раствор, неопходно е да се надмине привлечната сила на оваа решетка. При растворање на соли, оваа сила е привлекување на јони на решетка од молекулите на водата, што се карактеризира со таканаречената енергија на хидратација. Ако енергијата на хидратација е доволно висока во споредба со енергијата на кристалната решетка, тогаш јоните ќе се отцепат од втората и ќе влезат во раствор.
Односот помеѓу молекулите на водата и јоните одвоени од решетката во растворот не само што не слабее, туку станува уште поблизок.
Како што веќе беше забележано, во растворот, јоните се опкружени и одделени со молекули на вода, кои, фокусирајќи се на нив со нивните спротивставени делови, ја формираат таканаречената хидратантна обвивка (сл. 13). Големината на оваа школка варира во зависност од различни јонии зависи од полнежот на јонот, неговата големина и, дополнително, од концентрацијата на јоните во растворот.
Неколку години, физичките хемичари ја проучувале водата главно како растворувач за електролити. Како резултат на тоа, многу информации се добиени за електролитите, но многу малку за самата вода. Чудно е доволно, но само во последните годиниСе појавија дела посветени на проучување на односот на водата со супстанциите што се практично нерастворливи во неа.
Беа забележани многу неверојатни феномени. На пример, еден ден се покажа дека цевката што носи природен гас на t = 19 ° C е затнат со влажен снег и вода. Стана јасно дека тука проблемот не е температурата, туку другите својства на водата. Се појавија голем број прашања: зошто водата замрзна на толку висока температура, како водата може да се комбинира со супстанции кои се нерастворливи во неа.
Оваа мистерија сè уште не беше решена кога беше откриено дека дури и такви благородни гасови како аргон и ксенон, кои не влегуваат во хемиски реакции, може да се врзе со вода, формирајќи некаков привид на соединенија.

Ориз. 13. Одвојување на јони Na + и C1 - поларни молекуливода, формирајќи хидратантна обвивка околу нив.
Интересни резултатина растворливоста на метанот во вода се добиени во Илиноис. Молекулите на метанот не формираат јони во водата и не ги перцепираат водородните врски; привлечноста меѓу нив и молекулите на водата е многу слаба. Меѓутоа, метанот сепак, иако слабо, се раствора во вода, а неговите дисоцирани молекули формираат соединенија со него - хидрати, во кои неколку молекули на вода се прикачени на една молекула на метан. Оваа реакција ослободува 10 пати повеќе топлина отколку со растворање на метан во хексан (метан подобро се раствора во хексан отколку во вода).
Голем интерес е фактот дека метанот се раствора во вода. На крајот на краиштата, молекулата на метан има двојно поголем волумен повеќе молекулавода. За метанот да се раствори во вода, мора да се формираат доста големи „дупки“ помеѓу неговите молекули. Ова бара значително трошење на енергија, поголемо отколку за испарување на водата (приближно 10.000 калории за секој мол). Од каде толку енергија? Привлечните сили помеѓу молекулите на метанот и водата се премногу слаби, тие не можат да обезбедат толку многу енергија. Затоа, постои друга можност: структурата на огништето се менува во присуство на метан. Да претпоставиме дека молекула на растворен метан е опкружена со обвивка од 10-20 молекули на вода. Кога се формираат такви молекуларни асоцијации, топлината се ослободува. Во просторот окупиран од молекула на метан, силите на взаемно привлекување помеѓу молекулите на водата, а со тоа и внатрешниот притисок, исчезнуваат. Во такви услови, како што видовме, водата замрзнува на температури над нулата.
Ова е причината зошто молекулите во јазот помеѓу метанот и водата можат да се кристализираат, што се случи во случајот опишан погоре. Замрзнатите хидрати може да се апсорбираат во растворот и да се ослободат од него. Оваа теорија е позната како теорија на ледениот брег. Во пракса, како што покажуваат студиите, сите неспроводливи супстанции кои беа тестирани формираат стабилни кристални хидрати. Во исто време, оваа тенденција е слабо изразена во електролитите. Сето ова води до сосема ново разбирање на растворливоста.
Се веруваше дека растворањето на електролитите се јавува како резултат на привлечни сили. Сега е докажано дека растворањето на не-електролитите не се случува поради силите на привлекување помеѓу овие супстанции и водата, туку како резултат на недоволна привлечност меѓу нив. Супстанциите кои не се распаѓаат на јони се комбинираат со вода, бидејќи го елиминираат внатрешниот притисок и со тоа придонесуваат за појава на кристални формации.
За подобро да се разбере формирањето на таквите хидрати, корисно е да се разгледа нивната молекуларна структура.
Докажано е дека добиените хидрати имаат кубна структура(решетка) за разлика од хексагоналната структура на мразот. Понатамошна работаИстражувачите покажаа дека хидратот може да има две кубни решетки: во едната просторите меѓу молекулите се 12 А, во другата - 17 А. Во помалата решетка има 46 молекули на вода, во поголемата 136. Дупките на молекулите на гас во помалата решетка имаат 12-14 лица, а во поголемата - 12-16, згора на тоа, тие се разликуваат по големина и се полни со молекули со различни големини, а не може да се пополнат сите дупки. Овој модел ја објаснува вистинската структура на хидратите со висок степен на точност.
Улогата на таквите хидрати во животните процеси тешко може да се прецени. Овие процеси се случуваат главно во просторот помеѓу молекулите на водата и протеините. Водата има силна тенденција да се кристализира, бидејќи протеинската молекула содржи многу нејонски или неполарни групи. Секој таков хидрат се формира со помала густина од мразот, така што неговото формирање може да доведе до значително деструктивно ширење.
Значи, водата е еден вид соединениесо специфични и разновидни хемиски својства. Таа има витка и во исто време променлива физичка структура.
Развојот на сета жива и главно нежива природа е нераскинливо поврзан со карактеристични карактеристикивода.
Маргарита Калисова
Резиме на лекцијата „Водата е растворувач. Прочистување на водата"
Предмет: Водата е растворувач. Прочистување на водата.
Цел: консолидирајте го разбирањето дека супстанциите во водата не исчезнуваат, туку се раствораат.
Задачи:
1. Идентификувајте супстанции кои се раствораатво вода и кои не се се раствора во вода.
2. Воведете го методот на чистење вода – со филтрирање.
3. Создадете услови за идентификување и тестирање на различни методи за чистење вода.
4. Консолидирајте го знаењето за правилата за безбедно однесување при работа со разни супстанции.
5. Развијте логично размислувањепреку моделирање на проблемски ситуации и нивно решавање.
6. Негувајте точност и безбедно однесување при работа со различни супстанции.
7. Негувајте интерес за когнитивна активност, експериментирање.
Образовни области:
Когнитивен развој
Социјален и комуникативен развој
Физички развој
Работа со вокабулар:
збогатување: филтер, филтрирање
активирање: инка
Прелиминарна работа: разговори за водата, нејзината улога во животот на човекот; направи набљудувања на водата во градинка, Куќи; експерименти со вода; погледна илустрации на темата « Вода» ; се запозна со безбедносните правила за време на истражување и експериментирање; прашување загатки за вода; читање фикција, еколошки приказни; игри за вода.
Демонстрација и визуелна материјал: кукла во сино одело "Капка".
Материјал: празни чаши со вода; растворувачи: шеќер, сол, брашно, песок, прехранбена боја, растително масло; пластични лажици, инки, газа салфетки, памучни влошки, престилки за масла, шолји за чај, лимон, џем, чинии за еднократна употреба, масла за маси.
GCD потег
Воспитувач: - Момци, пред да започнам разговор со вас, сакам да ви посакам загатка:
Живее во мориња и реки
Но, често лета низ небото.
Како ќе и здодее да лета?
Повторно паѓа на земја. (вода)
Можете ли да погодите за што ќе биде разговорот? Така е, за водата. Тоа веќе го знаеме водата е течност.
Ајде да се потсетиме кои својства водавоспоставивме со помош на експерименти врз други часови. Список.
Деца:
1. У водата нема мирис.
2. Без вкус.
3. Проѕирно е.
4. Безбоен.
5. Водаго добива обликот на садот во кој се истура.
6. Има тежина.
Воспитувач: - Точно. Дали сакате повторно да експериментирате со вода? За да го направите ова, треба накратко да се претвориме во научници и да погледнеме во нашата лабораторија експериментирање:
Свртете десно, свртете лево,
Најдете се во лабораторија.
(децата се приближуваат до мини-лабораторија).
Воспитувач: - Момци, погледнете кој повторно не посетува? А што има ново во лабораторијата?
Деца: - "Капка", внука на дедо Знаејќи и убава кутија.
Сакате да знаете што има во оваа кутија? Погоди загатки:
1. Одделно - не сум толку вкусен,
Но, во храната - на сите им треба (сол)
2. Јас сум бел како снег
Во чест на сите.
Го добив во устата -
Таму исчезна. (шеќер)
3. Од мене печат колачи со сирење,
И палачинки и палачинки.
Ако правите тесто,
Мора да ме спуштат (брашно)
4. Жолта, не сонцето,
Истура, не вода,
Се пени во тавата,
Прскање и подсвиркване (нафта)
Боја за храна - се користи во готвењето за украсување колачи и боење јајца.
Песок - за изградба, играјте со него во песокот.
Децата ги испитуваат епруветите со супстанции.
Воспитувач: - Ги донесов сите овие супстанции "Капка"за да можеме да и помогнеме да разбере што ќе се случи со водата при интеракција со нив.
Воспитувач: - Што ни е потребно за да ја започнеме нашата работа со вода?
Деца: - престилки.
(децата ставаат престилки од масла и одат до масата, каде што има чаши чиста вода на послужавник).
Воспитувач: - Да се потсетиме на правилата пред да почнеме да работиме со овие супстанции:
Деца:
1. Не можете да ги вкусите супстанциите - постои можност за труење.
2. Мора внимателно да шмркате, бидејќи супстанците можат да бидат многу каустични и да го изгорат вашиот респираторен тракт.
Воспитувач: - Данил ќе ви покаже како правилно да го направите тоа (со дланка го насочува мирисот од чашата).
I. Истражување Работа:
Воспитувач: - Момци, што мислите дека ќе се смени ако растворете ги овие супстанции во вода?
Ги слушам очекуваните резултати на децата пред да ги измешам супстанциите со вода.
Воспитувач: - Ајде да провериме.
Предлагам децата да земат по една чаша вода.
Воспитувач: - Погледнете и одреди кој е таму вода?
Деца: - Водата е чиста, безбоен, без мирис, ладен.
Воспитувач: - Земете епрувета со супстанцијата што сте ја избрале и се раствора во чаша вода, мешајќи со лажица.
Размислуваме. Ги слушам одговорите на децата. Дали точно погодија?
Воспитувач: - Што стана со шеќерот и солта?
Сол и шеќер брзо се раствора во вода, водата останува чиста, безбоен.
Брашно исто така се раствора во вода, Но водата станува заматена.
Но после водата ќе отстои некое време, брашното се таложи на дното, но решениепродолжува да биде облачно.
Водасо песок стана валкано, заматено, ако веќе не го мешаш, песокот потонал до дното на чашата, се гледа, т.е. растворени.
храна во прав растворувачбрзо ја смени бојата вода, значи, добро се раствора.
Нафтата не е се раствора во вода: или е се ширина неговата површина како тенок филм, или плови во водата во форма на жолти капки.
Водата е растворувач! Но, не сите супстанции се раствораат во него.
Воспитувач: - Момци, работевме со вас и "Капка"не поканува на одмор.
(Децата седат на друга маса и се игра игра.
Игра: „Погодете го вкусот на пијалокот (чај)».
Пиење чај со различни вкусови: шеќер, џем, лимон.
II Експериментална работа.
Се приближуваме до табелата 1.
Воспитувач: - Момци, дали е можно да се прочисти водата од овие супстанции што ги имаме растворени? Вратете го во претходната состојба на транспарентност, без талог. Како да се направи тоа?
Ви предлагам да ги земете очилата од решенијаи одете на табелата 2.
Воспитувач: - Можете да го филтрирате. За ова ви треба филтер. Од што може да се направи филтер? Ќе го направиме тоа со помош на газа салфетка и памучна подлога. Ви покажувам (во инката ставам газа салфетка свиткана во неколку слоеви и памучна подлога и ја ставам во празна чаша).
Изработка на филтри со деца.
Го прикажувам начинот на филтрирање, а потоа самите деца ја филтрираат водата со супстанцијата што ја избрале.
Ги потсетувам децата да не брзаат, истурете во мал поток решениево инка со филтер. јас зборувам поговорка: „Ако побрзаш, ќе ги насмееш луѓето“.
Ајде да погледнеме што се случи по филтрирањето водасо различни материи.
Маслото брзо се филтрира бидејќи не беше растворени во вода, на филтерот јасно се гледаат траги од масло. Истото се случи и со песокот. Практично не беа филтрирани супстанции кои беа добри растворени во вода: шеќер, сол.
Водасо брашно по филтрирањето стана потранспарентно. Поголемиот дел од брашното се наталожило на филтерот, само многу мали честички се лизгале низ филтерот и завршувале во чашата, па водане е целосно транспарентен.
По филтрирањето на бојата, бојата на филтерот се промени, но се филтрира решениеисто така остана во боја.
Резултат на GCD:
1. Какви материи се раствора во вода? – шеќер, сол, боја, брашно.
2. Кои супстанции не се се раствора во вода - песок, нафта.
3. Со каков метод на чистење вода што ја запознавме? – филтрирање.
4. Со што? – филтер.
5. Дали сите ги почитуваа безбедносните правила? (еден пример).
6. Што е интересно (нов)дали дозна денес?
Воспитувач: - Денес го научивте тоа водата е растворувач, провери какви супстанции се раствораатво вода и како можете да ја прочистите водата од различни материи.
"Капка"ви благодариме за помошта и ви дава албум за скицирање на вашите експерименти. Со ова нашето истражување е завршено, се враќаме од лабораторија во група:
Свртете десно, свртете лево.
Повторно ќе се најдете во групата.
Литература:
1. А. И. Иванова Еколошки набљудувања и експерименти во градинка
2. Г. П. Тугушева, А. Е. Чистјакова Експериментални активностидеца од средна и поголема предучилишна возраст возраст Санкт Петербург: Childhood-Press 2010 година.
3. Когнитивни истражувачки активности на постари деца од предучилишна возраст - Дете во градинка бр.3,4,5 2003 година.
4. Истражувачки активностипредучилишна возраст - Д/в бр.7 2001 г.
5. Експериментирање со вода и воздух - Д/В бр.6, 2008 г.
6. Експериментални активности во градинка - Воспитувачка од предучилишна возрастбр.9 2009 г
7. Игри - експериментирање помладо дете од предучилишна возраст – Предучилишна педагогијабр.5 2010 г
Решениенаречен термодинамички стабилен хомоген (еднофазен) систем со променлив состав, кој се состои од две или повеќе компоненти ( хемиски супстанции). Компонентите што го сочинуваат растворот се растворувач и растворена супстанција. Вообичаено, растворувачот се смета за компонента што постои во својата чиста форма во истиот состојба на агрегација, како добиен раствор (на пример, во случај на воден раствор на сол, растворувачот е, се разбира, вода). Ако и двете компоненти биле во иста состојба на агрегација пред растворањето (на пример, алкохол и вода), тогаш компонентата што е во поголеми количини се смета за растворувач.
Растворите се течни, цврсти и гасовити.
Течни раствори се раствори на соли, шеќер, алкохол во вода. Течните раствори можат да бидат водени или неводени. Водни раствори се раствори во кои растворувачот е вода. Неводени раствори се раствори во кои растворувачите се органски течности (бензен, алкохол, етер итн.). Цврстите раствори се метални легури. Гасовити раствори - воздух и други мешавини на гасови.
Процес на растворање. Распуштањето е сложен физички и хемиски процес. Во текот на физичкиот процес, структурата на растворената супстанција се уништува и нејзините честички се дистрибуираат помеѓу молекулите на растворувачот. Хемиски процес е интеракција на молекулите на растворувачите со честичките на растворената супстанција. Како резултат на оваа интеракција, солвати.Ако растворувачот е вода, се нарекуваат добиените солвати хидрира.Процесот на формирање на солвати се нарекува солвација, процесот на формирање на хидрати се нарекува хидратација. При испарување водени растворисе формираат кристални хидрати - тоа се кристални материи, кои содржат одреден број на молекули на вода (вода на кристализација). Примери на кристални хидрати: CuSO 4 . 5H 2 O – бакар (II) сулфат пентахидрат; FeSO4 . 7H 2 O – железо (II) сулфат хептахидрат.
Физичкиот процес на растворање настанува со апсорпцијаенергија, хемиски - со истакнување. Ако, како резултат на хидратација (солвација), се ослободува повеќе енергија отколку што се апсорбира за време на уништувањето на структурата на супстанцијата, тогаш растворањето е егзотермичнипроцес. Енергијата се ослободува кога се раствораат NaOH, H 2 SO 4, Na 2 CO 3, ZnSO 4 и други супстанции. Ако е потребна повеќе енергија за уништување на структурата на супстанцијата отколку што се ослободува за време на хидратацијата, тогаш е растворање ендотермиченпроцес. Апсорпцијата на енергија се јавува кога NaNO 3, KCl, NH 4 NO 3, K 2 SO 4, NH 4 Cl и некои други супстанции се раствораат во вода.
Количината на енергија што се ослободува или апсорбира за време на растворањето се нарекува термички ефект на растворање.
Растворливостсупстанција е нејзината способност да се дистрибуира во друга супстанција во форма на атоми, јони или молекули за да формира термодинамички стабилен систем со променлив состав. Квантитативна карактеристика на растворливост е коефициент на растворливост, што покажува која максимална маса на супстанција може да се раствори во 1000 или 100 g вода на дадена температура. Растворливоста на супстанцијата зависи од природата на растворувачот и супстанцијата, од температурата и притисокот (за гасовите). Растворливоста на цврстите материи генерално се зголемува со зголемување на температурата. Растворливоста на гасовите се намалува со зголемување на температурата, но се зголемува со зголемување на притисокот.
Врз основа на нивната растворливост во вода, супстанциите се поделени во три групи:
1. Добро растворлив (р.). Растворливоста на супстанциите е повеќе од 10 g во 1000 g вода. На пример, 2000 g шеќер се раствораат во 1000 g вода или во 1 литар вода.
2. Малку растворлив (м.). Растворливоста на супстанциите е од 0,01 g до 10 g во 1000 g вода. На пример, 2 g гипс (CaSO 4 . 2 H 2 O) се раствора во 1000 g вода.
3. Практично нерастворлив (н.). Растворливоста на супстанциите е помала од 0,01 g во 1000 g вода. На пример, 1,5 се раствора во 1000 g вода . 10-3 g AgCl.
Кога супстанциите се раствораат, може да се формираат заситени, незаситени и презаситени раствори.
Заситен растворе раствор кој содржи максимална количина на растворена супстанција во дадени услови. Кога супстанцијата се додава на таков раствор, супстанцијата повеќе не се раствора.
Незаситен раствор- раствор кој содржи помалку растворена супстанца од заситен раствор во дадени услови. Кога супстанцијата се додава на таков раствор, супстанцијата сè уште се раствора.
Понекогаш е можно да се добие раствор кој содржи повеќе растворена супстанца од заситен раствор на дадена температура. Таквото решение се нарекува презаситено. Овој раствор се подготвува со внимателно ладење на заситениот раствор додека собна температура. Презаситените раствори се многу нестабилни. Кристализацијата на супстанцијата во таков раствор може да биде предизвикана со триење на ѕидовите на садот во кој се наоѓа растворот со стаклена прачка. Овој метод се користи при изведување на некои квалитативни реакции.
Растворливоста на супстанцијата може да се изрази и со моларната концентрација на нејзиниот заситен раствор (дел 2.2).
Константа на растворливост. Да ги разгледаме процесите што се јавуваат при интеракцијата на слабо растворливиот, но силен електролит на бариум сулфат BaSO 4 со вода. Под влијание на водните диполи, јоните Ba 2+ и SO 4 2 - од кристалната решетка BaSO 4 ќе преминат во течна фаза. Истовремено со овој процес, под влијание електростатско полекристалната решетка, дел од јоните Ba 2+ и SO 4 2 - повторно ќе се депонираат (сл. 3). На дадена температура, конечно ќе се воспостави рамнотежа во хетерогениот систем: брзината на процесот на растворање (V 1) ќе биде еднаква на брзината на процесот на врнежи (V 2), т.е.
BaSO 4 ⇄ Ba 2+ + SO 4 2 -
цврст раствор
Ориз. 3. Заситен раствор на бариум сулфат
Растворот во рамнотежа со цврстата фаза BaSO 4 се нарекува богатво однос на бариум сулфат.
Заситениот раствор е рамнотежен хетероген систем, кој се карактеризира со константа хемиска рамнотежа:
 , (1)
, (1)
каде што a (Ba 2+) е активноста на бариумските јони; a(SO 4 2-) – активност на сулфатни јони;
a (BaSO 4) – активност на молекулите на бариум сулфат.
Именителот на оваа дропка - активноста на кристалниот BaSO 4 - е константна вредност еднаква на единството. Производот на две константи дава нова константа наречена константа на термодинамичка растворливости означи K s °:
К s° = a(Ba 2+) . a (SO 4 2-). (2)
Оваа количина претходно беше наречена производ на растворливост и означена како PR.
Така, во заситен раствор на слабо растворлив силен електролит, производот од рамнотежните активности на неговите јони е константна вредност на дадена температура.
Ако претпоставиме дека во заситен раствор на слабо растворлив електролит коефициентот на активност ѓ~ 1, тогаш активноста на јоните во овој случај може да се замени со нивните концентрации, бидејќи a ( X) = ѓ (X) . СО ( X). Термодинамичката константа на растворливост K s ° ќе се претвори во константа на растворливост на концентрацијата K s:
K s = C(Ba 2+) . C(SO 4 2-), (3)
каде што C(Ba 2+) и C(SO 4 2 -) се рамнотежни концентрации на јони Ba 2+ и SO 4 2 - (mol/l) во заситен раствор на бариум сулфат.
За да се поедностават пресметките, обично се користи константата на растворливост на концентрацијата K s, земајќи ѓ(X) = 1 (Прилог 2).
Ако слабо растворлив силен електролит формира неколку јони при дисоцијација, тогаш изразот K s (или K s °) ги вклучува соодветните моќи еднакви на стехиометриските коефициенти:
PbCl 2 ⇄ Pb 2+ + 2 Cl - ; K s = C (Pb 2+) . C2 (Cl-);
Ag 3 PO 4 ⇄ 3 Ag + + PO 4 3 - ; K s = C 3 (Ag +) . C (PO 4 3 -).
ВО општ погледизразување на константата на растворливост на концентрацијата за електролитот A m B n ⇄ мА n+ + n B m - ја има формата
K s = С m (A n+) . C n (B m -),
каде што C е концентрацијата на A n+ и Bm јони во заситен раствор на електролит во mol/l.
Вредноста на K s обично се користи само за електролити чија растворливост во вода не надминува 0,01 mol/l.
Услови за формирање на врнежи
Да претпоставиме дека c е вистинската концентрација на јони на слабо растворлив електролит во растворот.
Ако C m (A n +) . Со n (B m -) > K s, тогаш ќе дојде до формирање на талог, бидејќи растворот станува презаситен.
Ако C m (A n +) . C n (B m -)< K s , то раствор является ненасыщенным и осадок не образуется.
Својства на решенијата. Подолу ќе ги разгледаме својствата на не-електролитните раствори. Во случај на електролити, во дадените формули се внесува изотоничен фактор на корекција.
Ако неиспарлива супстанција се раствора во течност, тогаш притисокот на заситената пареа над растворот е помал од притисокот на заситената пареа над чистиот растворувач. Истовремено со намалување на притисокот на пареата над растворот, се забележува промена во неговите точки на вриење и замрзнување; Точките на вриење на растворите се зголемуваат, а температурите на замрзнување се намалуваат во споредба со температурите што ги карактеризираат чистите растворувачи.
Релативното намалување на точката на замрзнување или релативното зголемување на точката на вриење на растворот е пропорционално на неговата концентрација.
Задача:Покажете им на децата растворливост и нерастворливост на различни материи во вода.
Материјали:брашно, гранулиран шеќер, речен песок, прехранбени бои, прашок за перење, чаши чиста вода, лажици или стапчиња за јадење, послужавници, слики кои ги прикажуваат презентираните супстанции.
Опис.Пред децата на послужавниците се чаши вода, стапчиња за јадење, лажици и материи во различни контејнери. Децата гледаат во водата и се сеќаваат на нејзините својства. Што мислите дека ќе се случи ако гранулиран шеќер се додаде во водата? Дедо знае додава шеќер, меша и сите заедно набљудуваат што се сменило. Што ќе се случи ако додадеме речен песок во водата? Додава речен песок во водата и се меша. Дали водата се сменила? Дали стана облачно или остана ведро? Дали речниот песок се раствори?
Што ќе се случи со водата ако и додадеме прехранбена боја? Додава боја и меша. Што се смени? (Водата ја промени бојата.) Дали бојата се раствори? (Бојата се раствори и ја промени бојата на водата, водата стана непроѕирна.)
Дали брашното ќе се раствори во вода? Децата додаваат брашно во водата и мешаат. Што стана водата? Облачно или ведро? Дали брашното се раствори во водата?
Дали прашокот за перење ќе се раствори во вода? Додадете прашок за перење и измешајте. Дали прашокот се раствори во вода? Што забележавте дека е невообичаено? Потопете ги прстите во смесата и проверете дали сè уште е исто како чиста вода? (Водата стана сапуница.) Кои материи се растворени во нашата вода? Кои материи не се раствораат во вода?
(Резултатите се запишуваат на фланелграф.)
ОБОЈЕН ПЕСОК
Задачи:запознајте ги децата со начинот на правење обоен песок (мешање со креда во боја); научете како да користите ренде.
Материјали:боички во боја, песок, проѕирен контејнер, ситни предмети, 2 кесички, мали ренде, чинии, лажици (стапчиња), мали теглички со капаци.
Опис.Малата чавка, Кјуриосити, им долета на децата. Ги замолува децата да погодат што има во неговите торби. Децата се обидуваат да одредат со допир.(Во едната кеса има песок, во другата има парчиња креда.) Наставникот ги отвора кесите, децата ги проверуваат своите претпоставки. Наставникот и децата ја испитуваат содржината на кесите. Што е ова? Каков вид на песок? Што можете да направите со него? Која боја е кредата? Какво е чувството? Дали може да се скрши? За што е? Малата Гал прашува: „Дали песокот може да се обои? Како да го направите обоен? Што се случува ако помешаме песок со креда? Како можеш да направиш креда да тече како песок?“ Малиот Гал се пофали дека има алатка за претворање на кредата во фин прав.
На децата им покажува ренде. Што е ова? Како да го користите? Децата, по примерот на малата чавка, земаат чинии, ренде и тријат креда. Што се случи? Каква боја е вашата пудра? (Камчето го прашува секое дете) Како да го направам песокот обоен сега? Децата истураат песок во сад и го мешаат со лажици или стапчиња за јадење. Децата гледаат во обоен песок. Како можеме да го искористиме овој песок? (Направете убави слики.)
Малиот Галхоф се нуди да игра. Покажува проѕирен сад исполнет со повеќебојни слоеви песок и ги прашува децата: „Како можете брзо да пронајдете скриен предмет? Децата нудат свои опции. Наставникот објаснува дека не можете да го мешате песокот со раце, стап или лажица и покажува како да истуркате предмет од песокот со тресење на садот.
Што се случи со шарениот песок? Децата забележуваат дека на овој начин брзо го најдовме предметот и го измешавме песокот.
Децата кријат мали предмети во проѕирни тегли, ги покриваат со слоеви разнобоен песок, ги затвораат теглите со капаци и му покажуваат на девојчето како брзо го пронаоѓаат скриениот предмет и го мешаат песокот. Малиот Галчон на децата им подарува кутија со креда во боја како проштален подарок.
ИГРИ СО ПЕСОК
Задачи:да ги консолидираат детските идеи за својствата на песокот, да развијат љубопитност и набљудување, да го активираат детскиот говор и да развијат конструктивни вештини.
Материјали:голема детска песочна кутија, во која се оставени траги од пластични животни, играчки за животни, топки, детски гребла, канти за полевање, план на просторот за прошетки на оваа група.
Опис.Децата излегуваат надвор и ја истражуваат областа за пешачење. Наставникот им го привлекува вниманието на необични стапалки во песокот. Зошто стапалките се толку јасно видливи во песокот? Чии се овие траки? Зошто мислиш така?
Децата наоѓаат пластични животни и ги тестираат своите претпоставки: земаат играчки, ги ставаат шепите на песокот и го бараат истиот отпечаток. Каква трага ќе остане од дланката? Децата оставаат свои траги. Чија дланка е поголема? Чија е помала? Проверете со аплицирање.
Наставникот наоѓа писмо во шепите на мечката и извади план за локација од него. Што е прикажано? Кое место е заокружено со црвено? (Sandbox.) Што друго може да биде интересно таму? Можеби некакво изненадување? Децата, потопувајќи ги рацете во песокот, бараат играчки. Кој е ова?
Секое животно има свој дом. Лисицата има... (дупка), мечката има... (дувло), кучето има... (одгледувачница). Ајде да изградиме куќа од песок за секое животно. Со кој песок е најдобар за градење? Како да се навлажни?
Децата земаат канти за полевање и го полеваат песокот. Каде оди водата? Зошто песокот стана влажен? Децата градат куќи и си играат со животни.