Органски материи.Живите организми, покрај неорганските, вклучуваат и разновидни органска материја. Органските материи на живите суштества се формираат првенствено од четири хемиски елементи, повикан биогени: јаглерод, водород, кислород и азот. Во протеините, на овие елементи се додава сулфур, а во нуклеинските киселини се додава фосфор.
Разновидноста на органската материја во голема мера е одредена од јаглеродот. Оваа ставка благодарам уникатни својстваја формира хемиската основа на животот. Може да формира ковалентни врски со многу атоми и нивни групи, формирајќи синџири и прстени кои сочинуваат скелет со различен состав, структура, должина и форма органски молекули. Тие, пак, формираат сложени хемиски соединенија, кои се разликуваат по структура и функции. Главната причина за различноста на органските молекули не е толку разликата во атомите што ги сочинуваат, туку различниот редослед по кој се распоредени во молекулата.
Концепт на биополимери.Во жив организам, органските материи се претставени или со мали молекули со релативно мала молекуларна тежина или со големи макромолекули. Соединенијата со мала молекуларна тежина вклучуваат амино киселини, шеќери, органски киселини, алкохоли, витамини итн.
Протеините, полисахаридите и нуклеинските киселини се главно структури со висока молекуларна тежина. Затоа се нарекуваат макромолекули(од грчки макро- големо). Така, молекуларната тежина на повеќето протеини е од 5000 до 1.000.000. Висока молекуларна тежина органски соединенија– протеини, нуклеински киселини, полисахариди, чии молекули се состојат од големо количествоисти или различни хемиска структурасе нарекуваат повторливи единици биополимери(од грчки биос- животот и политика– многубројни). Едноставните молекули од кои се составени биополимерите се нарекуваат мономери. Мономерите на протеините се амино киселини, мономерите на полисахаридите се моносахариди, а мономерите на нуклеинските киселини се нуклеотиди. Макромолекулите сочинуваат околу 90% од сувата маса на клетката.
Ова поглавје ги испитува сите три класи на макромолекули и нивните мономерни единици. На сметката се додадени липиди - молекули, по правило, многу помали од биополимерите, но исто така извршуваат функции во телото.
Посебна група на органски материи се биолошки активни супстанции: ензими, хормони, витамини итн. Тие се разновидни по структура; влијае на метаболизмот и конверзијата на енергијата.
Во клетките на различни групи на организми содржината на одредени органски соединенија е различна. На пример, протеините и мастите доминираат во животинските клетки, додека јаглехидратите доминираат во растителните клетки. Меѓутоа, во различни клетки одредени органски соединенија вршат слични функции.
Верверички.Во живите организми, протеините играат водечка улога меѓу макромолекулите во однос на нивното функционално значење. Протеините се доминантни и квантитативни кај многу организми. Така, во телото на животните тие сочинуваат 40-50%, во телото на растенијата - 20-35% од нивната сува маса. Протеините се хетерополимери чии мономери се амино киселини.
Амино киселините се „градежни блокови“ на протеинските молекули.Амино киселини - органски соединенија кои содржат и амино група (–NH), која се карактеризира со основни својства, и карбоксилна група (–COOH) со кисели својства. Амино групата и карбоксилните групи се поврзани со истиот јаглероден атом (сл.). Според оваа карактеристика, сите амино киселини се слични една на друга. Повеќето амино киселини кои формираат протеини имаат една карбоксилна група и една амино група; овие амино киселини се нарекуваат неутрален.
Дел од молекулата наречена радикална (Р) различни амино киселини имаат различни структури (сл.). Радикалот на различни амино киселини може да биде неполарен или поларен (наполнет или ненаполнет), хидрофобен или хидрофилен, што на протеините им дава одредени својства. Во прилог на неутрални, постојат основни амино киселини- со повеќе од една амино група, како и кисели амино киселини- со повеќе од една карбоксилна група. Присуството на дополнителна амино или хидроксилна група влијае на својствата на радикалот. Сите својства на аминокиселинските радикали играат одлучувачка улога во формирањето на просторната структура на протеинот.
Вкупниот број на познати амино киселини е околу 200, а само 20 видови се вклучени во формирањето на природните протеини. Овие амино киселини се нарекуваат формирање на протеини(Табела 2; табелата ги прикажува целосните и скратените имиња на амино киселините, а не за меморирање).
Табела 2. Основни амино киселини и нивните кратенки
Растенијата и бактериите можат да ги синтетизираат сите потребни амино киселини од примарните производи на фотосинтезата. Луѓето и животните не се способни да ги синтетизираат сите аминокиселини, затоа т.н есенцијални амино киселинитреба да се примаат готови со храна.
Есенцијалните амино киселини за луѓето се: лизин, валин, леуцин, изолеуцин, треонин, фенилаланин, триптофанИ метионин; за децата се исто така незаменливи аргининИ хистидин. Протеините во храната кои ги содржат сите есенцијални амино киселини се нарекуваат полноправно, За разлика од хендикепиран, кои немаат одредени есенцијални амино киселини.
Присуството на двете базни и кисели групи во една аминокиселина ја одредува нивната амфотерност и висока реактивност. Амино група
(–NH 2) од една амино киселина е способна да комуницира со карбоксилната група (–COOH) на друга амино киселина, ослободувајќи молекула на вода. Добиената молекула е дипептид (сл.), а врската –CO-NH– се нарекува пептид. На едниот крај на молекулата на дипептид има слободна амино група, а на другиот има карбоксилна група. Благодарение на ова, дипептидот може да прикачи други амино киселини за себе, формирајќи олигопептиди. Ако многу амино киселини (повеќе од десет) се поврзат на овој начин, се формира долг синџир - полипептид.
Пептидите играат важна улога во телото. Многу олиго- и полипептиди се хормони, антибиотици и токсини.
Олигопептидите вклучуваат, на пример, хипофизните хормони окситоцин и вазопресин, како и брадикинин (пептид за болка) и некои опијати (човечки „природни лекови“) кои делуваат како ослободувачи на болка. Редовна употреба Употребата на дрога е многу опасна, го уништува опијатниот систем на телото, па зависникот без доза на дрога доживува силна болка - „повлекување“. Олигопептидите вклучуваат некои антибиотици, на пример, грамицидин С.
Хормоните (инсулин, адренокортикотропен хормон, итн.), антибиотиците (грамицидин А), токсините (токсин од дифтерија) се исто така полипептиди.
Полипептидните синџири можат да бидат многу долги и да вклучуваат широк спектар на комбинации на амино киселини. Полипептидите, чија молекула содржи од 50 до неколку илјади остатоци од аминокиселини со молекуларна тежина од над 6000, се нарекуваат протеини.
Секој специфичен протеин се карактеризира со строго константен состав и низа на остатоци од аминокиселини.
Нивоа на организација на протеинска молекула.Протеинските молекули можат да добијат различни просторни форми – конформација, кои претставуваат четири нивоа на нивната организација (сл.)
Ланец од многу амино киселински остатоци поврзани со пептидни врски е примарна структурапротеинска молекула. Таа е најважната структура бидејќи ја одредува нејзината форма, својства и функции. Врз основа на примарната структура, се создаваат други видови структури. Токму оваа структура е кодирана во молекулата на ДНК. Секој поединечен протеин во телото има единствена примарна структура. Сите молекули на одреден поединечен протеин (на пример, албумин) имаат иста алтернација на остатоци од аминокиселини, што го разликува албуминот од кој било друг поединечен протеин. Разновидноста на примарната структура се одредува според составот, количината и редоследот на остатоците од аминокиселините во полипептидниот синџир.
Секундарна структура протеините се јавуваат како резултат на формирање на водородни врски помеѓу водородниот атом на NH групи и кислородниот атом на CO групи од различни амино киселински остатоци од полипептидниот синџир. Полипептидниот синџир е извиткан во спирала. Иако водородните врски се слаби, поради нивниот значителен број обезбедуваат стабилност на оваа структура. Молекулите на кератин протеин имаат целосно спирална конфигурација. Тоа е структурен протеин на косата, крзното, канџите, пердувите и роговите; тој е дел од надворешниот слој на кожата на 'рбетниците. Покрај кератинот, спиралната секундарна структура е карактеристична за фибриларните (нишки) протеини, како што се миозин, фибриноген и колаген.
Секундарната структура на протеинот, покрај спиралата, може да биде претставена и со превиткан слој. Во преклопениот слој, неколку полипептидни синџири (или делови од еден полипептиден синџир) лежат паралелно, формирајќи рамна конфигурација превиткана како хармоника (сл. b6). На пример, протеинот фиброин, кој го сочинува најголемиот дел од свилените влакна што се лачат од свилените жлезди на гасеницата од свилена буба за време на ткаењето на кожурците, има секундарна структура во форма на превиткан слој.
Терцијарна структурасе создава со S-S врски („дисулфидни мостови“) помеѓу остатоците од цистеин (амино киселина која содржи сулфур), како и водородни, јонски и други интеракции. Терциерната структура ја одредува специфичноста на протеинските молекули и нивната биолошка активност. Протеините како што е миоглобинот (протеин кој се наоѓа во мускулите; вклучен во создавањето на резерви на кислород), трипсин (ензим кој ги разградува протеините во цревата) имаат терцијарна структура.
Во некои случаи, неколку полипептидни синџири со терциерна структура се комбинираат во еден комплекс, со што се формира квартерна структура. Во него, протеинските подединици не се ковалентно врзани, а силата е обезбедена со интеракцијата на слабите меѓумолекуларни сили. На пример, квартерната структура е карактеристична за протеинот на хемоглобин, кој се состои од четири протеински подединици и непротеински дел - хем.
с 1. Што се протеини? 2. Каква е структурата на протеините? 3. Што се амино киселини? 4. Како амино киселините се поврзани за да формираат полипептиден синџир? 5. Кои нивоа на структурна организација на протеините постојат? 6. Кои хемиски врскиодредуваат различни нивоа на структурна организација на протеинските молекули? 7. Постојат три типа на амино киселини A.B.C. Колку варијанти на полипептидни синџири што се состојат од пет амино киселини може да се конструираат? Дали полипептидите ќе ги имаат истите својства?
Како што знаете, протеините се основа за потеклото на животот на нашата планета. Но, токму коацерватната капка, составена од молекули на пептид, стана основа за потеклото на живите суштества. Ова е несомнено, бидејќи анализата на внатрешниот состав на кој било претставник на биомасата покажува дека овие супстанции се присутни во сè: растенија, животни, микроорганизми, габи, вируси. Покрај тоа, тие се многу разновидни и макромолекуларни по природа.
Овие структури имаат четири имиња, сите се синоними:
- протеини;
- протеини;
- полипептиди;
- пептиди.
Протеински молекули
Нивниот број е навистина безброј. Во овој случај, сите протеински молекули може да се поделат во две големи групи:
- едноставно - се состои само од секвенци на аминокиселини поврзани со пептидни врски;
- комплекс - структурата и структурата на протеинот се карактеризираат со дополнителни протолитички (протетски) групи, исто така наречени кофактори.
Во исто време, сложените молекули имаат и своја класификација.
Градација на комплексни пептиди
- Гликопротеините се тесно поврзани соединенија на протеини и јаглени хидрати. Протетските групи на мукополисахариди се вткаени во структурата на молекулата.
- Липопротеините се сложено соединение од протеини и липиди.
- Металопротеини - метални јони (железо, манган, бакар и други) делуваат како протетска група.
- Нуклеопротеините се врската помеѓу протеините и нуклеинските киселини (ДНК, РНК).
- Фосфопротеини - конформација на протеин и остаток на ортофосфорна киселина.
- Хромопротеините се многу слични на металопротеините, меѓутоа, елементот што е дел од протетската група е цел комплекс во боја (црвено - хемоглобин, зелено - хлорофил и така натаму).
Во секоја разгледана група, структурата и својствата на протеините се различни. Функциите што ги извршуваат исто така варираат во зависност од видот на молекулата.

Хемиска структура на протеините
Од оваа гледна точка, протеините се долг, масивен ланец на остатоци од аминокиселини поврзани едни со други со специфични врски наречени пептидни врски. Гранките наречени радикали се протегаат од страничните структури на киселините. Оваа молекуларна структура е откриена од Е. Фишер на почетокот на 21 век.
Подоцна, протеините, структурата и функциите на протеините беа подетално проучувани. Стана јасно дека има само 20 амино киселини кои ја формираат структурата на пептидот, но тие можат да се комбинираат на различни начини. Оттука и разновидноста на полипептидните структури. Покрај тоа, во процесот на живот и извршување на нивните функции, протеините се способни да подлежат на голем број хемиски трансформации. Како резултат на тоа, тие ја менуваат структурата и се појавува сосема нов тип на врска.
За да ја прекинете пептидната врска, односно да го нарушите протеинот и структурата на синџирите, треба да изберете многу строги услови (високи температури, киселини или алкалии, катализатор). Ова се должи на високата јачина во молекулата, имено во групата на пептиди.

Откривањето на структурата на протеините во лабораторија се врши со помош на реакцијата на биурет - изложеност на свежо преципитираниот полипептид (II). Комплексот на пептидната група и бакарниот јон дава светла виолетова боја.
Постојат четири главни структурни организации, од кои секоја има свои структурни карактеристики на протеините.
Нивоа на организација: примарна структура
Како што споменавме погоре, пептидот е низа од остатоци од аминокиселини со или без инклузии, коензими. Значи, примарната е структурата на молекула која е природна, природна, вистински аминокиселини поврзани со пептидни врски, и ништо повеќе. Тоа е, полипептид со линеарна структура. Покрај тоа, структурните карактеристики на протеините од овој тип се дека таквата комбинација на киселини е одлучувачка за извршување на функциите на протеинската молекула. Благодарение на присуството на овие карактеристики, можно е не само да се идентификува пептид, туку и да се предвидат својствата и улогата на сосема нов, сè уште неоткриен. Примери на пептиди со природна примарна структура се инсулин, пепсин, химотрипсин и други.

Секундарна конформација
Структурата и својствата на протеините во оваа категорија се разликуваат малку. Таквата структура може да се формира првично по природа или кога примарната е изложена на тешка хидролиза, температура или други услови.
Оваа конформација има три варијанти:
- Мазни, правилни, стереорегуларни свиоци, изградени од остатоци од аминокиселини, кои се извртуваат околу главната оска на врската. Тие се држат заедно само од оние што произлегуваат помеѓу кислородот на една пептидна група и водородот од друга. Покрај тоа, структурата се смета за точна поради фактот што вртењата се повторуваат рамномерно на секои 4 врски. Таквата структура може да биде или левак или деснак. Но, кај повеќето познати протеини доминира декстророторниот изомер. Ваквите конформации обично се нарекуваат алфа структури.
- Составот и структурата на протеините од следниот тип се разликуваат од претходниот по тоа што водородните врски не се формираат помеѓу остатоците во непосредна близина на едната страна од молекулата, туку помеѓу значително оддалечените и на прилично големо растојание. Поради оваа причина, целата структура има форма на неколку брановидни полипептидни синџири слични на змии. Постои една карактеристика што протеинот мора да ја покаже. Структурата на аминокиселините на гранките треба да биде што е можно пократка, како глицин или аланин, на пример. Овој тип на секундарна конформација се нарекува бета листови поради нивната способност да се држат заедно за да формираат заедничка структура.
- Биологијата се однесува на третиот тип на протеинска структура како сложени, хетерогено расфрлани, нарушени фрагменти кои немаат стереорегуларност и се способни да ја менуваат структурата под влијание на надворешни услови.
Не се идентификувани примери на протеини кои природно имаат секундарна структура.

Терцијарно образование
Ова е прилично сложена конформација наречена „глобула“. Што е овој протеин? Неговата структура се заснова на секундарната структура, меѓутоа, се додаваат нови типови на интеракции помеѓу атомите на групите, а целата молекула изгледа како да се превиткува, со што се фокусира на фактот дека хидрофилните групи се насочени во топката, а хидрофобните оние однадвор.
Ова го објаснува полнењето на протеинската молекула во колоидните раствори на вода. Какви видови на интеракции се присутни овде?
- Водородни врски - остануваат непроменети помеѓу истите делови како и во секундарната структура.
- интеракции - се јавуваат кога полипептидот се раствора во вода.
- Јонските атракции се формираат помеѓу различно наелектризираните групи на остатоци од аминокиселини (радикали).
- Ковалентни интеракции - може да се формираат помеѓу специфични кисели места - молекули на цистеин, или подобро кажано, нивните опашки.
Така, составот и структурата на протеините со терциерна структура може да се опишат како полипептидни синџири преклопени во глобули, задржувајќи ја и стабилизирајќи ја нивната конформација поради различни типовихемиски интеракции. Примери за такви пептиди: фосфоглицерат кеназа, tRNA, алфа-кератин, свилен фиброин и други.
Кватернарна структура
Ова е една од најкомплексните глобули што ги формираат протеините. Структурата и функциите на протеините од овој тип се многу повеќеслојни и специфични.
Каква е оваа конформација? Тоа се неколку (во некои случаи десетици) големи и мали полипептидни синџири кои се формираат независно еден од друг. Но потоа, поради истите интеракции што ги разгледавме за терциерната структура, сите овие пептиди се извртуваат и се испреплетуваат еден со друг. На овој начин се добиваат сложени конформациски глобули кои можат да содржат метални атоми, липидни групи и јаглехидрати. Примери за такви протеини: ДНК полимераза, протеинската обвивка на вирусот на тутунот, хемоглобинот и други.

Сите пептидни структури што ги испитавме имаат свои методи за идентификација во лабораторија, засновани на современи можности за користење на хроматографија, центрифугирање, електронска и оптичка микроскопија и високи компјутерски технологии.
Извршени функции
Структурата и функциите на протеините се тесно поврзани едни со други. Односно, секој пептид игра специфична улога, единствена и специфична. Има и такви кои се способни да извршат неколку значајни операции одеднаш во една жива клетка. Сепак, можно е да се изразат во генерализирана форма главните функции на протеинските молекули во живите организми:
- Обезбедување на движење. Едноклеточните организми или органели или некои типови на клетки се способни за движење, контракција и движење. Ова го обезбедуваат протеините кои ја сочинуваат структурата на нивниот моторен апарат: цилии, флагели и цитоплазматска мембрана. Ако зборуваме за клетки неспособни за движење, тогаш протеините можат да придонесат за нивната контракција (мускулен миозин).
- Нутритивна или резервна функција. Тоа е акумулација на протеински молекули во јајцата, ембрионите и семките на растенијата за дополнително да се надополнат хранливите материи кои недостасуваат. Кога се разградуваат, пептидите произведуваат амино киселини и биолошки активни супстанции кои се неопходни за нормален развој на живите организми.
- Енергетска функција. Покрај јаглехидратите, протеините исто така можат да му дадат сила на телото. Со распаѓањето на 1 g пептид се ослободуваат 17,6 kJ корисна енергија во форма на аденозин трифосфорна киселина (ATP), која се троши на витални процеси.
- Сигнализацијата се состои од внимателно следење на тековните процеси и пренесување сигнали од клетки до ткива, од нив до органи, од вторите до системите итн. Типичен пример е инсулинот, кој строго ја фиксира количината на гликоза во крвта.
- Функција на рецепторот. Се изведува со менување на конформацијата на пептидот на едната страна од мембраната и вклучување на другиот крај во реструктуирањето. Во исто време, сигналот и потребните информации се пренесуваат. Најчесто, таквите протеини се вградени во цитоплазматските мембрани на клетките и вршат строга контрола врз сите супстанции што минуваат низ него. Тие исто така даваат информации за хемиските и физичките промени во животната средина.
- Транспортна функција на пептиди. Се изведува преку канални протеини и транспортерни протеини. Нивната улога е очигледна - транспортирање на потребните молекули до места со мала концентрација од делови со висока концентрација. Типичен пример е транспортот на кислород и јаглерод диоксид низ органите и ткивата преку протеинот хемоглобин. Тие исто така вршат испорака на соединенија со мала молекуларна тежина преку клеточната мембрана во внатрешноста.
- Структурна функција. Една од најважните функции што ја извршуваат протеините. Структурата на сите клетки и нивните органели е обезбедена со пептиди. Тие, како рамка, ја поставуваат формата и структурата. Покрај тоа, тие го поддржуваат и го менуваат доколку е потребно. Затоа, за раст и развој, сите живи организми бараат протеини во нивната исхрана. Таквите пептиди вклучуваат еластин, тубулин, колаген, актин, кератин и други.
- Каталитичка функција. Се изведува од ензими. Бројни и разновидни, тие ги забрзуваат сите хемиски и биохемиски реакции во телото. Без нивно учество, обично јаболко во желудникот би можело да се свари за само два дена, а најверојатно ќе изгние во тој процес. Под влијание на каталаза, пероксидаза и други ензими, овој процес се случува за два часа. Во принцип, благодарение на оваа улога на протеините се вршат анаболизмот и катаболизмот, односно пластика и

Заштитна улога
Постојат неколку видови на закани од кои протеините се дизајнирани да го заштитат телото.
Прво, трауматски реагенси, гасови, молекули, супстанции од различен спектар на дејство. Пептидите се способни да комуницираат со нив хемиска реакција, трансформирајќи го во безопасна форма или едноставно неутрализирајќи го.
Второ, физичката закана од рани - ако протеинот фибриноген не се трансформира навреме во фибрин на местото на повредата, тогаш крвта нема да се згрутчи, што значи дека нема да дојде до блокада. Потоа, напротив, ќе ви треба пептид плазмин, кој може да го раствори згрутчувањето и да ја врати проодноста на садот.
Трето, закана за имунитетот. Структурата и значењето на протеините кои формираат имунолошка одбрана се исклучително важни. Антитела, имуноглобулини, интерферони - сето тоа се важни и значајни елементи на лимфниот и имунолошки системлице. Секоја странска честичка, штетна молекула, мртов дел од клетка или цела структура е предмет на итно испитување од пептидното соединение. Затоа човек може самостојно, без помош на лекови, секојдневно да се заштити од инфекции и едноставни вируси.
Физички својства
Структурата на клеточниот протеин е многу специфична и зависи од извршената функција. Но, физичките својства на сите пептиди се слични и се сведуваат на следните карактеристики.
- Тежината на молекулата е до 1.000.000 Далтони.
- Колоидните системи се формираат во воден раствор. Таму структурата добива полнеж што може да варира во зависност од киселоста на околината.
- Кога се изложени на сурови услови (зрачење, киселина или алкали, температура итн.) тие се способни да преминат на други нивоа на конформации, односно денатурација. Овој процеснеповратни во 90% од случаите. Сепак, постои и обратно поместување - ренатурација.
Ова се главните својства на физичките карактеристики на пептидите.
Станува збор за високомолекуларни органски соединенија, биополимери, изградени од 20 видови на остатоци од L-?-аминокиселини поврзани во одредена низа во долги синџири. Молекуларната тежина на протеините варира од 5 илјади до 1 милион. Името „белки“ за прв пат е дадено на супстанцијата на птичји јајца, која се коагулира кога се загрева во бела нерастворлива маса. Терминот подоцна беше проширен на други супстанции со слични својства изолирани од животни и растенија.
Ориз. 1. Најсложени биополимери се протеините. Нивните макромолекули се состојат од мономери, кои се амино киселини. Секоја аминокиселина има две функционални групи: карбоксилна група и амино група. Целата разновидност на протеините се создава како резултат на различни комбинации на 20 амино киселини.
Протеините доминираат над сите други соединенија присутни во живите организми, обично сочинуваат повеќе од половина од нивната сува тежина. Се претпоставува дека во природата има неколку милијарди индивидуални протеини (на пример, повеќе од 3 илјади различни протеини се присутни само во бактеријата E. coli).
Протеините играат клучна улога во животните процеси на секој организам. Протеините вклучуваат ензими, со чие учество се случуваат сите хемиски трансформации во клетката (метаболизам); тие го контролираат дејството на гените; со нивно учество се реализира дејството на хормоните, се врши трансмембрански транспорт, вклучително и генерирање на нервни импулси. Тие се составен дел на имунолошкиот систем (имуноглобулини) и системот за коагулација, ја формираат основата на коскеното и сврзното ткиво и се вклучени во трансформацијата и искористувањето на енергијата.
Историја на истражување на протеини
Првите обиди да се изолираат протеините беа направени уште во 18 век. До почетокот на 19 век, се појавија првите дела за хемиско проучување на протеините. Француските научници Џозеф Луис Геј-Лусак и Луис Жак Тенар се обидоа да го утврдат елементарниот состав на протеините од различни извори, што го означи почетокот на систематските аналитички студии, благодарение на кои беше заклучено дека сите протеини се слични во множеството елементи вклучени во нивниот состав. Во 1836 година, холандскиот хемичар G. J. Mulder ја предложил првата теорија за структурата на протеинските супстанции, според која сите протеини имаат одреден хипотетички радикал (C 40 H 62 N 10 O 12), поврзан во различни пропорции со атоми на сулфур и фосфор. Тој го нарече овој радикален „протеин“ (од грчкиот протеин - прво, главен). Теоријата на Мулдер придонесе за зголемен интерес за проучување на протеините и подобрување на методите на хемијата на протеините. Развиени се техники за изолирање на протеини со екстракција со раствори на неутрални соли и за прв пат се добиени протеини во кристална форма (некои растителни протеини). За да ги анализираат протеините, тие почнаа да го користат нивното прелиминарно варење со киселини и алкалии.
Во исто време, зголеменото внимание почна да се посветува на проучувањето на функцијата на протеините. Јенс Јакоб Берзелиус бил првиот што во 1835 година предложил да ја играат улогата на биокатализатори. Наскоро беа откриени протеолитички ензими - пепсин (T. Schwann, 1836) и трипсин (L. Corvisar, 1856), кои привлекоа внимание на физиологијата на варењето и анализата на производите формирани за време на варењето хранливи материи. Понатамошните студии за структурата на протеините и работата на хемиската синтеза на пептидите резултираа со појава на хипотеза за пептиди, според која сите протеини се изградени од амино киселини. До крајот на 19 век, повеќето од амино киселините кои ги сочинуваат протеините беа проучувани.
На почетокот на 20 век, германскиот хемичар Емил Херман Фишер бил првиот што ги користел методите на органска хемија за проучување на протеините и докажал дека протеините се состојат од β-амино киселини поврзани едни со други со амид (пептидна) врска. Подоцна, благодарение на употребата физички и хемиски методианализа, беше утврдена молекуларната маса на многу протеини, беше воспоставена сферичната форма на глобуларните протеини, спроведена е рендгенска структурна анализа на амино киселини и пептиди и беа развиени методи за хроматографска анализа (види хроматографија).
Првиот протеински хормон беше изолиран (Фредерик Грант Бантинг, Џон Џејмс Рикард Меклаод, 1922), беше докажано присуството на гама глобулини во антителата и опишана е ензимската функција на мускулниот протеин миозин (Владимир Александрович Енгелхард, М. Н. Љубимова, 1939). . За прв пат се добиени ензими во кристална форма - уреаза (J.B. Saliner, 1926), пепсин (J.H. Nortron, 1929), лизозим (E.P. Abraham, Robert Robinson, 1937).

Ориз. 2. Шема на тродимензионална структура на ензимот лизозим. Кругови - амино киселини; нишки - пептидни врски; засенчените правоаголници се дисулфидни врски. Видливи се спирализирани и издолжени делови од полипептидниот синџир.
Во 1950-тите, беше докажана организација на три нивоа на протеинските молекули - присуство на примарна, секундарна и терцијарна структура; создаде автоматски аминокиселински анализатор (Стенфорд Мур, Вилијам Хауард Стајн, 1950). Во 60-тите, беа направени обиди за хемиска синтеза на протеини (инсулин, рибонуклеаза). Значително се подобрени методите за анализа на дифракција на Х-зраци; беше создаден уред - секвенсер (П. Едман, Г. Бег, 1967), што овозможи да се одреди низата на амино киселини во полипептиден синџир. Последица на ова беше воспоставувањето на структурата на неколку стотици протеини од различни извори. Меѓу нив се протеолитички ензими (пепсин, трипсин, химотрипсин, субтилизин, карбоксипептидази), миоглобини, хемоглобини, цитохроми, лизозими, имуноглобулини, хистони, невротоксини, вирусни обвивни протеини, протеин-пепти. Како резултат на тоа, се појавија предуслови за решавање тековни проблемиензимологија, имунологија, ендокринологија и други области од биолошката хемија.
На крајот на 20 век, постигнат е значителен напредок во проучувањето на улогата на протеините во синтезата на матрицата на биополимерите, разбирањето на механизмите на нивното дејство во различните животни процеси на организмите и воспоставувањето на врската помеѓу нивната структура и функција. Од големо значење беше подобрувањето на методите на истражување и појавата на нови методи за одвојување на протеините и пептидите.
Развој ефективен методанализата на низата на нуклеотиди во нуклеинските киселини овозможи значително да се олесни и забрза одредувањето на амино киселинската секвенца во протеините. Се покажа дека ова е можно бидејќи редоследот на аминокиселините во протеинот се одредува според низата на нуклеотиди во генот што го кодира овој протеин (фрагмент). Следствено, знаејќи го распоредот на нуклеотидите во овој ген и генетскиот код, може точно да се предвиди по кој редослед се наоѓаат амино киселините во полипептидниот синџир на протеинот. Заедно со успехот во структурна анализапротеини, постигнати се значајни резултати при нивното проучување просторна организација, механизми на формирање и дејство на супрамолекуларни комплекси, вклучувајќи рибозоми и други клеточни органели, хроматин, вируси итн.
Структура на протеини
Речиси сите протеини се изградени од 20 α-амино киселини кои припаѓаат на серијата L и се исти кај скоро сите организми. Амино киселините во протеините се поврзани една со друга со пептидна врска -CO-NH-, која е формирана од карбоксилната и -амино групата на соседните амино киселински остатоци: две амино киселини формираат дипептид во кој терминалниот карбоксил (-COOH) а амино групата (H2N-) остануваат слободни, на која може да се додадат нови амино киселини за да се формира полипептиден синџир.
Делот од синџирот на кој се наоѓа терминалот H 2 N-група се нарекува N-терминал, а делот спроти него се нарекува C-терминал. Огромната разновидност на протеини е одредена од редоследот на распоредот и бројот на остатоци од аминокиселини што ги содржат. Иако не постои јасна разлика, кратките синџири обично се нарекуваат пептиди или олигопептиди (од олиго...), а полипептидите (протеини) обично се сфаќаат како синџири што се состојат од 50 или повеќе. Најчести протеини се оние кои содржат 100-400 остатоци од аминокиселини, но има и такви чии молекули се формираат од 1000 или повеќе остатоци. Протеините може да се состојат од неколку полипептидни синџири. Во таквите протеини, секој полипептиден синџир се нарекува подединица.
Просторна структура на протеините

Ориз. 3. Протеините во сите организми се состојат од 20 видови на амино киселини. Секој протеин се карактеризира со одреден асортиман и квантитативен сооднос на амино киселини. Во протеинските молекули, аминокиселините се поврзани една со друга со пептидни врски (- CO - NH -) во линеарна низа, што ја сочинува таканаречената примарна структура на протеинот. Горна линија - слободни амино киселини со странични групи R1, R2, R3; крајна линија - амино киселините се поврзани со пептидни врски.
Полипептидниот синџир е способен спонтано да формира и одржува посебна просторна структура. Врз основа на обликот на протеинските молекули, протеините се поделени на фибриларни и глобуларни. Во глобуларните протеини, еден или повеќе полипептидни синџири се превиткуваат во компактна сферична структура, или топка. Обично овие протеини се многу растворливи во вода. Тие ги вклучуваат речиси сите ензими, протеини за транспорт на крв и многу протеини за складирање. Фибриларните протеини се молекули слични на нишки кои се држат заедно со вкрстени врски и формираат долги влакна или слоевити структури. Имаат висока механичка сила, нерастворливи во вода и вршат главно структурни и заштитни функции. Типични претставници на таквите протеини се кератините за коса и волна, свилен фиброин и колаген на тетивите.
Редоследот на ковалентно поврзани амино киселини во полипептидниот синџир се нарекува амино киселинска секвенца или примарна структура на протеините. Примарната структура на секој протеин, кодирана од соодветниот ген, е константна и ги носи сите информации потребни за формирање на структури повеќе високо ниво. Потенцијалниот број на протеини што може да се формираат од 20 амино киселини е практично неограничен.
Како резултат на интеракцијата на страничните групи на амино киселински остатоци, поединечни релативно мали делови од полипептидниот синџир добиваат една или друга конформација (тип на преклопување), позната како секундарна структура на протеините. Неговите најкарактеристични елементи се периодично повторувачката α-спирала и β-структурата. Секундарната структура е многу стабилна. Бидејќи во голема мера е одредена од амино киселинската секвенца на соодветниот протеински регион, станува возможно да се предвиди со одреден степен на веројатност. Терминот „?-хеликс“ беше воведен од американскиот биохемичар, физичар и хемичар Линус Карл Полинг, кој го опиша распоредот на полипептидниот синџир во протеинот?-кератин во форма на десна спирала (?-спиралата може да да се спореди со телефонски кабел). За секое вртење на таква спирала во протеинот има 3,6 остатоци од аминокиселини. Тоа значи дека групата -C= O еден пептидна врскаформира водородна врска со -NH групата на друга пептидна врска, четири аминокиселински остатоци оддалечени од првата. Во просек, секој α-спирален регион вклучува до 15 амино киселини, што одговара на 3-4 вртења на спиралата. Но, во секој поединечен протеин, должината на спиралата може многу да се разликува од оваа вредност. Во пресек, α-спиралата има форма на диск, од кој страничните синџири на амино киселини се насочени кон надвор.
Структура или? - преклопен слој, може да се формира од неколку делови од полипептидниот синџир. Овие делови се испружени и поставени паралелно еден на друг, поврзани едни со други со водородни врски што се јавуваат помеѓу пептидните врски. Тие можат да бидат ориентирани во исти или спротивни насоки (насоката на движење по полипептидниот синџир обично се смета дека е од N-крајот до C-крајот). Во првиот случај, преклопениот слој се нарекува паралелен, во вториот - антипаралелен. Вториот се формира кога пептидниот синџир нагло се врти назад, формирајќи свиок (?-свиткување). Дали страничните синџири на амино киселините се ориентирани нормално на рамнината? -Слој.
Релативна содржина? -спирални пресеци и? -Структурите може да варираат во голема мера меѓу различните протеини. Постојат протеини со доминација на α-спирали (околу 75% од амино киселините во миоглобинот и хемоглобинот), а главниот тип на преклопување на синџирот во многу фибриларни протеини (вклучувајќи свилен фиброин, β-кератин) е α-хеликс. -структура. Регионите на полипептидниот синџир кои не можат да се класифицираат во ниту една од гореопишаните конформации се нарекуваат поврзувачки јамки. Нивната структура е одредена главно од интеракциите помеѓу страничните синџири на амино киселините, а во молекулата на кој било протеин се вклопува на строго дефиниран начин.
Терциерната структура се нарекува просторна структураглобуларни протеини. Но, често овој концепт се однесува на методот на преклопување на полипептидниот синџир во вселената, карактеристичен за секој специфичен протеин. Терцијарна структурасе формира од полипептидниот синџир на протеин спонтано, очигледно, по одреден пат(и) на коагулација со прелиминарно формирање на секундарни структурни елементи. Ако стабилноста на секундарната структура се должи на водородни врски, тогаш терциерната структура е фиксирана со различен систем на не-ковалентни интеракции: водородни, јонски, интермолекуларни интеракции, како и хидрофобни контакти помеѓу страничните синџири на неполарните амино киселински остатоци.
Кај некои протеини, терциерната структура дополнително се стабилизира со формирање на дисулфидни врски (-S-S- врски) помеѓу остатоците од цистеин. Како по правило, во внатрешноста на протеинската топка има странични синџири на хидрофобни амино киселини собрани во јадрото (нивниот трансфер во протеинската топка е термодинамички поволен), а на периферијата има хидрофилни остатоци и некои хидрофобни. Протеинската топка е опкружена со неколку стотици молекули на хидратациона вода, која е неопходна за стабилноста на протеинската молекула и често е вклучена во неговото функционирање. Терциерната структура е мобилна, нејзините поединечни делови можат да се поместат, што доведува до конформациски транзиции кои играат значајна улога во интеракцијата на протеинот со другите молекули.
Терциерната структура е основата на функционалните својства на протеинот. Го одредува формирањето на ансамбли на функционални групи во протеините - активни центри и зони за врзување, им ја дава потребната геометрија и овозможува да се создадат внатрешно опкружување, што е предуслов за појава на многу реакции, обезбедува интеракција со други протеини.
Терциерната структура на протеините јасно одговара на нејзината примарна структура; веројатно постои уште недешифриран стереохемиски код кој ја одредува природата на преклопувањето на протеините. Сепак, еден ист метод на уредување на просторот обично не одговара на една примарна структура, туку на цело семејство на структури во кои само мал дел (до 20-30%) од остатоците од амино киселини може да се совпаднат, но во одредени места во синџирот сличноста на амино киселинските остатоци е зачувана. Резултатот е формирање на големи семејства на протеини кои се карактеризираат со слична терцијарна и повеќе или помалку слична примарна структура и, по правило, заедничка функција. Тоа се, на пример, протеините на организмите различни типови, кои ја имаат истата функција и еволутивно поврзани: миоглобини и хемоглобини, трипсин, химотрипсин, еластаза и други животински протеинази.

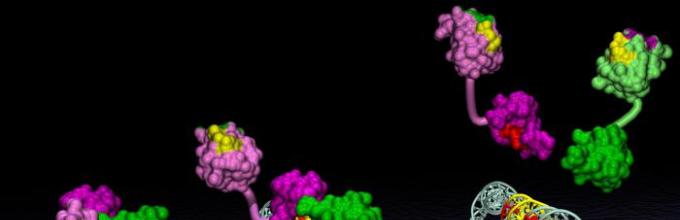
Ориз. 4. Како резултат на комбинацијата на неколку протеински макромолекули со терциерна структура, кватернарна протеинска структура се формира во комплексен комплекс. Пример за такви сложени протеини е хемоглобинот, кој се состои од четири макромолекули.
Често, особено кај големите протеини, преклопувањето на полипептидниот синџир се случува преку формирање од поединечни делови од синџирот на повеќе или помалку автономни елементи на просторната структура - домени кои можат да имаат функционална автономија, одговорни за една или друга биолошка активност на протеини. Така, N-терминалните домени на протеините за коагулација на крвта обезбедуваат нивно прицврстување на клеточната мембрана.
Постојат многу протеини чии молекули се ансамбл од глобули (подединици) кои се држат заедно со хидрофобни интеракции, водородни или јонски врски. Таквите комплекси се нарекуваат олигомерни, мултимерни или подединици протеини. Распоредот на подединици во функционално активен протеински комплекс се нарекува кватернарна структура на протеинот. Некои протеини се способни да формираат структури од повисоки редови, на пример, мултиензимски комплекси, проширени структури (протеини на обвивката на бактериофагот), супрамолекуларни комплекси кои функционираат како една целина (на пример, рибозоми или компоненти на митохондријалниот респираторен синџир).
Кватернарната структура овозможува создавање на молекули со необични геометрии. Така, феритинот, формиран од 24 подединици, има внатрешна празнина, благодарение на која протеинот успева да врзе до 3000 железни јони. Покрај тоа, кватернарната структура овозможува извршување на неколку различни функции во една молекула. Триптофан синтетаза комбинира ензими одговорни за неколку последователни фази на синтезата на аминокиселината триптофан.
Методи за проучување на структурата на протеините
Примарната структура на протеините ги одредува сите други нивоа на организација на протеинската молекула. Затоа, кога се проучува биолошката функција на различни протеини, важно е знаењето за оваа структура. Првиот протеин за кој беше воспоставена аминокиселинската секвенца беше панкреасниот хормон, инсулин. Оваа работа, која траеше 11 години, ја изврши англискиот биохемичар Фредерик Сангер (1954). Тој ја утврди локацијата на 51 аминокиселина во молекулата на хормонот и покажа дека таа се состои од 2 синџири поврзани со дисулфидни врски. Подоцна, поголемиот дел од работата за воспоставување на примарната структура на протеините беше автоматизирана.
Со развојот на методите на генетски инженеринг, стана можно дополнително да се забрза овој процес со одредување на примарната структура на протеините во согласност со резултатите од анализата на нуклеотидната секвенца во гените што ги кодираат овие протеини. Секундарната и терциерната структура на протеините се изучува со користење на прилично сложени физички методи, на пример, кружен дихроизам или рендгенска дифракциона анализа на протеинските кристали. Терциерната структура за прв пат беше воспоставена од англискиот биохемичар Џон Каудри Кендру (1957) за мускулниот протеин миоглобин.

Ориз. 5. Модел на молекулата на миоглобинот (просторна конфигурација на молекулата)
Денатурација на протеини
Релативно слабите врски одговорни за стабилизирање на секундарните, терциерните и кватернерните структури на протеинот лесно се уништуваат, што е придружено со губење на неговата биолошка активност. Уништувањето на првобитната (матична) протеинска структура, наречена денатурација, се случува во присуство на киселини и бази, со загревање, промени во јонската јачина и други влијанија. Како по правило, денатурираните протеини се слабо или воопшто не се растворливи во вода. Со краткотраен ефект и брза елиминација на денатурираните фактори, можна е ренатурација на протеините со целосно или делумно враќање на првобитната структура и биолошките својства.
Класификација на протеини
Сложеноста на структурата на протеинските молекули и екстремната разновидност на функции што тие ги извршуваат го отежнуваат создавањето на унифицирана и јасна класификација на нив, иако обидите да се направи тоа постојано се правени од крајот на 19 век. Врз основа хемиски составПротеините се поделени на едноставни и сложени (понекогаш се нарекуваат протеиди). Молекулите на првите се состојат само од амино киселини. Покрај самиот полипептиден синџир, комплексните протеини содржат непротеински компоненти претставени со јаглехидрати (гликопротеини), липиди (липопротеини), нуклеински киселини (нуклеопротеини), метални јони (металопротеини), фосфатна група (фосфопротеини), пигменти (хромопротеини), итн.
Во зависност од функциите што ги извршуваат, се разликуваат неколку класи на протеини. Најразновидна и најспецијализирана класа се состои од протеини со каталитичка функција - ензими кои имаат способност да ги забрзуваат хемиските реакции што се случуваат во живите организми. Во овој капацитет, протеините учествуваат во сите процеси на синтеза и разградување на различни соединенија за време на метаболизмот, во биосинтезата на протеините и нуклеинските киселини, регулирањето на развојот и диференцијацијата на клетките. Транспортните протеини имаат способност селективно да ги врзуваат масните киселини, хормоните и другите органски и неоргански соединенија и јони, а потоа да ги транспортираат со струја во Вистинско место(на пример, хемоглобинот е вклучен во трансферот на кислород од белите дробови до сите клетки на телото). Транспортните протеини исто така вршат активен транспорт на јони, липиди, шеќери и амино киселини низ биолошките мембрани.
Структурните протеини вршат потпорна или заштитна функција; тие учествуваат во формирањето на клеточниот скелет. Најчести меѓу нив се колагенот на сврзното ткиво, кератинот, ноктите и пердувите, еластинот на васкуларните клетки и многу други. Во комбинација со липидите, тие се структурна основа на клеточните и внатрешните клеточните мембрани.
Голем број на протеини вршат заштитна функција. На пример, имуноглобулините (антитела) на 'рбетниците, кои имаат способност да ги врзуваат странските патогени микроорганизми и супстанции, да ги неутрализираат нивните патогени ефекти врз телото и да го спречат размножувањето на клетките. Фибриногенот и тромбинот се вклучени во процесот на згрутчување на крвта. Многу протеински супстанции кои се излачуваат од бактерии, како и компоненти на некои безрбетници, се класифицирани како токсини.
Некои протеини (регулаторни) се вклучени во регулирањето на физиолошката активност на телото како целина, поединечни органи, клетки или процеси. Тие ја контролираат транскрипцијата на гените и синтезата на протеините; тие вклучуваат пептидно-протеински хормони кои се излачуваат од ендокрините жлезди. Протеините за складирање на семиња обезбедуваат хранливи материи почетни фазиразвој на ембрионот. Тие исто така вклучуваат казеин, албумин од белка од јајце (овалбумин) и многу други. Благодарение на протеините, мускулните клетки стекнуваат способност да се контрахираат и на крајот обезбедуваат движење на телото. Примери за такви контрактилни протеини се актинот и миозинот на скелетните мускули, како и тубулинот, кои се компоненти на цилиите и флагелите на едноклеточните организми; Тие исто така обезбедуваат дивергенција на хромозомите за време на клеточната делба.
Рецепторските протеини се цел на хормоните и другите биолошки активни соединенија. Со нивна помош, клетката согледува информации за состојбата на надворешното опкружување. Тие играат важна улога во пренесувањето на нервната возбуда и во ориентираното движење на клетките (хемотаксија). Трансформацијата и искористувањето на енергијата што влегува во телото, како и енергијата, се случува и со учество на протеини од биоенергетскиот систем (на пример, визуелниот пигмент родопсин, цитохромите на респираторниот синџир). Исто така, има многу протеини со други, понекогаш прилично невообичаени функции (на пример, плазмата на некои риби на Антарктикот содржи протеини кои имаат антифризни својства).
Биосинтеза на протеини
Сите информации за структурата на одреден протеин се „складираат“ во соодветните гени во форма на низа нуклеотиди и се имплементираат во процесот на синтеза на шаблоните. Прво, информациите се пренесуваат (читаат) од молекулата на ДНК до гласник РНК (мРНК) со помош на ензимот ДНК зависна РНК полимераза, а потоа во рибозомот до мРНК, како на матрица во согласност со генетски кодсо учество на транспортни РНК кои доставуваат амино киселини, се јавува формирање на полипептиден синџир.
Синтетизираните полипептидни синџири кои излегуваат од рибозомот, спонтано се преклопуваат, ја добиваат конформациската карактеристика на протеинот и можат да бидат предмет на пост-транслациска модификација. Страничните синџири на поединечни амино киселини можат да претрпат модификации (хидроксилација, фосфорилација, итн.). Затоа, на пример, хидроксипролин и хидроксилизин се наоѓаат во колагенот (види). Модификацијата може да биде придружена и со прекин на полипептидните врски. На овој начин, на пример, доаѓа до формирање на активна инсулинска молекула која се состои од два синџири поврзани со дисулфидни врски.

Ориз. 6. Општа шемабиосинтеза на протеини.
Важноста на протеините во исхраната
Протеините се најважните компоненти на животинската и човечката храна. Хранливата вредност на протеините се одредува според нивната содржина на есенцијални амино киселини, кои не се произведуваат во самото тело. Во овој поглед, растителните протеини се помалку вредни од животинските: тие се посиромашни со лизин, метионин и триптофан и потешко се вари во гастроинтестиналниот тракт. Недостатокот на есенцијални амино киселини во храната доведува до сериозни нарушувања на метаболизмот на азот.
Протеините се разградуваат на слободни амино киселини, кои по апсорпцијата во цревата влегуваат и се дистрибуираат до сите клетки. Некои од нив се разградуваат на едноставни соединенија со ослободување на енергија, кои се користат за различни потреби на клетката, а некои одат во синтеза на нови протеини карактеристични за даден организам. (Р. А. Матвеева, Енциклопедија Кирил и Методиј)
Набројување на протеини
- амилоид - амилоид;
- анјонски - анјонски;
- антивирус - антивирусно;
- автоимуни - автоимуни;
- автологен - автологичен;
- бактериски - бактериски;
- Бенс Џонс протеин;
- вирусно индуцирано - вирусно индуцирано;
- вирусна - вирусна;
- вирусни неструктурни - вирусни неструктурни;
- вирусни структурни - вирусни структурни;
- вирус-специфичен - вирус специфичен;
- висока молекуларна тежина - висока молекуларна тежина;
- што содржи хем - хем;
- хетерологно - странско;
- хибрид - хибрид;
- гликолизиран - гликозиран;
- топчеста - топчеста;
- денатуриран - денатуриран;
- што содржи железо - железо;
- жолчка - жолчка;
- животински протеини - животински протеини;
- заштитно - одбранбено;
- имун - имун;
- имуноген - имунолошки релевантен;
- врзување на калциум;
- кисело - кисело;
- корпускуларен - корпускуларен;
- мембрана - мембрана;
- миелом - миелом;
- микрозомално - микрозомално;
- млечен протеин - млечен протеин;
- моноклонален - моноклонален имуноглобулин;
- мускулен протеин - мускулен протеин;
- мајчин - мајчин;
- нонхистон - нехистон;
- неисправни - делумно;
- нерастворлив - нерастворлив;
- несварлив - нерастворлив;
- неензимски - неензимски;
- ниска молекуларна тежина - мала молекуларна тежина;
- нов протеин - нов протеин;
- општо - целина;
- онкоген - онкопротеин;
- протеин на главната фаза - анјонски;
- протеин на акутна фаза (воспаление) - протеин на акутна фаза;
- храна - храна;
- протеин на крвната плазма - плазма протеин;
- плацентарна - плацента;
- разврзување - разврзување;
- протеин на регенерирачки нерв;
- регулаторна - регулаторна;
- рекомбинација - рекомбинантна;
- рецептор - рецептор;
- рибозомално - рибозомално;
- обврзувачки - обврзувачки;
- секреторен протеин - секреторен протеин;
- C-реактивен - C-реактивен;
- протеин од сурутка - протеин од сурутка, лактопротеин;
- ткиво - ткиво;
- токсичен - токсичен;
- химеричен - химеричен;
- целина - целина;
- цитосолен - цитозолен;
- алкален протеин - анјонски протеин;
- егзоген - егзоген;
- ендогени - ендогени протеин.
Прочитајте повеќе за протеините во литературата:
- Volkenshtein M.V., Molecules and, M., 1965, ch. 3 - 5;
- Гауровиц Ф., Хемија и функции на протеините, транс. од англиски, Москва, 1965;
- Sissakyan N. M. и Gladilin K. L., Биохемиски аспекти на синтезата на протеини, во книгата: Напредоци во биолошката хемија, том 7, М., 1965, стр. 3;
- Степанов В.М. Молекуларна биологија. Структура и функција на протеините. М., 1996;
- Шамин А.Н., Развој на хемија на протеини, М., 1966;
- Протеини и пептиди. М., 1995-2000 година. Т. 1-3;
- Биосинтеза на протеини и нуклеински киселини, ед. А. С. Спирина, М., 1965;
- Вовед во молекуларна биологија, транс. од англиски, М., 1967 г
- Молекули и клетки. [саб. чл.], транс. од англиски, М., 1966, стр. 7 - 27, 94 - 106;
- Основи на биохемија: Превод од англиски М., 1981. Т. 1;
- Проблемот со протеините. М., 1995. Т. 1-5;
- Протеините. Њујорк, 1975-79. 3 ед. V. 1-4.
Најдете нешто друго интересно:
Верверички- органски соединенија со висока молекуларна тежина кои се состојат од остатоци од α-аминокиселини.
ВО протеински составвклучува јаглерод, водород, азот, кислород, сулфур. Некои протеини формираат комплекси со други молекули кои содржат фосфор, железо, цинк и бакар.
Протеините имаат голема молекуларна тежина: албумин од јајца - 36.000, хемоглобин - 152.000, миозин - 500.000. За споредба: молекуларната тежина на алкохолот е 46, оцетна киселина- 60, бензен - 78.
Аминокиселински состав на протеини
Верверички- непериодични полимери, чии мономери се α-амино киселини. Типично, 20 видови на α-амино киселини се нарекуваат протеински мономери, иако над 170 од нив се наоѓаат во клетките и ткивата.
Во зависност од тоа дали аминокиселините можат да се синтетизираат во телото на луѓето и другите животни, тие се разликуваат: неесенцијални амино киселини- може да се синтетизира; есенцијални амино киселини- не може да се синтетизира. Есенцијални амино киселинимора да влезе во телото со храна. Растенијата ги синтетизираат сите видови амино киселини.
Во зависност од составот на аминокиселините, протеините се: целосни- го содржи целиот сет на амино киселини; неисправни- некои амино киселини недостасуваат во нивниот состав. Ако протеините се состојат само од амино киселини, тие се нарекуваат едноставно. Ако протеините содржат, покрај аминокиселините, неаминокиселинска компонента (протетска група), тие се нарекуваат комплекс. Протетската група може да биде претставена со метали (металопротеини), јаглени хидрати (гликопротеини), липиди (липопротеини), нуклеински киселини(нуклеопротеини).
Сите амино киселините содржат: 1) карбоксилна група (-COOH), 2) амино група (-NH 2), 3) радикална или R-група (остатокот од молекулата). Структурата на радикалот е различна за различни типови на амино киселини. Во зависност од бројот на амино групи и карбоксилни групи вклучени во составот на амино киселините, тие се разликуваат: неутрални амино киселиниима една карбоксилна група и една амино група; основни амино киселиниима повеќе од една амино група; кисели амино киселиниима повеќе од една карбоксилна група.
Амино киселините се амфотерични соединенија , бидејќи во раствор тие можат да дејствуваат и како киселини и како бази. Во водени раствори, амино киселините постојат во различни јонски форми.
Пептидна врска
Пептиди- органски материи кои се состојат од остатоци од аминокиселини поврзани со пептидни врски.
Формирањето на пептиди се јавува како резултат на реакцијата на кондензација на амино киселините. Кога амино групата на една аминокиселина е во интеракција со карбоксилната група на друга, меѓу нив се јавува ковалентна азотно-јаглеродна врска, која се нарекува. пептид. Во зависност од бројот на аминокиселински остатоци вклучени во пептидот, постојат дипептиди, трипептиди, тетрапептидиитн. Формирањето на пептидна врска може да се повтори многу пати. Ова доведува до формирање полипептиди. На едниот крај на пептидот има слободна амино група (наречена N-терминал), а на другиот има слободна карбоксилна група (наречена C-крај).

Просторна организација на протеинските молекули
Извршувањето на одредени специфични функции од страна на протеините зависи од просторната конфигурација на нивните молекули, освен тоа, енергетски е неповолно за клетката да ги одржува протеините во расклопена форма, во форма на синџир, затоа полипептидните синџири се подложени на превиткување, стекнувајќи одредена тродимензионална структура или конформација. Има 4 нивоа просторна организација на протеините.
Примарна протеинска структура- редоследот на распоредот на амино киселинските остатоци во полипептидниот синџир што ја сочинува протеинската молекула. Врската помеѓу амино киселините е пептидна врска.

Ако протеинската молекула се состои од само 10 остатоци од аминокиселини, тогаш бројот е теоретски можни опциипротеински молекули кои се разликуваат по редоследот на алтернација на амино киселини - 10 20. Имајќи 20 амино киселини, можете да направите уште поразновидни комбинации од нив. Во човечкото тело се пронајдени околу десет илјади различни протеини, кои се разликуваат како едни од други, така и од протеините на другите организми.
Примарната структура на протеинската молекула е таа што ги одредува својствата на протеинските молекули и нејзината просторна конфигурација. Замената на само една аминокиселина со друга во полипептидниот синџир доведува до промена на својствата и функциите на протеинот. На пример, заменувањето на шестата глутаминска амино киселина со валин во β-подединицата на хемоглобинот води до фактот дека молекулата на хемоглобинот како целина не може да ја изврши својата главна функција - транспорт на кислород; Во такви случаи, лицето развива болест наречена српеста анемија.
Секундарна структура- наредено преклопување на полипептидниот синџир во спирала (изгледа како продолжена пружина). Вртежите на спиралата се зајакнати со водородни врски што се појавуваат помеѓу карбоксилните групи и амино групите. Речиси сите CO и NH групи учествуваат во формирањето на водородни врски. Тие се послаби од пептидните, но, повторени многу пати, даваат стабилност и цврстина на оваа конфигурација. На ниво на секундарна структура, постојат протеини: фиброин (свила, пајакова мрежа), кератин (коса, нокти), колаген (тетиви).



Терцијарна структура- пакување на полипептидни синџири во глобули, кои произлегуваат од формирањето на хемиски врски (водород, јонски, дисулфид) и воспоставување на хидрофобни интеракции помеѓу радикалите на амино киселинските остатоци. Главната улога во формирањето на терциерната структура ја играат хидрофилно-хидрофобните интеракции. Во водените раствори, хидрофобните радикали имаат тенденција да се кријат од водата, групирајќи се во глобулата, додека хидрофилните радикали, како резултат на хидратација (интеракција со водните диполи), имаат тенденција да се појавуваат на површината на молекулата. За некои протеини, терциерната структура се стабилизира со дисулфиди. ковалентни врски, што произлегува помеѓу атомите на сулфур на два остатоци од цистеин. На ниво на терциерна структура има ензими, антитела и некои хормони.

Кватернарна структуракарактеристични за сложените протеини чии молекули се формирани од две или повеќе глобули. Подединиците се држат во молекулата со јонски, хидрофобни и електростатски интеракции. Понекогаш, за време на формирањето на кватернарна структура, се јавуваат дисулфидни врски помеѓу подединици. Најпроучен протеин со кватернарна структура е хемоглобинот. Формирана е од две α-подединици (141 остатоци од аминокиселини) и две β-подединици (146 остатоци од аминокиселини). Со секоја подединица е поврзана хем молекула која содржи железо.
Ако поради некоја причина просторната конформација на протеините отстапува од нормалата, протеинот не може да ги извршува своите функции. На пример, причината за „кравјо лудило“ (спонгиформна енцефалопатија) е абнормалната конформација на прионите, површинските протеини на нервните клетки.
Својства на протеините
Аминокиселинскиот состав и структурата на протеинската молекула го одредуваат својства. Протеините ги комбинираат основните и киселински својства, определено со аминокиселински радикали: колку повеќе кисели амино киселини во протеинот, толку поизразени се неговите кисели својства. Утврдена е способноста за донирање и додавање H + пуферски својства на протеините; Еден од најмоќните пуфери е хемоглобинот во црвените крвни зрнца, кој ја одржува pH вредноста на крвта на константно ниво. Постојат растворливи протеини (фибриноген), а има и нерастворливи протеини кои вршат механички функции (фиброин, кератин, колаген). Постојат протеини кои се хемиски активни (ензими), има хемиски неактивни протеини кои се отпорни на различни услови на животната средина и оние кои се крајно нестабилни.
Надворешни фактори (топлина, ултравиолетово зрачење, тешки металии нивните соли, pH промени, зрачење, дехидрација)
може да предизвика нарушување на структурната организација на протеинската молекула. Процесот на губење на тродимензионалната конформација својствена за дадена протеинска молекула се нарекува денатурација. Причината за денатурација е кршењето на врските кои стабилизираат одредена протеинска структура. Првично, најслабите врски се прекинуваат, а како што се заоструваат условите, се прекинуваат уште посилните. Затоа, прво се губат квартерните, потоа терциерните и секундарните структури. Промената во просторната конфигурација доведува до промена на својствата на протеинот и, како резултат на тоа, го оневозможува протеинот да го изврши својот својствен биолошки функции. Ако денатурацијата не е придружена со уништување на примарната структура, тогаш тоа може да биде реверзибилна, во овој случај, се случува само-обновување на конформациската карактеристика на протеинот. На пример, мембранските рецепторни протеини се подложени на таква денатурација. Процесот на обновување на протеинската структура по денатурација се нарекува ренатурација. Ако обновувањето на просторната конфигурација на протеинот е невозможно, тогаш се нарекува денатурација неповратен.
Функции на протеините
| Функција | Примери и објаснувања |
|---|---|
| Градба | Протеините се вклучени во формирањето на клеточните и екстрацелуларните структури: тие се дел од клеточните мембрани (липопротеини, гликопротеини), косата (кератин), тетивите (колаген) итн. |
| Транспорт | Крвниот протеин хемоглобинот го прицврстува кислородот и го транспортира од белите дробови до сите ткива и органи, а од нив го пренесува јаглерод диоксидот во белите дробови; Составот на клеточните мембрани вклучува специјални протеини кои обезбедуваат активен и строго селективен трансфер на одредени супстанции и јони од клетката во надворешната средина и назад. |
| Регулаторна | Протеинските хормони учествуваат во регулирањето на метаболичките процеси. На пример, хормонот инсулин го регулира нивото на гликоза во крвта, ја промовира синтезата на гликоген и го зголемува формирањето на масти од јаглехидратите. |
| Заштитна | Како одговор на пенетрацијата на туѓи протеини или микроорганизми (антигени) во телото, се формираат специјални протеини - антитела кои можат да ги врзат и неутрализираат. Фибринот, формиран од фибриноген, помага да се запре крварењето. |
| Мотор | Контрактилните протеини актин и миозин обезбедуваат мускулна контракција кај повеќеклеточните животни. |
| Сигнал | Во површинската мембрана на клетката се вградени протеински молекули кои се способни да ја менуваат својата терциерна структура како одговор на факторите на околината, со што добиваат сигнали од надворешната средина и пренесуваат команди до клетката. |
| Складирање | Во телото на животните, протеините, по правило, не се складираат, со исклучок на албумин од јајца и млечен казеин. Но, благодарение на протеините, некои супстанции можат да се складираат во телото; на пример, за време на распаѓањето на хемоглобинот, железото не се отстранува од телото, туку се складира, формирајќи комплекс со протеинот феритин. |
| Енергија | Кога 1 g протеин се распаѓа во финални производи, се ослободува 17,6 kJ. Прво, протеините се разложуваат на амино киселини, а потоа во финалните производи - вода, јаглерод диоксид и амонијак. Меѓутоа, протеините се користат како извор на енергија само кога се трошат други извори (јаглехидрати и масти). |
| Каталитички | Една од најважните функции на протеините. Обезбедени од протеини - ензими кои ги забрзуваат биохемиските реакции што се случуваат во клетките. На пример, рибулоза бифосфат карбоксилаза ја катализира фиксацијата на CO 2 за време на фотосинтезата. |
Ензими
Ензими, или ензими, се посебна класа на протеини кои се биолошки катализатори. Благодарение на ензимите, биохемиските реакции се случуваат со огромна брзина. Брзината на ензимските реакции е десетици илјади пати (а понекогаш и милиони) поголема од брзината на реакциите што се случуваат со учество на неоргански катализатори. Супстанцијата на која делува ензимот се нарекува супстрат.
Ензимите се глобуларни протеини, структурни карактеристикиензимите можат да се поделат во две групи: едноставни и сложени. Едноставни ензимисе едноставни протеини, т.е. се состои само од амино киселини. Комплексни ензимисе сложени протеини, т.е. Покрај протеинскиот дел содржат и група од непротеинска природа - кофактор. Некои ензими користат витамини како кофактори. Молекулата на ензимот содржи посебен дел наречен активен центар. Активен центар- мал дел од ензимот (од три до дванаесет амино киселински остатоци), каде што врзувањето на супстратот или супстратите се случува за да се формира комплекс ензим-супстрат. По завршувањето на реакцијата, комплексот ензим-супстрат се распаѓа во ензимот и во производ(ите) на реакцијата. Некои ензими имаат (освен активните) алостерични центри- области на кои се прикачени регулаторите на брзината на ензимот ( алостерични ензими).

Реакциите на ензимската катализа се карактеризираат со: 1) висока ефикасност, 2) строга селективност и насока на дејство, 3) специфичност на супстратот, 4) фина и прецизна регулација. Подлогата и специфичноста на реакцијата на реакциите на ензимска катализа се објаснети со хипотезите на E. Fischer (1890) и D. Koshland (1959).
Е. Фишер (хипотеза за заклучување на клучот)сугерираше дека просторните конфигурации на активниот центар на ензимот и супстратот мора точно да одговараат една на друга. Подлогата се споредува со „клучот“, ензимот со „бравата“.
Д. Кошланд (хипотеза за ракавици)сугерираше дека просторната кореспонденција помеѓу структурата на подлогата и активниот центар на ензимот се создава само во моментот на нивната меѓусебна интеракција. Оваа хипотеза е исто така наречена хипотеза за индуцирана кореспонденција.
Брзината на ензимските реакции зависи од: 1) температура, 2) концентрација на ензимот, 3) концентрација на супстратот, 4) pH вредност. Треба да се нагласи дека бидејќи ензимите се протеини, нивната активност е највисока во физиолошки нормални услови.
Повеќето ензими можат да работат само на температури помеѓу 0 и 40°C. Во овие граници, брзината на реакција се зголемува приближно 2 пати со секое зголемување на температурата за 10 °C. На температури над 40 °C, протеинот се подложува на денатурација и ензимската активност се намалува. На температури блиску до замрзнување, ензимите се деактивираат.
Како што се зголемува количината на супстратот, брзината на ензимската реакција се зголемува додека бројот на молекули на супстратот не се изедначи со бројот на ензимските молекули. Со дополнително зголемување на количината на супстрат, брзината нема да се зголеми, бидејќи активните центри на ензимот се заситени. Зголемувањето на концентрацијата на ензимот доведува до зголемена каталитичка активност, бидејќи поголем број на молекули на супстратот се подложени на трансформации по единица време.

За секој ензим, постои оптимална pH вредност при која покажува максимална активност (пепсин - 2,0, плунковна амилаза - 6,8, панкреасна липаза - 9,0). При повисоки или пониски pH вредности, ензимската активност се намалува. Со ненадејни промени во pH вредноста, ензимот се денатурира.
Брзината на алостеричните ензими е регулирана со супстанции кои се прикачуваат на алостерични центри. Ако овие супстанции ја забрзаат реакцијата, тие се нарекуваат активатори, ако успорат - инхибитори.
Класификација на ензими
Според видот на хемиските трансформации што ги катализираат, ензимите се поделени во 6 класи:
- оксиредуктази(пренос на атоми на водород, кислород или електрони од една супстанција во друга - дехидрогеназа),
- трансферази(пренос на метил, ацил, фосфат или амино група од една супстанција во друга - трансаминаза),
- хидролази(реакции на хидролиза во кои од супстратот се формираат два производи - амилаза, липаза),
- лијази(нехидролитичко додавање на подлогата или одвојување на група атоми од него, при што може да се прекинат врските C-C, C-N, C-O, C-S - декарбоксилаза),
- изомерази(интрамолекуларно преуредување - изомераза),
- лигази(поврзување на две молекули како резултат на формирање на врски C-C, C-N, C-O, C-S - синтетаза).
Класите за возврат се поделени на подкласи и поткласи. Во тековната меѓународна класификацијаСекој ензим има специфичен код, кој се состои од четири броеви одделени со точки. Првиот број е класата, вториот е подкласата, третиот е поткласата, четвртиот е серискиот број на ензимот во оваа подкласа, на пример, кодот на аргиназа е 3.5.3.1.
Оди до предавања бр.2„Структура и функции на јаглени хидрати и липиди“
Оди до предавања бр.4„Структура и функции на АТП нуклеинските киселини“
Животната активност на клетката се заснова на биохемиските процеси што се случуваат во молекуларно нивои служи како предмет на проучување на биохемијата. Соодветно, феномените на наследноста и варијабилноста се поврзуваат и со молекулите на органските материи, а првенствено со нуклеинските киселини и протеините.
Состав на протеини
Протеините се големи молекули, кој се состои од стотици и илјадници елементарни единици - амино киселини. Таквите супстанции, кои се состојат од повторувачки елементарни единици - мономери, се нарекуваат полимери. Соодветно на тоа, протеините може да се наречат полимери, чии мономери се амино киселини.
Вкупно, 20 видови на амино киселини се познати во живата клетка. Името на аминокиселината е добиено поради содржината во нејзиниот состав на аминската група NHy, која има основни својства и карбоксилната група COOH, која има кисели својства. Сите амино киселини имаат иста NH2-CH-COOH група и се разликуваат една од друга со хемиска група наречена радикал - R. Спојувањето на амино киселините во полимерен синџир настанува поради формирањето на пептидна врска (CO - NH) помеѓу карбоксилната група на една амино киселина и амино групата на друга амино киселина. Ова ослободува молекула на вода. Ако добиениот полимерен синџир е краток, тој се нарекува олигопептид, ако е долг, се нарекува полипептид.
Структура на протеини
Кога се разгледува структурата на протеините, се разликуваат примарни, секундарни и терциерни структури.
Примарна структураопределена со редоследот на алтернација на амино киселините во синџирот. Промената на распоредот на дури една аминокиселина доведува до формирање на сосема нова протеинска молекула. Бројот на протеински молекули што се формираат со комбинирање на 20 различни амино киселини достигнува астрономска бројка.
Доколку големите молекули (макромолекули) на протеинот се наоѓаат во издолжена состојба во клетката, тие би заземале премногу простор во неа, што би го отежнало функционирањето на клетката. Во овој поглед, протеинските молекули се извртуваат, се наведнуваат и преклопуваат во различни конфигурации. Значи врз основа на примарната структура се јавува секундарна структура -Протеинскиот синџир се вклопува во спирала која се состои од униформни вртења. Соседните вртења се поврзани едни со други со слаби водородни врски, кои, кога се повторуваат многу пати, даваат стабилност на протеинските молекули со оваа структура.
Спиралата на секундарната структура се вклопува во калем, формирајќи терцијарна структура.Обликот на намотката на секој тип на протеин е строго специфичен и целосно зависи од примарната структура, т.е. од редот на амино киселините во синџирот. Терциерната структура се одржува поради многу слаби електростатски врски: позитивно и негативно наелектризираните групи на амино киселини се привлекуваат и ги спојуваат дури и широко одвоените делови од протеинскиот синџир. Други делови од протеинската молекула, кои носат, на пример, хидрофобни (водоотпорни) групи, исто така се приближуваат еден до друг.
Некои протеини, како што е хемоглобинот, се состојат од неколку синџири кои се разликуваат во примарната структура. Комбинирајќи се заедно, тие создаваат комплексен протеин кој има не само терцијарен, туку и квартерна структура(сл. 2).
Следната шема е забележана во структурите на протеинските молекули: колку е повисоко структурното ниво, толку се послаби хемиските врски што ги поддржуваат. Врските што ја формираат квартерната, терциерната и секундарната структура се исклучително чувствителни на физичко-хемиските услови на околината, температурата, зрачењето итн. Под нивно влијание структурите на протеинските молекули се уништуваат до примарна - оригинална структура. Ова нарушување на природната структура на протеинските молекули се нарекува денатурација.Кога ќе се отстрани денатурирачкиот агенс, многу протеини се способни спонтано да ја вратат нивната првобитна структура. Ако природниот протеин е изложен на високи температури или интензивно дејство на други фактори, тогаш тој е неповратно денатуриран. Тоа е фактот за неповратна денатурација на клеточните протеини што ја објаснува неможноста за живот во услови на многу високи температури.

Биолошка улога на протеините во клетката
Протеини, исто така наречени протеини(грчки протос - прво),во клетките на животните и растенијата извршуваат разновидни и многу важни функции, кои го вклучуваат следново.
Каталитички.Природни катализатори - ензимисе целосно или речиси целосно протеини. Благодарение на ензимите, хемиските процеси во живите ткива се забрзуваат стотици илјади или милиони пати. Под нивно влијание, сите процеси се случуваат веднаш под „благи“ услови: при нормална телесна температура, во средина неутрална за живо ткиво. Брзината, точноста и селективноста на ензимите се неспоредливи со кој било вештачки катализатор. На пример, една ензимска молекула во една минута врши реакција на распаѓање на 5 милиони молекули на водород пероксид (H2O2). Ензимите се карактеризираат со селективност. Така, мастите се разградуваат со посебен ензим кој не влијае на протеините и полисахаридите (скроб, гликоген). За возврат, ензимот кој го разградува само скробот или гликогенот не влијае на мастите.
Процесот на разградување или синтеза на која било супстанција во клетката обично се дели на голем број хемиски операции. Секоја операција се изведува од посебен ензим. Група такви ензими сочинуваат биохемиска подвижна лента.
Се верува дека каталитичката функција на протеините зависи од нивната терциерна структура; кога таа е уништена, каталитичката активност на ензимот исчезнува.
Заштитна.Некои видови на протеини ја штитат клетката и телото како целина од патогени и туѓи тела кои влегуваат во нив. Таквите протеини се нарекуваат антитела.Антителата се врзуваат за протеините на бактериите и вирусите кои се туѓи за телото, што ја потиснува нивната репродукција. За секој странски протеин, телото произведува специјални „анти-протеини“ - антитела. Овој механизам на отпорност на патогени се нарекува имунитет.
За да се спречи болеста, на луѓето и животните им се даваат ослабени или убиени патогени (вакцини), кои не предизвикуваат болест, туку предизвикуваат посебни клетки во телото да произведуваат антитела против овие патогени. Доколку во таков организам по некое време навлезат патогени вируси и бактерии, тие наидуваат на силна заштитна бариера од антитела.
Хормонални.Многу хормони се исто така протеини. Заедно со нервниот систем, хормоните го контролираат функционирањето на различни органи (и на целото тело) преку системот хемиски реакции.
Рефлексивни.Клеточните протеини примаат сигнали кои доаѓаат однадвор. При што различни факторисредини (температурни, хемиски, механички итн.) предизвикуваат промени во структурата на протеините - реверзибилна денатурација, што, пак, придонесува за појава на хемиски реакции кои обезбедуваат одговор на клетката на надворешна иритација. Оваа способност на протеините е во основата на функционирањето на нервниот систем и мозокот.
Мотор.Сите видови движења на клетките и телото: треперење на цилиите кај протозоите, мускулна контракција кај вишите животни и други моторни процеси - се произведуваат од посебен вид на протеин.
Енергија.Протеините можат да послужат како извор на енергија за клетките. Со недостаток на јаглени хидрати или масти, молекулите на амино киселините се оксидираат. Енергијата што се ослободува во овој случај се користи за одржување на виталните процеси на телото.
Транспорт.Протеинот хемоглобин во крвта е способен да го врзува кислородот од воздухот и да го транспортира низ телото. Оваа важна функција ја делат и некои други протеини.
Пластика.Протеини - главни градежен материјалклетките (нивните мембрани) и организмите (нивните крвни садови, нервите, дигестивниот тракт итн.). Во исто време, протеините имаат индивидуална специфичност, т.е. организмите на поединечни луѓе содржат некои протеини кои се карактеристични само за нив -
Така, протеините се најважната компонента на клетката, без која е невозможна манифестацијата на својствата на животот. Сепак, репродукцијата на живите суштества, феноменот на наследноста, како што ќе видиме подоцна, е поврзан со молекуларните структури на нуклеинските киселини. Ова откритие е резултат најновите достигнувањабиологија. Сега е познато дека живата клетка нужно поседува два вида полимери - протеини и нуклеински киселини. Нивната интеракција ги содржи најдлабоките аспекти на феноменот на животот.