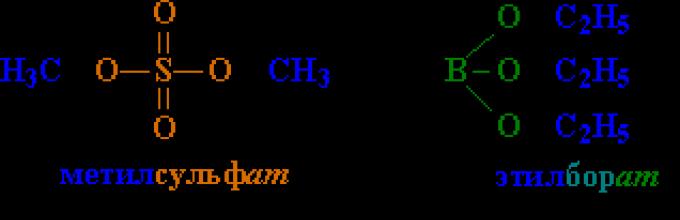Jeśli wyjściowy kwas jest wielozasadowy, możliwe jest utworzenie albo pełnych estrów - wszystkie grupy HO zostaną zastąpione, albo estrów kwasowych - częściowe podstawienie. W przypadku kwasów jednozasadowych możliwe są tylko pełne estry (ryc. 1).
Ryż. 1. PRZYKŁADY ESTRÓW na bazie kwasu nieorganicznego i karboksylowego
Nazewnictwo estrów.
Nazwę tworzy się w następujący sposób: najpierw wskazuje się grupę R przyłączoną do kwasu, następnie nazwę kwasu z przyrostkiem „at” (jak w nazwach soli nieorganicznych: węgiel Na Azotan sodu Na chrom). Przykłady na ryc. 2

Ryż. 2. NAZWY ESTRÓW. Fragmenty cząsteczek i odpowiadające im fragmenty nazw są podświetlone tym samym kolorem. Estry są zwykle uważane za produkty reakcji kwasu z alkoholem; na przykład propionian butylu można traktować jako wynik reakcji kwasu propionowego z butanolem.
Jeśli użyjesz trywialnego ( cm. TRYWALNE NAZWY SUBSTANCJI) nazwa wyjściowego kwasu, wówczas nazwa związku zawiera słowo „ester”, na przykład C 3 H 7 COOC 5 H 11 - ester amylowy kwasu masłowego.
Klasyfikacja i skład estrów.
Wśród badanych i powszechnie stosowanych estrów przeważają związki pochodne kwasy karboksylowe. Estry na bazie kwasów mineralnych (nieorganicznych) nie są tak różnorodne, ponieważ klasa kwasów mineralnych jest mniej liczna niż kwasów karboksylowych (różnorodność związków jest jedną z cech charakterystycznych chemii organicznej).
Gdy liczba atomów C w pierwotnym kwasie karboksylowym i alkoholu nie przekracza 6–8, odpowiednie estry są bezbarwnymi oleistymi cieczami, najczęściej o owocowym zapachu. Tworzą grupę estrów owocowych. Jeśli w tworzeniu estru bierze udział aromatyczny alkohol (zawierający rdzeń aromatyczny), wówczas takie związki z reguły mają zapach kwiatowy, a nie owocowy. Wszystkie związki z tej grupy są praktycznie nierozpuszczalne w wodzie, natomiast łatwo rozpuszczalne w większości rozpuszczalników organicznych. Związki te są interesujące ze względu na szeroką gamę przyjemnych aromatów (tab. 1), niektóre z nich zostały najpierw wyizolowane z roślin, a później syntetyzowane sztucznie.
| Tabela 1. NIEKTÓRE ESTRY, posiadający owocowy lub kwiatowy aromat (fragmenty oryginalnych alkoholi w formule związku i w nazwie wyróżniono pogrubioną czcionką) | ||
| Formuła estrowa | Nazwa | Aromat |
| CH3 COO C 4 H 9 | Butyl octan | gruszka |
| C3H7COO CH 3 | Metyl Ester kwasu masłowego | jabłko |
| C3H7COO C 2 H 5 | Etyl Ester kwasu masłowego | Ananas |
| C4H9COO C 2 H 5 | Etyl | karmazynowy |
| C4H9COO C 5 H 11 | Izoamil ester kwasu izowalerianowy | banan |
| CH3 COO CH 2 C 6 H 5 | Benzyl octan | jaśmin |
| C 6 H 5 COO CH 2 C 6 H 5 | Benzyl benzoesan | kwiatowy |
Gdy wielkość grup organicznych zawartych w estrach wzrasta do C 15–30, związki uzyskują konsystencję substancji plastycznych, łatwo mięknących. Ta grupa nazywa się woskami; są one zwykle bezwonne. Wosk pszczeli zawiera mieszaninę różnych estrów, jednym ze składników wosku, który wyizolowano i oznaczono jego skład, jest ester mirycylowy kwasu palmitynowego C 15 H 31 COOC 31 H 63. Wosk chiński (produkt wydaliny koszenili - owadów Azji Wschodniej) zawiera ester cerylowy kwasu cerotowego C 25 H 51 COOC 26 H 53. Ponadto woski zawierają również wolne kwasy karboksylowe i alkohole, które zawierają duże grupy organiczne. Woski nie zwilżają się wodą i są rozpuszczalne w benzynie, chloroformie i benzenie.
Trzecia grupa to tłuszcze. W przeciwieństwie do poprzednich dwóch grup opartych na alkohole jednowodorotlenowe ROH, wszystkie tłuszcze są estrami powstałymi z alkoholu trójwodorotlenowego glicerolu HOCH 2 – CH (OH) – CH 2 OH. Kwasy karboksylowe tworzące tłuszcze mają zwykle łańcuch węglowodorowy zawierający 9–19 atomów węgla. Tłuszcze zwierzęce (masło krowie, jagnięcina, smalec) są substancjami plastycznymi, topliwymi. Tłuszcze roślinne (z oliwek, nasion bawełny, oleju słonecznikowego) są lepkimi cieczami. Tłuszcze zwierzęce składają się głównie z mieszaniny glicerydów kwasu stearynowego i palmitynowego (ryc. 3A, B). Oleje roślinne zawierają glicerydy kwasów o nieco krótszej długości łańcucha węglowego: laurynowy C 11 H 23 COOH i mirystynowy C 13 H 27 COOH. (podobnie jak kwas stearynowy i palmitynowy, są to kwasy nasycone). Takie oleje można długo przechowywać na powietrzu, nie zmieniając ich konsystencji, dlatego nazywane są nieschnącymi. Natomiast olej lniany zawiera gliceryd nienasyconego kwasu linolowego (Rysunek 3B). Olej taki nałożony cienką warstwą na powierzchnię wysycha pod wpływem tlenu atmosferycznego podczas polimeryzacji wzdłuż wiązań podwójnych i tworzy się elastyczny film, nierozpuszczalny w wodzie i rozpuszczalnikach organicznych. Naturalny olej suszący wytwarzany jest z oleju lnianego.

Ryż. 3. Glicerydy kwasu stearynowego i palmitynowego (A i B)– składniki tłuszczu zwierzęcego. Gliceryd kwasu linolowego (B) jest składnikiem oleju lnianego.
Estry kwasów mineralnych (siarczany alkilowe, borany alkilowe zawierające fragmenty niższych alkoholi C1–8) są cieczami oleistymi, estry wyższych alkoholi (począwszy od C9) są związkami stałymi.
Właściwości chemiczne estrów.
Najbardziej charakterystyczną cechą estrów kwasów karboksylowych jest hydrolityczne (pod wpływem wody) rozszczepienie wiązania estrowego, które w środowisku obojętnym przebiega powoli, a w obecności kwasów lub zasad zauważalnie przyspiesza, gdyż Jony H+ i HO – katalizują ten proces (rys. 4A), przy czym jony hydroksylowe działają efektywniej. Hydroliza w obecności zasad nazywa się zmydlaniem. Jeśli weźmiesz ilość alkaliów wystarczającą do zneutralizowania całego utworzonego kwasu, nastąpi całkowite zmydlenie estru. Proces ten prowadzony jest na skalę przemysłową, a glicerynę i wyższe kwasy karboksylowe (C 15–19) otrzymuje się w postaci soli metale alkaliczne, reprezentujący mydło (ryc. 4B). Fragmenty kwasów nienasyconych zawartych w olejach roślinnych, podobnie jak wszelkie związki nienasycone, mogą ulegać uwodornieniu, wodór przyłącza się do podwójnych wiązań i powstają związki podobne do tłuszczów zwierzęcych (Rys. 4B). Tą metodą na skalę przemysłową wytwarza się tłuszcze stałe na bazie oleju słonecznikowego, sojowego lub kukurydzianego. Z produktów uwodornienia olejów roślinnych zmieszanych z naturalnymi tłuszczami zwierzęcymi i różnymi dodatki do żywności, zrób margarynę.

Główną metodą syntezy jest oddziaływanie kwasu karboksylowego i alkoholu, katalizowane przez kwas i któremu towarzyszy uwolnienie wody. Reakcja ta jest odwrotna do pokazanej na ryc. 3A. Aby proces przebiegał w pożądanym kierunku (synteza estrów), z mieszaniny reakcyjnej oddestylowuje się (destyluje) wodę. Dzięki specjalnym badaniom z wykorzystaniem znakowanych atomów udało się ustalić, że podczas procesu syntezy atom O, będący częścią powstałej wody, oddziela się od kwasu (zaznaczonego czerwoną przerywaną ramką), a nie od alkoholu ( niezrealizowana opcja jest zaznaczona niebieską przerywaną ramką).
Estry wytwarza się według tego samego schematu kwasy nieorganiczne na przykład nitrogliceryna (ryc. 5B). Zamiast kwasów można zastosować chlorki kwasowe, metodę można zastosować zarówno w przypadku kwasów karboksylowych (rys. 5C), jak i nieorganicznych (rys. 5D).
Oddziaływanie soli kwasów karboksylowych z halogenkami RCl prowadzi również do estrów (rys. 5D), reakcja jest dogodna, ponieważ jest nieodwracalna - uwolniona sól nieorganiczna jest natychmiast usuwana z organicznego środowiska reakcji w postaci osadu.
Zastosowanie estrów.
Mrówczan etylu HCOOC 2 H 5 i octan etylu H 3 COOC 2 H 5 stosowane są jako rozpuszczalniki do lakierów celulozowych (na bazie nitrocelulozy i octanu celulozy).
Estry na bazie niższych alkoholi i kwasów (Tabela 1) są stosowane w Przemysł spożywczy przy tworzeniu esencji owocowych i estrów na bazie alkoholi aromatycznych – w przemyśle perfumeryjnym.
Na bazie wosków produkowane są pasty, smary, impregnaty do papieru (papieru woskowanego) i skóry, wchodzą także w skład kremów kosmetycznych i maści leczniczych.
Tłuszcze wraz z węglowodanami i białkami tworzą zestaw pokarmów niezbędnych do odżywiania, są częścią wszystkich komórek roślinnych i zwierzęcych, ponadto gromadząc się w organizmie pełnią rolę rezerwy energii. Ze względu na niską przewodność cieplną warstwa tłuszczu dobrze chroni zwierzęta (zwłaszcza zwierzęta morskie - wieloryby lub morsy) przed hipotermią.
Tłuszcze zwierzęce i roślinne są surowcami do produkcji wyższych kwasów karboksylowych, detergenty i gliceryna (ryc. 4), stosowana w przemyśle kosmetycznym oraz jako składnik różnych smarów.
Nitrogliceryna (ryc. 4) jest dobrze znanym lekiem i materiał wybuchowy, podstawa dynamitu.
Oleje schnące powstają z olejów roślinnych (ryc. 3), które stanowią podstawę farb olejnych.
Estry kwasu siarkowego (rys. 2) stosowane są w syntezie organicznej jako odczynniki alkilujące (wprowadzające grupę alkilową do związku), a estry Kwas fosforowy(ryc. 5) - jako środki owadobójcze, a także dodatki do olejów smarowych.
Michaił Lewicki
Kiedy kwasy karboksylowe reagują z alkoholami (reakcja estryfikacji), tworzą się estry:
R 1 -COOH (kwas) + R 2 -OH (alkohol) ↔ R 1 -COOR 2 (ester) + H 2 O
Ta reakcja jest odwracalna. Produkty reakcji mogą oddziaływać ze sobą tworząc materiały wyjściowe - alkohol i kwas. Zatem reakcja estrów z wodą – hydroliza estrów – jest odwrotnością reakcji estryfikacji. Równowaga chemiczna, który ustala się, gdy szybkości reakcji bezpośredniej (estryfikacja) i odwrotnej (hydroliza) są równe, można przesunąć w kierunku tworzenia estrów w obecności substancji usuwających wodę.
Estry w przyrodzie i technologii
Estry są szeroko rozpowszechnione w przyrodzie i znajdują zastosowanie w technologii i różnych gałęziach przemysłu. Są dobrymi rozpuszczalnikami materia organiczna, ich gęstość jest mniejsza niż gęstość wody i praktycznie się w niej nie rozpuszczają. Zatem estry o stosunkowo małej masie cząsteczkowej są łatwopalnymi cieczami o niskiej temperaturze wrzenia i mają zapach różnych owoców. Stosowane są jako rozpuszczalniki do lakierów i farb oraz jako środki aromatyzujące produkty w przemyśle spożywczym. Na przykład ester metylowy kwasu masłowego ma zapach jabłek, etanol ten kwas - zapach ananasów, eter izobutylowy kwas octowy– zapach bananów:
C3H7-COO-CH3 (ester metylowy kwasu masłowego);
C3H7-COO-C2H5 (maślan etylu);
CH 3-COO-CH 2-CH 2 (octan izobutylu)
Nazywa się estry wyższych kwasów karboksylowych i wyższych alkoholi jednozasadowych woski. Zatem wosk pszczeli składa się głównie z estru kwasu palmitynowego i alkoholu mirycylowego C 15 H 31 COOC 31 H 63; wosk kaszalotii – spermacet – ester tego samego kwasu palmitynowego i alkoholu cetylowego C 15 H 31 COOC 16 H 33
Estry– funkcjonalne pochodne kwasów karboksylowych,
w cząsteczkach, w których grupa hydroksylowa (-OH) jest zastąpiona resztą alkoholową (-OR)
Estry kwasów karboksylowych – związki o wzorze ogólnym
R-COOR”,gdzie R i R” oznaczają rodniki węglowodorowe.
Estry nasyconych jednozasadowych kwasów karboksylowych mają ogólny wzór:
Lotne, bezbarwne ciecze
· Słabo rozpuszczalny w wodzie
· Najczęściej o przyjemnym zapachu
Lżejszy od wody
Estry występują w kwiatach, owocach i jagodach. Określają ich specyficzny zapach.
Czy część integralna olejki eteryczne(znanych jest około 3000 m.in. - pomarańcza, lawenda, róża itp.)
Estry niższych kwasów karboksylowych i niższych alkoholi jednowodorotlenowych mają przyjemny zapach kwiatów, jagód i owoców. Podstawą wosków naturalnych są estry wyższych kwasów jednozasadowych i wyższych alkoholi jednowodorotlenowych. Na przykład wosk pszczeli zawiera ester kwasu palmitynowego i alkoholu mirycylowego (palmitynian mirycylu):
CH 3 (CH 2) 14 –CO – O – (CH 2) 29 CH 3
|
Aromat. Formuła strukturalna. |
Imię estera |
|
Jabłko
|
Eter etylowy Kwas 2-metylobutanowy |
|
wiśnia
|
Ester kwasu amylomrówkowego |
|
Gruszka
|
Ester izoamylowy kwasu octowego |
|
Ananas |
Ester etylowy kwasu masłowego (maślan etylu) |
|
Banan
|
Ester izobutylowy kwasu octowego (j octan izoamylu również przypomina zapach banana) |
|
Jaśmin
|
Octan eteru benzylowego (octan benzylu) |
Krótkie nazwy estrów opierają się na nazwie rodnika (R") w reszcie alkoholowej i nazwie grupy RCOO w reszcie kwasowej. Na przykład kwas etylooctowy CH 3 COO C 2 H 5 zwany octan etylu.
Aplikacja
· Jako substancje zapachowe i wzmacniacze zapachu w przemyśle spożywczym i perfumeryjnym (produkcja mydła, perfum, kremów);
· W produkcji tworzyw sztucznych i gumy jako plastyfikatory.
Plastyfikatory – substancje wprowadzane do składu materiałów polimerowych w celu nadania (lub zwiększenia) elastyczności i (lub) plastyczności podczas przetwarzania i eksploatacji.
Zastosowanie w medycynie
W koniec XIX- na początku XX wieku, kiedy synteza organiczna stawiała pierwsze kroki, zsyntetyzowano i zbadano wiele estrów przez farmakologów. Stały się podstawą takich leków jak salol, walidol itp. Salicylan metylu był szeroko stosowany jako miejscowy środek drażniący i przeciwbólowy, który obecnie został praktycznie zastąpiony skuteczniejszymi lekami.
Przygotowanie estrów
Estry można otrzymać w reakcji kwasów karboksylowych z alkoholami ( reakcja estryfikacji). Katalizatorami są kwasy mineralne.
Wideo „Przygotowanie eteru etylowo-acetylowego”
Wideo „Przygotowanie eteru boronetylowego”
Reakcja estryfikacji w warunkach katalizy kwasowej jest odwracalna. Proces odwrotny - rozszczepienie estru pod działaniem wody z wytworzeniem kwasu karboksylowego i alkoholu - nazywa się hydroliza estrów.
RCOOR" + H2O (H+)↔ RCOOH + R”OH
Hydroliza w obecności zasady jest nieodwracalna (ponieważ powstały ujemnie naładowany anion karboksylanowy RCOO nie reaguje z odczynnikiem nukleofilowym - alkoholem).
Ta reakcja nazywa się zmydlanie estrów(analogicznie do alkalicznej hydrolizy wiązań estrowych w tłuszczach przy produkcji mydła).
5 marca 2018 rEstry nazywane są zwykle związkami otrzymywanymi w reakcji estryfikacji z kwasów karboksylowych. W tym przypadku OH- z grupy karboksylowej zostaje zastąpiony rodnikiem alkoksylowym. W rezultacie powstają estry, których wzór ogólnie zapisuje się jako R-COO-R.
Struktura grupy estrowej
Biegunowość wiązania chemiczne w cząsteczkach estrów jest podobna do polarności wiązań w kwasach karboksylowych. Główną różnicą jest brak ruchomego atomu wodoru, w miejscu którego znajduje się reszta węglowodorowa. Jednocześnie centrum elektrofilowe znajduje się na atomie węgla grupy estrowej. Ale atom węgla połączonej z nim grupy alkilowej jest również spolaryzowany dodatnio.
O elektrofilowości, a co za tym idzie o właściwościach chemicznych estrów, decyduje budowa reszty węglowodorowej, która zajmuje miejsce atomu H w grupie karboksylowej. Jeśli rodnik węglowodorowy tworzy układ sprzężony z atomem tlenu, to reaktywność zauważalnie wzrasta. Dzieje się tak na przykład w przypadku estrów akrylowych i winylowych.
Właściwości fizyczne
Większość estrów to ciecze lub substancje krystaliczne z przyjemnym aromatem. Ich temperatura wrzenia jest zwykle niższa niż kwasów karboksylowych o podobnych masach cząsteczkowych. Potwierdza to spadek oddziaływań międzycząsteczkowych, a to z kolei tłumaczy się brakiem wiązań wodorowych między sąsiednimi cząsteczkami.
Jednakże, podobnie jak właściwości chemiczne estrów, właściwości fizyczne zależą od cech strukturalnych cząsteczki. Dokładniej, od rodzaju alkoholu i kwasu karboksylowego, z którego powstaje. Na tej podstawie estry dzieli się na trzy główne grupy:
- Owocowe estry. Powstają z niższych kwasów karboksylowych i tych samych alkoholi jednowodorotlenowych. Płyny o charakterystycznym przyjemnym zapachu kwiatowo-owocowym.
- Woski. Są pochodnymi wyższych (o liczbie atomów węgla od 15 do 30) kwasów i alkoholi, mających jeden Grupa funkcyjna. Są to substancje plastyczne, które łatwo miękną w dłoniach. Głównym składnikiem wosku pszczelego jest palmitynian mirycylu C 15 H 31 COOC 31 H 63, a chińskim jest ester kwasu cerotowego C 25 H 51 COOC 26 H 53. Są nierozpuszczalne w wodzie, ale rozpuszczalne w chloroformie i benzenie.
- Tłuszcze. Powstaje z gliceryny oraz średnich i wyższych kwasów karboksylowych. Tłuszcze zwierzęce w normalnych warunkach są zwykle stałe, ale łatwo się topią wraz ze wzrostem temperatury (masło, smalec itp.). Tłuszcze roślinne charakteryzują się stanem ciekłym (olej lniany, oliwkowy, sojowy). Zasadniczą różnicą w budowie tych dwóch grup, która wpływa na różnice we właściwościach fizycznych i chemicznych estrów, jest obecność lub brak wiązań wielokrotnych w reszcie kwasowej. Tłuszcze zwierzęce to glicerydy nienasyconych kwasów karboksylowych, a tłuszcze roślinne to kwasy nasycone.
Właściwości chemiczne
Estry reagują z nukleofilami, powodując podstawienie grupy alkoksylowej i acylację (lub alkilację) środka nukleofilowego. Jeśli w formuła strukturalna ester ma atom α-wodoru, wówczas możliwa jest kondensacja estrów.
1. Hydroliza. Możliwa jest hydroliza kwasowa i zasadowa, będąca reakcją odwrotną do estryfikacji. W pierwszym przypadku hydroliza jest odwracalna, a kwas pełni rolę katalizatora:
R-COO-R" + H2O<―>R-COO-H + R"-OH
Zasadowa hydroliza jest nieodwracalna i zwykle nazywana jest zmydlaniem, a sole sodowe i potasowe kwasów tłuszczowych karboksylowych nazywane są mydłami:
R-COO-R" + NaOH ―> R-COO-Na + R"-OΗ

2. Amonoliza. Amoniak może działać jako środek nukleofilowy:
R-COO-R" + NH 3 ―> R-СО-NH 2 + R"-OH
3. Transestryfikacja. Tę właściwość chemiczną estrów można również przypisać sposobom ich wytwarzania. Pod wpływem alkoholi w obecności H + lub OH - można zastąpić rodnik węglowodorowy związany z tlenem:
R-COO-R" + R""-OH ―> R-COO-R"" + R"-OH
4. Redukcja wodorem prowadzi do powstania cząsteczek dwóch różnych alkoholi:
R-СО-OR" + LiAlH 4 ―> R-СΗ 2 -ОХ + R"OH
5. Spalanie to kolejna typowa reakcja dla estrów:
2CΗ 3 -COO-CΗ 3 + 7O 2 = 6CO 2 + 6H 2 O
6. Uwodornienie. Jeżeli w łańcuchu węglowodorowym cząsteczki eteru występuje wiele wiązań, możliwe jest dodanie wzdłuż nich cząsteczek wodoru, co następuje w obecności platyny lub innych katalizatorów. Na przykład możliwe jest otrzymanie stałych uwodornionych tłuszczów (margaryny) z olejów.

Zastosowanie estrów
Estry i ich pochodne znajdują zastosowanie w różnych gałęziach przemysłu. Wiele z nich dobrze się rozpuszcza związki organiczne, stosowane są w przemyśle perfumeryjnym i spożywczym do produkcji polimerów i włókien poliestrowych.
Octan etylu. Stosowany jako rozpuszczalnik nitrocelulozy, octanu celulozy i innych polimerów, do produkcji i rozpuszczania lakierów. Ze względu na przyjemny zapach stosowany jest w przemyśle spożywczym i perfumeryjnym.
Octan butylu. Stosowany również jako rozpuszczalnik, ale także żywice poliestrowe.
Octan winylu (CH3-COO-CH=CH2). Stosowany jako baza polimerowa niezbędna przy przygotowaniu klejów, lakierów, włókien syntetycznych i folii.
Eter malonowy. Ze względu na swoje szczególne właściwości chemiczne ester ten jest szeroko stosowany w syntezie chemicznej do produkcji kwasów karboksylowych, związków heterocyklicznych i kwasów aminokarboksylowych.

Ftalany. Estry kwasu ftalowego stosuje się jako dodatki uplastyczniające do polimerów i kauczuków syntetycznych, ftalan dioktylu stosuje się także jako repelent.
Akrylan metylu i metakrylan metylu. Łatwo polimeryzują, tworząc tafle szkła organicznego, które są odporne na różne wpływy.