1. Σύμφωνα με τις ουσίες που πρέπει να ταυτοποιηθούν, πρέπει να αναφέρονται γνωστές ποιοτικές αντιδράσεις, αντιδραστήρια και χαρακτηριστικά αναγνώρισης.
Στην περίπτωσή μας, μπορούμε να χρησιμοποιήσουμε τις ακόλουθες αντιδράσεις:
| Όλες οι πρωτεΐνες r-my | Αντίδραση διουρίας | Cu(OH) 2 ↓ πρόσφατα κατατεθεί. | Μωβ δαχτυλίδι |
| Πρωτεΐνες με γεύση. αμινοξέα | Αντίδραση ξανθοπρωτεΐνης | Συμπ. HNO3, συζ. διάλυμα αμμωνίας, t° | Πορτοκαλί χρώση |
| Πρωτεΐνες και όλα τα αμινοξέα | Αντίδραση νινυδρίνης | Νινυδρίνη σε ακετόνη, t° | Χρώμα βιολετί (προλίνη – κίτρινο) |
| Αμινοξέα | Εκπαίδευση σύνθετες ενώσεις | Cu(OH) 2 ↓ πρόσφατα κατατεθεί. | Σκούρο μπλε χρωματισμός |
| Τυχόν υδατάνθρακες (μονο-, δι- και πολυσακχαρίτες) | Αντίδραση Molisch | Συμπ. H 2 SO 4, διάλυμα α-ναφθόλης | Σκούρο μωβ δαχτυλίδι στο όριο δύο στρώσεων |
| Μονοσακχαρίτες και δισακχαρίτες (οποιοιδήποτε) | Σχηματισμός σακχαριτών | Cu(OH) 2 ↓ πρόσφατα κατατεθεί. | Αραίωση ιζήματος, χρωματισμός μπλε αραβοσίτου |
| (μειώνοντας τους μονο- και δισακχαρίτες) | Αντίδραση Trommer ενός «χάλκινου καθρέφτη» Αντίδραση ενός «ασημένιου καθρέφτη» | Cu(OH) 2, t° πρόσφατα κατατεθειμένο. Ag 2 O, διάλυμα αμμωνίας, t° | Τούβλο-κόκκινο ίζημα Cu 2 O Ασήμι εναποτίθεται στα τοιχώματα του δοκιμαστικού σωλήνα |
2. Προτείνετε με τη μορφή διαγράμματος την πιο αποτελεσματική αλληλουχία για τον προσδιορισμό αυτών των ενώσεων.
3. Υποδείξτε τη διαδικασία αντίδρασης, τις συνθήκες και γράψτε την εξίσωση αντίδρασης που υποδεικνύει το χαρακτηριστικό γνώρισμα αναγνώρισης.
Ως προκαταρκτική δοκιμή για διαλυτές πρωτεΐνες, μπορείτε να χρησιμοποιήσετε αντιδραστήρια που προκαλούν μετουσίωση (δίπλωμα): θερμικά ή χημικά.
Κατά την επίλυση αυτού του προβλήματος, είναι δυνατές επιλογές ανάλυσης.
Επιλογή 1.Η ακολουθία για τον προσδιορισμό του περιεχομένου των φιαλών μπορεί να είναι η εξής:
1. Πραγματοποιούμε μια προκαταρκτική δοκιμή για την παρουσία πρωτεϊνών. Ζεσταίνουμε δείγματα από κάθε ένα από τα 4 μπουκάλια στη φλόγα μιας λάμπας αλκοόλης. Σε δοκιμαστικούς σωλήνες με διαλύματα πρωτεΐνης παρατηρείται μετουσίωση (η πρωτεΐνη πήζει και χάνει τη διαλυτότητα). Σε δοκιμαστικούς σωλήνες με δείγματα άλλων ουσιών, δεν παρατηρούνται αλλαγές.
2. Αναγνωρίζουμε τις πρωτεΐνες χρησιμοποιώντας τις διαφορές τους στη σύνθεση αμινοξέων. Πραγματοποιούμε αντίδραση ξανθοπρωτεΐνης με δείγματα πρωτεΐνης. Σε δοκιμαστικό σωλήνα με διάλυμα ασπραδιού αυγού διαλύεται το κίτρινο ίζημα που σχηματίστηκε αρχικά και εμφανίζεται ένα πορτοκαλί χρώμα, αφού το ασπράδι περιέχει αρωματικά οξέα (tyr, fen, tri). Η ζελατίνη δεν περιέχει αρωματικά αμινοξέα, το τεστ για την παρουσία τους θα είναι αρνητικό.
3. Ταυτοποιούμε το περιεχόμενο των φιαλών με γλυκόζη και αμινοξύ χρησιμοποιώντας την αντίδραση με νινυδρίνη. Ένα χαρακτηριστικό βιολετί χρώμα εμφανίζεται σε δοκιμαστικό σωλήνα που περιέχει γλυκίνη.
4. Επιβεβαιώστε την παρουσία γλυκόζης στο υπόλοιπο μπουκάλι. Η γλυκόζη είναι ένας αναγωγικός μονοσακχαρίτης, επομένως για να τον αναγνωρίσετε μπορείτε να χρησιμοποιήσετε είτε την αντίδραση "ασημένιο καθρέφτη" (όταν θερμαίνεται σε υδατόλουτρο, εμφανίζεται μια χαρακτηριστική επίστρωση ασημιού στα τοιχώματα του δοκιμαστικού σωλήνα) είτε την αντίδραση "χάλκινου καθρέφτη". (όταν θερμαίνεται στη φλόγα μιας λάμπας αλκοόλης, ένα χαρακτηριστικό ίζημα οξειδίου εμφανίζεται χάλκινο (Ι) τούβλο-κόκκινο χρώμα).
Επιλογή 2.
1. Προσδιορίζουμε εάν μια ένωση ανήκει στην ομάδα πρωτεϊνών χρησιμοποιώντας την αντίδραση διουρίας με πρόσφατα καταβυθισμένο υδροξείδιο του χαλκού (II). Ένας χαρακτηριστικός μωβ δακτύλιος εμφανίζεται σε δοκιμαστικούς σωλήνες που περιέχουν δείγματα διαλυμάτων πρωτεΐνης. Σε δοκιμαστικό σωλήνα με γλυκόζη, παρατηρείται επίσης η διάλυση ενός μπλε ιζήματος υδροξειδίου του χαλκού (II) και η εμφάνιση ενός μπλε χρώματος αραβοσίτου λόγω του σχηματισμού μιας πολύπλοκης ένωσης - χαλκού σακχαρόζης - σε δοκιμαστικό σωλήνα με αμινο οξύ, εμφανίζεται ένα σκούρο μπλε χρώμα λόγω του σχηματισμού μιας σύνθετης ένωσης - γλυκινικού χαλκού.
2. Επιβεβαιώστε την παρουσία γλυκόζης. Ζεσταίνουμε και τους δύο δοκιμαστικούς σωλήνες στη φλόγα μιας λάμπας αλκοόλης. Σε δοκιμαστικό σωλήνα με γλυκόζη, σχηματίζεται ένα χαρακτηριστικό τούβλο-κόκκινο ίζημα οξειδίου του χαλκού (II), αφού η γλυκόζη ανήκει στην ομάδα των αναγωγικών μονοσακχαριτών.
3. Αναγνωρίζουμε τις πρωτεΐνες χρησιμοποιώντας τις διαφορές τους στη σύνθεση αμινοξέων. Πραγματοποιούμε μια αντίδραση ξανθοπρωτεΐνης με νέα δείγματα πρωτεϊνικών διαλυμάτων (βλ. έκδοση 1).
Για να προσδιορίσετε με μεγαλύτερη ακρίβεια το αμινοξύ, μπορείτε να πάρετε ένα νέο δείγμα και να εκτελέσετε μια αντίδραση με ένα διάλυμα νινυδρίνης.
Δεν μπορούν να αποκλειστούν άλλες επιλογές που διαφέρουν ως προς την αλληλουχία των αντιδράσεων και των αντιδραστηρίων.
Οδηγίες για εκπαιδευτικούς
2. Ερωτήσεις σχετικά με τη χημεία για την προετοιμασία για το σεμινάριο πρέπει να δίνονται στους μαθητές το αργότερο δύο εβδομάδες πριν από το μάθημα.
4. Ο δάσκαλος χημείας παρέχει κίνητρα για το μάθημα, εξετάζει τη σύνθεση και τις ιδιότητες των πρωτεϊνών. Ένας καθηγητής βιολογίας γενικεύει και ενημερώνει τις γνώσεις σχετικά με τη δομή των μορίων πρωτεΐνης, τις λειτουργίες και τις εφαρμογές τους.
5. Στο τέλος του μαθήματος, οι δάσκαλοι αξιολογούν τη δουλειά των μαθητών σε αυτό το μάθημα. Εξοπλισμός:ταινίες κωδικού, προβολέας εναέριας επιφάνειας, οθόνη, προβολέας οροφής, διαφάνειες, χημικά, πίνακας επίδειξης, πίνακες.
Σχέδιο μαθήματος (γραμμένο στον πίνακα)
1. Σύνθεση και δομή πρωτεΐνης.
2. Ιδιότητες πρωτεΐνης (μετουσίωσης, μετουσίωση, υδρόλυση, χρωματικές αντιδράσεις).
3. Λειτουργίες της πρωτεΐνης και η σύνθεσή της στο κύτταρο.
4. Εφαρμογή πρωτεΐνης, τεχνητή σύνθεση πεπτιδίων.
Καθηγητής Χημείας.Σήμερα διεξάγουμε ένα ασυνήθιστο μάθημα - καλύπτει τα προβλήματα της χημείας και της βιολογίας ταυτόχρονα. Σκοπός του μαθήματός μας είναι η συστηματοποίηση και εμβάθυνση της γνώσης στο θέμα «Πρωτεΐνη». Δίνουμε ιδιαίτερη προσοχή στη μελέτη των πρωτεϊνών, γιατί οι πρωτεΐνες είναι οι κύριες αναπόσπαστο μέροςόλης της ζωής στη Γη. Θυμηθείτε τη δήλωση του F. Engels για το τι είναι η ζωή: «Όπου και αν συναντάμε τη ζωή, διαπιστώνουμε ότι συνδέεται με κάποιο είδος πρωτεϊνικού σώματος, και όπου βρίσκουμε οποιοδήποτε πρωτεϊνικό σώμα που δεν βρίσκεται σε διαδικασία αποσύνθεσης, εμείς, χωρίς εξαίρεση , συναντούν τα φαινόμενα της ζωής. Η ζωή είναι ένας τρόπος ύπαρξης πρωτεϊνικών σωμάτων». Καμία ουσία δεν εκτελεί τόσο συγκεκριμένες και ποικίλες λειτουργίες στο σώμα όσο η πρωτεΐνη.
Ας θυμηθούμε ποιες ενώσεις ονομάζονται πρωτεΐνες. ( Φυσικά πολυμερή των οποίων τα μονομερή είναι αμινοξέα.)
Η μελέτη ποιας διαδικασίας βοήθησε στη δημιουργία της δομής των πρωτεϊνών; ( Μελέτη υδρόλυσης πρωτεϊνών.)
Ποια διαδικασία ονομάζεται υδρόλυση;
Ποιες ενώσεις σχηματίζονται κατά την υδρόλυση των πρωτεϊνών;
Ποιες ενώσεις ονομάζονται αμινοξέα;
Πόσα αμινοξέα είναι γνωστά στη φύση;
Πόσα αμινοξέα βρίσκονται στις πρωτεΐνες;
Ένας δάσκαλος χημείας επιδεικνύει μια ταινία κώδικα.

Καθηγητής Χημείας.Δώστε προσοχή στη θέση της αμινομάδας στα αμινοξέα. Σύμφωνα με τη θέση της αμινομάδας, τα αμινοξέα που αποτελούν τις πρωτεΐνες ονομάζονται α-αμινοξέα. Ο γενικός τύπος οποιουδήποτε από αυτά τα αμινοξέα μπορεί να γραφτεί ως εξής:
Στο φιλμ κώδικα βλέπετε δύο αμινοξέα, το ένα από τα οποία περιέχει δύο καρβοξυλομάδες - COOH, το άλλο - δύο αμινο ομάδες - NH2. Τέτοια οξέα ονομάζονται αμινοδικαρβοξυλικά ή διαμινοκαρβοξυλικά οξέα, αντίστοιχα.
Από το μάθημα της χημείας σας γνωρίζετε για οπτικά ισομερή φυσικών ενώσεων. Σχεδόν όλες οι πρωτεΐνες περιέχουν μόνο L-αμινοξέα.
Τα αμινοξέα είναι μονομερή πρωτεϊνών. Μπορούν να συνδεθούν μεταξύ τους μέσω ενός δεσμού αμιδίου (πεπτιδίου), ο οποίος σχηματίζεται με την απελευθέρωση νερού - αυτή είναι μια αντίδραση συμπύκνωσης.
Ας δημιουργήσουμε μια εξίσωση για την αντίδραση μεταξύ των αμινοξέων γλυκίνη και αλανίνη.
(Οι μαθητές εργάζονται ανεξάρτητα και στη συνέχεια συγκρίνουν τα αποτελέσματά τους με τη γραφή στον πίνακα ή την ταινία.)
Η δομή που προκύπτει ονομάζεται διπεπτίδιο. Ένα πολυμερές πολλών αμινοξέων ονομάζεται πολυπεπτίδιο.
Καθηγητής Βιολογίας.Ας συνεχίσουμε να μελετάμε τις ιδιότητες των πρωτεϊνών, αλλά πρώτα θα απαντήσουμε στις ακόλουθες ερωτήσεις.
1. Πώς μπορούμε να εξηγήσουμε την ποικιλομορφία των πρωτεϊνών που υπάρχει στη φύση; ( Διαφορές στη σύνθεση των αμινοξέων και τη διαφορετική αλληλουχία τους στην πολυπεπτιδική αλυσίδα.)
2. Ποια είναι τα επίπεδα οργάνωσης ενός μορίου πρωτεΐνης; ( Πρωτογενής – αλληλουχία αμινοξέων; δευτερεύον -ένα -σπείρα ήσι - διπλωμένη δομή τμημάτων αλυσίδας. τριτογενής - η χωρική δομή της πρωτεΐνης, που σχηματίζεται λόγω της αλληλεπίδρασης των υπολειμμάτων αμινοξέων απομακρυσμένων τμημάτων της αλυσίδας: ένα σφαιρίδιο για σφαιρικές πρωτεΐνες, μια νηματοειδής δομή για τις ινιδιακές πρωτεΐνες. τεταρτοταγές - η ένωση δύο ή περισσότερων ξεχωριστών πρωτεϊνικών μορίων.)
3. Τι τύπος δεσμού εμφανίζεται μεταξύ αμινοξέων στην πρωτογενή δομή; Ποιο είναι το άλλο όνομα για αυτή τη σύνδεση; ( Ομοιοπολικό δεσμό. Αμιδικός ή πεπτιδικός δεσμός.)
4. Ποιοι δεσμοί παρέχουν κυρίως τη δευτερογενή δομή ενός μορίου πρωτεΐνης; ( Δεσμοί υδρογόνου, δισουλφυδρυλικές γέφυρες.)
5. Ποιες συνδέσεις παρέχουν τριτογενή δομή; ( Δεσμοί υδρογόνου, υδρόφοβες και ιοντικές αλληλεπιδράσεις.)
6. Ποιοι δεσμοί παρέχουν την τεταρτοταγή δομή ενός μορίου πρωτεΐνης; ( Ηλεκτροστατικές, υδρόφοβες και ιοντικές αλληλεπιδράσεις.)
7. Δώστε ένα παράδειγμα μιας γνωστής σε εσάς πρωτεΐνης που έχει τεταρτοταγή δομή. ( ΑΤΡάση, αιμοσφαιρίνη.)
Τώρα ας λύσουμε το παρακάτω πρόβλημα ( η κατάσταση της εργασίας προβάλλεται μέσω ενός προβολέα πάνω από το κεφάλι, εμφανίζεται μια διαφάνεια με επιχρίσματα αίματος ενός υγιούς ατόμου και ενός ασθενούς με δρεπανοκυτταρική αναιμία).
Η ασθένεια δρεπανοκυτταρική αναιμία συνοδεύεται από την αντικατάσταση του υπολείμματος αμινοξέος γλουταμινικό οξύ στην πολυπεπτιδική αλυσίδα του μορίου της αιμοσφαιρίνης με ένα υπόλειμμα βαλίνης. Θραύσμα της αλυσίδας της φυσιολογικής αιμοσφαιρίνης: - glu–glu–Liz–. Θραύσμα μιας μη φυσιολογικής αλυσίδας αιμοσφαιρίνης: - άξονας–glu–Liz–
(glu– γλουταμικό οξύ; Liz- λυσίνη; άξονας– βαλίνη). Σχεδιάστε αυτά τα θραύσματα ως χημικούς τύπους.
Λύση.
Θραύσμα μιας αλυσίδας φυσιολογικής αιμοσφαιρίνης:
Θραύσμα μιας μη φυσιολογικής αλυσίδας αιμοσφαιρίνης:
Από το παραπάνω παράδειγμα προκύπτει ότι η πρωτογενής δομή ενός μορίου πρωτεΐνης μπορεί να καθορίσει όλα τα επόμενα επίπεδα οργάνωσής του. Αλλαγές στη δομική οργάνωση μιας πρωτεΐνης μπορεί να διαταράξουν τις λειτουργίες της, γεγονός που σε ορισμένες περιπτώσεις οδηγεί στην ανάπτυξη παθολογίας - ασθένειας.
Η δομή μιας πρωτεΐνης το καθορίζει φυσικοχημικά χαρακτηριστικά, για παράδειγμα, διαλυτότητα.
Ένας δάσκαλος χημείας επιδεικνύει μια ταινία κώδικα.
Ταξινόμηση πρωτεϊνών ανάλογα με τη διαλυτότητά τους

Καθηγητής Χημείας.Για να διατηρήσουν τη λειτουργική τους δραστηριότητα, οι πρωτεΐνες πρέπει να έχουν μια φυσική (εγγενή) δομική οργάνωση σε όλα τα επίπεδα.
Οι διαταραχές στην πρωτογενή οργάνωση, που οδηγούν στη ρήξη του αμιδικού δεσμού με την προσθήκη ενός μορίου νερού, ονομάζονται υδρόλυση πρωτεΐνης. Με την πλήρη υδρόλυση, η πρωτεΐνη διασπάται στα αμινοξέα που την αποτελούν.
Παραβίαση δευτεροβάθμιας και τριτοβάθμιας δομή πρωτεΐνης, δηλ. η απώλεια της φυσικής της δομής ονομάζεται μετουσίωση πρωτεΐνης.
Προκαλείται μετουσίωση της πρωτεΐνης διάφορους παράγοντες: σημαντικές αλλαγές στη θερμοκρασία, αύξηση και μείωση του pH του περιβάλλοντος, έκθεση σε ιόντα βαρέων μετάλλων, ορισμένες χημικές ενώσειςγια παράδειγμα, φαινόλες.
Ένας δάσκαλος χημείας επιδεικνύει πειράματα.
Εμπειρία 1.Πρωτεΐνη + θερμότητα -->
Εμπειρία 2. Πρωτεΐνη + φαινόλη --> μετουσίωση (κατακρήμνιση).
Εμπειρία 3.Πρωτεΐνη + Pb ή CH 3 COOH --> μετουσίωση (κατακρήμνιση).
Εμπειρία 4.Πρωτεΐνη + CuSO4 --> μετουσίωση (κατακρήμνιση).
Καθηγητής Βιολογίας.Η μετουσίωση συμβαίνει ως αποτέλεσμα της καταστροφής του υδρογόνου και του δισουλφιδίου ομοιοπολικούς δεσμούς(όχι όμως πεπτιδικοί δεσμοί, ιοντικές και υδρόφοβες αλληλεπιδράσεις), που διασφαλίζουν το σχηματισμό και τη διατήρηση των δευτερογενών και τριτογενών δομών της πρωτεΐνης. Σε αυτή την περίπτωση, η πρωτεΐνη χάνει τις εγγενείς βιολογικές της ιδιότητες.
Οι αντιδράσεις που χρησιμοποιούνται για τον προσδιορισμό της σύνθεσης μιας ουσίας ονομάζονται ποιοτικές.
Ποιες είναι οι ποιοτικές αντιδράσεις στην πρωτεΐνη;
Ένας δάσκαλος χημείας επιδεικνύει τα ακόλουθα πειράματα.
Εμπειρία 1.Αντίδραση ξανθοπρωτεΐνης (νιτροποίηση δακτυλίων βενζολίου αρωματικών αμινοξέων πρωτεΐνης):
πρωτεΐνη (ψύχεται) + ΗΝΟ 3 (συμπ.) + θερμότητα --> κίτρινο χρώμα
Εμπειρία 2.Αντίδραση διουρίας (σας επιτρέπει να προσδιορίσετε τον αριθμό των πεπτιδικών δεσμών):
πρωτεΐνη + CuSO 4
+ NaOH --> ιώδες χρώμα (η ουρία δίνει αυτή την αντίδραση).
CuSO 4
+ NaOH --> Cu(OH) 2
+Να 2
ΕΤΣΙ 4
;
πρωτεΐνη + Cu(OH) 2
--> βιολετί χρωματισμός.
Είναι δυνατόν να αναγνωρίσουμε τη γλυκερίνη, την πρωτεΐνη και τη γλυκόζη χρησιμοποιώντας ένα αντιδραστήριο; Μπορώ! Αυτό το αντιδραστήριο είναι υδροξείδιο του χαλκού, δίνει διαφορετικά χρώματα στα διαλύματα αυτών των ουσιών:
α) γλυκερίνη + Cu(OH) 2
--> φωτεινό μπλε λύση?
β) γλυκόζη + Cu(OH) 2
+ θέρμανση --> κόκκινο ίζημα;
γ) πρωτεΐνη + Cu(OH) 2
--> βιολετί χρωματισμός.
Καθηγητής Βιολογίας.Ονομάστε τις λειτουργίες των πολυπεπτιδίων που γνωρίζετε. ( Κατασκευή Τα πολυπεπτίδια αποτελούν μέρος των κυτταρικών τοιχωμάτων μυκήτων και μικροοργανισμών και συμμετέχουν στην κατασκευή μεμβρανών. Τα μαλλιά, τα νύχια και τα νύχια αποτελούνται από πρωτεΐνη κερατίνης. Η πρωτεΐνη κολλαγόνου είναι η βάση των τενόντων και των συνδέσμων. Μια άλλη σημαντική λειτουργία της πρωτεΐνης είναι η ενζυματική, καταλυτική.
Οι πρωτεΐνες παρέχουν επίσης όλους τους τύπους βιολογικής κινητικότητας. Επιπλέον, οι πρωτεΐνες εκτελούν μεταφορικές, ορμονικές ή ρυθμιστικές, υποδοχείς, αιμοστατικές, τοξικογενείς, προστατευτικές και ενεργειακές λειτουργίες.)
Ορίστε τα ένζυμα. ( Τα ένζυμα είναι πρωτεΐνες που έχουν καταλυτική δράση, δηλ. επιταχυνόμενες αντιδράσεις.)
Όλα τα ένζυμα είναι εξαιρετικά ειδικά για το υπόστρωμά τους και, κατά κανόνα, καταλύουν μόνο μία πολύ συγκεκριμένη αντίδραση. Δείτε τη διαγραμματική αναπαράσταση της δομής ενός ενζύμου. ( Ένας καθηγητής βιολογίας επιδεικνύει μια ταινία κώδικα με μια σχηματική αναπαράσταση ενός ενζύμου.) Κάθε ένζυμο έχει μια ενεργή θέση στην οποία λαμβάνει χώρα ο χημικός μετασχηματισμός του υποστρώματος της αντίδρασης. Μερικές φορές μπορεί να υπάρχουν πολλές θέσεις δέσμευσης υποστρώματος. Η δομή της θέσης πρόσδεσης είναι συμπληρωματική προς τη δομή του υποστρώματος, δηλ. ταιριάζουν μεταξύ τους «όπως ένα κλειδί ταιριάζει σε μια κλειδαριά».
Το έργο των ενζύμων επηρεάζεται από πολλούς παράγοντες: pH, θερμοκρασία, ιοντικό σύνθεση του περιβάλλοντος, παρουσία μικρού οργανικά μόρια, που συνδέονται με το ένζυμο ή αποτελούν μέρος της δομής του και αλλιώς ονομάζονται συμπαράγοντες (συνένζυμα). Ορισμένες βιταμίνες, όπως η πυριδοξίνη (Β 6
) και κοβαλαμίνη (Β 12
).
Ο καθηγητής βιολογίας παρουσιάζει τους μαθητές στο Πρακτική εφαρμογηένζυμα.
Κλινική σημασία των ενζύμων
1. Οι ασθένειες που προκαλούνται από ανεπάρκεια ενζύμων είναι ευρέως γνωστές. Παραδείγματα: δυσπεψία του γάλακτος (χωρίς ένζυμο λακτάση). υποβιταμίνωση (ανεπάρκεια βιταμινών) – η έλλειψη συνενζύμων μειώνει τη δραστηριότητα των ενζύμων (η υποβιταμίνωση της βιταμίνης Β1 οδηγεί σε ασθένεια beriberi). φαινυλκετονουρία (που προκαλείται από παραβίαση της ενζυμικής μετατροπής του αμινοξέος φαινυλαλανίνη σε τυροσίνη).
2. Προσδιορισμός της ενζυμικής δραστηριότητας σε βιολογικά υγρά έχει μεγάλης σημασίαςγια τη διάγνωση ασθενειών. Για παράδειγμα, η ιογενής ηπατίτιδα καθορίζεται από τη δραστηριότητα των ενζύμων στο πλάσμα του αίματος.
3. Τα ένζυμα χρησιμοποιούνται ως αντιδραστήρια στη διάγνωση ορισμένων ασθενειών.
4. Τα ένζυμα χρησιμοποιούνται για τη θεραπεία ορισμένων ασθενειών. Παραδείγματα μερικών φαρμάκων που βασίζονται σε ένζυμα: παγκρεατίνη, festal, λιδάση.
Χρήση ενζύμων στη βιομηχανία
1. Β Βιομηχανία τροφίμωνΤα ένζυμα χρησιμοποιούνται στην παρασκευή αναψυκτικών, τυριών, κονσερβοποιημένων τροφίμων, λουκάνικων και καπνιστών κρεάτων.
2. Στην κτηνοτροφία χρησιμοποιούνται ένζυμα για την παρασκευή των ζωοτροφών.
3. Στην παραγωγή φωτογραφικού υλικού χρησιμοποιούνται ένζυμα.
4. Τα ένζυμα χρησιμοποιούνται στην επεξεργασία του λιναριού και της κάνναβης.
5. Τα ένζυμα χρησιμοποιούνται για να μαλακώσουν το δέρμα στη βιομηχανία δέρματος.
6. Τα ένζυμα αποτελούν μέρος των σκονών πλυσίματος.
Καθηγητής Βιολογίας.Ας δούμε άλλες λειτουργίες των πρωτεϊνών. Οι κινητικές λειτουργίες εκτελούνται από ειδικές συσταλτικές πρωτεΐνες, οι οποίες περιλαμβάνουν, για παράδειγμα, την ακτίνη και τη μυοσίνη, που αποτελούν μέρος των μυϊκών ινών.
Μια άλλη σημαντική λειτουργία των πρωτεϊνών είναι η μεταφορά. Οι πρωτεΐνες, για παράδειγμα, μεταφέρουν ιόντα καλίου, αμινοξέα, σάκχαρα και άλλες ενώσεις μέσω της κυτταρικής μεμβράνης μέσα στο κύτταρο. Οι πρωτεΐνες είναι επίσης διάμεσοι φορείς.
Ρυθμίζοντας το μεταβολισμό μέσα στα κύτταρα και μεταξύ των κυττάρων και των ιστών ολόκληρου του σώματος, οι πρωτεΐνες εκτελούν μια ορμονική ή ρυθμιστική λειτουργία. Για παράδειγμα, η ορμόνη ινσουλίνη εμπλέκεται στη ρύθμιση του μεταβολισμού τόσο των πρωτεϊνών όσο και του λίπους.
Στην επιφάνεια των κυτταρικών μεμβρανών υπάρχουν υποδοχείς πρωτεΐνης που δεσμεύουν επιλεκτικά ορμόνες και μεσολαβητές, εκτελώντας έτσι μια λειτουργία υποδοχέα.
Η ομοιοστατική λειτουργία των πρωτεϊνών είναι ο σχηματισμός θρόμβου κατά τη διακοπή της αιμορραγίας.
Ορισμένες πρωτεΐνες και πεπτίδια που απελευθερώνονται από οργανισμούς, όπως παθογόνα ή ορισμένα δηλητηριώδη ζώα, είναι τοξικά για άλλους ζωντανούς οργανισμούς - αυτή είναι η τοξικογόνος λειτουργία των πρωτεϊνών.
Η προστατευτική λειτουργία των πρωτεϊνών είναι πολύ σημαντική. Τα αντισώματα είναι πρωτεΐνες που παράγονται από το ανοσοποιητικό σύστημα του σώματος όταν εισβάλλει μια ξένη πρωτεΐνη, βακτήρια ή ιό. Αναγνωρίζουν τον «άγνωστο» και συμμετέχουν στην καταστροφή του.
Οι πρωτεΐνες που χρησιμεύουν ως ενεργειακό απόθεμα περιλαμβάνουν, για παράδειγμα, την καζεΐνη, την κύρια πρωτεΐνη του γάλακτος.
Απάντησε τις παρακάτω ερωτήσεις.
2. Τι προκαλεί την απόρριψη μεταμοσχευμένων οργάνων και ιστών στους ασθενείς; ( Τα αντισώματα, επιτελώντας προστατευτική λειτουργία, αναγνωρίζουν την ξένη πρωτεΐνη των μεταμοσχευμένων οργάνων και προκαλούν αντιδράσεις απόρριψής της.)
3. Γιατί τα βραστά αυγά δεν βγάζουν ποτέ κοτόπουλο; ( Τα ασπράδια αυγών έχουν χάσει αμετάκλητα τη φυσική τους δομή λόγω της θερμικής μετουσίωσης.)
4. Γιατί μειώνεται το βάρος του κρέατος και του ψαριού μετά το μαγείρεμα; ( Κατά τη θερμική επεξεργασία, λαμβάνει χώρα μετουσίωση πρωτεϊνών κρέατος ή ψαριού. Οι πρωτεΐνες γίνονται πρακτικά αδιάλυτες στο νερό και εγκαταλείπουν σημαντικό μέρος του νερού που περιέχουν, ενώ το βάρος του κρέατος μειώνεται κατά 20-40%.)
5. Τι δείχνει ο σχηματισμός «νιφάδων» ή θόλωση του ζωμού κατά το μαγείρεμα του κρέατος; ( Εάν το κρέας βυθιστεί σε κρύο νερό και θερμανθεί, οι διαλυτές πρωτεΐνες από τα εξωτερικά στρώματα του κρέατος μεταφέρονται στο νερό. Κατά το μαγείρεμα, μετουσιώνονται, με αποτέλεσμα να σχηματίζονται νιφάδες, αφρός που επιπλέει στην επιφάνεια του νερού ή ένα λεπτό εναιώρημα που κάνει το διάλυμα θολό.)
Ολα μόρια πρωτεΐνηςέχουν πεπερασμένη διάρκεια ζωής - καταστρέφονται με την πάροδο του χρόνου. Ως εκ τούτου, οι πρωτεΐνες ανανεώνονται συνεχώς στο σώμα. Από αυτή την άποψη, ας θυμηθούμε τα βασικά της βιοσύνθεσης πρωτεϊνών. Απάντησε τις παρακάτω ερωτήσεις.
1. Πού γίνεται η πρωτεϊνοσύνθεση στο κύτταρο; ( Στα ριβοσώματα.)
2. Σε τι κυτταρικό οργανίδιοαποθηκεύονται πληροφορίες σχετικά με την πρωτογενή δομή της πρωτεΐνης. ( Στα χρωμοσώματα, ο φορέας πληροφοριών είναι το DNA.)
3. Τι σημαίνει ο όρος «γονίδιο»; ( Αλληλουχία νουκλεοτιδίων που κωδικοποιεί τη σύνθεση μιας πρωτεΐνης.)
4. Ποια ονομάζονται τα κύρια στάδια της βιοσύνθεσης πρωτεϊνών; ( Μεταγραφή, μετάδοση.)
5. Από τι αποτελείται η μεταγραφή; ( Αυτό είναι η ανάγνωση πληροφοριών από το DNA με τη σύνθεση αγγελιοφόρου RNA που είναι συμπληρωματικό της περιοχής DNA που διαβάζεται.)
6. Σε ποιο σημείο του κυττάρου γίνεται η μεταγραφή; ( Στον πυρήνα.)
7. Από τι αποτελείται η εκπομπή; ( Αυτή είναι η σύνθεση πρωτεΐνης από αμινοξέα στην αλληλουχία που καταγράφεται στο mRNA. συμβαίνει με τη συμμετοχή μεταφορικών tRNA που παραδίδουν τα αντίστοιχα αμινοξέα στο ριβόσωμα.)
8. Σε ποιο σημείο του κελιού γίνεται η μετάφραση; ( Στο κυτταρόπλασμα, στα ριβοσώματα, στα μιτοχόνδρια.)
Η βιοσύνθεση πρωτεϊνών συμβαίνει στο σώμα καθ 'όλη τη διάρκεια της ζωής, πιο εντατικά στην παιδική ηλικία. Η ένταση της πρωτεϊνικής σύνθεσης σε ορισμένες περιπτώσεις μπορεί να ρυθμιστεί. Η δράση πολλών αντιβιοτικών βασίζεται στην καταστολή της πρωτεϊνικής σύνθεσης, συμπεριλαμβανομένων των βακτηρίων που προκαλούν την ασθένεια. Για παράδειγμα, το αντιβιοτικό τετρακυκλίνη εμποδίζει το tRNA να συνδεθεί με τα ριβοσώματα.
Ας ακούσουμε σύντομα μηνύματασχετικά με τα πρωτεϊνικά σκευάσματα που χρησιμοποιούνται στη σύγχρονη ιατρική.
Αντιισταμινικά
Ο σύγχρονος έντονος ρυθμός της ζωής συνοδεύεται από αύξηση του αριθμού των ασθενειών, όπως το έμφραγμα, η υπέρταση, η παχυσαρκία και κάθε είδους αλλεργίες. Η αλλεργία είναι η υπερβολική ευαισθησία του οργανισμού σε συγκεκριμένους εξωτερικούς ερεθιστικούς παράγοντες. Όλες αυτές οι ασθένειες χαρακτηρίζονται από αυξημένα επίπεδα ισταμίνης στο αίμα. Οι ισταμίνες είναι ουσίες που σχηματίζονται με αποκαρβοξυλίωση του αμινοξέος ιστιδίνη. Τα αντιισταμινικά παρεμβαίνουν σε αυτή την αντίδραση και τα επίπεδα ισταμίνης μειώνονται.
Ιντερφερόνη
Στη διαδικασία της εξέλιξης, στην καταπολέμηση των ιών, τα ζώα έχουν αναπτύξει έναν μηχανισμό για τη σύνθεση της προστατευτικής πρωτεΐνης ιντερφερόνης. Το πρόγραμμα για τον σχηματισμό ιντερφερόνης, όπως κάθε πρωτεΐνη, κωδικοποιείται στο DNA στον πυρήνα του κυττάρου και ενεργοποιείται αφού τα κύτταρα μολυνθούν με ιό. Η ψύξη, το νευρικό σοκ και η έλλειψη βιταμινών στα τρόφιμα οδηγούν σε μείωση της ικανότητας παραγωγής ιντερφερόνης. Επί του παρόντος, το παρασκεύασμα ιντερφερόνης για ιατρικούς σκοπούς παράγεται από λευκοκύτταρα αίματος δότη ή χρήση γενετική μηχανική. Η ιντερφερόνη χρησιμοποιείται για την πρόληψη και τη θεραπεία ιογενών λοιμώξεων - γρίπης, έρπητα, καθώς και για κακοήθη νεοπλάσματα.
Ινσουλίνη
Η ινσουλίνη είναι μια πρωτεΐνη που αποτελείται από 51 αμινοξέα. Απελευθερώνεται ως απόκριση στα αυξημένα επίπεδα γλυκόζης στο αίμα. Η ινσουλίνη ελέγχει τον μεταβολισμό των υδατανθράκων και προκαλεί τα ακόλουθα αποτελέσματα:
– αύξηση του ρυθμού μετατροπής της γλυκόζης σε γλυκογόνο.
– επιτάχυνση της μεταφοράς γλυκόζης μέσω των κυτταρικών μεμβρανών στους μύες και τον λιπώδη ιστό.
– αυξημένη σύνθεση πρωτεϊνών και λιπιδίων.
– αύξηση του ρυθμού σύνθεσης ATP, DNA και RNA.
Η ινσουλίνη είναι απαραίτητη για τη ζωή, γιατί είναι η μόνη ορμόνη που μειώνει τη συγκέντρωση της γλυκόζης στο αίμα. Η ανεπαρκής έκκριση ινσουλίνης οδηγεί σε μια μεταβολική διαταραχή γνωστή ως σακχαρώδης διαβήτης. Τα σκευάσματα ινσουλίνης λαμβάνονται από το πάγκρεας των βοοειδών ή μέσω γενετικής μηχανικής.
Καθηγητής Χημείας.Η ινσουλίνη ήταν η πρώτη πρωτεΐνη της οποίας η πρωταρχική δομή αποκρυπτογραφήθηκε. Χρειάστηκαν σχεδόν 10 χρόνια για να καθοριστεί η αλληλουχία των αμινοξέων στην ινσουλίνη. Επί του παρόντος, η πρωτογενής δομή ενός πολύ μεγάλου αριθμού πρωτεϊνών, συμπεριλαμβανομένων εκείνων μιας πολύ πιο σύνθετης δομής, έχει αποκρυπτογραφηθεί.
Η σύνθεση πρωτεϊνικών ουσιών πραγματοποιήθηκε αρχικά χρησιμοποιώντας το παράδειγμα δύο ορμονών της υπόφυσης (βασοπρεσσίνης και ωκυτοκίνης).
Τέλος, οι δάσκαλοι βαθμολογούν τους μαθητές για την εργασία τους στο μάθημα της χημείας και της βιολογίας.
Η σημασία των χρωματικών αντιδράσεων είναι ότι καθιστούν δυνατή την ανίχνευση της παρουσίας πρωτεΐνης σε βιολογικά υγρά, διαλύματα και τον καθορισμό της σύνθεσης αμινοξέων διαφόρων φυσικών πρωτεϊνών. Αυτές οι αντιδράσεις χρησιμοποιούνται τόσο για ποιοτικό όσο και για ποσοτικό προσδιορισμό της πρωτεΐνης και των αμινοξέων που περιέχει. Ορισμένες αντιδράσεις είναι εγγενείς όχι μόνο σε πρωτεΐνες, αλλά και σε άλλες ουσίες, για παράδειγμα, η φαινόλη, όπως η τυροσίνη, δίνει ένα ροζ-κόκκινο χρώμα με το αντιδραστήριο Millon, επομένως η διεξαγωγή μιας αντίδρασης δεν αρκεί για τον προσδιορισμό της παρουσίας μιας πρωτεΐνης.
Υπάρχουν δύο τύποι χρωματικών αντιδράσεων: 1) καθολική - διουρητική (για όλες τις πρωτεΐνες) και νινυδρίνη (για όλες ΕΝΑ-αμινοξέα και πρωτεΐνες). 2) ειδικό - μόνο για ορισμένα αμινοξέα τόσο στο μόριο της πρωτεΐνης όσο και σε διαλύματα μεμονωμένων αμινοξέων, για παράδειγμα, η αντίδραση Foll (για αμινοξέα που περιέχουν ασθενώς δεσμευμένο θείο), η αντίδραση Millon (για τυροσίνη), η αντίδραση Sakaguchi ( για αργινίνη) κ.λπ.
Κατά τη διεξαγωγή χρωματικών αντιδράσεων για πρωτεΐνες και αμινοξέα, πρέπει πρώτα να συντάξετε τον ακόλουθο πίνακα:
Χρωματικές αντιδράσεις σε πρωτεΐνες (ποιοτικές αντιδράσεις)
Αντιδράσεις χρώματος σε πρωτεΐνες Πείραμα 1. Αντίδραση διουρίας.
Αντίδραση διουρίας– Ποιότητα για όλα ανεξαιρέτως σκίουροι, καθώς και προϊόντα των ελλιπών τους υδρόλυση, τα οποία περιέχουν τουλάχιστον δύο πεπτιδικούς δεσμούς.
Αρχή της μεθόδου. Η αντίδραση διουρίας προκαλείται από την παρουσία σε πρωτεΐνες πεπτιδικών δεσμών (- CO – NH -), οι οποίοι σε αλκαλικό περιβάλλον σχηματίζουν άλατα χαλκού κόκκινου-ιώδους χρώματος με θειικό χαλκό (II). συγκροτήματα. Η αντίδραση διουρίας παράγεται επίσης από ορισμένες μη πρωτεϊνικές ουσίες, για παράδειγμα διουρία(NH 2 -CO-NH-CO-NH 2), οξαμίδιο(NH 2 CO-CO-NH 2), σειρά αμινοξέα (ιστιδίνη, σερίνη, θρεονίνη, ασπαραγίνη).
Αντίδραση διουρίας με γλυκίνη
Η σειρά εργασίας.
Ένας ίσος όγκος διαλύματος 10% προστίθεται σε 1 ml του δοκιμαστικού διαλύματος πρωτεΐνης 1%. υδροξείδιο του νατρίου(NaOH) αλκάλι και μετά 2-3 σταγόνες διαλύματος 1%. θειικός χαλκός(CuSO 4). αραιωμένο, σχεδόν άχρωμο διάλυμα θειικού χαλκού.
Εάν η αντίδραση είναι θετική, εμφανίζεται ένα μωβ χρώμα με κόκκινη ή μπλε απόχρωση.
Εμπειρία 2.Αντίδρασηστο «ασθενώς δεσμευμένο θείο».
Αρχή της μεθόδου. Αυτή είναι μια αντίδραση στην κυστεΐνη και την κυστίνη. Κατά την αλκαλική υδρόλυση, το «ασθενώς δεσμευμένο θείο» στην κυστεΐνη και την κυστίνη διασπάται αρκετά εύκολα, με αποτέλεσμα το σχηματισμό υδρόθειου, το οποίο, αντιδρώντας με αλκάλια, παράγει θειούχα νάτριο ή κάλιο. Όταν προστίθεται οξικός μόλυβδος (II), σχηματίζεται ένα γκριζόμαυρο ίζημα θειούχου μολύβδου (II).
Η σειρά εργασίας.
1 ml μη αραιωμένης πρωτεΐνης κοτόπουλου χύνεται σε δοκιμαστικό σωλήνα, προστίθενται 2 ml διαλύματος υδροξειδίου του νατρίου 20%. Το μείγμα βράζεται προσεκτικά (για να μην πεταχτεί το μείγμα).
Σε αυτήν την περίπτωση, απελευθερώνεται αμμωνία, η οποία ανιχνεύεται από το μπλε του υγρού χαρτιού λακκούβας που φέρεται στο άνοιγμα του δοκιμαστικού σωλήνα (μην αγγίζετε τον τοίχο). Το ελαφρύ ίζημα που σχηματίζεται διαλύεται στο βρασμό και στη συνέχεια προστίθενται 0,5 ml διαλύματος οξικού μολύβδου(II). Παρατηρείται ένα γκριζόμαυρο ίζημα θειούχου μολύβδου(II):


Χημεία της αντίδρασης:

|
μαύρο ίζημα |
1 ml χύνεται σε δοκιμαστικό σωλήνα. προσθέστε 2 ml αδιάλυτη πρωτεΐνη κοτόπουλου. συμπυκνωμένο αλκαλικό διάλυμα, βάλτε αρκετούς λέβητες. Στο ζεστό διάλυμα προστίθεται ένα διάλυμα νατριούχου plumbite - σχηματίζεται ένα κίτρινο-καφέ ή μαύρο χρώμα. (Το νάτριο plumbite παρασκευάζεται ως εξής: ένα διάλυμα αλκαλίου προστίθεται στάγδην σε 1 ml οξικού μολύβδου μέχρι να διαλυθεί το ίζημα υδροξειδίου του μολύβδου που αρχικά σχηματίζει ίζημα).
Εάν ένα μόριο πρωτεΐνης περιέχει αμινοξέα που περιέχουν θείο (κυστίνη, κυστεΐνη), το θείο αποκόπτεται σταδιακά από αυτά τα αμινοξέα με τη μορφή ενός ιόντος σε κατάσταση οξείδωσης - 2, η παρουσία του οποίου ανιχνεύεται από το ιόν μολύβδου, το οποίο σχηματίζει μαύρο αδιάλυτο θειούχο μόλυβδο με το ιόν θείου:
Pb(CH 3 COO) 2 + 2NaOH Pb(OH) 2 + 2 CH 3 COONa,
Pb(OH) 2 + 2NaOH Na 2 PbO 2 + H 2 O,
Na 2 S + Na 2 PbO 2 + 2H 2 O PbS + 4NaOH.
Πείραμα 3. Αντίδραση πρωτεϊνών ξανθοπρωτεΐνης.
Αρχή της μεθόδου. Αυτή η αντίδραση χρησιμοποιείται για την ανίχνευση α-αμινοξέων που περιέχουν αρωματικές ρίζες. Η τυροσίνη, η τρυπτοφάνη, η φαινυλαλανίνη, όταν αλληλεπιδρούν με πυκνό νιτρικό οξύ, σχηματίζουν νιτροπαράγωγα που έχουν κίτρινο χρώμα. Σε ένα αλκαλικό περιβάλλον, τα νιτροπαράγωγα αυτών των α-αμινοξέων δίνουν άλατα πορτοκαλί. Η ζελατίνη, για παράδειγμα, που δεν περιέχει αρωματικά αμινοξέα, δεν δίνει τεστ ξανθοπρωτεΐνης.
Η σειρά εργασίας.
Σε 1 ml διαλύματος ασπραδιού αυγού κοτόπουλου 10% προσθέστε 0,5 ml συμπυκνωμένου νιτρικό οξύ. Ως αποτέλεσμα της πήξης των πρωτεϊνών, σχηματίζεται ένα λευκό ίζημα ή θολότητα στο περιεχόμενο του δοκιμαστικού σωλήνα. Όταν θερμαίνεται, το διάλυμα και το ίζημα γίνονται έντονο κίτρινο. Στην περίπτωση αυτή, το ίζημα διαλύεται σχεδόν πλήρως ως αποτέλεσμα της υδρόλυσης. Μετά την ψύξη, προσθέστε 1–2 ml διαλύματος υδροξειδίου του νατρίου 20% (μέχρι το διάλυμα να γίνει πορτοκαλί).
Ας εξετάσουμε τον μηχανισμό της αντίδρασης της ξανθοπρωτεΐνης στη ρίζα τυροσίνης:


Χημεία αντιδράσεων:

Σχεδιασμός του πειράματος: βγάλτε συμπέρασμα και γράψτε την εξίσωση αντίδρασης.
Πείραμα 4. Αντίδραση Adamkiewicz (στην παρουσία τρυπτοφάνης σε πρωτεΐνες).
Αρχή της μεθόδου. Οι πρωτεΐνες που περιέχουν τρυπτοφάνη δίνουν ένα κόκκινο-ιώδες χρώμα παρουσία γλυοξυλικών και θειικών οξέων. Η αντίδραση βασίζεται στην ικανότητα της τρυπτοφάνης να αλληλεπιδρά σε όξινο περιβάλλον με αλδεΰδες γλυοξυλικού οξέος (η οποία είναι πρόσμειξη σε πυκνό οξικό οξύ) για να σχηματίζει έγχρωμα προϊόντα συμπύκνωσης. Η αντίδραση προχωρά σύμφωνα με την εξίσωση:

Η ζελατίνη δεν δίνει αυτή την αντίδραση, γιατί. δεν περιέχει τρυπτοφάνη. Το χρώμα εμφανίζεται λόγω της αντίδρασης της τρυπτοφάνης με το γλυοξυλικό οξύ, το οποίο υπάρχει πάντα στο οξικό οξύ ως πρόσμειξη.
Η ίδια αντίδραση στην τρυπτοφάνη μπορεί να πραγματοποιηθεί χρησιμοποιώντας αντ' αυτού οξικό οξύφορμαλδεΰδη 2,5% διάλυμα πυκνού H 2 SO 4. Αναδεύουμε το διάλυμα και μετά από 2-3 λεπτά. Προσθέστε 10 σταγόνες νιτρώδους νατρίου 5% ενώ ανακινείτε. Αναπτύσσεται ένα έντονο βιολετί χρώμα, αυτή είναι η βάση αρχή της μεθόδουαντιδράσεις.
Η σειρά εργασίας.
Ρίξτε μερικές σταγόνες αδιάλυτης πρωτεΐνης σε ένα δοκιμαστικό σωλήνα και προσθέστε 2 ml. παγόμορφο οξικό οξύ και μερικές σταγόνες γλυοξυλικό οξύ. Το μείγμα θερμαίνεται ελαφρά μέχρι να διαλυθεί το ίζημα που σχηματίζεται, να κρυώσει και, γέρνοντας έντονα τον δοκιμαστικό σωλήνα, το συμπυκνωμένο H 2 SO 4 χύνεται προσεκτικά κατά μήκος του τοιχώματος έτσι ώστε να μην αναμειχθούν τα δύο υγρά.
Μετά από 5-10 λεπτά, παρατηρείται ο σχηματισμός ενός κόκκινου-ιώδους δακτυλίου στη διεπιφάνεια μεταξύ των δύο στρωμάτων.
Πείραμα 5. Αντίδραση νινυδρίνης.
Αρχή της μεθόδου. α-Τα αμινοξέα αντιδρούν με τη νινυδρίνη, σχηματίζοντας ένα μπλε-ιώδες σύμπλοκο (μωβ Ruemann), η ένταση του χρώματος του οποίου είναι ανάλογη με την ποσότητα του αμινοξέος. Η αντίδραση προχωρά σύμφωνα με το ακόλουθο σχήμα:

Χημεία αντιδράσεων :


Η αντίδραση με νινυδρίνη χρησιμοποιείται για οπτική ανίχνευση α-αμινοξέων σε χρωματογραφήματα (σε χαρτί, σε λεπτό στρώμα), καθώς και για χρωματομετρικό προσδιορισμό της συγκέντρωσης αμινοξέων με βάση την ένταση χρώματος του προϊόντος αντίδρασης.
Το προϊόν αυτής της αντίδρασης περιέχει τη ρίζα (R) του αρχικού αμινοξέος, η οποία προκαλεί διαφορετικά χρώματα: μπλε, κόκκινο κ.λπ. ενώσεις που προκύπτουν από την αντίδραση αμινοξέων με νινυδρίνη.
Επί του παρόντος, η αντίδραση νινυδρίνης χρησιμοποιείται ευρέως τόσο για την ανακάλυψη μεμονωμένων αμινοξέων όσο και για τον προσδιορισμό της ποσότητάς τους.
Η σειρά εργασίας.
1 ml αραιωμένου διαλύματος 1-10% ασπράδι αυγού κοτόπουλου και 1-2 ml διαλύματος 1% νινυδρίνης σε ακετόνη χύνονται σε δοκιμαστικό σωλήνα. Το περιεχόμενο του δοκιμαστικού σωλήνα αναμειγνύεται και θερμαίνεται προσεκτικά σε υδατόλουτρο για 2-3 λεπτά μέχρι να εμφανιστεί ένα μπλε-ιώδες χρώμα, που υποδηλώνει την παρουσία πρωτεΐνης α -αμινοξέα.
Σχεδιασμός του πειράματος: βγάλτε συμπέρασμα και γράψτε την εξίσωση αντίδρασης.
Πείραμα 6. Αντίδραση Σακαγκούτσι.
Αρχή της μεθόδου. Αυτή η αντίδραση στο αμινοξύ αργινίνη βασίζεται στην αλληλεπίδραση της αργινίνης με την α-ναφθόλη παρουσία ενός οξειδωτικού παράγοντα. Ο μηχανισμός του δεν έχει ακόμη αποσαφηνιστεί πλήρως. Προφανώς, η αντίδραση πραγματοποιείται σύμφωνα με την ακόλουθη εξίσωση:

Εφόσον τα παράγωγα των ιμινών κινόνης (στην περίπτωση αυτή, η ναφθοκινόνη), στα οποία το υδρογόνο της ιμινοομάδας –NH– αντικαθίσταται από μια ρίζα αλκυλίου ή αρυλίου, έχουν πάντα κίτρινο-κόκκινο χρώμα, τότε, προφανώς, το πορτοκαλοκόκκινο χρώμα του η λύση κατά την αντίδραση Sakaguchi εξηγείται από την εμφάνιση του παραγώγου ναφθοκινονεϊμίνης. Ωστόσο, δεν μπορεί να αποκλειστεί η πιθανότητα σχηματισμού μιας ακόμη πιο πολύπλοκης ένωσης λόγω περαιτέρω οξείδωσης των υπόλοιπων ομάδων NH του υπολείμματος αργινίνης και του βενζολικού δακτυλίου της α-ναφθόλης:
Η σειρά εργασίας.
Σε 2 ml. Προσθέστε 2 ml αραιωμένου διαλύματος 1% ασπράδι αυγού κοτόπουλου. 10% υδροξείδιο του νατρίου (NaOH) και μερικές σταγόνες διαλύματος αλκοόλης 0,2%. α -ναφθόλη. Τα περιεχόμενα του δοκιμαστικού σωλήνα αναμειγνύονται καλά. Στη συνέχεια προσθέστε 0,5 ml. υποβρωμιούχο νάτριο (NaBrO) ή υποχλωριώδες νάτριο (υποχλωριώδες νάτριο - NaOCl), αναμειγνύεται. Αμέσως εμφανίζεται ένα κόκκινο χρώμα που σταδιακά εντείνεται.
Προσθέστε αμέσως 1 ml διαλύματος ουρίας 40% για να σταθεροποιήσετε το ταχέως αναπτυσσόμενο πορτοκαλοκόκκινο χρώμα.
Αυτή η αντίδραση είναι χαρακτηριστική για ενώσεις που περιέχουν ένα υπόλειμμα γουανιδίνης
NH = C –NH 2,
και υποδεικνύει την παρουσία του αμινοξέος αργινίνη στο μόριο της πρωτεΐνης:
NH = C –NH – (CH 2) 3 –CH –COOH
Σχεδιασμός του πειράματος: βγάλτε συμπέρασμα και γράψτε την εξίσωση αντίδρασης.
Εργαστηριακή εργασία 15 «Σκίουροι»
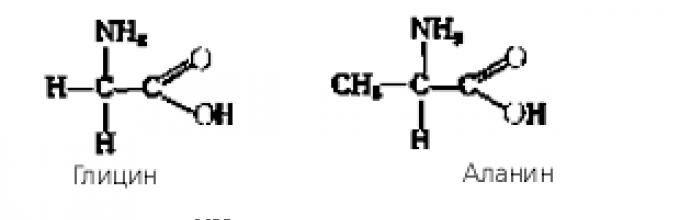
Αμινοξέα ονομάζονται αζωτούχα ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ, των οποίων τα μόρια περιέχουν αμινομάδες και καρβοξυλομάδες.
Εξαρτάται από σχετική θέσηΟι καρβοξυλικές και αμινο ομάδες διακρίνονται -, b-, g-, κ.λπ. αμινοξέα. Για παράδειγμα,
Ο όρος "αμινοξύ" χρησιμοποιείται συχνότερα για να αναφερθεί καρβοξυλικά οξέα, η αμινομάδα της οποίας βρίσκεται στη θέση -, δηλ. για - αμινοξέα. Ο γενικός τύπος των αμινοξέων μπορεί να αναπαρασταθεί ως εξής:
Ανάλογα με τη φύση της ρίζας (R), τα αμινοξέα χωρίζονται σε αλειφατικά, αρωματικά και ετεροκυκλικά.
Τα αμινοξέα αντιδρούν μεταξύ τους μέσω μιας αντίδρασης πολυσυμπύκνωσης, που οδηγεί σε αμίδια οξέος. Τα προϊόντα μιας τέτοιας συμπύκνωσης ονομάζονται πεπτίδια. Όταν δύο αμινοξέα αλληλεπιδρούν, σχηματίζεται ένα διπεπτίδιο:
Η αναδυόμενη ομάδα -CO-NH- που ονομάζεται πεπτιδικός δεσμός.
Όταν ένα διπεπτίδιο αλληλεπιδρά με ένα νέο μόριο αμινοξέος, λαμβάνεται ένα τριπεπτίδιο κ.λπ.
Παραδείγματα των απλούστερων αμινοξέων
σκίουροι - Αυτά περιέχουν άζωτο υψηλού μοριακού βάρους οργανική ύλημε σύνθετη σύνθεσηκαι τη δομή των μορίων. Είναι φυσικά πολυμερή (σύνθετα πολυπεπτίδια), τα μόρια των οποίων είναι κατασκευασμένα από υπολείμματα αμινοξέων που συνδέονται μεταξύ τους με έναν αμιδικό (πεπτιδικό) δεσμό.
Αυτά είναι φυσικά πολυπεπτίδια με υψηλές τιμές μοριακού βάρους (από 5-10 χιλιάδες έως 1 εκατομμύριο ή περισσότερο). Αποτελούν μέρος των κυττάρων και των ιστών όλων των ζωντανών οργανισμών και αποτελούν το κύριο συστατικό της τροφής μας.
Οι πρωτεΐνες περιέχουν άνθρακα, υδρογόνο, οξυγόνο και άζωτο. Σε πολύ μικρότερες ποσότητες, η σύνθεσή τους μπορεί επίσης να περιλαμβάνει θείο, φώσφορο και άλλα στοιχεία. Οι πρωτεΐνες είναι πολύ ασταθείς ενώσεις, γεγονός που καθιστά δύσκολη τη μελέτη των φυσικών και χημικών ιδιοτήτων τους. Τα τελικά προϊόντα της διάσπασης των πρωτεϊνών είναι
β- αμινοξέα. Το μοριακό τους βάρος είναι πολύ μεγάλο.
Όλες οι διαδικασίες της ζωής συνδέονται με πρωτεΐνες. Υπηρετούν ΘΡΕΠΤΙΚΕΣ ουσιες, ρυθμίζουν το μεταβολισμό, παίζοντας το ρόλο των ενζύμων - μεταβολικών καταλυτών, προάγουν τη μεταφορά οξυγόνου σε όλο το σώμα και την απορρόφησή του, παίζουν σημαντικό ρόλο στη λειτουργία νευρικό σύστημα, αποτελούν τη μηχανική βάση της μυϊκής συστολής, συμμετέχουν στη μετάδοση γενετικές πληροφορίεςκαι τα λοιπά.
Πείραμα 1. Πήξη πρωτεΐνης όταν θερμαίνεται.
Αναδίπλωση πρωτεΐνης, δηλ. μετουσίωση - η διαδικασία μιας πρωτεΐνης που χάνει τη φυσική της (εγγενή) διαμόρφωση, που συνήθως συνοδεύεται από απώλεια της βιολογικής της λειτουργίας.Όταν μετουσιώνεται υπό την επίδραση εξωτερικοί παράγοντες(θερμοκρασία, μηχανική καταπόνηση, δράση χημικών αντιδραστηρίων και πλήθος άλλων παραγόντων) συμβαίνει η καταστροφή των δευτεροταγών, τριτοταγών και τεταρτοταγών δομών του μακρομορίου της πρωτεΐνης. Πρωτογενής δομή, και συνεπώς, χημική σύνθεσηοι πρωτεΐνες δεν αλλάζουν. Αλλάζουν φυσικές ιδιότητες: η διαλυτότητα, η ικανότητα ενυδάτωσης μειώνεται, η βιολογική δραστηριότητα χάνεται. Το σχήμα του μακρομορίου της πρωτεΐνης αλλάζει και εμφανίζεται μεγέθυνση.
Για να δουλέψετε, χρησιμοποιήστε ασπράδι αυγού κοτόπουλου διαλυμένο σε νερό (ένα ασπράδι αυγού ανά 150 ml νερού).
Περιγραφή της εμπειρίας. Ζεσταίνουμε μια μικρή ποσότητα διαλύματος πρωτεΐνης σε ένα καυστήρα μέχρι να βράσει. Παρατηρείται θολότητα του υγρού. Το προκύπτον ίζημα δεν διαλύεται ούτε κατά την ψύξη ούτε κατά την αραίωση με νερό, δηλ. η αντίδραση είναι μη αναστρέψιμη.
Πείραμα 2. Αντίδραση ξανθοπρωτεΐνης
Η αντίδραση ξανθοπρωτεΐνης υποδηλώνει την παρουσία υπολειμμάτων αρωματικών αμινοξέων (φαινυλαλανίνη, τυροσίνη, τρυπτοφάνη) στις πρωτεΐνες. Όταν εκτίθεται σε πυκνό νιτρικό οξύ, η αντίδραση νίτρωσης των αρωματικών πυρήνων συμβαίνει με το σχηματισμό κίτρινων νιτρο ενώσεων. Όταν εκτίθενται σε αμμωνία, οι νιτροενώσεις ισομερίζονται για να σχηματίσουν προϊόντα που μοιάζουν με άλατα με έντονο χρώμα.
Περιγραφή της εμπειρίας. Προσθέστε 5-6 σταγόνες πυκνού ΗΝΟ3 σε 1 ml διαλύματος πρωτεΐνης έως ότου εμφανιστεί ένα λευκό ίζημα (ή θολότητα από την πρωτεΐνη που έχει πήξει υπό την επίδραση οξέος). Όταν θερμανθεί, το διάλυμα και το ίζημα θα γίνουν έντονο κίτρινο (το ίζημα θα υδρολυθεί σχεδόν πλήρως και θα διαλυθεί).
Ψύξτε το μείγμα, προσθέστε (προσεκτικά, χωρίς ανακίνηση) περίσσεια συμπυκνωμένης υδατικής αμμωνίας (ή καυστικού αλκάλιου) σταγόνα-σταγόνα μέχρι να συμβεί μια αλκαλική αντίδραση. Το ίζημα του όξινου λευκωματικού που πέφτει πρώτο θα διαλυθεί και το υγρό θα γίνει έντονο πορτοκαλί.
Η αντίδραση διουρίας υποδεικνύει την παρουσία επαναλαμβανόμενων πεπτιδικών ομάδων -CO-NH- στην πρωτεΐνη. Αυτό επιβεβαιώνεται από το γεγονός ότι οι πρωτεΐνες δίνουν ένα ιώδες χρώμα όταν εκτίθενται σε μικρή ποσότητα διαλύματος θειικού χαλκού παρουσία αλκαλίων. Το χρώμα οφείλεται στο σχηματισμό συμπλεγμάτων χαλκού.
Πείραμα 3. Αντίδραση διουρίας
Περιγραφή της εμπειρίας. Τοποθετήστε 1 ml διαλύματος λευκού αυγού, 1 ml διαλύματος υδροξειδίου του νατρίου και 1-2 σταγόνες διαλύματος θειικού χαλκού (II) σε δοκιμαστικό σωλήνα. Το υγρό θα γίνει κόκκινο-ιώδες (αν η περιεκτικότητα σε πρωτεΐνη είναι χαμηλή, προσθέστε προσεκτικά 0,5-1 ml διαλύματος CuSO4 στο διάλυμά του σε αλκάλιο· το χρώμα θα εμφανιστεί στα όρια των στρωμάτων). Εξίσωση αντίδρασης:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
2R - CH - COOH + Cu(OH)2 > (R- CH-COO) 2Cu + 2H2O
Πείραμα 4. Καταβύθιση πρωτεΐνης με άλατα βαριά μέταλλα
Περιγραφή της εμπειρίας. Πάρτε δύο δοκιμαστικούς σωλήνες και τοποθετήστε σε αυτούς 1 ml διαλύματος ασπραδιού και αργά, ανακινώντας, σταγόνα-σταγόνα, προσθέστε ένα κορεσμένο διάλυμα θειικού χαλκού (II) στον ένα δοκιμαστικό σωλήνα και ένα διάλυμα 20% οξικού μολύβδου στον άλλο. . Σχηματίζονται ιζήματα από κακώς διαλυτές πρωτεϊνικές ενώσεις που μοιάζουν με άλατα. Η εμπειρία δείχνει τη χρήση πρωτεΐνης ως αντίδοτο για δηλητηρίαση με άλατα βαρέων μετάλλων. Εξισώσεις αντίδρασης:
- 2R - CH - COOH + CuSO4 > (R- CH-COO) 2Cu + H2SO4
- 2R-CH-COOH + (CH3COO)2Pb> (R-CH-COO)2Pb + CH3COOH
Πείραμα 4. Ανακάλυψη θείου σε πρωτεΐνες
Περιγραφή της εμπειρίας. Περίπου 0,5 ml διαλύματος οξικού μολύβδου χύνεται σε δοκιμαστικό σωλήνα και προστίθεται διάλυμα υδροξειδίου του καλίου μέχρις ότου διαλυθεί το προκύπτον ίζημα υδροξειδίου του μολύβδου. Περίπου 2-3 ml διαλύματος πρωτεΐνης χύνονται σε άλλο δοκιμαστικό σωλήνα και προστίθεται ο ίδιος όγκος του προκύπτοντος διαλύματος plumbite. Ζεσταίνουμε το μείγμα σε βράση για 2-3 λεπτά. Η εμφάνιση σκούρου χρώματος υποδηλώνει το σχηματισμό θειώδους μολύβδου. Γράψτε τις εξισώσεις αντίδρασης.
1) Αντίδραση διουρίας(για όλες τις πρωτεΐνες)
Πρωτεΐνη + CuSO 4 + NaOH έντονο μωβ χρώμα
СuSO 4 + 2NaOH Cu(OH) 2 + Na 2 SO 4
μπλε ίζημα
C = O: Cu: O = C C = O: N
NHOHN:O=C
διαλυτό σύμπλοκο
έντονο μωβ
2) Αντίδραση ξανθοπρωτεΐνης(για πρωτεΐνες που περιέχουν ΑΑ με αρωματική ρίζα)
πρωτεΐνη + ίζημα HNO 3 (k). κίτρινο χρώμα
| || -- H 2 O | ||
N CH C─ + HONO 2 N CH C─
|
κίτρινο χρώμα
Εάν προσθέσετε ένα συμπυκνωμένο διάλυμα αμμωνίας, εμφανίζεται ένα πορτοκαλί χρώμα επειδή η πυκνότητα των ηλεκτρονίων μετατοπίζεται στο νιτροβενζόλιο.
3) Αντίδραση κυστεΐνης- αντίδραση σε ένα υπόλειμμα ΑΚ που περιέχει S
Πρωτεΐνη + NaOH + Pb(CH 3 COO) 2 PbS + πρωτεΐνη
Μαύρο χρώμα
| Pb + PbS
ΒΙΟΚΑΤΑΛΥΣΗ
Ενας από σημαντικά χαρακτηριστικάΟι χημικές αντιδράσεις που συμβαίνουν σε ζωντανούς οργανισμούς είναι η καταλυτική τους φύση. Ένα ζωντανό κύτταρο μπορεί να θεωρηθεί ως ένας μικροσκοπικός καταλυτικός αντιδραστήρας. Η διαφορά μεταξύ ενός κυττάρου και της φιάλης ενός χημικού είναι ότι εάν σε μια φιάλη όλες οι αντιδράσεις προχωρούν ανεξάρτητα (εφαρμόζεται η θεμελιώδης αρχή της ανεξαρτησίας των αντιδράσεων), τότε σε ένα κελί όλα συμβαίνουν αλληλένδετα.
Αυτό δεν συμβαίνει γιατί παραβιάζονται φυσικοί νόμοιή το κύτταρο υπακούει σε άλλους νόμους - όχι, μόνο νόμοι λειτουργούν στη ζωντανή ύλη. Απλώς, στη διαδικασία της εξέλιξης, η φύση δημιούργησε έναν αποτελεσματικό μηχανισμό για τη ρύθμιση όλων κυτταρικές αντιδράσεις, που επιτρέπει σε ολόκληρο το κύτταρο να ελέγχει την αναλογία των προϊόντων έτσι ώστε όλες οι αντιδράσεις να λειτουργούν βέλτιστα.
Όλα λοιπόν είναι βιολογικά χημικές αντιδράσεις- αυτές είναι αντιδράσεις καταλυτικός.
Οι βιολογικοί καταλύτες ονομάζονται ένζυμα ή ένζυμα.
Καταρχήν, στο κύτταρο συμβαίνουν οι ίδιες χημικές αντιδράσεις όπως και στο κύτταρο χημείο, αλλά επιβάλλονται αυστηροί περιορισμοί στις συνθήκες για τις αντιδράσεις στο κύτταρο, δηλαδή T = 37 ◦ C και P = 1 atm.
Επομένως, συχνά διεργασίες που συμβαίνουν σε ένα στάδιο στο εργαστήριο πραγματοποιούνται σε διάφορα στάδια σε ζωντανά κύτταρα.
Η ουσία των καταλυτικών αντιδράσεων, παρά την ποικιλομορφία τους, συνοψίζεται στο γεγονός ότι οι πρώτες ύλες σχηματίζονται με τον καταλύτη ενδιάμεση σύνδεση, που σχετικά γρήγορα μετατρέπεται σε προϊόντα αντίδρασης, αναγεννώντας τον καταλύτη.
Μερικές φορές τα ενδιάμεσα μπορούν να απομονωθούν σε καθαρή μορφή, αλλά συνήθως αποτελούνται από ασταθή μόρια που μπορούν να ανιχνευθούν μόνο χρησιμοποιώντας πολύ ευαίσθητα φασματικά όργανα.
Η διαδικασία που περιλαμβάνει έναν καταλύτη είναι κυκλική ή κυκλική.

Ένα μέτρο της ενζυμικής δραστηριότητας - Ταχύτητα(αριθμός γραμμομορίων υποστρώματος που υφίσταται αλλαγή σε 1 λεπτό ανά 1 mol ενζύμου)
Ο αριθμός των περιστροφών μπορεί να φτάσει τις 10 8.
Αρκετά συχνά, οι κύκλοι πολλών καταλυτών συνδυάζονται μαζί, σχηματίζοντας μια κυκλική διαδικασία.

Οι ουσίες S1 και S2 μετατρέπονται σε προϊόντα P1 και P2. Κατά τη διάρκεια αυτού του μετασχηματισμού, πρώτα το S1 αντιδρά με μια τρίτη ουσία Χ και τον καταλύτη Ε1, σχηματίζοντας το ενδιάμεσο προϊόν Μ1, το οποίο με τη σειρά του μετατρέπεται από τον καταλύτη Ε2 σε ενδιάμεσο προϊόν Μ2 κ.λπ.
Το επιταχυντικό αποτέλεσμα ενός καταλύτη σχετίζεται με μείωση της ενέργειας ενεργοποίησης (αυτή είναι η πρόσθετη ενέργεια που πρέπει να προσδοθεί σε ένα mole μιας ουσίας προκειμένου τα σωματίδια της ουσίας να γίνουν αντιδραστικά και ικανά να ξεπεράσουν το ενεργειακό φράγμα του αντίδραση).
Οι κύριες ιδιότητες των ενζύμων περιλαμβάνουν:
Απόδοση, η οποία έγκειται στον βαθμό επιτάχυνσης (επιτάχυνση κατά 100 εκατομμύρια φορές).
Αυξημένη ειδικότητα υποστρώματος. Τα ένζυμα διακρίνουν το υπόστρωμα μέσω βιολογικής αναγνώρισης (συμπληρωματικότητα).
Αυξημένη ειδικότητα της καταλυόμενης αντίδρασης. Τα περισσότερα ένζυμα επιταχύνουν έναν τύπο αντίδρασης.
Αυξημένη εξειδίκευση για οπτικά ισομερή (μπορεί να αναγνωρίσει αριστερόστροφα και δεξιόχειρα ισομερή).
Αιτία όλων μοναδικές ιδιότητεςένζυμα - τους χωρική δομή. Συνήθως πρόκειται για σφαιρικές πρωτεΐνες, πολύ μεγαλύτερες από το υπόστρωμα σε μέγεθος. Αυτή η περίσταση οδηγεί στο γεγονός ότι κατά τη διαδικασία της εξέλιξης σχηματίστηκε ένα ενεργό κέντρο στην επιφάνεια του ενζύμου, το οποίο είναι συμπληρωματικό με το υπόστρωμα. Αυτό είναι κλειδαριά και κλειδί.
Τα υπό όρους ενεργά κέντρα χωρίζονται σε: δεσμευτικά και καταλυτικά.
Το κέντρο δέσμευσης δεσμεύει το υπόστρωμα και το προσανατολίζει βέλτιστα σε σχέση με την καταλυόμενη ομάδα, ενώ όλες οι ενεργές ομάδες συγκεντρώνονται στο καταλυτικό κέντρο.
Εάν η υδρόλυση (πρωτεϊνών, λιπιδίων) είναι απαραίτητη για να πραγματοποιηθεί μια αντίδραση, τότε το καταλυόμενο κέντρο σχηματίζεται από πλευρικές ρίζες υπολειμμάτων ΑΑ.
Σε αυτή την περίπτωση, το ένζυμο αποτελείται μόνο από πολυπεπτιδικές αλυσίδες. Ωστόσο, εκτός από τις υδρολυτικές αντιδράσεις, συμβαίνουν και άλλες: αντιδράσεις οξειδοαναγωγής, αντιδράσεις μεταφοράς οποιωνδήποτε ομάδων.
Σε αυτές τις περιπτώσεις, τα ένζυμα περιέχουν ένα μη πρωτεϊνικό μέρος. Αυτό το μέρος είναι συνένζυμο(r-factor, προσθετική ομάδα). Το πρωτεϊνικό τμήμα παρέχει το δεσμευτικό αποτέλεσμα και το συνένζυμο παρέχει το καταλυτικό αποτέλεσμα. Μέρος πρωτεΐνης - αποένζυμο.
Αποένζυμο + συνένζυμο ↔ολοένζυμο