Οι μεγάλες περίοδοι του συστήματος Mendeleev, συμπεριλαμβανομένων των λεγόμενων ενδιάμεσων δεκαετιών, περιέχουν δέκα στοιχεία η καθεμία, για τα οποία ο αριθμός των ηλεκτρονίων στο εξωτερικό περίβλημα είναι ίσος με δύο (δύο ηλεκτρονίων) και τα οποία διαφέρουν μόνο ως προς τον αριθμό των ηλεκτρονίων σε δεύτερο έξωκέλυφος. Τέτοια στοιχεία είναι, για παράδειγμα, τα στοιχεία σκάνδιο σε ψευδάργυρο ή ύττριο σε κάδμιο.
Το δεύτερο κέλυφος από το εξωτερικό παίζει μικρότερο ρόλο στην εκδήλωση χημικών ιδιοτήτων από το εξωτερικό περίβλημα, επειδή η σύνδεση μεταξύ των ηλεκτρονίων του εξωτερικού κελύφους και του πυρήνα είναι ασθενέστερη από ό,τι στο δεύτερο έξω. Ως εκ τούτου, στοιχεία στα άτομα των οποίων τα εξωτερικά κελύφη είναι κατασκευασμένα πανομοιότυπα και μόνο τα δεύτερα κελύφη στο εξωτερικό διαφέρουν πολύ λιγότερο μεταξύ τους σε χημικές ιδιότητες από τα στοιχεία με διαφορετικές δομές των εξωτερικών κελύφους. Έτσι, όλα τα στοιχεία των ενδιάμεσων δεκαετιών, που μαζί αποτελούν τις λεγόμενες δευτερεύουσες υποομάδες των κύριων οκτώ ομάδων του συστήματος Mendeleev, είναι μέταλλα· όλα χαρακτηρίζονται από μεταβλητό σθένος. ΣΕ έκτη περίοδο περιοδικό σύστημα, εκτός από την εισαγόμενη δεκαετία, υπάρχουν 14 ακόμη στοιχεία μετά το λανθάνιο, στα οποία η διαφορά στη δομή των φλοιών ηλεκτρονίων εκδηλώνεται μόνο στο τρίτο εξωτερικό κέλυφος ηλεκτρονίων (η πλήρωση των /-θέσεων στο τέταρτο κέλυφος συμβαίνει παρουσία των γεμισμένων θέσεων.Τα στοιχεία αυτά (λανθανίδες) στις -23
Ως αποτέλεσμα πειραμάτων για τον προσδιορισμό των φορτίων των ατομικών πυρήνων μέχρι το έτος 4, ο συνολικός αριθμός των γνωστών στοιχείων - από υδρογόνο (Z = 1) έως ουράνιο (Z = 92) - ήταν 86. Έξι στοιχεία με ατομικούς αριθμούς = 43, 61, 72 χάθηκαν στο σύστημα , 75, 85, 87. Ωστόσο, παρά αυτά τα κενά, ήταν ήδη σαφές ότι στην πρώτη περίοδο του περιοδικού συστήματος θα έπρεπε να υπάρχουν δύο στοιχεία - υδρογόνο και ήλιο, στο 2ο και στο τρίτο - οκτώ στοιχεία το καθένα, στο τέταρτο και το πέμπτο - το καθένα δεκαοκτώ, στο έκτο υπάρχουν τριάντα δύο στοιχεία.13
Πριν αποσαφηνιστεί η δομή της έκτης περιόδου του συστήματος Mendeleev, το στοιχείο Νο. 72 αναζητήθηκε μεταξύ των στοιχείων σπανίων γαιών και ακόμη και μεμονωμένοι επιστήμονες ανακοίνωσαν την ανακάλυψη αυτού του στοιχείου. Όταν έγινε σαφές ότι έκτη περίοδο του περιοδικού συστήματοςπεριέχει 32 στοιχεία, εκ των οποίων τα 14 είναι σπάνια γη, τότε ο N. Bohr επεσήμανε ότι το στοιχείο Νο. 72 βρίσκεται ήδη πίσω από τα σπάνια γαία, στην τέταρτη ομάδα, και είναι, όπως περίμενε ο Mendeleev, ανάλογο του ζιρκονίου.
Ομοίως, ο Bohr επεσήμανε ότι το στοιχείο Νο. 75 βρίσκεται στην ομάδα επτά και είναι το προβλεπόμενο ανάλογο του Μαγγανίου από τον Mendeleev. Πράγματι, στο 3, το στοιχείο Νο. 72, που ονομάζεται άφνιο, ανακαλύφθηκε σε μεταλλεύματα ζιρκονίου και αποδείχθηκε ότι όλα όσα προηγουμένως ονομάζονταν ζιρκόνιο ήταν ουσιαστικά ένα μείγμα ζιρκονίου και αφνίου.
Την ίδια χρονιά 3 έγιναν έρευνες για το στοιχείο Νο 75 σε διάφορα ορυκτά, όπου με βάση τη σχέση με το μαγγάνιο αναμενόταν η παρουσία του στοιχείου αυτού. Οι χημικές εργασίες για την απομόνωση αυτού του στοιχείου βασίστηκαν επίσης στην υποτιθέμενη ομοιότητά του ως προς τις ιδιότητες με το μαγγάνιο. Η αναζήτηση κορυφώθηκε το 5 μ.Χ. με την ανακάλυψη ενός νέου στοιχείου που ονομάζεται ρήνιο.24
Αλλά αυτό δεν εξαντλούσε ακόμη όλες τις δυνατότητες για τεχνητή απόκτηση νέων στοιχείων. Σύνορο Περιοδικός Πίνακαςστην περιοχή των ελαφρών πυρήνων δίνεται από το υδρογόνο, γιατί δεν μπορεί να υπάρχει στοιχείο με πυρηνικό φορτίο μικρότερο από ένα.
Αλλά στην περιοχή των βαρέων πυρήνων αυτό το όριο δεν τίθεται σε καμία περίπτωση από το ουράνιο. Στην πραγματικότητα, η απουσία στη φύση στοιχείων βαρύτερων από το ουράνιο δείχνει μόνο ότι οι χρόνοι ημιζωής τέτοιων στοιχείων είναι σημαντικά μικρότεροι από την ηλικία της Γης. Επομένως, μεταξύ των τριών δέντρων φυσικής ραδιενεργής αποσύνθεσης, συμπεριλαμβανομένων των ισοτόπων με αριθμούς μάζας A = 4n, 4n- -2 και 4 4-3, μόνο οι κλάδοι που ξεκινούν με ισότοπα μακράς περιόδου Tb και 2 και Όλοι οι κλάδοι μικρής περιόδου, μεταφορικά μιλώντας, ξεράθηκε και έπεσε από αμνημονεύτων χρόνων. Επιπλέον, το τέταρτο δέντρο ραδιενεργής αποσύνθεσης, συμπεριλαμβανομένων των ισοτόπων με μάζες αριθμούς A = 4n + 1, έχει στεγνώσει εντελώς και πέθανε, αν υπήρχαν ποτέ ισότοπα αυτής της σειράς στη Γη.
Όπως είναι γνωστό, η τέταρτη και η πέμπτη περίοδος του συστήματος Mendeleev περιέχουν 18 στοιχεία, ενώ η έκτη περίοδο περιέχει 32 στοιχεία, επειδή μεταξύ του στοιχείου της τρίτης ομάδας λανθάνιο (Νο. 57) και της τέταρτης ομάδας στοιχείου άφνιο (Νο. 72) υπάρχουν δεκατέσσερα ακόμη στοιχεία σπανίων γαιών παρόμοια με το λανθάνιο.
Μετά την αποσαφήνιση της δομής της έβδομης περιόδου του συστήματος του D.I. Mendeleev, έγινε σαφές ότι στο περιοδικό σύστημα, η πρώτη περίοδος δύο στοιχείων ακολουθείται από δύο περιόδους των οκτώ στοιχείων, στη συνέχεια δύο περιόδους των δεκαοκτώ στοιχείων και δύο περιόδους των τριάντα δύο στοιχεία. Στη 2η τέτοια περίοδο, που θα πρέπει να τελειώνει με στοιχείο-. Τόμος Νο., ενώ λείπουν ακόμη δεκαεπτά στοιχεία, δύο από αυτά δεν αρκούν για να συμπληρώσουν την οικογένεια ακτινιδών και το στοιχείο Νο. θα πρέπει ήδη να βρίσκεται στην τέταρτη ομάδα του περιοδικού συστήματος, που είναι ανάλογο του αφνίου.
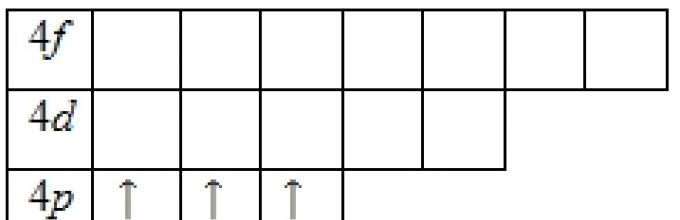
Όταν n + / = 5, συμπληρώνονται τα επίπεδα l = 3, 1 = 2 (M), l = 4, / = 1 (4p) και, τέλος, l = 5, / = O (55). Εάν πριν από το ασβέστιο η πλήρωση των ηλεκτρονικών επιπέδων προχωρούσε με αύξουσα σειρά αριθμών ηλεκτρονίων κελύφους (15, 25, 2p, 33, 3p, 45), τότε αφού γεμίσετε τις 5 θέσεις του τέταρτου κελύφους ηλεκτρονίων, αντί να συνεχίσετε να γεμίζετε αυτό. φλοιός με /7-ηλεκτρόνια, αρχίζει η πλήρωση του προηγούμενου, τρίτου , κελύφη - ηλεκτρόνια. Συνολικά, κάθε κέλυφος μπορεί να περιέχει, όπως προκύπτει από τα παραπάνω, 10 ηλεκτρόνια. Αντίστοιχα, το ασβέστιο στον περιοδικό πίνακα ακολουθείται από 10 στοιχεία από το σκάνδιο (3.452) έως τον ψευδάργυρο (3.452), στα άτομα του οποίου γεμίζει το στρώμα του τρίτου κελύφους και μόνο τότε το στρώμα p του τέταρτου κελύφους γεμάτο - από γάλλιο (3(Sh3 p) έως κρυπτό ZiShchz r). Στο ρουβίδιο και το στρόντιο, που ξεκινούν την πέμπτη περίοδο, εμφανίζονται 55 και 552 ηλεκτρόνια.19
Η έρευνα τα τελευταία δεκαπέντε χρόνια οδήγησε στην τεχνητή παραγωγή ορισμένων βραχυπρόθεσμων. ισότοπα των πυρήνων των στοιχείων από τον υδράργυρο στο ουράνιο, στην ανάσταση των από καιρό νεκρών γονέων του ουρανίου, του πρωτακτινίου και του θορίου στη φύση - στοιχεία σαουρανίου από το Νο. 93 έως το Νο. - και στην ανακατασκευή της τέταρτης σειράς αποσύνθεσης, συμπεριλαμβανομένων ισότοπα με μαζικούς αριθμούς /4 = 4r-1. Αυτή η σειρά μπορεί υπό όρους να ονομαστεί σειρά διάσπασης του ποσειδώνιου, επειδή το μακροβιότερο στη σειρά είναι το ισότοπο του στοιχείου Νο. 93 - ο χρόνος ημιζωής του οποίου είναι κοντά στα 2 εκατομμύρια χρόνια.
Η έκτη περίοδος ξεκινά με την πλήρωση δύο θέσεων για s-ηλεκτρόνια στο έκτο κέλυφος, έτσι ώστε η δομή των εξωτερικών κελυφών των ατόμων του στοιχείου Νο. 56 - βάριο - να έχει τη μορφή 4s j0 d 05s2p66s2. Είναι προφανές ότι με περαιτέρω αύξηση του αριθμού των ηλεκτρονίων στα άτομα των στοιχείων που ακολουθούν το βάριο, τα κελύφη μπορούν να γεμίσουν είτε με 4/-, είτε με bd-, ή, τέλος, με ηλεκτρόνια br. Ήδη στην τέταρτη και πέμπτη περίοδο περιοδικό σύστημα, που περιέχει 18 στοιχεία, συμπληρώνοντας δ-θέσεις δεύτερο έξωτο κέλυφος εμφανίστηκε πριν από την πλήρωση των σημείων p του εξωτερικού κελύφους. Έτσι μέσα έκτη περίοδοη πλήρωση των 6/7 θέσεων ξεκινά μόνο με το στοιχείο Νο. 81-θάλλιο. Στα άτομα των είκοσι τεσσάρων στοιχείων που βρίσκονται μεταξύ βαρίου και θαλλίου, το τέταρτο κέλυφος είναι γεμάτο με /-ηλεκτρόνια και το πέμπτο κέλυφος με ηλεκτρόνια d.
Μοτίβα μεταβολών στη δραστηριότητα των d-στοιχείων στην περίοδο
Κατηγορίες
Επιλέξτε την επικεφαλίδα 1. ΦΥΣΙΚΕΣ ΚΑΙ ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ ΠΕΤΡΕΛΑΙΟΥ ΚΑΙ ΦΥΣΙΚΟΥ ΑΕΡΙΟΥ 3. ΒΑΣΙΚΕΣ ΑΝΑΠΤΥΞΗΣ ΚΑΙ ΛΕΙΤΟΥΡΓΙΑΣ ΠΕΤΡΕΛΑΙΟΥ ΚΟΜΗΜΑΤΩΝ 3.1. Ροή λειτουργία πετρελαιοπηγών 3.4. Λειτουργία φρεατίων με υποβρύχιο ηλεκτρικό φυγόκεντρο 3.6. Έννοια της ανάπτυξης γεωτρήσεων πετρελαίου και φυσικού αερίου 7. ΜΕΘΟΔΟΙ ΕΠΙΡΡΟΗΣ ΣΤΗΝ ΚΟΝΤΙΑ ΚΑΙ ΤΙΣ ΔΥΟ ΖΩΝΕΣ ΤΟΥ ΣΧΗΜΑΤΙΣΜΟΥ ΚΥΡΙΑ ΣΤΟΙΧΕΙΑ ΤΟΥ ΔΟΚΙΜΑΣΤΗ ΣΧΗΜΑΤΙΣΜΟΥ ΒΙΔΑ ΚΑΤΩ ΚΑΤΩ ΚΙΝΗΤΗΡΕΣ ΕΚΤΑΚΤΗΣ ΑΝΑΓΚΗΣ ΚΑΙ ΕΙΔΙΚΕΣ ΛΕΙΤΟΥΡΓΙΕΣ ΤΡΟΠΟΙ ΕΡΓΑΣΙΕΣ ΕΛΛΣ ΑΝΑΛΥΣΗ ΑΙΤΙΩΝ ΛΙΓΕΣ ΑΝΑΛΥΣΗ ΠΑΡΑΓΩΓΙΚΟΤΗΤΑΣ ΓΕΩΡΓΙΩΝ ΤΕΧΝΟΛΟΓΙΩΝ ΚΑΕ ΕΠΙΣΚΕΥΗΣ Εξαρτήματα φρεατίων ΑΣΦΑΛΤΙΚΗ ΡΗΤΙΝΗ-ΠΑΡΑΦΙΝΕΣ ΚΑΤΑΘΕΣΕΙΣ Χωρίς επικεφαλίδες ΜΟΝΑΔΕΣ ΚΥΚΛΟΦΟΡΙΑΣ ΣΥΣΤΗΜΑΤΑ ΚΥΚΛΟΦΟΡΙΑΣ ΜΟΝΑΔΕΣ. καταπολέμηση υδρατών ΚΑΤΑΠΟΛΕΜΗΣΗ ΠΑΡΑΦΙΝΗΣ ΚΑΤΑΘΕΣΗ ΣΕ ΑΝΥΨΩΣΗ ΣΩΛΗΝΩΝ γεώτρηση Drilling sidetracks DRILLING DIRECTIVE AND HORIZONTAL WELLS Drilling wells DRILL DRILLING DRILLING AUTOMATIC STATIONARY TONGS DRILLINGOR DRILLING DRILLING PL AND ΑΝΤΛΙΕΣ ΓΕΩΤΡΗΣΗΣ ΑΝΤΛΙΕΣ ΓΕΩΤΡΗΣΗΣ ΣΩΛΗΝΕΣ ΔΙΑΤΥΠΗΣΗΣ ΓΕΩΤΡΑΝΙΑ ΣΕ ΒΑΛΒΙΔΑ PERMAFROST (MMP). ΕΙΔΗ ΕΤΕΡΟΓΕΝΕΙΑΣ ΣΤΗ ΔΟΜΗ ΤΩΝ ΑΠΟΘΕΜΑΤΩΝ ΠΕΤΡΕΛΑΙΟΥ Τύποι φρεατίων ΒΙΔΩΜΕΝΕΣ ΥΠΟΒΡΥΧΙΕΣ ΑΝΤΛΙΕΣ ΠΡΟΒΟΛΗΜΕΝΕΣ ΣΤΟ ΦΡΕΑΔΙΟ ΠΕΡΙΕΧΟΜΕΝΟ ΥΓΡΑΣΙΑΣ ΚΑΙ ΦΥΣΙΚΟΥ ΑΕΡΙΟΥ ΣΥΝΘΕΣΗ ΕΝΥΔΡΑΤΩΝ ΣΥΝΘΕΣΗ ΕΝΥΔΡΑΤΙΚΟ διάφορους παράγοντες σχετικά με τα χαρακτηριστικά της SDM ΕΡΩΤΗΣΕΙΣ ΒΕΛΤΙΣΤΟΠΟΙΗΣΗΣ ΤΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΤΟΥ ΣΥΣΤΗΜΑΤΟΣ REZERVOIR-ESP ΕΠΙΛΟΓΗ ΕΞΟΠΛΙΣΜΟΥ ΚΑΙ ΤΡΟΠΟΣ ΛΕΙΤΟΥΡΓΙΑΣ ESP SELECTION OF A PUMPER MACHINE Gas lift LN εγκατάσταση Ανύψωση αερίου Λειτουργία πετρελαιοειδών πετρελαίου GIS OF OPERATING ΠΕΔΙΑ ΑΕΡΙΟΥ ΚΑΙ ΟΙ ΙΔΙΟΤΗΤΕΣ ΤΟΥΣ ΣΧΗΜΑΤΙΣΜΟΣ ΥΔΡΑΣ ΣΕ ΦΡΕΑΤΙΔΑ ΣΥΜΠΥΚΝΩΜΑΤΟΣ ΑΕΡΙΟΥ ΣΧΗΜΑΤΙΣΜΟΣ ΕΝΥΔΑΤΩΝ ΣΤΟ ΣΥΣΤΗΜΑ ΣΥΛΛΟΓΗΣ ΛΑΔΙΟΥ υδραυλική προστασία υποβρύχιου ηλεκτροκινητήρα GIDROKEY GKSH-1500MT υδραυλική αντλία εμβόλου GIDROKEY GKSH-1500MT Κεφάλαιο 8. MEADSHE FLIGHT ANDOW C. ΒΑΘΙΕΣ ΑΝΤΛΙΕΣ ΣΤΕΛΩΝ Οριζόντια γεώτρηση ΟΡΥΞΕΙΣ ΓΕΩΛΟΓΙΚΕΣ ΣΥΝΘΗΚΕΣ ΓΕΩΤΡΗΣΗΣ ΠΗΓΕΙΩΝ ΠΕΤΡΕΛΑΙΟΥ ΚΑΙ ΑΕΡΙΟΥ ΚΟΣΚΙΟΜΕΤΡΙΚΕΣ (ΜΗΧΑΝΙΚΗ ΣΥΝΘΕΣΗ ΒΡΑΧΩΝ) ΜΑΚΡΥ ΜΕΤΑΦΟΡΑ ΠΕΤΡΕΛΑΙΟΥ ΚΑΙ ΑΕΡΙΟΥ ΠΑΡΑΜΟΡΦΩΣΗ ΠΙΕΣΕΙΣ ΜΕΤΡΟΜΕΤΡΟΙ ηλεκτρικές αντλίες διαφράγματος DIESEL-HYDRAULIC UNIT50DIELES-SAT. ΜΕΤΡΗΣΗ ΚΑΤΩ ΕΓΚΑΤΑΣΤΑΤΙΚΩΝ ΜΟΝΑΔΩΝ ΜΕ ΚΑΤΑΣΚΕΥΕΣ LMP OJSC " ORENBURGNEFT» παραγωγή λαδιού Παραγωγή πετρελαίου σε δύσκολες συνθήκες ΠΑΡΑΓΩΓΗ ΛΑΔΙΟΥ ΜΕ ΧΡΗΣΗ ΜΕΤΡΟΜΕΤΡΗΤΩΝ ΠΙΕΣΗΣ ΥΓΡΟΥ SPU DOWNHEATH MOTORS Έγχυση διαλυμάτων οξέος στο φρεάτιο ΣΥΣΤΑΤΙΚΑ ΣΥΣΤΗΜΑΤΑ. ΠΡΟΣΤΑΣΙΑ ΕΞΟΠΛΙΣΜΟΥ ΠΕΤΡΕΛΑΙΟΥ ΠΕΔΙΟΥ ΚΑΤΑ ΔΙΑΒΡΩΣΗ ΠΡΟΣΤΑΣΙΑ ΑΠΟ ΔΙΑΒΡΩΣΗ ΕΞΟΠΛΙΣΜΟΥ ΠΕΤΡΕΛΑΙΟΥ ΠΕΔΙΟΥ ΑΛΛΑΓΗ ΤΗΣ ΠΟΡΕΙΑΣ μέτρησης πίεσης, ροής, υγρού, αερίου και ατμού ΜΕΤΡΗΣΗ ΤΗΣ ΠΟΣΟΤΗΤΑΣ ΤΩΝ ΥΓΡΩΝ ΚΑΙ ΤΩΝ ΥΓΡΩΝ ΠΙΟ ΚΑΙ ΑΤΜΟΙ ΜΕΤΡΗΣΗ ΕΠΙΠΕΔΟΥ ΥΓΡΟΥ ΜΕΤΡΗΣΕΙΣ ΠΡΟΪΟΝΤΩΝ ΧΑΜΗΛΗΣ ΑΠΟΔΟΣΗΣ ΠΛΗΡΟΦΟΡΙΚΗ ΤΕΧΝΟΛΟΓΙΑ ΣΕ ΠΑΡΑΓΩΓΗ ΠΕΤΡΕΛΑΙΟΥ ΚΑΙ ΑΕΡΙΟΥ ΔΟΚΙΜΗ ΤΩΝ WELL ELECTRIC HEATERS Ερευνα φρεατίων άντλησης βαθέων φρεατίων K EFFICIENCY STUDY ESP ESP Cable Cable OF ComplexOS1 ΣΧΕΔΙΑΣΜΟΣ ΜΟΝΑΔΑΣ ΒΑΛΒΙΔΑΣ διάβρωση Γερανοί. ΣΤΕΡΕΩΣΗ ΠΑΡΑΦΗΝΩΝ KTPPN MANIFOLDS Διαρρύθμιση εκκρεμούς Μέτρα ασφαλείας κατά την προετοιμασία όξινων διαλυμάτων ΜΕΘΟΔΟΣ ΥΠΟΛΟΓΙΣΜΟΥ ΓΙΑ ΔΙΑΤΡΥΠΑΝΕΣ ΜΕΘΟΔΟΙ ΚΑΤΑΠΟΛΕΜΗΣΗΣ ΚΑΤΑΘΕΣΕΩΝ ΠΑΡΑΦΙΝΗΣ ΣΤΑ ΠΗΓΑΔΙΑ FLOWWELL Μέθοδοι για τον επηρεασμό της ζώνης πλησίον γεώτρησης MANDEY METHOD MANDREGREAD HONSFOR LIDS Μέθοδοι μελέτης τμημάτων φρεατίων . ΜΕΘΟΔΟΙ ΕΜΜΕΣΩΝ ΜΕΤΡΗΣΕΩΝ ΠΙΕΣΗΣ ΜΕΘΟΔΟΙ ΑΦΑΙΡΕΣΗΣ ΑΛΑΤΙΟΥ ΜΗΧΑΝΙΣΜΟΙ ΚΙΝΗΣΗΣ ΚΑΙ ΕΥΘΥΓΡΑΜΜΗΣΗΣ ΤΩΝ ΓΕΩΡΕΥΜΑΤΩΝ γεώτρησης ΜΗΧΑΝΙΣΜΟΙ ΚΙΝΗΣΗΣ ΚΑΙ ΕΥΘΥΓΡΑΜΜΙΣΗΣ ΜΗΧΑΝΙΣΜΟΙ ΚΑΤΑ ΤΗΝ ΚΑΤΑΣΤΑΣΗ ΤΗΣ ΑΡΘΡΩΣΗΣ ΤΗΣ νέας εξοπλισμός άντληση λειτουργία φρεατίων ΑΝΤΛΙΕΣ ΚΑΙ ΣΩΛΗΝΕΣ ΣΥΜΠΙΕΣΤΗ ετερογενής δεξαμενή Πετρέλαιο και προϊόντα πετρελαίου Ειδήσεις πύλης ΝΕΑ ΤΕΧΝΟΛΟΓΙΚΗ ΚΑΙ ΤΕΧΝΙΚΗ ΕΞΑΣΦΑΛΙΣΗ ΠΕΡΙΒΑΛΛΟΝΤΙΚΗΣ ΑΣΦΑΛΕΙΑΣ ΔΙΑΔΙΚΑΣΙΩΝ ΠΑΡΑΓΩΓΗΣ ΕΞΟΠΛΙΣΜΟΣ ΓΙΑ ΑΝΥΨΩΣΗ ΦΡΕΑΤΙΩΝ ΕΞΟΠΛΙΣΜΟΣ ΓΙΑ ΜΗΧΑΝΙΣΜΟ ΔΡΑΣΤΗΡΙΟΤΗΤΩΝ ΚΟΜΜΑΤΟΣ ΕΞΟΠΛΙΣΜΟΣ ΓΙΑ ΕΞΟΠΛΙΣΜΟ πετρελαίου και αερίου ΕΞΟΠΛΙΣΜΟΣ ΕΞΟΠΛΙΣΜΟΥ ΑΝΟΙΚΤΟΙ ΠΟΡΟΙ ΝΕΟΣ ΕΞΟΠΛΙΣΜΟΣ ΓΙΑ ΓΕΝΙΚΟ ΛΟΓΟ Εξοπλισμός γεώτρησης που ολοκληρώθηκε με γεώτρηση ΣΥΜΠΙΕΣΤΗΣ ΦΡΕΤΙΔΑΣ ΕΞΟΠΛΙΣΜΟΣ ΕΞΟΠΛΙΣΜΟΣ ΦΡΕΑΤΙΔΩΝ Εξοπλισμός φρεατίων για λειτουργία ESP EQUIPMENT FOR FLOW WELLS EQUIPMENT FOR FLOW WELLS επεξεργασία της ζώνης της κάτω οπής ΣΧΗΜΑΤΙΣΜΟΣ ΥΔΡΑΤΩΝ ΚΑΙ ΜΕΘΟΔΟΙ ΚΑΤΑΠΟΛΕΜΗΣΗΣ ΤΟΥΣ ΣΧΗΜΑΤΙΣΜΟΣ ΚΡΥΣΤΑΛΛΙΚΩΝ ΥΔΡΑΤΩΝ ΚΑΙ ΥΔΡΑΤΩΝ ΠΕΡΙΣΣΟΤΕΡΑ HAUL REPAIRS ΓΕΝΙΚΕΣ ΕΝΝΟΙΕΣ ΕΙΜΑΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗΝ ΚΑΤΑΣΚΕΥΗ ΦΡΕΑΤΩΝ ΠΕΡΙΟΡΙΣΜΟΣ ΤΗΣ ΕΙΣΟΡΟΣ ΣΧΗΜΑΤΙΣΜΕΝΟΥ ΝΕΡΟΥ Επικίνδυνοι και επιβλαβείς φυσικοί παράγοντες ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΠΙΕΣΗΣ ΣΤΗΝ ΕΞΟΔΟ ΤΗΣ ΑΝΤΛΙΑΣ ΔΟΚΙΜΗ ΥΠΟΧΡΕΩΤΙΚΟΙ ΟΡΙΖΟΝΤΕΣ ΒΕΛΤΙΣΤΟΠΟΙΗΣΗ ΤΡΟΠΟΥ ΛΕΙΤΟΥΡΓΙΑΣ ΤΡΟΠΟΥ ΛΕΙΤΟΥΡΓΙΑΣ ΜΟΝΑΔΑΣ ΩΘΗΣΗΣ ΔΙΠΛΑΣΤΙΚΗ ΜΟΝΑΔΑ ΩΘΗΣΗΣ ΕΛΕΓΧΟΣ ΕΞΕΛΙΞΗ ΠΕΙΡΑ ΚΑΙ ΔΟΚΙΜΗ ΑΝΑΠΤΥΞΗΣ ΠΗΓΕΙΩΝ ΚΑΙ ΘΕΣΗ ΑΝΘΗΚΩΝ ΕΠΙΠΛΕΞΕΙΣ ΠΗΓΕΙΩΝ ΣΤΗ ΔΙΑΔΙΚΑΣΙΑ ΕΜΒΑΘΥΝΣΗΣ ΑΛΛΩΝ ΒΑΣΙΚΩΝ ΕΝΝΟΙΩΝ ΚΑΙ ΔΙΑΤΑΞΕΩΝ ΒΑΣΙΚΕΣ ΕΝΝΟΙΕΣ ΚΑΙ ΔΙΑΤΑΞΕΙΣ ΒΑΣΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΠΕΤΡΕΛΑΙΟ, ΑΕΡΙΟ ΚΑΙ ΣΥΜΠΥΚΝΩΜΑ ΑΕΡΙΟΥ ΘΕΜΕΛΙΩΣΕΙΣ ΤΗΣ ΥΔΡΑΥΛΙΚΗΣ ΕΝΔΕΙΞΗΣ ΒΑΣΕΙΣ ΣΧΕΔΙΑΣΜΟΥ ΚΑΤΕΥΘΥΝΣΕΩΝ ΠΗΓΕΙΩΝ ΒΑΣΕΙΣ ΒΙΟΜΗΧΑΝΙΚΗΣ ΑΣΦΑΛΕΙΑΣ ΚΑΘΑΡΙΣΜΟΣ ΓΕΩΤΡΗΣΗΣ WELL FROM CUTS CLEANING ASSOCIATED GASES συγκόλληση και επιφάνειες HYDROMECHANICAL DOUBLE-CUP PACKER PGMD1 HYDROMECHANICAL PACKERS ΔΗΛ. RS ΠΑΡΑΜΕΤΡΟΙ ΚΑΙ ΠΛΗΡΟΤΗΤΑ ΤΩΝ ΣΥΣΤΗΜΑΤΩΝ ΚΥΚΛΟΦΟΡΙΑΣ Παράμετροι κινητών μπλοκ για εργασία με ASP ΠΡΩΤΟΡΙΚΟ ΑΝΟΙΓΜΑ ΠΑΡΑΓΩΓΙΚΩΝ ΣΧΗΜΑΤΙΣΜΩΝ ΠΡΩΤΙΚΕΣ ΜΕΘΟΔΟΙ ΤΣΙΜΕΝΤΟΠΟΙΗΣΗΣ ΚΙΝΗΤΩΝ ΑΝΤΛΙΩΝ ΜΟΝΑΔΩΝ ΚΑΙ ΜΟΝΑΔΩΝ ΕΠΕΞΕΡΓΑΣΙΑ TRAP OIL (OIL SLUDGE) ΠΕΡΙΟΔΙΚΟΣ ΑΝΥΨΩΣΗ ΑΕΡΙΟΥ ΠΡΟΟΠΤΙΚΕΣ ΓΙΑ ΤΗ ΧΡΗΣΗ ΑΥΞΗΣΗΣ ΤΟΥ DP UMPYPUNCIEAS EFFICING THE IFFIC PUNCIEAS s βύθιση κάτω από το δυναμικό επίπεδο Υπόγειος εξοπλισμός για ρέοντα φρεάτια ΑΝΥΨΩΣΗ ΠΥΞΧΩΡΟ ΥΓΡΟ ΜΕΣΩ ΕΤΗΣΙΑ ΕΡΓΑΛΕΙΑ ΚΑΤΑΣΤΡΟΦΗΣ ΒΡΑΧΟΥ ΧΩΡΟΥ ΦΡΕΑΤΩΝ ΜΕΤΡΟΜΕΤΡΟΙ ΠΙΕΣΗΣ ΕΜΒΟΛΟΥ Απώλεια πίεσης κατά την κίνηση του υγρού κατά μήκος της σωλήνωσης Κανόνες ασφαλείας για τη λειτουργία του φρεατίου Κανόνες για εργασίες επισκευής σε φρεάτια RD 153-39-023-97 ΠΡΟΛΗΨΗ ΠΡΟΛΗΨΗΣ ΑΛΑΤΙ Θεωρητική βάσηΑσφάλεια ΤΕΧΝΙΚΕΣ ΜΕΤΡΗΣΗΣ ΡΟΗΣ Τεχνική φυσική ΤΡΟΧΙΑ ΚΙΝΗΣΗΣ ΤΟΥ ΚΑΤΩ ΤΟΥ ΦΡΕΑΤΙΟΥ Σωλήνες ΟΔΗΓΙΕΣ ΥΠΟΛΟΓΙΣΜΟΥ ΡΕΥΜΑΤΩΝ ΒΡΑΧΥΚΥΚΛΩΜΑΤΟΣ ΣΥΝΘΗΚΕΣ ΥΓΡΟΥ ΚΑΙ ΑΕΡΙΟΥ παραγωγής ΥΓΡΩΝ ΚΑΙ ΑΕΡΙΟΥ για παραγωγή λαδιών ηλεκτρικών αντλιών βυθιζόμενων βιδών Εγκαταστάσεις υποβρύχιων διαφραγμάτων αντικατάσταση ηλεκτρ αντλιες Εξοπλισμός γεώτρησης ΒΑΘΜΙΣΜΕΝΟΙ ΣΩΛΗΝΕΣ ΓΕΩΡΥΠΑΝΟΥ ESP ESP εντελώς ΠΑΡΑΓΟΝΤΕΣ ΠΟΥ ΕΠΗΡΕΑΖΟΥΝ ΤΗΝ ΕΝΤΑΣΗ ΣΧΗΜΑΤΙΣΜΟΥ ASPO Φυσικές και μηχανικές ιδιότητες των πετρωμάτων ταμιευτήρα ΦΥΣΙΚΑ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΩΝ ΑΕΡΙΩΝ ΠΕΤΡΕΛΑΙΟ ΚΑΙ ΑΕΡΙΟ ΤΟΠΟΙ ΦΙΛΤΡΑ ΠΑΡΑΓΩΓΗ ΛΑΔΙΟΥ IGS Σκωρία-τσιμέντα άμμου Σκωρία- τσιμέντα άμμου συντριβής Τμ. ράβδοι άντλησης (SHN) ROD PUMPING UNITS (SHPU) ROD PUMPS FOR ISCOUS LIFTING OIL ROD WELL PUMPS Ράβδοι αντλίες φρεατίων ShSN ΛΕΙΤΟΥΡΓΙΑ ΠΗΓΕΙΩΝ ΑΕΡΙΟΥ λειτουργία φρεατίων χαμηλής ταχύτητας ΛΕΙΤΟΥΡΓΙΑ ΧΑΜΗΛΗΣ ΑΠΟΔΟΣΗΣ ΤΡΟΠΟΣ ΛΕΙΤΟΥΡΓΙΑΣ ΦΡΕΑΤΙΔΙΩΝ ΠΕΡΙΣΤΩΜΕΝΩΝ ΠΑΡΑΦΙΝΩΝ ΛΕΙΤΟΥΡΓΙΑ ESP ESP ELECTRIC AHYDRATOR. ΗΛΕΚΤΡΙΚΗ ΔΙΑΦΡΑΓΜΑ ΑΝΤΛΙΑ εξοικονόμησης ενέργειας κάτω οπή μονάδα ηλεκτρική αντλία YAKORId-στοιχεία και οι ενώσεις τους έχουν έναν αριθμό από χαρακτηριστικές ιδιότητες: μεταβλητές καταστάσεις οξείδωσης. ικανότητα σχηματισμού σύνθετων ιόντων. σχηματισμός έγχρωμων ενώσεων.
Ο ψευδάργυρος δεν είναι μεταβατικό στοιχείο. Οι φυσικές και χημικές του ιδιότητες δεν του επιτρέπουν να χαρακτηριστεί ως μέταλλο μετάπτωσης. Συγκεκριμένα, στις ενώσεις του εμφανίζει μόνο μία κατάσταση οξείδωσης και δεν παρουσιάζει καταλυτική δράση.
Τα d-Elements έχουν κάποια χαρακτηριστικά σε σύγκριση με στοιχεία των κύριων υποομάδων.
1. Στα στοιχεία d, μόνο ένα μικρό μέρος των ηλεκτρονίων σθένους αποεντοπίζεται σε όλο τον κρύσταλλο (ενώ στα αλκάλια και μέταλλα αλκαλικών γαιώντα ηλεκτρόνια σθένους παραδίδονται πλήρως σε συλλογική χρήση). Τα υπόλοιπα d-ηλεκτρόνια συμμετέχουν στο σχηματισμό κατευθυνόμενων ομοιοπολικών δεσμών μεταξύ γειτονικών ατόμων. Έτσι, αυτά τα στοιχεία στην κρυσταλλική κατάσταση δεν έχουν αμιγώς μεταλλικό δεσμό, αλλά ομοιοπολικό-μεταλλικό. Επομένως, είναι όλα σκληρά (εκτός από Hg) και πυρίμαχα (εκτός Zn, Cd) μέταλλα.
Τα πιο πυρίμαχα μέταλλα είναι τα μέταλλα της υποομάδας VB και VIB. Σε αυτά, το μισό του d-υποεπίπεδου είναι γεμάτο με ηλεκτρόνια και επιτυγχάνεται ο μέγιστος δυνατός αριθμός μη ζευγαρωμένων ηλεκτρονίων, και επομένως, μεγαλύτερος αριθμόςομοιοπολικούς δεσμούς. Η περαιτέρω πλήρωση οδηγεί σε μείωση του αριθμού των ομοιοπολικών δεσμών και πτώση των θερμοκρασιών τήξης.
2. Λόγω των μη γεμάτων d-κελυφών και της παρουσίας μη γεμάτων ns- και np-επιπέδων που είναι κοντά σε ενέργεια, τα στοιχεία d είναι επιρρεπή σε σχηματισμό συμπλόκου. δικα τους σύνθετες ενώσεις, κατά κανόνα, είναι έγχρωμα και παραμαγνητικά.
3. Τα d-στοιχεία συχνότερα από τα στοιχεία των κύριων υποομάδων σχηματίζουν ενώσεις μεταβλητής σύστασης (οξείδια, υδρίδια, καρβίδια, πυριτίδια, νιτρίδια, βορίδια). Επιπλέον, σχηματίζουν κράματα μεταξύ τους και με άλλα μέταλλα, καθώς και διαμεταλλικές ενώσεις.
4. Τα στοιχεία D χαρακτηρίζονται από ένα μεγάλο σύνολο καταστάσεων σθένους (Πίνακας 8.10) και, κατά συνέπεια, αλλαγές στις ιδιότητες οξέος-βάσης και οξειδοαναγωγής σε ένα ευρύ φάσμα.
Δεδομένου ότι μερικά από τα ηλεκτρόνια σθένους βρίσκονται σε τροχιακά s, οι χαμηλότερες καταστάσεις οξείδωσης που παρουσιάζουν είναι συνήθως ίσες με δύο. Εξαίρεση αποτελούν τα στοιχεία των οποίων τα ιόντα E +3 και E + έχουν σταθερές διαμορφώσεις d 0, d 5 και d 10: Sc 3+, Fe 3+, Cr +, Cu +, Ag +, Au +.
Οι ενώσεις στις οποίες τα στοιχεία d βρίσκονται στη χαμηλότερη κατάσταση οξείδωσης σχηματίζουν κρυστάλλους ιοντικού τύπου, σε χημικές αντιδράσειςπαρουσιάζουν βασικές ιδιότητες και είναι, κατά κανόνα, αναγωγικοί παράγοντες.
Η σταθερότητα των ενώσεων στις οποίες τα στοιχεία d βρίσκονται στην υψηλότερη κατάσταση οξείδωσης (ίσο με τον αριθμό της ομάδας) αυξάνεται σε κάθε μεταβατική σειρά από αριστερά προς τα δεξιά, φτάνοντας στο μέγιστο για τα στοιχεία 3d σε Mn και στη δεύτερη και τρίτη μεταβατική σειρά σε Ru και Os, αντίστοιχα. Μέσα σε μία υποομάδα, η σταθερότητα των ενώσεων της υψηλότερης κατάστασης οξείδωσης μειώνεται στη σειρά 5d > 4d > 3d, όπως αποδεικνύεται από τη φύση της μεταβολής της ενέργειας Gibbs (ισοβαρικό-ισόθερμο δυναμικό) ενώσεων του ίδιου τύπου, για παράδειγμα :
Αυτό το φαινόμενο οφείλεται στο γεγονός ότι με την αύξηση του κύριου κβαντικού αριθμού εντός μιας υποομάδας, η διαφορά μεταξύ των ενεργειών των (n – 1)d- και ns-υποεπιπέδων μειώνεται. Αυτές οι ενώσεις χαρακτηρίζονται από ομοιοπολικούς πολικούς δεσμούς. Είναι όξινης φύσης και είναι οξειδωτικοί παράγοντες (CrO 3 και K 2 CrO 4, Mn 2 O 7 και KMnO 4).
Οι ενώσεις στις οποίες τα d-ηλεκτρόνια βρίσκονται σε ενδιάμεσες καταστάσεις οξείδωσης εμφανίζουν αμφοτερικές ιδιότητες και δυαδικότητα οξειδοαναγωγής.
5. Η ομοιότητα των d-στοιχείων με τα στοιχεία των κύριων υποομάδων Ε(0) εκδηλώνεται πλήρως στα στοιχεία της τρίτης ομάδας ns 2 np 1 και (n – 1)d 1 ns 2. Καθώς ο αριθμός της ομάδας αυξάνεται, μειώνεται. στοιχεία της υποομάδας VIIIA είναι αέρια, VIIIΒ είναι μέταλλα. Στην πρώτη ομάδα, εμφανίζεται πάλι μια μακρινή ομοιότητα (όλα τα στοιχεία είναι μέταλλα) και τα στοιχεία της υποομάδας IB είναι καλοί αγωγοί. αυτή η ομοιότητα ενισχύεται στη δεύτερη ομάδα, αφού τα d-στοιχεία Zn, Cd και Hg δεν συμμετέχουν στο σχηματισμό χημικού δεσμού.
6. Τα d-στοιχεία IIIB–VIIB των υποομάδων σε υψηλότερες καταστάσεις οξείδωσης είναι παρόμοια σε ιδιότητες με τα αντίστοιχα p-στοιχεία. Έτσι, σε υψηλότερες καταστάσεις οξείδωσης, το Mn (VII) και το Cl (VII) είναι ηλεκτρονικά ανάλογα. Η ομοιότητα των ηλεκτρονικών διαμορφώσεων (s 2 p 6) οδηγεί σε παρόμοιες ιδιότητες των ενώσεων του επτασθενούς μαγγανίου και του χλωρίου. Τα Mn 2 O 7 και Cl 2 O 7 υπό κανονικές συνθήκες είναι ασταθή υγρά, τα οποία είναι ανυδρίτες ισχυρών οξέων με γενικό τύπο NEO 4. Σε χαμηλότερες καταστάσεις οξείδωσης, το μαγγάνιο και το χλώριο έχουν διαφορετικά ηλεκτρονική δομή, που προκαλεί έντονη διαφορά στις ιδιότητες των ενώσεων τους. Για παράδειγμα, το κατώτερο οξείδιο του χλωρίου Cl 2 O (s 2 p 4) είναι μια αέρια ουσία που είναι ανυδρίτης υποχλωριώδους οξέος (HClO), ενώ το κατώτερο οξείδιο του μαγγανίου MnO (d 5) είναι στερεό κρυσταλλική ουσίαβασικός χαρακτήρας.
7. Όπως είναι γνωστό, η αναγωγική ικανότητα ενός μετάλλου καθορίζεται όχι μόνο από την ενέργεια ιοντισμού του (M – ne – → M n + ; +ΔH ιοντισμός), αλλά και από την ενθαλπία της ενυδάτωσης του σχηματιζόμενου κατιόντος (M n + + mH 2 O → M n + mH 2 O; –∆H hydr). Οι ενέργειες ιονισμού των d-στοιχείων είναι υψηλές σε σύγκριση με άλλα μέταλλα, αλλά αντισταθμίζονται από τις μεγάλες ενθαλπίες ενυδάτωσης των ιόντων τους. συνεπώς δυναμικά ηλεκτροδίωνΤα περισσότερα στοιχεία d είναι αρνητικά.
Καθώς το Z αυξάνεται, οι αναγωγικές ιδιότητες των μετάλλων μειώνονται, φτάνοντας στο ελάχιστο για τα στοιχεία της ομάδας ΙΒ. Βαριά μέταλλαΟι ομάδες VIIB και IV ονομάζονται ευγενείς λόγω της αδράνειας τους.
Οι τάσεις οξειδοαναγωγής των ενώσεων των d-στοιχείων καθορίζονται από αλλαγές στη σταθερότητα υψηλότερων και χαμηλότερων καταστάσεων οξείδωσης, ανάλογα με τη θέση τους στο περιοδικό σύστημα. Οι ενώσεις με την υψηλότερη κατάσταση οξείδωσης ενός στοιχείου εμφανίζουν αποκλειστικά οξειδωτικές ιδιότητες και εκείνες με τις χαμηλότερες - αναγωγικές ιδιότητες. Το Mn(OH) 2 οξειδώνεται εύκολα στον αέρα Mn(OH) 2 + 1/2O 2 = MnO 2 + H 2 O. Οι ενώσεις Mn(IV) ανάγεται εύκολα σε Mn (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O, αλλά οξειδώνεται σε Mn (VII) από ισχυρούς οξειδωτικούς παράγοντες. Το υπερμαγγανικό ιόν MnO 4 μπορεί να είναι μόνο οξειδωτικός παράγοντας.
Δεδομένου ότι για τα στοιχεία d σε μια υποομάδα η σταθερότητα των υψηλότερων καταστάσεων οξείδωσης αυξάνεται από πάνω προς τα κάτω, οι οξειδωτικές ιδιότητες των ενώσεων των υψηλότερων καταστάσεων οξείδωσης μειώνονται απότομα. Έτσι, οι ενώσεις του χρωμίου (VI) (CrO 3, K 2 CrO 4, K 2 Cr 2 O 7) και του μαγγανίου (VII) (Mn 2 O 7, KMnO 4) είναι ισχυροί οξειδωτικοί παράγοντες και το WO 3, Re 2 O 7 και τα άλατα των αντίστοιχων οξέων τους (H 2 WO 4, HReO 4) μειώνονται με δυσκολία.
8. Οι ιδιότητες οξέος-βάσης των υδροξειδίων των στοιχείων d επηρεάζονται από τους ίδιους παράγοντες (ιονική ακτίνα και φορτίο ιόντων) με τα υδροξείδια του στοιχείου p.
Τα υδροξείδια χαμηλότερων καταστάσεων οξείδωσης των στοιχείων d συνήθως παρουσιάζουν βασικές ιδιότητες και οι αντίστοιχες υψηλότερους βαθμούςοξείδωση – όξινη. Σε ενδιάμεσες καταστάσεις οξείδωσης, τα υδροξείδια είναι αμφοτερικά. Η αλλαγή στις ιδιότητες οξέος-βάσης των υδροξειδίων με αλλαγή του βαθμού οξείδωσης είναι ιδιαίτερα έντονη στις ενώσεις μαγγανίου. Στη σειρά Mn(OH) 2 – Mn(OH) 3 – Mn(OH) 4 – H 2 MnO 4 – HMnO 4 οι ιδιότητες των υδροξειδίων ποικίλλουν από την ασθενή βάση Mn(OH) 2 έως την αμφοτερική Mn(OH) 3 και Mn(OH) 4 k ισχυρά οξέα H 2 MnO 4 και HMnO 4 .
Σε μία υποομάδα, τα υδροξείδια των στοιχείων d της ίδιας κατάστασης οξείδωσης χαρακτηρίζονται από αύξηση των βασικών ιδιοτήτων όταν μετακινούνται από πάνω προς τα κάτω. Για παράδειγμα, στην ομάδα IIIB, το Sc(OH) 3 είναι μια ασθενής βάση και το La(OH) 3 είναι μια ισχυρή βάση. Στοιχεία IVB της ομάδας Ti, Zn, Hf μορφή αμφοτερικά υδροξείδιαΕ(ΟΗ) 4, αλλά όξινες ιδιότητεςεξασθενούν κατά τη μετάβαση από το Ti στο Hf.
9. Διακριτικό χαρακτηριστικόμεταβατικά στοιχεία είναι ο σχηματισμός φάσεων μεταβλητής σύνθεσης. Αυτά είναι, πρώτον, ενδιάμεσα και υποκατάστατα στερεά διαλύματα και, δεύτερον, ενώσεις μεταβλητής σύνθεσης. Τα στερεά διαλύματα σχηματίζονται από στοιχεία με παρόμοια ηλεκτραρνητικότητα, ατομικές ακτίνες και πανομοιότυπα κρυσταλλικά πλέγματα. Όσο περισσότερα στοιχεία διαφέρουν στη φύση τους, τόσο λιγότερο διαλυτά είναι μεταξύ τους και τόσο πιο επιρρεπή είναι να σχηματίσουν χημικές ενώσεις. Τέτοιες ενώσεις μπορούν να έχουν σταθερή και μεταβλητή σύνθεση. Σε αντίθεση με τα στερεά διαλύματα, στα οποία διατηρείται το πλέγμα ενός από τα συστατικά, οι ενώσεις χαρακτηρίζονται από το σχηματισμό ενός νέου πλέγματος και ενός νέου χημικοί δεσμοί. Με άλλα λόγια, να χημικές ενώσειςπεριλαμβάνουν μόνο εκείνες τις φάσεις μεταβλητής σύνθεσης που διαφέρουν έντονα ως προς τη δομή και τις ιδιότητες από τις αρχικές.
Οι ενώσεις μεταβλητής σύνθεσης χαρακτηρίζονται από τα ακόλουθα χαρακτηριστικά:
α) Η σύνθεση αυτών των ενώσεων εξαρτάται από τη μέθοδο παρασκευής. Έτσι, ανάλογα με τις συνθήκες σύνθεσης, τα οξείδια του τιτανίου έχουν τη σύσταση TiO 1,2–1,5 και TiO 1,9–2,0. καρβίδια τιτανίου και βαναδίου – TiC 0,6–1,0 και VС 0,58–1,09, νιτρίδιο τιτανίου TiN 0,45–1,00.
β) Οι συνδέσεις διατηρούν κρυσταλλικού πλέγματοςμε σημαντικές διακυμάνσεις στην ποσοτική σύσταση, έχουν δηλαδή μεγάλο εύρος ομοιογένειας. Έτσι, το TiC 0,6–1,0, όπως προκύπτει από τον τύπο, διατηρεί το πλέγμα καρβιδίου του τιτανίου με έλλειψη έως και 40% ατόμων άνθρακα σε αυτό.
γ) Η φύση του δεσμού σε τέτοιες ενώσεις καθορίζεται από το βαθμό πλήρωσης των d-τροχιακών του μετάλλου. Τα ηλεκτρόνια του εισαγόμενου μη μετάλλου καταλαμβάνουν κενά d-τροχιακά, γεγονός που οδηγεί σε αυξημένη ομοιοπολικότητα των δεσμών. Γι' αυτό μειώνεται η αναλογία των μεταλλικών δεσμών στις ενώσεις των αρχικών στοιχείων της σειράς d (ομάδες IV–V).
Διαθεσιμότητα ομοιοπολικό δεσμόεπιβεβαιώνονται από μεγάλες θετικές ενθαλπίες σχηματισμού ενώσεων, υψηλότερη σκληρότητα και σημείο τήξης, χαμηλότερη ηλεκτρική αγωγιμότητα σε σύγκριση με τα μέταλλα που τις σχηματίζουν.
Ο χαλκός είναι στοιχείο της ενδέκατης ομάδας της τέταρτης περιόδου του περιοδικού πίνακα χημικά στοιχεία D.I. Mendeleev, με ατομικό αριθμό 29. Συμβολίζεται με το σύμβολο Cu (λατ. Cuprum). Η απλή ουσία χαλκός (αριθμός CAS: 7440-50-8) είναι όλκιμος μεταβατικό μέταλλοχρυσαφένιος- Ροζ χρώμα(ροζ χρώμα απουσία μεμβράνης οξειδίου). Έχει χρησιμοποιηθεί ευρέως από τους ανθρώπους για μεγάλο χρονικό διάστημα.
ΟΡΙΣΜΟΣ
Κάλιο- το πρώτο στοιχείο της τέταρτης περιόδου. Βρίσκεται στην Ομάδα Ι της κύριας (Α) υποομάδας του Περιοδικού Πίνακα.
Αναφέρεται σε στοιχεία της οικογένειας s. Μέταλλο. Τα μεταλλικά στοιχεία που περιλαμβάνονται σε αυτή την ομάδα ονομάζονται συλλογικά αλκαλικά. Ονομασία - Κ. Σειριακός αριθμός- 19. Σχετική ατομική μάζα - 39,102 amu.
Ηλεκτρονική δομή του ατόμου του καλίου
Το άτομο καλίου αποτελείται από έναν θετικά φορτισμένο πυρήνα (+19), μέσα στον οποίο υπάρχουν 19 πρωτόνια και 20 νετρόνια και 19 ηλεκτρόνια κινούνται γύρω σε 4 τροχιές.
Εικ.1. Σχηματική δομή του ατόμου καλίου.
Η κατανομή των ηλεκτρονίων μεταξύ των τροχιακών έχει ως εξής:
1μικρό 2 2μικρό 2 2Π 6 3μικρό 2 3Π 6 4μικρό 1 .
Το εξωτερικό επίπεδο ενέργειας του ατόμου καλίου περιέχει 1 ηλεκτρόνιο, το οποίο είναι ηλεκτρόνιο σθένους. Η κατάσταση οξείδωσης του καλίου είναι +1. Το ενεργειακό διάγραμμα της βασικής κατάστασης έχει την ακόλουθη μορφή:
Ενθουσιασμένη κατάσταση, παρά την παρουσία κενών 3 Π- και 3 ρε-δεν υπάρχουν τροχιακά.
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Ένα άτομο ενός στοιχείου έχει την ακόλουθη διαμόρφωση ηλεκτρονίων 1 μικρό 2 2μικρό 2 2Π 6 3μικρό 2 3Π 6 3ρε 10 4μικρό 2 4Π 3. Αναφέρατε: α) πυρηνικό φορτίο. β) αριθμός συμπληρωμένων επίπεδα ενέργειαςστο ηλεκτρονικό κέλυφος αυτού του ατόμου. γ) ο μέγιστος δυνατός βαθμός οξείδωσης. δ) σθένος του ατόμου σε συνδυασμό με υδρογόνο. |
| Λύση | Για να απαντήσετε στις ερωτήσεις που τέθηκαν, πρέπει πρώτα να προσδιορίσετε τον συνολικό αριθμό ηλεκτρονίων σε ένα άτομο ενός χημικού στοιχείου. Αυτό μπορεί να γίνει αθροίζοντας όλα τα ηλεκτρόνια που υπάρχουν στο άτομο, χωρίς να λαμβάνεται υπόψη η κατανομή τους στα ενεργειακά επίπεδα: 2+2+6+2+6+10+2+3 = 33. Αυτό είναι αρσενικό (As). Τώρα ας απαντήσουμε στις ερωτήσεις: α) το πυρηνικό φορτίο είναι +33. β) το άτομο έχει τέσσερα επίπεδα, από τα οποία τα τρία είναι πλήρη. γ) γράψτε το ενεργειακό διάγραμμα για τα ηλεκτρόνια σθένους του ατόμου του αρσενικού στη θεμελιώδη κατάσταση. Το αρσενικό είναι ικανό να περάσει σε διεγερμένη κατάσταση: ηλεκτρόνια μικρό-Τα υποεπίπεδα εξατμίζονται και ένα από αυτά μετακινείται σε ένα κενό ρε-τροχιάς. Πέντε ασύζευκτα ηλεκτρόνια δείχνουν ότι η μέγιστη δυνατή κατάσταση οξείδωσης του αρσενικού είναι +5. δ) Το σθένος του αρσενικού σε συνδυασμό με το υδρογόνο είναι III (AsH 3). |
Αυτό το άρθρο δεν διαθέτει συνδέσμους προς πηγές πληροφοριών. Οι πληροφορίες πρέπει να είναι επαληθεύσιμες, διαφορετικά ενδέχεται να τεθούν υπό αμφισβήτηση και να διαγραφούν. Μπορείτε να... Wikipedia
Η περίοδος είναι μια σειρά του περιοδικού συστήματος των χημικών στοιχείων, μια ακολουθία ατόμων κατά σειρά αύξησης του πυρηνικού φορτίου και πλήρωσης του εξωτερικού κελύφους ηλεκτρονίων με ηλεκτρόνια. Ο περιοδικός πίνακας έχει επτά περιόδους. Η πρώτη περίοδος περιέχει 2 στοιχεία ... Wikipedia
104 Laurencium ← Rutherfordium → Dubnium ... Βικιπαίδεια
D. I. Mendeleev, φυσική ταξινόμηση χημικών στοιχείων, η οποία είναι μια έκφραση σε πίνακα (ή άλλη γραφική) περιοδικός νόμος Mendeleev (Βλέπε περιοδικό νόμο του Mendeleev). ΥΣΤΕΡΟΓΡΑΦΟ. μι. που αναπτύχθηκε από τον D.I. Mendeleev το 1869... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
Μεντελέεφ Ντμίτρι Ιβάνοβιτς- (Dmitry Ivanovich Mendeleyev) Βιογραφία του Mendeleev, επιστημονική δραστηριότητα του Mendeleev Πληροφορίες για τη βιογραφία του Mendeleev, επιστημονική δραστηριότητα του Mendeleev Περιεχόμενα 1. Βιογραφία 2. Μέλος του ρωσικού λαού 3. Επιστημονική δραστηριότηταΠεριοδικός... Εγκυκλοπαίδεια Επενδυτών
Περιοδικός πίνακας χημικών στοιχείων (πίνακας Mendeleev) ταξινόμηση χημικών στοιχείων, που καθορίζει την εξάρτηση των διαφόρων ιδιοτήτων των στοιχείων από το φορτίο ατομικό πυρήνα. Το σύστημα είναι μια γραφική έκφραση του περιοδικού νόμου, ... ... Wikipedia
Το περιοδικό σύστημα χημικών στοιχείων (πίνακας Mendeleev) είναι μια ταξινόμηση χημικών στοιχείων που καθιερώνει την εξάρτηση των διαφόρων ιδιοτήτων των στοιχείων από το φορτίο του ατομικού πυρήνα. Το σύστημα είναι μια γραφική έκφραση του περιοδικού νόμου, ... ... Wikipedia
Το περιοδικό σύστημα χημικών στοιχείων (πίνακας Mendeleev) είναι μια ταξινόμηση χημικών στοιχείων που καθιερώνει την εξάρτηση των διαφόρων ιδιοτήτων των στοιχείων από το φορτίο του ατομικού πυρήνα. Το σύστημα είναι μια γραφική έκφραση του περιοδικού νόμου, ... ... Wikipedia
Ταξινόμηση χημικών στοιχείων (περιοδικός πίνακας) των χημικών στοιχείων, που καθορίζει την εξάρτηση των διαφόρων ιδιοτήτων των στοιχείων από το φορτίο του ατομικού πυρήνα. Το σύστημα είναι μια γραφική έκφραση του περιοδικού νόμου που θεσπίστηκε από τη ρωσική... ... Wikipedia
Εννοια μεταβατικό στοιχείοσυνήθως χρησιμοποιείται για να αναφέρεται σε οποιοδήποτε στοιχείο με d ή f ηλεκτρόνια σθένους. Αυτά τα στοιχεία καταλαμβάνουν μια μεταβατική θέση στον περιοδικό πίνακα μεταξύ των ηλεκτροθετικών στοιχείων s και των ηλεκτραρνητικών στοιχείων p.
Τα στοιχεία d συνήθως ονομάζονται κύρια μεταβατικά στοιχεία. Τα άτομά τους χαρακτηρίζονται από την εσωτερική δομή των d-υποκελυφών. Το γεγονός είναι ότι το s-τροχιακό του εξωτερικού τους κελύφους συνήθως γεμίζεται πριν αρχίσει η πλήρωση των d-τροχιακών στο προηγούμενο ηλεκτρονιακό κέλυφος. Αυτό σημαίνει ότι κάθε νέο ηλεκτρόνιο που προστίθεται σε νέφος ηλεκτρονίωντο επόμενο στοιχείο d, σύμφωνα με την αρχή της πλήρωσης, δεν πέφτει στο εξωτερικό κέλυφος, αλλά στο εσωτερικό υποκέλυφος που προηγείται του. Χημικές ιδιότητεςαπό αυτά τα στοιχεία καθορίζονται από τη συμμετοχή ηλεκτρονίων και από τα δύο αυτά κελύφη σε αντιδράσεις.

Τα d-Elements σχηματίζουν τρεις μεταβατικές σειρές - στην 4η, 5η και 6η περίοδο, αντίστοιχα. Η πρώτη μεταβατική σειρά περιλαμβάνει 10 στοιχεία, από σκάνδιο έως ψευδάργυρο. Χαρακτηρίζεται από την εσωτερική διαμόρφωση τρισδιάστατων τροχιακών. Το τροχιακό 4s γεμίζει νωρίτερα από το τροχιακό 3d,γιατί έχει λιγότερη ενέργεια (κανόνας Klechkovsky).
Θα πρέπει να σημειωθεί, ωστόσο, ότι υπάρχουν δύο ανωμαλίες. Το χρώμιο και ο χαλκός έχουν μόνο ένα ηλεκτρόνιο στα τροχιακά τους 4s. Το γεγονός είναι ότι τα μισογεμισμένα ή πλήρως γεμάτα υποκέλυφα είναι πιο σταθερά από τα μερικώς γεμάτα υποκέλυφα.
Το άτομο του χρωμίου έχει ένα ηλεκτρόνιο σε καθένα από τα πέντε τρισδιάστατα τροχιακά που σχηματίζουν το 3d υποκέλυφος. Αυτό το υποκέλυφος είναι μισογεμάτο. Σε ένα άτομο χαλκού, καθένα από τα πέντε τρισδιάστατα τροχιακά περιέχει ένα ζεύγος ηλεκτρονίων. Παρόμοια ανωμαλία παρατηρείται και στο ασήμι.
Όλα τα στοιχεία d είναι μέταλλα.
Ηλεκτρονικές διαμορφώσεις των στοιχείων της τέταρτης περιόδου από το σκάνδιο στον ψευδάργυρο: 


Χρώμιο
Το Chromium βρίσκεται στην 4η περίοδο, στην ομάδα VI, σε δευτερεύουσα υποομάδα. Είναι μέταλλο μέτριας δραστικότητας. Στις ενώσεις του, το χρώμιο εμφανίζει καταστάσεις οξείδωσης +2, +3 και +6. Το CrO είναι ένα τυπικό βασικό οξείδιο, Cr 2 O 3 - αμφοτερικό οξείδιο, το CrO 3 είναι ένα τυπικό όξινο οξείδιο με τις ιδιότητες ενός ισχυρού οξειδωτικού παράγοντα, δηλαδή, η αύξηση του βαθμού οξείδωσης συνοδεύεται από αύξηση των όξινων ιδιοτήτων.

Σίδερο
Ο σίδηρος βρίσκεται στην 4η περίοδο, στην ομάδα VIII, στη δευτερεύουσα υποομάδα. Ο σίδηρος είναι μέταλλο μέτριας δραστικότητας· στις ενώσεις του εμφανίζει τη μεγαλύτερη χαρακτηριστικούς βαθμούςοξείδωση +2 και +3. Είναι επίσης γνωστές ενώσεις σιδήρου στις οποίες εμφανίζει κατάσταση οξείδωσης +6, οι οποίες είναι ισχυροί οξειδωτικοί παράγοντες. Το FeO παρουσιάζει βασικές ιδιότητες και το Fe 2 O 3 παρουσιάζει αμφοτερικές ιδιότητες με κυριαρχία βασικών ιδιοτήτων.

Χαλκός
Ο χαλκός βρίσκεται στην 4η περίοδο, στην ομάδα Ι, στη δευτερεύουσα υποομάδα. Οι πιο σταθερές καταστάσεις οξείδωσης είναι +2 και +1. Στη σειρά των τάσεων των μετάλλων, ο χαλκός βρίσκεται μετά το υδρογόνο, του χημική δραστηριότηταόχι πολύ μεγάλο. Οξείδια χαλκού: Cu2O CuO. Το τελευταίο και το υδροξείδιο του χαλκού Cu(OH)2 εμφανίζουν αμφοτερικές ιδιότητες με υπεροχή των βασικών.
Ψευδάργυρος
Ο ψευδάργυρος βρίσκεται στην 4η περίοδο, στην ομάδα II, στη δευτερεύουσα υποομάδα. Ο ψευδάργυρος είναι μέταλλο μεσαίας δράσης· στις ενώσεις του εμφανίζει μια μοναδική κατάσταση οξείδωσης +2. Το οξείδιο του ψευδαργύρου και το υδροξείδιο είναι αμφοτερικά.