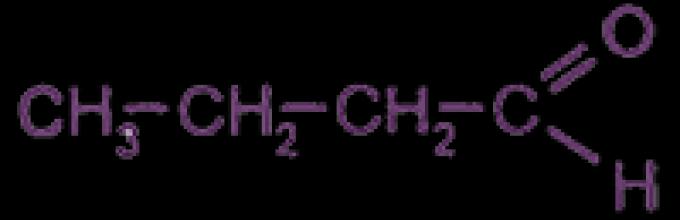(για την απλούστερη αλδεΰδη R=H)
Ταξινόμηση αλδεΰδων
Σύμφωνα με τη δομή της ρίζας υδρογονάνθρακα:
Οριο; Για παράδειγμα:

Απεριόριστος; Για παράδειγμα:

Αρωματικός; Για παράδειγμα:

Αλικυκλική; Για παράδειγμα:

Γενικός τύπος κορεσμένων αλδεΰδων

Ομόλογες σειρές, ισομέρεια, ονοματολογία

Οι αλδεΰδες είναι ισομερείς σε μια άλλη κατηγορία ενώσεων, τις κετόνες.

Για παράδειγμα:

Οι αλδεΰδες και οι κετόνες περιέχουν μια καρβονυλική ομάδα ˃C=O και γι' αυτό ονομάζονται καρβονυλικές ενώσεις.
Ηλεκτρονική δομή μορίων αλδεΰδης
Το άτομο άνθρακα της ομάδας αλδεΰδης βρίσκεται σε κατάσταση υβριδισμού sp 2, επομένως όλοι οι δεσμοί σ αυτής της ομάδας βρίσκονται στο ίδιο επίπεδο. Νέφη ηλεκτρονίων p που σχηματίζουν δεσμό π είναι κάθετα σε αυτό το επίπεδο και μετατοπίζονται εύκολα προς το πιο ηλεκτραρνητικό άτομο οξυγόνου. Επομένως, ο διπλός δεσμός C=O (σε αντίθεση με τον διπλό δεσμό C=C στα αλκένια) είναι πολύ πολωμένος.
Φυσικές ιδιότητες

Χημικές ιδιότητες
Οι αλδεΰδες είναι δραστικές ενώσεις που υφίστανται πολλές αντιδράσεις. Τα πιο χαρακτηριστικά των αλδεΰδων:
α) αντιδράσεις προσθήκης στην ομάδα καρβονυλίου. Τα αντιδραστήρια τύπου HX προστίθενται ως εξής:

β) αντιδράσεις οξείδωσης Δεσμοί C-Hομάδα αλδεΰδης, με αποτέλεσμα το σχηματισμό καρβοξυλικών οξέων:
I. Αντιδράσεις προσθήκης
1. Υδρογόνωση (σχηματίζονται πρωτογενείς αλκοόλες

2. Προσθήκη αλκοολών (σχηματίζονται ημιακετάλες και ακετάλες)

Σε περίσσεια αλκοόλης παρουσία HCl, οι ημιακετάλες μετατρέπονται σε ακετάλες:

II. Αντιδράσεις οξείδωσης
1. Η αντίδραση του «ασημένιου καθρέφτη».

Απλοποιημένο:

Αυτή η αντίδραση είναι μια ποιοτική αντίδραση στην ομάδα αλδεΰδης (στα τοιχώματα του δοχείου αντίδρασης σχηματίζεται μια κατοπτρική επικάλυψη από μεταλλικό άργυρο).
2. Αντίδραση με υδροξείδιο του χαλκού(II).

Αυτή η αντίδραση είναι επίσης μια ποιοτική αντίδραση στην ομάδα αλδεΰδης y (ένα κόκκινο ίζημα του Cu 2 O κατακρημνίζεται).
Η φορμαλδεΰδη οξειδώνεται από διάφορα οξειδωτικά που περιέχουν Ο, πρώτα σε μυρμηκικό οξύ και στη συνέχεια σε H 2 CO 3 (CO 2 + H 2 O ):

III. Αντιδράσεις δι-, τρι- και πολυμερισμού
1. Συμπύκνωση Aldol

2. Τριμερισμός ακεταλδεΰδης

3. Πολυμερισμός φορμαλδεΰδης
Κατά τη μακροχρόνια αποθήκευση φορμαλδεΰδης (υδατικό διάλυμα φορμαλδεΰδης 40%), λαμβάνει χώρα πολυμερισμός σε αυτήν με σχηματισμό ενός λευκού παραμορφικού ιζήματος:

IV. Αντίδραση πολυσυμπύκνωσης φορμαλδεΰδης με φαινόλη

Διάλεξη Νο 11
ΑΛΔΕΥΔΕΣ ΚΑΙ ΚΕΤΟΝΕΣ
Σχέδιο
1. Μέθοδοι παραλαβής.
2. Χημικές ιδιότητες.
2.1. Πυρηνόφιλες αντιδράσεις
ένταξη.
2.2. Αντιδράσεις από τον α - άτομο άνθρακα.
2.3.
Διάλεξη Νο 11
ΑΛΔΕΥΔΕΣ ΚΑΙ ΚΕΤΟΝΕΣ
Σχέδιο
1. Μέθοδοι παραλαβής.
2. Χημικές ιδιότητες.
2.1. Πυρηνόφιλες αντιδράσεις
ένταξη.
2.2. Αντιδράσεις από τον α - άτομο άνθρακα.
2.3. Αντιδράσεις οξείδωσης και αναγωγής.
Οι αλδεΰδες και οι κετόνες περιέχουν μια ομάδα καρβονυλίου
C=O. Γενικός τύπος:
1. Μέθοδοι απόκτησης.

2. Χημικό
ιδιότητες.
Οι αλδεΰδες και οι κετόνες είναι μια από τις πιο αντιδραστικές κατηγορίες
ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ. Δικα τους Χημικές ιδιότητεςκαθορίζεται από την παρουσία
καρβονυλ ομάδα. Λόγω της μεγάλης διαφοράς στην ηλεκτραρνητικότητα
άνθρακα και οξυγόνο και υψηλή πολωσιμότητα p -δεσμοί Ο δεσμός C=O έχει σημαντική πολικότητα
( m C=O =2,5-2,8 D). Άτομο άνθρακα καρβονυλίου
ομάδα φέρει ένα αποτελεσματικό θετικό φορτίο και είναι αντικείμενο για επίθεση
πυρηνόφιλα. Ο κύριος τύπος αντιδράσεων αλδεΰδων και κετονών είναι αντιδράσεις
πυρηνόφιλη προσθήκη AdΝ. Επιπλέον, η ομάδα καρβονυλίου επηρεάζει
αντιδραστικότηταΣυνδέσεις S-Nένα -θέση, αυξάνοντας την οξύτητά του.
Έτσι, μόρια αλδεΰδων και κετονών
περιέχουν δύο κύρια κέντρα αντίδρασης - τον δεσμό C=O και Σύνδεση C-H Vμια θέση:

2.1. Πυρηνόφιλες αντιδράσεις
ένταξη.
Οι αλδεΰδες και οι κετόνες προσθέτουν εύκολα πυρηνόφιλα αντιδραστήρια στον δεσμό C=O.
Η διαδικασία ξεκινά με μια επίθεση από ένα πυρηνόφιλο στο άτομο άνθρακα του καρβονυλίου. Επειτα
Το τετραεδρικό ενδιάμεσο που σχηματίζεται στο πρώτο στάδιο προσθέτει ένα πρωτόνιο και
δίνει το προϊόν προσθήκης:

Δραστηριότητα καρβονυλικών ενώσεων σε
Ενα δΝ – οι αντιδράσεις εξαρτώνται από το μέγεθος
αποτελεσματικό θετικό φορτίο στο άτομο άνθρακα και τον όγκο του καρβονυλίου
υποκαταστάτες στην ομάδα καρβονυλίου. Δότες ηλεκτρονίων και ογκώδεις υποκαταστάτες
περιπλέκουν την αντίδραση, οι υποκαταστάτες που αποσύρουν ηλεκτρόνια αυξάνουν την αντίδραση
ικανότητα καρβονυλικής ένωσης. Επομένως, οι αλδεΰδες σε
Ενα δΝ -οι αντιδράσεις είναι πιο ενεργές από
κετόνες.
Η δραστηριότητα των καρβονυλικών ενώσεων αυξάνεται σε
παρουσία όξινων καταλυτών, οι οποίοι αυξάνουν το θετικό φορτίο κατά
καρβονυλικό άτομο άνθρακα:

Οι αλδεΰδες και οι κετόνες προσθέτουν νερό, αλκοόλες,
θειόλες, υδροκυανικό οξύ, υδροθειώδες νάτριο, ενώσεις όπως
N.H. 2 Χ. Όλες οι αντιδράσεις προσθήκης
προχωρήστε γρήγορα, υπό ήπιες συνθήκες, αλλά τα προϊόντα που προκύπτουν, κατά κανόνα,
θερμοδυναμικά ασταθής. Επομένως, οι αντιδράσεις προχωρούν αναστρέψιμα, και το περιεχόμενο
τα προϊόντα προσθήκης στο μείγμα ισορροπίας μπορεί να είναι χαμηλά.
Νερό σύνδεσης.
Οι αλδεΰδες και οι κετόνες προσθέτουν νερό
σχηματισμός υδριτών. Η αντίδραση είναι αναστρέψιμη. Σχηματισμός υδρατμών
θερμοδυναμικά ασταθής. Η ισορροπία μετατοπίζεται προς τα προϊόντα
προσθήκη μόνο στην περίπτωση ενεργών καρβονυλικών ενώσεων.

Προϊόν ενυδάτωσης τριχλωροξικής αλδεΰδης
Η ένυδρη χλωράλη είναι μια σταθερή κρυσταλλική ένωση που χρησιμοποιείται σε
φάρμακο ως ηρεμιστικό και υπνωτικό.
Προσθήκη αλκοολών και
θειόλες.
Οι αλδεΰδες συνδυάζονται με αλκοόλες για να σχηματιστούν ημιακετάλες. Σε περίσσεια αλκοόλης και παρουσία όξινου καταλύτη
η αντίδραση προχωρά παραπέρα - μέχρι το σχηματισμό ακετάλες

Η αντίδραση σχηματισμού ημιακετάλης προχωρά ως
πυρηνόφιλη προσθήκη και επιταχύνεται παρουσία οξέων ή
λόγους.

Η διαδικασία σχηματισμού ακετάλης έχει ως εξής:
πυρηνόφιλη υποκατάσταση της ομάδας ΟΗ στην ημιακετάλη και είναι δυνατή μόνο υπό συνθήκες
όξινη κατάλυση, όταν η ομάδα ΟΗ μετατρέπεται σε καλή αποχωρούσα ομάδα
(Η 2 Ο).

Ο σχηματισμός ακεταλών είναι μια αναστρέψιμη διαδικασία. ΣΕ
Σε όξινο περιβάλλον, οι ημιακετάλες και οι ακετάλες υδρολύονται εύκολα. Σε αλκαλικό περιβάλλον
υδρόλυση δεν συμβαίνει. Οι αντιδράσεις σχηματισμού και υδρόλυσης των ακεταλών παίζουν σημαντικό ρόλο
χημεία των υδατανθράκων.
Οι κετόνες υπό παρόμοιες συνθήκες δεν το κάνουν
δίνω.
Οι θειόλες είναι ισχυρότερα πυρηνόφιλα από τις αλκοόλες
σχηματίζουν προϊόντα προσθήκης τόσο με αλδεΰδες όσο και με κετόνες.
Σύνδεση υδροκυανικού
οξέα
Το υδροκυανικό οξύ προστίθεται σε μια καρβονυλική ένωση υπό συνθήκες
βασική κατάλυση για το σχηματισμό κυανοϋδρινών.

Η αντίδραση έχει παρασκευαστική αξία και
χρησιμοποιείται στη σύνθεσηα-υδροξυ- και α -αμινοξέα (βλ. διάλεξη αρ. 14). Καρποί ορισμένων φυτών
(π.χ. πικραμύγδαλα) περιέχουν κυανυδρίνες. Ξεχωρίζει όταν αυτοί
Όταν διασπάται, το υδροκυανικό οξύ έχει δηλητηριώδη δράση.
Προσθήκη διθειώδους
νάτριο
Οι αλδεΰδες και οι μεθυλοκετόνες προσθέτουν όξινο θειώδες νάτριο NaHSO 3 με το σχηματισμό διθειωδών παραγώγων.

Διθειώδη παράγωγα καρβονυλικών ενώσεων
– κρυσταλλικές ουσίες που είναι αδιάλυτες σε περίσσεια διαλύματος όξινου θειώδους νατρίου.
Η αντίδραση χρησιμοποιείται για την απομόνωση ενώσεων καρβονυλίου από μείγματα. Καρβονύλιο
η ένωση μπορεί εύκολα να αναγεννηθεί με επεξεργασία του όξινου θειώδους παραγώγου
οξύή αλκάλι.
Αλληλεπίδραση με κοινές συνδέσεις
τύποι NH 2 Χ.
Οι αντιδράσεις προχωρούν σύμφωνα με γενικό σχέδιοως διαδικασία
προσκόλληση-εξάλειψη. Το προϊόν προσθήκης που σχηματίστηκε στο πρώτο στάδιο δεν είναι
σταθερό και απομακρύνει εύκολα το νερό.

Σύμφωνα με το δεδομένο σχήμα με καρβονύλιο
οι ενώσεις αντιδρούν με την αμμωνία, πρωτοταγείς αμίνες, υδραζίνη, υποκατεστημένες υδραζίνες,
υδροξυλαμίνη.

Τα παράγωγα που προκύπτουν είναι
κρυσταλλικές ουσίες που χρησιμοποιούνται για απομόνωση και ταυτοποίηση
καρβονυλικές ενώσεις.
Οι ιμίνες (βάσεις Schiff) είναι ενδιάμεσες
προϊόντα σε πολλές ενζυμικές διεργασίες (τρανσαμίνωση υπό την επίδραση
συνένζυμο φωσφορική πυριδοξάλη; αναγωγική αμίνωση κετοξέων σε
συμμετοχή του συνενζύμου NADΝ). Η καταλυτική υδρογόνωση των ιμινών παράγει
αμίνες Η διαδικασία χρησιμοποιείται για τη σύνθεση αμινών από αλδεΰδες και κετόνες και
που ονομάζεται αναγωγική αμίνωση.
Η αναγωγική αμίνωση λαμβάνει χώρα in vivo
κατά τη σύνθεση αμινοξέων (βλ. διάλεξη αρ. 16)
2.2. Αντιδράσεις απόένα - άτομο άνθρακα.
Ταυτομερισμός κετο-ενόλης.
Υδρογόνο σε α -Η θέση στην ομάδα καρβονυλίου είναι όξινη
ιδιότητες, αφού το ανιόν που σχηματίζεται κατά την αποβολή του σταθεροποιείται από
λογαριασμό συντονισμού.

Το αποτέλεσμα της κινητικότητας των πρωτονίων του ατόμου του υδρογόνου
Vένα -θέση
είναι η ικανότητα των καρβονυλικών ενώσεων να σχηματίζουν μορφές ενόλης λόγω
μετανάστευση πρωτονίων απόένα -θέση στο άτομο οξυγόνου της καρβονυλικής ομάδας.

Η κετόνη και η ενόλη είναι ταυτομερή.
Τα ταυτομερή είναι ισομερή που μπορούν γρήγορα και αναστρέψιμα να μετατραπούν το ένα στο άλλο
λόγω της μετανάστευσης μιας ομάδας (στην περίπτωση αυτή, ενός πρωτονίου). Ισορροπία μεταξύ
κετόνη και ενόλη ονομάζονται ταυτομερισμός κετο-ενόλης.
Η διαδικασία ενολίωσης καταλύεται από οξέα και
αιτιολογικό. Η ενολίωση υπό την επίδραση μιας βάσης μπορεί να αντιπροσωπεύεται από
με το παρακάτω διάγραμμα:
Υπάρχουν οι περισσότερες καρβονυλικές ενώσεις
κυρίως σε μορφή κετόνης. Η περιεκτικότητα της μορφής ενόλης αυξάνεται με
αύξηση της οξύτητας της ένωσης καρβονυλίου, καθώς και στην περίπτωση του
πρόσθετη σταθεροποίηση της μορφής ενόλης λόγω δεσμού υδρογόνου ή λόγω
ζευγάρωμα.
Πίνακας 8. Περιεκτικότητα μορφών ενόλης και
οξύτητα των καρβονυλικών ενώσεων
Για παράδειγμα, σε ενώσεις 1,3-δικαρβονυλίου
η κινητικότητα των πρωτονίων της ομάδας του μεθυλενίου αυξάνεται απότομα λόγω
επίδραση έλξης ηλεκτρονίων δύο καρβονυλικών ομάδων. Επιπλέον, η ενολ
η μορφή σταθεροποιείται λόγω της παρουσίας σε αυτήν ενός συστήματος συζυγούςΠ -δεσμούς και ενδομοριακούς
δεσμός υδρογόνου.

Αν μια ένωση σε μορφή ενόλης είναι
είναι ένα συζευγμένο σύστημα με υψηλή ενέργεια σταθεροποίησης, μετά η μορφή ενόλης
επικρατεί. Για παράδειγμα, η φαινόλη υπάρχει μόνο σε μορφή ενόλης.
Η ενολίωση και ο σχηματισμός ενολικών ανιόντων είναι
τα πρώτα στάδια των αντιδράσεων των καρβονυλικών ενώσεων που συμβαίνουν μέσωένα - άτομο άνθρακα. Το πιο σημαντικό
εκ των οποίων είναι αλογόνωσηΚαι αλδολικό-κροτονικό
συμπύκνωση
.
Αλογόνωση.
Οι αλδεΰδες και οι κετόνες αντιδρούν εύκολα με τα αλογόνα (Cl2,
Br 2, I 2 ) με την εκπαίδευση
αποκλειστικάένα -παράγωγα αλογόνου.

Η αντίδραση καταλύεται από οξέα ή
αιτιολογικό. Ο ρυθμός αντίδρασης δεν εξαρτάται από τη συγκέντρωση και τη φύση του αλογόνου.
Η διαδικασία προχωρά μέσω του σχηματισμού της μορφής ενόλης (αργό στάδιο), η οποία
στη συνέχεια αντιδρά με αλογόνο (γρήγορο βήμα). Έτσι, το αλογόνο δεν είναι
εμπλέκονται στην ταχύτητα—καθοριστικό στάδιο
επεξεργάζομαι, διαδικασία.

Εάν μια καρβονυλική ένωση περιέχει πολλάένα -υδρογόνο
άτομα, τότε η αντικατάσταση κάθε επόμενου γίνεται πιο γρήγορα από την προηγούμενη,
λόγω της αύξησης της οξύτητάς τους υπό την επίδραση της επιρροής που έλκει τα ηλεκτρόνια
αλαγόνο. Σε αλκαλικό περιβάλλον δίνουν η ακεταλδεΰδη και οι μεθυλοκετόνες
παράγωγα τριαλογόνου, τα οποία στη συνέχεια αποσυντίθενται από περίσσεια αλκαλίων με
σχηματισμός τριαλομεθανίων ( αντίδραση αλοφορμίου)
.
Η διάσπαση της τριιωδοακετόνης συμβαίνει ως αντίδραση
πυρηνόφιλη υποκατάσταση. ομάδες CI 3 — ανιόν υδροξειδίου, όπως το SΝ -αντιδράσεις στην καρβοξυλομάδα (βλ. διάλεξη αρ. 12).
Το ιωδοφόρμιο καθιζάνει από το μίγμα της αντίδρασης στη μορφή
ωχροκίτρινο κρυσταλλικό ίζημα με χαρακτηριστική οσμή. Ιωδοφόρμιο
η αντίδραση χρησιμοποιείται για αναλυτικούς σκοπούς για την ανίχνευση ενώσεων του τύπου
CH 3 -CO-R, συμπεριλαμβανομένων
κλινικά εργαστήρια για τη διάγνωση του σακχαρώδους διαβήτη.
Αντιδράσεις συμπύκνωσης.
Παρουσία καταλυτικών ποσοτήτων οξέων
ή αλκάλια καρβονυλ ενώσεις που περιέχουνένα -άτομα υδρογόνου,
υποβάλλονται σε συμπύκνωση για να σχηματιστούνσι -υδροξυκαρβονυλικές ενώσεις.

Στην εκπαίδευση Συνδέσεις S-Sεμπλέκονται καρβονύλιο
άτομο άνθρακα ενός μορίου ( καρβονυλικό συστατικό) Καιένα -Το άτομο άνθρακα είναι διαφορετικό
μόρια ( συστατικό μεθυλενίου). Αυτή η αντίδραση ονομάζεται συμπύκνωση αλδόλης(με το όνομα του προϊόντος συμπύκνωσης της ακεταλδεΰδης -
αλδόλ).
Όταν το μίγμα της αντίδρασης θερμαίνεται, το προϊόν εύκολα
αφυδατώνεται για να σχηματιστεία, β -ακόρεστο καρβονύλιο
συνδέσεις.

Αυτός ο τύπος συμπύκνωσης ονομάζεται κρότο(με το όνομα του προϊόντος συμπύκνωσης της ακεταλδεΰδης - κρότον
αλδεγύδη).
Ας εξετάσουμε τον μηχανισμό της συμπύκνωσης αλδόλης
αλκαλικό περιβάλλον. Στο πρώτο στάδιο, το ανιόν υδροξειδίου αφαιρεί ένα πρωτόνιο απόένα - θέση καρβονυλίου
ενώσεις για το σχηματισμό ενός ενολικού ανιόντος. Στη συνέχεια το ενολικό ανιόν ως πυρηνόφιλο
επιτίθεται στο άτομο άνθρακα καρβονυλίου ενός άλλου μορίου καρβονυλικής ένωσης.
Το προκύπτον τετραεδρικό ενδιάμεσο (ανιόν αλκοξειδίου) είναι ισχυρό
βάση και αφαιρεί περαιτέρω ένα πρωτόνιο από το μόριο του νερού.

Κατά την αλδόλη συμπύκνωση δύο διαφορετικών
πιθανές ενώσεις καρβονυλίου (διασταυρούμενη αλδολική συμπύκνωση).
σχηματισμός 4 διαφορετικών προϊόντων. Ωστόσο, αυτό μπορεί να αποφευχθεί εάν ένα από τα
δεν περιέχει καρβονυλικές ενώσειςένα -άτομα υδρογόνου (για παράδειγμα, αρωματικές αλδεΰδες
ή φορμαλδεΰδη) και δεν μπορεί να δράσει ως συστατικό μεθυλενίου.

Ως συστατικό μεθυλενίου στις αντιδράσεις
Η συμπύκνωση μπορεί να είναι όχι μόνο ενώσεις καρβονυλίου, αλλά και άλλες
C-H-οξέα. Οι αντιδράσεις συμπύκνωσης έχουν παρασκευαστική αξία, αφού επιτρέπουν
επεκτείνει την αλυσίδα των ατόμων άνθρακα. Ανάλογα με τον τύπο της συμπύκνωσης αλδόλης και
αποσύνθεση ρετροαλδόλης (αντίστροφη διαδικασία) συμβαίνουν πολλές βιοχημικές αντιδράσεις
διεργασίες: γλυκόλυση, σύνθεση κιτρικού οξέος στον κύκλο του Krebs, σύνθεση νευραμινικού οξέος
οξέα.
2.3. Αντιδράσεις οξείδωσης και
ανάκτηση
Ανάκτηση
Οι καρβονυλικές ενώσεις ανάγεται σε
αλκοόλες ως αποτέλεσμα καταλυτικής υδρογόνωσης ή υπό την επίδραση
αναγωγικοί παράγοντες που είναι δότες ανιόντων υδριδίου.

[Η]: Η 2 /κατ., κατ. – Ni, Pt,
Pd;
LiAlH4; NaBH4.
Αναγωγή ενώσεων καρβονυλίου
σύμπλοκα υδρίδια μετάλλων περιλαμβάνει πυρηνόφιλη επίθεση της καρβονυλικής ομάδας
ανιόν υδριδίου. Η επακόλουθη υδρόλυση παράγει αλκοόλη.
Η ανάκτηση γίνεται με τον ίδιο τρόπο
καρβονυλική ομάδα in vivo υπό την επίδραση του συνενζύμου NADΝ, που είναι
δότης ιόντος υδριδίου (βλ. διάλεξη αρ. 19).
Οξείδωση
Οι αλδεΰδες οξειδώνονται πολύ εύκολα
τυχόν οξειδωτικά μέσα, ακόμη και τόσο αδύναμα όπως το οξυγόνο του αέρα και οι ενώσεις
ασήμι (Ι) και χαλκός(II).
Οι δύο τελευταίες αντιδράσεις χρησιμοποιούνται ως
ποιοτική για την ομάδα αλδεΰδης.
Παρουσία αλκαλίων, αλδεΰδες που δεν περιέχουνένα -άτομα υδρογόνου
δυσανάλογο να σχηματίσει αλκοόλη και οξύ (αντίδραση Cannizzaro).
2HCHO + NaOH ® HCOONa + CH 3 OH
Αυτός είναι ο λόγος που το υδατικό διάλυμα
Η φορμαλδεΰδη (φορμαλίνη) κατά τη μακροχρόνια αποθήκευση γίνεται όξινη
αντίδραση.
Οι κετόνες είναι ανθεκτικές στους οξειδωτικούς παράγοντες
ουδέτερο περιβάλλον. Σε όξινα και αλκαλικά περιβάλλοντα υπό την επίδραση ισχυρών
οξειδωτικά μέσα(KMnO 4 ) Αυτοί
οξειδώνονται σπάζοντας τον δεσμό C-C. Ο σκελετός άνθρακα διασπάται από
Ο διπλός δεσμός άνθρακα-άνθρακα ενόλης σχηματίζει μια ένωση καρβονυλίου, παρόμοια με
οξείδωση διπλών δεσμών σε αλκένια. Αυτό παράγει ένα μείγμα προϊόντων
που περιέχει καρβοξυλικά οξέα ή καρβοξυλικά οξέα και κετόνες.
Η οργανική χημεία είναι μια πολύ περίπλοκη αλλά ενδιαφέρουσα επιστήμη. Άλλωστε, συνδέσεις των ίδιων στοιχείων, σε διαφορετικές ποσότητεςκαι η αλληλουχία συμβάλλει στον σχηματισμό διαφόρων Ας δούμε ενώσεις της καρβονυλικής ομάδας που ονομάζονται «κετόνες» (χημικές ιδιότητες, φυσικά χαρακτηριστικά, μέθοδοι σύνθεσής τους). Θα τα συγκρίνουμε επίσης με άλλες ουσίες του ίδιου είδους - αλδεΰδες.
Κετόνες
Αυτή η λέξη είναι μια γενική ονομασία για μια ολόκληρη κατηγορία οργανικών ουσιών, στα μόρια των οποίων η καρβονυλική ομάδα (C=O) συνδέεται με δύο ρίζες άνθρακα.
Στη δομή τους, οι κετόνες είναι κοντά σε αλδεΰδες και καρβοξυλικά οξέα. Ωστόσο, περιέχουν δύο άτομα C (άνθρακα ή άνθρακα) συνδεδεμένα με C=O.
Τύπος
Ο γενικός τύπος ουσιών αυτής της κατηγορίας έχει ως εξής: R 1 -CO-R 2.
Για να γίνει πιο κατανοητό, κατά κανόνα, γράφεται έτσι.

Σε αυτό, το C=O είναι μια καρβονυλική ομάδα. Και τα R 1 και R 2 είναι ρίζες άνθρακα. Στη θέση τους μπορεί να υπάρχουν διάφορες ενώσεις, αλλά πρέπει να περιέχουν άνθρακα.
Αλδεΰδες και κετόνες
Οι φυσικές και χημικές ιδιότητες αυτών των ομάδων ουσιών είναι αρκετά παρόμοιες μεταξύ τους. Για το λόγο αυτό, θεωρούνται συχνά μαζί.

Το γεγονός είναι ότι οι αλδεΰδες περιέχουν επίσης μια καρβονυλική ομάδα στα μόριά τους. Έχουν μάλιστα πολύ παρόμοιες φόρμουλες με τις κετόνες. Ωστόσο, εάν στις υπό εξέταση ουσίες το C=O συνδέεται με 2 ρίζες, τότε στις αλδεΰδες υπάρχει μόνο μία, αντί για το δεύτερο - ένα άτομο υδρογόνου: R-CO-H.
Ως παράδειγμα, μπορούμε να δώσουμε τον τύπο μιας ουσίας αυτής της κατηγορίας - φορμαλδεΰδη, πιο γνωστή σε όλους ως φορμαλίνη.

Με βάση τον τύπο CH 2 O, είναι σαφές ότι η καρβονυλική του ομάδα συνδέεται όχι με ένα, αλλά με δύο άτομα Η ταυτόχρονα.
Φυσικές ιδιότητες
Πριν κατανοήσουμε τις χημικές ιδιότητες των αλδεΰδων και των κετονών, αξίζει να εξεταστούν οι φυσικές τους ιδιότητες.

- Οι κετόνες είναι εύτηκτα ή πτητικά υγρά. Οι κατώτεροι εκπρόσωποι αυτής της κατηγορίας είναι εξαιρετικά διαλυτοί σε H2O και αλληλεπιδρούν καλά με την προέλευσή τους.
Μεμονωμένοι εκπρόσωποι(για παράδειγμα, CH 3 COCH 3) είναι αξιοσημείωτα διαλυτά στο νερό και σε απολύτως οποιεσδήποτε αναλογίες.
Σε αντίθεση με τις αλκοόλες και τα καρβοξυλικά οξέα, οι κετόνες είναι πιο πτητικές, με το ίδιο μοριακό βάρος. Αυτό διευκολύνεται από την αδυναμία αυτών των ενώσεων να σχηματίσουν δεσμούς με το Η, όπως μπορεί το H-CO-R. - Διαφορετικοί τύποι αλδεΰδων μπορεί να υπάρχουν σε διαφορετικούς καταστάσεις συνάθροισης. Άρα υψηλότερα R-CO-H είναι αδιάλυτα στερεά. Τα κατώτερα είναι υγρά, μερικά από τα οποία αναμιγνύονται τέλεια με το H 2 O, αλλά μερικά από αυτά είναι διαλυτά μόνο στο νερό, αλλά όχι περισσότερο.
Η απλούστερη από αυτό το είδος ουσίας, η μυρμηκική αλδεΰδη, είναι ένα αέριο που έχει έντονη οσμή. Αυτή η ουσία είναι εξαιρετικά διαλυτή σε H2O.
Οι πιο διάσημες κετόνες
Υπάρχουν πολλές ουσίες R 1 -CO-R 2, αλλά δεν είναι πολλές από αυτές γνωστές. Πρώτα απ 'όλα, είναι η διμεθυλκετόνη, την οποία όλοι γνωρίζουμε ως ακετόνη.

Επίσης, συνάδελφός του διαλύτης είναι η βουτανόνη ή, όπως σωστά λέγεται, η μεθυλαιθυλοκετόνη.
Άλλες κετόνες των οποίων οι χημικές ιδιότητες χρησιμοποιούνται ενεργά στη βιομηχανία περιλαμβάνουν την ακετοφαινόνη (μεθυλφαινυλ κετόνη). Σε αντίθεση με το ασετόν και τη βουτανόνη, η μυρωδιά του είναι αρκετά ευχάριστη, γι' αυτό και χρησιμοποιείται στην αρωματοποιία.
Για παράδειγμα, η κυκλοεξανόνη είναι τυπικός εκπρόσωπος του R1-CO-R2 και χρησιμοποιείται συχνότερα στην παραγωγή διαλυτών.
Είναι αδύνατο να μην αναφέρουμε δικετόνες. Αυτό το όνομα δίνεται στο R 1 -CO-R 2, που έχουν όχι μία, αλλά δύο καρβονυλ ομάδες στη σύνθεσή τους. Έτσι, ο τύπος τους μοιάζει με: R 1 -CO-CO-R 2. Ένα από τα πιο απλά, αλλά ευρέως χρησιμοποιούμενο σε Βιομηχανία τροφίμωνεκπρόσωπος των δικετονών είναι το διακετύλιο (2,3-βουτανοδιόνη).
Οι αναφερόμενες ουσίες είναι απλώς ένας μικρός κατάλογος κετονών που συντίθενται από επιστήμονες (οι χημικές ιδιότητες συζητούνται παρακάτω). Στην πραγματικότητα, υπάρχουν περισσότερα από αυτά, αλλά δεν έχουν βρει όλα εφαρμογή. Επιπλέον, αξίζει να ληφθεί υπόψη ότι πολλά από αυτά είναι τοξικά.
Χημικές ιδιότητες κετονών
- Οι κετόνες είναι ικανές να προσθέτουν Η στον εαυτό τους (αντίδραση υδρογόνωσης). Ωστόσο, για να συμβεί αυτή η αντίδραση, είναι απαραίτητη η παρουσία καταλυτών με τη μορφή ατόμων μετάλλου νικελίου, κοβαλτίου, χαλκού, πλατίνας, παλλαδίου και άλλων. Ως αποτέλεσμα της αντίδρασης, το R1-CO-R2 εξελίσσεται σε δευτεροταγείς αλκοόλες.
Επίσης, όταν αλληλεπιδρά με υδρογόνο παρουσία αλκαλιμέταλλαή αμαλγάματα Mg, οι γλυκόλες λαμβάνονται από κετόνες. - Οι κετόνες που έχουν τουλάχιστον ένα άτομο άλφα-υδρογόνου τυπικά υφίστανται ταυτομερισμό κετο-ενόλης. Καταλύεται όχι μόνο από οξέα, αλλά και από βάσεις. Τυπικά, η κετομορφή είναι πιο σταθερή από την ενόλη. Αυτή η ισορροπία καθιστά δυνατή τη σύνθεση κετονών με ενυδάτωση αλκυνίων. Η σχετική σταθεροποίηση της ενολκετομορφής με σύζευξη οδηγεί σε μια μάλλον ισχυρή οξύτητα R1-CO-R2 (σε σύγκριση με αλκάνια).
- Αυτές οι ουσίες μπορεί να αντιδράσουν με την αμμωνία. Ωστόσο, προχωρούν πολύ αργά.
- Οι κετόνες αλληλεπιδρούν με τα προκύπτοντα α-υδροξυνιτρίλια, η σαπωνοποίηση των οποίων συμβάλλει στην εμφάνιση α-υδροξυοξέων.
- Η αντίδραση με αλογονίδια αλκυλομαγνήσιου οδηγεί στο σχηματισμό δευτεροταγών αλκοολών.
- Η προσθήκη στο NaHSO 3 προάγει τον σχηματισμό υδροθειωδών (διθειωδών) παραγώγων. Αξίζει να θυμηθούμε ότι μόνο οι μεθυλκετόνες είναι ικανές να αντιδράσουν στη σειρά λίπους.
Εκτός από τις κετόνες, οι αλδεΰδες μπορούν επίσης να αλληλεπιδράσουν με το υδροθειώδες νάτριο με παρόμοιο τρόπο.
Όταν θερμαίνεται με διάλυμα NaHCO 3 (μαγειρική σόδα) ή ανόργανο οξύ, τα παράγωγα NaHSO 3 μπορεί να αποσυντεθούν, απελευθερώνοντας ελεύθερη κετόνη. - Κατά την αντίδραση του R1-CO-R2 με ΝΗ2ΟΗ (υδροξυλαμίνη), σχηματίζονται κετοξίμες και Η2Ο ως παραπροϊόν.
- Σε αντιδράσεις που περιλαμβάνουν υδραζίνη, σχηματίζονται υδραζόνες (η αναλογία των ουσιών που λαμβάνονται είναι 1:1) ή αζίνες (1:2).
Εάν το προϊόν που λαμβάνεται από την αντίδραση (υδραζόνη) αντιδρά με καυστικό κάλιο υπό την επίδραση της θερμοκρασίας, το Ν και κορεσμένους υδρογονάνθρακες. Αυτή η διαδικασίαονομάζεται αντίδραση Kizhner. - Όπως αναφέρθηκε παραπάνω, οι αλδεΰδες και οι κετόνες έχουν παρόμοιες χημικές ιδιότητες και διαδικασίες παραγωγής. Σε αυτή την περίπτωση, σχηματίζονται ακετάλες R 1 -CO-R 2 που είναι πιο σύνθετες από τις ακετάλες R-CO-H. Εμφανίζονται ως αποτέλεσμα της δράσης των εστέρων του ορθοφορμικού και του ορθοπυριτικού οξέος στις κετόνες.
- Υπό συνθήκες με υψηλότερη συγκέντρωση αλκαλίων (για παράδειγμα, όταν θερμαίνεται με πυκνό H2SO4), το R1-CO-R2 υφίσταται διαμοριακή αφυδάτωση με το σχηματισμό ακόρεστων κετονών.
- Εάν υπάρχουν αλκάλια στην αντίδραση με R1-CO-R2, οι κετόνες υφίστανται συμπύκνωση αλδόλης. Ως αποτέλεσμα, σχηματίζονται β-κετοαλκοόλες, οι οποίες μπορούν εύκολα να χάσουν το μόριο H2O.
- Οι χημικές ιδιότητες των κετονών είναι αρκετά αποκαλυπτικές στο παράδειγμα της ακετόνης που αντιδρά με το μεσιτυλοξείδιο. Σε αυτή την περίπτωση, σχηματίζεται μια νέα ουσία που ονομάζεται "phoron".
- Επίσης στις χημικές ιδιότητες του θέματος οργανική ύλημπορεί να αποδοθεί στην αντίδραση Leuckart-Wallach, η οποία προάγει τη μείωση των κετονών.
Από τι λαμβάνεται το R1-CO-R2;
Έχοντας εξοικειωθεί με τις ιδιότητες των εν λόγω ουσιών, αξίζει να μάθετε τις πιο κοινές μεθόδους σύνθεσής τους.
- Μία από τις πιο γνωστές αντιδράσεις για την παραγωγή κετονών είναι η αλκυλίωση και η ακυλίωση αρωματικές ενώσειςπαρουσία όξινων καταλυτών (AlCl3, FeCI3, ανόργανα οξέα, οξείδια, ρητίνες ανταλλαγής κατιόντων, κ.λπ.). Αυτή η μέθοδοςγνωστή ως αντίδραση Friedel-Crafts.
- Οι κετόνες συντίθενται με υδρόλυση κετιμινών και βικ-διολών. Στην περίπτωση του τελευταίου είναι απαραίτητη η παρουσία καταλυτών.
- Επίσης, για τη λήψη κετονών χρησιμοποιείται η ενυδάτωση ομολόγων ακετυλενίου ή όπως λέγεται η αντίδραση Kucherov.
- Αντιδράσεις Guben-Gesch.
- Η κυκλοποίηση Ruzicka είναι κατάλληλη για τη σύνθεση κυκλοκετονών.
- Επίσης, αυτές οι ουσίες εξάγονται από τριτοταγείς υπεροξοαιθέρες χρησιμοποιώντας την αναδιάταξη Krige.
- Υπάρχουν διάφοροι τρόποι σύνθεσης κετονών κατά τις αντιδράσεις οξείδωσης δευτεροταγών αλκοολών. Ανάλογα με τη δραστική ένωση, διακρίνονται 4 αντιδράσεις: Swern, Kornblum, Corey-Kim και Parik-Dering.
Πεδίο εφαρμογής
Έχοντας κατανοήσει τις χημικές ιδιότητες και την παραγωγή των κετονών, αξίζει να μάθετε πού χρησιμοποιούνται αυτές οι ουσίες.

Όπως προαναφέρθηκε, τα περισσότερα από αυτά χρησιμοποιούνται στη χημική βιομηχανία ως διαλύτες για βερνίκια και σμάλτα, καθώς και στην παραγωγή πολυμερών.
Επιπλέον, μερικά R1-CO-R2 έχουν αποδειχθεί καλά ως αρωματικοί παράγοντες. Με αυτή την ιδιότητα, οι κετόνες (βενζοφαινόνη, ακετοφαινόνη και άλλες) χρησιμοποιούνται στην αρωματοποιία και τη μαγειρική.
Η ακετοφαινόνη χρησιμοποιείται επίσης ως συστατικό για την παρασκευή υπνωτικών χαπιών.

Η βενζοφαινόνη, λόγω της ικανότητάς της να απορροφά την επιβλαβή ακτινοβολία, είναι κοινό συστατικό των αντιμαυρικών καλλυντικών και ταυτόχρονα συντηρητικό.
Επιδράσεις του R1-CO-R2 στο σώμα
Έχοντας μάθει τι είδους ενώσεις ονομάζονται κετόνες (χημικές ιδιότητες, εφαρμογή, σύνθεση και άλλα δεδομένα σχετικά με αυτές), αξίζει να εξοικειωθείτε με τα βιολογικά χαρακτηριστικά αυτών των ουσιών. Με άλλα λόγια, μάθετε πώς ενεργούν στους ζωντανούς οργανισμούς.
Παρά την αρκετά συχνή χρήση του R 1 -CO-R 2 στη βιομηχανία, αξίζει πάντα να θυμόμαστε ότι τέτοιες ενώσεις είναι πολύ τοξικές. Πολλά από αυτά έχουν καρκινογόνες και μεταλλαξιογόνες ιδιότητες.
Ειδικοί εκπρόσωποι μπορεί να προκαλέσουν ερεθισμό στους βλεννογόνους, ακόμη και εγκαύματα. Το αλεικυκλικό R 1 -CO-R 2 μπορεί να δράσει στο σώμα σαν φάρμακα.
Ωστόσο, δεν είναι όλες οι ουσίες αυτού του είδους επιβλαβείς. Το γεγονός είναι ότι μερικά από αυτά παίρνουν ενεργό μέρος στο μεταβολισμό των βιολογικών οργανισμών.
Επίσης, οι κετόνες είναι μοναδικοί δείκτες διαταραχών του μεταβολισμού του άνθρακα και ανεπάρκειας ινσουλίνης. Κατά την ανάλυση ούρων και αίματος, η παρουσία του R 1 -CO-R 2 υποδεικνύει διάφορες μεταβολικές διαταραχές, συμπεριλαμβανομένης της υπεργλυκαιμίας και της κετοξέωσης.
Αλδεΰδες είναι ενώσεις των οποίων τα μόρια περιέχουν μια ομάδα καρβονυλίου συνδεδεμένη με ένα άτομο υδρογόνου, δηλ. ο γενικός τύπος των αλδεΰδων μπορεί να γραφτεί ως
όπου το R είναι μια ρίζα υδρογονάνθρακα, η οποία μπορεί να είναι ποικίλου βαθμού κορεσμού, για παράδειγμα, κορεσμένη ή αρωματική.
Η ομάδα –CHO ονομάζεται αλδεΰδη.
Κετόνες – ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ, τα μόρια του οποίου περιέχουν μια ομάδα καρβονυλίου συνδεδεμένη με δύο ρίζες υδρογονάνθρακα. Ο γενικός τύπος για τις κετόνες μπορεί να γραφτεί ως εξής:
όπου τα R και R' είναι ρίζες υδρογονάνθρακα, για παράδειγμα, κορεσμένες (αλκυλ) ή αρωματικές.
Υδρογόνωση αλδεΰδων και κετονών
Οι αλδεΰδες και οι κετόνες μπορούν να αναχθούν με υδρογόνο παρουσία καταλυτών και θέρμανση σε πρωτοταγείς και δευτεροταγείς αλκοόλες, αντίστοιχα:
Οξείδωση αλδεΰδης
Οι αλδεΰδες μπορούν εύκολα να οξειδωθούν ακόμη και με ήπιους οξειδωτικούς παράγοντες όπως το υδροξείδιο του χαλκού και το διάλυμα αμμωνίας του οξειδίου του αργύρου.
Όταν το υδροξείδιο του χαλκού και η αλδεΰδη θερμαίνονται, το αρχικό μπλε χρώμα του μείγματος της αντίδρασης εξαφανίζεται και σχηματίζεται ένα ίζημα οξειδίου του χαλκού σε κόκκινο τούβλο:
Στην αντίδραση με ένα διάλυμα αμμωνίας οξειδίου του αργύρου, αντί για το ίδιο το καρβοξυλικό οξύ, σχηματίζεται το άλας αμμωνίου του, καθώς η αμμωνία στο διάλυμα αντιδρά με οξέα:
Οι κετόνες δεν αντιδρούν με υδροξείδιο του χαλκού (II) και με διάλυμα αμμωνίας οξειδίου του αργύρου. Για το λόγο αυτό, αυτές οι αντιδράσεις είναι ποιοτικές για τις αλδεΰδες. Έτσι η αντίδραση με ένα διάλυμα αμμωνίας οξειδίου του αργύρου στο σωστή τεχνικήη εφαρμογή του οδηγεί στο σχηματισμό ενός χαρακτηριστικού ασημένιου καθρέφτη στην εσωτερική επιφάνεια του δοχείου αντίδρασης.
Προφανώς, εάν ήπιοι οξειδωτικοί παράγοντες μπορούν να οξειδώσουν αλδεΰδες, τότε ισχυρότεροι οξειδωτικοί παράγοντες, για παράδειγμα, υπερμαγγανικό κάλιο ή διχρωμικό κάλιο, μπορούν φυσικά να κάνουν το ίδιο. Όταν αυτοί οι οξειδωτικοί παράγοντες χρησιμοποιούνται παρουσία οξέων, σχηματίζονται καρβοξυλικά οξέα:
Χημικές ιδιότητες καρβοξυλικών οξέων
Καρβοξυλικά οξέα είναι παράγωγα υδρογονανθράκων που περιέχουν μία ή περισσότερες καρβοξυλομάδες.
Ομάδες καρβοξυλίουΕΝΑ:
Όπως μπορείτε να δείτε, η καρβοξυλική ομάδα αποτελείται από μια ομάδα καρβονυλίου –C(O)- συνδεδεμένη με μια ομάδα υδροξυλίου –ΟΗ.
Λόγω του γεγονότος ότι μια ομάδα καρβονυλίου συνδέεται άμεσα με την ομάδα υδροξυλίου, η οποία έχει αρνητική επαγωγική επίδραση Σύνδεση O-Hείναι πιο πολικό από ό,τι στις αλκοόλες και τις φαινόλες. Για το λόγο αυτό, τα καρβοξυλικά οξέα είναι αισθητά πιο έντονα από τις αλκοόλες και τις φαινόλες, όξινες ιδιότητες. ΣΕ υδατικά διαλύματαπαρουσιάζουν τις ιδιότητες των ασθενών οξέων, δηλ. διασπώνται αναστρέψιμα σε κατιόντα υδρογόνου (Η+) και ανιόντα υπολειμμάτων οξέος:
Αντιδράσεις σχηματισμού άλατος
Για να σχηματίσουν άλατα, τα καρβοξυλικά οξέα αντιδρούν με:
1) μέταλλα σε υδρογόνο στη σειρά δραστηριότητας:
2) αμμωνία
3) βασικά και αμφοτερικά οξείδια:
4) βασικά και αμφοτερικά υδροξείδια μετάλλων:
5) άλατα ασθενέστερων οξέων - ανθρακικά και διττανθρακικά, σουλφίδια και υδροσουλφίδια, ανώτερα άλατα (με ένας μεγάλος αριθμόςάτομα άνθρακα σε ένα μόριο) οξέα:
Οι συστηματικές και ασήμαντες ονομασίες ορισμένων οξέων και των αλάτων τους παρουσιάζονται στον ακόλουθο πίνακα:
| όξινη φόρμουλα | Οξύ όνομα ασήμαντο/συστηματικό | Αλάτι όνομα τετριμμένο/συστηματικό |
| HCOOH | μυρμηκικό / μεθάνιο | μυρμηκικό/μεθανοϊκό |
| CH3COOH | οξικό/αιθάνιο | οξικό/αιθανοϊκό |
| CH3CH2COOH | προπιονικό/προπάνιο | προπιονικός/προπανικός |
| CH 3 CH 2 CH 2 COOH | λάδι/βουτάνιο | βουτυρικό/βουτανοϊκό |
Το αντίθετο πρέπει επίσης να θυμόμαστε: τα ισχυρά ορυκτά οξέα εκτοπίζουν τα καρβοξυλικά οξέα από τα άλατά τους ως ασθενέστερα:
Αντιδράσεις που αφορούν την ομάδα ΟΗ
Καρβοξυλικά οξέαεισέρχονται σε αντίδραση εστεροποίησης με μονοϋδρικές και πολυϋδρικές αλκοόλες παρουσία ισχυρών ανόργανα οξέα, στην περίπτωση αυτή σχηματίζονται εστέρες:
Αυτός ο τύπος αντίδρασης είναι αναστρέψιμος, και επομένως, προκειμένου να μετατοπιστεί η ισορροπία προς το σχηματισμό αστήρΘα πρέπει να πραγματοποιούνται με απόσταξη του πιο πτητικού εστέρα με θέρμανση.
Το αντίστροφο της αντίδρασης εστεροποίησης ονομάζεται υδρόλυση εστέρα:
Αυτή η αντίδραση συμβαίνει μη αναστρέψιμα παρουσία αλκαλίων, καθώς το προκύπτον οξύ αντιδρά με το υδροξείδιο του μετάλλου για να σχηματίσει ένα άλας:
Αντιδράσεις υποκατάστασης ατόμων υδρογόνου σε υποκαταστάτη υδρογονάνθρακα
Κατά τη διεξαγωγή αντιδράσεων ανθρακικών αλάτων με χλώριο ή βρώμιο παρουσία κόκκινου φωσφόρου, κατά τη θέρμανση, τα άτομα υδρογόνου στο άτομο α-άνθρακα αντικαθίστανται από άτομα αλογόνου:
Στην περίπτωση υψηλότερης αναλογίας αλογόνου/οξέος, μπορεί να συμβεί βαθύτερη χλωρίωση:
Αντιδράσεις καταστροφής της καρβοξυλικής ομάδας (αποκαρβοξυλίωση)
Ειδικές χημικές ιδιότητες του μυρμηκικού οξέος
Το μόριο του μυρμηκικού οξέος, παρά το μικρό του μέγεθος, περιέχει δύο λειτουργικές ομάδες:
Από αυτή την άποψη, εμφανίζει όχι μόνο τις ιδιότητες των οξέων, αλλά και τις ιδιότητες των αλδεΰδων:
Όταν εκτίθεται σε πυκνό θειικό οξύ, το μυρμηκικό οξύ αποσυντίθεται σε νερό και μονοξείδιο του άνθρακα.
Οι αλδεΰδες και οι κετόνες είναι παράγωγα υδρογονανθράκων των οποίων τα μόρια περιέχουν μια ομάδα καρβονυλίου. Οι αλδεΰδες διαφέρουν στη δομή από τις κετόνες στη θέση της καρβονυλικής ομάδας. ΣΧΕΤΙΚΑ ΜΕ φυσικές ιδιότητεςΟι αλδεΰδες και οι κετόνες, καθώς και η ταξινόμηση και η ονοματολογία τους, συζητούνται σε αυτό το άρθρο.
Φυσικές ιδιότητες
Σε αντίθεση με τις αλκοόλες και τις φαινόλες, οι αλδεΰδες και οι κετόνες δεν χαρακτηρίζονται από το σχηματισμό δεσμών υδρογόνου, γι' αυτό και τα σημεία βρασμού και τήξης τους είναι πολύ χαμηλότερα. Έτσι, η φορμαλδεΰδη είναι αέριο· η ακεταλδεΰδη βράζει σε θερμοκρασία 20,8 βαθμών, ενώ η μεθανόλη βράζει σε θερμοκρασία 64,7 βαθμών. Παρόμοια με τη φαινόλη - κρυσταλλική ουσίακαι η βενζαλδεΰδη είναι υγρό.
Η φορμαλδεΰδη είναι ένα άχρωμο αέριο με έντονη οσμή. Τα υπόλοιπα μέλη της σειράς αλδεΰδων είναι υγρά και οι ανώτερες αλδεΰδες είναι στερεά. Τα κατώτερα μέλη της σειράς (φορμαλδεΰδη, ακεταλδεΰδη) είναι διαλυτά στο νερό και έχουν έντονη οσμή. Οι ανώτερες αλδεΰδες είναι εξαιρετικά διαλυτές στους περισσότερους οργανικούς διαλύτες (αλκοόλες, αιθέρες), οι αλδεΰδες C 3 - C 8 έχουν πολύ δυσάρεστη οσμή και οι υψηλότερες αλδεΰδες χρησιμοποιούνται στην αρωματοποιία λόγω των λουλουδιών τους.

Ρύζι. 1. Πίνακας ταξινόμησης αλδεΰδων και κετονών.
Ο γενικός τύπος των αλδεΰδων και κετονών έχει ως εξής:
- τύπος αλδεΰδης – R-COH
- τύπος κετόνης – R-CO-R
Ταξινόμηση και ονοματολογία
Οι αλδεΰδες και οι κετόνες διαφέρουν ως προς τον τύπο της ανθρακικής αλυσίδας που περιέχει την ομάδα καρβονυλίου. Ας εξετάσουμε τις λιπαρές και αρωματικές ενώσεις:
- άκυκλος, όριο. Το πρώτο μέλος της ομόλογης σειράς αλδεΰδων είναι η μυρμηκική αλδεΰδη (φορμαλδεΰδη, μεθανάλη) – CH 2 =O.
Η μυρμηκική αλδεΰδη χρησιμοποιείται ως αντισηπτικό. Χρησιμοποιείται για την απολύμανση των χώρων και την επεξεργασία σπόρων.
Το δεύτερο μέλος της σειράς αλδεΰδης είναι η ακεταλδεΰδη (ακεταλδεΰδη, αιθανάλη). Χρησιμοποιείται ως ενδιάμεσο στη σύνθεση οξικό οξύΚαι εθυλική αλκοόληαπό ασετυλίνη.

Ρύζι. 2. Τύπος: ακεταλδεΰδη.
- απεριόριστος. Είναι απαραίτητο να αναφέρουμε μια τέτοια ακόρεστη αλδεΰδη όπως η ακρολεΐνη (προπενάλη). Αυτή η αλδεΰδη σχηματίζεται κατά τη θερμική αποσύνθεση της γλυκερίνης και των λιπών, αναπόσπαστο μέροςπου είναι η γλυκερίνη.
- αρωματικός. Το πρώτο μέλος της ομόλογης σειράς αρωματικών αλδεΰδων είναι η βενζολοαλδεΰδη (βενζαλδεΰδη). Μπορείτε επίσης να σημειώσετε μια αλδεΰδη φυτικής προέλευσης όπως η βανιλίνη (3-μεθοξυ-4-υδροξυβενζαλδεΰδη).

Ρύζι. 3. Φόρμουλα βανιλίνης.
Οι κετόνες μπορεί να είναι καθαρά αρωματικές ή λιπαρές-αρωματικές. Για παράδειγμα, η διφαινυλκετόνη (βενζοφαινόνη) είναι καθαρά αρωματική. Το λιπαρό αρωματικό είναι, για παράδειγμα, η μεθυλφαινυλ κετόνη (ακετοφαινόνη)
Τι μάθαμε;
Στα μαθήματα χημείας της 10ης τάξης, η πιο σημαντική εργασία είναι η μελέτη αλδεΰδων και κετόνων. Στις αλδεΰδες, το άτομο άνθρακα της ομάδας καρβονυλίου είναι πρωτογενές και στις κετόνες είναι δευτερεύον. Επομένως, στις αλδεΰδες, η καρβονυλική ομάδα συνδέεται πάντα με ένα άτομο υδρογόνου. Η ομάδα αλδεΰδης έχει περισσότερα χημική δραστηριότητααπό την κετόνη, ειδικά στις αντιδράσεις οξείδωσης.
Δοκιμή για το θέμα
Αξιολόγηση της έκθεσης
Μέση βαθμολογία: 4.2. Συνολικές βαθμολογίες που ελήφθησαν: 166.