Oksidlanish darajasi - oksidlanish-qaytarilish reaktsiyalarini qayd qilish uchun ishlatiladigan shartli qiymat. Oksidlanish darajasini aniqlash uchun kimyoviy elementlarning oksidlanish jadvali qo'llaniladi.
Ma'nosi
Asosiy kimyoviy elementlarning oksidlanish darajasi ularning elektromanfiyligiga asoslanadi. Qiymat birikmalarda almashtirilgan elektronlar soniga teng.
Oksidlanish darajasi musbat deb hisoblanadi, agar elektronlar atomdan joy almashtirilsa, ya'ni. element birikmadagi elektronlarni beradi va qaytaruvchi vositadir. Bu elementlarga metallar kiradi, ularning oksidlanish darajasi har doim ijobiy bo'ladi.
Elektron atom tomon siljiganida, qiymat manfiy, element esa oksidlovchi vosita hisoblanadi. Atom elektronlarni tashqi energiya darajasi tugaguniga qadar qabul qiladi. Aksariyat metall bo'lmaganlar oksidlovchi moddalardir.
Reaksiyaga kirmaydigan oddiy moddalar har doim nol oksidlanish darajasiga ega.

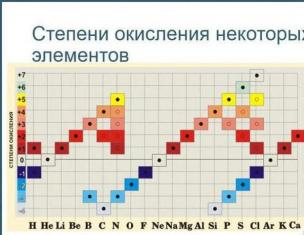
Guruch. 1. Oksidlanish darajalari jadvali.
Murakkabda elektromanfiyligi past bo'lgan metall bo'lmagan atom ijobiy oksidlanish darajasiga ega.
Ta'rif
Mendeleyev davriy jadvalidan foydalanib, maksimal va minimal oksidlanish darajasini (atom qancha elektron berishi va olishi mumkin) aniqlashingiz mumkin.
Maksimal quvvat element joylashgan guruh soniga yoki valent elektronlar soniga teng. Minimal qiymat quyidagi formula bo'yicha aniqlanadi:
No (guruhlar) - 8.

Guruch. 2. Davriy jadval.
Uglerod to'rtinchi guruhga kiradi, shuning uchun uning eng yuqori oksidlanish darajasi +4, eng pasti esa -4. Oltingugurtning maksimal oksidlanish darajasi +6, minimal -2. Aksariyat metall bo'lmaganlar har doim o'zgaruvchan - ijobiy va salbiy - oksidlanish darajasiga ega. Istisno ftordir. Uning oksidlanish darajasi har doim -1 ga teng.
Shuni esda tutish kerakki, ushbu qoida mos ravishda I va II guruhlarning gidroksidi va gidroksidi tuproq metallariga taalluqli emas. Bu metallar doimiy musbat oksidlanish darajasiga ega - litiy Li +1, natriy Na +1, kaliy K +1, berilliy Be +2, magniy Mg +2, kaltsiy Ca +2, stronsiy Sr +2, bariy Ba +2. Boshqa metallar turli xil oksidlanish darajasini ko'rsatishi mumkin. Istisno alyuminiydir. III guruhda bo'lishiga qaramay, uning oksidlanish darajasi har doim +3 ni tashkil qiladi.

Guruch. 3. Ishqoriy va ishqoriy yer metallari.
VIII guruhdan faqat ruteniy va osmiy eng yuqori oksidlanish darajasini +8 ko'rsatishi mumkin. I guruhga kiruvchi oltin va misning oksidlanish darajasi mos ravishda +3 va +2 ga teng.
Yozib olish
Oksidlanish holatini to'g'ri qayd etish uchun siz bir nechta qoidalarni eslab qolishingiz kerak:
- inert gazlar reaksiyaga kirishmaydi, shuning uchun ularning oksidlanish darajasi har doim nolga teng;
- birikmalarda o'zgaruvchan oksidlanish darajasi o'zgaruvchan valentlikka va boshqa elementlar bilan o'zaro ta'sirga bog'liq;
- metallar bilan birikmalarda vodorod manfiy oksidlanish darajasini ko'rsatadi - Ca +2 H 2 -1, Na +1 H -1;
- kislorod har doim -2 oksidlanish darajasiga ega, kislorod ftorid va peroksiddan tashqari - O +2 F 2 -1, H 2 +1 O 2 -1.
Biz nimani o'rgandik?
Oksidlanish darajasi - element atomi birikmada qancha elektron olgan yoki berganligini ko'rsatadigan shartli qiymat. Qiymat valentlik elektronlar soniga bog'liq. Aralashmalardagi metallar har doim ijobiy oksidlanish holatiga ega, ya'ni. restavratorlardir. Ishqoriy va ishqoriy tuproq metallari uchun oksidlanish darajasi har doim bir xil bo'ladi. Ftordan tashqari metall bo'lmaganlar musbat va manfiy oksidlanish darajasini olishlari mumkin.
Mavzu viktorina
Hisobotni baholash
O'rtacha reyting: 4.5. Qabul qilingan umumiy baholar: 247.
Valentlik (lot. valere — maʼnoga ega boʻlmoq) kimyoviy elementning bir atom hosil qilishi mumkin boʻlgan alohida kimyoviy bogʻlanishlar soniga teng boʻlgan “bogʻlanish qobiliyati” oʻlchovidir.
Valentlik bir atomning boshqa atomlar bilan hosil qiladigan aloqalar soni bilan belgilanadi. Masalan, molekulani ko'rib chiqing
Valentlikni aniqlash uchun siz moddalarning grafik formulalari haqida yaxshi tasavvurga ega bo'lishingiz kerak. Ushbu maqolada siz ko'plab formulalarni ko'rasiz. Men sizga doimiy valentlikka ega kimyoviy elementlar haqida ham ma'lumot beraman, ularni bilish juda foydali.

Elektron nazariyada bog'lanish valentligi erdagi yoki qo'zg'aluvchan holatdagi juftlanmagan (valentlik) elektronlar soni bilan belgilanadi, deb ishoniladi. Biz valent elektronlar va atomning hayajonlangan holati mavzusiga to'xtaldik. Fosfor misolidan foydalanib, to'liq tushunish uchun ushbu ikki mavzuni birlashtiramiz.

Kimyoviy elementlarning katta qismi o'zgaruvchan valentlik qiymatiga ega. O'zgaruvchan valentlik mis, temir, fosfor, xrom va oltingugurtga xosdir.
Quyida valentligi o'zgaruvchan elementlar va ularning birikmalarini ko'rasiz. E'tibor bering, boshqa elementlar bizga ularning doimiy bo'lmagan valentligini aniqlashga yordam beradi - doimiy valentlik bilan.

Esda tutingki, ba'zi oddiy moddalar uchun valentlik qiymatlarni oladi: III - azot uchun, II - kislorod uchun. Azot, kislorod, karbonat angidrid va uglerod oksidi, natriy karbonat, litiy fosfat, temir (II) sulfat va kaliy asetatning grafik formulalarini yozish orqali olingan bilimlarni umumlashtiramiz.

Siz sezganingizdek, valentliklar rim raqamlari bilan ko'rsatilgan: I, II, III va boshqalar. Taqdim etilgan formulalar bo'yicha moddalarning valentliklari teng:
- N-III
- O-II
- H, Na, K, li - I
- S-VI
- C - II (karbon monoksit CO ), IV (karbonat angidrid CO 2 va natriy karbonat Na 2 CO 3 da)
- Fe-II
Oksidlanish darajasi (CO) - bu birikmadagi atomning zaryadini va uning OVR (qaytarilish-qaytarilish reaktsiyasi)dagi harakatini tavsiflovchi shartli ko'rsatkich. Oddiy moddalarda CO har doim nolga teng, murakkab moddalarda u ba'zi elementlarning doimiy oksidlanish darajalariga qarab aniqlanadi.
Raqamli bo'lib, oksidlanish darajasi atomga tegishli bo'lishi mumkin bo'lgan shartli zaryadga teng bo'lib, bog'lanish hosil qiluvchi barcha elektronlar ko'proq elektronegativ elementga o'tgan degan taxminga asoslanadi.
Oksidlanish darajasini aniqlab, shartli zaryadni bir elementga "+", ikkinchisiga esa "-" belgilaymiz. Bu elektronegativlik bilan bog'liq - atomning elektronlarni o'ziga jalb qilish qobiliyati. "+" belgisi elektronlarning etishmasligini va "-" - ularning ortiqchaligini anglatadi. Takror aytaman, CO shartli tushunchadir.

Molekuladagi barcha oksidlanish darajalarining yig'indisi nolga teng - bu o'z-o'zini tekshirish uchun eslash muhimdir.
Davriy sistemaning davrlari va guruhlarida elektron manfiylikning o'zgarishini bilish D.I. Mendeleev, qaysi element "+" va qaysi minusni oladi degan xulosaga kelishimiz mumkin. Doimiy oksidlanish darajasi bo'lgan elementlar ham bu masalada yordam beradi.
Kim ko'proq elektronegativ bo'lsa, u elektronlarni o'ziga kuchliroq tortadi va "minusga kiradi". Elektronlarini hadya qilgan va ularning etishmasligini boshdan kechirganlar "+" belgisini oladilar.

Quyidagi moddalardagi atomlarning oksidlanish darajalarini mustaqil ravishda aniqlang: RbOH, NaCl, BaO, NaClO 3, SO 2 Cl 2, KMnO 4, Li 2 SO 3, O 2, NaH 2 PO 4. Quyida ushbu muammoning yechimini topasiz.
Elektromanfiylik qiymatini davriy jadval bo'yicha solishtiring va, albatta, o'z intuitsiyangizdan foydalaning :) Biroq, kimyoni o'rganayotganda, oksidlanish holatlari haqidagi aniq bilimlar hatto eng rivojlangan sezgi o'rnini bosishi kerak ;-)

Men ayniqsa ionlar mavzusini ta'kidlamoqchiman. Ion - bu bir yoki bir nechta elektronning yo'qolishi yoki ortishi tufayli musbat yoki manfiy zaryad olgan (va) atom yoki atomlar guruhi.
Iondagi atomlarning CO ni aniqlashda molekuladagi kabi ionning umumiy zaryadini "0" ga etkazishga harakat qilmaslik kerak. Ionlar eruvchanlik jadvalida berilgan, ular turli zaryadlarga ega - ionni bunday zaryadga keltirish kerak. Men misol bilan tushuntiraman.

© Bellevich Yuriy Sergeevich 2018-2020
Ushbu maqola Yuriy Sergeevich Bellevich tomonidan yozilgan va uning intellektual mulki hisoblanadi. Mualliflik huquqi egasining oldindan roziligisiz ma'lumotlar va ob'ektlardan nusxa olish, tarqatish (shu jumladan Internetdagi boshqa saytlar va resurslarga nusxa ko'chirish yo'li bilan) yoki boshqa har qanday tarzda foydalanish qonun bilan jazolanadi. Maqola materiallarini va ulardan foydalanishga ruxsat olish uchun murojaat qiling
Oksidlanish darajasi - bu birikmadagi kimyoviy element atomlarining shartli zaryadi bo'lib, barcha bog'lanishlar ion tipiga ega degan taxmindan kelib chiqadi. Oksidlanish darajalari ijobiy, manfiy yoki nol qiymatga ega bo'lishi mumkin, shuning uchun molekuladagi elementlarning oksidlanish darajalarining algebraik yig'indisi, ularning atomlari sonini hisobga olgan holda, 0 ga, ionda esa ionning zaryadidir. .
Oksidlanish darajalarining ushbu ro'yxati Mendeleyev davriy sistemasidagi kimyoviy elementlarning barcha ma'lum oksidlanish darajalarini ko'rsatadi. Ro'yxat barcha qo'shimchalar bilan Greenwood jadvaliga asoslangan. Rang bilan ta'kidlangan chiziqlarga oksidlanish darajasi nolga teng bo'lgan inert gazlar kiritiladi.
| 1 | −1 | H | +1 | ||||||||||
| 2 | U | ||||||||||||
| 3 | Li | +1 | |||||||||||
| 4 | -3 | Bo'l | +1 | +2 | |||||||||
| 5 | −1 | B | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | O | +1 | +2 | ||||||||
| 9 | −1 | F | +1 | ||||||||||
| 10 | Yo'q | ||||||||||||
| 11 | −1 | Na | +1 | ||||||||||
| 12 | mg | +1 | +2 | ||||||||||
| 13 | Al | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ar | ||||||||||||
| 19 | K | +1 | |||||||||||
| 20 | Ca | +2 | |||||||||||
| 21 | sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ti | +2 | +3 | +4 | ||||||||
| 23 | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | co | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Ni | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Ga | +1 | +2 | +3 | |||||||||
| 32 | −4 | Ge | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | Sifatida | +2 | +3 | +5 | ||||||||
| 34 | −2 | Se | +2 | +4 | +6 | ||||||||
| 35 | −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | kr | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | Sr | +2 | |||||||||||
| 39 | Y | +1 | +2 | +3 | |||||||||
| 40 | Zr | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Nb | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Ag | +1 | +2 | +3 | |||||||||
| 48 | CD | +2 | |||||||||||
| 49 | In | +1 | +2 | +3 | |||||||||
| 50 | −4 | sn | +2 | +4 | |||||||||
| 51 | −3 | Sb | +3 | +5 | |||||||||
| 52 | −2 | Te | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | I | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ba | +2 | |||||||||||
| 57 | La | +2 | +3 | ||||||||||
| 58 | Ce | +2 | +3 | +4 | |||||||||
| 59 | Pr | +2 | +3 | +4 | |||||||||
| 60 | Nd | +2 | +3 | ||||||||||
| 61 | Pm | +3 | |||||||||||
| 62 | sm | +2 | +3 | ||||||||||
| 63 | EI | +2 | +3 | ||||||||||
| 64 | Gd | +1 | +2 | +3 | |||||||||
| 65 | Tb | +1 | +3 | +4 | |||||||||
| 66 | Dy | +2 | +3 | ||||||||||
| 67 | Xo | +3 | |||||||||||
| 68 | Ha | +3 | |||||||||||
| 69 | Tm | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Lu | +3 | |||||||||||
| 72 | hf | +2 | +3 | +4 | |||||||||
| 73 | −1 | Ta | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | V | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Au | +1 | +2 | +3 | +5 | |||||||
| 80 | hg | +1 | +2 | +4 | |||||||||
| 81 | Tl | +1 | +3 | ||||||||||
| 82 | −4 | Pb | +2 | +4 | |||||||||
| 83 | −3 | Bi | +3 | +5 | |||||||||
| 84 | −2 | Po | +2 | +4 | +6 | ||||||||
| 85 | −1 | Da | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | Fr | +1 | |||||||||||
| 88 | Ra | +2 | |||||||||||
| 89 | AC | +3 | |||||||||||
| 90 | Th | +2 | +3 | +4 | |||||||||
| 91 | Pa | +3 | +4 | +5 | |||||||||
| 92 | U | +3 | +4 | +5 | +6 | ||||||||
| 93 | Np | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Pu | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Am | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | sm | +3 | +4 | ||||||||||
| 97 | bk | +3 | +4 | ||||||||||
| 98 | qarang | +2 | +3 | +4 | |||||||||
| 99 | Es | +2 | +3 | ||||||||||
| 100 | fm | +2 | +3 | ||||||||||
| 101 | md | +2 | +3 | ||||||||||
| 102 | yo'q | +2 | +3 | ||||||||||
| 103 | lr | +3 | |||||||||||
| 104 | RF | +4 | |||||||||||
| 105 | Db | +5 | |||||||||||
| 106 | Sg | +6 | |||||||||||
| 107 | bh | +7 | |||||||||||
| 108 | hs | +8 |
Elementning eng yuqori oksidlanish darajasi ushbu element joylashgan davriy tizimning guruh raqamiga to'g'ri keladi (istisnolar: Au + 3 (I guruh), Cu + 2 (II), VIII guruhdan, oksidlanish darajasi +8 faqat osmiy Os va rutenium Ruda bo'lishi mumkin.
Metalllarning birikmalardagi oksidlanish darajalari
Metalllarning birikmalardagi oksidlanish darajalari har doim ijobiy bo'ladi, lekin agar biz metall bo'lmaganlar haqida gapiradigan bo'lsak, ularning oksidlanish darajasi uning qaysi atomga bog'langanligiga bog'liq:
- agar metall bo'lmagan atom bo'lsa, oksidlanish darajasi ham ijobiy, ham salbiy bo'lishi mumkin. Bu elementlar atomlarining elektronegativligiga bog'liq;
- agar metall atomi bo'lsa, oksidlanish darajasi manfiy.
Metall bo'lmaganlarning salbiy oksidlanish darajasi
Nometalllarning eng yuqori salbiy oksidlanish darajasini 8 dan berilgan kimyoviy element joylashgan guruh sonini ayirish yo'li bilan aniqlash mumkin, ya'ni. eng yuqori musbat oksidlanish darajasi guruh raqamiga mos keladigan tashqi qatlamdagi elektronlar soniga teng.
E'tibor bering, oddiy moddalarning oksidlanish darajalari metall yoki metall bo'lmaganligidan qat'i nazar, 0 ga teng.
Manbalar:
- Grinvud, Norman N.; Earnshaw, A. Elementlar kimyosi - 2-nashr. - Oksford: Battervort-Heinemann, 1997 yil
- Mg-Mg bog'lari bilan yashil barqaror magniy (I) birikmalari / Jons C.; Stasch A.. - Fan jurnali, 2007. - dekabr (318-son (5857-son))
- Fan jurnali, 1970. - soni. 3929. - No 168. - S. 362.
- Kimyoviy jamiyat jurnali, Kimyoviy aloqalar, 1975. - 760b-761-betlar.
- Irving Langmuir Elektronlarning atom va molekulalarda joylashishi. - J. Am jurnali. Kimyo. Soc., 1919. - Nashr. 41.
Murakkab tarkibidagi kimyoviy element, barcha bog'lanishlar ionli degan faraz asosida hisoblanadi.
Oksidlanish darajalari ijobiy, manfiy yoki nol qiymatga ega bo'lishi mumkin, shuning uchun molekuladagi elementlarning oksidlanish darajalarining algebraik yig'indisi ularning atomlari sonini hisobga olgan holda 0 ga, ionda esa ionning zaryadiga teng.
1. Metalllarning birikmalardagi oksidlanish darajalari doimo musbat.
2. Eng yuqori oksidlanish darajasi ushbu element joylashgan davriy tizimning guruh raqamiga to'g'ri keladi (istisno: Au+3(I guruh), Cu+2(II), VIII guruhdan oksidlanish darajasi +8 faqat osmiyda bo'lishi mumkin Os va ruteniy Ru.
3. Nometallarning oksidlanish darajalari uning qaysi atom bilan bog‘langanligiga bog‘liq:
- agar metall atomi bo'lsa, oksidlanish darajasi manfiy;
- agar metall bo'lmagan atom bo'lsa, oksidlanish darajasi ham ijobiy, ham salbiy bo'lishi mumkin. Bu elementlar atomlarining elektromanfiyligiga bog'liq.
4. Metall bo'lmaganlarning eng yuqori salbiy oksidlanish darajasini 8 dan ushbu element joylashgan guruhning sonini ayirish orqali aniqlash mumkin, ya'ni. eng yuqori musbat oksidlanish darajasi guruh raqamiga mos keladigan tashqi qatlamdagi elektronlar soniga teng.
5. Oddiy moddalarning oksidlanish darajalari, uning metall yoki metall bo'lmaganligidan qat'i nazar, 0 ga teng.
Doimiy oksidlanish darajasiga ega bo'lgan elementlar.
|
Element |
Xarakterli oksidlanish darajasi |
Istisnolar |
|
Metall gidridlar: LIH-1 |
||
|
oksidlanish darajasi bog'lanish to'liq uzilgan (ionli xususiyatga ega) degan faraz ostida zarrachaning shartli zaryadi deb ataladi. H- Cl = H + + Cl - , Xlorid kislotadagi bog'lanish kovalent qutblidir. Elektron juftligi atomga nisbatan ko'proq moyil bo'ladi Cl - , chunki u ko'proq elektronegativ butun elementdir. Oksidlanish darajasini qanday aniqlash mumkin?Elektromanfiylik atomlarning boshqa elementlardan elektronlarni jalb qilish qobiliyatidir. Oksidlanish darajasi element ustida ko'rsatilgan: Br 2 0 , Na 0 , O +2 F 2 -1 ,K + Cl - va hokazo. Bu ijobiy va salbiy bo'lishi mumkin. Oddiy moddaning oksidlanish darajasi (bog'lanmagan, erkin holat) nolga teng. Aksariyat birikmalarda kislorodning oksidlanish darajasi -2 (istisno peroksidlar). H 2 O 2, bu erda -1 va ftor bilan birikmalar - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Oksidlanish holati oddiy monotomik ion uning zaryadiga teng: Na + , Ca +2 . Uning birikmalarida vodorod oksidlanish darajasi +1 ga teng (gidridlar bundan mustasno - Na + H - va ulanishlarni yozing C +4 H 4 -1 ). Metall-metall bo'lmagan bog'larda eng yuqori elektronegativlikka ega bo'lgan atom manfiy oksidlanish holatiga ega (elektromanfiylik ma'lumotlari Pauling shkalasida berilgan): H + F - , Cu + Br - , Ca +2 (YO'Q 3 ) - va hokazo. Kimyoviy birikmalarda oksidlanish darajasini aniqlash qoidalari.Keling, ulanishni olaylik KMnO 4 , marganets atomining oksidlanish darajasini aniqlash kerak. Sabab:
K+MnXO 4 -2 Mayli X- marganetsning oksidlanish darajasi bizga noma'lum. Kaliy atomlari soni - 1, marganets - 1, kislorod - 4. Molekula umuman elektr neytral ekanligi isbotlangan, shuning uchun uning umumiy zaryadi nolga teng bo'lishi kerak. 1*(+1) + 1*(X) + 4(-2) = 0, X = +7, Demak, kaliy permanganatdagi marganetsning oksidlanish darajasi = +7. Keling, oksidning yana bir misolini olaylik Fe2O3. Temir atomining oksidlanish darajasini aniqlash kerak. Sabab:
2*(X) + 3*(-2) = 0, Xulosa: bu oksidda temirning oksidlanish darajasi +3 ga teng. Misollar. Molekuladagi barcha atomlarning oksidlanish darajalarini aniqlang. 1. K2Cr2O7. Oksidlanish holati K+1, kislorod O -2. Berilgan indekslar: O=(-2)×7=(-14), K=(+1)×2=(+2). Chunki molekuladagi elementlarning oksidlanish darajalarining algebraik yig'indisi, ularning atomlari sonini hisobga olgan holda, 0 ga teng bo'lsa, ijobiy oksidlanish darajalari soni manfiylar soniga teng bo'ladi. Oksidlanish holatlari K+O=(-14)+(+2)=(-12). Bundan kelib chiqadiki, xrom atomining musbat kuchlari soni 12 ga teng, lekin molekulada 2 ta atom bor, ya'ni har bir atomda (+12):2=(+6) bor. Javob: K 2 + Cr 2 +6 O 7 -2. 2.(AsO 4) 3-. Bunday holda, oksidlanish darajalarining yig'indisi endi nolga teng bo'lmaydi, balki ionning zaryadiga, ya'ni. - 3. Tenglama tuzamiz: x+4×(- 2)= - 3 . Javob: (+5 O 4 -2 kabi) 3-. |
Ushbu kontseptsiyani belgilashda shartli ravishda bog'lovchi (valentlik) elektronlar ko'proq elektronegativ atomlarga o'tadi (qarang Elektromanfiylik ) va shuning uchun birikmalar xuddi musbat va manfiy zaryadlangan ionlardan iborat. Oksidlanish holati nol, manfiy va musbat qiymatlarga ega bo'lishi mumkin, ular odatda element belgisining tepasida joylashgan.
Oksidlanish darajasining nol qiymati erkin holatdagi elementlarning atomlariga beriladi, masalan: Cu, H 2, N 2, P 4, S 6. Oksidlanish darajasining salbiy qiymati bog'lovchi elektron buluti (elektron jufti) siljigan atomlarga ega. Uning barcha birikmalarida ftor uchun u -1 ga teng. Valentlik elektronlarini boshqa atomlarga beradigan atomlar ijobiy oksidlanish holatiga ega. Masalan, gidroksidi va ishqoriy tuproq metallari uchun mos ravishda +1 va +2 ga teng. Cl − , S 2− , K + , Cu 2+ , Al 3+ kabi oddiy ionlarda u ion zaryadiga teng. Ko'pgina birikmalarda vodorod atomlarining oksidlanish darajasi +1, lekin metall gidridlarda (ularning vodorod bilan birikmalari) - NaH, CaH 2 va boshqalarda -1 ga teng. Kislorod uchun oksidlanish darajasi -2 ga teng, lekin, masalan, ftor OF 2 bilan birgalikda u +2, peroksid birikmalarida (BaO 2 va boshqalar) -1 bo'ladi. Ba'zi hollarda bu qiymat kasr son sifatida ham ifodalanishi mumkin: temir oksidi (II, III) Fe 3 O 4 tarkibidagi temir uchun u +8/3 ga teng.
Murakkab tarkibidagi atomlarning oksidlanish darajalarining algebraik yig'indisi nolga teng, kompleks ionda esa ionning zaryadi. Bu qoidadan foydalanib, masalan, H 3 PO 4 fosfor kislotasida fosforning oksidlanish darajasini hisoblaymiz. Uni x bilan belgilab, vodorod (+1) va kislorodning (−2) oksidlanish darajasini ularning birikmadagi atomlari soniga ko‘paytirsak, tenglamani olamiz: (+1) 3+x+(−2) 4=0 , bundan x=+5 . Xuddi shunday Cr 2 O 7 2− ionida xromning oksidlanish darajasini hisoblaymiz: 2x+(−2) 7=−2; x=+6. MnO, Mn 2 O 3, MnO 2, Mn 3 O 4, K 2 MnO 4, KMnO 4 birikmalarida marganetsning oksidlanish darajasi +2, +3, +4, +8/3, +6, mos ravishda +7.
Eng yuqori oksidlanish darajasi uning eng yuqori ijobiy qiymati hisoblanadi. Aksariyat elementlar uchun u davriy tizimdagi guruh raqamiga teng va uning birikmalaridagi elementning muhim miqdoriy xarakteristikasi hisoblanadi. Elementning birikmalarida uchraydigan oksidlanish darajasining eng past qiymati odatda eng past oksidlanish darajasi deb ataladi; qolganlarning hammasi oraliq. Shunday qilib, oltingugurt uchun eng yuqori oksidlanish darajasi +6, eng pasti -2 va oraliq +4 ga teng.
Davriy tizim guruhlari bo'yicha elementlarning oksidlanish darajalarining o'zgarishi ularning kimyoviy xossalarining seriya raqamining oshishi bilan davriyligini aks ettiradi.
Elementlarning oksidlanish darajasi tushunchasi moddalarni tasniflashda, ularning xossalarini tavsiflashda, birikmalarni shakllantirishda va ularning xalqaro nomlarida foydalaniladi. Lekin u, ayniqsa, oksidlanish-qaytarilish reaktsiyalarini o'rganishda keng qo'llaniladi. "Oksidlanish darajasi" tushunchasi ko'pincha noorganik kimyoda "valentlik" tushunchasi o'rniga qo'llaniladi (qarang.