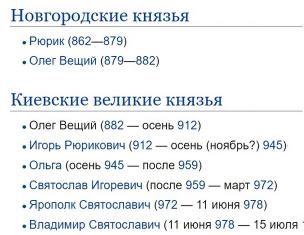
В ходе урока мы изучим тему «Гидролиз. Среда водных растворов. Водородный показатель». Вы узнаете о гидролизе - обменной реакции вещества с водой, приводящей к разложению химического вещества. Кроме того, будет введено определение водородному показателю - так называемому РН.
Тема: Растворы и их концентрация, дисперсные системы, электролитическая диссоциация
Урок: Гидролиз. Среда водных растворов. Водородный показатель
Гидролиз - это обменная реакция вещества с водой, приводящая к его разложению . Попробуем разобраться в причине данного явления.
Электролиты делятся на сильные электролиты и слабые. См. Табл. 1.
Табл. 1
Вода относится к слабым электролитам и поэтому диссоциирует на ионы лишь в незначительной степени Н 2 О ↔ Н + + ОН -
Ионы веществ, попадающие в раствор, гидратируются молекулами воды. Но при этом может происходить и другой процесс. Например, анионы соли, которые образуются при её диссоциации, могут взаимодействовать с катионами водорода, которые, пусть и в незначительной степени, но все-таки образуются при диссоциации воды. При этом может происходить смещение равновесия диссоциации воды. Обозначим анион кислоты Х - .
Предположим, что кислота сильная. Тогда она по определению практически полностью распадается на ионы. Если кислота слабая , то она диссоциирует неполностью. Она будет образовываться при прибавлении в воду из анионов соли и ионов водорода, получающихся при диссоциации воды. За счет её образования, в растворе будут связываться ионы водорода, и их концентрация будет уменьшаться. Н + + Х - ↔ НХ
Но, по правилу Ле Шателье, при уменьшении концентрации ионов водорода равновесие смещается в первой реакции в сторону их образования, т. е. вправо. Ионы водорода будут связываться с ионами водорода воды, а гидроксид ионы - нет, и их станет больше, чем было в воде до прибавления соли. Значит, среда раствора будет щелочная . Индикатор фенолфталеин станет малиновым. См. рис. 1.
Рис. 1
Аналогично можно рассмотреть взаимодействие катионов с водой. Не повторяя всю цепочку рассуждений, подытоживаем, что если основание слабое , то в растворе будут накапливаться ионы водорода, и среда будет кислая .
Катионы и анионы солей можно разделить на два типа. Рис. 2.
Рис. 2. Классификация катионов и анионов по силе электролитов
Поскольку и катионы и анионы, согласно данной классификации, бывают двух типов, то всего существует 4 разнообразных комбинации при образовании их солей. Рассмотрим, как относится к гидролизу каждый из классов этих солей. Табл. 2.
|
Какими по силе кислотой и основанием образована соль |
Примеры солей |
Отношение к гидролизу |
Среда |
Окраска лакмуса |
|
Соль сильного основания и сильной кислоты |
NaCl, Ba(NO 3) 2 , K 2 SO 4 |
Гидролизу не подвергаются. |
нейтральная |
фиолетовый |
|
Соль слабого основания и сильной кислоты |
ZnSO 4 , AlCl 3 , Fe(NO 3) 3 |
Гидролиз по катиону. Zn 2+ + HOH ZnOH + + H + |
||
|
Соль сильного основания и слабой кислоты |
Na 2 CO 3 ,К 2 SiO 3 , Li 2 SO 3 |
Гидролиз по аниону CO 3 2 + HOH |
щелочная |
|
|
Соль слабого основания и слабой кислоты |
FeS, Al(NO 2) 3 , CuS |
Гидролиз и по аниону, и по катиону. |
среда раствора зависит от того, какое из образующихся соединений будет более слабым электролитом. |
зависит от более сильного электролита. |
Табл. 2.
Усилить гидролиз можно разбавлением раствора или нагреванием системы.
Соли, которые подвергаются необратимому гидролизу
Реакции ионного обмена протекают до конца при выпадении осадка, выделения газа или малодиссоируемого вещества.
2 Al (NO 3) 3 + 3 Na 2 S +6 Н 2 О → 2 Al (OH) 3 ↓+ 3 H 2 S+6 NaNO 3 (1)
Если взять соль слабого основания и слабой кислоты и при этом и катион, и анион будут многозарядным, то при гидролизе таких солей будет образовываться и нерастворимый гидроксид соответствующего металла, и газообразный продукт. В данном случае гидролиз может стать необратимым. Например, в реакции (1) не образуется осадок сульфида алюминия.
Под это правило подпадают следующие соли: Al 2 S 3 , Cr 2 S 3 , Al 2 (CO 3) 3 , Cr 2 (CO 3) 3 , Fe 2 (CO 3) 3 , CuCO 3 . Эти соли в водной среде подвергаются необратимому гидролизу. Их невозможно получить в водном растворе.
В органической химии гидролиз имеет очень большое значение.
При гидролизе изменяется концентрация ионов водорода в растворе, а во многих реакциях используются кислоты или основания. Поэтому, если мы будем знать концентрацию ионов водорода в растворе, то будет легче следить за процессом и управлять им. Для количественной характеристики содержания ионов в растворе используется pН раствора. Он равен отрицательному логарифму концентрации ионов водорода.
p Н = - lg [ H + ]
Концентрация ионов водорода в воде равна 10 -7 степени, соответственно, рН = 7 у абсолютно чистой воды при комнатной температуре.
Если долить в раствор кислоты или добавить соль слабого основания и сильной кислоты, то концентрация ионов водорода станет больше 10 -7 и рН < 7.
Если добавить щелочи или соли сильного основания и слабой кислоты, то концентрация ионов водорода станет меньше, чем 10 -7 и рН>7. См. рис. 3. Знать количественный показатель кислотности необходимо во многих случаях. Например, водородный показатель желудочного сока равен 1,7. Увеличение или уменьшение этого значения приводит к нарушению пищеварительных функций человека. В сельском хозяйстве ведется контроль кислотности почвы. Например, для садоводства наилучшей является почва с рН = 5-6. При отклонении от этих значений в почву вносят подкисляющие или подщелачивающие добавки.

Рис. 3
Подведение итога урока
В ходе урока мы изучили тему «Гидролиз. Среда водных растворов. Водородный показатель». Вы узнали о гидролизе - обменной реакции вещества с водой, приводящей к разложению химического вещества. Кроме того, было введено определение водородному показателю - так называемому рН.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. - 14-е изд. - М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. - К.: ИЦ «Академия», 2008. - 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. - М.: Дрофа, 2007. - 220 с.
Домашнее задание
1. №№6-8 (с. 68) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. - 14-е изд. - М.: Просвещение, 2012.
2. Почему рН дождевой воды всегда меньше 7?
3. Что обусловливает малиновую окраску раствора карбоната натрия?
Задания с комментариями и решениями
В предыдущие годы усвоение этого элемента содержания проверялось заданиями с выбором ответа (базового уровня сложности). Вот примеры подобных заданий.
Пример 39. Кислую реакции среды имеет водный раствор
1) нитрата кальция
2) хлорида стронция
3) хлорида алюминия
4) сульфата цезия
Вспомним, что кислую реакцию среды имеют средние соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону). Среди предложенных вариантов ответа такая соль есть - это хлорид алюминия. Следовательно, среда его раствора - кислая:
Пример 40. Одинаковую реакцию среды имеют водные растворы сульфата железа(III) и
1) нитрата кальция
2) хлорида стронция
3) хлорида меди
4) сульфата цезия
Водная среда сульфата железа(III) кислая, как и для всех солей, образованных слабым основанием и сильной кислотой:
В вариантах ответов есть только одна подобная соль - это хлорид меди. Следовательно, среда его раствора тоже кислая:
В экзаменационной работе 2017 года знание этого элемента содержания будет проверяться заданиями повышенного уровня сложности (задания с кратким ответом). Вот примеры подобных заданий.
Пример 41. Установите соответствие между названием соли и реакцией среды ее водного раствора.
Среда водного раствора соли определяется типом ее гидролиза (если он возможен). Рассмотрим отношение к гидролизу каждой из предложенных солей.
A) Нитрат калия KNO 3 является солью сильной кислоты и сильного основания. Соли такого состава не подвергаются гидролизу. Среда водного раствора этой соли - нейтральная (А-2).
Б) Сульфат алюминия Al 2 (SO 4) 3 является солью, образованной сильной серной кислотой и слабым основанием (гидроксидом алюминия). Следовательно, соль будет подвергаться гидролизу по катиону:
В результате накопления ионов Н + среда раствора соли будет кислой (Б-1).
B) Сульфид калия K 2 S образован сильным основанием и очень слабой сероводородной кислотой. Такие соли подвергаются гидролизу по аниону:
В результате накопления ионов ОН - среда раствора соли будет щелочной (В-3).
Г) Ортофосфат натрия Na 3 PO 4 образован сильным основанием и довольно слабой ортофосфорной кислотой. Следовательно, соль будет подвергаться гидролизу по аниону:
В результате накопления ионов ОН - среда раствора соли будет щелочной (Г-3).
Подведем итог. Первый раствор - нейтральный, второй - кислый, два последних - щелочные.
Для получения правильного ответа, сначала установим природу кислот и оснований, которыми образованы эти соли.
A) BeSO 4 образована слабым основанием и сильной серной кислотой, такие соли подвергаются гидролизу по катиону.
Б) KNO 2 образована сильным основанием и слабой азотистой кислотой, такие соли подвергаются гидролизу по аниону.
B) Pb(NO 3) 2 образована слабым основанием и сильной азотной кислотой, такие соли подвергаются гидролизу по катиону.
Г) СuСl 2 образована слабым основанием и сильной соляной кислотой, такие соли подвергаются гидролизу по катиону.
Для получения правильного ответа установим природу кислот и оснований, которыми образованы предложенные соли:
A) сульфид лития Li 2 S - соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону;
Б) хлорат калия КСlO 3 - соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается;
B) нитрит аммония NH 4 NO 2 - соль, образованная слабым основанием и слабой кислотой, гидролиз идет и по катиону, и по аниону;
Г) пропионат натрия C 3 H 7 COONa - соль, образованная сильным основанием и слабой кислотой, гидролиз идет по аниону.
| А | Б | В | Г |
Исследуем действие универсального индикатора на растворы некоторых солей
Как мы видим, среда первого раствора — нейтральная (рН=7), второго — кислая (рН < 7), третьего щелочная (рН > 7). Чем же объяснить столь интересный факт? 🙂
Для начала, давайте вспомним, что такое pH и от чего он зависит.
pH- водородный показатель, мера концентрации ионов водорода в растворе (по первым буквам латинских слов potentia hydrogeni - сила водорода).
pH вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на один литр:
В чистой воде при 25 °C концентрации ионов водорода и гидроксид-ионов одинаковы и составляют 10 -7 моль/л (рН=7).
Когда концентрации обоих видов ионов в растворе одинаковы, раствор имеет нейтральную реакцию. Когда > раствор является кислым, а при > - щелочным.
За счет чего же в некоторых водных растворах солей происходит нарушение равенства концентраций ионов водорода и гидроксид-ионов?
Дело в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов ( или ) с ионами соли с образованием малодиссоциированного, труднорастворимого или летучего продукта. Это и есть суть гидролиза.
— это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита -кислоты (или кислой соли), или основания (или основной соли).
Слово «гидролиз» означает разложение водой («гидро»-вода, «лизис» — разложение).
В зависимости от того какой ион соли вступает во взаимодействие с водой, различают три типа гидролиза:
- гидролиз по катиону (в реакцию с водой вступает только катион);
- гидролиз по аниону (в реакцию с водой вступает только анион);
- совместный гидролиз — гидролиз по катиону и по аниону (в реакцию с водой вступает и катион, и анион).
Любую соль можно рассматривать как продукт, образованный взаимодействием основания и кислоты:


Гидролиз соли – взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа.
Процесс гидролиза протекает только с участием растворимых
солей и состоит из двух этапов:
1) диссоциация
соли в растворе – необратимая
реакция (степень диссоциации, или 100%);
2) собственно , т.е. взаимодействие ионов соли с водой, — обратимая
реакция (степень гидролиза ˂ 1, или 100%)
Уравнения 1-го и 2-го этапов – первый из них необратим, второй обратим – складывать нельзя!
Отметим, что соли, образованные катионами щелочей
и анионами сильных
кислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей KCl, NaNO 3 , NaSO 4 и BaI среда нейтральная
.
Гидролиз по аниону
В случае взаимодействия анионов
растворенной соли с водой процесс называется гидролизом соли по аниону
.
1) KNO 2 = K + + NO 2 — (диссоциация)
2) NO 2 — + H 2 O ↔ HNO 2 + OH — (гидролиз)
Диссоциация соли KNO 2 протекает полностью, гидролиз аниона NO 2 – в очень малой степени (для 0,1 М раствора – на 0,0014%), но этого оказывается достаточно, чтобы раствор стал щелочным
(среди продуктов гидролиза присутствует ион OH —), в нем p
H = 8,14.
Гидролизу подвергаются анионы только слабых
кислот (в данном примере – нитрит-ион NO 2 , отвечающий слабой азотистой кислоте HNO 2). Анион слабой кислоты притягивает к себе катион водорода, имеющийся в воде, и образует молекулу этой кислоты, а гидроксид-ион остается свободным:
NO 2 — + H 2 O (H +, OH —) ↔ HNO 2 + OH —
Примеры:
а) NaClO = Na + + ClO —
ClO — + H 2 O ↔ HClO + OH —
б) LiCN = Li + + CN —
CN — + H 2 O ↔ HCN + OH —
в) Na 2 CO 3 = 2Na + + CO 3 2-
CO 3 2- + H 2 O ↔ HCO 3 — + OH —
г) K 3 PO 4 = 3K + + PO 4 3-
PO 4 3- + H 2 O ↔ HPO 4 2- + OH —
д) BaS = Ba 2+ + S 2-
S 2- + H 2 O ↔ HS — + OH —
Обратите внимание, что в примерах (в- д) нельзя увеличить число молекул воды и вместо гидроанионов (HCO 3, HPO 4, HS) писать формулы соответствующих кислот (H 2 CO 3, H 3 PO 4, H 2 S). Гидролиз – обратимая реакция, и протекать «до конца» (до образования кислоты) он не может.
Если бы такая неустойчивая кислота, как H 2 CO 3 , образовывалась в растворе своей соли NaCO 3 , то наблюдалось бы выделение из раствора газа CO 2 (H 2 CO 3 = CO 2 + H 2 O). Однако, при растворении соды в воде образуется прозрачный раствор без газовыделения, что является свидетельством неполноты протекания гидролиза аниона с появлением в растворе только гидранионов угольной кислоты HCO 3 — .
Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза – кислоты. Чем слабее кислота, тем выше степень гидролиза.
Например, ионы CO 3 2- , PO 4 3- и S 2- подвергаются гидролизу в большей степени, чем ион NO 2 , так как диссоциация H 2 CO 3 и H 2 S по 2-й ступени, а H 3 PO 4 по 3-тей ступени протекает значительно меньше, чем диссоциация кислоты HNO 2 . Поэтому растворы, например, Na 2 CO 3 , K 3 PO 4 и BaS будут сильнощелочными
(в чем легко убедиться по мылкости соды на ощупь).
Избыток ионов ОН в растворе легко обнаружить индикатором или измерить специальными приборами (рН-метрами).
Если в концентрированный раствор сильно гидролизующейся по аниону соли,
например Na 2 CO 3 , внести алюминий, то последний (вследствие амфотерности) прореагирует со щелочью и будет наблюдаться выделение водорода. Это – дополнительное доказательство протекания гидролиза, ведь в раствор соды мы не добавляли щелочь NaOH!
Обратите особое внимание на соли кислот средней силы — ортофосфорной и сернистой. По первой ступени эти кислоты диссоциируют довольно хорошо, поэтому их кислые соли гидролизу не подвергаются, и среда раствора таких солей — кислая (из-за наличия катиона водорода в составе соли). А средние соли гидролизуются по аниону — среда щелочная. Итак, гидросульфиты, гидрофосфаты и дигидрофосфаты — не гидролизуются по аниону, среда кислая. Сульфиты и фосфаты — гидролизуются по аниону, среда щелочная.
Гидролиз по катиону
В случае взаимодействия катиона растворенной соли с водой процесс называется
гидролизом соли по катиону
1) Ni(NO 3) 2 = Ni 2+ + 2NO 3 − (диссоциация)
2) Ni 2+ + H 2 O ↔ NiOH + + H + (гидролиз)
Диссоциация соли Ni(NO 3) 2 протекает нацело, гидролиз катиона Ni 2+ − в очень малой степени (для 0,1М раствора − на 0,001%), но этого оказывается достаточно, чтобы среда стала кислотной (среди продуктов гидролиза присутствует ион H +).
Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH 4 + . Катион металла отщепляет от молекулы воды гидроксид-ион и освобождает катион водорода H + .
Катион аммония в результате гидролиза образует слабое основание − гидрат аммиака и катион водорода:
NH 4 + + H 2 O ↔ NH 3 · H 2 O + H +
Обратите внимание, что нельзя увеличивать число молекул воды и вместо гидроксокатионов (например, NiOH +) писать формулы гидроксидов (например, Ni(OH) 2). Если бы гидроксиды образовались, то из растворов солей выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы).
Избыток катионов водорода легко обнаружить индикатором или измерить специальными приборами. В концентрированный раствор сильно гидролизующейся по катиону соли, вносится магний или цинк, то последние реагируют с кислотой с выделением водорода.
Если соль нерастворимая — то гидролиза нет, т.к ионы не взаимодействуют с водой.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н +), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН −).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na 2 S = 2Na + + S 2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO 3) 2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H 2 SO 3) и фосфорную (H 3 PO 4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H + . Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S 2- + H 2 O ↔ HS − + OH −
HS − + H 2 O ↔ H 2 S + OH −
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону .
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn 2+ , которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn 2+ + H 2 O ↔ Zn(OH) + + H +
Zn(OH) + + H 2 O ↔ Zn(OH) + + H +
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону .
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу .
Примеры: Ba(NO 3) 2 , KCl, Li 2 SO 4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K 2 CO 3 , Li 2 S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону , среда кислая.
Примеры: Zn(NO 3) 2 , Fe 2 (SO 4) 3 , CuSO 4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону или же. Также говорят про такие соли, что они подвергаются необратимому гидролизу .
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH 4 +) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H + , и ионы OH − , которые образуют крайне малодиссоциирующее вещество – воду (H 2 O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO 3) 3 + 3Na 2 S = Al 2 S 3 + 6NaNO 3 (− так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO 3) 3 + 3Na 2 S + 6H 2 O= 2Al(OH) 3 ↓+ 3H 2 S + 6NaNO 3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al 2 S 3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S
Гидролиз - это взаимодействие веществ с водой, в результате которого изменяется среда раствора.
Катионы и анионы слабых электролитов способны взаимодействовать с водой с образованием устойчивых малодиссоциируемых соединений или ионов, в результате чего меняется среда раствора. Формулы воды в уравнениях гидролиза обычно записывают в виде Н‑ОН. При реакции с водой катионы слабых оснований отнимают от воды гидроксил ион, и в растворе образуется избыток Н + . Среда раствора становится кислотной. Анионы слабых кислот притягивают из воды Н + , и реакция среды становится щелочной.
В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды в процессе их растворения. Различают 4 варианта гидролиза.
1. Соль образована сильным основанием и сильной кислотой.
Такая соль гидролизу практически не подвергается. При этом равновесие диссоциации воды в присутствии ионов соли почти не нарушается, поэтому рН=7, среда нейтральная.
Na + + H 2 O Cl ‑ + H 2 O
2. Если соль образована катионом сильного основания и анионом слабой кислоты, то происходит гидролиз по аниону.
Na 2 CO 3 + HOH \(\leftrightarrow\) NaHCO 3 + NaOH
Так как в растворе накапливаются ионы ОН ‑ , то среда - щелочная, рН>7.
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то гидролиз идет по катиону.
Cu 2+ + HOH \(\leftrightarrow\) CuOH + + H +
СuCl 2 + HOH \(\leftrightarrow\) CuOHCl + HCl
Так как в растворе накапливаются ионы Н + , то среда кислая, рН<7.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу и по катиону и по аниону.
CH 3 COONH 4 + HOH \(\leftrightarrow\) NH 4 OH + CH 3 COOH
CH 3 COO ‑ + + HOH \(\leftrightarrow\) NH 4 OH + CH 3 COOH
Растворы таких солей имеют или слабокислую, или слабощелочную среду, т.е. величина рН близка к 7. Реакция среды зависит от соотношения констант диссоциации кислоты и основания. Гидролиз солей, образованных очень слабыми кислотой и основанием, является практически необратимым. Это, в основном, сульфиды и карбонаты алюминия, хрома, железа.
Al 2 S 3 + 3HOH \(\leftrightarrow\) 2Al(OH) 3 + 3H 2 S
При определении среды раствора солей необходимо учитывать, что среда раствора определяется сильным компонентом. Если соль образована кислотой, являющейся сильным электролитом, то среда раствора кислая. Если основание сильный электролит, то - щелочная.
Пример. Щелочную среду имеет раствор
1) Pb(NO 3) 2 ; 2) Na 2 CO 3 ; 3) NaCl; 4) NaNO 3
1) Pb(NO 3) 2 нитрат свинца(II). Соль образована слабым основанием и сильной кислотой , значит среда раствора кислая.
2) Na 2 CO 3 карбонат натрия. Соль образована сильным основанием и слабой кислотой, значит среда раствора щелочная.
3) NaCl; 4) NaNO 3 Соли образованы сильным основанием NaOH и сильными кислотами HCl и HNO 3 . Среда раствора нейтральная.
Правильный ответ 2) Na 2 CO 3
В растворы солей опустили индикаторную бумажку. В растворах NaCl и NaNO 3 она не изменила цвет, значит среда раствора нейтральная . В растворе Pb(NO 3) 2 окрасилась в красный цвет, среда раствора кислая. В растворе Na 2 СO 3 окрасилась в синий цвет, среда раствора щелочная.

 HCO 3 + OH
HCO 3 + OH