ИОН
(от греч. ion - идущий), электрически заряж. ч-ца, образующаяся при потере или присоединении эл-нов атомами, молекулами, радикалами и т. д. И. соответственно могут быть положительными (при потере эл-нов) и отрицательными (при присоединении эл-нов), И. кратен заряду эл-на. И. могут входить в состав молекул и существовать в несвязанном состоянии (в газах, жидкостях, плазме).
Физический энциклопедический словарь. - М.: Советская энциклопедия . . 1983 .
ИОН (от греч. ion - идущий) - электрически заряженная частица, образующаяся при отрыве или присоединении одного или неск. электронов (или др. заряж. частиц) к атому, молекуле, радикалу и др. иону. Положительно заряженные И. наз. катионами, отрицательно заряженные - анионам и. И. обозначают хим. символом с индексом (вверху справа), указывающим знак и величину заряда - кратность И.- в единицах заряда электрона (напр., Li + , H 2 + , SO 4 2-). Атомные И. обозначают также хим. символом элемента с римскими цифрами, указывающими кратность И. (напр., NI, NII, NIII, что соответствует N, N + , N 2+ ; в этом случае римские цифры являются спектроскопич. символами Z, они больше заряда иона Z i на единицу: Z=Z i +l). Последовательность И. различных хим. элементов, содержащих одинаковое число электронов, образует (см. напр., Водородоподобные атомы). Понятие и термин "И." (а также " " и "анион") введены в 1834 М. Фарадеем (М. Faraday). Для удаления электрона из нейтрального атома или необходимо затратить определ. энергию, к-рая наз. энергией ионизации. Энергия ионизации, отнесённая к заряду электрона, называется ионизационным потенциалом. Характеристика, противоположная энергии ионизации - - равна энергии связи дополнит, электрона в отрицат. И. Нейтральные атомы и ионизируются под действием квантов оптич. излучения, рентг. и g-излучения, электрич. поля при столкновениях с др. атомами, электронами и др. частицами и т. п. молекула ДНК, несущая в каждой своей повторяющейся единице отрицательно заряженную фосфатную группу РО 4 -). Нек-рые молекулы, находящиеся в растворах и кристаллах, остаются в целом электронейтральными, хотя и содержат в разл. её участках противоположно заряженные группы, их наз. цвиттерионами. Так, молекула аминокислоты H 2 N - СНР-СООН (Р - боковой радикал) переходит в цвиттерионную форму H 3 N-СНР-СОО - , что сопровождается переносом протона с группы СООН на группу H 2 N. Комплекс, состоящий из неск. нейтральных атомов или молекул и простого И. образует сложный И., наз. кластерным ионом. В газах при обычных условиях образующиеся И. недолговечны, однако при высоких темп-pax и давлениях степень ионизации газа растёт с ростом темп-ры и давления и при очень высоких темп-pax и давлениях газпереходит в плазму. В жидкостях, в зависимости от природы растворителя и растворённого вещества, катионы и анионы могут располагаться на практически бесконечном расстоянии друг от друга (в том случае, когда они окружены молекулами растворителя), но могут оказаться и достаточно близко друг от друга и, сильно взаимодействуя, образовывать т. н. ионные пары. Соли в твёрдом состоянии обычно образуют ионные кристаллы. Энергия взаимодействия атомных И. как ф-ции расстояния между ними может быть вычислена с помощью разл. приближенных методов (см. Межмолекулярное взаимодействие). Уровни энергии атомных и молекулярных И. и нейтральных частиц различны и в принципе могут быть рассчитаны методами квантовой механики, как и энергии ионизации. Оптич. спектры атомных И. аналогичны спектрам нейтральных атомов с тем же числом электронов, они только смещаются в коротковолновый диапазон, т. к. длины воли спектральных линий, соответствующих квантовым переходам между уровнями энергии с различными значениями гл. квантового числа, пропорциональны квадрату заряда ядра. В спектрах И. появляются т. наз. сателлитные линии, анализ к-рых позволяет исследовать структуру и свойства многозарядных ионов. Ионная компонента оказывает существенное влияние на параметры лабораторной и астрофизической плазмы. Изучение И. важно для различных областей физики и химии плазмы, астрофизики, квантовой электроники, для исследования строения веществ п т. д. И. широко используются в эксперим. исследованиях и приборах (масс-спектрометры, Вильсона камеры, ионный проектор , ионные пучки и т. д.). Лит.: Смирнов Б. М., Отрицательные ионы, М., 1978; Пресняков Л. П., Шевелько В. П., Янев Р. К., Элементарные с участием многозарядных ионов, М., 1986. В. Г. Дашевский.
Физическая энциклопедия. В 5-ти томах. - М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Синонимы :
Смотреть что такое "ИОН" в других словарях:
У этого термина существуют и другие значения, см. Ион (значения). «ИОН» Тип Частная компания … Википедия
ион - Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд. Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика
А, муж. Разг. к (см. Иона).Отч.: Ионович, Ионовна; разг. Ионыч. Словарь личных имён. Ион См. Ивон. День Ангела. Справочник по именам и именинам. 2010 … Словарь личных имен
- (Ion, Ιων). Сын Ксуфа, родоначальник ионийского племени. (Источник: «Краткий словарь мифологии и древностей». М.Корш. Санкт Петербург, издание А. С. Суворина, 1894.) ИОН (Ίων), в греческой мифологии афинский царь, сын Креусы. Отцом И. большинство … Энциклопедия мифологии
ИОН, йон муж. лад, толк, смысл, пригодность. Он несуразый, иону в нем нет. Окно не к иону было прорублено, я его и заделал. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Сущ., кол во синонимов: 17 адденд (1) амфион (2) анион (1) … Словарь синонимов
Атом (или гр. атомов комплексный ион), несущий положительный (катион) или отрицательный (анион) электрический заряд и являющийся самостоятельной или относительно самостоятельной составной частью (строительной единицей) к лов или… … Геологическая энциклопедия
Ион, Ion, с Хиоса, ок. 490 ок. 421 гг. до н. э., греческий поэт. Часто бывал в Афинах, хотя и не поселился там навсегда. Состоял в дружеских отношениях с Тимоном и Фемистоклом, знал также Эсхила и Софокла. Первую трагедию поставил в 451 г. Нам… … Античные писатели
В греческой мифологии внук Эллина, сын Ксуфа (или Аполлона); родоначальник племени ионийцев. Стал афинским царем; его сыновья Гоплет, Гелеонт, Эгикорей, Аргад эпонимы четырех древнейших фил Аттики … Большой Энциклопедический словарь
- (Аин) (возм., руины), город и равнина, находящиеся сев. истока Иордана (3Цар 15:20; 4Цар 15:29). И. был завоеван арам. (сир.) царем Венададом, а позднее Тиглатпаласаром III (библ. Феглаффелласар). В 3Цар 15:20 названия местностей перечислены в… … Библейская энциклопедия Брокгауза
Книги
- Ион Крянгэ. Избранные произведения. Воспоминания детства. Сказки. Повести , Ион Крянгэ. Бухарест, 1959 год. Издательство на иностранных языках. С иллюстрациями. Издательский переплет. Сохранность хорошая. Классик румынской и молдавской литератур Ион Крянгэ (1837- 1889) в своих…
ИОНЫ
ИОНЫ, электрически заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные ионы - анионами.
Современная энциклопедия . 2000 .
Смотреть что такое "ИОНЫ" в других словарях:
ИОНЫ - (от греч. ion идущий,странствующий), атомы или хим. радикалы, несущие электрические заряды. И с т о р и я. Как установил впервые Фарадей (Faraday), проведение электрического тока в растворах связано с передвижением материальных частиц, несущих… … Большая медицинская энциклопедия
ионы - – электрически заряженные атомы или молекулы. Общая химия: учебник / А. В. Жолнин Ионы – электрически заряженные частицы, возникающие при потере или присоединении электронов атомами, молекулами и радикалами. Словарь по аналитической химии… … Химические термины
Продукты разложения какого либо тела при посредстве электролиза. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
- (от греч. iōn идущий), заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. В растворах положительно заряженные ионы называются катионами, отрицательно заряженные ионы … … Энциклопедический словарь
Ион (греч. ιόν «идущий») электрически заряженная частица (атом, молекула), образующаяся, обычно, в результате потери или присоединения одного или нескольких электронов атомами или молекулами. Заряд иона кратен заряду электрона. Понятие и… … Википедия
Ионы - (от греческого ion идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов (молекулы, радикалы и др.). Понятие и термин ионы ввел в 1834 г.… … Энциклопедический словарь по металлургии
- (от греч. идущий), одноатомные или многоатомные частицы, несущие электрич. заряд, напр. Н +, Li+, Аl3+, NH4+, F , SO42 . Положительные И. называют катионами (от греч. kation, буквально идущий вниз), отрицательные а н и о н а м и (от греч. anion,… … Химическая энциклопедия
- (от греч. ión идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И.… … Большая советская энциклопедия
ионы - физ. частицы, несущие положительный или отрицательный заряд. Положительно заряженные ионы несут меньше электронов, чем положено, а отрицательные больше … Универсальный дополнительный практический толковый словарь И. Мостицкого
- (физ.) По терминологии, введенной в учение об электричестве знаменитым Фарадеем, тело, подвергающееся разложению действием на него гальванического тока, называется электролитом, разложение таким путем электролизом, а продукты разложения ионами.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Книги
- Ионы водорода лечат рак. Луч надежды , Гарбузов Геннадий Алексеевич. Геннадий Алексеевич Гарбузов - известный ученый из Сочи, биолог, давний последователь академика Болотова, специалист в области нетрадиционного лечения онкологических заболеваний. Многолетние…
- Ионы водорода лечат рак Луч надежды , Гарбузов Г.. Геннадий Алексеевич Гарбузов - известный ученый из Сочи, биолог, давний последователь академика Болотова, специалист в области нетрадиционного лечения онкологических заболеваний. .…
Многоатомные частицы, несущие электрический заряд. Заряд иона кратен элементарному электрическому заряду и всегда целочисленный. Заряд одноатомного иона химического элемента по числу и знаку совпадает со степенью окисления этого элемента; заряд многоатомного иона равен алгебраической сумме степеней окисления элементов с учётом числа их атомов. Положительно заряженные ионы (например, К + , Са 2+ , ΝΗ + 4) называют катионами (от греческого κατιών - идущий вниз), отрицательно заряженные ионы (например, Сl - , SO 4 2- , СН 3 СОО -) - анионами (от греческого ανιών - идущий вверх). Процесс образования ионов называется ионизацией. Термины «ион», «катион» и «анион» ввёл в 1834 году М. Фарадей, изучавший действие электрического поля на водные растворы различных химических соединений. В постоянном электрическом поле катионы перемещаются к отрицательно заряженному электроду (катоду), анионы - к положительно заряженному электроду (аноду).
В виде самостоятельных частиц ионы могут существовать во всех агрегатных состояниях вещества: в газах (смотри Ионы в газах, Ионы в атмосфере), в кристаллах (смотри Ионные кристаллы), в плазме, в жидкостях - в расплавах (смотри Ионные жидкости) и в растворах (смотри Электролитическая диссоциация). Ионы являются структурными единицами химических соединений с ионной химической связью. Такие соединения в твёрдом состоянии, расплавах и растворах состоят из катионов и анионов; например, хлорид натрия NaCl - из катионов Na + и анионов Cl - , ацетат калия СН 3 СООК - из катионов К + и анионов СН3СОО - . Некоторые соединения с полярной ковалентной связью (например, хлороводород НСl) при растворении в воде и других полярных растворителях диссоциируют на ионы. В зависимости от природы растворителя и растворённого вещества, содержащиеся в растворах ионы, могут либо взаимодействовать с молекулами растворителя, в результате чего вокруг ионов формируются сольватные оболочки, либо находиться достаточно близко, образуя ионные пары.
Ионы образуются при отрыве электронов от атомов и молекул, находящихся в газовой фазе (при этом расходуется энергия ионизации), или в результате присоединения электронов к таким атомам и молекулам (энергия, затрачиваемая или высвобождающаяся при этом, - сродство атома или молекулы к электрону). К образованию ионов приводит также присоединение иона простого состава к нейтральной молекуле или другому иону. Например, при присоединении иона Н + к молекуле воды Н 2 О получается ион гидроксония Н 3 О + . Возможно образование ионов при разрушении молекул в результате термического или радиационного воздействия. При образовании иона всегда сохраняется суммарный первоначальный заряд участвующих в этом процессе частиц (если ионы образовались из нейтральных атомов или молекул, то суммарный заряд всех ионов равен нулю). Некоторые молекулы, находящиеся в растворах или кристаллах, оставаясь в целом электронейтральными, содержат в различных участках противоположно заряженные группы (смотри Цвиттер-ионы). Комплекс, состоящий из нескольких нейтральных атомов или молекул и ионов, - кластерный ион.
Химические реакции в растворе (или расплаве) с участием ионных соединений обусловлены перемещением ионов в этой среде и образованием ими новых нейтральных частиц или более сложных ионов. В живых организмах ионы участвуют в различных обменных процессах, регуляции мышечных сокращений, передаче нервных импульсов и т.д. (смотри, например, в статье Ионные насосы).
Лит.: Крестов Г. А. Термодинамика ионных процессов в растворах. Л., 1984.
ИОНЫ (от греч. - идущий), одноатомные или многоатомные частицы, несущие электрич. заряд, напр. Н + , Li + , Аl 3+ , NH 4 + , F - , SO 4 2 - . Положительные ионы называют катионами (от греч. kation, буквально - идущий вниз), отрицательные - а н и о н а м и (от греч. anion, буквально идущий вверх). В своб. состоянии существуют в газовой фазе (в плазме). Положительные ионы в газовой фазе можно получить в результате отрыва одного или неск. электронов от нейтральных частиц при сильном нагреве газа , действии электрич. разряда, ионизирующих излучений и др. Поглощаемую при образовании однозарядного положит. иона энергию называют первым потенциалом ионизации (или первой энергией ионизации), для получения двухзарядного иона из однозарядного затрачивается вторая энергия ионизации и т. д. Отрицат. ионы образуются в газовой фазе при присоединении к частицам своб. электронов , причем нейтральные атомы могут присоединять не более одного электрона ; отрицат. многозарядные одноатомные ионы в индивидуальном состоянии не существуют. Выделяющаяся при присоединении электрона к нейтральной частице энергия наз. сродством к электрону . В газовой фазе ионы могут присоединять нейтральные молекулы и образовывать ионмолекулярные комплексы. См. также Ионы в газах . В конденсир. фазах ионы находятся в ионных кристаллич. решетках и ионных расплавах ; в р-рах электролитов имеются сольватир. ионы, образовавшиеся в результате электролитич. диссоциации растворенного в-ва. В конденсир. фазе ионы интенсивно взаимодействуют (связаны) с окружающими их частицами - ионами противоположного знака в кристаллах и в расплавах , с нейтральными молекулами - в р-рах. Взаимод. происходит по кулоновскому, ион-дипольному, донорно-акцепторному механизмам. В р-рах вокруг ионов образуются сольватные оболочки из связанных с ионами молекул р-рителя (см. Гидратация , Сольватация). Представление об ионах в кристаллах - удобная идеализир. модель, т.к. чисто ионной связи никогда не бывает, напр., в кристаллич. NaCl эффективные заряды атомов Na и Сl равны соотв. приблизительно +0,9 и -0,9. Св-ва ионов в конденсир. фазе значительно отличаются от св-в тех же ионов в газовой фазе. В р-рах существуют отрицательные двухзарядные одноатомные ионы . В конденсир. фазе имеется множество разл. многоатомных ионов - анионы кислородсодержащих к-т, напр. NO 3 - , SO 4 2 - , комплексные ионы, напр. 3+ , 2 - , кластерные ионы 2+ и др. (см. Кластеры), ионы полиэлектролитов и др. В р-ре ионы могут образовывать ионные пары . Термодинамич. характеристики - D H 0 обр, S 0 , D G 0 обр индивидуальных ионов известны точно только для ионов в газовой фазе. Для ионов в р-рах при эксперим. определении всегда получают сумму значений термодинамич. характеристик для катиона и аниона . Возможен теоретич. расчет термодинамич. величин индивидуальных ионов, но его точность пока меньше точности эксперим. определения суммарных значений, поэтому для практич. целей пользуются условными шкалами термодинамич. характеристик индивидуальных ионов в р-ре, причем обычно принимают величины термодинамич. характеристик Н + равными нулю. Осн. структурные характеристики ионов в конденсир. фазе -радиус и координац. число. Было предложено много разл. шкал радиусов одноатомных ионов. Часто используются т. наз. физ. радиусы ионов, найденные К. Шенноном (1969) по эксперим. данным о точках минимума электронной плотности в кристаллах . Координац. числа одноатомных ионов в осн. лежат в пределах 4-8. И оны участвуют во множестве разнообразных р-ций. Часто бывают катализаторами , промежут. частицами в хим. р-циях, напр., при гетеролитических реакциях . Обменные ионные р-ции в р-рах электролитов обычно протекают практически мгновенно. В электрич. поле ионы переносят электричество: катионы - к отрицат. электроду (катоду), анионы - к положительному (аноду); одновременно происходит перенос в-ва, к-рый играет важную роль вВпервые термин "ион" был введен в 1834 году, в чем заслуга Майкла Фарадея. После изучения действия электрического тока на растворы солей, щелочей и кислот он пришел к выводу, что в них содержатся частицы, имеющие некий заряд. Катионами Фарадей назвал ионы, которые в электрическом поле двигались к катоду, имеющему отрицательный заряд. Анионы - отрицательно заряженные неэлементарные ионные частицы, которые в электрическом поле движутся к плюсу - аноду.
Данная терминология применяется и сейчас, а частицы изучаются далее, что позволяет рассматривать химическую реакцию как результат электростатического взаимодействия. Многие реакции протекают по этому принципу, что позволило понять их ход и подобрать катализаторы и ингибиторы для ускорения их протекания и для угнетения синтеза. Также стало известно, что многие вещества, особенно в растворах, всегда находятся в виде ионов.
Номенклатура и классификация ионов
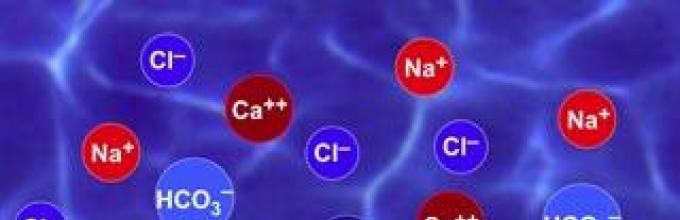
Ионы - это заряженные атомы или группа атомов, которая в ходе химической реакции потеряла или приобрела электроны. Они составляют внешние слои атома и могут теряться из-за низкой силы притяжения ядра. Тогда результатом отсоединения электрона является положительный ион. Также если атом имеет сильный ядерный заряд и узкую электронную оболочку, ядро является акцептором дополнительных электронов. В результате этого образуется отрицательная ионная частица.
Сами ионы - это не только атомы с избыточной или недостаточной электронной оболочкой. Это может быть и группа атомов. В природе чаще всего существуют именно групповые ионы, которые присутствуют в растворах, биологических жидкостях тел организмов и в морской воде. Имеется огромное количество видов ионов, названия которых вполне традиционны. Катионы - это ионные частицы, заряженные положительно, а заряженные отрицательно ионы - это анионы. В зависимости от состава их называют по-разному. Например, катион натрия, катион цезия и другие. Анионы называются по-другому, так как чаще всего состоят из многих атомов: сульфат-анион, ортофосфат-анион и другие.
Механизм образования ионов
Химические элементы в составе соединений редко являются электрически нейтральными. То есть они почти никогда не находятся в состоянии атомов. В образовании ковалентной связи, которая считается самой распространенной, атомы также имеют некий заряд, а электронная плотность смещается вдоль связей внутри молекулы. Однако заряд иона здесь не формируется, потому как энергия ковалентной связи меньше, нежели энергия ионизации. Потому, несмотря на различную электроотрицательность, одни атомы не могут полностью притянуть электроны внешнего слоя других.
В ионных реакциях, где разница электроотрицательности между атомами достаточно большая, один атом может забирать электроны внешнего слоя у другого атома. Тогда созданная связь сильно поляризуется и разрывается. Затраченная на это энергия, которая создает заряд иона, называется энергией ионизации. Для каждого атома она различная и указывается в стандартных таблицах.

Ионизация возможна только в том случае, когда атом или группа атомов способен либо отдавать электроны, либо акцептировать их. Чаще всего это наблюдается в растворе и кристаллах солей. В кристаллической решетке также присутствуют почти неподвижные заряженные частицы, лишенные кинетической энергии. А поскольку в кристалле нет возможности для передвижения, то реакция ионов протекают чаще всего в растворах.
Ионы в физике и химии
Физики и химики активно изучают ионы по нескольким причинам. Во-первых, эти частицы присутствуют во всех известных агрегатных состояниях вещества. Во-вторых, энергию отрыва электронов от атома можно измерить, чтобы использовать это в практической деятельности. В-третьих, в кристаллах и растворах ионы ведут себя по-разному. И, в-четвертых, ионы позволяют проводить электрический ток, а физико-химические свойства растворов меняются в зависимости от концентраций ионов.

Ионные реакции в растворе
Сами растворы и кристаллы следует рассмотреть детальнее. В кристаллах солей существуют отдельно расположенные положительные ионы, к примеру, катионы натрия и отрицательные, анионы хлора. Структура кристалла удивительна: за счет сил электростатического притяжения и отталкивания ионы ориентируются особым образом. В случае с хлоридом натрия они образуют так называемую алмазную кристаллическую решетку. Здесь каждый натриевый катион окружен 6 хлоридными анионами. В свою очередь, каждый хлоридный анион окружает 6 анионов хлора. Из-за этого простая поваренная соль и в холодной и горячей воде растворяется почти с одинаковой скоростью.

В растворе тоже не существует цельной молекулы хлорида натрия. Каждый из ионов здесь окружается диполями воды и хаотично передвигается в ее толще. Наличие зарядов и электростатических взаимодействий приводит к тому, что солевые растворы воды замерзают при температуре чуть меньше нуля, а кипят при температуре выше 100 градусов. Более того, если в растворе присутствуют другие вещества, способные вступить в химическую связь, то реакция протекает не с участием молекул, а ионов. Это создало учение о стадийности химической реакции.
Те продукты, которые получаются в конце, не образуются сразу в ходе взаимодействия, а постепенно синтезируются из промежуточных продуктов. Изучение ионов позволило понять, что реакция протекает как раз по принципам электростатических взаимодействий. Их результатом является синтез ионов, которые электростатически взаимодействуют с другими ионами, создавая конечный равновесный продукт реакции.
Резюме
Такая частица, как ион, это электрически заряженный атом или группа атомов, которая получается в ходе потери или приобретения электронов. Самым простым ионом является водородный: если он теряет один электрон, то представляет собой лишь ядро с зарядом +1. Он обуславливает кислую среду растворов и сред, что важно для функционирования биологических систем и организмов.
Ионы могут иметь как положительные, так и отрицательные заряды. За счет этого в растворах каждая частица вступает в электростатическое взаимодействие с диполями воды, что также создает условия для жизни и передачи сигналов клетками. Более того, в ионные технологии развиваются дальше. К примеру, созданы ионные двигатели, которыми оснащалось уже 7 космических миссий NASA.