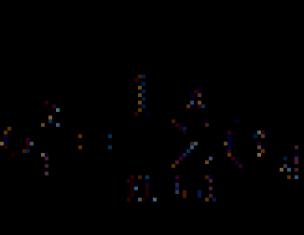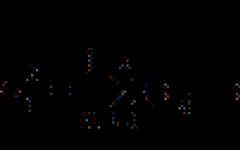2 HNO 2 NO + NO 2 + H 2 O .
Соли азотистой кислоты называются нитритами или азотистокислыми . Нитриты гораздо более устойчивы, чем HNO 2 , все они токсичны.
2HNO 2 + 2HI = I 2 + 2NO + 2H 2 O,
HNO 2 + H 2 O 2 = HNO 3 + H 2 O,
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + K 2 SO 4 + 2MnSO 4 + 3H 2 O.
Строение азотистой кислоты.
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-:

При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис - HNO 2 (г) DG° f = −42,59 кДж/моль, а для транс-HNO 2 (г) DG = −44,65 кДж/моль.
Химические свойства азотистой кислоты.
В водных растворах существует равновесие:
Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислоты:
HNO 2 в водных растворах диссоциирует (K D =4,6·10 −4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
Азотистая кислота проявляет окислительные и восстановительные свойства. При действии более сильных окислителей (пероксид водорода , хлор , перманганат калия) происходит окисление в азотную кислоту:
Кроме того, она может окислять вещества, которые обладают восстановительными свойствами:
Получение азотистой кислоты.
Азотистую кислоту получают при растворении оксида азота (III) N 2 O 3 в воде:
Кроме того, она образуется при растворении в воде оксида азота (IV) NO 2 :
.
Применение азотистой кислоты.
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе в производстве органических красителей.
Физиологическое действие азотистой кислоты.
Азотистая кислота является токсичной и обладает ярко выраженным мутагенным действием, так как является деаминирующим агентом.
Азотистая кислота существует либо в растворе, либо в газовой фазе. Она неустойчива и при нагревании распадается в парах:
2HNO 2 «NO+NO 2 +Н 2 О
Водные растворы этой кислоты при нагревании разлагаются:
3HNO 2 «HNO 3 +H 2 O+2NO
Эта реакция обратимая, поэтому, хотя растворение NO 2 и сопровождается образованием двух кислот: 2NO 2 + Н 2 O=HNO 2 +HNO 3
практически взаимодействием NO 2 с водой получают HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
По кислотным свойствам азотистая кислота лишь немного сильнее уксусной. Соли ее называются нитритами и в отличие от самой кислоты являются устойчивыми. Из растворов ее солей можно добавлением серной кислоты получить раствор HNO 2:
Ba(NO 2) 2 +H 2 SO 4 =2HNO 2 +BaSO 4 ¯
На основе данных о ее соединениях предполагают два типа структуры азотистой кислоты:
которым соответствуют нитриты и нитросоединения. Нитриты активных металлов имеют структуру I типа, а малоактивных металлов - II типа. Почти все соли этой кислоты хорошо растворимы, но нитрит серебра труднее всех. Все соли азотистой кислоты ядовиты. Для химической технологии важны KNO 2 и NaNO 2 , которые необходимы для производства органических красителей. Обе соли получают из оксидов азота:
NO+NO 2 +NaOH=2NaNO 2 +Н 2 О или при нагревании их нитратов:
KNO 3 +Pb=KNO 2 +PbO
Pb необходим для связывания выделяющегося кислорода.
Из химических свойств HNO 2 сильнее выражены окислительные, при этом сама она восстанавливается до NO:

Однако можно привести много примеров таких реакций, где азотистая кислота проявляет восстановительные свойства:

Определить присутствие азотистой кислоты и ее солей в растворе можно, если прибавить раствор иодида калия и крахмала. Нитрит-ион окисляет анион иода. Эта реакция требует присутствия Н + , т.е. протекает в кислой среде.
Азотная кислота
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO 3 +H 2 SO 4(к) =NaHSO 4 +HNO 3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH 3 + 5O 2 =4NO+6Н 2 О
2 . При охлаждении происходит дальнейшее окисление NO до NO 2: 2NO+O 2 =2NO 2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О 2 с образованием HNO 3: 4NO 2 +2Н 2 O+O 2 =4HNO 3
Исходные продукты - аммиак и воздух - тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Азотная кислота - бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO 3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:
Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Электронную структуру азотной кислоты можно вывести так:
1. Атом водорода связывается с атомом кислорода ковалентной связью:
2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:
4. Третий атом кислорода, возбуждаясь, образует свободную 2р- орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кислорода приводит к образованию молекулы азотной кислоты:
Химические свойства
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:
HNO 3 «Н + +NO - 3 Под действием теплоты и на свету частично разлагается:
4HNO 3 =4NO 2 +2Н 2 O+O 2 Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.

Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.

3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» - смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Au+НNO 3 +3НСl= AuСl 3 +NO+2Н 2 О НСl+AuСl 3 =H
3Pt+4HNO 3 +12НСl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H 2
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO 3 +HCl=Сl 2 +2Н 2 О+NOCl 2NOCl=2NO+Сl 2 Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO 2:
S+бНNO 3(конц) =H 2 SO 4 +6NO 2 +2Н 2 ОР+5НNO 3(конц) =Н 3 РO 4 +5NO 2 +Н 2 О I 2 +10HNO 3(конц) =2HIO 3 +10NO 2 +4Н 2 О 3Р+5HNO 3(p азб) +2Н 2 О= 3Н 3 РО 4 +5NO
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO 3 на металлы, их оксиды и гидроксиды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO 3 применяют для приготовления черного пороха (смесь 75% KNO 3 , 15% С и 10% S). Из NH 4 NO 3 , порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:

Разложение при нагревании (термолиз) - важное свойство солей азотной кислоты.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 =2CuO+NO 2 +O 2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu - оксид металла, NO 2 и кислород, после Си - свободный металл, NO 2 и кислород.
Применение
Азотная кислота - важнейший продукт химической промышленности. Большие количества расходуются на приготовление азотных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон и др. материалов. Дымящая
азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Соли аммония - очень своеобразные. Все они легко разлагаются, причем некоторые самопроизвольно, например карбонат аммония:
(NH4)2CО3 = 2NH3 + Н2О + СО2 (реакция ускоряется при нагревании).
Другие соли, например хлорид аммония (нашатырь), возгоняются при нагревании, т. е. сначала разлагаются на аммиак и хлористый под действием нагревания, а при понижении температуры вновь на холодных частях сосуда образуется хлорид аммония:
нагревание
NH4Cl ⇄ NH3 + НСl
охлаждение
Нитрат аммония при нагревании разлагается на закись азота и воду. Эта реакция может происходить со взрывом:
NH4NО3 = N2О + Н2О
Нитрит аммония NH4NО2 разлагается при нагревании с образованием азота и воды, поэтому им пользуются в лаборатории для получения азота.
При действии на соли аммония щелочей выделяется аммиак:
NH4Cl + NaOH = NaCl + NH3 + H2О
Выделение аммиака - характерный признак для распознавания солей аммония. Все соли аммония являются соединениями комплексного характера.
Аммиак и соли аммония находят широкое применение. Аммиак используется как сырье для получения азотной кислоты и ее солей, а также солей аммония, которые служат хорошими азотными удобрениями. Таким удобрением являются сульфат аммония (NH4)2SО4 и особенно нитрат аммония NH4NО3 или аммиачная селитра, в состав молекулы которой входят два атома азота: один аммиачный, другой нитратный. Растения вначале усваивают аммиачный , и затем нитратный. Этот вывод принадлежит основоположнику русской агрохимии акад. Д. Н. Прянишникову, посвятившему свои труды физиологии растений и обосновавшему значение минеральных удобрений в сельском хозяйстве.
Аммиак в виде нашатырного спирта применяется в медицине. Жидкий аммиак используется в холодильных установках. Хлорид аммония применяется для изготовления сухого гальванического элемента Лекланше. Смесь нитрата аммония с алюминием и углем, называемая аммоналом, является сильным взрывчатым веществом.
Карбонат аммония применяется в кондитерской промышленности как разрыхлитель теста.
■ 25. На каком свойстве карбоната аммония основано его использование для разрыхления теста?
26. Как обнаружить в составе соли ион аммония?
27. Как осуществить ряд превращений:
N2 ⇄ NH3 → NO
↓
NH4N03
Кислородные соединения азота
Образует с кислородом несколько соединений, в которых проявляет различные степени окисления.
Существует закись азота N2О, или, как ее называют, «веселящий газ». В ней проявляет степень окисления + 1. В окиси азота NO азот проявляет степень окисления + 2, в азотистом ангидриде N2О3 - + 3, в двуокиси азота NО2 - +4, в пятиокиси азота, или азотном
ангидриде, N2О5 - +5.
Закись азота N2О - несолеобразующий окисел. Это газ, довольно хорошо растворимый в воде, но в реакцию с водой не вступающий. Закись азота в смеси с кислородом (80% N2O и 20% О2) производит наркотизирующее действие и применяется для так называемого газового наркоза, преимущество которого в том, что он не имеет длительного последействия.
Остальные азота сильно ядовиты. Ядовитое действие их сказывается обычно через несколько часов после вдыхания. Первая помощь состоит в приеме внутрь большого количества молока, вдыхании чистого кислорода, пострадавшему должен быть обеспечен покой.
■ 28. Перечислите возможные степени окисления азота и , отвечающие этим степеням окисления.
29. Какие меры первой помощи следует принимать при отравлениях окислами азота?
Наиболее интересными и важными окислами азота являются окись и двуокись азота, которые мы и будем изучать.
Окись азота NО образуется из азота и кислорода при сильных электрических разрядах. В воздухе во время грозы наблюдается иногда образование окиси азота, но в очень небольших количествах. Окись азота бесцветный газ, не имеющий запаха. В воде окись азота нерастворима, поэтому ее можно собирать над водой в тех случаях, когда получение ведется лабораторным способом. В лаборатории окись азота получают из умеренно концентрированной азотной кислоты действием ее на :
HNО3 + Сu → Cu(NO3)2 + NO + Н2О
В этом уравнении самостоятельно расставьте коэффициенты.
Окись азота можно получить и другими способами, например в пламени электрической дуги:
N2 + O2 ⇄ 2NO.
В производстве азотной кислоты окись азота получают каталитическим окислением аммиака, о котором говорилось в § 68, стр. 235.
Окись азота является несолеобразующим окислом. Она легко окисляется кислородом воздуха и превращается при этом в двуокись азота NO2. Если окисление производить в стеклянном сосуде, бесцветная окись азота превращается в бурый газ - двуокись азота.
■ 30. При взаимодействии меди с азотной кислотой выделилось 5,6 л окиси азота. Рассчитайте, сколько прореагировало меди и сколько образовалось соли.
Двуокись азота NO2 - бурый газ с характерным запахом. Хорошо растворяется в воде, так как реагирует с водой по уравнению:
3NO2 + Н2O = 2HNO3 + NO
В присутствии кислорода можно получить только азотную кислоту:
4NO2 + 2Н2О + O2 = 4HNO3
Молекулы двуокиси азота NO2 довольно легко соединяются попарно и образуют четырехокись азота N2O4 - бесцветную жидкость, структурная формула которой
Этот процесс происходит на холоде. При нагревании четырехокись азота вновь переходит в двуокись.
Двуокись азота - кислотный окисел, так как может реагировать с щелочами, образуя соль и воду. Однако вследствие того, что атомы азота в модификации N2O4 имеют различное число валентных связей, при взаимодействии двуокиси азота со щелочью образуются две соли - нитрат и нитрит:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Получают двуокись азота, как уже говорилось выше, окислением окиси:
2NO + О2 = 2NO2
Кроме того, двуокись азота получают действием концентрированной азотной кислоты на :
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(конц.)
или лучше прокаливанием нитрата свинца:
2Pb(NO3)2 = 2РbO + 4NO2 + О2
■ 31. Перечислите способы получения двуокиси азота, приведя уравнения соответствующих реакций.
32. Изобразите схему строения атома азота в степени окисления +4 и объясните, каким должно быть его поведение в окислительно-восстановительных реакциях.
33. В концентрированную азотную кислоту поместили 32 г смеси меди и окиси меди. Содержание меди в смеси 20%. Какой объем какого газа при этом выделится. Сколько грамм-молекул соли при этом получается?
Азотистая кислота и нитриты
Азотистая кислота HNO2 - очень слабая неустойчивая кислота. Она существует лишь в разбавленных растворах ( а =6,3% в 0,1 н. растворе). Азотистая кислота легко разлагается с образованием окиси и двуокиси азота
2HNO2 = NO + NO2 + Н2O.
Степень окисления азота в азотистой кислоте +3. При такой степени окисления условно можно считать, что с внешнего слоя атома азота отдано 3 электрона и еще осталось 2 валентных электрона. В связи с этим для N+3 в окислительно-восстановительных реакциях существуют две возможности: он может проявлять как окислительные, так и восстановительные свойства в зависимости от того, в какую среду-окислительную или восстановительную - попадает.
Соли азотистой кислоты называются нитритами. Действуя на нитриты серной кислотой, можно получить азотистую кислоту:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2.
Нитриты представляют собой соли, довольно хорошо растворимые в воде. Как и сама азотистая кислота, нитриты могут проявлять окислительные свойства при реакции с восстановителями, например:
NaNO2 + KI + H2SO4 → I2 + NO…
Найти конечные продукты и расставить коэффициенты на основе электронного баланса попытайтесь самостоятельно.
Поскольку выделяющийся легко обнаружить с помощью крахмала, данная реакция может служить способом обнаружения даже незначительных количеств нитритов в питьевой воде, присутствие которых нежелательно из-за ядовитости. С другой стороны, нитритный азот может окисляться до N +5 под действием сильного окислителя.
NaNO2 + K2Cr2O7 + H2SO4 → NaNO3 + Cr2(SO4)3 + …
Остальные продукты реакции найдите самостоятельно, составьте электронный баланс и расставьте коэффициенты.
■ 34. Закончите уравнение.
HNO2 + KMnO4 + H2SO4 → … (N +5 , Мn +2).
35. Перечислите свойства азотистой кислоты и нитритов.
Азотная кислота
HNO3 - сильный электролит. Это летучая жидкость. Чистая кипит при температуре 86°, не имеет цвета; плотность ее 1,53. В лаборатории обычно поступает 65% HNO3 с плотностью 1,40.
дымит на воздухе, так как ее пары, поднимаясь в воздух и соединяясь с парами воды, образуют капельки тумана. Азотная кислота смешивается с водой в любых соотношениях. Она имеет резкий запах, легко испаряется, поэтому переливать концентрированную азотную кислоту следует лишь под тягой. При попадании на кожу азотная кислота может причинить сильные ожоги. Небольшой ожог дает о себе знать характерным желтым пятном на коже. Сильные ожоги могут вызвать образование язв. При попадании на кожу азотной кислоты ее следует быстро смыть большим количеством воды, а затем нейтрализовать слабым раствором соды.
Концентрированная 96-98% азотная кислота поступает в лабораторию редко и при хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 = 2Н2O + 4NO2 + O2
Она постоянно окрашена двуокисью азота в желтый цвет. Избыток двуокиси азота и постепенно улетучиваются из раствора, в растворе накапливается , а кислота продолжает разлагаться. В связи с этим концентрация азотной кислоты постепенно уменьшается. При концентрации 65% азотная кислота может сохраняться длительное время.
Азотная кислота является одним из сильнейших окислителей. Она реагирует почти со всеми металлами, но без выделения водорода. Ярко выраженные окислительные свойства азотной кислоты оказывают на некоторые ( , ) так называемое пассивирующее действие. Это особенно характерно для концентрированной кислоты. При ее воздействии на поверхности металла образуется очень плотная не растворимая в кислотах оксидная пленка, защищающая металл от дальнейшего воздействия кислоты. Металл становится «пассивным». .
Однако с большинством металлов азотная кислота реагирует. Во всех реакциях с металлами в азотной кислоте восстанавливается азот и тем полнее, чем разбавлен-нее кислота и чем активнее металл.
Концентрированная кислота восстанавливается до двуокиси азота. Примером этого может служить реакция с медью, приведенная выше (см. § 70). Разбавленная азотная кислота с медью восстанавливается до окиси азота (см. § 70). Более активные , например , восстанавливают разбавленную азотную кислоту до закиси азота.
Sn + HNO3 → Sn(NO3)2 + N2O
При очень сильном разбавлении с активным металлом, например с цинком, реакция доходит до образования соли аммония:
Zn + HNO3 → Zn(NO3)2 + NH4NO3
Во всех приведенных схемах реакций расставьте коэффициенты, составив электронный баланс самостоятельно.
■ 36. Почему при хранении в лаборатории даже в хорошо закупоренной посуде концентрация азотной кислоты понижается?
37. Почему концентрированная азотная кислота имеет желтовато-бурую окраску?
38. Напишите уравнение реакции разбавленной азотной кислоты с железом. Продуктами реакции являются нитрат железа (III), и выделяется газ бурого цвета.
39. Выпишите в тетрадь все уравнения реакций, характеризующие взаимодействие азотной кислоты с металлами. Перечислите, какие , помимо нитратов металлов, образуются в этих реакциях.
Многие могут гореть в азотной кислоте, например уголь и :
С + HNO3 → NO + СО2
Р + HNO3 → NO + H3PO4
Свободный при этом окисляется до фосфорной кислоты. при кипячении в азотной кислоте превращается в S+6 и из свободной серы образуется :
HNO3 + S → NO + H2SO4
Закончите уравнения реакций самостоятельно.
Сложные также могут гореть в азотной кислоте. Например, в азотной кислоте горят скипидар, нагретые древесные опилки.
Азотная кислота может также окислять соляную кислоту. Смесь трех частей соляной и одной части азотной кислоты называется «царской водкой». Такое название дано потому, что эта смесь окисляет и платину, на которые никакие кислоты не действуют. Реакция протекает по таким стадиям: в самой смеси происходит окисление иона хлора в свободный и восстановление азота до образования хлористого нитрозила:
HNO3 + 3НСl ⇄ Сl2 + 2Н2O + NOCl
царская водка хлористый нитрозил
Последний легко разлагается на окись азота и свободный по уравнению:
2NOCl = 2NO + Сl2
Помещенное в «царскую водку» металлическое легко окисляется хлористым нитрозилом:
Au + 3NOCl = АuСl3 + 3NO
Азотная кислота может вступать в реакцию нитрования с органическими веществами. При этом обязательно должна присутствовать концентрированная . Смесь концентрированных азотной и серной кислот, называется нитрующей смесью. С помощью такой смеси можно получить из глицерина нитроглицерин, из бензола - нитробензол, из клетчатки - нитроклетчатку и т. д. В сильно разбавленном состоянии азотная кислота проявляет характерные свойства кислот.
■ 40. Примеры типичных свойств кислот применительно к азотной кислоте приведите самостоятельно. Уравнения напишите в молекулярной и. ионной формах.
41. Почему склянки с концентрированной азотной кислотой запрещается перевозить упакованными в древесные стружки?
42. При испытании фенолфталеином концентрированной азотной кислоты фенолфталеин приобретает оранжевую окраску, а не остается бесцветным. Чем это объясняется?
Получить азотную кислоту в лаборатории очень легко. Обычно ее получают путем вытеснения из ее солей серной кислотой, например:
2KNО3 + H2SО4 = K2SО4 + 2HNО3
На рис. 61 изображена лабораторная установка для получения азотной кислоты.
В промышленности сырьем для получения азотной кислоты служит аммиак. В результате окисления аммиака в присутствии платинового катализатора образуется окись азота:
4NH3 + 5О2 = 4NO + 6Н2О
Как было указано выше, окись азота легко окисляется кислородом воздуха в двуокись азота:
2NO + О2 = 2NO2
а двуокись азота, соединяясь с водой, образует азотную кислоту и снова окись азота по уравнению:
3NО2 + Н2О = 2HNО3 + NO.
Затем окись азота снова подается на окисление:
Первая стадия процесса - окисление аммиака в окись азота - осуществляется в контактном аппарате при температуре 820°. Катализатором служат сетки из платины с примесью родия, которые нагревают перед запуском аппарата. Так как реакция экзотермична, в дальнейшем сетки нагреваются за счет тепла самой реакции. Вышедшую из контактного аппарата окись азота охлаждают до температуры около 40°, так как процесс окисления окиси азота идет быстрее при более низкой температуре. При температуре 140° образующаяся двуокись азота разлагается снова на окись азота и кислорода.
Окисление окиси азота в двуокись осуществляется в башнях, называемых абсорберами, обычно под давлением 8-10 атм. В них одновременно происходит и поглощение (абсорбция) образующейся двуокиси азота водой. Для лучшего поглощения двуокиси азота раствор охлаждают. Получается 50-60% азотная кислота.
Концентрирование азотной кислоты проводят в присутствии концентрированной^серной кислоты в ректификационных колоннах. образует с имеющейся водой гидраты с температурой кипения более высокой, чем у азотной кислоты, поэтому из смеси довольно легко выделяются пары азотной кислоты. При конденсации этих паров можно получить 98-99% азотную кислоту. Обычно более концентрированная кислота применяется редко.
■ 43. Запишите в тетрадь все уравнения реакций, происходящих при получении азотной кислоты лабораторным и промышленным способами.
44. Как осуществить ряд превращений:

45. Сколько 10% раствора можно приготовить из азотной кислоты, полученной взаимодействием 2,02 кг нитрата калия с избытком серной кислоты?
46. Определите молярность 63% азотной кислоты.
47. Сколько азотной кислоты можно получить из 1 т аммиака при 70% выходе?
48. Цилиндр заполнили окисью азота путем вытеснения воды. Затем, не вынимая из воды, под него подвели трубку от газометра
(см. рис. 34) и начали пропускать . Опишите, что должно наблюдаться в цилиндре, если избытка кислорода не допускалось. Обоснуйте свой ответ уравнениями реакций.

Рис. 62. Горение угля в расплавленной селитре. 1 - расплавленная селитра; 2 - горящий уголек; 3 - песок.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты щелочных металлов, а также кальция и аммония называются селитрами. Например, KNО3 - калийная селитра, NH4NО3 - аммиачная селитра. Природные залежи нитрата натрия имеются в огромном количестве в Чили, в связи с чем эта соль получила название чилийской селитры.
Рис. 62. Горение угля в расплавленной селитре. 1 - расплавленная селитра; 2 - горящий уголек; 3 - песок.
Соли азотной кислоты, как и она сама, являются сильными окислителями. Например, соли щелочных металлов при плавлении выделяют по уравнению:
2KNО3 = 2KNO2+ О2
Благодаря этому уголь, и другие горючие вещества горят в расплавленной селитре (рис. 62).
Соли тяжелых металлов также разлагаются с выделением кислорода, но по другой схеме.
2Pb(NО3)2 = 2РbО + 4NO2 + О2

Рис. 63. Круговорот азота в природе
Калийная селитра применяется для изготовления черного пороха. Для этого ее смешивают с углем и серой. для этой цели не используется, так как она гигроскопична. Черный порох при поджигании интенсивно сгорает по уравнению:
2KNO3 + 3С + S = N2 + 3CO2 + K2S
Нитраты кальция и аммония - очень хорошие азотные удобрения. В последнее время получил распространение в качестве удобрения и нитрат калия.
Азотная кислота широко применяется в производстве химико-фармацевтических препаратов (стрептоцид), органических красителей, целлулоида, кино- и фотопленок. Соли азотной кислоты широко используются в пиротехнике.
В природе существует круговорот азота, при котором растения при отмирании возвращают обратно в почву полученный из нее азот. Животные, питаясь растениями, возвращают азот в почву в виде испражнений, а после смерти их трупы перегнивают и тем самым также возвращают почве полученный от нее азот (рис.63). Снимая урожай, человек вмешивается в этот круговорот, нарушает его и тем самым обедняет почву азотом, поэтому приходится вносить азот на поля в виде минеральных удобрений.
■ 49. Как осуществить ряд превращений

Азотистая кислота
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
Соли азотистой кислоты - нитриты - образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO 2 применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
Она принадлежит к числу слабых кислот (K = A- 10~ 4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
Степень окисленности азота в азотистой кислоте равна +3, т.е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO 2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями - окисляется до HNO 3 . Примерами могут служить следующие реакции:
Азотная кислота
Чистая азотная кислота HNO3 - бесцветная жидкость плотностью 1,51 г/см3, при -42 0C застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы H + и NO 3 .
Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота - один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор - в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO 3 , ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы - в оксиды.
Концентрированная HNO 3 пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO 3 . Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние (см. § 100).
Степень окисленности азота в азотной кислоте равна +5. Выступая в качестве окислителя, HNO 3 может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т.е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрация HNO 3 , тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO 2 . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например с медью, выделяется NO. В случае более активных металлов - железа, цинка - образуется N 2 O. Сильно разбавленная азотная кислота взаимодействует с активными металлами - цинком, магнием, алюминием - с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой :

При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до NO 2 , например:
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием HNO 3 , протекают сложно.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» - золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:

Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
![]()
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям:
C избытком соляной кислоты хлорид золота (III) и хлорид платины (IV) образуют комплексные соединения Н[АиС1 4 ] и H 2 .
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами - NO 2 . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Электронная структура молекулы HNO 3 рассмотрена в § 44.
Азотная кислота - одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия NaNO 3 , или натриевая селитра , иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия KNO 3 , или калийная селитра , в небольших количествах также встречается в природе, но, главным образом, получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция Ca(NO 3) 2 , или кальциевая селитра , получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
Нитрат аммония NH 4 NO 3 .
- Учащемуся рекомендуется самому составить полные уравнения этих реакций.
Азо́тистая кислота HNO 2 - слабая одноосновная кислота , существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO 2 , все они токсичны.
Строение
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс- .
| цис-изомер | транс-изомер |
При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO 2 (г) DG° f = −42,59 кДж/моль, а для транс-HNO 2 (г) DG = −44,65 кДж/моль.
Химические свойства
В водных растворах существует равновесие:
При нагревании раствора азотистая кислота распадается с выделением и образованием азотной кислоты :
HNO 2 является слабой кислотой. В водных растворах диссоциирует (K D =4,6·10 −4), немного сильнее уксусной кислоты . Легко вытесняется более сильными кислотами из солей :
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода , хлор , перманганат калия) окисляется в азотную кислоту:
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
\mathsf{2HNO_2 + 2HI \rightarrow 2NO\uparrow + I_2 +2H_2O}
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N 2 O 3 в воде :
Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония . Нитриты применяются в органическом синтезе при производстве органических красителей.
Физиологическое действие
Азотистая кислота токсична, причём обладает ярко выраженным мутагенным действием , поскольку является деаминирующим агентом .
Источники
- Карапетьянц М. Х. , Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Напишите отзыв о статье "Азотистая кислота"
Ссылки
- // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). - СПб. , 1890-1907.
| Это заготовка статьи о неорганическом веществе . Вы можете помочь проекту, дополнив её. |
Отрывок, характеризующий Азотистая кислота
Соня, как бы не веря своим ушам, смотрела во все глаза на Наташу.– А Болконский? – сказала она.
– Ах, Соня, ах коли бы ты могла знать, как я счастлива! – сказала Наташа. – Ты не знаешь, что такое любовь…
– Но, Наташа, неужели то всё кончено?
Наташа большими, открытыми глазами смотрела на Соню, как будто не понимая ее вопроса.
– Что ж, ты отказываешь князю Андрею? – сказала Соня.
– Ах, ты ничего не понимаешь, ты не говори глупости, ты слушай, – с мгновенной досадой сказала Наташа.
– Нет, я не могу этому верить, – повторила Соня. – Я не понимаю. Как же ты год целый любила одного человека и вдруг… Ведь ты только три раза видела его. Наташа, я тебе не верю, ты шалишь. В три дня забыть всё и так…
– Три дня, – сказала Наташа. – Мне кажется, я сто лет люблю его. Мне кажется, что я никого никогда не любила прежде его. Ты этого не можешь понять. Соня, постой, садись тут. – Наташа обняла и поцеловала ее.
– Мне говорили, что это бывает и ты верно слышала, но я теперь только испытала эту любовь. Это не то, что прежде. Как только я увидала его, я почувствовала, что он мой властелин, и я раба его, и что я не могу не любить его. Да, раба! Что он мне велит, то я и сделаю. Ты не понимаешь этого. Что ж мне делать? Что ж мне делать, Соня? – говорила Наташа с счастливым и испуганным лицом.
– Но ты подумай, что ты делаешь, – говорила Соня, – я не могу этого так оставить. Эти тайные письма… Как ты могла его допустить до этого? – говорила она с ужасом и с отвращением, которое она с трудом скрывала.
– Я тебе говорила, – отвечала Наташа, – что у меня нет воли, как ты не понимаешь этого: я его люблю!
– Так я не допущу до этого, я расскажу, – с прорвавшимися слезами вскрикнула Соня.
– Что ты, ради Бога… Ежели ты расскажешь, ты мой враг, – заговорила Наташа. – Ты хочешь моего несчастия, ты хочешь, чтоб нас разлучили…
Увидав этот страх Наташи, Соня заплакала слезами стыда и жалости за свою подругу.
– Но что было между вами? – спросила она. – Что он говорил тебе? Зачем он не ездит в дом?
Наташа не отвечала на ее вопрос.
– Ради Бога, Соня, никому не говори, не мучай меня, – упрашивала Наташа. – Ты помни, что нельзя вмешиваться в такие дела. Я тебе открыла…
– Но зачем эти тайны! Отчего же он не ездит в дом? – спрашивала Соня. – Отчего он прямо не ищет твоей руки? Ведь князь Андрей дал тебе полную свободу, ежели уж так; но я не верю этому. Наташа, ты подумала, какие могут быть тайные причины?
Наташа удивленными глазами смотрела на Соню. Видно, ей самой в первый раз представлялся этот вопрос и она не знала, что отвечать на него.
– Какие причины, не знаю. Но стало быть есть причины!
Соня вздохнула и недоверчиво покачала головой.
– Ежели бы были причины… – начала она. Но Наташа угадывая ее сомнение, испуганно перебила ее.
– Соня, нельзя сомневаться в нем, нельзя, нельзя, ты понимаешь ли? – прокричала она.
– Любит ли он тебя?
– Любит ли? – повторила Наташа с улыбкой сожаления о непонятливости своей подруги. – Ведь ты прочла письмо, ты видела его?
– Но если он неблагородный человек?
– Он!… неблагородный человек? Коли бы ты знала! – говорила Наташа.