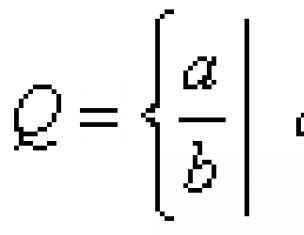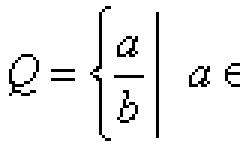В веществах атомы связаны друг с другом в определённой последовательности, а между парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о геометрии связей в веществах частично (иногда полностью) отражаются в структурных формулах.
В структурных формулах связь между атомами изображается чертой. Например:
Химическая формула воды H2O, а структурная H-O-H,
Химическая формула пероксида натрия Na2O2, а структурная Na-O-O–Na,
Химическая формула азотистой кислоты HNO2, а структурная H-O-N=O.
При изображении структурных формул чёрточками обычно показывают стехиометрическую валентность элементов. Структурные формулы, построенные по стехиометрическим валентностям, иногда называются графическими .Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о химических связях между атомами.
Структурная формула - это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.
Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера. Про явления изомерии и гомологии узнайти подробнее в следующих статьях!
На основе этих идей А. М. Бутлеров разработал принципы построения графических формул химических веществ. Для этого требуется знать валентность каждого элемента, которую изображают на рисунке в виде соответствующего числа чёрточек. Пользуясь этим правилом, легко установить, возможно или невозможно существование вещества с определённой формулой. Так, существует соединение, называемое метаном и имеющее формулу СН 4 . Соединение с формулой СН 5 невозможно, так как для пятого водорода у углерода уже не найдётся свободной валентности.
Рассмотрим сначала принципы строения наиболее просто устроенных органических соединений. Их называют углеводородами, так как в их состав входят только атомы углерода и водорода (рис. 138). Самым простым из них является упомянутый метан, в котором есть всего один атом углерода. Прибавим к нему ещё один такой же атом и посмотрим, как будет выглядеть молекула вещества, называемого этаном. У каждого атома углерода одна валентность занята его собратом – другим углеродным атомом. Теперь надо заполнить водородом оставшиеся валентности. У каждого атома осталась по три свободных валентных связи, к которым и присоединим по одному атому водорода. Получилось вещество, имеющее формулу С 2 Н 6 . Прибавим к нему ещё один атом углерода.
Рис. 138. Полные и сокращённые структурные формулы органических соединений
Теперь мы видим, что у среднего атома осталось только две свободных валентности. К ним мы присоединим по атому водорода. А к крайним углеродным атомам добавим, как и прежде, по три атома водорода. Получим пропан – соединение с формулой С 3 Н 8 . Такую цепочку можно продолжать, получая всё новые и новые углеводороды.
Но углеродные атомы необязательно должны располагаться в молекуле в линейном порядке. Допустим, что мы хотим добавить к пропану ещё один углеродный атом. Оказывается, это можно сделать двумя способами: присоединить его либо к крайнему, либо к среднему атому углерода пропана. В первом случае мы получим бутан с формулой С 4 Н 10 . Во втором случае общая, так называемая эмпирическая, формула будет такой же, но изображение на рисунке, называемое структурной формулой , будет выглядеть иначе. И название вещества будет несколько иное: не бутан, а изобутан.
Вещества, имеющие одну и ту же эмпирическую, но разные структурные формулы, называют изомерами , а способность вещества существовать в виде различных изомеров – изомерией . Мы, например, употребляем в пищу различные вещества, имеющие одну и ту же формулу С 6 Н 12 О 6 , но структурные формулы они имеют различные и носят разные названия: глюкоза, фруктоза или галактоза.
Углеводороды, которые мы рассмотрели, называют предельными. В них все атомы углерода связаны между собой одинарной связью. Но так как атом углерода четырёхвалентен и имеет четыре валентных электрона, то теоретически он может образовывать двойные, тройные и даже четверные связи. Четверные связи между атомами углерода в природе не существуют, тройные встречаются редко, а вот двойные присутствуют во многих органических веществах, в том числе и в углеводородах. Соединения, в которых имеются двойные или тройные связи между атомами углерода, называют непредельными или ненасыщенными углеводородами. Возьмём снова молекулу углеводорода, содержащую два атома углерода, но соединим их с помощью двойной связи (см. рис. 138). Мы видим, что теперь у каждого атома углерода осталось по две свободных связи, к каждой из которых он может присоединить по одному атому водорода. Получаемое соединение имеет формулу С 2 Н 4 и называется этиленом. Этилен, в отличие от этана, имеет меньше атомов водорода при том же числе углеродных атомов. Поэтому углеводороды, имеющие двойную связь, и называют ненасыщенными в том смысле, что они не насыщены водородом.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества - холестерина . Далеко не все знают, что он является одноатомным спиртом!
|`/`\\`|<`|w>`\`/|<`/w$color(red)HO$color()>\/`|0/`|/\<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`\|dH; #a_(A-72)<_(A-120,d+)>-/-/<->`\
Гидроксильную группу в нём я обозначил красным цветом.
Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет. Но химики знают причину - если к спирту присоединить ещё один атом кислорода, то получится кислота.Посмотрим на формулы кислот, которые получаются из уже знакомых нам спиртов:
| Вещество | Скелетная формула | Брутто-формула | ||
|---|---|---|---|---|
| Метановая кислота (муравьиная кислота) |
H/C`|O|\OH | HCOOH | O//\OH | |
| Этановая кислота (уксусная кислота) |
H-C-C\O-H; H|#C|H | CH3-COOH | /`|O|\OH | |
| Пропановая кислота (метилуксусная кислота) |
H-C-C-C\O-H; H|#2|H; H|#3|H | CH3-CH2-COOH | \/`|O|\OH | |
| Бутановая кислота (масляная кислота) |
H-C-C-C-C\O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-COOH | /\/`|O|\OH | |
| Обобщённая формула | {R}-C\O-H | {R}-COOH или {R}-CO2H | {R}/`|O|\OH |
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH), которая и придаёт таким веществам кислотные свойства.
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты. Обычно столовый уксус содержит от 3 до 15% уксусной кислоты, а остальное (по большей части) - вода. Употребление в пищу уксусной кислоты в неразбавленном виде представляет опасность для жизни.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В этом случае они называются: двухосновная , трёхосновная и т.д...
В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся.
Кстати, обратите внимание, что здесь встречаются кислоты, имеющие и гидроксильную группу, характерную для спиртов.
Такие вещества называются оксикарбоновыми кислотами
(или оксикислотами).
Внизу под каждой из кислот подписано, уточняющее название той группы органических веществ, к которой она относится.
Радикалы
Радикалы - это ещё одно понятие, которое оказало влияние на химические формулы.
Само слово наверняка всем известно, но в химии радикалы не имеют ничего общего с политиками, бунтовщиками и прочими гражданами с активной позицией.
Здесь это всего лишь фрагменты молекул. И сейчас мы разберёмся, в чём их особенность и познакомимся с новым способом записи химических формул.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты - {R}-OH и карбоновые кислоты - {R}-COOH . Напомню, что -OH и -COOH - это функциональные группы. А вот R - это и есть радикал. Не зря он изображается в виде буквы R.
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода. Ну а если отнять два атома водорода, то получится двухвалентный радикал.
Радикалы в химии получили собственные названия.
Некоторые из них получили даже латинские обозначения, похожие на обозначения элементов.
И кроме того, иногда в формулах радикалы могут быть указаны в сокращённом виде, больше напоминающем брутто-формулы.
Всё это демонстрируется в следующей таблице.
| Название | Структурная формула | Обозначение | Краткая формула | Пример спирта | ||
|---|---|---|---|---|---|---|
| Метил | CH3-{} | Me | CH3 | {Me}-OH | CH3OH | |
| Этил | CH3-CH2-{} | Et | C2H5 | {Et}-OH | C2H5OH | |
| Пропил | CH3-CH2-CH2-{} | Pr | C3H7 | {Pr}-OH | C3H7OH | |
| Изопропил | H3C\CH(*`/H3C*)-{} | i-Pr | C3H7 | {i-Pr}-OH | (CH3)2CHOH | |
| Фенил | `/`=`\//-\\-{} | Ph | C6H5 | {Ph}-OH | C6H5OH | |
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Некоторые радикалы записываются в виде, напоминающем брутто-формулу, но функциональная группа записывается отдельно.
Например, CH3-CH2-OH
превращается в C2H5OH
.
А для разветвлённых цепочек вроде изопропила применяются конструкции со скобочками.
Существует ещё такое явление, как свободные радикалы . Это радикалы, которые по каким-то причинам отделились от функциональных групп. При этом нарушается одно из тех правил, с которых мы начали изучение формул: число химических связей уже не соответствует валентности одного из атомов. Ну или можно сказать, что одна из связей становится незакрытой с одного конца. Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот
.
Он обозначается латинской буквой N
и имеет валентность, равную трём.
Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Скелетная формула | Брутто-формула |
|---|---|---|---|---|
| Аминометан (метиламин) |
H-C-N\H;H|#C|H | CH3-NH2 | \NH2 | |
| Аминоэтан (этиламин) |
H-C-C-N\H;H|#C|H;H|#3|H | CH3-CH2-NH2 | /\NH2 | |
| Диметиламин | H-C-N<`|H>-C-H; H|#-3|H; H|#2|H | $L(1.3)H/N<_(A80,w+)CH3>\dCH3 | /N<_(y-.5)H>\ | |
| Аминобензол (Анилин) |
H\N|C\\C|C<\H>`//C<|H>`\C<`/H>`||C<`\H>/ | NH2|C\\CH|CH`//C<_(y.5)H>`\HC`||HC/ | NH2|\|`/`\`|/_o | |
| Триэтиламин | $slope(45)H-C-C/N\C-C-H;H|#2|H; H|#3|H; H|#5|H;H|#6|H; #N`|C<`-H><-H>`|C<`-H><-H>`|H | CH3-CH2-N<`|CH2-CH3>-CH2-CH3 | \/N<`|/>\| |
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины . Функциональная группа {}-NH2 называется аминогруппой . Вот несколько обобщающих формул аминов:
В общем, никаких особых новшеств здесь нет.
Если эти формулы Вам понятны, то можете смело заниматься дальнейшим изучением органической химии,
используя какой-нибудь учебник или интернет.
Но мне бы хотелось ещё рассказать о формулах в неорганической химии.
Вы убедитесь, как их легко будет понять после изучения строения органических молекул.
Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая. Конечно, неорганические молекулы обычно выглядят гораздо проще, потому что они не склонны к образованию таких сложных структур, как углеводороды. Но зато приходится изучать более сотни элементов, входящих в состав таблицы Менделеева. А элементы эти имеют склонность объединяться по химическим свойствам, но с многочисленными исключениями.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи - химические формулы.
А с ними как раз всё относительно просто.
Наиболее часто в неорганической химии употребляются рациональные формулы
.
И мы сейчас разберёмся, чем же они отличаются от уже знакомых нам.
Для начала, познакомимся с ещё одним элементом - кальцием. Это тоже весьма распространённый элемент.
Обозначается он Ca
и имеет валентность, равную двум.
Посмотрим, какие соединения он образует с известными нам углеродом, кислородом и водородом.
| Вещество | Структурная формула | Рациональная формула | Брутто-формула |
|---|---|---|---|
| Оксид кальция | Ca=O | CaO | |
| Гидроксид кальция | H-O-Ca-O-H | Ca(OH)2 | |
| Карбонат кальция | $slope(45)Ca`/O\C|O`|/O`\#1 | CaCO3 | |
| Гидрокарбонат кальция | HO/`|O|\O/Ca\O/`|O|\OH | Ca(HCO3)2 | |
| Угольная кислота | H|O\C|O`|/O`|H | H2CO3 |
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой. Но пока что не очень понятно, как они получаются. Чтобы понять смысл этих формул, нужно рассмотреть химические реакции, в которых участвуют вещества.
Кальций в чистом виде - это мягкий белый металл. В природе он не встречается.
Но его вполне возможно купить в магазине химреактивов. Он обычно хранится в специальных баночках без доступа воздуха.
Потому что на воздухе он вступает в реакцию с кислородом. Собственно, поэтому он и не встречается в природе.
Итак, реакция кальция с кислородом:
2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы.
Из кальция и кислорода получается оксид кальция.
Это вещество тоже не встречается в природе потому что он вступает в реакцию с водой:
CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
что она образована одним атомом кальция и двумя гидроксильными группами, с которыми мы уже знакомы.
Таковы законы химии: если гидроксильная группа присоединяется к органическому веществу, получается спирт,
а если к металлу - то гидроксид.
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. Думаю, что все слыхали про этот газ. Он образуется при дыхании людей и животных, сгорании угля и нефтепродуктов, при пожарах и извержениях вулканов. Поэтому он всегда присутствует в воздухе. Но ещё он довольно хорошо растворяется в воде, образуя угольную кислоту:
CO2 + H2O <=> H2CO3
Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой и превращается в малорастворимый карбонат кальция:
Ca(OH)2 + H2CO3 -> CaCO3"|v" + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок.
При дальнейшем контакте карбоната кальция с углекислым газом в присутствии воды происходит обратимая
реакция образования кислой соли - гидрокарбоната кальция, который хорошо растворим в воде
CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды. При повышении температуры гидрокарбонат обратно превращается в карбонат. Поэтому в регионах с жесткой водой в чайниках образуется накипь.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Так же он входит в состав кораллов, раковин моллюсков, костей животных и т.д...
Но если карбонат кальция раскалить на очень сильном огне, то он превратится в оксид кальция и углекислый газ.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы. Так вот, рациональные формулы записываются так, чтобы были видны функциональные группы. В нашем случае это:
Кроме того, отдельные элементы - Ca, H, O(в оксидах) - тоже являются самостоятельными группами.Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо. А после изучения функциональных групп, нам ничего не стоит разобраться, что же представляют собой эти ионы.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. Электроны - это частицы с отрицательным зарядом. Элемент с полным набором электронов имеет нулевой заряд. Если он отдал электрон, то его заряд становится положительным, а если принял - то отрицатеньным. Например, водород имеет всего один электрон, который он достаточно легко отдаёт, превращаясь в положительный ион. Для этого существует специальная запись в химических формулах:
H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации
вода распадается на положительно заряженный
ион водорода и отрицательно заряженную группу OH.
Ион OH^-
называется гидроксид-ион
.
Не следует его путать с гидроксильной группой, которая является не ионом, а частью какой-то молекулы.
Знак + или - в верхнем правом углу демонстрирует заряд иона.
А вот угольная кислота никогда не существует в виде самостоятельного вещества.
Фактически, она является смесью ионов водорода и карбонат-ионов (или гидрокарбонат-ионов):
H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2-
Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы
. Обычно к ним относятся кислотные остатки.
Положительно заряженные ионы - катионы
. Чаще всего это водород и металлы.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним - анион. Даже если формула не содержит никаких зарядов.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. Вот скелетная формула гидрокарбонат-аниона:
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки.
Проще говоря, каждый лишний электрон уменьшает количество химических связей, изображаемых в структурной формуле.
С другой стороны, если у какого-то узла структурной формулы стоит знак +, то у него появляется дополнительная палочка.
Как всегда, подобный факт нужно продемонстрировать на примере.
Но среди знакомых нам веществ не встречается ни одного катиона, который состоял бы из нескольких атомов.
А таким веществом является аммиак . Его водный раствор часто называется нашатырный спирт
и входит в состав любой аптечки.
Аммиак является соединением водорода и азота и имеет рациональную формулу NH3
.
Рассмотрим химическую реакцию, которая происходит при растворении аммиака в воде:
NH3 + H2O <=> NH4^+ + OH^-
То же самое, но с использованием структурных формул:
H|N<`/H>\H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
Они образовались в результате того, что один атом водорода переместился из молекулы воды в молекулу аммиака.
Но этот атом переместился без своего электрона. Анион нам уже знаком - это гидроксид-ион.
А катион называется аммоний
. Он проявляет свойства, схожие с металлами.
Например, он может объединиться с кислотным остатком.
Вещество, образованное соединением аммония с карбонат-анионом называется карбонат аммония:
(NH4)2CO3
.
Вот уравнение реакции взаимодействия аммония с карбонат-анионом, записанное в виде структурных формул:
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-\C|O`|/O^- <=> H|N^+<`/H><_(A75,w+)H>_(A15,d+)H`|0O^-\C|O`|/O^-|0H_(A-15,d-)N^+<_(A105,w+)H><\H>`|H
Но в таком виде уравнение реакции дано в демонстрационных целях. Обычно уравнения используют рациональные формулы:
2NH4^+ + CO3^2- <=> (NH4)2CO3
Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
Но есть ещё один вопрос, который стоит рассмотреть подробнее.
Чем же всё-таки отличаются брутто-формулы от рациональных?
Мы знаем почему рациональная формула угольной кислоты записывается H2CO3
, а не как-то иначе.
(Сначала идут два катиона водорода, а за ними карбонат-анион).
Но почему брутто-формула записывается CH2O3
?
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
ведь в ней нет повторяющихся элементов. В отличие от NH4OH
или
Ca(OH)2
.
Но к брутто-формулам очень часто применяется дополнительное правило, определяющее порядок следования элементов.
Правило довольно простое: сначала ставится углерод, затем водород, а дальше остальные элементы в алфавитном порядке.
Вот и выходит CH2O3
- углерод, водород, кислород.
Это называется системой Хилла. Она используется практически во всех химических справочниках. И в этой статье тоже.
Немного о системе easyChem
Вместо заключения мне хотелось бы рассказать о системе easyChem. Она разработана для того, чтобы все те формулы, которые мы тут обсуждали, можно было легко вставить в текст. Собственно, все формулы в этой статье нарисованы при помощи easyChem.
Зачем вообще нужна какая-то система для вывода формул? Всё дело в том, что стандартный способ отображения информации в интернет-браузерах - это язык гипертекстовой разметки (HTML). Он ориентирован на обработку текстовой информации.
Рациональные и брутто-формулы вполне можно изобразить при помощи текста.
Даже некоторые упрощённые структурные формулы тоже могут быть записаны текстом,
например спирт CH3-CH2-OH
.
Хотя для этого пришлось бы в HTML использовать такую запись:
CH3-CH2-OH .
Это конечно создаёт некоторые трудности, но с ними можно смириться. Но как изобразить структурную формулу?
В принципе, можно использовать моноширинный шрифт:
H H | | H-C-C-O-H | | H H Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Здесь не остаётся иного пути, кроме подключения растрового изображения.
Растры хранятся в отдельных файлах. Браузеры могут подключать изображения в формате gif, png или jpeg.
Для создания таких файлов требуется графический редактор. Например, Фотошоп.
Но я более 10 лет знаком с Фотошопом и могу сказать точно, что он очень плохо подходит для изображения химических формул.
Гораздо лучше с этой задачей справляются
молекулярные редакторы .
Но при большом количестве формул, каждая из которых хранится в отдельном файле, довольно легко в них запутаться.
Например, число формул в этой статье равно .
Из них выведены виде графических изображений (остальные при помощи средств HTML).
Система easyChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Кроме того, брутто-формулы в этой статье вычисляются автоматически.
Потому что easyChem работает в два этапа: сначала текстовое описание преобразуется в информационную структуру (граф),
а затем с этой структурой можно выполнять различные действия.
Среди них можно отметить следующие функции: вычисление молекулярной массы, преобразование в брутто-формулу,
проверка на возможность вывода в виде текста, графическая и текстовая отрисовка.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Причём, мне не пришлось думать, какая из формул будет графической, а какая - текстовой.
Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце.
В первой строчке описание рациональной формулы очень похоже на отображаемый результат.
Разница только в том, что числовые коэффициенты выводятся подстрочником.
Во второй строке развёрнутая формула задана в виде трёх отдельных цепочек, разделённых символом;
Я думаю, нетрудно заметить, что текстовое описание во многом напоминает те действия,
которые потребовались бы для изображения формулы карандашом на бумаге.
В третьей строке демонстрируется использование наклонных линий при помощи символов \ и /.
Значок ` (обратный апостроф) означает, что линия проводится справа налево (или снизу вверх).
Здесь есть гораздо более подробная документация по использованию системы easyChem.
На этом разрешите закончить статью и пожелать удачи в изучении химии.
Краткий толковый словарь использованных в статье терминов
Углеводороды Вещества, состоящие из углерода и водорода. Отличаются друг от друга структурой молекул. Структурные формулы схематические изображения молекул, где атомы обозначаются латинскими буквами, а химические связи - чёрточками. Структурные формулы бывают развёрнутыми, упрощёнными и скелетными. Развёрнутые структурные формулы - такие структурные формулы, где каждый атом представлен в виде отдельного узла. Упрощённые структурные формулы - такие структурные формулы, где атомы водорода записаны рядом с тем элементом, с которым они связаны. А если к одному атому крепится больше одного водорода, то количество записывается в виде числа. Так же можно сказать, что в качестве узлов в упрощённых формулах выступают группы. Скелетные формулы - структурные формулы, где атомы углерода изображаются в виде пустых узлов. Число атомов водорода, связанных с каждым атомом углерода равно 4 минус число связей, которые сходятся в узле. Для узлов, образованных не углеродом, применяются правила упрощённых формул. Брутто-формула (она же истинная формула) - список всех химических элементов, которые входят в состав молекулы, с указанием количества атомов в виде числа (если атом один, то единица не пишется) Система Хилла - правило, определяющее порядок следования атомов в брутто-формуле: первым ставится углерод, затем водород, а далее остальные элементы в алфавитном порядке. Это а система используется очень часто. И все брутто-формулы в этой статье записаны по системе Хилла. Функциональные группы Устойчивые сочетания атомов, которые сохраняются в процессе химических реакций. Часто функциональные группы имеют собственные названия, влияют на химические свойства и научное название веществаВыполним обратное задание. Составим название органического соединения по ее структурной формуле. (Прочитайте правила составления названий органических соединений. Составите название органического соединения по структурной формуле.)
4. Многообразие органических соединений.
Ежедневно количество добытых и описанных химиками органических веществ возрастает почти на тысячу. Сейчас их известно около 20 миллионов (неорганических соединений существует в десятки раз меньше).
Причиной многообразия органических соединений является уникальность атомов Карбона, а именно:
- достаточно высокая валентность - 4;
Возможность создания простых, двойных и тройных ковалентных связей;
Способность сочетаться друг с другом;
Возможность образования линейных цепей, разветвленных, а также замкнутых, которые называют циклами.
Среди органических веществ наибольшее соединений Карбона с Гидрогеном; их называют углеводородами. Это название происходит от старых названий элементов - "углерод" и "водород".
Современная классификация органических соединений базируется на теории химического строения. В основу классификации положены особенности строения углеродной цепи углеводородов, поскольку они просты по составу и в большинстве известных органических веществ углеводородные радикалы составляют основную часть молекулы.
5. Классификация насыщенных углеводородов.
Органические соединения можно классифицировать:
1) по структуре их карбонового каркаса. В основе такой классификации лежат четыре главных класса органических соединений (алифатические соединения, алициклические соединения, ароматические соединения и гетероциклические соединения);
2) по функциональным группам.




Ациклические (нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
Среди разнообразия органических соединений можно выделить группы веществ, которые сходны по своим свойствам и отличаются между собой на группу - СН 2 .
Ø Соединения, сходные по химическим свойствам и состав которых отличается между собой на группу - СН 2 , называются гомологами.
Ø Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд.
Ø Группа - СН2 2 , называется гомологической разностью.
Примером гомологического ряда может быть ряд насыщенных углеводородов (алканов). Самый простой его представитель - метан СН 4 . Окончание -ан
характерно для названий предельных углеводородов. Далее идут этан С 2 Н 6 , пропан СзН 8 , бутан С 4 Н 10 . Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончание -ан
. Это пентан С 5 Н 12 , гексан С 6 Н 14 , гептан С 7 Н 16 , октан С 8 Н 18 , нонан СдН 20 , декан С 10 Н 22 и т. д.
Формулу любого следующего гомолога можно получить добавлением к формуле предыдущего углеводорода гомологической разности.
Четыре С-Н связи, например, в метане, равноценны и размещены симметрично (тетраэдрично) под углом 109 0 28 относительно друг друга. Это объясняется тем, что одна 2s и три 2p-орбитали объединяются так, чтобы образовать четыре новые (идентичные) орбитали, способные дать более прочные связи. Эти орбитали направлены к вершинам тетраэдра - такого размещения, когда орбитали максимально удалены друг от друга. Такие новые орбитали называются sp 3
– гибридизоваными атомными орбиталями.
Наиболее удобной номенклатурой, что дает возможность называть любые соединения, является
систематическа
я номенклатура органических соединений.
Чаще всего систематические названия основываются на принципе замещения, то есть любое соединение рассматривается как неразветвленный углеводород - ациклический или циклический, в молекуле которого один или несколько атомов Водорода замещены другими атомами и группами, в том числе углеводородными остатками. С развитием органической химии систематическая номенклатура постоянно совершенствуется и дополняется, за этим следит комиссия по номенклатуре Международного союза теоретической и прикладной химии (Internation Union of Pure and Applied Chemistry - IUPAC).
Номенклатура алканов и их производных названия первым десяти членам ряда насыщенных углеводородов уже дано. Чтобы подчеркнуть, что алкан имел неразветвленный углеродный цепь, часто к названию добавляют слово нормальный (н-), например:

При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называют углеводородными радикалами (сокращенно обозначают буквой R.
Названия одновалентных радикалов происходят от названий соответствующих углеводородов с заменой окончания -ан на -ил (-ил). Вот соответствующие примеры:

Контроль знаний:
1. Что изучает органическая химия?
2. Как отличить органические вещества от неорганических?
3. Элемент обязанностью входит в состав органических соединений?
4. Перелечите типы органических реакций.
5. Запишите изомеры бутана.
6. Какие соединения называются насыщенными?
7. Которые номенклатуры вам известны? В чем заключается их суть?
8. Что такое изомеры? Приведите примеры.
9. Что такое структурная формула?
10. Запишите шестой представитель алканов.
11. Как классифицируют органические соединения?
12. Какие способы разрыва связи вам известны?
13. Перелечите типы органических реакций.
ДОМАШНЕЕ ЗАДАНИЕ
Проработать: Л1. Стр.4-6 Л1. Стр.8-12,пересказ конспекта лекции №8.
Лекция № 9.
Тема: Алканы: гомологический ряд, изомерия и номенклатура алканов. Химические свойства алканов (на примере метана и этана): горение, замещение, разложение и дегидрирование. Применение алканов на основе свойств.
алканы,гомологический ряд алканов, крекинг, гомологи, гомологическая разность, строение алканов: тип гибридизации – sр 3 .
План изучения темы
1. Насыщенные углеводороды: состав, строение, номенклатура.
2.Типы химических реакций, характерные для органических соединений.
3.Физические свойства (на примере метана).
4. Получение предельных углеводородов.
5. Химические свойства.
6.Применение алканов.
1. Насыщенные углеводороды: состав, строение, номенклатура.
Углеводороды
- простейшие органические соединения, состоящие из двух элементов: углерода и водорода.
Алканами или насыщенными углеводородами (международное название), называют углеводороды, в молекулах которых атомы Углерода соединены друг с другом простыми (ординарными) связями, а валентности углеродных атомов, которые не принимают участия в их взаимном сочетании, образуют связи с атомами Водорода.
Алканы образуют гомологический ряд соединений, отвечающих общей формуле С n Н 2n+2,
где: п
- число атомов углерода.
В молекулах насыщенных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а остальные валентностей насыщены атомами водорода. Алканы называют также парафинами.
Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры.
Правила систематической номенклатуры.
Общее (родовое) название предельных углеводородов - алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан (этим подчеркивается сходство всех предельных углеводородов с родоначальником этого ряда - метаном). Для простейших углеводородов изостроения сохраняются их несистематические названия: изобутан, изопентан, неопентад.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода - метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
Свою номенклатуру имеют и радикалы
(углеводородные радикалы). Одновалентные радикалы называют алкилами
и обозначают буквойR
илиAlk
.
Их общая формула
C n H 2n+ 1 .
Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан - метил, этан - этил, пропан - пропил и т.д.).
Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН 2).
Трехвалентные радикалы имеют суффикс -илидин (исключение - радикал метин ==СН).
В таблице приведены названия первых пяти углеводородов, их радикалов, возможных изомеров и соответствующие им формулы.
|
2.Типы химических реакций, характерные для органических соединений
1) Реакции окисления (горения):
Такие реакции характерны для всех представителей гомологических рядов 2) Реакции замещения:
Такие реакции характерны для алканов, аренов (при определенных условиях), а также возможные для представителей других гомологичных рядов.
3) Реакции отщепления
: Такие реакции возможны для алканов, алкенов.
4) Реакции присоединения:
Такие реакции возможны для алкенов, алкинов, аренов.
 Простейшая органическое вещество - метан
- имеет молекулярную формулу СН 4 . Структурная формула метана:
Простейшая органическое вещество - метан
- имеет молекулярную формулу СН 4 . Структурная формула метана:
Электронная формула метана:
Молекула метана имеет форму тетраэдра : в центре - атом Углерода, в вершинах - атомы Водорода, соединения направлены к вершинам тетраэдра под углом.
3. Физические свойства метана . Газ без цвета и запаха, легче воздуха, мало растворим в воде. В природе метан образуется при гниении растительных остатков без доступа воздуха.
Метан является основной составной частью природного газа.
Алканы практически нерастворимы в воде, потому что их молекулы малополярные и не взаимодействуют с молекулами воды, но хорошо растворяются в неполярных органических растворителях, таких как бензен, тетрахлорметан. Жидкие алканы легко смешиваются друг с другом.
4.Получение метана.
1) С натрий ацетата:
2) Синтезом из углерода и водорода (400-500 и повышенное давление):
3) С алюминий карбида(в лабораторных условиях):
4) Гидрирование (присоединение водорода) непредельных углеводородов:
5) Реакция Вюрца, что служит для увеличения карбонной цепи:![]()
5. Химические свойства метана:
1) Не вступают в реакции присоединения.
2) Горят:
3) Разлагаются при нагревании:
4) Вступают в реакции галогенирование
(реакции замещения):
5) При нагревании и под действием катализаторов происходит крекинг
- гемолитический разрыв С-С связей. При этом образуются алканы и низшие алканы, например:
6) При дегидрирование метана и этилена образуется ацетилен:
7) Горения:- при достаточном количестве кислорода образуется углекислый газ и вода:
- при недостаточном количестве кислорода образуется угарный газ и вода:
- или углерод и вода:
Смесь метана с воздухом взрывоопасна.
8) Термическое разложение без доступа кислорода на углерод и водород:
6.Применение алканов:
Метан в больших количествах расходуется в качестве топлива. Из него получают водород, ацетилен, сажу. Он используется в органических синтезах, в частности, для получения формальдегида, метанола, муравьиной кислоты и других синтетических продуктов.
При обычных условиях первые четыре члена гомологического ряда алканов - газы.
Нормальные алканы от пентана до гептадекана - жидкости, начиная с и выше - твердые вещества. По мере увеличения числа атомов в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
Низшие члены гомологического ряда используются для получения соответствующих непредельных соединений реакцией дегидрирования. Смесь пропана и бутана используется в качестве бытового топлива. Средние члены гомологического ряда применяются как растворители и моторные топлива.
Большое промышленное значение имеет окисление высших предельных углеводородов - парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
Контроль знаний:
1. Какие соединения называются насыщенные?
2. Которые номенклатуры вам известны? В чем заключается их суть?
3. Что такое изомеры? Приведите примеры.
4. Что такое структурная формула?
5. Запишите шестой представитель алканов.
6. Что такое гомологический ряд и гомологическая разница.
7. Назовите правила, которыми пользуются, когда называют соединения.
8. Определите формулу парафина, 5,6 г которого (н. у.) имеют массу 11г.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр. 25-34,пересказ конспекта лекции №9.
Лекция № 10.
Тема: Алкены . Этилен, его получение (дегидрированием этана и дегидратацией этанола). Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация. Полиэтилен , его свойства и применение. Применение этилена на основе свойств.
Алкины. Ацетилен , его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды , присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Основные понятия и термины по теме: алкены и алкины,гомологический ряд, крекинг, гомологи, гомологическая разность, строение алкенов и алкинов: тип гибридизации.
План изучения темы
(перечень вопросов, обязательных к изучению):
1Ненасыщенные углеводороды: состав.
2.Физические свойства этилена и ацетилена.
3.Строение.
4.Изомерия алкенов и алкинов.
5.Получение непредельных углеводородов.
6.Химические свойства.
1.Ненасыщенные углеводороды: состав:
Углеводороды с общей формулой СnH 2 n и СnH 2 n -2 , в молекулах которых между атомами углерода имеется двойная связь или тройная связь называются непредельными. Углеводороды с двойной связью относятся к непредельным ряда этилена (называют этиленовыми углеводородами, или алкенами) , с тройной – ряда ацетилена.
2.Физические свойства этилена и ацетилена:
Этилен и ацетилен - это бесцветные газы. Они плохо растворяются в воде, но хорошо в бензине, эфире и других неполярных растворителях. Температура кипения тем больше, чем больше их молекулярная масса. В сравнении с алканами, алкины имеют более высокие температуры кипения. Плотность алкинов меньше плотности воды.
3.Строение ненасыщенных углеводородов:
Изобразим строение молекул этилена и ацетилена структурно. Если углерод считать четырехвалентным, то исходя из молекулярной формулы этилена, у него не все валентности востребованы, а у ацетилена лишними оказываются четыре связи. Изобразим структурные формулы этих молекул:

На образование двойной связи атом углерода затрачивает по два электрона, а на тройную связь по три электрона. В формуле это обозначается в виде двух или трех точек. Каждая черточка – это пара электронов.

электронная формула.
Экспериментально доказано, что в молекуле с двойной связью одна из них относительно легко разрывается, соответственно с тройной связью легко разрываются две связи. Мы можем продемонстрировать это на опыте.
Демонстрация опыта:
1.Смесь спирта с H 2 SO 4 нагреваем в пробирке с песком. Газ пропускаем через раствор KMnO 4 , затем поджигаем.
Обесцвечивание раствора происходит по причине присоединения атомов по месту разрыва кратных связей.
3СН 2 =СН 2 +2КМnO 4 +4H 2 O → 2MnO 2 +3C 2 H 4 (OH) 2 +2KOH
Электроны, образующие кратные связи, в момент взаимодействия с КМnO 4 распариваются, образуются непарные электроны, легко вступающие во взаимосвязь с другими атомами с неспаренными электронами.
Этилен и ацетилен являются первыми в гомологических рядах алкенов и алкинов.
Этен. На плоской горизонтальной поверхности, которая демонстрирует плоскость перекрывания гибридных облаков (σ – связи) лежат 5 σ –связей. Перпендикулярно этой поверхности лежат Р –облака негибридные, они образуют одну π-связь.
Этин. В этой молекуле две π -связи, которые лежат в плоскости, перпендикулярной плоскости σ –связи и взаимно перпендикулярно друг другу. π-связи непрочные, т.к. имеют небольшую область перекрывания.
4.Изомерия алкенов и алкинов.
В ненасыщенных углеводородах кроме изомерии по углеродному скелету появляется новый вид изомерии - изомерия по положению кратной связи . Положения кратной связи указывается цифрой в конце названия углеводорода.
Например:
бутен-1;
бутин-2.
Считают атомы Карбона с той стороны, к которой ближе кратная связь.
Например:
![]() 4-метилпентен-1
4-метилпентен-1
Для алкенов и алкинов изомерия зависит от положения кратной связи и строения углеродной цепи. Поэтому в названии цифрой следует указать положение боковых цепей и положение кратной связи.
изомерия кратной связи: СН3-СН2-СН=СН2 СН3-СН=СН-СН3
бутен-1 бутен-2
Для непредельных углеводородов характерна пространственная или стереоизомерия. Она называется цис-, трансизомерией.
Подумайте, какое из этих соединений может иметь изомер.

Цистрансизомерия возникает только в случае, если каждый атом углерода при кратной связи соединен с разными атомами или группами атомов. Поэтому в молекуле хлорэтена (1) как бы мы не повернули атом хлора, молекула будет такой же. Другое дело в молекуле дихлорэтена (2), где положение атомов хлора относительно кратной связи может быть различным.
Физические свойства углеводорода зависят не только от количественного состава молекулы, но и от ее строения.
Так, цисизомер 2 – бутена имеет температуру плавления – 138ºС, а его трансизомер – 105,5ºС.
Этен и этин : промышленные способы их получения связаны с дегидрированием предельных углеводородов.

5.Получение непредельных углеводородов:
1. Крекинг нефтепродуктов . В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов.
![]()
2.Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:

3.Дегидратация с пиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров)
4.Дегидрогалогенировани е (отщепление галогеноводорода).
При взаимодействии галогеналкана со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода. Реакция идет в присутствии катализаторов (платины или никеля) и при нагревании. В зависимости от степени дегидрирования можно получить алкены или алкины, а также осуществить переход от алкенов к алкинов: ![]()
Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева:Водород в реакциях разложения отщепляется от того атома Углерода, у которого наименьшее количество атомов Водорода:
![]()
(Водород отщепляется от , но не от ).
5. Дегалогенирование.
При действии цинка на дибромпроиз-водное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:

6. В промышленности ацетилен в основном получают термическим разложением метана:
6.Химические свойства.
Химические свойства непредельных углеводородов связаны прежде всего с наличием π – связи в молекуле . Область перекрывания облаков в этой связи мала, поэтому она легко разрывается, а углеводороды насыщаются другими атомами. Для непредельных углеводородов характерны реакции присоединения.
Для этилена и его гомологов характерны реакции, идущие с разрывом одной из двойных соединений и присоединением атомов по месту разрыва, то есть реакции присоединения.
1) Горение (в достаточном количестве кислорода или воздуха):
2) Гидрирование (присоединение водорода):
3) Галогенирование (присоединение галогенов):
4) Гидро галогенирование (присоединение галогеноводородов):
Качественной реакцией на непредельные углеводороды:
1) являются обесцвечивание бромной воды или 2) раствора калий перманганата.
При взаимодействии бромной воды с ненасыщенными углеводородами происходит присоединение брома по месту разрыва кратных связей и, соответственно, исчезновения окраски, которое было обусловлено растворенным бромом:
Правило Марковникова
:
Водород присоединяется к тому атому Углерода, который связан с большим числом атомов Водорода
. Это правило можно показать на реакциях гидратации несимметричных алкенов и гидро- галогенирование:
![]()
2-хлорпропан
При взаимодействии галогеноводородов с алкинами присоединения второй молекулы галогеноводню идет в соответствии с правилом Марковникова:
Для ненасыщенных соединений характерны реакции полимеризации.
Полимеризация
- это последовательное соединение молекул низкомолекулярного вещества с образованием высокомолекулярного вещества. При этом соединение молекул происходит по месту разрыва двойных связей. Например, полимеризация этена:
Продукт полимеризации называется полимером, а исходное вещество, вступающее в реакцию, -мономером
; повторяющиеся в полимере группировки называются структурными
или элементарными звеньями
; число элементарных звеньев в макромолекуле называется степенью полимеризации.
Название полимера складывается из названия мономера и приставки поли-,
например полиэтилен, поливинилхлорид, полистирол. В зависимости от степени полимеризации тех же мономеров можно получать вещества с различными свойствами. Например, полиэтилен с короткими цепями является жидкостью, что имеет смазочные свойства. Полиэтилен с длиной цепи в 1500-2000 звеньев - твердый, но гибкий пластический материал, идущий на изготовление пленки, посуды, бутылок. Полиэтилен с длиной цепи в 5-6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, трубы. В расплавленном состоянии полиэтилена можно придать любую форму, которая сохраняется после отверждения. Такое свойство называется термопластичностью.
Контроль знаний:
1. Какие соединения называются ненасыщенные?
2. Изобразить все возможные изомеры для углеводорода с двойной связью состава С 6 Н 12 и С 6 Н 10 . Дать им названия. Составить уравнение реакции горения пентена, пентина.
3. Решить задачу: Определить объем ацетилена, который можно получить из карбида кальция массой 100 г, массовой долей 0,96, если выход составляет 80% ?
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр. 43-47,49-53, Л1. Стр. 60-65, пересказ конспекта лекции №10.
Лекция № 11.
Тема: Единство химической организации живых организмов. Химический состав живых организмов. Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Представление о водородной связи. Химические свойства этанола : горение, взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Вредное воздействие спиртов на организм человека. Понятие о предельных многоатомных спиртах . Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты . Применение глицерина .
Альдегиды. Получение альдегидов окислением соответствующих спиртов. Химические свойства альдегидов: окисление в соответствующую кислоту и восстановление в соответствующий спирт. Применение формальдегида и ацетальдегида на основе свойств.
Основные понятия и термины
ОПРЕДЕЛЕНИЕ
Структурная формула - это химическая формула, отражающая то, как атомы связаны внутри молекулы.
Она имеет две разновидности: плоскостная (2D) и пространственная (3D) (рис. 1). Внутримолекулярные связи при изображении структурной формулы принято обозначать черточками (штрихами).
Рис. 1. Структурная формула этилового спирта: а) плоскостная; б) пространственная.
Плоскостные структурные формулы могут изображаться по-разному. Выделяют краткую графическую формулу, в которой связи атомов с водородом не указываются:
CH 3 - CH 2 - OH
скелетную графическую формулу, которую наиболее часто используют при изображении строения органических соединений, в ней не только не указываются связи углерода с водородом, но и не обозначаются связи, соединяющие атомы углерода друг с другом и другими атомами:

для органических соединений ароматического ряда используются специальные структурные формулы, изображающие бензольное кольцо в виде шестиугольника:

Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Укажите молекулярную и структурную формулы сульфата магния и рассчитайте молекулярную массу этого соединения. |
| Ответ | Молекулярная формула сульфата магния MgSO 4 . Она показывает, что в состав данной молекулы входят один атома магния (Ar = 24 а.е.м.), один атом серы (Ar = 32 а.е.м.) и четыре атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу сульфата магния:
Mr(MgSO 4) = Ar(Mg) + Ar(S) + 4×Ar(O); |