Историческая справка.
1) М.В. Ломоносов, проведя стройные рассуждения и простые опыты, пришел к выводу, что «причина теплоты состоит во внутреннем движении частиц связанной материи… Весьма известно, что тепло возбуждается движением: руки от взаимного трения согреваются, дерево загорается, искры вылетают при ударе кремнием о сталь, железо накаливается при ковании его частиц сильными ударами»
2) Б. Румфорд, работая на заводе по изготовлению пушек, заметил, что при сверлении пушечного ствола он сильно нагревается. Например, он помещал металлический цилиндр массой около 50 кг в ящик с водой и, сверля цилиндр сверлом, доводил воду в ящике до кипения за 2.5часа.
3) Дэви в 1799 году осуществил интересный опыт. Два куска льда при трении одного о другой начали таять и превращаться в воду.
4) Корабельный врач Роберт Майер в 1840 году во время плавания на остров Яву заметил, что после шторма вода в море всегда теплее, чем до него.
Вычисление работы.
В механике
работа определяется как произведение модулей силы и перемещения: A=FS. При
рассмотрении термодинамических процессов механическое перемещение макротел в
целом не рассматривается. Понятие работы здесь связывается с изменением объема
тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот
приводит к изменению расстояния между частицами, а также часто к изменению
скоростей их движения, следовательно, к изменению внутренней энергии тела.
Пусть в цилиндре с подвижным поршнем находится газ при температуре T 1 (рис.). Будем медленно нагревать газ до температуры T 2 . Газ будет изобарно расширяться, и поршень переместится из положения 1 в положение 2 на расстояние Δl . Сила давления газа при этом совершит работу над внешними телами. Так как p = const, то и сила давления F = pS тоже постоянная. Поэтому работу этой силы можно рассчитать по формуле A =F Δ l =pS Δ l =p Δ V , A= p Δ V
где ΔV - изменение объема газа. Если объем газа не изменяется (изохорный процесс), то работа газа равна нулю.
Почему при сжатии или расширении меняется внутренняя энергия тела? Почему при сжатии газ нагревается, а при расширении охлаждается?
Причиной изменения температуры газа при сжатии и расширении является следующее: при упругих соударениях молекул с движущимся поршнем их кинетическая энергия изменяется .
- Если газ сжимается, то при столкновении движущийся навстречу поршень передаёт молекулам часть своей механической энергии, в результате чего газ нагревается;
- Если газ расширяется, то после столкновения с удаляющимся поршнем скорости молекул уменьшаются. в результате чего газ охлаждается.
При сжатии и расширении меняется и средняя потенциальная энергия взаимодействия молекул, так как при этом меняется среднее расстояние между молекулами.
Работа внешних сил, действующих на газ
- При сжатии газа, когда ΔV = V 2 – V 1 < 0 , A>0, направления силы и перемещения совпадают;
- При расширении, когда ΔV = V 2 – V 1 > 0 , A<0, направления силы и перемещения противоположны.
Запишем уравнение Клапейрона-Менделеева для двух состояний газа:
pV 1 = m/M*RT 1 ; pV 2 =m/M* RT 2 ⇒
p (V 2 − V 1 )= m/M* R (T 2 − T 1 ).
Следовательно, при изобарном процессе
A = m/M* R Δ T .
Если m = М (1 моль идеального газа), то при ΔΤ = 1 К получим R = A . Отсюда вытекает физический смысл универсальной газовой постоянной : она численно равна работе, совершаемой 1 моль идеального газа при его изобарном нагревании на 1 К.
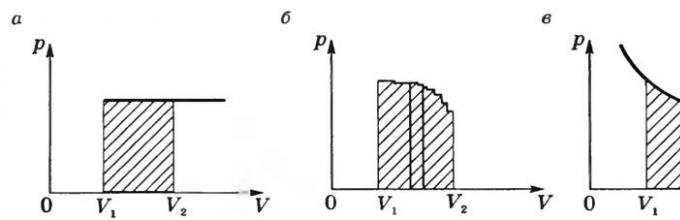
Геометрическое истолкование работы:
На графике p = f(V) при изобарном процессе работа равна площади заштрихованного на рисунке а) прямоугольника.
Если процесс
не изобарный (рис. б), то кривую p
= f
(V
) можно
представить как ломаную, состоящую из большого количества изохор и изобар.
Работа на изохорных участках равна нулю, а суммарная работа на всех изобарных
участках будет равна площади заштрихованной фигуры. При изотермическом процессе
(Т
= const) работа равна площади заштрихованной фигуры, изображенной на
рисунке в.

>>Физика: Работа в термодинамике
В результате каких процессов может меняться внутренняя энергия? Вы уже знаете, что есть два вида таких процессов: совершение работы и теплопередача. Начнем с работы. Чему она равна при сжатии и расширении газа и других тел?
Работа в механике и термодинамике.
В механике
работа определяется как произведение модуля силы, модуля перемещения точки ее приложения и косинуса угла между ними. При действии силы на движущееся тело работа равна изменению его кинетической энергии.
В движение тела как целого не рассматривается, речь идет о перемещении частей макроскопического тела друг относительно друга. В результате может меняться объем тела, а его скорость остается равной нулю. Работа в термодинамике определяется так же, как и в механике, но она равна не изменению кинетической энергии тела, а изменению его внутренней энергии.
Изменение внутренней энергии при совершении работы.
Почему при сжатии или расширении тела меняется его внутренняя энергия тела? Почему, в частности, нагревается воздух при накачивании велосипедной шины?
Причина изменения температуры газа в процессе его сжатия состоит в следующем: при упругих соударениях молекул газа с движущимся поршнем изменяется их кинетическая энергия
. Так, при движении навстречу молекулам газа поршень во время столкновений передает им часть своей механической энергии, в результате чего газ нагревается. Поршень действует подобно футболисту, встречающему летящий мяч ударом ноги. Нога сообщает мячу скорость, значительно большую той, которой он обладал до удара.
И наоборот, если газ расширяется, то после столкновения с удаляющимся поршнем скорости молекул уменьшаются, в результате чего газ охлаждается. Так же действует и футболист, для того чтобы уменьшить скорость летящего мяча или остановить его, - нога футболиста движется от мяча, как бы уступая ему дорогу.
При сжатии или расширении меняется и средняя потенциальная энергия взаимодействия молекул, так как при этом меняется среднее расстояние между молекулами.
Вычисление работы.
Вычислим работу в зависимости от изменения объема на примере газа в цилиндре под поршнем (рис.13.1
).
Проще всего вначале вычислить не работу силы , действующей на газ со стороны внешнего тела (поршня), а работу, которую совершает сила давления газа, действуя на поршень с силой . Согласно третьему закону Ньютона  . Модуль силы, действующей со стороны газа на поршень, равен
. Модуль силы, действующей со стороны газа на поршень, равен ![]() , где p
- давление газа, а S
- площадь поверхности поршня. Пусть газ расширяется изобарно и поршень смещается в направлении силы на малое расстояние
, где p
- давление газа, а S
- площадь поверхности поршня. Пусть газ расширяется изобарно и поршень смещается в направлении силы на малое расстояние ![]() . Так как давление газа постоянно, то работа газа равна:
. Так как давление газа постоянно, то работа газа равна:
Эту работу можно выразить через изменение объема газа. Начальный его объем V 1 =Sh 1
, а конечный V 2 =Sh 2
. Поэтому
где - изменение объема газа.
При расширении газ совершает положительную работу, так как направление силы и направление перемещения поршня совпадают.
Если газ сжимается, то формула (13.3) для работы газа остается справедливой. Но теперь ![]() , и поэтому
, и поэтому ![]() (рис.13.2
).
(рис.13.2
).

Работа A
, совершаемая внешними телами над газом, отличается от работы самого газа A
´ только знаком: ![]() , так как сила , действующая на газ, направлена против силы а перемещение поршня остается тем же самым. Поэтому работа внешних сил, действующих на газ, равна:
, так как сила , действующая на газ, направлена против силы а перемещение поршня остается тем же самым. Поэтому работа внешних сил, действующих на газ, равна:
При сжатии газа, когда , работа внешней силы оказывается положительной. Так и должно быть: при сжатии газа направления силы и перемещения точки ее приложения совпадают.
Если давление не поддерживать постоянным, то при расширении газ теряет энергию и передает ее окружающим телам: поднимающемуся поршню, воздуху и т. д. Газ при этом охлаждается. При сжатии газа, наоборот, внешние тела передают ему энергию и газ нагревается.
Геометрическое истолкование работы.
Работе A´
газа для случая постоянного давления можно дать простое геометрическое истолкование.
Построим график зависимости давления газа от занимаемого им объема (рис.13.3
). Здесь площадь прямоугольника abdc
, ограниченная графиком p 1
=const, осью V
и отрезками ab
и cd
, равными давлению газа, численно равна работе (13.3):

В общем случае давление газа не остается неизменным. Например, при изотермическом процессе оно убывает обратно пропорционально объему (рис.13.4
). В этом случае для вычисления работы нужно разделить общее изменение объема на малые части и вычислить элементарные (малые) работы, а потом все их сложить. Работа газа по-прежнему численно равна площади фигуры, ограниченной графиком зависимости p
от V
, осью V
и отрезками ab
и cd
, равными давлениям p 1
, p 2
в начальном и конечном состояниях газа.

???
1. Почему газы при сжатии нагреваются?
2. Положительную или отрицательную работу совершают внешние силы при изотермическом процессе, изображенном на рисунке 13.2?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиЕсли у вас есть исправления или предложения к данному уроку,
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро )

Масс у , в свою очередь, можно вычислить, как произведение плотности и объема .

Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:

Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:

Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ

Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:

Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы .
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:

протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.

идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.

. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:

Внутренняя энергия одноатомного и двухатомного идеального газа

Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.

Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.

Тепловые машины. Формула КПД в термодинамике
Тепловая машина , в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вно вь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле

Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе , специалисты которого готовы в любой момент прийти на выручку.
Работа в термодинамике
В термодинамике, в отличие от механики, рассматривается не движение тела как целого, а лишь относительное изменение частей термодинамической системы, в результате которого меняется ее объем.
Рассмотрим работу газа при изобарическом расширении.
Вычислим работу, совершаемую газом при его действии на поршень с силой ${F"}↖{→}$, равной по величине и противоположной по направлению силе ${F"}↖{→}$, действующей на газ со стороны поршня: ${F"}↖{→}=-{F"}↖{→}$ (согласно третьему закону Ньютона), $F"=pS$, где $p$ — давление газа, а $S$ — площадь поверхности поршня. Если перемещение поршня $∆h$ в результате расширения мало, то давление газа можно считать постоянным и работа газа равна:
$A"=F"∆h=pS∆h=p∆V$
Если газ расширяется, он совершает положительную работу, та к как перемещение поршня совпадает по направлению с силой ${F"}↖{→}$. Если газ сжимается, то работа газа отрицательна, поскольку перемещение поршня противоположно силе ${F"}↖{→}$. В формуле $A"=F"∆h=pS∆h=p∆V$ появится знак «минус»: $∆V

Работа внешних сил $А$, наоборот, положительна при сжатии газа и отрицательна при расширении:
Совершая над газом положительную работу, внешние тела передают ему часть своей энергии. При расширении газа внешние тела отбирают у газа часть его энергии — работа внешних сил отрицательна.

На графике зависимости давления от объема $р(V)$ работа определяется как площадь, ограниченная кривой $р(V)$, осью $V$ и отрезками $ab$ и $cd$, равными давлениям $р_1$ в начальном ($V_1$) и $р_2$ в конечном ($V_2$) состояниях, как для изобарного, так и для изотермического процессов.
Первый закон термодинамики
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Майером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где $∆U$ — изменение внутренней энергии, $А$ — работа внешних сил, $Q$ — количество теплоты, переданной системе.
Из $∆U=A+Q$ следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, $A=0$ и $Q=0$,а следовательно, $∆U=0$.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение ($∆U=A+Q$) записывается в виде:
где $А"$ - работа, совершаемая системой ($А"=-А$).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника, т. е. только за счет внутренней энергии.
Действительно, если к телу не поступает теплота ($Q=0$), то работа $А"$, согласно уравнению $Q=∆U+A"$, совершается только за счет убыли внутренней энергии $A"=-∆U$. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс. Зависимость $р(Т)$ на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинмический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется ($∆V=0$), и, согласно первому началу термодинамики $Q=∆U+A"$,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа ($A=p∆V=0$) газом не совершается.

Если газ нагревается, то $Q > 0$ и $∆U > 0$, его внутренняя энергия увеличивается. При охлаждении газа $Q
Изотермический процесс графически изображается изотермой.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется ($T=const$), то все переданное газу количество теплоты идет на совершение работы:
При получении газом теплоты ($Q > 0$) он совершает положительную работу ($А" > 0$). Если газ отдает тепло окружающей среде, $Q
Изобарный процесс на термодинамической диаграмме изображается изобарой .
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением $p$.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе согласно формуле $Q=∆U+A"$ передаваемое газу количество теплоты идет на изменение его внутренней энергии $∆U$ и на совершение им работы $A"$ при постоянном давлении:
Работа идеального газа определяется по графику зависимости $p(V)$ для изобарного процесса ($A"=p∆V$).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой ($Q=0$).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия и может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики ($∆U=A+Q$), в адиабатной системе
где $А$ - работа внешних сил.
При адиабатном расширении газа $А
Следовательно,
$∆U={i}/{2}·{m}/{M}R∆T
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе.

На рисунке адиабата $1—2$, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема $V_1$ до $V_2$.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
Принцип действия тепловых двигателей
Тепловой двигатель — это устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Согласно второму началу термодинамики, тепловой двигатель может непрерывно совершать периодически повторяющуюся механическую работу за счет охлаждения окружающих тел, если он не только получает теплоту от более горячего тела (нагревателя), но при этом отдает теплоту менее нагретому телу (холодильнику). Следовательно, на совершение работы идет не все количество теплоты, полученное от нагревателя, а только часть ее.
Таким образом, основными элементами любого теплового двигателя являются:
- рабочее тело (газ или пар), совершающее работу;
- нагреватель, сообщающий энергию рабочему телу;
- холодильник, поглощающий часть энергии от рабочего тела.

Коэффициент полезного действия теплового двигателя
Согласно закону сохранения энергии, работа, совершаемая двигателем, равна:
$A"=|Q_1|-|Q_2|$
где $Q_1$ — количество теплоты, полученное от нагревателя, $Q_2$ — количество теплоты, отданное холодильнику.
Коэффициентом полезного действия (КПД) теплового двигателя называется отношение работы $А"$, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
$η={A"}/{|Q_1|}={|Q_1|-|Q_2|}/{|Q_1|}=1-{|Q_2|}/{|Q_1|}$
Так как у всех двигателей некоторое количество теплоты передается холодильнику, то $η
КПД теплового двигателя пропорционален разности температур нагревателя и холодильника. При $T_1 - T_2=0$ двигатель не может работать.
Цикл Карно
Цикл Карно — это круговой обратимый процесс, состоящий из двух изотермических и двух адиабатических процессов.
Впервые этот процесс был рассмотрен французским инженером и ученым Н. Л. С. Карно в 1824 г. в книге «Размышления о движущей силе огня и о машинах, способных развивать эту силу».
Целью исследований Карно было выяснение причин несовершенства тепловых машин того времени (они имели КПД $< 5%$)и поиски путей их усовершенствования.
Выбор двух изотермических и двух адиабатических процессов был обусловлен тем, что работа газа при изотермическом расширении совершается за счет внутренней энергии нагревателя, а при адиабатном процессе — за счет внутренней энергии расширяющегося газа. В этом цикле исключен контакт тел с разной температурой, следовательно, исключена теплопередача без совершения работы.
Цикл Карно — самый эффективный из всех возможных. Его КПД максимален.

На рисунке изображены термодинамические процессы цикла. В процессе изотермического расширения ($1-2$) при температуре $Т_1$ работа совершается за счет изменения внутренней энергии нагревателя, т. е. за счет подведения к газу количества теплоты $Q_1$:
$A_{12}=Q_1.$ Охлаждение газа перед сжатием ($3-4$) происходит при адиабатном расширении ($2-3$). Изменение внутренней энергии $∆U_{23}$ при адиабатном процессе ($Q=0$) полностью преобразуется в механическую работу:
$A_{23}=-∆U_{23}$
Температура газа в результате адиабатического расширения ($2-3$) понижается до температуры холодильника $Т_2
Цикл завершается процессом адиабатического сжатия ($4—1$), при котором газ нагревается до температуры $Т_1$.
Максимальное значение КПД тепловых двигателей, работающих на идеальном газе, по циклу Карно:
$η={T_1-T_2}/{T_1}=1-{T_2}/{T_1}$
Суть формулы $η={T_1-T_2}/{T_1}=1-{T_2}/{T_1}$ выражена в доказанной С. Карно теореме о том, что КПД любого теплового двигателя не может превышать КПД цикла Карно, осуществляемого при той же температуре нагревателя и холодильника.
Приложение нагрузки к любому сооружению вызывает его деформацию. При этом части сооружения выходят из состояния покоя, приобретают некоторые скорости и ускорения. Если нагрузка возрастает медленно, то эти ускорения невелики, а потому можно пренебречь силами инерции, развивающимися в процессе перехода системы в деформированное состояние. Такое плавное (постепенное) приложение нагрузки называется статическим.
Определим работу внешней нагрузки, например силы Р, статически приложенной к некоторой упругой системе (рис. 1.11), материал которой удовлетворяет закону Гука.
При малых деформациях к этой системе применим принцип независимости действия сил, и, следовательно, перемещения отдельных точек и сечений конструкции прямо пропорциональны величине вызывающей их нагрузки. В общем виде эту зависимость можно выразить равенством
Здесь А - перемещение по направлению действия силы Р; а - некоторый коэффициент, зависящий от материала, схемы и размеров сооружения.
Увеличим силу Р на бесконечно малую величину Это приращение вызовет возрастание перемещения на величину
Составим выражение элементарной работы внешней силы на перемещении отбрасывая при этом бесконечно малые величины второго порядка малости:
Заменяем значение на основании формулы (1.11) выражением
Интегрируя это выражение в пределах полного изменения силы от нуля до ее конечного значения, получаем формулу для определения работы, совершенной статически приложенной внешней силой Р:

Так как то полученную формулу можно представить в виде
В общем случае направление силы Р может не совпадать с направлением вызванного ею перемещения. Так как величина работы определяется произведением силы на путь, пройденный по направлению этой силы, то под величиной А надо понимать проекцию действительного (полного) перемещения точки приложения силы на направление силы. Например, при действии силы Р под углом к горизонтальной оси (рис. 2.11) перемещение А измеряется отрезком (представляющим собой проекцию действительного перемещения на направление силы Р).


В случае, когда к системе приложена пара сил с моментом ЗК (сосредоточенный момент), выражение работы можно получить аналогичным образом. При этом необходимо выбрать соответствующий сосредоточенному моменту вид перемещения; это будет угол поворота того поперечного сечения бруса, к которому приложен момент.
Например, работа момента, статически приложенного к балке, изображенной на рис. 3.11,
где О - угол поворота (в радианах) того сечения балки, к которому приложен момент Ш.
Итак, работа внешней силы при статическом действии ее на любое упругое сооружение равна половине произведения значения этой силы на величину соответствующего ей перемещения.
Для обобщения полученного вывода под силой понимаем любое воздействие, приложенное к упругой системе, т. е. не только сосредоточенную силу, но и момент, равномерно распределенную нагрузку и т. п.; под перемещением понимаем тот вид перемещения, на котором данная сила производит работу. Сосредоточенной силе Р соответствует линейное перемещение, моменту - угловое, а равномерно распределенной нагрузке - площадь эпюры перемещений на участке действия нагрузки.
При статическом действии на сооружение группы внешних сил работа этих сил равна половине суммы произведений каждой силы на величину соответствующего ей перемещения, вызванного действием всей группы сил.
Так, например, при действии на балку, изображенную на рис. 4.11, сосредоточенных сил и сосредоточенных моментов работа внешних сил

Знак минус перед последним членом выражения принят потому, что направление угла поворота поперечного сечения балки, в котором приложен момент противоположно направлению этого момента.
Работу внешних сил на вызванных ими перемещениях можно выразить и иначе, а именно: через изгибающие моменты, продольные и поперечные силы, возникающие в поперечных сечениях стержней конструкции.


Выделим из прямолинейного стержня двумя сечениями, перпендикулярными его оси (рис. 5.11), бесконечно малый элемент длиной (элемент ). Стержень состоит из бесконечно большого числа таких элементов. К элементу в общем случае плоской задачи приложены продольная сила N, изгибающий момент М и поперечная сила
Усилия N, М, Q являются внутренними, усилиями по отношению к целому стержню. Однако для выделенного элемента они являются внешними силами, а потому работу А можно получить как сумму работ, совершенных статически возрастающими усилиями N, М, Q на соответствующих деформациях элементов Рассмотрим отдельно влияние каждого из этих усилий на элемент
Элемент находящийся под действием только продольных сил N, изображен на рис. 6.11. Если левое его сечение считать неподвижным, то правое сечение под влиянием продольной силы переместится вправо на величину На этом перемещении статически возрастающая сила N совершит работу
Элемент находящийся под действием только изгибающих моментов М, изображен на рис. 7.11.


Если левое его сечение не подвижно закрепить, то взаимный угол поворота торцовых сечений элемента будет равен углу поворота До его правого сечения [см. формулу (16.7) и рис. 33.7]:
![]()
На этом угловом перемещении статически возрастающий момент М совершит работу
Элемент находящийся под действием только поперечных сил Q, изображен на рис. 8.11, а. Закрепив левое его сечение (рис. 8.11, б), приложим к правому касательные усилия равнодействующей которых является поперечная сила
Предположим, что касательные напряжения равномерно распределены по всей площади F поперечного сечения, т. е. тогда перемещение (рис. 8.11,б), вызванное действием поперечной силы Q, представляющее собой сдвиг торцовых сечений элемента друг относительно друга, на основании формулы (3.4) определится из выражения
а работа статически возрастающей силы Q на этом перемещении