4. Природа и типы химической связи. Ковалентная связь
Приложение. Пространственное строение молекул
Каждая молекула (например, CO 2 , H 2 O, NH 3) или молекулярный ион (например, CO 3 2 − , H 3 O + , NH 4 +) имеет определенный качественный и количественный состав, а также структуру (геометрию). Геометрия молекулы формируется за счет фиксированного взаимного расположения атомов и значений валентных углов.
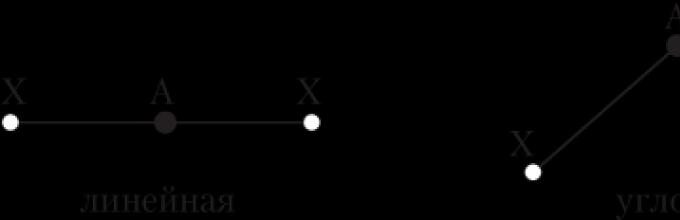
Валентный угол - это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Можно также сказать, что это угол между двумя линиями-связями, имеющими общий атом.
Линия связи - это линия, соединяющая ядра двух химически связанных атомов.
Только в случае двухатомных молекул (H 2 , Cl 2 и т.п.) вопрос об их геометрии не возникает - они всегда линейные, т.е. ядра атомов расположены на одной прямой. Структура более сложных молекул может напоминать разные геометрические фигуры, например:
- трехатомные молекулы и ионы типа АХ 2 (Н 2 О, СО 2 , ВеCl 2)

- четырехатомные молекулы и ионы типа АХ 3 (NH 3 , BF 3 , PCl 3 , H 3 O + , SO 3) или A 4 (P 4 , As 4)

- пятиатомные молекулы и ионы типа АХ 4 (CH 4 , XeF 4 , GеCl 4)

Существуют частицы и более сложного строения (октаэдр, тригональная бипирамида, плоский правильный шестиугольник). Кроме того, молекулы и ионы могут иметь форму искаженного тетраэдра, неправильного треугольника; в молекулах углового строения значения α могут быть разными (90°, 109°, 120°).
Строение молекул надежно устанавливается экспериментально с использованием различных физических методов. Для объяснения причин формирования той или иной структуры, предсказания геометрии молекул разработаны различные теоретические модели. Наиболее простые для понимания - модель отталкивания валентных электронных пар (модель ОВЭП) и модель гибридизации валентных атомных орбиталей (модель ГВАО).
Основой всех (в том числе и двух упомянутых) теоретических моделей, объясняющих строение молекул, является следующее положение: устойчивому состоянию молекулы (иона) отвечает такое пространственное расположение ядер атомов, при котором взаимное отталкивание электронов валентного слоя будет минимальным.
При этом учитывается отталкивание электронов как участвующих в образовании химической связи (электроны связи), так и не участвующих (неподеленные пары электронов). Принимается во внимание, что орбиталь связывающей электронной пары компактно сосредоточена между двумя атомами и поэтому занимает меньшее пространство, чем орбиталь неподеленной пары электронов. По этой причине отталкивающее действие несвязывающей (неподеленной) пары электронов и ее влияние на валентные углы выражены сильнее, чем связывающей.
Модель ОВЭП . Эта теория исходит из следующих основных положений (излагается упрощенно):
- геометрию молекулы определяют только σ-связи (но не π-);
- углы между связями зависят от числа неподеленных пар электронов центрального атома.
Данные положения следует рассматривать совместно, поскольку и электроны химической связи, и неподеленные пары электронов отталкиваются друг от друга, что в итоге приводит к формированию такой структуры молекулы, при которой это отталкивание будет минимальным.
Рассмотрим с позиций метода ОВЭП геометрию некоторых молекул и ионов; электроны σ-связи будем обозначать двумя точками (:), неподеленные пары электронов - условным символом ( или ) или черточкой.
Начнем с пятиатомной молекулы метана СН 4 . В этом случае центральный атом (этом углерода) полностью исчерпал свои валентные возможности и не содержит неподеленных пар валентных электронов, т.е. все четыре валентных электрона формируют четыре σ-связи. Как же должны расположиться относительно друг друга электроны σ-связи, чтобы отталкивание между ними было минимальным? Очевидно, под углом 109°, т.е. вдоль линий, направленных к вершинам воображаемого тетраэдра, в центре которого находится атом углерода. В этом случае электроны, принимающие участие в образовании связи, максимально удалены друг от друга (для квадратной конфигурации расстояние между этими электронами связи больше и межэлектронное отталкивание меньше). По этой причине молекула метана, а также молекулы CCl 4 , CBr 4 , CF 4 имеют форму правильного тетраэдра (как говорят, имеют тетраэдрическое строение):

Такое же строение имеют катион аммония NH + 4 и анион BF 4 − , поскольку атомы азота и бора образуют по четыре σ-связи, а неподеленных пар электронов у них нет.
Рассмотрим строение четырехатомной молекулы аммиака NH 3 . В молекуле аммиака имеется три пары связывающих электронов и одна неподеленная пара электронов у атома азота, т.е. тоже четыре пары электронов. Однако будет ли валентный угол оставаться равным 109°? Нет, так как неподеленная пара электронов, занимающая больший объем в пространстве, оказывает сильное отталкивающее влияние на электроны σ-связи, что приводит к некоторому уменьшению валентного угла, в данном случае этот угол равен примерно 107°. Молекула аммиака имеет форму тригональной пирамиды (пирамидальное строение):

Пирамидальное строение имеет также четырехатомный ион гидроксония Н 3 О + : атом кислорода образует три σ-связи и содержит одну неподеленную пару электронов.
В четырехатомной молекуле BF 3 число σ-связей также равно трем, но неподеленных пар электронов у атома бора нет. Очевидно, что межэлектронное отталкивание будет минимальным, если молекула BF 3 будет иметь форму правильного плоского треугольника с валентным углом 120°:

Такое же строение и по тем же причинам имеют молекулы BCl 3 , BH 3 , AlH 3 , AlF 3 , AlCl 3 , SO 3 .
Какое же строение будет иметь молекула воды?
В трехатомной молекуле воды имеется четыре пары электронов, однако только две из них являются электронами σ-связи, две оставшиеся - это неподеленные пары электронов атома кислорода. Отталкивающее влияние двух неподеленных пар электронов в молекуле H 2 O сильнее, чем в молекуле аммиака с одной неподеленной парой, поэтому валентный угол H–O–H меньше угла H–N–H в молекуле аммиака: в молекуле воды валентный угол равен примерно 105°:

В молекуле СО 2 (O=C=O) также две пары связывающих электронов (рассматриваем только σ-связи), однако в отличие от молекулы воды у атома углерода неподеленных пар электронов нет. Очевидно, что отталкивание между парами электронов в этом случае будет минимальным, если они расположатся под углом 180°, т.е. при линейной форме молекулы СО 2:
Аналогичное строение и по тем же причинам имеют молекулы BeH 2 , BeF 2 , BeCl 2 . В трехатомной молекуле SO 2 центральный атом (атом серы) также образует две σ-связи, но имеет неподеленную пару электронов, поэтому у молекулы оксида серы(IV) угловое строение, но валентный угол в ней больше, чем в молекуле воды (у атома кислорода две неподеленные пары электронов, а у атома серы только одна):

Линейное строение имеют и некоторые трехатомные молекулы состава АВС (например, H–C≡N, Br–C≡N, S=C=Te, S=C=O), в которых центральный атом не имеет неподеленных пар электронов. А вот молекула HClO имеет угловое строение (α ≈ 103°), так как центральный атом, атом кислорода, содержит две неподеленные пары электронов.
С помощью модели ОВЭП можно также предсказать строение молекул органических веществ. Например, в молекуле ацетилена С 2 Н 2 каждый атом углерода образует две σ-связи, а неподеленных пар электронов у атомов углерода нет; поэтому молекула имеет линейное строение H–C≡C–H.
В молекуле этена С 2 Н 4 каждый атом углерода образует три σ-связи, что при отсутствии неподеленных пар электронов у атомов углерода приводит к треугольному расположению атомов вокруг каждого атома углерода:
В табл. 4.2 суммированы некоторые данные о строении молекул и ионов.
Таблица 4.2
Связь строения молекул (ионов) с числом σ-связей и неподеленных пар электронов центрального атома
| Тип молекулы (иона) | Число σ-связей, образованных центральным атомом | Число неподеленных пар электронов | Структура, валентный угол | Примеры частиц (центральный атом выделен) |
|---|---|---|---|---|
| АВ 2 | 2 | 0 | Линейная, α = 180° | C O 2 , Be H 2 , HC N, Be Cl 2 , C 2 H 2 , N 2 O, C S 2 |
| 1 | Угловая, 90° < α < 120° | Sn Cl 2 , S O 2 , N O 2 − | ||
| 2 | Угловая, α < 109° | H 2 O , O F 2 , H 2 S , H 2 Se , S F 2 , Xe O 2 , − | ||
| АВ 3 | 3 | 0 | Треугольная, α ≈ 120° | B F 3 , B H 3 , B Cl 3 , Al F 3 , S O 3 , С O 3 2 − , N O 3 − |
| 1 | Тригональная пирамида, α < 109° | N H 3 , H 3 O + , N F 3 , S O 3 2 − , P F 3 , P Cl 3 , As H 3 | ||
| АВ 4 | 4 | 0 | Тетраэдр, α = 109° | N H 4 + , C H 4 , Si H 4 , B F 4 , B H 4 − , S O 4 2 − , A l H 4 − |
Модель ГВАО . Главное положение этой модели состоит в том, что в образовании ковалентных связей участвуют не «чистые» валентные s -, p - и d - орбитали, а так называемые гибридные орбитали . Далее рассматривается гибридизация только с участием 2p - и 2s -АО.
Гибридизация - явление смешивания валентных орбиталей, вследствие чего они выравниваются по форме и энергии.
Концепция гибридизации используется всегда, когда в образовании химических связей участвуют электроны разных энергетических подуровней, не очень сильно отличающихся по энергии: 2s и 2p , 4s , 4p и 3d и т.д.
Гибридная орбиталь не похожа по форме на исходные 2p - и 2s -АО. Она имеет форму неправильной объемной восьмерки:
Как видим, гибридные АО более вытянуты, поэтому могут лучше перекрываться и образуют более прочные ковалентные связи. При перекрывании гибридных орбиталей образуются только σ-связи; в образовании π-связей из-за своей специфической формы гибридные АО не участвуют (π-связи образуют только негибридные АО). Число гибридных орбиталей всегда равно числу исходных АО, участвующих в гибридизации. Гибридные орбитали должны ориентироваться в пространстве так, чтобы обеспечивалось их максимальное удаление друг от друга. В этом случае отталкивание находящихся на них электронов (связывающих и несвязывающих) будет минимальным; минимальной будет и энергия всей молекулы.
В модели ГВАО предполагается, что в гибридизации участвуют орбитали с близкими значениями энергии (т.е. валентные орбитали) и достаточно высокой электронной плотностью. Электронная плотность орбитали уменьшается при увеличении ее размеров, поэтому роль в гибридизации особенно существенна для молекул элементов малых периодов.
Следует помнить, что ГВАО не реальное физическое явление, а удобная концепция (математическая модель), позволяющая описать строение некоторых молекул. Никакими физическими методами образование гибридных АО не фиксируется. Тем не менее теория гибридизации имеет некоторое физическое обоснование.
Рассмотрим строение молекулы метана. Известно, что молекула СН 4 имеет форму правильного тетраэдра с атомом углерода в центре, все четыре связи С–Н образованы по обменному механизму и имеют одинаковую энергию и длину, т.е. эквивалентны. Объяснить наличие у атома углерода четырех неспаренных электронов достаточно просто, предположив переход его в возбужденное состояние:

Однако этот процесс никак не объясняет эквивалентность всех четырех связей С–Н, поскольку согласно приведенной схеме три из них образованы с участием 2p -АО атома углерода, одна - с участием 2s -АО, а форма и энергия 2p - и 2s -АО разные.
Для объяснения этого и других подобных фактов Л. Полингом была разработана концепция ГВАО. Предполагается, что смешивание орбиталей происходит в момент образования химических связей. Данный процесс требует затрат энергии на расспаривание электронов, которые, однако, компенсируются за счет выделения энергии при образовании гибридными АО более прочных (по сравнению с негибридными) связей.
На основании природы и числа АО, участвующих в гибридизации, различают несколько ее типов.
В случае sp 3 -гибридизации смешиваются одна s - и три p -орбитали (откуда и произошло название типа гибридизации). Для атома углерода процесс можно представить следующим образом:
1 s 2 2 s 2 2 p x 1 2 p y 1 → электронов переход 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → дизация гибри- 1 s 2 2 (s p 3) 4
или с помощью электронных конфигураций:

Четыре sp 3 -гибридные АО по энергии занимают промежуточное положение между 2p - и 2s -АО.
Схему sp 3 -гибридизации можно представить с использованием изображений формы АО атома углерода:

Таким образом, в результате sp 3 -гибридизации образуются четыре гибридные орбитали, на каждой из которых находится неспаренный электрон. Эти орбитали в пространстве располагаются под углом 109°28′, что обеспечивает минимальное отталкивание находящихся на них электронов. Если соединить вершины гибридных орбиталей, то получится объемная фигура - тетраэдр. По этой причине молекулы состава АХ 4 (CH 4 , SiH 4 , CCl 4 и др.), в которых реализуется данный тип гибридизации, имеют форму тетраэдра.
Концепция sp 3 -гибридизации AO хорошо объясняет также строение молекул H 2 O и NH 3 . Предполагается, что в гибридизации участвуют 2s - и 2p -АО атомов азота и кислорода. В этих атомах число валентных электронов (5 и 6 соответственно) превышает число sp 3 -гибридных АО (4), поэтому часть гибридных АО содержит неспаренные электроны, а часть - неподеленные пары электронов:

Видим, что в атоме азота неподеленная пара электронов находится на одной гибридной АО, а в атоме кислорода - на двух. В образовании связей с атомами водорода участвуют только АО с неспаренными электронами, а неподеленные пары электронов будут оказывать отталкивающее действие (рис. 4.5) друг на друга (в случае кислорода) и на связывающие электроны (для кислорода и азота).

Рис. 4.5. Схема отталкивающего действия связывающих и несвязывающих орбиталей в молекуле аммиака (а ) и воды (б )
Сильнее отталкивание выражено в случае молекулы воды. Так как у атома кислорода две неподеленные пары электронов, то отклонение от идеального значения валентного угла для этого типа гибридизации (109°28′) в молекуле воды больше, чем в молекуле аммиака (в молекулах H 2 O и NH 3 валентный угол равен соответственно 104,5° и 107°).
Модель sp 3 -гибридизации привлекается для объяснения строения алмаза, кремния, ионов NH 4 + и H 3 O + , алканов, циклоалканов и др. В случае углерода данный тип гибридизации используется всегда, когда атом этого элемента образует только σ-связи.
В случае sp 2 -гибридизации смешиваются одна s - и две p -орбитали. Этот тип гибридизации рассмотрим на примере атома бора. Процесс представлен с помощью энергетических схем


Таким образом, в результате sp 2 -гибридизации валентных орбиталей атома бора образуются три гибридные АО, направленные под углом 120°, а одна из 2p -орбиталей участия в гибридизации не принимает. Гибридные орбитали содержат по одному неспаренному электрону, расположены в одной плоскости, и если соединить их вершины, то получится правильный треугольник. По этой причине молекулы состава АХ 3 с sp 2 -гибридизацией орбиталей атома А имеют треугольное строение, как это показано для молекулы BF 3:

Негибридная 2p -АО атома бора свободна (не занята) и ориентирована перпендикулярно к плоскости связей B−F, поэтому молекула BF 3 является акцептором электронов при образовании ковалентной связи по донорно-акцепторному механизму при взаимодействии с молекулой аммиака.
Концепция sp 2 -гибридизации привлекается для объяснения природы двойной связи углерод - углерод в алкенах, строения бензола и графита, т.е. в тех случаях, когда атом углерода образует три σ- и одну π-связь.
Пространственное расположение орбиталей атома углерода для sp 2 -гибридизации выглядит так: негибридная 2p -АО ориентирована перпендикулярно плоскости, в которой расположены гибридные орбитали (и гибридные, и негибридные АО содержат по неспаренному электрону).

Рассмотрим образование химических связей в молекуле этилена H 2 C=CH 2 . В ней гибридные АО перекрываются между собой и с 1s -АО атома водорода, образуя пять σ-связей: одну C–C и четыре C–H. Негибридные 2p -АО перекрываются боковым способом и образуют π-связь между атомами углерода (рис. 4.6).

Рис. 4.6. Схема образования σ-связей (а ) и π-связи (б ) в молекуле этилена
В случае sp -гибридизации смешиваются одна s - и одна p -орбиталь. Этот тип гибридизации рассмотрим на примере атома бериллия. Представим процесс гибридизации с помощью энергетической схемы:

и с изображением формы орбиталей
Таким образом, в результате sp -гибридизации образуются две гибридные АО, содержащие по одному неспаренному электрону. Две 2p -АО участия в гибридизации не принимают и в случае бериллия остаются вакантными. Гибридные орбитали ориентированы под углом 180°, поэтому молекулы типа АХ 2 с sp -гибридизацией орбиталей атома А имеют линейное строение (рис. 4.7).

Рис. 4.7. Пространственное строение молекулы BeCl 2
С помощью модели sp -гибридизации орбиталей атома углерода объясняют природу тройной связи в молекулах алкинов. В этом случае на двух гибридных и двух негибридных 2р -АО (показаны горизонтальными стрелками →, ←) содержится по неспаренному электрону:

В молекуле ацетилена HC≡CH за счет гибридных АО образуются σ-связи C–H и C–C:

Гибридные 2p -АО перекрываются в двух перпендикулярных плоскостях и образуют две π-связи между атомами углерода (рис. 4.8).

Рис. 4.8. Схематическое изображение π-связей (а ) и плоскостей π-связей (б ) в молекуле ацетилена (волнистой линией показано боковое перекрывание 2p -АО атома углерода)
Концепция sp -гибридизации орбиталей атома углерода позволяет объяснить образование химических связей в карбине, молекулах СО и СО 2 , пропадиене (CH 2 =C=CH 2), т.е. во всех случаях, когда атом углерода образует две σ- и две π-связи.
Основные характеристики рассмотренных типов гибридизации и геометрические конфигурации молекул, соответствующие некоторым типам гибридизации орбиталей центрального атома А (с учетом влияния несвязывающих электронных пар), представлены в табл. 4.3 и 4.4.
Таблица 4.3
Основные характеристики разных типов гибридизации
Сравнивая данные табл. 4.2 и 4.4, можно сделать вывод, что обе модели - ОВЭП и ГВАО - приводят к одинаковым результатам относительно строения молекул.
Таблица 4.4
Виды пространственной конфигурации молекул, соответствующие некоторым типам гибридизации
Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь
- химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается.
Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а) | H· + ·H H:H | H-H | H 2 | (одна общая пара электронов; H одновалентен); |
| б) | NN | N 2 | (три общие пары электронов; N трехвалентен); | |
| в) | H-F | HF | (одна общая пара электронов; H и F одновалентны); | |
| г) | NH 4 + | (четыре общих пары электронов; N четырехвалентен) |
- По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную . Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность
- мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются + и -, например: .
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на -связь и -связь.
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков
- предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp
-, sp
2 и sp
3 -гибридизация. Например:
sp
-гибридизация - в молекулах C 2 H 2 , BeH 2 , CO 2 (линейное строение);
sp
2 -гибридизация - в молекулах C 2 H 4 , C 6 H 6 , BF 3 (плоская треугольная форма);
sp
3 -гибридизация - в молекулах CCl 4 , SiH 4 , CH 4 (тетраэдрическая форма); NH 3 (пирамидальная форма); H 2 O (уголковая форма).
Металлическая связь
- химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr 2 , Ca 2 Cu, Cu 5 Zn 8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH 2 , H—O—H ··· NH 3 , H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи
- энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений - 1 кДж/моль.
Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Строение вещества
По типу строения все вещества делятся на молекулярные и немолекулярные . Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H 2 , O 2 , N 2 , Cl 2 , Br 2 , S 8 , P 4 и другие простые вещества; CO 2 , SO 2 , N 2 O 5 , H 2 O, HCl, HF, NH 3 , CH 4 , C 2 H 5 OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO 2 , SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)(NO 3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Задачи и тесты по теме "Тема 10. "Химическая связь. Строение вещества"."
- Типы химической связи - Строение вещества 8–9 класс
Уроков: 2 Заданий: 9 Тестов: 1
- Заданий: 9 Тестов: 1
Проработав эту тему, Вы должны усвоить следующие понятия: химическая связь, межмолекулярная связь, ионная связь, ковалентная связь, металлическая связь, водородная связь, простая связь, двойная связь, тройная связь, кратные связи, неполярная связь, полярная связь, электроотрицательность, поляризация связи, - и -связь, гибридизация атомных орбиталей, энергия связи.
Вы должны знать классификацию веществ по типу строения, по типу химической связи, зависимость свойств простых и сложных веществ от типа химической связи и типа "кристаллической решетки".
Вы должны уметь: определять тип химической связи в веществе, тип гибридизации, составлять схемы образования связей, пользоваться понятием электроотрицательность, рядом электроотрицательностей; знать как меняется электроотрицательность у химических элементов одного периода, и одной группы для определения полярности ковалентной связи.
Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян, Г. Г. Лысова. Химия 11 кл. М., Дрофа, 2002.
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М., Просвещение, 2001.
Вариант 2
Часть А:
А 1 . Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера, б) водород и азот, в) калий и кислород, г) кремний и водород.
А 2. Формула вещества с ковалентной связью:
а) NaCl, б) HCl, в) BaO, г) Ca 3 N 2 .
А 3. Наименее полярной является связь:
а) С – Н, б) С – Сl, в) С – F, г) С – Br.
А 4 . Верным является утверждение, что δ – связь в отличие от π – связи:
а) менее прочная, б) образуется при боковом перекрывании атомных орбиталей,
в) не является ковалентной, г) образуется при осевом перекрывании атомных орбиталей.
А 5. Вещество в молекуле которого нет π –связи:
а) этилен, б) бензол, в) аммиак, г) азот.
А 6 . Наиболее прочной является молекула:
а) Н 2 , б) N 2 , в) F 2 , г) O 2 .
А 7 . В ионе СО 3 2- атом углерода находится в sp 2 – гибридном состоянии, поэтому ион имеет форму:
а) линейную, б) тетраэдра, в) треугольника, г) октаэдра.
А 8 . Атом углерода имеет степень окисления -3 и валентность 4 в соединении с формулой:
а) СО 2 , б) С 2 Н 6 , в) СН 3 Сl, г) CaC 2 .
А 9 . Атомную кристаллическую решетку имеет:
а) сода, б) вода, в) алмаз, г) парафин.
А 10 . Вещество между молекулами которого существует водородная связь:
а) этан, б) фторид натрия, в) оксид углерода (4), г) этанол.
А 11 . Выберите группу элементов, расположенных в порядке возрастания электроотрицательности:
а) Cl, Si, N, O, б) Si, P, N, F, в) F, Cl, O, Si, г) O, N, F, Cl.
А 12 . Между атомами есть ковалентная связь, образованная по донорно – акцепторному механизму в веществе, формула которого:
13.
А 14. Образованием водородных связей можно объяснить:
а) растворимость уксусной кислоты в воде, б) кислотные свойства этанола,
в) высокую температуру плавления многих металлов, г) нерастворимость метана в воде.
А 15. Формула вещества с ковалентной полярной связью:
а) Cl 2 , б) KCl, в) NH 3 , г) O 2 .
Часть Б:
Б 1 . Из числа предложенных, выберите вещество, в молекуле которого имеются π – связи: H 2 , CH 4 , Br 2 , N 2 , H 2 S, CH 3 OH, NH 3 . Напишите название этого вещества.
Б 2. Процесс взаимодействия электронных орбиталей, приводящих к их выравниванию по форме и энергии, называется……
Б 3 . Как называется явление укрупнения коллоидных частиц м выпадение их в осадок из коллоидного раствора?
Б 4. Приведите пример вещества, в молекуле которого имеются три δ – и одна π – связи. Вещество назовите в именительном падеже.
Б 5. В каком из указанных веществ, связи наиболее полярны: хлороводород, фтор, вода, аммиак, сероводород. Выбранное вещество запишите формулой.
Часть С:
С 1. Напишите структурные формулы всех изомерных веществ состава С 4 Н 8 . Назовите каждое вещество.
С 2 . Составьте структурные формулы веществ: СHF 3 , C 2 H 2 Br 2 , O 2 .
Составьте графические формулы: Mg 3 N 2 , Na 2 SO 4 , KHCO 3 .
С 3.
Mg 3 N 2 , Cl 2 , ZnSO 4 , KHS, CH 3 Cl, FeOHCl 2 , BrO 2 , AsO 4 3- , NH 4 +
Контрольная работа №2 «СТРОЕНИЕ ВЕЩЕСТВА».
Вариант 3
Часть А:
А 1 . Химические связи в веществах, формулы которых СН 4 и СaCl 2 соответственно:
а) ионная и ковалентная полярная, б) ковалентная полярная и ионная,
в) ковалентная неполярная и ионная, г) ковалентная полярная и металлическая.
А 2. Полярность связи больше в веществе с формулой:
а) Br 2 , б) LiBr, в) HBr, г) KBr
А 3. Ионный характер связи в ряду соединений Li 2 O – Na 2 O - K 2 O - Rb 2 O:
а) увеличивается, б) уменьшается, в) не изменяется, г) сначала уменьшается, потом увеличивается.
А 4 . Между атомами есть ковалентная связь, образованная по донорно - акцепторному механизму в веществе, формула которого:
а) Al(OH) 3 , б) [СН 3 NH 3 ]Cl, в) С 2 H 5 OH, г) C 6 H 12 O 6 .
А 5. Пара формул веществ, в молекулах которых есть только δ – связи:
а) СН 4 и О 2 , б) С 2 Н 5 ОН и Н 2 О, в) N 2 и СО 2 , г) НBr и С 2 Н 4 .
А 6 . Наиболее прочная связь из приведенных:
а) С - Cl, б) С – F, в) С – Br, г) С - I.
А 7 . Группа формул соединений, в которых имеется сходная направленность связей, обусловленная sp 3 – гибридизацией электронных орбиталей:
а) СН 4 , С 2 Н 4 , С 2 Н 2 , б) NH 3 , CH 4 , H 2 O, в) H 2 O, C 2 H 6 , C 6 H 6 , г) C 3 H 8 , BCl 3 , BeCl 2 .
А 8 . Валентность и степень окисления атома углерода в молекуле метанола соответственно равны:
а) 4 и +4, б) 4 и -2, в) 3 и +2, г) 4 и -3.
А 9 . Вещества с ионной кристаллической решеткой характеризуются:
а) плохой растворимостью в воде, б) высокой температурой кипения, в) легкоплавкостью, г) летучестью.
А 10 . Образование водородной связи между молекулами приводит:
а) к уменьшению температур кипения веществ, б) к уменьшению растворимости веществ в воде,
в) к увеличению температур кипения веществ, г) к увеличению летучести веществ.
А 11 . Формула вещества с ионной связью:
а) NH 3 , б) C 2 H 4 , в) KH, г) CCl 4 .
А 12 . Только δ – связь есть в молекуле:
а) азота, б) этанола, в) этилена, г) оксида углерода (4).
13. Молекулярное строение имеет вещество с формулой:
а) СН 4 , б) NaOH, в) SiO 2 , г) Al.
А 14. Водородная связь образуется между:
а) молекулами воды, б) молекулами водорода,
в) молекулами углеводородов, г) атомами металлов и атомами водорода.
А 15. Если интенсивно взболтать смесь растительного масла и воды то получится:
а) суспензия, б) эмульсия, в) пена, г) аэрозоль.
Часть Б:
Б 1 . Число общих электронных пар между атомами брома в молекуле Br 2 равно……
Б 2. Из каких связей образуются тройная связь в молекуле N 2 (ответ представь в именительном падеже).
Б 3 . В узлах металлической кристаллической решетки находятся…….. .
Б 4. Приведите пример вещества, в молекуле которого имеются пять δ – и две π – связи. Вещество назовите в именительном падеже.
Б 5. Каково максимальное число π – связей, которые могут образоваться между двумя атомами в молекуле? (ответ представь цифрой)
Часть С:
С 1. Напишите структурные формулы всех изомерных веществ состава С 5 Н 10 О. Назовите каждое вещество.
С 2 . Составьте структурные формулы веществ: СHCl 3 , C 2 H 2 Cl 2 , F 2 .
Составьте графические формулы: AlN, CaSO 4 , LiHCO 3 .
С 3. Определите степень окисления в химических соединениях и ионах:
HNO 3 , HClO 4 , K 2 SO 3 , KMnO 4 , CH 3 F, MgOHCl 2 , ClO 3 - , CrO 4 2- , NH 4 +
Похожая информация.
Контрольная работа №2 ДКР «СТРОЕНИЕ ВЕЩЕСТВА».
А 1 . Химические связи в веществах, формулы которых СН 4 и СaCl 2 соответственно:
а) ионная и ковалентная полярная, б) ковалентная полярная и ионная,
в) ковалентная неполярная и ионная, г) ковалентная полярная и металлическая.
А 2. Полярность связи больше в веществе с формулой:
а) Br 2 , б) LiBr, в) HBr, г) KBr
А 3. Ионный характер связи в ряду соединений Li 2 O – Na 2 O - K 2 O - Rb 2 O:
а) увеличивается, б) уменьшается, в) не изменяется, г) сначала уменьшается, потом увеличивается.
А 4 . Между атомами есть ковалентная связь, образованная по донорно - акцепторному механизму в веществе, формула которого:
а) Al(OH) 3 , б) [СН 3 NH 3 ]Cl, в) С 2 H 5 OH, г) C 6 H 12 O 6 .
А 5. Пара формул веществ, в молекулах которых есть только δ – связи:
а) СН 4 и О 2 , б) С 2 Н 5 ОН и Н 2 О, в) N 2 и СО 2 , г) НBr и С 2 Н 4 .
А 6 . Наиболее прочная связь из приведенных:
а) С - Cl, б) С – F, в) С – Br, г) С - I.
А 7 . Группа формул соединений, в которых имеется сходная направленность связей, обусловленная sp 3 – гибридизацией электронных орбиталей:
а) СН 4 , С 2 Н 4 , С 2 Н 2 , б) NH 3 , CH 4 , H 2 O, в) H 2 O, C 2 H 6 , C 6 H 6 , г) C 3 H 8 , BCl 3 , BeCl 2 .
А 8 . Валентность и степень окисления атома углерода в молекуле метанола соответственно равны:
а) 4 и +4, б) 4 и -2, в) 3 и +2, г) 4 и -3.
А 9 . Вещества с ионной кристаллической решеткой характеризуются:
а) плохой растворимостью в воде, б) высокой температурой кипения, в) легкоплавкостью, г) летучестью.
А 10 . Образование водородной связи между молекулами приводит:
а) к уменьшению температур кипения веществ, б) к уменьшению растворимости веществ в воде,
в) к увеличению температур кипения веществ, г) к увеличению летучести веществ.
А 11 . Формула вещества с ионной связью:
а) NH 3 , б) C 2 H 4 , в) KH, г) CCl 4 .
А 12
А13. Молекулярное строение имеет вещество с формулой:
А 14. Водородная связь образуется между:
а) молекулами воды, б) молекулами водорода,
в) молекулами углеводородов, г) атомами металлов и атомами водорода.
А 15. Если интенсивно взболтать смесь растительного масла и воды то получится:
а) суспензия, б) эмульсия, в) пена, г) аэрозоль.
А 16 . Формула вещества с ковалентной полярной связью:
а) Cl 2 , б) KCl, в) NH 3 , г) O 2 .
А 17. Вещество, между молекулами которого существует водородная связь:
а) этанол, б) метан, в) Водород, г) Бензол.
А 18. Число общих электронных пар в молекуле водорода:
а) одна, б) две, в) три, г) четыре.
А 19 . Полярность химической связи увеличивается в ряду соединений, формулы которых:
а) NH 3 , HI, O 2 , б) CH 4 , H 2 O, HF, в) PH 3 , H 2 S, H 2 , г) HCl, CH 4 , CL 2 .
А 20. Кристаллическая решетка хлорида натрия:
а) атомная, б) ионная, в) металлическая, г) молекулярная.
А 21 . Число δ и π – связей в молекуле ацетилена:
а) 5 δ и π - нет, б) 2 δ и 3 π , в) 3 δ и 2 π , г) 4 δ и 1 π .
А 22 . Вещества, формулы которых: СН 3 – СН 2 – ОН и СН 3 – О – СН 3 , - это:
а) гомологи, б) изомеры, в) одно и то же вещество, г) и гомологи и изомеры.
А 23 . Гомологом вещества, формула которого СН 2 = СН – СН 3 , - это:
а) бутан, б) бутен - 1, в) бутен - 2, г) бутин - 1.
А 24 . Ковалентная неполярная связь образуется между атомами:
а) водорода и кислорода, б) углерода и водорода, в) хлора, г) магния.
А 25 . Только δ – связь есть в молекуле:
а) азота, б) этанола, в) этилена, г) оксида углерода (4).
А 26 . Атом азота имеет валентность 3 и степень окисления 0 в молекуле вещества, формула которого:
а) NH 3 , б) N 2 , в) CH 3 NO 2 , г) N 2 O 3 .
А 27 . Молекулярное строение имеет вещество с формулой:
а) СН 4 , б) NaOH, в) SiO 2 , г) Al.
А28. Связь С – Н прочнее, чем связь Si – H, так как:
а) длина связи меньше, б) длина связи больше,
в) полярность связи меньше, г) полярность связи больше.
А 29. Между атомами есть ковалентная связь, образованная по донорно – акцепторному механизму в веществе, формула которого:
а) СН 3 NО 2 , б) NH 4 NO 2 , в) C 5 H 8 , г) H 2 O.
А 30. Наименее полярной является связь:
а) С – Н, б) С – Сl, в) С – F, г) С – Br
Часть Б:
Б 1
. Число общих электронных пар между атомами брома в молекуле Br 2 равно……
Б 2.
Из каких связей образуются тройная связь в молекуле N 2 (ответ представь в именительном падеже).
Б 3
. В узлах металлической кристаллической решетки находятся…….. .
Б 4.
Приведите пример вещества, в молекуле которого имеются пять δ – и две π – связи. Вещество назовите в именительном падеже.
Б 5.
Б 6
. Число общих электронных пар между атомами брома в молекуле N 2 равно……
Б 7.
Из каких связей образуются тройная связь в молекуле C 2 H 2 (ответ представь в именительном падеже).
Б 8
. В узлах ионной кристаллической решетки находятся…….. .
Б 9.
Приведите пример вещества, в молекуле которого имеются пять δ – и одна π – связи. Вещество назовите в именительном падеже.
Б 10.
Каково максимальное число π – связей, которые могут образоваться между двумя атомами в молекуле? (ответ представь цифрой)
Часть С:
С 1.
Напишите структурные формулы всех изомерных веществ состава С 5 Н 10 О. Назовите каждое вещество.
С 2
.
Составьте структурные формулы веществ: СHCl 3 , C 2 H 2 Cl 2 , F 2 .
Составьте графические формулы: AlN, CaSO 4 , LiHCO 3 .
С 3.
HNO 3 , HClO 4 , K 2 SO 3 , KMnO 4 , CH 3 F, MgOHCl 2 , ClO 3 - , CrO 4 2- , NH 4 +
С 4.
Напишите структурные формулы всех изомерных веществ состава С 4 Н 8 О 2 . Назовите каждое вещество.
С 5
.
Составьте структурные формулы веществ: СHBr 3 , C 2 H 2 Br 2 , Br 2 .
Составьте графические формулы: Al 2 S 3 , MgSO 4 , Li 2 CO 3 .
С 6.
Определите степень окисления в химических соединениях и ионах:
CCl 4 , Ba(NO 3) 2 , Al 2 S 3 , HClO 3 , Na 2 Cr 2 O 7 , K 2 O 4 , SrO 2- , Cr 2 O 3 2
страница 1
Новикова Олеся Владимировна
Учитель химии и биологии
МОУ – СОШ с. Прокудино
Аткарского района
Саратовской области.
Контрольная работа № 1 на тему: «Строение веществ».
Вариант I .
а) хлороводороде
б) гидроксиде натрия
в) оксиде углерода (II)
г) оксиде углерода (IV)
2. Ковалентная полярная связь присутствует в молекуле
а) кислорода
б) ромбической серы
г) водорода
3. Химическая связь в молекуле углекислого газа
а) ковалентная неполярная
б) ковалентная полярная
в) металлическая
г) ионная
4. Наиболее прочной является молекула:
а) H 2 ;
б) N 2 ;
в) F 2 ;
г) O 2 .
5. Вещество, между молекулами которого существует водородная связь:
б) фторид натрия;
в) оксид углерода(II );
г) этанол.
6. Вещества с ионной кристаллической решеткой характеризуются:
а) плохой растворимостью в воде; в) легкоплавкостью;
б) высокой температурой кипения; г) летучестью.
7. Образование водородной связи между молекулами приводит:
а) к уменьшению температур кипения;
б) к уменьшению растворимости веществ в воде;
в) к увеличению температур кипения;
г) к увеличению летучести веществ.
8. В каком веществе содержится больше кислорода в Na 2 CO 3 или в Ca(HCO 3 ) 2 ?
9. :
А) SO 2 +H 2 O͢͢→
Б) Na+H 2 O→
В) Na 2 O+H 2 O→
Г) S+H 2 O→
10. Решите задачу :
Сколько воды и гидроксида натрия понадобиться, чтобы приготовить 180 г 15%-ного раствора?
11 . Решите задачу :
Какова масса кислорода, полученного путем фракционной перегонки 200 м 3 (н.у.) воздуха, если объемная доля кислорода составляет 0,21?
Контрольная работа № 1 на тему «Строение веществ».
Вариант II .
Ионная химическая связь реализуется в
а) кристаллической сере
б) твёрдом иоде
в) иодиде кальция
г) оксиде фосфора (v)
2. Ковалентная полярная связь имеется в молекуле
а) серной кислоты
б) пластической серы
г) сульфида рубидия
3. Химическая связь в молекуле водорода
а) ковалентная неполярная
б) ковалентная полярная
в) металлическая
г) ионная
4. Наиболее прочные связи в молекуле вещества, формула которого:
а) H 2 S ;
б) H 2 Se ;
в) H 2 O ;
г) H 2 Te .
5. Молекулярное строение имеет вещества с формулой:
а) CH 4 ;
б) NaOH ;
в) SiO 2 ;
г) Al .
6. Водородная связь образуется между:
а) молекулами воды; в) молекулами углеводородов;
б) молекулами водорода; г) атомами металлов и атомами водорода.
7. Образованием водородных связей можно объяснить:
а) растворимость уксусной кислоты в воде;
б) кислотные свойства этанола;
в) высокую температуру плавления многих металлов;
г) нерастворимость метана в воде.
8. Сравните содержание серы в Mg(HSO 4 ) 2 и CuSO 4 ?
9. Закончите уравнения возможных реакций :
А) СO 2 +H 2 O͢͢→
Б) Аl+H 2 O→
В) Fe+H 2 O→
Г) C+H 2 O→
10. Решите задачу:
Необходимо приготовить 540 г 12%-ного раствора азотной кислоты. Рассчитайте сколько взять воды и кислоты для приготовления такого раствора.
11. Решите задачу:
Какова масса азота, полученного из 143,6 л воздуха, содержащего в объемных долях 78% азота?