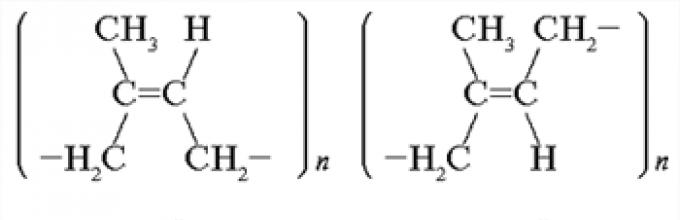Зависимость свойств веществ от строения молекул
Урок открытых мыслей
Цели
. Образовательная – закрепить и
углубить знания учащихся по теории химического
строения, ее основным положениям.
Воспитательная
– содействовать
формированию причинно-следственных связей и
отношений.
Развивающая
– развитие мыслительных
умений, способности переносить знания и умения в
новые ситуации.
Оборудование и реактивы.
Набор
шаростержневых моделей; образцы натурального и
синтетического каучука, диэтиловый эфир,
бутанол, этанол, фенол, литий, натрий, раствор
лакмуса, бромная вода, муравьиная и уксусная
кислоты.
Девиз
. «Всякое вещество – от самого
простого до самого сложного – имеет три
различные, но взаимосвязанные стороны –
свойство, состав, строение»
(В.М.Кедров).
ХОД УРОКА
Что включает в себя понятие «зависимость»?
(Узнать мнение учащихся).
На доске написать определение: «Зависимость –
1) отношение одного явления к другому как
следствие к причине;
2) подчиненность другим при отсутствии
самостоятельности, свободы» (словарь
С.И.Ожегова).
Цели урока определим совместно, составив схему:
Мотивационно-ориентационный блок
Интеллектуальная разминка
Определите верность приведенных ниже суждений, подтвердите ваши ответы примерами.
Теорию химического строения открыл
Д.И.Менделеев.
Ответ
. А.М.Бутлеров, 1861 г.
Валентность углерода в органических
соединениях может быть II и IV.
Ответ
. Валентность углерода – чаще
всего IV.
Атомы, образующие молекулы органических
веществ, связаны беспорядочно, без учета
валентности.
Ответ
. Атомы в молекулах связаны в
определенной последовательности согласно их
валентности.
Свойства веществ не зависят от строения
молекул.
Ответ
. Бутлеров в теории химического
строения утверждал, что свойства органических
соединений определяются составом и строением их
молекул.
Операционно-исполнительный блок
Фактор пространственного строения
Что вам известно о пространственном строении
молекул алканов и алкенов?
Ответ
. В алканах при каждом углероде
– четыре соседних атома, которые располагаются в
вершинах тетраэдра. Сам углерод находится в
центре тетраэдра. Тип гибридизации атома
углерода – sp 3
, углы между связями
(Н–С–С, Н–С–Н, С–С–С) - 109°28". Строение
углеродной цепи – зигзагообразное.
В алкенах два атома углерода, связанных двойной
связью, и четыре атома при них с одинарными
связями находятся в одной плоскости. Тип
гибридизации атомов – sp 2
, углы между связями
(Н–С=С, C–С=С) - 120°.
Вспомните, в чем отличие пространственного
строения молекул натурального каучука и
синтетического.
Ответ
. Натуральный каучук – линейный
полимер изопрена – имеет строение цис
-1,4-полиизопрена.
Синтетический каучук может иметь строение транс
-1,4-полиизопрена.

Одинакова ли эластичность этих каучуков?
Ответ
. Цисформа более эластична, чем
трансформа. Молекулы натурального каучука
длиннее и более упруго закручены (сначала в
спираль, а потом в клубок), чем молекулы
синтетического каучука.
Крахмал (С 5 Н 10 О 5) m –
белый аморфный порошок, а целлюлоза (С 5 Н 10 О 5) n
– волокнистое вещество.
В чем причина такого различия?
Ответ
. Крахмал – полимер -глюкозы,
тогда как целлюлоза – полимер-глюкозы.

Отличаются ли химические свойства крахмала и
целлюлозы?
Ответ
. Крахмал + I 2 синий р-р,
целлюлоза + HNO 3
нитроцеллюлоза.
Вывод . От пространственного строения зависят как физические, так и химические свойства.
Фактор химического строения
Что является главной идеей теории
химического строения?
Ответ
. Химическое строение отражает
зависимость свойств веществ от порядка
соединения атомов и их взаимодействия.
Определите, что общего у веществ:
Ответ . Состав.
Сравните физические свойства данных веществ.
В чем вы видите причину такого отличия?
На основании распределения электронной
плотности химической связи определите, какая
молекула более полярна? С чем это связано?
Ответ
. –ОН
водородную связь.
Демонстрационный эксперимент

Вывод . Реакционная способность спирта определяется взаимным влиянием атомов в молекуле.
Фактор электронного строения
В чем заключается сущность взаимного влияния
атомов?
Ответ
. Взаимное влияние состоит во
взаимодействии электронных структур атомов, что
приводит к смещению электронной плотности
химических связей.
Лабораторная работа
Учитель
. На ваших столах стоят
наборы для лабораторной работы. Выполните
задание и докажите экспериментально зависимость
свойств веществ от электронного строения. Работа
в парах. Строго соблюдайте правила техники
безопасности.
Вариант I
. Проведите исследование
химических свойств этанола и фенола. Докажите
зависимость их реакционной способности от
электронного строения. Используйте реагенты –
металлический литий и бромную воду. Составьте
уравнения возможных реакций. Покажите смещение
электронной плотности химической связи в
молекулах.
Вариант II
. Поясните сущность взаимного
влияния карбоксильной группы –СООН и
заместителя при карбонильном углероде в
молекулах карбоновых кислот. Рассмотрите на
примере муравьиной и уксусной кислот.
Используйте раствор лакмуса и литий. Составьте
уравнения реакций. Покажите смещение
электронной плотности химической связи в
молекулах.
Вывод . Химические свойства зависят от взаимного влияния атомов.


Итоговый контроль знаний
Учитель
. Подведем итог нашего урока.
Мы с вами подтвердили, что свойства веществ
зависят от пространственного химического и
электронного строения.
1. Формулы НСООН, С 6 Н 5 ОН и C 4 H 9 COОН
запишите в порядке возрастания кислотных
свойств веществ.
2. Расположите формулы СН 3 СООН, С 3 Н 7 СООН,
СН 3 ОН, ClCH 2 СООН в порядке убывания
кислотных свойств веществ.
3. У какого альдегида:

более активная альдегидная группа? Почему?
Оцените свою работу на уроке.
Л.А.ЕРЕМИНА,
учитель химии школы № 24
(г. Абакан, Хакасия)
Тест А6 Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. 1. Кристаллическая решетка хлорида кальция 1) ионная 2)молекулярная 3) металлическая 4) атомная 2. Молекулярное строение имеет 1) ртуть 2) бром 3) гидроксид натрия 4) сульфат калия 3. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 4. Вещества, обладающие твёрдостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку: 1) молекулярную 2) атомную 3) ионную 4) металлическую 5. Молекулярную кристаллическую решетку имеет 1) НВr 2) K2О 3) ВаО 4) КСl 6. Вещества с атомной кристаллической решеткой 1) очень твёрдые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах. 7. Молекулярную кристаллическую решетку имеет 1) Са3Р2 2) СО2 3) SO2 4) АlF3 8. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V) 9. Кристаллическая решетка графита 1) ионная 2) молекулярная 3) атомная 4) металлическая 10. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку 1) молекулярную 2) ионную 3) атомную 4) металлическую 11. Молекулярную кристаллическую решетку имеет 1) кремний 2) оксид углерода(IV) 3) диоксид кремния 4) нитрат аммония 12. Кристаллическая решетка галогенов 1) атомная 2) ионная 3) молекулярная 4) металлическая 13. К веществам с атомной кристаллической решеткой относятся 1) натрий, фтор, оксид серы (IV) 2) свинец, азотная кислота, оксид магния 3) бор, алмаз, карбид кремния 4) хлорид калия, белый фосфор, йод 14. Молекулярное строение имеет 1) цинк 2) нитрат бария 3) гидроксид калия 4) бромоводород 15. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную 16. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия 17. Немолекулярное строение имеют все неметаллы группы 1) углерод, бор, кремний 3) кислород, сера, азот 2) фтор, бром, иод 4) хлор, фосфор, селен 18. Кристаллическую структуру, подобную структуре алмаза, имеет 1) кремнезем 2) оксид натрия 3) оксид углерода (II) 4) белый фосфор Р4 19. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 20. Молекулярную кристаллическую решетку имеет каждое из двух веществ 1) графит и алмаз 2) кремний и йод 3) хлор и оксид углерода(IV) 4) хлорид бария и оксид бария 21. Атомную кристаллическую решетку имеет каждое из двух веществ 1) оксид кремния (IV) и оксид углерода (IV) 2) графит и кремний 3) хлорид калия и фторид натрия 4) хлор и йод 22. Молекулярное строение имеет 1) натрий 2) фруктоза 3) фосфат натрия 4) оксид натрия 23. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду 1) хлорид калия, азот, метан 2) иод, диоксид углерода, озон 3) алюминий, бром, алмаз 4) водород, сульфат магния, оксид железа (III) 24. Оксид кремния тугоплавок, нерастворим в воде. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 25. В зависимости от характера частиц, образующих кристалл, и от природы сил взаимодействия между ними различают четыре типа кристаллических решеток: 1) ионные, атомные, молекулярные и металлические 2) ионные, ковалентные, атомные и молекулярные 3) металлические, ковалентные, атомные и молекулярные 4) ионные, кубические, треугольные и слоистые 26. Кристаллическая решетка льда: 1) атомная 2) молекулярная 3) ионная 4) металлическая 27. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку. 1) графит 2) натрий 3) гидроксид натрия 4) водород 28. Укажите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) хлороводород 2) хлор 3) оксид кремния (IV) 4) оксид кальция 29. Для твердых веществ с металлической кристаллической решеткой характерна высокая... 1) растворимость в воде 2) электроотрицательность атомов 3) летучесть 4) электропроводность 30. Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит кристаллическая решетка этого вещества? 1) атомная 2) молекулярная 3) ионная 4) металлическая 31. Немолекулярное строение имеет каждое из двух веществ: 1) S8 и O2 2) Fe и NaCl 3) CO и Mg 4) Na2CO3 и I2 32. Веществом молекулярного строения является 1) озон 2) оксид бария 3) графит 4) сульфид калия 33. Атомная кристаллическая решетка у простого вещества: 1) алмаз 2) медь 3) фтор 4) олово 34. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) алмаза 2) поваренной соли 3) кремния 4) азота 35. Ионную кристаллическую решетку имеет 1) вода 2) фторид натрия 3) серебро 4) бром 36. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами 1) малых периодов 3) побочных подгрупп 2) главных подгрупп 4) больших периодов 37. Кристаллическую структуру, подобную структуре алмаза, имеет: 1) кремнезем SiO2 2) оксид натрия Na2O 3) оксид углерода(II) CO 4) белый фосфор Р4 38. Фосфин РН3 - это газ. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 39. Из молекул состоят кристаллы. 1) сахара 2) соли 3) алмаза 4) серебра 40. Из разноимённо заряженных ионов состоят кристаллы 1) сахара 2) гидроксида натрия 3) алмаза 4) серебра 41. Какие частицы образуют кристалл нитрата натрия? 1) атомы Nа, N и О 3) ионы Nа+, NO3+ 5+ 22) ионы Nа, N ,О 4) молекулы NаNО3 42. Оцените правильность суждений о связи между строением и свойствами вещества. А. Среди веществ молекулярного строения есть газообразные, жидкие и твёрдые при обычных условиях. Б. Вещества с атомной кристаллической решеткой при обычных условиях твёрдые. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 43. Оцените правильность суждений о связи между строением и свойствами вещества: А. Если между частицами в кристалле прочная химическая связь, то вещество тугоплавко. Б. Все твёрдые вещества имеют немолекулярное строение 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 44. Какие из приведенных утверждений верны: А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность. Б. Вещества с атомной решеткой пластичны и обладают высокой электропроводностью. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 45. Установите соответствие между веществом и типом его кристаллической решетки. ВЕЩЕСТВО ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ 1) поваренная соль А) молекулярная 2) серебро Б) ионная 3) углекислый газ В) атомная 4) графит Г) металлическая 5) глюкоза 46. Установите соответствие между типом кристаллической решетки и свойствами веществ. ТИП КРИСТАЛЛИЧЕСКОЙ СВОЙСТВА ВЕЩЕСТВ РЕШЕТКИ A) ионная 1) твердые, тугоплавкие, не растворяются в воде Б) металлическая 2) хрупкие, легкоплавкие, не проводят электрический ток В) атомная 3) пластичные, имеют различные температуры плавления, проводят электрический ток Г) молекулярная 4) твердые, тугоплавкие, хорошо растворяются в воде 47. Укажите ряд, характеризующийся уменьшением длины химической связи 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl, SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Оцените правильность суждений о связи между строением и свойствами вещества. А. Если между частицами в кристалле прочная химическая связь, то вещество легко испаряется. Б. Все газы имеют молекулярное строение. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Лекция 7Зависимость свойств веществ от их
строения. Химическая связь. Основные
виды химической связи.
Рассматриваемые вопросы:
1. Уровни организации вещества. Иерархия структуры.
2. Вещества молекулярного и немолекулярного строения.
3.
4. Причины возникновения химической связи.
5. Ковалентная связь: механизмы образования, способы
перекрывания атомных орбиталей, полярность, дипольный момент
молекулы.
6. Ионная связь.
7. Сравнение ковалентной полярной и ионной связи.
8. Сравнение свойств веществ с ковалентными полярными и
ионными связями.
9. Металлическая связь.
10. Межмолекулярные взаимодействия.Вещество (более 70 млн.)
Что надо знать о каждом веществе?
Формула (из чего состоит)
Структура (как устроено)
Физические свойства
Химические свойства
Способы получения
(лаб. и промышл.)
6. Практическое применение
1.
2.
3.
4.
5.Иерархия структуры вещества
Все вещества
состоят из
атомов, но не
все – из
молекул.
Атом
Молекула
У всех веществ
Только у веществ
молекулярного
строения
Наноуровень
У всех веществ
Объемный (макро)
уровень
У всех веществ
Все 4 уровня – объект изучения химииВещества молекулярного
и немолекулярного строенияВещества
Молекулярного
строения
Немолекулярного
строения
Состоят из молекул
Состоят из атомов
или ионов
H2O, CO2, HNO3, C60,
почти все орг. вещества
Алмаз, графит, SiO2,
металлы, соли
Формула отражает
состав молекулы
Формула отражает состав
формульной единицыВещества
Хлорид натрия
Формульная единица NaClВещества
Диоксид кремния
Формульная единица SiO2
Минералогический музей имени Ферсмана находится возле входа в Нескучный сад.
Адрес: Москва, Ленинский проспект, дом 18, корпус 2.Разнообразие химических структур.
пропеллан
C5H6
коронен
(супербензол)
C24H12
кавитанд
C36H32O8Разнообразие химических структур.
катенанРазнообразие химических структур.
катенанРазнообразие химических структур.
лист МебиусаМолекула
Молекула – устойчивая система, состоящая из нескольких
атомных ядер и электронов.
Атомы объединяются в молекулы путем образования
химических связей.
Главная движущая сила образования молекулы из
атомов – уменьшение общей энергии.
Молекулы имеют геометрическую форму, характеризующуюся
расстояниями между ядрами и углами между связями.Главная движущая сила
образования химической связи
между частицами вещества –
уменьшение общей энергии
системы.Основные типы химической
связи:
1.Ионная
2.Ковалентная
3.Металлическая
Основные межмолекулярные
взаимодействия:
1.Водородные связи
2.Ван-дер-Ваальсовы связиИонная связь
Если связь образуют атомы с резко различающимися
значениями электроотрицательности (ΔОЭО ≥ 1,7),
общая электронная пара практически полностью
смещается в сторону более электроотрицательного
атома.
Na Cl
ОЭО 0,9 3,16
∆ 2,26
+Na
Анион
:ClКатион
Химическая связь между ионами, возникающая за
счет их электростатического притяжения,
называется ионной.Ионная связь
Кулоновский потенциал сферически
симметричен, направлен во все стороны,
поэтому ионная связь ненаправлена.
Кулоновский потенциал не имеет
ограничений на количество
присоединяемых противоионов -
следовательно, ионная связь
ненасыщаема.Ионная связь
Соединения с ионным типом связи
твердые, хорошо растворимые в
полярных растворителях, имеют высокие
температуры плавления и кипения.Ионная связь
Кривая I: притяжение ионов, если
бы они представляли собой
точечные заряды.
Кривая II: отталкивание ядер в
случае сильного сближения ионов.
Кривая III: минимум энергии Е0 на
кривой соответствует
равновесному состоянию ионной
пары, при котором силы
притяжения электронов к ядрам
скомпенсированы силами
отталкивания ядер между собой на
расстоянии r0,Химическая связь в молекулах
Химическую связь в молекулах можно описать с
позиций двух методов:
- метода валентных связей, МВС
- метода молекулярных орбиталей, ММОМетод валентных связей
Теория Гейтлера-Лондона
Основные положения метода ВС:
1. Связь образуют два электрона с противоположными
спинами, при этом происходит перекрывание волновых
функций и увеличивается электронная плотность между
ядрами.
2. Связь локализована в направлении максимального
перекрывания Ψ-функций электронов. Чем сильнее
перекрывание, тем прочнее связь.
dсв - длина
связи;
Есв - энергия
связи.Образование молекулы водорода:
Н· + ·Н → Н:Н
При сближении двух атомов
возникают силы притяжения и
отталкивания:
1) притяжения: «электрон-ядро»
соседних атомов;
2) отталкивания: «ядро-ядро»,
«электрон-электрон» соседних
атомов.Образование молекулы водорода:
Молекулярное
двухэлектронное облако,
обладающее максимальной
электронной плотностью.Химическая связь, осуществляемая общими
электронными парами, называется ковалентной.
Общая электронная пара может образоваться двумя
способами:
1) в результате объединения двух непарных электронов:
2) в результате обобществления неподеленной
электронной пары одного атома (донора) и пустой
орбитали другого (акцептора).
Два механизма образования ковалентной связи:
обменный и донорно-акцепторный.
плотности связи происходит по линии,
соединяющей центры атомов (ядра), то такое
перекрывание называется σ-связью:Способы перекрывания атомных орбиталей при
образовании ковалентной связи
Если образование максимальной электронной
плотности связи происходит по обе стороны
линии, соединяющей центры атомов (ядра), то
такое перекрывание называется π-связью:Полярная и неполярная ковалентная связь
1) Если связь образуют одинаковые атомы,
двухэлектронное облако связи распределяется в
пространстве симметрично между их ядрами - такая
связь называется неполярной: H2, Cl2, N2.
2) если связь образуют разные атомы, облако связи
смещено в сторону более электроотрицательного атома
- такая связь называется полярной: HCl, NH3, CO2.Полярная ковалентная связь
Дипольный момент связи
Диполь
H+δCl-δ или H+0,18Cl-0,18
Где ±δ - эффективный
заряд атома, доля
абсолютного заряда
электрона.
+δ
-δ
Не путать со степенью окисления!
l
Произведение эффективного заряда на длину диполя
называется электрическим моментом диполя: μ = δl
Это векторная величина: направлен от положительного
заряда к отрицательному.Полярная ковалентная связь
Дипольный момент молекулы
Дипольный момент молекулы равен сумме
векторов дипольных моментов связей с учетом
неподеленных электронных пар.
Единицей измерения дипольного момента
является Дебай: 1D = 3,3·10-30 Кл·м.Полярная ковалентная связь
Дипольный момент молекулы
В произведении μ = δl обе величины разнонаправлены.
Поэтому надо внимательно отслеживать причину
изменения μ.
Например,
CsF
CsCl
24
31
δ «проиграл» l
CsI
HF
HCl
HBr
HI
37
5,73
3,24
2,97
1,14
наоборотПолярная ковалентная связь
Дипольный момент молекулы
Может ли молекула быть неполярной, если
все связи в ней полярные?
Молекулы типа АВ всегда полярны.
Молекулы типа АВ2 могут быть и полярными, и
неполярными...
Н2О
О
Н
СО2
μ>0
Н
О
С
μ=0
ОПолярная ковалентная связь
Молекулы, состоящие из трех атомов и более
(АВ2, АВ3, АВ4, АВ5, АВ6) ,
могут быть неполярными, если они симметричны.
На что влияет наличие дипольного момента
молекулы?
Имеются межмолекулярные взаимодействия, а,
следовательно, увеличиваются плотность вещества,
t°плавления и t°кипения.Сравнение ионной и ковалентной полярной связей
Общее: образование общей
электронной пары.
Отличие: степень
смещения общей
электронной пары
(поляризация связи).
Ионную связь следует рассматривать как крайний
случай ковалентной полярной связи.
полярной связей
Ковалентная связь: насыщена и направлена
Насыщаемость (максимальная валентность) -
определяется способностью атома образовывать
ограниченное количество связей (с учетом обоих
механизмов образования).
Направление связи задает валентный угол, зависящий от
типа гибридизации орбиталей центрального атома.
Ионная связь: ненасыщена и ненаправлена.Сравнение характеристик ионной и ковалентной
полярной связей
Направленность связи задают валентные углы.
Валентные углы определяют экспериментально или
предсказывают на основе теории гибридизации
атомных орбиталей Л. Поллинга либо теории
Гиллеспи.
Подробно об этом на семинарах.
ковалентными связями
Ковалентные связи
Атомные кристаллы
Между атомами
в самом кристалле
Высокая твердость
высокие tºплав, tºкип
плохие тепло- и
электропроводность
Молекулярные кристаллы
Между атомами
в молекуле
Умеренная мягкость
достаточно низкие
tºплав, tºкип
плохие тепло- и
Электропроводность
Нерастворимы в водеСравнение свойств веществ с ионными и
ковалентными связями
Молекулярный кристалл
Температура плавления 112,85 °ССравнение свойств веществ с ионными и
ковалентными связями
Атомный ковалентный кристалл
Температура плавления ≈ 3700 °ССравнение свойств веществ с ионными и
ковалентными связями
Ионные связи
между ионами
в кристалле
твердость и хрупкость
высокая температура плавления
плохие тепло- и электропроводность
Растворимы в водеСравнение свойств веществ с ионными и
ковалентными связями
Ионный кристалл
Температура плавления ≈ 800 °СМеталлическая связь
Металлическая связь осуществляется электронами,
принадлежащими всем атомам одновременно.
Электронная плотность
делокализована «электронный газ».
Характерный
металлический блеск
Пластичность
Ковкость
Высокие тепло- и
электропроводность
Температуры плавления
очень разные.Межмолекулярные связи.
1. Водородная связь
Притяжение между атомом водорода (+) одной
молекулы и атомом F, O, N (–) другой молекулы
F
F
H
H
H
H
F
F
O
H3C
H
F
C
H
Полимер
(HF)n
O
C
O
H
CH3
Димер
уксусной кислоты
O
Водородные связи слабы индивидуально,
но сильны коллективноМежмолекулярные связи.
2. Водородная связь в ДНКМежмолекулярные связи.
3. Водородные связи в воде
жидкая вода
ледМежмолекулярные связи.
4. Образование водородных связей в
воде
жидкая вода
превращение
воды в ледМежмолекулярные связи.
5. Ван-дер-ваальсовы связи
Даже если между молекулами нет водородных связей,
молекулы всегда притягиваются друг к другу.
Притяжение между молекулярными диполями называют вандер-ваальсовой связью.
В-д-в притяжение тем сильнее, чем больше:
1) полярность; 2) размер молекул.
Пример: метан (CH4) – газ, бензол (C6H6) – жидкость
Одна из самых слабых в-д-в связей – между молекулами
H2 (т. пл. –259 оС, т. кип. –253 оС).
Взаимодействие между молекулами во много раз слабее связи между атомами:
Eков(Cl–Cl) = 244 кДж/моль, Eвдв(Cl2–Cl2) = 25 кДж/моль
но именно оно обеспечивает существование жидкого и твердого состояния веществаВ лекции использованы материалы профессора
химического факультета МГУ им. Ломоносова
Еремина Вадима Владимировича
Спасибо
за внимание!
Современное учение о свойствах органических является развитием идеи А. М. Бутлерова о зависимости от его строения. Выражающая строение дает представление о всем многообразии , хотя предсказания на не являются следствием строгих математических законов, а носят лишь качественный характер и предоставляют еще многое на долю таланта и интуиции химика-экспериментатора.
Характеристики физических свойств соединений часто выражают как сумму нескольких слагаемых, относящихся к соответствующих элементов, которые входят в состав данного соединения. Применение таких аддитивных схем для нахождения какой-либо физико-химической характеристики соединения по формуле его строения равносильно, следовательно, предположению, что элемента, входя в состав различных соединений, вносит всегда одну и ту же долю такой характеристики.
В простейших случаях это предположение в отношении оказывается очень близким к истине (аддитивны, например, величины молекулярных объемов и
Лекция 7 Зависимость свойств веществ от их строения. Химическая связь. Основные виды химической связи. Рассматриваемые вопросы: 1. Уровни организации вещества. Иерархия структуры. 2. Вещества молекулярного и немолекулярного строения. 3. Разнообразие химических структур. 4. Причины возникновения химической связи. 5. Ковалентная связь: механизмы образования, способы перекрывания атомных орбиталей, полярность, дипольный момент молекулы. 6. Ионная связь. 7. Сравнение ковалентной полярной и ионной связи. 8. Сравнение свойств веществ с ковалентными полярными и ионными связями. 9. Металлическая связь. 10. Межмолекулярные взаимодействия.
 Вещество (более 70 млн.) Что надо знать о каждом веществе? 1. 2. 3. 4. 5. Формула (из чего состоит) Структура (как устроено) Физические свойства Химические свойства Способы получения (лаб. и промышл.) 6. Практическое применение
Вещество (более 70 млн.) Что надо знать о каждом веществе? 1. 2. 3. 4. 5. Формула (из чего состоит) Структура (как устроено) Физические свойства Химические свойства Способы получения (лаб. и промышл.) 6. Практическое применение
 Иерархия структуры вещества Все вещества состоят из атомов, но не все – из молекул. Атом Молекула У всех веществ Только у веществ молекулярного строения Наноуровень У всех веществ Объемный (макро) уровень У всех веществ Все 4 уровня – объект изучения химии
Иерархия структуры вещества Все вещества состоят из атомов, но не все – из молекул. Атом Молекула У всех веществ Только у веществ молекулярного строения Наноуровень У всех веществ Объемный (макро) уровень У всех веществ Все 4 уровня – объект изучения химии

 Вещества Молекулярного строения Немолекулярного строения Состоят из молекул Состоят из атомов или ионов H 2 O, CO 2, HNO 3, C 60, почти все орг. вещества Алмаз, графит, Si. O 2, металлы, соли Формула отражает состав молекулы Формула отражает состав формульной единицы
Вещества Молекулярного строения Немолекулярного строения Состоят из молекул Состоят из атомов или ионов H 2 O, CO 2, HNO 3, C 60, почти все орг. вещества Алмаз, графит, Si. O 2, металлы, соли Формула отражает состав молекулы Формула отражает состав формульной единицы

 Вещества Диоксид кремния Формульная единица Si. O 2 Минералогический музей имени Ферсмана находится возле входа в Нескучный сад. Адрес: Москва, Ленинский проспект, дом 18, корпус 2.
Вещества Диоксид кремния Формульная единица Si. O 2 Минералогический музей имени Ферсмана находится возле входа в Нескучный сад. Адрес: Москва, Ленинский проспект, дом 18, корпус 2.
 Разнообразие химических структур. пропеллан C 5 H 6 коронен (супербензол) C 24 H 12 кавитанд C 36 H 32 O 8
Разнообразие химических структур. пропеллан C 5 H 6 коронен (супербензол) C 24 H 12 кавитанд C 36 H 32 O 8



 Молекула – устойчивая система, состоящая из нескольких атомных ядер и электронов. Атомы объединяются в молекулы путем образования химических связей. Главная движущая сила образования молекулы из атомов – уменьшение общей энергии. Молекулы имеют геометрическую форму, характеризующуюся расстояниями между ядрами и углами между связями.
Молекула – устойчивая система, состоящая из нескольких атомных ядер и электронов. Атомы объединяются в молекулы путем образования химических связей. Главная движущая сила образования молекулы из атомов – уменьшение общей энергии. Молекулы имеют геометрическую форму, характеризующуюся расстояниями между ядрами и углами между связями.

 Основные типы химической связи: 1. Ионная 2. Ковалентная 3. Металлическая Основные межмолекулярные взаимодействия: 1. Водородные связи 2. Ван-дер-Ваальсовы связи
Основные типы химической связи: 1. Ионная 2. Ковалентная 3. Металлическая Основные межмолекулярные взаимодействия: 1. Водородные связи 2. Ван-дер-Ваальсовы связи
 Ионная связь Если связь образуют атомы с резко различающимися значениями электроотрицательности (ΔОЭО ≥ 1, 7), общая электронная пара практически полностью смещается в сторону более электроотрицательного атома. Na Cl ОЭО 0, 9 3, 16 ∆ 2, 26 +Na Анион: Cl. Катион Химическая связь между ионами, возникающая за счет их электростатического притяжения, называется ионной.
Ионная связь Если связь образуют атомы с резко различающимися значениями электроотрицательности (ΔОЭО ≥ 1, 7), общая электронная пара практически полностью смещается в сторону более электроотрицательного атома. Na Cl ОЭО 0, 9 3, 16 ∆ 2, 26 +Na Анион: Cl. Катион Химическая связь между ионами, возникающая за счет их электростатического притяжения, называется ионной.
 Ионная связь Кулоновский потенциал сферически симметричен, направлен во все стороны, поэтому ионная связь ненаправлена. Кулоновский потенциал не имеет ограничений на количество присоединяемых противоионов - следовательно, ионная связь ненасыщаема.
Ионная связь Кулоновский потенциал сферически симметричен, направлен во все стороны, поэтому ионная связь ненаправлена. Кулоновский потенциал не имеет ограничений на количество присоединяемых противоионов - следовательно, ионная связь ненасыщаема.
 Ионная связь Соединения с ионным типом связи твердые, хорошо растворимые в полярных растворителях, имеют высокие температуры плавления и кипения.
Ионная связь Соединения с ионным типом связи твердые, хорошо растворимые в полярных растворителях, имеют высокие температуры плавления и кипения.
 Ионная связь Кривая I: притяжение ионов, если бы они представляли собой точечные заряды. Кривая II: отталкивание ядер в случае сильного сближения ионов. Кривая III: минимум энергии Е 0 на кривой соответствует равновесному состоянию ионной пары, при котором силы притяжения электронов к ядрам скомпенсированы силами отталкивания ядер между собой на расстоянии r 0,
Ионная связь Кривая I: притяжение ионов, если бы они представляли собой точечные заряды. Кривая II: отталкивание ядер в случае сильного сближения ионов. Кривая III: минимум энергии Е 0 на кривой соответствует равновесному состоянию ионной пары, при котором силы притяжения электронов к ядрам скомпенсированы силами отталкивания ядер между собой на расстоянии r 0,
 Химическая связь в молекулах Химическую связь в молекулах можно описать с позиций двух методов: - метода валентных связей, МВС - метода молекулярных орбиталей, ММО
Химическая связь в молекулах Химическую связь в молекулах можно описать с позиций двух методов: - метода валентных связей, МВС - метода молекулярных орбиталей, ММО
 Метод валентных связей Теория Гейтлера-Лондона Основные положения метода ВС: 1. Связь образуют два электрона с противоположными спинами, при этом происходит перекрывание волновых функций и увеличивается электронная плотность между ядрами. 2. Связь локализована в направлении максимального перекрывания Ψ-функций электронов. Чем сильнее перекрывание, тем прочнее связь.
Метод валентных связей Теория Гейтлера-Лондона Основные положения метода ВС: 1. Связь образуют два электрона с противоположными спинами, при этом происходит перекрывание волновых функций и увеличивается электронная плотность между ядрами. 2. Связь локализована в направлении максимального перекрывания Ψ-функций электронов. Чем сильнее перекрывание, тем прочнее связь.

 Образование молекулы водорода: Н· + ·Н → Н: Н При сближении двух атомов возникают силы притяжения и отталкивания: 1) притяжения: «электрон-ядро» соседних атомов; 2) отталкивания: «ядро-ядро» , «электрон-электрон» соседних атомов.
Образование молекулы водорода: Н· + ·Н → Н: Н При сближении двух атомов возникают силы притяжения и отталкивания: 1) притяжения: «электрон-ядро» соседних атомов; 2) отталкивания: «ядро-ядро» , «электрон-электрон» соседних атомов.

 Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Общая электронная пара может образоваться двумя способами: 1) в результате объединения двух непарных электронов: 2) в результате обобществления неподеленной электронной пары одного атома (донора) и пустой орбитали другого (акцептора). Два механизма образования ковалентной связи: обменный и донорно-акцепторный.
Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Общая электронная пара может образоваться двумя способами: 1) в результате объединения двух непарных электронов: 2) в результате обобществления неподеленной электронной пары одного атома (донора) и пустой орбитали другого (акцептора). Два механизма образования ковалентной связи: обменный и донорно-акцепторный.
 Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по линии, соединяющей центры атомов (ядра), то такое перекрывание называется σ-связью:
Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по линии, соединяющей центры атомов (ядра), то такое перекрывание называется σ-связью:
 Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по обе стороны линии, соединяющей центры атомов (ядра), то такое перекрывание называется π-связью:
Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по обе стороны линии, соединяющей центры атомов (ядра), то такое перекрывание называется π-связью:
 Полярная и неполярная ковалентная связь 1) Если связь образуют одинаковые атомы, двухэлектронное облако связи распределяется в пространстве симметрично между их ядрами - такая связь называется неполярной: H 2, Cl 2, N 2. 2) если связь образуют разные атомы, облако связи смещено в сторону более электроотрицательного атома - такая связь называется полярной: HCl, NH 3, CO 2.
Полярная и неполярная ковалентная связь 1) Если связь образуют одинаковые атомы, двухэлектронное облако связи распределяется в пространстве симметрично между их ядрами - такая связь называется неполярной: H 2, Cl 2, N 2. 2) если связь образуют разные атомы, облако связи смещено в сторону более электроотрицательного атома - такая связь называется полярной: HCl, NH 3, CO 2.
 Полярная ковалентная связь Дипольный момент связи Диполь H+δCl-δ или H+0, 18 Cl-0, 18 +δ -δ Где ±δ - эффективный заряд атома, доля абсолютного заряда электрона. Не путать со степенью окисления! l Произведение эффективного заряда на длину диполя называется электрическим моментом диполя: μ = δl Это векторная величина: направлен от положительного заряда к отрицательному.
Полярная ковалентная связь Дипольный момент связи Диполь H+δCl-δ или H+0, 18 Cl-0, 18 +δ -δ Где ±δ - эффективный заряд атома, доля абсолютного заряда электрона. Не путать со степенью окисления! l Произведение эффективного заряда на длину диполя называется электрическим моментом диполя: μ = δl Это векторная величина: направлен от положительного заряда к отрицательному.
 Полярная ковалентная связь Дипольный момент молекулы равен сумме векторов дипольных моментов связей с учетом неподеленных электронных пар. Единицей измерения дипольного момента является Дебай: 1 D = 3, 3· 10 -30 Кл·м.
Полярная ковалентная связь Дипольный момент молекулы равен сумме векторов дипольных моментов связей с учетом неподеленных электронных пар. Единицей измерения дипольного момента является Дебай: 1 D = 3, 3· 10 -30 Кл·м.
 Полярная ковалентная связь Дипольный момент молекулы В произведении μ = δl обе величины разнонаправлены. Поэтому надо внимательно отслеживать причину изменения μ. Например, Cs. F Cs. Cl 24 31 δ «проиграл» l Cs. I HF HCl HBr HI 37 5, 73 3, 24 2, 97 1, 14 наоборот
Полярная ковалентная связь Дипольный момент молекулы В произведении μ = δl обе величины разнонаправлены. Поэтому надо внимательно отслеживать причину изменения μ. Например, Cs. F Cs. Cl 24 31 δ «проиграл» l Cs. I HF HCl HBr HI 37 5, 73 3, 24 2, 97 1, 14 наоборот
 Полярная ковалентная связь Дипольный момент молекулы Может ли молекула быть неполярной, если все связи в ней полярные? Молекулы типа АВ всегда полярны. Молекулы типа АВ 2 могут быть и полярными, и неполярными. . . Н 2 О О Н СО 2 μ>0 Н О С μ=0 О
Полярная ковалентная связь Дипольный момент молекулы Может ли молекула быть неполярной, если все связи в ней полярные? Молекулы типа АВ всегда полярны. Молекулы типа АВ 2 могут быть и полярными, и неполярными. . . Н 2 О О Н СО 2 μ>0 Н О С μ=0 О
 Полярная ковалентная связь Молекулы, состоящие из трех атомов и более (АВ 2, АВ 3, АВ 4, АВ 5, АВ 6) , могут быть неполярными, если они симметричны. На что влияет наличие дипольного момента молекулы? Имеются межмолекулярные взаимодействия, а, следовательно, увеличиваются плотность вещества, t°плавления и t°кипения.
Полярная ковалентная связь Молекулы, состоящие из трех атомов и более (АВ 2, АВ 3, АВ 4, АВ 5, АВ 6) , могут быть неполярными, если они симметричны. На что влияет наличие дипольного момента молекулы? Имеются межмолекулярные взаимодействия, а, следовательно, увеличиваются плотность вещества, t°плавления и t°кипения.
 Сравнение ионной и ковалентной полярной связей Общее: образование общей электронной пары. Отличие: степень смещения общей электронной пары (поляризация связи). Ионную связь следует рассматривать как крайний случай ковалентной полярной связи.
Сравнение ионной и ковалентной полярной связей Общее: образование общей электронной пары. Отличие: степень смещения общей электронной пары (поляризация связи). Ионную связь следует рассматривать как крайний случай ковалентной полярной связи.
 Сравнение характеристик ионной и ковалентной полярной связей Ковалентная связь: насыщена и направлена Насыщаемость (максимальная валентность) - определяется способностью атома образовывать ограниченное количество связей (с учетом обоих механизмов образования). Направление связи задает валентный угол, зависящий от типа гибридизации орбиталей центрального атома. Ионная связь: ненасыщена и ненаправлена.
Сравнение характеристик ионной и ковалентной полярной связей Ковалентная связь: насыщена и направлена Насыщаемость (максимальная валентность) - определяется способностью атома образовывать ограниченное количество связей (с учетом обоих механизмов образования). Направление связи задает валентный угол, зависящий от типа гибридизации орбиталей центрального атома. Ионная связь: ненасыщена и ненаправлена.
 Сравнение характеристик ионной и ковалентной полярной связей Направленность связи задают валентные углы. Валентные углы определяют экспериментально или предсказывают на основе теории гибридизации атомных орбиталей Л. Поллинга либо теории Гиллеспи. Подробно об этом на семинарах.
Сравнение характеристик ионной и ковалентной полярной связей Направленность связи задают валентные углы. Валентные углы определяют экспериментально или предсказывают на основе теории гибридизации атомных орбиталей Л. Поллинга либо теории Гиллеспи. Подробно об этом на семинарах.
 Сравнение свойств веществ с ионными и ковалентными связями Ковалентные связи Атомные кристаллы Между атомами в самом кристалле Высокая твердость высокие tºплав, tºкип плохие тепло- и электропроводность Молекулярные кристаллы Между атомами в молекуле Умеренная мягкость достаточно низкие tº плав, tºкип плохие тепло- и Электропроводность Нерастворимы в воде
Сравнение свойств веществ с ионными и ковалентными связями Ковалентные связи Атомные кристаллы Между атомами в самом кристалле Высокая твердость высокие tºплав, tºкип плохие тепло- и электропроводность Молекулярные кристаллы Между атомами в молекуле Умеренная мягкость достаточно низкие tº плав, tºкип плохие тепло- и Электропроводность Нерастворимы в воде

 Сравнение свойств веществ с ионными и ковалентными связями Атомный ковалентный кристалл Температура плавления ≈ 3700 °С
Сравнение свойств веществ с ионными и ковалентными связями Атомный ковалентный кристалл Температура плавления ≈ 3700 °С
 Сравнение свойств веществ с ионными и ковалентными связями Ионные связи между ионами в кристалле твердость и хрупкость высокая температура плавления плохие тепло- и электропроводность Растворимы в воде
Сравнение свойств веществ с ионными и ковалентными связями Ионные связи между ионами в кристалле твердость и хрупкость высокая температура плавления плохие тепло- и электропроводность Растворимы в воде

 Металлическая связь осуществляется электронами, принадлежащими всем атомам одновременно. Электронная плотность делокализована «электронный газ» . Характерный металлический блеск Пластичность Ковкость Высокие тепло- и электропроводность Температуры плавления очень разные.
Металлическая связь осуществляется электронами, принадлежащими всем атомам одновременно. Электронная плотность делокализована «электронный газ» . Характерный металлический блеск Пластичность Ковкость Высокие тепло- и электропроводность Температуры плавления очень разные.
 Межмолекулярные связи. 1. Водородная связь Притяжение между атомом водорода (+) одной молекулы и атомом F, O, N (–) другой молекулы Полимер (HF)n Димер уксусной кислоты Водородные связи слабы индивидуально, но сильны коллективно
Межмолекулярные связи. 1. Водородная связь Притяжение между атомом водорода (+) одной молекулы и атомом F, O, N (–) другой молекулы Полимер (HF)n Димер уксусной кислоты Водородные связи слабы индивидуально, но сильны коллективно
 Межмолекулярные связи. 5. Ван-дер-ваальсовы связи Даже если между молекулами нет водородных связей, молекулы всегда притягиваются друг к другу. Притяжение между молекулярными диполями называют вандер-ваальсовой связью. В-д-в притяжение тем сильнее, чем больше: 1) полярность; 2) размер молекул. Пример: метан (CH 4) – газ, бензол (C 6 H 6) – жидкость Одна из самых слабых в-д-в связей – между молекулами H 2 (т. пл. – 259 о. С, т. кип. – 253 о. С). Взаимодействие между молекулами во много раз слабее связи между атомами: Eков(Cl–Cl) = 244 к. Дж/моль, Eвдв(Cl 2–Cl 2) = 25 к. Дж/моль но именно обеспечивает существование жидкого и твердого состояния вещества
Межмолекулярные связи. 5. Ван-дер-ваальсовы связи Даже если между молекулами нет водородных связей, молекулы всегда притягиваются друг к другу. Притяжение между молекулярными диполями называют вандер-ваальсовой связью. В-д-в притяжение тем сильнее, чем больше: 1) полярность; 2) размер молекул. Пример: метан (CH 4) – газ, бензол (C 6 H 6) – жидкость Одна из самых слабых в-д-в связей – между молекулами H 2 (т. пл. – 259 о. С, т. кип. – 253 о. С). Взаимодействие между молекулами во много раз слабее связи между атомами: Eков(Cl–Cl) = 244 к. Дж/моль, Eвдв(Cl 2–Cl 2) = 25 к. Дж/моль но именно обеспечивает существование жидкого и твердого состояния вещества
 В лекции использованы материалы профессора химического факультета МГУ им. Ломоносова Еремина Вадима Владимировича Спасибо за внимание!
В лекции использованы материалы профессора химического факультета МГУ им. Ломоносова Еремина Вадима Владимировича Спасибо за внимание!