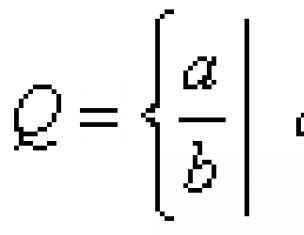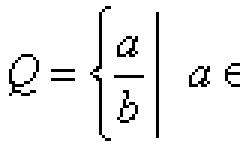Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты. a,b-Ненасыщенные кислоты
Производные карбоновых кислот
1. Галогенангидриды.
При действии галогенидов фосфора или хлористого тионила происходит образование галогенагидридов:
CH 3 COOH + PCl 5 ® CH 3 COCl + POCl 3 + HCl
Галоген в галогенангидридах обладает большой реакционной способностью. Сильный индукционный эффект определяет легкость замещения галогена другими нуклеофилами: -OH, -OR, -NH2, -N3, -CN и др.:
CH 3 COCl + CH 3 COOAg ® (CH 3 CO) 2 O уксусный ангидрид + AgCl
1. Ангидриды.
Ангидриды образуются при взаимодействии солей кислот с их галогенангидридами:
CH 3 COONa + CH 3 COCl ® NaCl + (CH 3 CO) 2 O
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами.
Амиды получают через галогенангидриды
CH 3 COCl +2 NH 3 ® CH 3 CONH 2 ацетамид + NH 4 Cl
или из аммонийных солей кислот, при сухой перегонке которых отщепляется вода и образуется амид кислоты. Также амиды кислот образуются как побочный продукт при гидролизе нитрилов. Процессы амидирования имеют важное значение в промышленности для производства ряда ценных соединений (N,N-диметилформамид, диметилацетамид, этаноламиды высших кислот).
4. Нитрилы. Важнейшими представителями нитрилов являются ацетонитрил CH 3 CN (применяется как полярный растворитель) и акрилонитрил CH 2 =CHCN (мономер для получения синтетического волокна нейрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью). Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
CH 3 CONH 2 ® CH 3 C-CN + H 2 O
5. Сложные эфиры. Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Их получают этерификацией спиртов кислотами, ангидридами и галогенангидридами или взаимодействием кислот и алкенов:
CH 3 -CH=CH 2 + CH 3 COOH ® CH 3 COOCH(CH 3) 2
Многие эфиры используются в качестве душистых веществ:
| CH 3 COOCH 2 CH 3 | грушевая эссенция |
| CH 3 CH 2 CH 2 COOCH 2 CH 2 CH 2 CH 2 CH 3 | ананасовая эссенция |
| ромовая эссенция |
Двухосновные насыщенные кислоты
Двухосновные предельные (насыщенные) кислоты имеют общую формулу C n H 2 n (COOH) 2 . Из них важнейшими являются:
НООС-СООН - щавелевая, этандикарбоновая кислота;
НООС-СН 2 -СООН - малоновая, пропандикарбоновая кислота;
НООС-СН 2 -СН 2 -СООН - янтарная, бутандикарбоновая кислота;
НООС-СН 2 -СН 2 -СН 2 -СООН - глутаровая, пентандикарбоновая кислота.
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№27).
1. Окисление оксикислот:
OH-CH 2 CH 2 COOH ® HOCCH 2 COOH ® HOOC-CH 2 -COOH
2. Окисление циклоалканов.
Это промышленный способ получения адипиновой кислоты HOOC-CH 2 CH 2 CH 2 CH 2 -COOH из циклогексана.
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Двухосновные кислоты более сильные, чем одноосновные. Это объясняется взаимным влиянием карбоксильных групп, облегчающих диссоциацию:

В целом реакции дикарбоновых кислот и их монокарбоновых аналогов почти не различаются между собой. Механизм реакций образования диамидов, диэфиров и др. из карбоновых кислот тот же, что и для монокарбоновых кислот. Исключение составляют дикарбоновые кислоты, содержащие меньше четырех атомов углерода между карбоксильными группами. Такие кислоты, две карбоксильные группы которых способны реагировать с одной функциональной группой или друг с другом, обнаруживают необычное поведение в реакциях, протекающих с образованием пяти- или шестичленных замкнутых активированных комплексов или продуктов.
Примером необычного поведения карбоновых кислот могут служить реакции, протекающие при нагревании.
При 150 о С щавелевая кислота разлагается на муравьиную кислоту и СО 2:
HOOC-COOH ® HCOOH + CO 2
2. Циклодегидратация.
При нагревании g-дикарбоновых кислот, у которых карбоксильные группы разделены атомами углерода, происходит циклодегидратация, в результате чего образуются циклические ангидриды:

Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты. a , b -Ненасыщенные кислоты
Производные карбоновых кислот
1. Галогенангидриды .
При действии галогенидов фосфора или хлористого тионила происходит образование галогенагидридов:
CH 3 COOH + PCl 5 ® CH 3 COCl + POCl 3 + HCl
Галоген в галогенангидридах обладает большой реакционной способностью. Сильный индукционный эффект определяет легкость замещения галогена другими нуклеофилами: - OH , - OR , - NH 2, - N 3, - CN и др.:
CH 3 COCl + CH 3 COOAg ® (CH 3 CO) 2 O уксусный ангидрид + AgCl
1. Ангидриды.
Ангидриды образуются при взаимодействии солей кислот с их галогенангидридами:
CH 3 COONa + CH 3 COCl ® NaCl + (CH 3 CO ) 2 O
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами.
2. Амиды .
Амиды получают через галогенангидриды
CH 3 COCl +2 NH 3 ® CH 3 CONH 2 ацетамид + NH 4 Cl
или из аммонийных солей кислот, при сухой перегонке которых отщепляется вода и образуется амид кислоты. Также амиды кислот образуются как побочный продукт при гидролизе нитрилов. Процессы амидирования имеют важное значение в промышленности для производства ряда ценных соединений (N , N -диметилформамид, диметилацетамид, этаноламиды высших кислот).
4. Нитрилы . Важнейшими представителями нитрилов являются ацетонитрил CH 3 CN (применяется как полярный растворитель) и акрилонитрил CH 2 = CHCN (мономер для получения синтетического волокна нейрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью). Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
CH 3 CONH 2 ® CH 3 C - CN + H 2 O
5. Сложные эфиры . Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Их получают этерификацией спиртов кислотами, ангидридами и галогенангидридами или взаимодействием кислот и алкенов:
CH 3 -CH=CH 2 + CH 3 COOH ® CH 3 COOCH(CH 3) 2
Многие эфиры используются в качестве душистых веществ:
| CH 3 COOCH 2 CH 3 | грушевая эссенция |
| CH 3 CH 2 CH 2 COOCH 2 CH 2 CH 2 CH 2 CH 3 | ананасовая эссенция |
| HCOOCH 2 CH 3 | ромовая эссенция |
Двухосновные насыщенные кислоты
Двухосновные предельные (насыщенные) кислоты имеют общую формулу C n H 2 n (COOH ) 2 . Из них важнейшими являются:
НООС-СООН - щавелевая, этандикарбоновая кислота;
НООС-СН 2 -СООН - малоновая, пропандикарбоновая кислота;
НООС-СН 2 -СН 2 -СООН - янтарная, бутандикарбоновая кислота;
НООС-СН 2 -СН 2 -СН 2 -СООН - глутаровая, пентандикарбоновая кислота.
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№27).
1. Окисление оксикислот :
OH-CH 2 CH 2 COOH ® HOCCH 2 COOH ® HOOC-CH 2 -COOH
2. Окисление циклоалканов .
Это промышленный способ получения адипиновой кислоты HOOC - CH 2 CH 2 CH 2 CH 2 - COOH из циклогексана.
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Химические свойства
Двухосновные кислоты более сильные, чем одноосновные. Это объясняется взаимным влиянием карбоксильных групп, облегчающих диссоциацию:
В целом реакции дикарбоновых кислот и их монокарбоновых аналогов почти не различаются между собой. Механизм реакций образования диамидов, диэфиров и др. из карбоновых кислот тот же, что и для монокарбоновых кислот. Исключение составляют дикарбоновые кислоты, содержащие меньше четырех атомов углерода между карбоксильными группами. Такие кислоты, две карбоксильные группы которых способны реагировать с одной функциональной группой или друг с другом, обнаруживают необычное поведение в реакциях, протекающих с образованием пяти- или шестичленных замкнутых активированных комплексов или продуктов.
Примером необычного поведения карбоновых кислот могут служить реакции, протекающие при нагревании.
При 150 о С щавелевая кислота разлагается на муравьиную кислоту и СО 2 :
HOOC-COOH ® HCOOH + CO 2
2. Циклодегидратация .
При нагревании g -дикарбоновых кислот, у которых карбоксильные группы разделены атомами углерода, происходит циклодегидратация, в результате чего образуются циклические ангидриды:
3. Синтезы на основе малонового эфира .
Двухосновные кислоты с двумя карбоксильными группами при одном углеродном атоме, т.е. малоновая кислота и ее моно- и дизамещенные гомологи, при нагревании несколько выше их температур плавления разлагаются (подвергаются декарбоксилированию ) с отщеплением одной карбоксильной группы и образованием уксусной кислоты или ее моно- и дизамещенных гомологов:
HOOCCH 2 COOH ® CH 3 COOH + CO 2
HOOCCH(CH 3)COOH ® CH3CH2COOH + CO 2
HOOCC(CH 3) 2 COOH ® (CH3) 2 CHCOOH + CO 2
Атомы водорода метиленовой группы, находящейся между ацильными группами диэтилового эфира малоновой кислоты (малоновый эфир ), обладают кислотными свойствами и дают натриевую соль с этилатом натрия. Эту соль – натрий-малоновый эфир – алкилируют по механизму нуклеофильного замещения S N 2 . На основе натрий-малонового эфира получают одно- и двухосновные кислоты:
- Na + + RBr ® RCH(COOCH 2 CH 3) 2 + 2 H 2 O ®
R-CH(COOH) 2 алкилмалоновая кислота ® R-CH 2 COOH алкилуксусная кислота + CO 2
4. Пиролиз кальциевых и бариевых солей .
При пиролизе кальциевых или бариевых солей адипиновой (С 6 ), пимелиновой (С 7 ) и пробковой (С 8 ) кислот происходит отщепление СО 2 и образуются циклические кетоны:
Непредельные одноосновные карбоновые кислоты
Непредельные одноосновные кислоты этиленового ряда имеют общую формулу C n H 2 n -1 COOH , ацетиленового и диэтиленового рядов - C n H 2 n -3 COOH . Примеры непредельных одноосновных кислот:
Непредельные одноосновные кислоты отличаются от предельных большими константами диссоциации. Ненасыщенные кислоты образуют все обычные производные кислот - соли, ангидриды, галогенангидриды, амиды, сложные эфиры и др. Но за счет кратных связей они вступают в реакции присоединения, окисления и полимеризации.
Благодаря взаимному влиянию карбоксильной группы и кратной связи присоединение галогенводородов к a,b-непредельным кислотам происходит таким образом, что водород направляется к наименее гидрогенизированному атому углерода:
CH 2 = CHCOOH + HBr ® BrCH 2 CH 2 COOH b -бромпропионовая кислота
Этиленовые кислоты типа акриловой кислоты и их эфиры значительно легче подвергаются полимеризации, чем соответствующие углеводороды.
Акриловую кислоту получают из этилена (через хлоргидрин или оксид этилена), гидролизом акрилонитрила или окислением пропилена, что более эффективно. В технике используются производные акриловой кислоты - ее эфиры, особенно метиловый (метилакрилат ). Метилакрилат легко полимеризуется с образованием прозрачных стекловидных веществ, поэтому его применяют в производстве органического стекла и других ценных полимеров.
Метакриловая кислота и ее эфиры получают в больших масштабах методами, сходными с методами синтеза акриловой кислоты и ее эфиров. Исходным продуктом является ацетон, из которого получают ацетонциангидрин, подвергают дегидратации и омылению с образованием метакриловой кислоты. Этерификацией метиловым спиртом получают метилметакрилат, который при полимеризации или сополимеризации образует стекловидные полимеры (органические стекла) с весьма ценными техническими свойствами.
Ароматические диазосоединения.
Реакции солей арилдиазония с выделением азота.
Реакции, в результате которых диазогруппа замещается другими группировками , имеют большое синтетическое применение, поскольку позволяют в довольно мягких условиях ввести в ароматическое кольцо те функциональные группы, введение которых иными способами было бы сопряжено со значительными трудностями или просто неосуществимо. Кроме того, с помощью этих реакций можно получать производные ароматических углеводородов с таким взаимным расположением функций, которого нельзя достичь, используя непосредственно реакции электрофильного замещения. Реакции с выделением азота могут протекать по ионному или радикальному механизмам .
Замена диазогруппы на гидроксильную группу. При нагревании водных растворов арилдиазониевых солей, даже до комнатной температуры, происходит выделение азота и образуются соответствующие фенолы . Во многих случаях выходы в этой реакции высокие, поэтому она может служить препаративным способом получения фенолов. Во избежание замены диазогруппы другими нуклеофилами реакцию обычно проводят с использованием серной кислоты , анионы которой обладают низкой нуклеофильностью:
Реакция протекает по механизму мономолекулярного арильного нуклеофильного замещения S N 1 Ar который в основном характерен именно для солей диазония. На первой, медленной, стадии катион диазония обратимо диссоциирует с образованием арил-катиона (в частности, фенил-катиона) и молекулы азота. На второй стадии крайне неустойчивый арил-катион быстро соединяется с нуклеофилом. Неустойчивость арил-катиона обусловлена невозможностью участия π-электронов ароматического кольца в делокализации положительного заряда, так как p-орбитали кольца не могут взаимодействовать с расположенной в плоскости σ-скелета вакантной sp 2 -гибридной орбиталью:

Замена диазогруппы на фтор . При нагревании сухих борофторидов арилдиазония образуются арилфториды ( реакциея Шимана ) :

Эта реакция - один из лучших способов введения фтора в ароматическое кольцо. Полагают, что она протекает по ионному механизму с образованием промежуточного арил-катиона:
Замена диазогруппы на иод . При добавлении к растворам солей арилдиазония растворимой соли иодоводородной кислоты образуются соответствующие арилиодиды . Например, из п-фенилендиамина практически с количественным выходом получают п-дииодобензол, который другими методами получить довольно трудно:
Замена диазогруппы на хлор или бром. Для получения хлоро- или бромопроизводных соли диазония нагревают в присутствии солей меди(I) - CuCl или СиВr соответственно:

Обе реакции протекают по радикальному механизму . Ион Сu + легко окисляется в ион Сu 2+ , отдавая один электрон катиону диазония. Последний превращается при этом в свободный радикал (I), который отщепляет молекулу азота, образуя арил-радикал (II). При последующем взаимодействии арил-радикала (II) с галогенид-ионом образуется конечный арилгалогенид . Отщепившийся на последней стадии электрон затрачивается на восстановление иона Сu 2+ , за счет чего происходит регенерация катализатора.
Замена диазогруппы на цианогруппу. При обработке растворов ароматических солей диазония цианидом меди образуются арилнитрилы (арилцианиды ):

Замена диазогруппы на нитрогруппу. Реакцию проводят, добавляя твердый борофторид арилдиазония к раствору нитрита натрия, в котором суспендирован медный порошок. Этот способ позволяет ввести нитрогруппу в такие положения ароматического кольца, которые недоступны для прямого нитрования, например:
Замена диазогруппы на водород. При действии на соли арилдиазония такого восстановителя, как фосфорноватистая кислота Н 3 РO 2 , происходит замещение диазогруппы на атом водорода. В качестве примера приведена схема получения 2,4,6-трибромобензойной кислоты, которую невозможно получить прямым бромированием бензойной кислоты:
Замена диазогруппы на металл. Из солей диазония можно получить органические соединения некоторых металлов. Например, при восстановлении медью двойных ртутных солей получаются ртутьорганические соединения (реакция Несмеянова ):

кислот - мезовинная не относится к числу оптически активных веществ. Гомологом щавелевой кислоты является адипиновая кислота НООС(СН 2) 4 СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон (см. статью «Гиганты органического мира. Полимеры»).
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
Хотя карбоксильная группа состоит из карбонильной и гидроксильной групп, карбоновые кислоты по свойствам сильно отличаются и от спиртов, и от карбонильных соединений. Взаимное влияние ОН- и -групп приводит
к перераспределению электронной плотности. В результате атом водорода гидроксильной группы приобретает кислотные свойства, т. е. легко отщепляется при растворении кислоты в воде. Карбоновые кислоты изменяют окраску индикаторов и проявляют все свойства, характерные для растворов неорганических кислот.
Все одноосновные кислоты, не содержащие заместителей (например, муравьиная и уксусная), являются слабыми - лишь в незначительной степени диссоциированными на ионы. Силу кислоты можно изменить, введя в a-положение к функциональной группе атом галогена. Так, трихлоруксусная кислота, образующаяся при хлорировании уксусной кислоты СН 3 СООН+3Сl 2 ®ССl 3 СООН+3НСl, в водном растворе в значительной степени диссоциирует на ионы.
Карбоновые кислоты могут образовывать функциональные производные, при гидролизе которых вновь получаются исходные кислоты. Так, при действии на карбоновые кислоты хлорида и оксида фосфора(V) образуются, соответственно, хлорангидриды и ангидриды; при действии аммиака и аминов - амиды; спиртов - сложные эфиры.
Кристаллы монохлоруксусной кислоты СН 2 ClСООН.
График зависимости температуры кипения алканов, спиртов, альдегидов и карбоновых кислот с неразветвлённой цепью от числа атомов углерода в молекуле.
Реакция образования сложных эфиров носит название этерификации (от греч. «этер» - «эфир»). Обычно её проводят в присутствии минеральной кислоты, играющей роль катализатора. При нагревании сложный эфир (или вода, если эфир кипит при температуре выше 100 °С) отгоняется из реакционной смеси, и равновесие смещается вправо. Так, из уксусной кислоты и этилового спирта получают этилацетат - растворитель, входящий в состав многих видов клея:
Многие сложные эфиры представляют собой бесцветные жидкости с приятным запахом. Так, изоамилацетат пахнет грушей, этилбутират - ананасом, изоамилбутират - абрикосом, бензилацетат - жасмином, а этилформиат - ромом. Многие сложные эфиры используются в качестве
вкусовых добавок при изготовлении различных напитков, а также в парфюмерии. Особенно нежный запах у производных 2-фенилэтилового спирта: эфир этого спирта и фенилуксусной кислоты пахнет мёдом и гиацинтами. А аромат эфира муравьиной кислоты заставляет вспомнить благоухание букета роз и хризантем. В присутствии щёлочи сложные эфиры могут быть гидролизованы - разложены на исходный спирт и соль карбоновой кислоты. При гидролизе жиров (сложных эфиров глицерина и высших карбоновых кислот) образуются основные компоненты мыла - пальмитат и стеарат натрия,
НАЗВАНИЯ НЕКОТОРЫХ КАРБОНОВЫХ КИСЛОТ И ИХ СОЛЕЙ
*Этилацетат- бесцветная нерастворимая в воде жидкость с приятным эфирным запахом (t кип =77,1 °C), смешивается с этиловым спиртом и другими органическими растворителями.
**Названия сложных эфиров образованы из названий соответствующих спиртов и кислот: этилацетат - эфир этилового спирта и уксусной кислоты (уксусноэтиловый эфир), изоамилформиат - эфир изоамилового спирта и муравьиной кислоты (муравьиноизоамиловый эфир).
ЛЕДЯНАЯ КИСЛОТА
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3-15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию - раствор с концентрацией уже 70-80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH 3 COOHNa+H 2 SO 4 (конц.)= CH 3 COOH+NaHSO 4 .
Такая чистая уксусная кислота, не содержащая воды, при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лёд. Вот почему её иногда называют ледяной.
Сходство не только внешнее: в кристаллах молекулы уксусной кислоты,
Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты.
Многие соли уксусной кислоты неустойчивы к нагреванию. Так, при разложении ацетата кальция образуется ацетон:
А при нагревании смеси ацетата натрия со щёлочью выделяется метан:
В течение многих столетии главным методом синтеза уксусной кислоты было брожение. Таким способом и сейчас производят пищевой уксус. А для производства сложных эфиров и искусственных волокон в качестве сырья используют кислоту, которая получается при каталитическом окислении углеводородов, например бутана:
СН 3 -СН 2 -СН 2 -СН 3 +2,5О 2 ®2СН 3 -СООН+Н 2 О.
Органические соединения, содержащие карбоксильную группу –СООН , относятся к классу кислот.
Биологически важные карбоновые кислоты:
| Кислоты (тривиальное название) | Название аниона | Формула кислоты |
| Одноосновные | ||
| муравьиная | формиат | HCOOH |
| уксусная | ацетат | CH 3 COOH |
| масляная | бутират | CH 3 (CH 2) 2 COOH |
| валериановая | валерат | CH 3 (CH 2) 3 COOH |
| Непредельные кислоты | ||
| акриловая | акрилаты | СН 2 = СН- СООН |
| кротоновая | кротонат | СН 3 – СН = СН - СООН |
| Ароматические | ||
| бензойная | бензоат | C 6 H 5 COOH |
| Дикарбоновые кислоты | ||
| щавелевая кислота | оксалаты | НООС - СООН |
| малоновая | малонаты | НООС-СН 2 - СООН |
| янтарная | сукцинаты | НООС-СН 2 – СН 2 -СООН |
| глутаровая | глутараты | НООС –(СН 2) 3 - СООН |
| Непредельные дикарбоновые | ||
| Фумаровая (транс-изомер) | фумараты | НООС-СН=СН-СООН |
Кислотные свойства карбоновых кислот:
RCOOH RCOO - + Н +
При диссоциации образуется карбоксилат анион, в котором отрицательный заряд равномерно распределяется между кислородными атомами, что увеличивает стабильность этой частицы. Сила карбоновых кислот зависит от длины радикала (чем больше радикал, тем слабее кислота) и заместителей (электроноакцепторные заместители усиливают кислотность). CI 3 COOH намного сильнее СН 3 СООН. Дикарбоновые кислоты сильнее одноосновных.
Функциональные производные карбоновых кислот:
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
1. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO) 2 Mg + Н 2 ,
2RCOOH + СаО → (RCOO) 2 Ca + Н 2 О,
RCOOH + NaOH → RCOONa + Н 2 О,
RCOOH + NaHCO 3 → RCOONa + Н 2 О + СО 2 .
Карбоновые кислоты - слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH 3 COONa + HCl → СН 3 СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН 3 СООК + Н 2 О СН 3 СООН + КОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
2. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R-СО-X; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R-CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
R-CO-OH + РСl 5 → R-CO-Cl + РОСl 3 + HCl.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-CO-OH + Р 2 О 5 → (R-CO-) 2 O + 2НРО 3 .
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-CO-Cl + Na-O-R" → R-CO-OR" + NaCl.
Амиды образуются реакцией хлорангидридов карбоновых кислот с аммиаком:
СН 3 -СО-Сl + NН 3 → СН 3 -СО-NН 2 + HCl.
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот: t o
CH 3 -COONH 4 → CH 3 -CO-NH 2 + Н 2 О
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
CH 3 -CO-NH 2 → CH 3 -C≡N + Н 2 О
3. Cвойства карбоновых кислот, обусловленные наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (α-атоме): р кр.
СН 3 -СН 2 -СООН + Вr 2 → СН 3 -СНВr-СООН + НВr
4. Непредельные карбоновые кислоты способны к реакциям присоединения:
СН 2 =СН-СООН + Н 2 → СН 3 -СН 2 -СООН,
СН 2 =СН-СООН + Сl 2 → СН 2 Сl-СНСl-СООН,
СН 2 =СН-СООН + HCl → СН 2 Сl-СН 2 -СООН,
СН 2 =СН-СООН + Н 2 O → НО-СН 2 -СН 2 -СООН,
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.

5. Окислительно-восстановительные реакции карбоновых кислот:
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды.
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа.
Муравьиная кислота - сильный восстановитель и легко окисляется до СО 2 . Она дает реакцию "серебряного зеркала":
НСООН + 2OH → 2Ag + (NH 4) 2 CO 3 + 2NH 3 + H 2 O,
или в упрощенном виде в аммиачном растворе при нагревании:
НСООН + Аg 2 О → 2Аg + СО 2 + Н 2 О.
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
Н 2 SО 4(конц)
НСООН → СО + Н 2 О
6. Реакции декарбоксилирования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С-С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
CH 3 -CH 2 -COONa + NaOH → С 2 Н 6 + Na 2 CO 3
Двухосновные карбоновые кислоты легко отщепляют СО 2 при нагревании:
НООС-СН 2 -СООН → СН 3 СООН + CO 2