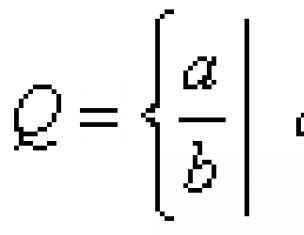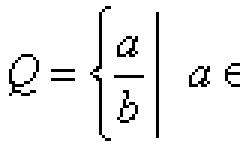Рис.1. Орбитальные радиусы элементов (r a) и длина одноэлектронной химической связи (d)
Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном . Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы.
Примерами таких химических соединений являются молекулярные ионы: H 2 + , Li 2 + , Na 2 + , K 2 + , Rb 2 + , Cs 2 + :
Полярная ковалентная связь возникает в гетероядерных двухатомных молекулах (рис.3). Связывающая электронная пара в полярной химической связи приближена к атому с более высоким первым потенциалом ионизации .
Характеризующее пространственную структуру полярных молекул расстояние d между атомными ядрами можно приближённо рассматривать как сумму ковалентных радиусов соответствующих атомов.
Характеристика некоторых полярных веществСдвиг связывающей электронной пары к одному из ядер полярной молекулы приводит к появлению электрического диполя (электродинамика) (рис.4).
Расстояние между центрами тяжести положительного и отрицательного зарядов называют длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной дипольного момента μ, представляющего собой произведение длины диполя l на величину электронного заряда :
Кратные ковалентные связи
Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л.Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей .
Гибридизация Полинга для двух S- и двух p- электронов позволила объяснить направленность химических связей, в частности тетраэдрическую конфигурацию метана . Для объяснения структуры этилена из четырёх равноценных Sp 3 - электронов атома углерода приходится вычленять один p-электрон для образования дополнительной связи, получившей название π-связи. При этом три оставшиеся Sp 2 -гибридные орбитали располагаются в плоскости под углом 120° и образуют основные связи, например, плоскую молекулу этилена (рис.5).
В новой теории Полинга все связывающие электроны становились равноценными и равноудалёнными от линии, соединяющей ядра молекулы. Теория изогнутой химической связи Полинга учитывала статистическую интерпретацию волновой функции М.Борна , кулоновскую электронную корреляцию электронов . Появился физический смысл - природа химической связи полностью определяется электрическим взаимодействием ядер и электронов. Чем больше связывающих электронов, тем меньше межъядерное расстояние и прочнее химическая связь между атомами углерода.
Трёхцентровая химическая связь
Дальнейшее развитие представлений о химической связи дал американской физикохимик У.Липскомб , разработавший теорию двухэлектронных трёхцентровых связей и топологическую теорию, позволяющую предсказывать строение ещё некоторых гидридов бора (бороводородов) .
Электронная пара в трёхцентровой химической связи становится общей для трёх ядер атомов. В простейшем представителе трёхцентровой химической связи - молекулярном ионе водорода H 3 + электронная пара удерживает в едином целом три протона (рис.6).

Рис.7.Диборан
Существование боранов с их двухэлектронными трёхцентровыми связями с «мостиковыми» атомами водорода нарушало каноническое учение о валентности . Атом водорода, считавшийся ранее стандартным одновалентным элементом, оказался связанным одинаковыми связями с двумя атомами бора и стал формально двухвалентным элементом. Работы У.Липскомба по расшифровке строения боранов расширяли представления о химической связи. Нобелевский комитет удостоил Уильяма Нанна Липскомба премии по химии за 1976 год с формулировкой "За исследования структуры боранов (боргидритов), проясняющие проблемы химических связей).
Многоцентровая химическая связь
Рис.8.Молекула ферроцена
Рис.9.Дибензолхром
Рис.10.Ураноцен
Все десять связей (C-Fe) в молекуле ферроцена равноценны, величина межъядерного расстояния Fe-c - 2,04 Å. Все атомы углерода в молекуле ферроцена структурно и химически эквивалентны, длина каждой связи C-C 1,40 - 1,41 Å (для сравнения, в бензоле длина связи C-C 1,39 Å). Вокруг атома железа возникает 36- электронная оболочка .
Динамика химической связи
Химическая связь достаточно динамична. Так, металлическая связь трансформируется в ковалентную в процессе фазового перехода при испарении металла. Переход металла из твёрдого в парообразное состояние требует затраты больших количеств энергии.
В парах указанные металлы состоят практически из гомоядерных двухатомных молекул и свободных атомов. При конденсации паров металла ковалентная связь превращается в металлическую.
Испарение солей с типичной ионной связью, например фторидов щелочных металлов, приводит к разрушению ионной связи и образованию гетероядерных двухатомных молекул с полярной ковалентной связью. При этом имеет место образование димерных молекул с мостиковыми связями.
Характеристика химической связи в молекулах фторидов щелочных металлов и их димерах.
При конденсации паров фторидов щелочных металлов полярная ковалентная связь трансформируется в ионную с образованием соответствующей кристаллической решётки соли.
Механизм перехода ковалентной в металлическую связь
Рис.11. Соотношение между радиусом орбитали электронной пары r e и длиной ковалентной химической связи d
Рис.12.Ориентация диполей двухатомных молекул и образование искажённого октаэдрического фрагмента кластера при конденсации паров щелочных металлов
Рис.13.Объёмноцентрированное кубическое расположение ядер в кристаллах щелочных металлов и связывающего звена
Дисперсное притяжение (силы Лондона) обуславливает межатомное взаимодействие и образование гомоядерных двухатомных молекул из атомов щелочных металлов.
Образование ковалентной связи металл-металл сопряжено с деформацией электронных оболочек взаимодействующих атомов - валентные электроны создают связывающую электронную пару, электронная плотность которой концентрируется в пространстве между атомными ядрами возникшей молекулы. Характерной особенностью гомоядерных двухатомных молекул щелочных металлов является большая длина ковалентной связи (в 3,6-5,8 раза больше длины связи в молекуле водорода) и низкая энергия её разрыва.
Указанное соотношение между r e и d определяет неравномерность распределения электрических зарядов в молекуле - в средней части молекулы сосредоточен отрицательный электрический заряд связывающей электронной пары, а на концах молекулы - положительные электрические заряды двух атомных остовов.
Неравномерность распределения электрических зарядов создаёт условия взаимодействия молекул за счёт ориентационных сил (силы Ван-дер-Ваальса). Молекулы щелочных металлов стремятся ориентироваться таким образом, чтобы по сосоедству оказывались разноимённые электрические заряды. В результате между молекулами действуют силы притяжения. Благодаря наличию последних, молекулы щелочных металлов сближаются и более менее прочно стягиваются между собой. Одновременно происходит некоторая деформация каждой из них под действием ближе расположенных полюсов соседних молекул (рис.12).
Фактически, связывающие электроны исходной двухатомной молекулы, попадая в электрическое поле четырёх положительно заряженных атомных остовов молекул щелочных металлов отрываются с орбитального радиуса атома и становятся свободными.
При этом связывающая электронная пара становится общей уже для системы с шестью катионами. Начинается построение кристаллической решётки металла на этапе кластера . В кристаллической решётке щелочных металлов чётко выражена структура связывающего звена, имеющего форму искажённого сплющенного октаэдра - квадратной бипирамиды, высота которой и рёбра базиса равны величина постоянной трансляционной решётки a w (рис.13).
Величина постоянной трансляционной решётки a w кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми », которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла - проводить электрический ток .
При сопоставлении процесса конденсации паров щелочных металлов с процессом конденсации газов, например, водорода, проявляется характерная особенность в свойствах металла. Так, если при конденсации водорода проявляются слабые межмолекулярные взаимодействия, то при конденсации паров металла протекают процессы, характерные для химических реакций. Сама конденсация паров металла идёт в несколько стадий и может быть описана следующей процессией: свободный атом → двухатомная молекула с ковалентной связью → металлический кластер → компактный металл с металлической связью.
Взаимодействие молекул галогенидов щелочных металлов сопровождается их димеризацией. Димерную молекулу можно рассматривать как электрический квадруполь (рис.15). В настоящее время известны основные характеристики димеров галогенидов щелочных металлов (длины химической связи и валентные углы между связями).
Длина химической связи и валентные углы в димерах галогенидов щелочных металлов (Э 2 X 2)(газовая фаза).
| Э 2 X 2 | X=F | X=Cl | X=Br | X=I | ||||
|---|---|---|---|---|---|---|---|---|
| d ЭF , Å | d ЭCl , Å | d ЭBr , Å | d ЭI , Å | |||||
| Li 2 X 2 | 1,75 | 105 | 2,23 | 108 | 2,35 | 110 | 2,54 | 116 |
| Na 2 X 2 | 2,08 | 95 | 2,54 | 105 | 2,69 | 108 | 2,91 | 111 |
| K 2 X 2 | 2,35 | 88 | 2,86 | 98 | 3,02 | 101 | 3,26 | 104 |
| Cs 2 X 2 | 2,56 | 79 | 3,11 | 91 | 3,29 | 94 | 3,54 | 94 |
В процессе конденсации действие ориентационных сил усиливается, межмолекулярное взаимодействие сопровождается образованием кластеров, а затем и твёрдого вещества. Галогениды щелочных металлов образуют кристаллы с простой кубической и объёмно-центрированной кубической решёткой.
Тип кристаллической решётки и постоянная трансляционной решётки для галогенидов щелочных металлов.
В процессе кристаллизации происходит дальнейшее увеличение межатомного расстояния, приводящее к срыву электрона с орбитального радиуса атома щелочного металла и передаче электрона атому галогена с образованием соответствующих ионов. Силовые поля ионов равномерно распределяются во всех направлениях в пространстве. В связи с этим в кристаллах щелочных металлов силовое поле каждого иона координирует отнюдь не один ион с противоположным знаком, как принято качественно представлять ионную связь (Na + Cl -).
В кристаллах ионных соединений понятие простых двухионных молекул типа Na + Cl - и Cs + Cl - теряет смысл, поскольку ион щелочного металла связан с шестью ионами хлора (в кристалле хлористого натрия) и с восемью ионами хлора (в кристалле хлористого цезия. При этом все межионные расстояния в кристаллах равноудалены.
Примечания
- Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 124. - 320 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 132-136. - 320 с.
- Ганкин В.Ю., Ганкин Ю.В. Как образуется химическая связь и протекают химические реакции. - М .: издат.группа "Граница", 2007. - 320 с. - ISBN 978-5-94691296-9
- Некрасов Б. В. Курс общей химии. - М .: Госхимиздат, 1962. - С. 88. - 976 с.
- Паулинг Л. Природа химической связи / под редакцией Я.К.Сыркина. - пер. с англ. М.Е.Дяткиной. - М.-Л.: Госхимиздат, 1947. - 440 с.
- Теоретическая органическая химия / под ред. Р.Х.Фрейдлиной. - пер. с англ. Ю.Г.Бунделя. - М .: Изд. иностранной литературы, 1963. - 365 с.
- Леменовский Д.А., Левицкий М.М. Российский химический журнал (журнал Российского химического общества им. Д.И.Менделеева). - 2000. - Т. XLIV, вып.6. - С. 63-86.
- Химический энциклопедический словарь / гл. ред. И.Л.Кнунянц. - М .: Сов. энциклопедия, 1983. - С. 607. - 792 с.
- Некрасов Б. В. Курс общей химии. - М .: Госхимиздат, 1962. - С. 679. - 976 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 155-161. - 320 с.
- Гиллеспи Р. Геометрия молекул / пер. с англ. Е.З. Засорина и В.С. Мастрюкова, под ред. Ю.А Пентина. - М .: «Мир», 1975. - С. 49. - 278 с.
- Справочник химика. - 2-е изд., перераб. и доп. - Л.-М.: ГНТИ Химической литературы, 1962. - Т. 1. - С. 402-513. - 1072 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ.. - М .: «Химия», 1987. - С. 132-136. - 320 с.
- Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми). Успехи физических наук.. - 1962. - Т. 78, вып.2. - 291 с.
См. также
- Химическая связь - статья из Большой советской энциклопедии
- Химическая связь - Chemport.ru
- Химическая связь - Физическая Энциклопедия
Силы, связывающие атомы друг с другом, имеют единую электрическую природу. Но вследствие различия в механизме образования и проявления этих сил химические связи могут быть разного типа.
Различают три основных типа валентной химической связи : ковалентную, ионную и металлическую.
Кроме них, большое значениеи распространение имеют: водородная связь, которая может быть валентной и невалентной, и невалентная химическая связь - межмолекулярная (или Ван-дер-Ваальсова), образующая относительно небольшие ассоциаты молекул и огромные молекулярные ансамбли – супер- и супрамолекулярные наноструктуры.
Ковалентная химическая связь (атомная, гомеополярная) –
это химическая связь, осуществляемая общими для взаимодействующих атомов одной -тремя парами электронов .
Эта связь – двухэлектронная и двухцентровая (связывает 2 атомных ядра).
При этом ковалентная связь является наиболее распространенным и наиболее общим типом валентной химической связи в бинарных соединениях – между а) атомами неметаллов и б) атомами амфотерных металлов и неметаллов.
Примеры : Н-Н (в молекуле водорода Н 2); четыре связи S-О (в ионе SО 4 2-); три связи Аl-H (в молекуле АlH 3); Fe-S (в молекуле FeS) и др.
Особенности ковалентной связи – ее направленность и насыщаемость .
Направленность - важнейшее свойство ковалентной связи, от
которого зависит структура (конфигурация, геометрия) молекул и химических соединений. Пространственная направленность ковалентной связи определяет химическое и кристаллохимическое строение вещества. Ковалентная связь всегда направлена в сторону максимального перекрывания атомных орбиталей валентных электронов взаимодействующх атомов, с образованием общего электронного облака и наиболее прочной химической связи . Направленность выражают в виде углов между направлениями связи атомов в молекулах разных веществ и кристаллах твердых тел.
Насыщаемость – это свойство , отличающее ковалентную связь от всех других видов взаимодействия частиц, проявляющееся в возможности атомов образовывать ограниченное число ковалентных связей , поскольку каждая пара связующих электронов образуется лишь валентными электронами с противоположно ориентированными спинами, число которых в атоме ограничено валентностью, 1 – 8. При этом запрещается использование одной и той же атомной орбитали дважды для образования ковалентной связи (принцип Паули).
Валентность – это способность атома присоединять или замещать определенное число других атомов с образованием валентных химических связей.
По спиновой теории ковалентной связи валентность определяется числом неспаренных электронов у атома в основном или возбужденном состоянии .
Таким образом, у разных элементов способность к образованию определенного числа ковалентных связей ограничена получением максимального числа неспаренных электронов в возбужденном состоянии их атомов.
Возбужденное состояние атома – это состояние атома с полученной им извне дополнительной энергией, вызывающей распаривание антипараллельных электронов, занимавших одну атомную орбиталь, т.е. переход одного из этих электронов из спаренного состояния на свободную (вакантную) орбиталь того же или близкого энергетического уровня.
Например, схемы заполнения s -, р-АО и валентность (В) у атома кальция Са в основном и возбужденном состоянии следующие:
Следует отметить, что атомыс насыщенными валентными связями могут образовывать дополнительные ковалентные связи по донорно-акцепторному или иному механизму (как, например, в комплексных соединениях).
Ковалентная связь может быть полярной и неполярной .
Ковалентная связь неполярна , е сли обобществленные валентные электроны равномерно распределены между ядрами взаимодействующих атомов, область перекрывания атомных орбиталей (электронных облаков) притягивается обоими ядрами с одинаковой силой и поэтому максимум общей электронной плотности не смещен ни к одному из них.
Этот вид ковалентной связи осуществляется в случае соединения двух одинаковых атомов элемента. Ковалентную связь между одинаовыми атомами называют также атомной или гомеополярной .
Полярная связь возникает при взаимодействии двух атомов разных химических элементов, если один из атомов за счет большего значения электроотрицательности сильнее притягивает валентные электроны, и тогда общая электронная плотность более или менее смещается в сторону этого атома.
При полярной связи вероятность нахождения электрона у ядра одного из атомов выше, чем у другого.
Качественная характеристика полярной связи –
разность относительных электротрицательностей (|∆ОЭО |) связанных атомов : чем она больше, тем более полярна ковалентная связь.
Количественная характеристика полярной связи, т.е. мера полярности связи и сложной молекулы - электрический момент дипо-ля μ св , равный произведению эффективного заряда δ на длину диполя l д : μ св = δ ∙ l д . Единица измерения μ св – Дебай. 1Дебай = 3,3.10 -30 Кл/м.
Электрический диполь – это электрически нейтральная система двух равных и противоположных по знаку электрических зарядов +δ и –δ .
Дипольный момент (электрический момент диполя μ св ) – векторная величина . Принято считать, что направление вектора от (+) к (–) совпадает с направлением смещения области общей электронной плотности (суммарного электронного облака) поляризованных атомов .
Общий дипольный момент сложной многоатомной молекулы зависит от числа и пространственной направленности полярных связей в ней. Таким образом, определение дипольных моментов позволяет судить не только о характере связей в молекулах, но и об их расположении в пространстве, т.е. о пространственной конфигурации молекулы.
С увеличением разности электроотрицательностей |∆ОЭО| атомов, образующих связь, электрический момент диполя возрастает.
Следует заметить, что определение дипольного момента связи – сложная и не всегда решаемая задача (взаимодействие связей, неизвестность направления μ св и т.д.).
Квантово-механические методы описания ковалентной связи – объясняютмеханизм образования ковалентной связи.
Проведенный В.Гейтлером и Ф.Лондоном, нем. учеными (1927гг.), расчет энергетического баланса образования ковалентной связи в молекуле водорода Н 2 позволил сделать вывод : природа ковалентной связи, как и любого другого типа химической связи, заключается в электрическом взаимодействии, происходящем в условиях квантово-механической микросистемы.
Для описания механизма образования ковалентной химической связи используют два приближенных квантово-механических метода :
валентных связей и молекулярных орбиталей – не исключающих, но взаимно дополняющих друг друга.
2.1. Метод валентных связей (МВС или локализованных электронных пар ), предложенный В. Гейтлером и Ф. Лондоном в 1927г., основывается на следующих положениях :
1) химическая связь между двумя атомами возникает в результате частичного перекрывания атомных орбиталей с образованием общей электронной плотности совместной пары электронов с противоположными спинами, - более высокой, чем в других областях пространства вокруг каждого ядра;
2) ковалентная связь образуется лишь при взаимодействии электронов с антипараллельными спинами , т.е. с противоположными по знаку спиновыми квантовыми числами m S = + 1/2 ;
3) характеристики ковалентной связи (энергия, длина, полярность и др.) определяются видом связи (σ –, π –, δ –), степенью перекрывания АО (чем она больше, тем прочнее химическая связь, т.е. выше энергия связи и меньше длина), электроотрицательностью взаимодействующих атомов;
4) ковалентная связь по МВС может образоваться двумя способами (двумя механизмами) , принципиально разными, но имеющими одинаковый результат – обобществление пары валентных электронов обоими взаимодействующими атомами: а) обменным, за счет перекрывания одноэлектронных атомных орбиталей с противоположными спинами электронов, когда каждый атом дает для перекрывания по одному электрону на связь – при этом связь может быть как полярной, так и неполярной , б) донорно-акцепторным, за счет двухэлектронной АО одного атома и свободной (вакантной) орбитали другого, по которомуодин атом (донор) предоставляет для связи пару электронов, находящихся на орбитали в спаренном состоянии, а другой атом (акцептор) – свободную орбиталь. При этом возникает полярная связь .
2.2. Комплексные (координационные) соединения , многие молекулярные ионы, являющиеся комплексными, (аммония, тетрагидрида бора, др.) образуются при наличии донорно-акцепторной связи – иначе, координационной связи.
Например, в реакции образования иона аммония NH 3 + H + = NH 4 + молекула аммиака NH 3 - донор пары электронов, а протон Н + - акцептор.
В реакции ВН 3 + Н – = ВН 4 – роль донора электронной пары играет гидрид-ион Н – , а акцептора – молекула гидрида бора ВН 3 , в которой имеется вакантная АО.
Кратность химической связи. Связи σ -, π – , δ –.
Максимальное перекрывание АО разного типа (с установлением наиболее прочных химических связей) достигается при их определенной направленности в пространстве, вследствие разной формы их энергетической поверхности.
Тип АО и направление их перекрывания определяют σ -, π – , δ – связи:
σ (сигма) – связь – это всегда о динарная (простая) связь ,возникающая при частичном перекрыванииодной пары s -, p x -, d - АО вдоль оси , соединяющей ядра взаимодействующих атомов.
Одинарные связи всегда являются σ – связями.
Кратные связи – π (пи) – (также δ (дельта )–связи), двойные или тройные ковалентные связи, осуществляемые соответственно двумя или тремя парами электронов при перекрывании их атомных орбиталей.
π (пи) – связь осуществляется при перекрывании р y -, p z - и d - АО по обе стороны оси, соединяющей ядра атомов, во взаимно перпендикулярных плоскостях ;
δ (дельта )– связь возникает при перекрывании двух d-орбиталей , расположенных в параллельных плоскостях .
Самой прочной из σ -, π – , δ – связей является σ– связь , но π – связи, налагаясь на σ – связь, образуют еще более прочные кратные связи: двойные и тройные.
Любая двойная связь состоит из одной σ – и одной π – связей, тройная – из одной σ – и двух π – связей.
Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
Характеристика ионной связи
 Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы , а наибольшими - типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет .
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na 0 - 1 е = Na + (катион)
Cl 0 + 1 е = Cl — (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba 0 - 2 е = Ba 2+
S 0 + 2 е = S 2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S 2- и катионы бария Ba 2+ .
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg - 2е <-> Mg 2+
Cs - e <-> Cs +
Ca - 2e <-> Ca 2+
Fe - 3e <-> Fe 3+
Ковалентная: полярная и неполярная
 Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого — свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
- простые или одинарные;
- двойные;
- тройные.
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные — трёх.
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
- неполярную;
- полярную.
Неполярную связь образуют одинаковые атомы, а полярную - разные по электроотрицательности.
 Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном — отрицательный заряд, а на менее — положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:
- Длина определяется расстоянием между ядрами взаимодействующих атомов.
- Полярность определяется смещением электронного облака к одному из атомов.
- Направленность - свойство образовывать ориентированные в пространстве связи и, соответственно, молекулы, имеющие определённые геометрические формы.
- Насыщаемость определяется способностью образовывать ограниченное число связей.
- Поляризуемость определяется способностью изменять полярность под действием внешнего электрического поля.
- Энергия необходимая для разрушения связи, определяющая её прочность.
 Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (H2S), соляной кислоты (HCL), воды (H2O), метана (CH4) , оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами — ионную, простые вещества неметаллы — ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.
170762 0
Каждый атом обладает некоторым числом электронов.
Вступая в химические реакции, атомы отдают, приобретают, либо обобществляют электроны, достигая наиболее устойчивой электронной конфигурации. Наиболее устойчивой оказывается конфигурация с наиболее низкой энергией (как в атомах благородных газов). Эта закономерность называется "правилом октета" (рис. 1).
Рис. 1.
Это правило применимо ко всем типам связей . Электронные связи между атомами позволяют им формировать устойчивые структуры, от простейших кристаллов до сложных биомолекул, образующих, в конечном счете, живые системы. Они отличаются от кристаллов непрерывным обменом веществ. При этом многие химические реакции протекают по механизмам электронного переноса , которые играют важнейшую роль в энергетических процессах в организме.
Химическая связь - это сила, удерживающая вместе два или несколько атомов, ионов, молекул или любую их комбинацию .
Природа химической связи универсальна: это электростатическая сила притяжения между отрицательно заряженными электронами и положительно заряженными ядрами, определяемая конфигурацией электронов внешней оболочки атомов. Способность атома образовывать химические связи называется валентностью , или степенью окисления . С валентностью связано понятие о валентных электронах - электронах, образующих химические связи, то есть находящихся на наиболее высокоэнергетических орбиталях. Соответственно, внешнюю оболочку атома, содержащую эти орбитали, называют валентной оболочкой . В настоящее время недостаточно указать наличие химической связи, а необходимо уточнить ее тип: ионная, ковалентная, диполь-дипольная, металлическая.
Первый тип связи - ионная связь
В соответствии с электронной теорией валентности Льюиса и Косселя, атомы могут достичь устойчивой электронной конфигурации двумя способами: во-первых, теряя электроны, превращаясь в катионы , во-вторых, приобретая их, превращаясь в анионы . В результате электронного переноса благодаря электростатической силе притяжения между ионами с зарядами противоположного знака образуется химическая связь, названная Косселем «электровалентной » (теперь ее называют ионной ).
В этом случае анионы и катионы образуют устойчивую электронную конфигурацию с заполненной внешней электронной оболочкой. Типичные ионные связи образуются из катионов Т и II групп периодической системы и анионов неметаллических элементов VI и VII групп (16 и 17 подгрупп - соответственно, халькогенов и галогенов ). Связи у ионных соединений ненасыщенные и ненаправленные, поэтому возможность электростатического взаимодействия с другими ионами у них сохраняется. На рис. 2 и 3 показаны примеры ионных связей, соответствующих модели электронного переноса Косселя.
Рис. 2.
Рис. 3. Ионная связь в молекуле поваренной соли (NaCl)
Здесь уместно напомнить о некоторых свойствах, объясняющих поведение веществ в природе, в частности, рассмотреть представление о кислотах и основаниях .
Водные растворы всех этих веществ являются электролитами. Они по-разному изменяют окраску индикаторов . Механизм действия индикаторов был открыт Ф.В. Оствальдом. Он показал, что индикаторы представляют собой слабые кислоты или основания, окраска которых в недиссоциированном и диссоциированном состояниях различается.
Основания способны нейтрализовать кислоты. Не все основания растворимы в воде (например, нерастворимы некоторые органические соединения, не содержащие ‑ ОН-групп, в частности, триэтиламин N(С 2 Н 5) 3) ; растворимые основания называют щелочами .
Водные растворы кислот вступают в характерные реакции:
а) с оксидами металлов - с образованием соли и воды;
б) с металлами - с образованием соли и водорода;
в) с карбонатами - с образованием соли, СO 2 и Н 2 O .
Свойства кислот и оснований описывают несколько теорий. В соответствие с теорией С.А. Аррениуса, кислота представляет собой вещество, диссоциирующее с образованием ионов Н + , тогда как основание образует ионы ОН ‑ . Эта теория не учитывает существования органических оснований, не имеющих гидроксильных групп.
В соответствие с протонной теорией Бренстеда и Лоури, кислота представляет собой вещество, содержащее молекулы или ионы, отдающие протоны (доноры протонов), а основание - вещество, состоящее из молекул или ионов, принимающие протоны (акцепторы протонов). Отметим, что в водных растворах ионы водорода существуют в гидратированной форме, то есть в виде ионов гидроксония H 3 O + . Эта теория описывает реакции не только с водой и гидроксидными ионами, но и осуществляющиеся в отсутствие растворителя или с неводным растворителем.
Например, в реакции между аммиаком NH 3 (слабым основанием) и хлороводородом в газовой фазе образуется твердый хлорид аммония, причем в равновесной смеси двух веществ всегда присутствуют 4 частицы, две из которых - кислоты, а две другие - основания:
Эта равновесная смесь состоит из двух сопряженных пар кислот и оснований:
1) NH 4 + и NH 3
2) HCl и Сl ‑
Здесь в каждой сопряженной паре кислота и основание различаются на один протон. Каждая кислота имеет сопряженное с ней основание. Сильной кислоте соответствует слабое сопряженное основание, а слабой кислоте - сильное сопряженное основание.
Теория Бренстеда-Лоури позволяет объяснить уникальность роли воды для жизнедеятельности биосферы. Вода, в зависимости от взаимодействующего с ней вещества, может проявлять свойства или кислоты, или основания. Например, в реакциях с водными растворами уксусной кислоты вода является основанием, а с водными растворами аммиака - кислотой.
1) СН 3 СООН + Н 2 O ↔ Н 3 O + + СН 3 СОО ‑ . Здесь молекула уксусной кислоты донирует протон молекуле воды;
2) NH 3 + Н 2 O ↔ NH 4 + + ОН ‑ . Здесь молекула аммиака акцептирует протон от молекулы воды.
Таким образом, вода может образовывать две сопряженные пары:
1) Н 2 O (кислота) и ОН ‑ (сопряженное основание)
2) Н 3 О + (кислота) и Н 2 O (сопряженное основание).
В первом случае вода донирует протон, а во втором - акцептирует его.
Такое свойство называется амфипротонностью . Вещества, способные вступать в реакции в качестве и кислот, и оснований, называются амфотерными . В живой природе такие вещества встречаются часто. Например, аминокислоты способны образовывать соли и с кислотами, и с основаниями. Поэтому пептиды легко образуют координационные соединения с присутствующими ионами металлов.
Таким образом, характерное свойство ионной связи - полное перемещение нары связывающих электронов к одному из ядер. Это означает, что между ионами существует область, где электронная плотность почти нулевая.
Второй тип связи - ковалентная связь
Атомы могут образовывать устойчивые электронные конфигурации путем обобществления электронов.
Такая связь образуется, когда пара электронов обобществляется по одному от каждого атома. В таком случае обобществленные электроны связи распределены между атомами поровну. Примерами ковалентной связи можно назвать гомоядерные двухатомные молекулы Н 2 , N 2 , F 2 . Этот же тип связи имеется у аллотропов O 2 и озона O 3 и у многоатомной молекулы S 8 , а также у гетероядерных молекул хлороводорода НСl , углекислого газа СO 2 , метана СH 4 , этанола С 2 Н 5 ОН , гексафторида серы SF 6 , ацетилена С 2 Н 2 . У всех этих молекул электроны одинаково общие, а их связи насыщенные и направлены одинаково (рис. 4).
Для биологов важно, что у двойной и тройной связей ковалентные радиусы атомов по сравнению с одинарной связью уменьшены.
Рис. 4. Ковалентная связь в молекуле Сl 2 .
Ионный и ковалентный типы связей - это два предельных случая множества существующих типов химических связей, причем на практике большинство связей промежуточные.
Соединения двух элементов, расположенных в противоположных концах одного или разных периодов системы Менделеева, преимущественно образуют ионные связи. По мере сближения элементов в пределах периода ионный характер их соединений уменьшается, а ковалентный - увеличивается. Например, галогениды и оксиды элементов левой части периодической таблицы образуют преимущественно ионные связи (NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH ), а такие же соединения элементов правой части таблицы - ковалентные (Н 2 O, СO 2 , NH 3 , NO 2 , СН 4 , фенол C 6 H 5 OH , глюкоза С 6 H 12 О 6 , этанол С 2 Н 5 ОН ).
Ковалентная связь, в свою очередь, имеет еще одну модификацию.
У многоатомных ионов и в сложных биологических молекулах оба электрона могут происходить только из одного атома. Он называется донором электронной пары. Атом, обобществляющий с донором эту пару электронов, называется акцептором электронной пары. Такая разновидность ковалентной связи названа координационной (донорно-акцепторной , или дативной ) связью (рис. 5). Этот тип связи наиболее важен для биологии и медицины, поскольку химия наиболее важных для метаболизма d-элементов в значительной степени описывается координационными связями.
Pиc. 5.
Как правило, в комплексном соединении атом металла выступает акцептором электронной пары; наоборот, при ионных и ковалентных связях атом металла является донором электрона.
Суть ковалентной связи и ее разновидности - координационной связи - можно прояснить с помощью еще одной теории кислот и оснований, предложенной ГН. Льюисом. Он несколько расширил смысловое понятие терминов «кислота» и «основание» по теории Бренстеда-Лоури. Теория Льюиса объясняет природу образования комплексных ионов и участие веществ в реакциях нуклеофильного замещения, то есть в образовании КС.
Согласно Льюису, кислота - это вещество, способное образовывать ковалентную связь путем акцептирования электронной пары от основания. Льюисовым основанием названо вещество, обладающее неподеленной электронной парой, которое, донируя электроны, образует ковалентную связь с Льюисовой кислотой.
То есть теория Льюиса расширяет круг кислотно-основных реакций также на реакции, в которых протоны не участвуют вовсе. Причем сам протон, по этой теории, также является кислотой, поскольку способен акцептировать электронную пару.
Следовательно, согласно этой теории, катионы являются Льюисовыми кислотами, а анионы - Льюисовыми основаниями. Примером могут служить следующие реакции:
Выше отмечено, что подразделение веществ на ионные и ковалентные относительное, поскольку полного перехода электрона от атомов металла к акцепторным атомам в ковалентных молекулах не происходит. В соединениях с ионной связью каждый ион находится в электрическом поле ионов противоположного знака, поэтому они взаимно поляризуются, а их оболочки деформируются.
Поляризуемость определяется электронной структурой, зарядом и размерами иона; у анионов она выше, чем у катионов. Наибольшая поляризуемость среди катионов - у катионов большего заряда и меньшего размера, например, у Hg 2+ , Cd 2+ , Pb 2+ , Аl 3+ , Тl 3+ . Сильным поляризующим действием обладает Н + . Поскольку влияние поляризации ионов двустороннее, она значительно изменяет свойства образуемых ими соединений.
Третий тип связи - диполь-дипольная связь
Кроме перечисленных типов связи, различают еще диполь-дипольные межмолекулярные взаимодействия, называемые также вандерваалъсовыми .
Сила этих взаимодействий зависит от природы молекул.
Выделяют взаимодействия трех типов: постоянный диполь - постоянный диполь (диполь-дипольное притяжение); постоянный диполь - индуцированный диполь (индукционное притяжение); мгновенный диполь - индуцированный диполь (дисперсионное притяжение, или лондоновские силы; рис. 6).
Рис. 6.
Диполь-дипольным моментом обладают только молекулы с полярными ковалентными связями (HCl, NH 3 , SO 2 , Н 2 O, C 6 H 5 Cl ), причем сила связи составляет 1-2 дебая (1Д = 3,338 × 10 ‑30 кулон-метра - Кл × м).
В биохимии выделяют еще один тип связи - водородную связь, являющуюся предельным случаем диполь-дипольного притяжения. Эта связь образована притяжением между атомом водорода и электроотрицательным атомом небольшого размера, чаще всего - кислородом, фтором и азотом. С крупными атомами, обладающими аналогичной электроотрицательностью (например, с хлором и серой), водородная связь оказывается значительно более слабой. Атом водорода отличается одной существенной особенностью: при оттягивании связывающих электронов его ядро - протон - оголяется и перестает экранироваться электронами.
Поэтому атом превращается в крупный диполь.
Водородная связь, в отличие от вандерваальсовой, образуется не только при межмолекулярных взаимодействиях, но и внутри одной молекулы - внутримолекулярная водородная связь. Водородные связи играют в биохимии важную роль, например, для стабилизации структуры белков в виде а-спирали, или для образования двойной спирали ДНК (рис. 7).
Рис.7.
Водородная и вандерваальсовая связи значительно слабее, чем ионная, ковалентная и координационная. Энергия межмолекулярных связей указана в табл. 1.
Таблица 1. Энергия межмолекулярных сил
Примечание : Степень межмолекулярных взаимодействий отражают показатели энтальпии плавления и испарения (кипения). Ионным соединениям требуется для разделения ионов значительно больше энергии, чем для разделения молекул. Энтальпии плавления ионных соединений значительно выше, чем молекулярных соединений.
Четвертый тип связи - металлическая связь
Наконец, имеется еще один тип межмолекулярных связей - металлический : связь положительных ионов решетки металлов со свободными электронами. В биологических объектах этот тип связи не встречается.
Из краткого обзора типов связей выясняется одна деталь: важным параметром атома или иона металла - донора электронов, а также атома - акцептоpa электронов является его размер .
Не вдаваясь в детали, отметим, что ковалентные радиусы атомов, ионные радиусы металлов и вандерваальсовы радиусы взаимодействующих молекул увеличиваются по мере возрастания их порядкового номера в группах периодической системы. При этом значения радиусов ионов - наименьшие, а вандерваальсовых радиусов - наибольшие. Как правило, при движении вниз по группе радиусы всех элементов увеличиваются, причем как ковалентные, так и вандерваальсовы.
Наибольшее значение для биологов и медиков имеют координационные
(донорно-акцепторные
) связи, рассматриваемые координационной химией.
Медицинская бионеорганика. Г.К. Барашков
В рассмотренных примерах образования химической связи принимала участие электронная пара. Такая связь называется одинарной. Иногда ее называют ординарной, т.е. обычной. Этот тип связи принято обозначать одной черточкой, соединяющей символы взаимодействующих атомов.
Перекрывание электронных облаков по прямой линии, соединяющей два ядра, приводит к сигма-связи (о-связь). Одинарная связь в большинстве случаев является а-связью.
Связь, образованная перекрыванием боковых областей р-элект- ронных облаков, называется пи-связыо (я-связь). Двойная и тройная связи образуются при участии соответственно двух и трех электронных пар. Двойная связь представляет собой одну а-связь и одну я-связь, тройная связь - одну a-связь и две я-связи.
Обсудим образование связей в молекулах этана С 2 Н 6 , этилена С 2 Н 4 , ацетилена С 2 Н 2 и бензола С 6 Н б.
Углы между связями в молекуле этана С. ; Н (. почти точно равны между собой (рис. 1.18, а) и не отличаются от углов между связями С-Н в молекуле метана. Поэтому можно предположить, что наружные электронные оболочки атомов углерода находятся в состоянии $р 3 -гибридизации. Молекула С 2 Н 6 диамагнитна и не имеет электрического момента диполя. Энергия связи С-С равна -335 кДж/моль. Все связи в молекуле С 9 Н 6 - а-связи.
В молекуле этилена С 2 Н 4 углы между связями равны примерно по 120°. Из этого можно сделать вывод о $р 2 -гибридизации наружных электронных орбиталей атома углерода (рис. 1.18, б). Связи С-Н лежат в одной плоскости под углами около 120°. У каждого атома углерода имеется по одной негибридной р-орбитали, содер-
Рис. 1.18. Модели молекул этана (а ), этилена (б) и ацетилена (в)
жащей по одному электрону. Эти орбитали расположены перпендикулярно плоскости рисунка.
Энергия связи между атомами углерода в молекуле этилена С 2 Н 4 равна -592 кДж/моль. Если бы атомы углерода были связаны такой же связью, как в молекуле этана, то энергии связи в этих молекулах были бы близки.
Однако энергия связи между атомами углерода в этане составляет 335 кДж/моль, что почти в два раза меньше, чем в этилене. Столь существенная разница в энергиях связи между атомами углерода в молекулах этилена и этана объясняется возможным взаимодействием негибридных р-орбиталей, что на рис. 1.18, б изображено волнистыми линиями. Связь, образованная таким способом, и называется я-связью.
В молекуле этилена С 2 Н 4 четыре связи С-Н, как и в молекуле метана СН 4 , являются a-связями, а связь между атомами углерода представляет собой a-связь и л-связь, т.е. двойную связь, и формула этилена записывается как Н 2 С=СН 2 .
Молекула ацетилена С 2 Н 2 линейная (рис. 1.18, в ), что говорит в пользу sp-гибридизации. Энергия связи между атомами углерода равна -811 кДж/моль, что позволяет предположить существование одной a-связи и двух л-связей, т.е. это тройная связь. Формула ацетилена записывается как НС=СН.
Один из сложных вопросов химии состоит в установлении природы связей между атомами углерода в так называемых ароматических соединениях , в частности в молекуле бензола С 6 Н (.. Молекула бензола плоская, углы между связями атомов углерода равны по

Рис. 1.19.
а - формульная модель: 6 - ^-орбитали атомов углерода и a-связи между атомами углерода и атомами углерода и водорода; в - p-обитали и л-связи между
атомами углерода

120°, что позволяет предположить.^-гибридизацию внешних орбиталей атомов углерода. Обычно молекулу бензола изображают, как это показано на рис. 1.19, а.
Казалось бы, в бензоле связь между атомами углерода должна быть длиннее двойной связи С=С как более прочной. Однако изучение структуры молекулы бензола показывает, что все расстояния между атомами углерода в бензольном кольце одинаковы.
Эта особенность молекулы лучше всего объясняется тем, что негибридные р-орбитали всех атомов углерода перекрываются «боковыми» частями (рис. 1.19, б), поэтому все межъядерные расстояния между атомами углерода равны. На рис. 1.19, в показаны а-связи между атомами углерода, образованные перекрыванием sp 2 - гибридных орбиталей.
Энергия связи между атомами углерода в молекуле бензола С 6 Н 6 равна -505 кДж/моль, и это позволяет предположить, что эти связи являются промежуточными между одинарной и двойной связями. Заметим, что электроны р-орбиталей в молекуле бензола двигаются по замкнутому шестиугольнику, и они делокализованы (не относятся к некоторому определенному месту).