Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода вих молекулах.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
|
Название |
Формула |
t°.пл., |
t°.кип., |
|
Бензол |
C 6 H 6 |
5,5 |
80,1 |
|
Толуол (метилбензол) |
С 6 Н 5 СH 3 |
95,0 |
110,6 |
|
Этилбензол |
С 6 Н 5 С 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензол) |
С 6 Н 4 (СH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пара- |
13,26 |
138,35 |
|
|
Пропилбензол |
С 6 Н 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (изопропилбензол) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Стирол (винилбензол) |
С 6 Н 5 CH=СН 2 |
30,6 |
145,2 |
Бензол – легкокипящая ( t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
бензоат натрия
2. Реакция Вюрца-Фиттинга : (здесь Г – галоген)
С 6 H 5 -Г + 2 Na + R -Г → C 6 H 5 - R + 2 Na Г
С 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C 6 H 14 t , kat →C 6 H 6 + 4H 2
2. Тримеризация ацетилена (только для бензола) – р. Зелинского :
3С 2 H 2 600° C , акт. уголь →C 6 H 6
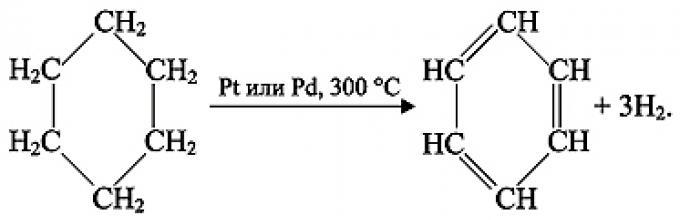
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C 6 H 12 t, kat →C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat →C 6 H 5 -CH 3 + 3H 2
метилциклогексантолуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса .
C 6 H 6 + C 2 H 5 -Cl t, AlCl3 →C 6 H 5 -C 2 H 5 + HCl
хлорэтан этилбензол

Химические свойства аренов
I . РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C 6 H 6 + 15O 2 t →12CO 2 + 6H 2 O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Упрощённо:
C 6 H 5 -CH 3 + 3O KMnO4 →C 6 H 5 COOH + H 2 O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO К + K ОН + 2MnO 2 + H 2 O
II . РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C 6 H 6 +3Cl 2 h ν → C 6 H 6 Cl 6 (гексахлорциклогексан - гексахлоран)
2. Гидрирование
C 6 H 6 + 3H 2 t , Pt или Ni →C 6 H 12 (циклогексан)
3. Полимеризация
III . РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм(легче, чем у алканов)
1. Галогенирование -
a ) бензола
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (хлорбензол)
C 6 H 6 + 6Cl 2 t ,AlCl3 →C 6 Cl 6 + 6HCl ( гексахлорбензол )
C 6 H 6 + Br 2 t,FeCl3 → C 6 H 5 -Br + HBr ( бромбензол )
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
в) гомологов бензола в присутствии катализатора
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (смесь орта, пара производных) +HCl
2. Нитрование (с азотной кислотой)
C 6 H 6 + HO-NO 2 t, H2SO4 →C 6 H 5 -NO 2 + H 2 O
нитробензол - запах миндаля !
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4 → С H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C 6 H 6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C 6 H 5 NO 2 (растворитель, из него получают анилин), хлорбензола C 6 H 5 Cl, фенола C 6 H 5 OH, стирола и т.д.
Толуол C 6 H 5 –CH 3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C 6 H 4 (CH 3) 2 . Технический ксилол – смесь трех изомеров (орто -, мета - и пара -ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C 6 H 5 –CH(CH 3) 2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С 6 Сl 6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С 6 Н 6 Сl 6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C 6 H 5 – CH = CH 2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности , что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O
3) CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 10KOH → CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 8K 2 MnO 4
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH → CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:


Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH 3 C≡CH + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O

Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +2Н 2 О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO 4 +12H 2 SO 4 → 5HOOC –COOH +8MnSO 4 +4К 2 SO 4 +12Н 2 О
CH≡CH + 2KMnO 4 +3H 2 SO 4 → 2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C 6 H 5 CH 3 +2KMnO 4 → C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4KMnO 4 → C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С 6 Н 5 СН 3 +6КMnO 4 +9 H 2 SO 4 → 5С 6 Н 5 СООН+6MnSO 4 +3K 2 SO 4 + 14H 2 O
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O


Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C 2 H 5 OH + 4KMnO 4 + 6H 2 SO 4 → 5CH 3 COOH + 4MnSO 4 + 2K 2 SO 4 + 11H 2 O
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.

Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислой среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 +12H 2 SO 4 → 5HOOC –COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О
3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +8Н 2 О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , OH, Cu(OH) 2 . Все реакции идут при нагревании:
3CH 3 CHO + 2KMnO 4 → CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2KMnO 4 + 3KOH → CH 3 COOK + 2K 2 MnO 4 + 2H 2 O
5CH 3 CHO + 2KMnO 4 + 3H 2 SO 4 → 5CH 3 COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH 3 CH=O + 2OH → CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
CH 3 –CH=O + 2Cu(OH) 2 → CH 3 COOH + Cu 2 O + 2H 2 O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO 4 (изб ) + 6H 2 SO 4 → 4MnSO 4 + 2K 2 SO 4 + 5CO 2 + 11H 2 O
3СН 2 О + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CO 2 +2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
HCHO + 4OH → (NH 4) 2 CO 3 + 4Ag↓ + 2H 2 O + 6NH 3
HCOH + 4Cu(OH) 2 → CO 2 + 2Cu 2 O↓+ 5H 2 O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:

Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl 2 =CO 2 + Hg + 2HCl
HCOOH+ Cl 2 = CO 2 +2HCl
HOOC-COOH+ Cl 2 =2CO 2 +2HCl
Муравьиная кислота , кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO + H2O
Каталитическое окисление алканов:

Каталитическое окисление алкенов:

Окисление фенолов:


18. Окислительно-восстановительные реакции (продолжение 2)
18.9. ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (нагревание)
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (нагревание)
3) CH 3 CH=CHCH 2 CH 3 + 6KMnO 4 + 10KOH CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 6K 2 MnO 4 (нагревание)
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4 (нагревание)
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH 3 C CH + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O (нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R 1 –CO–CO–R 2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C 2 H 2 + 8KMnO 4 = 3K 2 C 2 O 4 +2H 2 O + 8MnO 2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C 6 H 5 CH 3 +2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O (при кипячении)
C 6 H 5 CH 2 CH 3 + 4KMnO 4 = C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O (нагревание)
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислотной среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH 2 –COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , OH. Все реакции идут при нагревании:
3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK +
2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4
= 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2OH = CH 3 COONH 4
+ 2Ag + H 2 O + 3NH 3
Формальдегид с избытком окислителя окисляется до углекислого газа.
18.10. Сравнение окислительно-восстановительной активности различных веществ
Из определений понятий " атом-окислитель" и " атом-восстановитель" следует, что только окислительными свойствами обладают атомы в высшей степени окисления. Наоборот, только восстановительными свойствами обладают атомы в низшей степени окисления. Атомы, находящиеся в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Вместе с тем, основываясь только на степени окисления, невозможно однозначно оценить окислительно-восстановительные свойства веществ. В качестве примера рассмотрим соединения элементов VA группы. Соединения азота(V) и сурьмы(V) являются более или менее сильными окислителями, соединения висмута(V) – очень сильные окислители, а соединения фосфора(V) окислительными свойствами практически не обладают. В этом и других подобных случаях имеет значение, насколько данная степень окисления характерна для данного элемента, то есть, насколько устойчивы соединения, содержащие атомы данного элемента в этой степени окисления.
Любая ОВР протекает в направлении образования более слабого окислителя и более слабого восстановителя. В общем случае возможность протекания какой-либо ОВР, как и любой другой реакции, может быть определена по знаку изменения энергии Гиббса. Кроме того, для количественной оценки окислительно-восстановительной активности веществ используют электрохимические характеристики окислителей и восстановителей (стандартные потенциалы окислительно-восстановительных пар). Основываясь на этих количественных характеристиках, можно построить ряды окислительно-восстановительной активности различных веществ. Известный вам ряд напряжений металлов построен именно таким образом. Этот ряд дает возможность сравнивать восстановительные свойства металлов в водных растворах, находящихся в стандартных условиях (с = 1 моль/л, Т = 298,15 К), а также окислительные свойства простых аквакатионов. Если в верхней строке этого ряда поместить ионы (окислители), а в нижней – атомы металлов (восстановители), то левая часть этого ряда (до водорода) будет выглядеть так:
В этом ряду окислительные свойства ионов (верхняя строка) усиливаются слева направо, а восстановительные свойства металлов (нижняя строка), наоборот, справа налево.
Учитывая различия в окислительно-восстановительной активности в разных средах, можно построить аналогичные ряды и для окислителей. Так, для реакций в кислотной среде (pH = 0) получается " продолжение" ряда активности металлов в направлении усиления окислительных свойств
Как и в ряду активности металлов, в этом ряду окислительные свойства окислителей (верхняя строка) усиливаются слева направо. Но, используя этот ряд, сравнивать восстановительную активность восстановителей (нижняя строка) можно только в том случае, когда их окисленная форма совпадает с приведенной в верхней строке; в этом случае она усиливается справа налево.
Рассмотрим несколько примеров. Чтобы узнать, возможна ли данная ОВР будем использовать общее правило, определяющее направление протекания окислительно-восстановительных реакций (реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя).
1. Можно ли магнием восстановить кобальт из
раствора CoSO 4 ?
Магний более сильный восстановитель, чем
кобальт, и ионы Co 2
более сильные окислители, чем ионы Mg 2 , следовательно, можно.
2. Можно ли раствором FeCl 3 окислить медь до CuCl 2
в кислотной среде?
Так как ионы Fe 3B более сильные окислители,
чем ионы Cu 2 , а медь
более сильный восстановитель, чем ионы Fe 2 , то можно.
3. Можно ли, продувая кислород через подкисленный
соляной кислотой раствор FeCl 2 , получить
раствор FeCl 3 ?
Казалось бы нет, так как в нашем ряду кислород
стоит левее ионов Fe 3
и является более слабым окислителем, чем эти
ионы. Но в водном растворе кислород практически
никогда не восстанавливается до H 2 O 2 , в
этом случае он восстанавливается до H 2 O и
занимает место между Br 2 и MnO 2 .
Следовательно такая реакция возможна, правда,
протекает она довольно медленно (почему?).
4. Можно ли в кислотной среде перманганатом калия
окислить H 2 O 2 ?
В этом случае H 2 O 2 восстановитель и
восстановитель более сильный, чем ионы Mn 2B ,
а ионы MnO 4
окислители более сильные, чем образующийся из
пероксида кислород. Следовательно, можно.
Аналогичный ряд, построенный для ОВР в щелочной среде, выглядит следующим образом:
В отличие от " кислотного" ряда, этот ряд нельзя использовать совместно с рядом активности металлов.
Метод электронно-ионного баланса (метод полуреакций), межмолекулярные ОВР, внутримолекулярные ОВР, ОВР дисмутации (диспропорционирования, самоокисления-самовосстановления), ОВР конмутации, пассивация.
- Используя метод электронно-ионого баланса, составьте уравнения реакций, протекающих при добавлении к подкисленному серной кислотой раствору перманганата калия раствора а) H 2 S {S, точнее, S 8 }; б) KHS; в) K 2 S; г) H 2 SO 3 ; д) KHSO 3 ; е) K 2 SO 3 ; ё) HNO 2 ; ж) KNO 2 ; и) KI {I 2 }; к) FeSO 4 ; л) C 2 H 5 OH {CH 3 COOH}; м) CH 3 CHO; н) (COOH) 2 {CO 2 }; п) K 2 C 2 O 4 . Здесь и далее в необходимых случаях в фигурных скобках указаны продукты окисления.
- Составьте уравнения реакций, протекающих при пропускании следующих газов через подкисленный серной кислотой раствор перманганата калия: а) C 2 H 2 {CO 2 }; б) C 2 H 4 {CO 2 }; в) C 3 H 4 (пропин) {CO 2 и CH 3 COOH}; г) C 3 H 6 ; д) CH 4 ; е) HCHO.
- То же, но раствор восстановителя добавлен к нейтральному раствору перманганата калия: а) KHS; б) K 2 S; в) KHSO 3 ; г) K 2 SO 3 ; д) KNO 2 ; е) KI.
- То же, но в раствор перманганата калия предварительно добавлен раствор гидроксида калия: а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ; в) KNO 2 ; г) KI {KIO 3 }.
- Составьте уравнения следующих реакций,
протекающих в растворе: а) KMnO 4 + H 2 S ...;
б) KMnO 4 + HCl ...;
в) KMnO 4 + HBr ...;
г) KMnO 4 + HI ... - Составьте следующие уравнения ОВР диоксида марганца:
- К подкисленному серной кислотой раствору дихромата калия добавлены растворы следующих веществ: а) KHS; б) K 2 S; в) HNO 2 ; г) KNO 2 ; д) KI; е) FeSO 4 ; ж) CH 3 CH 2 CHO; и) H 2 SO 3 ; к) KHSO 3 ; л) K 2 SO 3 . Составьте уравнения протекающих реакций.
- То же, но через раствор пропущены следующие газы: а) H 2 S; б) SO 2 .
- К раствору хромата калия, содержащему гидроксид калия, добавлены растворы а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ; в) KNO 2 ; г) KI {KIO 3 }. Составьте уравнения протекающих реакций.
- К раствору хлорида хрома(III) прибавили раствор гидроксида калия до растворения первоначально образовавшегося осадка, а затем – бромную воду. Составьте уравнения протекающих реакций.
- То же, но на последнем этапе был добавлен раствор пероксодисульфата калия K 2 S 2 O 8 , восстановивегося в процессе реакции до сульфата.
- Составьте уравнения реакций, протекающих в растворе:
- Составьте уравнения реакций, протекающих между твердым триоксидом хрома и следующими веществами: а) C; б) CO; в) S {SO 2 }; г) H 2 S; д) NH 3 ; е) C 2 H 5 OH {CO 2 и H 2 O}; ж) CH 3 COCH 3 .
- Составьте уравнения реакций, протекающих при добавлении в концентрированную азотную кислоту следующих веществ: а) S {H 2 SO 4 }; б) P 4 {(HPO 3) 4 }; в) графит; г) Se; д) I 2 {HIO 3 }; е) Ag; ж) Cu; и) Pb; к) KF; л) FeO; м) FeS; н) MgO; п) MgS; р) Fe(OH) 2 ; с) P 2 O 3 ; т) As 2 O 3 {H 3 AsO 4 }; у) As 2 S 3 ; ф) Fe(NO 3) 2 ; х) P 4 O 10 ; ц) Cu 2 S.
- То же, но при пропускании следующих газов: а) CO; б) H 2 S; в) N 2 O; г) NH 3 ; д) NO; е) H 2 Se; ж) HI.
- Одинаково, или по-разному будут протекать реакции в следующих случаях: а) в высокую пробирку на две трети заполненную концентрированной азотной кислотой, поместили кусочек магния; б) на поверхность магниевой пластины поместили каплю концентрированной азотной кислоты? Составьте уравнения реакций.
- В чем отличие реакции концентрированной азотной кислоты с сероводородной кислотой и с газообразным сероводородом? Составьте уравнения реакций.
- Одинаково ли будут протекать ОВР при добавлении к концентрированному раствору азотной кислоты безводного кристаллического сульфида натрия и его 0,1 M раствора?
- Концентрированной азотной кислотой обработали смесь следующих веществ: Cu, Fe, Zn, Si и Cr. Составьте уравнения протекающих реакций.
- Составьте уравнения реакций, протекающих при добавлении в разбавленную азотную кислоту следующих веществ: а) I 2 ; б) Mg; в) Al; г) Fe; д) FeO; е) FeS; ж) Fe(OH) 2 ; и) Fe(OH) 3 ; к) MnS; л) Cu 2 S; м) CuS; н) CuO; п) Na 2 S кр; р) Na 2 S р; с) P 4 O 10 .
- Какие процессы будут протекать при пропускании через разбавленный раствор азотной кислоты а) аммиака, б) сероводорода, в) диоксида углерода?
- Составьте уравнения реакций, протекающих при добавлении в концентрированную серную кислоту следующих веществ: а) Ag; б) Cu; в) графит; г) HCOOH; д) С 6 H 12 O 6 ; е) NaCl кр; ж) C 2 H 5 OH.
- При пропускании через холодную концентрированную серную кислоту сероводорода образуется S и SO 2 , горячая концентрированная H 2 SO 4 окисляет серу до SO 2 . Составьте уравнения реакций. Как будет протекать реакция между горячей концентрированной H 2 SO 4 и сероводородом?
- Почему хлороводород получают, обрабатывая кристаллический хлорид натрия концентрированной серной кислотой, а бромоводород и йодоводород этим способом не получают?
- Составьте уравнения реакций, протекающих при взаимодействии разбавленной серной кислоты с а) Zn, б) Al, в) Fe, г) хромом в отсутствии кислорода, д) хромом на воздухе.
- Составьте уравнения реакций, характеризующих окислительно-восстановительные свойства пероксида водорода:
- Какие реакции протекают при нагревании следующих веществ: а) (NH 4) 2 CrO 4 ; б) NaNO 3 ; в) CaCO 3 ; г) Al(NO 3) 3 ; д) Pb(NO 3) 3 ; е) AgNO 3 ; ж) Hg(NO 3) 2 ; и) Cu(NO 3) 2 ; к) CuO; л) NaClO 4 ; м) Ca(ClO 4) 2 ; н) Fe(NO 3) 2 ; п) PCl 5 ; р) MnCl 4 ; с) H 2 C 2 O 4 ; т) LiNO 3 ; у) HgO; ф) Ca(NO 3) 2 ; х) Fe(OH) 3 ; ц) CuCl 2 ; ч) KClO 3 ; ш) KClO 2 ; щ) CrO 3 ?
- При сливании горячих растворов хлорида аммония и нитрата калия протекает реакция, сопровождающаяся выделением газа. Составьте уравнение этой реакции.
- Составьте уравнения реакций, протекающих при пропускании через холодный раствор гидроксида натрия а) хлора, б) паров брома. То же, но через горячий раствор.
- При взаимодействии с горячим концентрированным раствором гидроксида калия селен подвергается дисмутации до ближайших устойчивых степеней окисления (–II и +IV). Составьте уравнение этой ОВР.
- При тех же условиях сера подвергается аналогичной дисмутации, но при этом избыток серы реагирует с сульфит-ионами с образованием тиосульфат ионов S 2 O 3 2 . Составьте уравнения протекающих реакций. ;
- Составьте уравнения реакций электролиза а) раствора нитрата меди с серебряным анодом, б) раствора нитрата свинца с медным анодом.
а) CrCl 2 + FeCl 3 ; б) CrSO 4 + FeCl 3 ; в) CrSO 4 + H 2 SO 4 + O 2 ;
г) CrSO 4 + H 2 SO 4 + MnO 2 ; д) CrSO 4 + H 2 SO 4 + KMnO 4 .
В каких из этих реакций пероксид водорода является окислителем, а в каких – восстановителем?
| Опыт 1.
Окислительные
свойства перманганата калия в кислотной среде.
K 3-4 каплям раствора перманганата калия прилить
равный объем разбавленного раствора серной
кислоты, а затем раствор сульфита натрия до
обесцвечивания. Составить уравнение реакции. Опыт 2. Окислительные свойства перманганата калия в нейтральной среде. К 3-4 каплям раствора перманганата калия прилить 5-6 капель раствора сульфита натрия. Какое вещество выделилось в виде осадка? Опыт 3 . Окислительные свойства перманганата калия в щелочной среде. К 3-4 каплям раствора перманганата калия прилить 10 капель концентрированного раствора гидроксида натрия и 2 капли раствора сульфита натрия. Раствор должен приобрести зеленую окраску. Опыт 4 . Окислительные свойства дихромата калия в кислотной среде. 6 капель раствора дихромата калия подкислить четырьмя каплями разбавленного раствора серной кислоты и добавить раствор сульфита натрия до изменения окраски смеси. Опыт 5. Окислительные свойства разбавленной серной кислоты. В одну пробирку поместить гранулу цинка, а в другую – кусочек медной ленты. В обе пробирки добавить 8-10 капель разбавленного раствора серной кислоты. Сравнить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 6. Окислительные свойства концентрированной серной кислоты. Аналогично опыту 5, но добавить концентрированный раствор серной кислоты. Через минуту после начала выделения газообразных продуктов реакции ввести в пробирки полоски фильтровальной бумаги, смоченные растворами перманганата калия и сульфата меди. Объяснить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 7. Окислительные свойства разбавленной азотной кислоты. Аналогично опыту 5, но добавить разбавленный раствор азотной кислоты. Наблюдать изменение цвета газообразных продуктов реакции. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 8 . Окислительные свойства концентрированной азотной кислоты. В пробирку поместить кусочек медной ленты и прилить 10 капель концентрированного раствора азотной кислоты. Осторожно нагреть до полного растворения металла. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 9 . Окислительные свойства нитрита калия. К 5-6 каплям раствора нитрита калия прилить равный объем разбавленного раствора серной кислоты и 5 капель раствора иодида калия. Образование каких веществ наблюдается? Опыт 10 . Восстановительные свойства нитрита калия. К 5-6 каплям раствора перманганата калия добавить равный объем разбавленного раствора серной кислоты и раствор нитрита калия до полного обесцвечивания смеси. Опыт 11. Термическое разложение нитрата меди. Один микрошпатель тригидрата нитрата меди поместить в пробирку, закрепить ее в штативе и осторожно нагреть открытым пламенем. Наблюдать обезвоживание и последующее разложение соли. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 12 . Термическое разложение нитрата свинца. Провести аналогично опыту 11, поместив в пробирку нитрат свинца. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! В чем отличие процессов, протекающих при разложении этих солей? |
Составление уравнений окислительно-восстановительных реакций с участием органических веществ
В связи с введением в качестве единственной формы итоговой аттестации выпускников средней школы единого государственного экзамена (ЕГЭ) и переходом старшей школы на профильное обучение все большую актуальность приобретает подготовка старшеклассников к выполнению наиболее “дорогих” в балльном отношении заданий части “С” теста ЕГЭ по химии. Несмотря на то, что пять заданий части “С” считаются разными: химические свойства неорганических веществ, цепочки превращений органических соединений, расчетные задачи, – все они в той или иной мере связаны именно с окислительно-восстановительными реакциями (ОВР). Если усвоены основные знания теории ОВР, то можно правильно выполнить первое и второе задания полностью, а третье – частично. На наш взгляд, значительная часть успеха при выполнении части “С” заключается именно в этом. Опыт показывает, что если, изучая неорганическую химию, ученики достаточно хорошо справляются с заданиями по написанию уравнений ОВР, то аналогичные задания по органической химии вызывают у них большие трудности. Поэтому на протяжении изучения всего курса органической химии в профильных классах мы стараемся сформировать у старшеклассников навыки составления уравнений ОВР.
При изучении сравнительной характеристики неорганических и органических соединений мы знакомим учащихся с использованием степени окисления (с.о.) (в органической химии прежде всего углерода) и способами ее определения:
1) вычисление средней с.о. углерода в молекуле органического вещества;
2) определение с.о. каждого атома углерода.
Уточняем, в каких случаях лучше использовать тот или иной способ.
Статья опубликована при поддержке компании "ГЕО-Инжиниринг", представляющей на рынке продукцию под брендом "ProfKresla". Сфера деятельности компании - производство, продажа и установка кресел и стульев для различных залов. Высокий профессионализм сотрудников и собственные производственные мощности позволяют быстро и качественно реализовывать проекты любой степени сложности. Всю продукцию под брендом "ProfKresla", будь тоТеатральные кресла , сидения для залов ожидания или стулья для учебных заведений, отличают современный и эргономичный дизайн, а также высокая износостойкость, прочность и комфорт. Из огромного ассортимента продукции, представленного в каталоге на сайте profkresla.ru, Вы всегда сможете подобрать модели, наилучшим образом соответствующие корпоративному стилю, принятому в Вашей компании. Если же у Вас все-таки возникнут трудности с выбором, то специалисты компании всегда готовы дать консультацию, помочь определиться с моделью, после чего подготовить проект, на месте произвести все необходимые замеры и установку.
П ри изучении темы “Алканы” показываем, что процессы окисления, горения, галогенирования, нитрования, дегидрирования, разложения относятся к окислительно-восстановительным процессам. При написании уравнений реакций горения и разложения органических веществ лучше использовать среднее значение с.о. углерода. Например:
Обращаем внимание на первую половину электронного баланса: у атома углерода в дробном значении с.о. знаменатель равен 4, поэтому расчет передачи электронов ведем по этому коэффициенту.
В остальных случаях при изучении темы “Алканы” определяем значения с.о. каждого атома углерода в соединении, обращая при этом внимание учащихся на последовательность замещения атомов водорода у первичных, вторичных, третичных атомов углерода:


Таким образом мы подводим учащихся к выводу, что в начале протекает процесс замещения у третичных, затем – у вторичных, и, в последнюю очередь – у первичных атомов углерода.
П ри изучении темы “Алкены” рассматриваем процессы окисления в зависимости от строения алкена и среды протекания реакции.
При окислении алкенов концентрированным раствором перманганата калия KMnO 4 в кислой среде (жесткое окисление) происходит разрыв - и -связей с образованием карбоновых кислот, кетонов и оксида углерода(IV). Эта реакция используется для определения положения двойной связи.
Если двойная связь находится на конце молекулы (например, у бутена-1), то одним из продуктов окисления является муравьиная кислота, легко окисляющаяся до углекислого газа и воды:

Подчеркиваем, что если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле 2-метилбутена-2), то при его окислении происходит образование кетона, т. к. превращение такого атома в атом карбоксильной группы невозможно без разрыва C–C-связи, относительно устойчивой в этих условиях:

Уточняем, что если молекула алкена симметрична и двойная связь содержится в середине молекулы, то при окислении образуется только одна кислота:

Сообщаем, что особенностью окисления алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, является образование двух кетонов:


Рассматривая окисление алкенов в нейтральной или слабощелочной средах, акцентируем внимание старшеклассников на том, что в таких условиях окисление сопровождается образованием диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь:

В аналогичном плане рассматриваем окисление ацетилена и его гомологов в зависимости от того, в какой среде протекает процесс. Так, уточняем, что в кислой среде процесс окисления сопровождается образованием карбоновых кислот:

Реакция используется для определения строения алкинов по продуктам окисления:

В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот:

В се правила отрабатываются с учащимися на конкретных примерах, что приводит к лучшему усвоению ими теоретического материала. Поэтому при изучении окисления аренов в различных средах ученики могут самостоятельно высказать предположения, что в кислой среде следует ожидать образования кислот, а в щелочной – солей. Учителю останется только уточнить, какие продукты реакции образуются в зависимости от строения соответствующего арена.
Показываем на примерах, что гомологи бензола с одной боковой цепью (независимо от ее длины) окисляются сильным окислителем до бензойной кислоты по -углеродному атому. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Подчеркиваем, что если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:

П олученные навыки составления уравнений ОВР для углеводородов позволяют использовать их при изучении раздела “Кислородсодержащие соединения”.
Так, при изучении темы “Спирты” учащиеся самостоятельно составляют уравнения окисления спиртов, используя следующие правила:
1) первичные спирты окисляются до альдегидов
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) вторичные спирты окисляются до кетонов

3) для третичных спиртов реакция окисления не характерна.
В целях подготовки к ЕГЭ учителю целесообразно дать дополнительные сведения к указанным свойствам, что, несомненно, будет полезным для учащихся.
При окислении метанола подкисленным раствором перманганата калия или дихромата калия образуется CO 2 , первичные спирты при окислении в зависимости от условий протекания реакции могут образовать не только альдегиды, но и кислоты. Например, окисление этанола дихроматом калия на холоду заканчивается oбразованием уксусной кислоты, а при нагревании – ацетальдегида:
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
Вновь напомним учащимся о влиянии среды на продукты реакций окисления спиртов, а именно: горячий нейтральный раствор KMnO 4 окисляет метанол до карбоната калия, а остальные спирты – до солей соответствующих карбоновых кислот:

При изучении темы “Альдегиды и кетоны” акцентируем внимание учащихся на том, что альдегиды легче, чем спирты, окисляются в соответствующие карбоновые кислоты не только под действием сильных окислителей (кислород воздуха, подкисленные растворы KMnO 4 и K 2 Cr 2 O 7), но и под действием слабых (аммиачный раствор оксида серебра или гидроксида меди(II)):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 –CHO + 2OH CH 3 –COONH 4 + 2Ag + 3NH 3 + H 2 O.
Особое внимание уделяем окислению метаналя аммиачным раствором оксида серебра, т.к. в этом случае образуется карбонат аммония, а не муравьиная кислота:
HCHО + 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Как показывает наш многолетний опыт, предложенная методика обучения старшеклассников составлению уравнений ОВР с участием органических веществ повышает их итоговый результат ЕГЭ по химии на несколько баллов.
Окислительно-восстановительные реакции в органической химии представляют наибольший интерес, т.к. переход из одной степени окисления в другую сильно зависит от правильного выбора реагента и условий проведения реакций. ОВР изучают в обязательном курсе химии недостаточно полно, но в контрольно-измерительных материалах ЕГЭ встречаются не только в заданиях С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений органических веществ.
Скачать:
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ
«Думать легко, действовать трудно, а превратить мысль в действие - самая трудная вещь на свете» И. Гете Окислительно-восстановительные реакции в органической химии представляют наибольший интерес, т.к. селективность перехода из одной степени окисления в другую сильно зависит от правильного выбора реагента и условий проведения реакций. Но ОВР изучают в обязательном курсе химии недостаточно полно. Следует обратить особое внимание учащихся на окислительно-восстановительные процессы, происходящие с участием органических веществ. Это связано с тем, что окислительно-восстановительные реакции в контрольно-измерительных материалах ЕГЭ встречаются не только в заданиях С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений органических веществ. В школьных учебниках часто окислитель записывают над стрелкой как [О]. Требованием к выполнению таких заданий на ЕГЭ является обязательное обозначение всех исходных веществ и продуктов реакции с расстановкой необходимых коэффициентов. Окислительно-восстановительные реакции традиционно важны, и в то же время изучение в 10 классе, в курсе «Органическая химия» вызывает у учащихся определенные трудности.
С3 . Задания этого блока проверяют знания по органической химии В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома (VI), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
Определение степени окисления атомов в молекулах органических соединений ПРАВИЛО: СО (атома) = число связей с более ЭО атомами минус число связей с менее ЭО атомами.
Изменение степени окисления атомов углерода в молекулах органических соединений. Класс органических соединений Степень окисления атома углерода -4/-3 -2 -1 0 +1 +2 +3 +4 Алканы CH 4 CH 3 -CH 3 CH 3 -CH 2 -CH 3 CH 3 | C H 3 -C H-CH 3 CH 3 | C H 3 -C -CH 3 | CH 3 - - - - Алкены - CH 2 =CH 2 CH 3 -CH=CH 2 - - - - Алкины - - CH=CH CH 3 -C=CH - - - - Спирты _ _ H 3 C-CH 2 - ОН H 3 C-C H-CH 3 | OH CH 3 | H 3 C - C - CH 3 | OH - - - Галогеналканы - - H 3 C-CH 2 - CI H 3 C - C H - CH 3 | CI CH 3 | H 3 C - C - CH 3 | CI - - - Альдегиды и кетоны - - - - H 3 C-CH =O H 3 C-C OCH 3 - - Карбоновые кислоты - - - - - - H 3 C-C OOH - Продукты полного окисления - - - - - - - CO 2
Склонность органических соединений к окислению связывают с наличием: кратных связей (легко окисляются алкены, алкины, алкадиены); функциональных групп, способных легко окисляться (–OH, - СНО, - NH 2); активированных алкильных групп, расположенных по соседству с кратными связями или бензольным кольцом (например, пропен может быть окислен до непредельного альдегида акролеина, окисление толуола до бензойной кислоты перманганатом калия в кислой среде); наличие атомов водорода при атоме углерода, содержащем функциональную группу.
1.МЯГКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Для мягкого окисления органических соединений (спиртов, альдегдов, непредельных соединений) используются соединения хрома (VI) – оксид хрома (VI), CrO 3 , дихромат калия К 2 С r 2 O 7 и др. Как правило, окисление проводится в кислой среде, продуктами восстановления являются соли хрома (III), например: 3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 –COOH + 4K 2 SO 4 + Cr 2 (SO 4) 3 + 4H 2 O t 3CH 3 –CH 2 OH+2K 2 Cr 2 O 7 +8H 2 SO 4 →3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O При окислении спиртов дихроматом калия на холоду окисление можно остановить на стадии образования альдегида, при нагревании же образуются карбоновые кислоты: 3CH 3 –CH 2 OH+K 2 Cr 2 O 7 +4H 2 SO 4 →3CH 3 –C Н O+K 2 SO 4 +Cr 2 (SO 4) 3 +7H 2 O
АЛК ЕН + KMnO4 -1 КОН Н 2SO4 Диол Соль карбоновой к-ты + карбонат Карбоновая к-та + СО 2 АЛК ЕН + KMnO4 -2 КОН Н 2SO4 2 соли карбоновой к-ты 2 карбоновые к-та Диол 2.Значительно более сильным окислителем является перманганат калия НЕЙТР. НЕЙТР.
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4 АЛК ИН + KMnO4 -1 КОН Н 2SO4 Соль карбоновой к-ты + карбонат Карбоновая к-та + СО 2 АЛК ИН + KMnO4 -2 КОН Н 2SO4 2 соли карб. к-ты 2 карбоновых к-ты 5CH 3 C = CH + 8KMnO 4 + 12H 2 SO 4 = 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + 14H 2 O C 6 H 5 CH 3 +2KMnO 4 C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O C 6 H 5 CH 2 CH 3 + 4KMnO 4 C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH Гомологи бензола + KMnO4 КОН Н 2SO4 бензойная кислота НЕЙТР. Бензоат
Окислительно-восстановительные свойства кислородсодержащих соединений Окислителями спиртов чаще всего являются оксид меди (II) или перманганат калия, а окислителями альдегидов и кетонов - гидроксид меди (II), аммиачный раствор оксида серебра и другие окислители
ОЛ + KMnO4 -1 КОН Н 2SO4 АЛЬДЕГИД ОЛ + KMnO4 -2 КОН Н 2SO4 кетон ОЛ + К MnO4 (изб.) -1 КОН Н 2SO4 НЕЙТР Соль карбоновой кислоты Соль карбоновой кислоты Карбоновая кислота
Аль дегид + KMnO4 КОН Н 2SO4 Карбоновая кислота + соль карбоновой кислоты Соль карбоновой кислоты карбоновая кислота НЕЙТР. 3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями CH 3 CHO + 2OH CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
Алгоритм подбора коэффициентов Поскольку в задании С3 при составлении уравнений ОВР не требуется написания уравнений электронного баланса, подбирать коэффициенты удобно методом подстрочного баланса – упрощенным способом баланса электронного. 1 . Составляется схема ОВР. Например, для окисления толуола до бензойной кислоты подкисленным раствором перманганата калия схема реакции такова: С 6 Н 5 -СН 3 + KMnO 4 + H 2 SO 4 С 6 Н 5 -С OO Н + K 2 SO 4 + MnSO 4 + H 2 O 2. Указываются с.о. атомов. С.о. атома углерода определяется по приведенному выше способу. С 6 Н 5 -С -3 Н 3 + KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 3. Число электронов, отданных атомом углерода (6), записывается как коэффициент перед формулой окислителя (перманганата калия): С 6 Н 5 -С -3 Н 3 + 6 KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 4. Число электронов, принятых атомом марганца (5), записывается как коэффициент перед формулой восстановителя (толуола): 5 С 6 Н 5 -С -3 Н 3 + 6 KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 5. Важнейшие коэффициенты на месте. Дальнейший подбор не составляет труда: 5 С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 5 С 6 Н 5 -С OO Н + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Пример тестового задания(С3) 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Hg 2+ , H + KMnO 4 , H + С l 2 (эквимол.), h С 2 Н 2 Х 1 СН 3 СООН Х 2 СН 4 X 3 1. реакция Кучерова. Hg 2+ , H + CH CH + H 2 O CH 3 CHO 2.Альдегиды легко окисляются до карбоновых кислот, в том числе таким сильным окислителем, как перманганат калия в кислой среде. CH 3 CHO + KMnO 4 + H 2 SO 4 CH 3 COOH + K 2 SO 4 + MnSO 4 + H 2 O СН 3 С +1 Н О + KMn +7 O 4 + H 2 SO 4 СН 3 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 5 CH 3 CHO + 2 KMnO 4 + 3 H 2 SO 4 5 CH 3 COOH + K 2 SO 4 + 2 MnSO 4 + 3 H 2 O 3.Для выполнения следующего звена цепочки необходимо оценить вещество Х 2 с двух позиций: во-первых, оно в одну стадию образуется из уксусной кислоты, во-вторых, из него можно получить метан. Это вещество – ацетат щелочного металла. Записываются уравнения третьей и четвертой реакций. CH 3 COOH + NaOH CH 3 COONa + H 2 O сплавление 4. CH 3 COONa + NaOH CH 4 + Na 2 CO 3 5.Условия протекания следующей реакции (свет) однозначно указывают на ее радикальный характер. С учетом указанного соотношения реагентов (эквимолярное) записывается уравнение последней реакции: h CH 4 + Cl 2 CH 3 Cl + HCl
Сайты тренажеры: http://reshuege.ru/ (Решу ЕГЭ) http://4ege.ru/himiya/4181-demoversiya-ege-po-himii-2014.html (ЕГЭ портал) http://www.alleng.ru/edu/chem3.htm (Образовательные ресурсы Интернета - Химия) http://ege.yandex.ru/ (онлайн-тесты)