При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
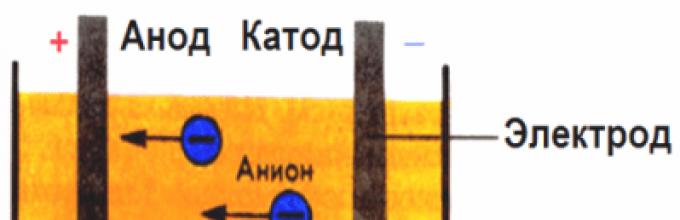
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)

На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
![]()
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются - выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.

Рассмотрим в качестве примера электрорафинирование меди . Главный компонент раствора - сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.

Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию . Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.

Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика - осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.

Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование , он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование , способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение , пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Лимонная батарейка (для увеличения нажмите нажмите на картинку)

Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Электролиз в промышленных масштабах используется для извлечения из металлосодержащих руд металлов и их очищения от примесей. При помощи этого физико-химического процесса на производстве получают медь и алюминий. Заряд химических источников тока (аккумуляторов) также происходит, благодаря протеканию этой реакции.
Определение электролиза
Химическая реакция, в результате которой на электродах происходит оседание компонентов из электролитических растворов веществ, и протекающая под действием электрического тока – вот что такое электролиз. Он включает в себя комплекс процессов окисления и восстановления, происходящих на электродах. Обязательным условием является движение постоянного тока от электрода к электроду.
В чём заключается процесс
Технологический порядок электролиза, или ещё его называют гальванолизом, происходит по законам химии и физики. При этом берутся электропроводящие растворы (жидкости), в которых при помощи двух электродов организовано электрическое поле.
Внимание! Электроды имеют названия. Катод (К) – электрод, имеющий отрицательный потенциал, анод (А) – электрод с положительным потенциалом.
Ионы движутся упорядоченно через раствор, который носит название электролита. При этом ионы, относящиеся к металлам, водороду (катионы) направляются к катоду, к аноду стремятся ионы, принадлежащие к кислотным остаткам или гидроксильной группы (анионы). Катионы имеют положительный знак заряда, анионы – отрицательный. Пропускание электрического тока при электролизе может осуществляться, как через растворы, так и через расплавы электролитов.
Информация. При приготовлении электролита происходит диссоциация раствора на ионы. Это обусловлено взаимодействием растворителя на растворяемое вещество. Такая реакция называется первичной. Дальнейшее воздействие электрического тока на электролит вызывает вторичную реакцию гальванолиза.
Подобное разделение на первичность и вторичность позволило Майклу Фарадею обосновать законы, применяемые к гальванолизу.

Электролиз растворов
Использование воды для приготовления раствора электролита осложняет процесс. В растворах солей и щелочей вода ведёт себя при электролизе неоднозначно. Это проявляется в том, что H2O ведёт себя как окислитель, так и как восстановитель. На катоде она получает электроны и восстанавливает атомы водорода до газообразной формы водорода. На аноде вода отдаёт отрицательно заряженные частицы, тогда атомы кислорода окисляются до газообразной формы кислорода. Кислота, используемая в качестве раствора для электролита, лишена этой проблемы.
Катодные процессы
Катод, помещённый в растворы солей, притягивает к себе катионы металлов. Эти катионы выступают как окислители.
Важно! У отдельных металлов способности ионов окислять различны. Чтобы оценить способности окисления – восстановления, необходимо опираться на электрохимический ряд напряжений.

ЭХП величина относительная, потому у отдельных ионов разная величина ЭХП. У водорода он равен нулю.
Во время процесса электролиза, протекающего в растворах солей, выявлены следующие замечания:
- когда в солях присутствуют активные М, то не они восстанавливаются на катоде, а водород;
- если М в электролите имеет среднюю активность, то на катоде разряжаются (восстанавливаются) оба: и водород, и М;
- при неактивном М на катоде восстанавливается только он, потому что его ион – более сильный окислитель, чем водородный ион.
Примерами таких процессов на катоде могут служить следующие реакции:
- при активном М: 2H2O +2ē → H2 + 2OH-;
- при М средней активности: Men+ + nē → Me0 и 2H+2O +2ē → H20 + 2OH-, где Ме – это растворённый металл;
- в случае неактивного М в солях: Men+ + nē → Me0.
Замечено, что, когда с катодом взаимодействуют водородные катионы H+, происходит их разряжение до молекул водорода – 2H+ + 2ē → H20
Анодные процессы
Плюс, поданный на анод, притягивает к себе анионы вместе с молекулами воды. В данном случае анод является окислителем, а восстановители – молекулы H2O или анионы кислотных остатков.
В процессе гальванолиза на аноде происходят следующие реакции:
- кислотные остатки, не содержащие кислорода, окисляются до нулевой степени окисления: неМеn- – nē = неМе0, где – неМе – это неметалл;
- при содержании в остатке кислорода окисляется вода и выделяет молекулы кислорода (молекулярный кислород О2): 2H2O-2 – 4ē → O20 + 4H+;
- в случае контакта с анодом гидроксид-иона последний также окисляется: 4O-2H– – 4ē → O20 + 2H2O, с выделением молекулярного кислорода.
Исключение . Фтор обладает электроотрицательностью более высокой, чем кислород. Поэтому электролиз растворов фторидов протекает с окислением молекул воды вместо фторид-ионов.
Суммарные процессы электролиза
Что получается в суммарной реакции гальванолиза, можно рассмотреть на примере хлорида натрия. При пропускании электрического тока на электродах происходит следующее:
- катод – на нём восстанавливается H – водород: 2H+2O +2ē → H20 + 2OH–;
- анод – на электроде происходит окисление хлорид-ионов: 2Cl– – 2ē → Cl20.
В этой реакции электролиза не принимают участия ионы натрия. Тем не менее, они входят в суммарное уравнение раствора хлорида натрия при электролизе. Оно имеет вид:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
Электролиз расплавов
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает. Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
В этом случае на катоде происходит восстановление катионов Na:
Na+ + ē → Na0.
Анод вызывает окисление анионов Cl:
2Cl– – 2ē → Cl20.
Общее уравнение гальванолиза расплава NaCl будет иметь вид:
2Na+Cl– → 2Na0 + Cl20.

Электролиз с растворимыми электродами
В этом случае электролиз металлов осуществляется при помощи электродов, выполненных из того же М, который присутствует в электролите. Также электроды могут быть изготовлены из М активностью выше.
Важно! При протекании этого процесса на аноде восстанавливаются не анионы или молекулы H2O, а окисляется сам анод. Его частицы растворяются (окисляются) и восстанавливаются уже на катоде.
В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
- ионы меди, входящие в раствор, восстанавливаются на катоде: Cu2+ + 2ē → Cu0;
- медный анод подвергается окислению своих частиц меди: Cu0 – 2ē → Cu2+.
Таким образом, если медную заготовку, имеющую примеси, использовать в качестве анода при гальванолизе в сульфате меди, то на катоде будет оседать медь в чистом виде. Анодный электрод при этом будет растворяться.

Вот перечень некоторых металлов, которые могут быть растворимыми электродами:
- медь (Cu);
- серебро (Ag);
- цинк (Zn);
- кобальт (Co);
- олово (Sn);
- никель (Ni);
- кадмий (Cd).
На растворимом аноде в начальной стадии электролиза процессы проходят при минимальном стандартном потенциале на электроде. Если электролиз не остановить, то значение потенциала отклоняется в отрицательную сторону. Это вызвано поляризацией из-за пребывания на катоде электронов.
К сведению. Потенциалы электродов могут отклоняться от их изначального значения в ходе электролиза. Это явление называют поляризацией. Она бывает электрохимической и концентрационной.
Активные металлы
Это тот тип металлов, который легко вступает в реакции. В периодической таблице это элементы 1-й и 2-й группы. Так как металлические свойства у элементов становятся слабее в ряду слева направо, то к ним относятся:
- щелочные металлы: литий, калий, натрий, цезий, франций, рубидий;
- щелочноземельные элементы: бериллий, магний, кальций, стронций, барий, радий;
- алюминий.
Данные металлы имеют один или два валентных электрона и легко их отдают, являясь восстановителями. К отличительным особенностям активных металлов относятся:
- мягкость;
- лёгкость;
- низкая температура плавления.
При взаимодействии с кислородом (на воздухе) щелочных металлов возможно самовозгорание. Самовозгорание щелочноземельных металлов происходит при повышении температуры. При взаимодействии их с водой образуются щёлочь и водород, вступая в реакцию с кислотами, они образуют соли.
Менее активные металлы и неактивные металлы
Среднюю активность проявляют металлы, стоящие в ряду после алюминия Al и до водорода H2.
К неактивным относятся элементы, стоящие правее водорода: медь (Cu), ртуть (Hg), серебро (Ag), платина (Pt), золото (Au).

Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии. При этом способе важно, чтобы заготовка отделилась от покрытия.

Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Видео
Электролиз широко используется в производственной сфере, например, для получения алюминия (аппараты с обожженными анодами РА-300, РА-400, РА-550 и т.д.) или хлора (промышленные установки Asahi Kasei). В быту этот электрохимический процесс применялся значительно реже, в качестве примера можно привести электролизер для бассейна Intellichlor или плазменный сварочный аппарат Star 7000. Увеличение стоимости топлива, тарифов на газ и отопление в корне поменяли ситуацию, сделав популярной идею электролиза воды в домашних условиях. Рассмотрим, что представляют собой устройства для расщепления воды (электролизеры), и какова их конструкция, а также, как сделать простой аппарат своими руками.
Что такое электролизер, его характеристики и применение
Так называют устройство для одноименного электрохимического процесса, которому требуется внешний источник питания. Конструктивно это аппарат представляет собой заполненную электролитом ванну, в которую помещены два или более электродов.
Основная характеристика подобных устройств – производительность, часто это параметр указывается в наименовании модели, например, в стационарных электролизных установках СЭУ-10, СЭУ-20, СЭУ-40, МБЭ-125 (мембранные блочные электролизеры) и т.д. В данных случаях цифры указывают на выработку водорода (м 3 /ч).
Что касается остальных характеристик, то они зависят от конкретного типа устройства и сферы применения, например, когда осуществляется электролиз воды, на КПД установки влияют следующие параметры:

Таким образом, подавая на выходы 14 вольт, мы получим 2 вольта на каждой ячейке, при этом на пластинах с каждой стороны будут разные потенциалы. Электролизеры, где используется подобная система подключения пластин, называются сухими.
- Расстояние между пластинами (между катодным и анодным пространством), чем оно меньше, тем меньше будет сопротивление и, следовательно, больший ток пройдет через раствор электролита, что приведет к увеличению выработки газа.
- Размеры пластины (имеется в виду площадь электродов), прямо пропорциональны току, идущему через электролит, а значит, также оказывают влияние на производительность.
- Концентрация электролита и его тепловой баланс.
- Характеристики материала, используемого для изготовления электродов (золото – идеальный материал, но слишком дорогой, поэтому в самодельных схемах используется нержавейка).
- Применение катализаторов процесса и т.д.
Как уже упоминалось выше, установки данного типа могут использоваться как генератор водорода, для получения хлора, алюминия или других веществ. Они также применяются в качестве устройств, при помощи которых осуществляется очистка и обеззараживание воды (УПЭВ, VGE), а также проводится сравнительный анализ ее качества (Tesp 001).

Нас, прежде всего, интересуют устройства, производящие газ Брауна (водород с кислородом), поскольку именно эта смесь имеет все перспективы для использования в качестве альтернативного энергоносителя или добавок к топливу. Их мы рассмотрим чуть позже, а пока перейдем к конструкции и принципу работы простейшего электролизера, расщепляющего воду на водород и кислород.
Устройство и подробный принцип работы
Аппараты для производства гремучего газа, в целях безопасности, не предполагают его накопление, то есть газовая смесь сжигается сразу после получения. Это несколько упрощает конструкцию. В предыдущем разделе мы рассмотрели основные критерии, влияющие на производительность аппарата и накладывающие определенные требования к исполнению.
Принцип работы устройства демонстрирует рисунок 4, источник постоянного напряжения подключен к погруженным в раствор электролита электродам. В результате через него начинает проходить ток, напряжение которого выше точки разложения молекул воды.
 Рисунок 4. Конструкция простого электролизера
Рисунок 4. Конструкция простого электролизера
В результате этого электрохимического процесса катод выделяет водород, а анод – кислород, в соотношении 2 к 1.
Виды электролизеров
Кратко ознакомимся с конструктивными особенностями основных видов устройств для расщепления воды.
Сухие
Конструкция прибора данного типа была показана на рисунке 2, ее особенность заключается в том, что манипулируя количеством ячеек, можно запитать устройство от источника с напряжением, существенно превышающим минимальный электродный потенциал.
Проточные
С упрощенным устройством приборов этого вида можно ознакомиться на рисунке 5. Как видим, конструкция включает в себя ванну с электродами «A», полностью залитую раствором и бак «D».
 Рис 5. Конструкция проточного электролизера
Рис 5. Конструкция проточного электролизера
Принцип работы устройства следующий:
- входе электрохимического процесса газ вместе с электролитом выдавливается в емкость «D» через трубу «В»;
- в баке «D» происходит отделение от электролитного раствора газа, который выводится через выходной клапан «С»;
- электролит возвращается в гидролизную ванну через трубу «Е».
Мембранные
Основная особенность устройств этого типа – использование твердого электролита (мембраны) на полимерной основе. С конструкцией приборов этого вида можно ознакомиться на рисунке 6.
 Рис 6. Электролизер мембранного типа
Рис 6. Электролизер мембранного типа
Основная особенность таких устройств заключается в двойном назначении мембраны, она не только переносит протоны и ионы, а и на физическом уровне разделяет как электроды, так и продукты электрохимического процесса.
Диафрагменные
В тех случаях, когда не допустима диффузия продуктов электролиза между электродными камерами, используют пористую диафрагму (что и дало название таким приборам). Материалом для нее может служить керамика, асбест или стекло. В некоторых случаях для создания такой диафрагмы можно использовать полимерные волокна или стеклянную вату. На рисунке 7 показан простейший вариант диафрагменного прибора для электрохимических процессов.

Пояснение:
- Выход для кислорода.
- U-образная колба.
- Выход для водорода.
- Анод.
- Катод.
- Диафрагма.
Щелочные
Электрохимический процесс невозможен в дистиллированной воде, в качестве катализатора применяется концентрированный раствор щелочи (использование соли нежелательно, так как при этом выделяется хлор). Исходя из этого, щелочными можно назвать большую часть электрохимических устройств для расщепления воды.
На тематических форумах советуют использовать гидроксид натрия (NaOH), который, в отличие от пищевой соды (NaHCO 3), не разъедает электрод. Заметим, что у последней имеются два весомых преимущества:
- Можно использовать железные электроды.
- Не выделяются вредные вещества.
Но, один существенный недостаток сводит на нет все преимущества пищевой соды, как катализатора. Ее концентрация в воде не более 80 грамм на литр. Это снижает морозостойкость электролита и его проводимость тока. Если с первым еще можно смириться в теплое время года, то второе требует увеличения площади пластин электродов, что в свою очередь, увеличивает размер конструкции.
Электролизер для получения водорода: чертежи, схема
Рассмотрим, как можно сделать мощную газовую горелку, работающую от смеси водорода с кислородом. Схему такого устройства можно посмотреть на рисунке 8.
 Рис. 8. Устройство водородной горелки
Рис. 8. Устройство водородной горелки
Пояснение:
- Сопло горелки.
- Резиновые трубки.
- Второй водяной затвор.
- Первый водяной затвор.
- Анод.
- Катод.
- Электроды.
- Ванна электролизера.
На рисунке 9 представлена принципиальная схема блока питания для электролизера нашей горелки.
 Рис. 9. Блок питания электролизной горелки
Рис. 9. Блок питания электролизной горелки
На мощный выпрямитель нам понадобятся следующие детали:
- Транзисторы: VT1 – МП26Б; VT2 – П308.
- Тиристоры: VS1 – КУ202Н.
- Диоды: VD1-VD4 – Д232; VD5 – Д226Б; VD6, VD7 – Д814Б.
- Конденсаторы: 0,5 мкФ.
- Переменные резисторы: R3 -22 кОм.
- Резисторы: R1 – 30 кОм; R2 – 15 кОм; R4 – 800 Ом; R5 – 2,7 кОм; R6 – 3 кОм; R7 – 10 кОм.
- PA1 – амперметр со шкалой измерения не менее 20 А.
Краткая инструкция по деталям к электролизеру.
Ванну можно сделать из старого аккумулятора. Пластины следует нарезать 150х150 мм из кровельного железа (толщина листа 0,5 мм). Для работы с вышеописанным блоком питания потребуется собрать электролизер на 81 ячейку. Чертеж, по которому выполняется монтаж, приведен на рисунке 10.
 Рис. 10. Чертеж электролизера для водородной горелки
Рис. 10. Чертеж электролизера для водородной горелки
Заметим, что обслуживание такого устройства и управление им не вызывает трудностей.
Электролизер для автомобиля своими руками
В интернете можно найти много схем HHO систем, которые, если верить авторам, позволяют экономить от 30% до 50% топлива. Такие заявления слишком оптимистичны и, как правило, не подтверждаются никакими доказательствами. Упрощенная схема такой системы продемонстрирована на 11 рисунке.
 Упрощенная схема электролизера для автомобиля
Упрощенная схема электролизера для автомобиля
По идее, такое устройство должно снизить расход топлива за счет его полного выгорания. Для этого в воздушный фильтр топливной системы подается смесь Брауна. Это водород с кислородом, полученные из электролизера, запитанного от внутренней сети автомобиля, что повышает расход топлива. Замкнутый круг.
Безусловно, может быть задействована схема шим регулятора силы тока, использован более эффективный импульсный блок питания или другие хитрости, позволяющие снизить расход энергии. Иногда в интернете попадаются предложения приобрести низкоамперный БП для электролизера, что вообще является нонсенсом, поскольку производительность процесса напрямую зависит от силы тока.
Это как система Кузнецова, активатор воды которой утерян, а патент отсутствует и т.д. В приведенных видео, где рассказывают о неоспоримых преимуществах таких систем, практически нет аргументированных доводов. Это не значит, что идея не имеет прав на существование, но заявленная экономия «слегка» преувеличена.
Электролизер своими руками для отопления дома
Делать самодельный электролизер для отопления дома на данный момент не имеет смысла, поскольку стоимость водорода, полученного путем электролиза значительно дороже природного газа или других теплоносителей.
Также следует учитывать, что температуру горения водорода не выдержит никакой металл. Правда имеется решение, которое запатентовал Стен Мартин, позволяющее обойти эту проблему. Необходимо обратить внимание на ключевой момент, позволяющий отличить достойную идею от очевидного бреда. Разница между ними заключается в том, что на первый выдают патент, а второй находит своих сторонников в интернете.
На этом можно было бы и закончить статью о бытовых и промышленных электролизерах, но имеет смысл сделать небольшой обзор компаний, производящих эти устройства.
Обзор производителей электролизеров
Перечислим производителей, выпускающих топливные элементы на базе электролизеров, некоторые компании также выпускают и бытовые устройства: NEL Hydrogen (Норвегия, на рынке с 1927 года), Hydrogenics (Бельгия), Teledyne Inc (США), Уралхиммаш (Россия), РусАл (Россия, существенно усовершенствовали технологию Содерберга), РутТех (Россия).
Электролиз (греч. elektron - янтарь + lysis - разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H 2 SO 4) восстанавливается водород из молекул кислоты: 2H + - 2e = H 2
Анод
К аноду притягиваются анионы - отрицательно заряженные ионы: SO 4 2- , PO 4 3- , Cl - , Br - , I - , F - , S 2- , CH 3 COO - .

При электролизе кислородсодержащих анионов: SO 4 2- , PO 4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO 2 .
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO 3) 2 , AlBr 3 , NaF, FeI 2 , CH 3 COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H 2 O → H 2 + Cl 2 + NaOH
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно:) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO 4:
CuSO 4 + H 2 O → Cu + O 2 + H 2 SO 4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl 3 → Al + Cl 2
LiBr → Li + Br 2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
Электролиз – это окислительно – восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита пропускают постоянный электрический ток.
Катод – восстановитель, отдаёт электроны катионам.
Анод – окислитель, принимает электроны от анионов.
|
Ряд активности катионов: |
Na + , Mg 2+ , Al 3+ , Zn 2+ , Ni 2+ , Sn 2+ , Pb 2+ , H + , Cu 2+ , Ag + _____________________________→ Усиление окислительной способности |
|
Ряд активности анионов: |
I - , Br - , Cl - , OH - , NO 3 - , CO 3 2- , SO 4 2- ←__________________________________ Возрастание восстановительной способности |
Процессы, протекающие на электродах при электролизе расплавов
(не зависят от материала электродов и природы ионов).
1. На аноде разряжаются анионы (A m - ; OH -
A m - - m ē → A °; 4 OH - - 4ē → O 2 + 2 H 2 O (процессы окисления).
2. На катоде разряжаются катионы (Me n + , H + ), превращаясь в нейтральные атомы или молекулы:
Me n + + n ē → Me ° ; 2 H + + 2ē → H 2 0 (процессы восстановления).
Процессы, протекающие на электродах при электролизе растворов
|
КАТОД (-) Не зависят от материала катода; зависят от положения металла в ряду напряжений |
АНОД (+) Зависят от материала анода и природы анионов. |
|
|
Анод нерастворимый (инертный), т.е. изготовлен из угля, графита, платины, золота . |
Анод растворимый (активный), т.е. изготовлен из Cu , Ag , Zn , Ni , Fe и др. металлов (кроме Pt , Au ) |
|
|
1.В первую очередь восстанавливаются катионы металлов, стоящие в ряду напряжений после H 2 : Me n+ +nē → Me° |
1.В первую очередь окисляются анионы бескислородных кислот (кроме F - ): A m- - mē → A° |
Анионы не окисляются. Идёт окисление атомов металла анода: Me° - nē → Me n+ Катионы Me n + переходят в раствор. Масса анода уменьшается. |
|
2.Катионы металлов средней активности, стоящие между Al и H 2 , восстанавливаются одновременно с водой: Me n+ + nē →Me° 2H 2 O + 2ē → H 2 + 2OH - |
2.Анионы оксокислот (SO 4 2- , CO 3 2- ,..) и F - не окисляются, идёт окисление молекул H 2 O : 2H 2 O - 4ē → O 2 +4H + |
|
|
3.Катионы активных металлов от Li до Al (включительно) не восстанавливаются, а восстанавливаются молекулы H 2 O : 2 H 2 O + 2ē →H 2 + 2OH - |
3.При электролизе растворов щелочей окисляются ионы OH - : 4OH - - 4ē → O 2 +2H 2 O |
|
|
4.При электролизе растворов кислот восстанавливаются катионы H + : 2H + + 2ē → H 2 0 |
||
ЭЛЕКТРОЛИЗ РАСПЛАВОВ
Задание 1 . Составьте схему электролиза расплава бромида натрия. (Алгоритм 1.)
|
Последовательность действий |
Выполнение действий |
|
NaBr → Na + + Br - |
|
|
K - (катод ): Na + , A + (анод ): Br - |
|
|
K + : Na + + 1ē → Na 0 (восстановление), A + : 2 Br - - 2ē → Br 2 0 (окисление). |
|
|
2NaBr = 2Na +Br 2 |
Задание 2 . Составьте схему электролиза расплава гидроксида натрия. (Алгоритм 2.)
|
Последовательность действий |
Выполнение действий |
|
NaOH → Na + + OH - |
|
|
2.Показать перемещение ионов к соответствующим электродам |
K - (катод ): Na + , A + (анод ): OH - . |
|
3.Составить схемы процессов окисления и восстановления |
K - : Na + + 1ē → Na 0 (восстановление), A + : 4 OH - - 4ē → 2 H 2 O + O 2 (окисление). |
|
4.Составить уравнение электролиза расплава щёлочи |
4NaOH = 4Na + 2H 2 O + O 2 |
Задание 3. Составьте схему электролиза расплава сульфата натрия. (Алгоритм 3.)
|
Последовательность действий |
Выполнение действий |
|
1.Составить уравнение диссоциации соли |
Na 2 SO 4 → 2Na + + SO 4 2- |
|
2.Показать перемещение ионов к соответствующим электродам |
K - (катод ): Na + A + (анод ): SO 4 2- |
|
K - : Na + + 1ē → Na 0 , A + : 2SO 4 2- - 4ē → 2SO 3 + O 2 |
|
|
4.Составить уравнение электролиза расплава соли |
2Na 2 SO 4 = 4Na + 2SO 3 + O 2 |
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Задание 1. Составить схему электролиза водного раствора хлорида натрия с использованием инертных электродов. (Алгоритм 1.)
|
Последовательность действий |
Выполнение действий |
|
1.Составить уравнение диссоциации соли |
NaCl → Na + + Cl - |
|
Ионы натрия в растворе не восстанавливаются, поэтому идёт восстановление воды. Ионы хлора окисляются. |
|
|
3.Составить схемы процессов восстановления и окисления |
K - : 2H 2 O + 2ē → H 2 + 2OH - A + : 2Cl - - 2ē → Cl 2 |
|
2NaCl + 2H 2 O = H 2 + Cl 2 + 2NaOH |
Задание 2. Составить схему электролиза водного раствора сульфата меди (II ) с использованием инертных электродов. (Алгоритм 2.)
|
Последовательность действий |
Выполнение действий |
|
1.Составить уравнение диссоциации соли |
CuSO 4 → Cu 2+ + SO 4 2- |
|
2. Выбрать ионы, которые будут разряжаться на электродах |
На катоде восстанавливаются ионы меди. На аноде в водном растворе сульфат-ионы не окисляются, поэтому окисляется вода. |
|
3.Составить схемы процессов восстановления и окисления |
K - : Cu 2+ + 2ē → Cu 0 A + : 2H 2 O - 4ē → O 2 +4H + |
|
4.Составить уравнение электролиза водного раствора соли |
2CuSO 4 +2H 2 O = 2Cu + O 2 + 2H 2 SO 4 |
Задание 3. Составить схему электролиза водного раствора водного раствора гидроксида натрия с использованием инертных электродов. (Алгоритм 3.)
|
Последовательность действий |
Выполнение действий |
|
1.Составить уравнение диссоциации щёлочи |
NaOH → Na + + OH - |
|
2. Выбрать ионы, которые будут разряжаться на электродах |
Ионы натрия не могут восстанавливаться, поэтому на катоде идёт восстановление воды. На аноде окисляются гидроксид-ионы. |
|
3.Составить схемы процессов восстановления и окисления |
K - : 2 H 2 O + 2ē → H 2 + 2 OH - A + : 4 OH - - 4ē → 2 H 2 O + O 2 |
|
4.Составить уравнение электролиза водного раствора щёлочи |
2 H 2 O = 2 H 2 + O 2 , т.е. электролиз водного раствора щёлочи сводится к электролизу воды. |
Запомнить. При электролизе кислородсодержащих кислот (H 2 SO 4 и др .) , оснований (NaOH , Ca (OH ) 2 и др.) , солей активных металлов и кислородсодержащих кислот (K 2 SO 4 и др.) на электродах протекает электролиз воды: 2 H 2 O = 2 H 2 + O 2
Задание 4. Составить схему электролиза водного раствора нитрата серебра с использованием анода, изготовленного из серебра, т.е. анод – растворимый. (Алгоритм 4.)
|
Последовательность действий |
Выполнение действий |
|
1.Составить уравнение диссоциации соли |
AgNO 3 → Ag + + NO 3 - |
|
2. Выбрать ионы, которые будут разряжаться на электродах |
На катоде восстанавливаются ионы серебра, серебряный анод растворяется. |
|
3.Составить схемы процессов восстановления и окисления |
K - : Ag + + 1ē→ Ag 0 ; A + : Ag 0 - 1ē→ Ag + |
|
4.Составить уравнение электролиза водного раствора соли |
Ag + + Ag 0 = Ag 0 + Ag + электролиз сводится к переносу серебра с анода на катод. |