Ας εξετάσουμε μερικά φαινόμενα που επιβεβαιώνουν πειραματικά τις κύριες διατάξεις και συμπεράσματα της μοριακής κινητικής θεωρίας.
1. Μπράουνια κίνηση.Ο Σκωτσέζος βοτανολόγος R. Brown (1773-1858), παρατηρώντας ένα εναιώρημα γύρης στο νερό κάτω από ένα μικροσκόπιο, διαπίστωσε ότι τα σωματίδια της γύρης κινούνταν ζωηρά και τυχαία, στη συνέχεια περιστρέφονταν και στη συνέχεια κινούνταν από μέρος σε μέρος, όπως σωματίδια σκόνης σε μια ηλιαχτίδα. Στη συνέχεια, αποδείχθηκε ότι μια τέτοια πολύπλοκη κίνηση ζιγκ -ζαγκ είναι χαρακτηριστική για τυχόν σωματίδια μικρού μεγέθους (1 μm) που αιωρούνται σε αέριο ή υγρό. Η ένταση αυτής της κίνησης, που ονομάζεται Brownian,αυξάνεται με την αύξηση της θερμοκρασίας του μέσου, με μείωση του ιξώδους και του μεγέθους των σωματιδίων (ανεξάρτητα από τη χημική τους φύση). Ο λόγος για την κίνηση Brownian παρέμεινε ασαφής για μεγάλο χρονικό διάστημα. Μόνο 80 χρόνια μετά την ανακάλυψη αυτού του φαινομένου, του δόθηκε μια εξήγηση: η Brownian κίνηση των αιωρούμενων σωματιδίων προκαλείται από την επίδραση μορίων του μέσου στο οποίο τα σωματίδια αιωρούνται. Δεδομένου ότι τα μόρια κινούνται χαοτικά, τα σωματίδια του Μπράουν δέχονται κραδασμούς από διαφορετικές κατευθύνσεις και επομένως κινούνται σε τόσο περίεργο σχήμα. Έτσι, η κίνηση Μπράουν είναι επιβεβαίωση των συμπερασμάτων της μοριακής κινητικής θεωρίας σχετικά με τη χαοτική θερμική κίνηση ατόμων και μορίων.
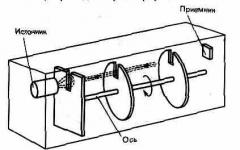
2. Η εμπειρία του Στερν.Ο πρώτος πειραματικός προσδιορισμός των ταχυτήτων των μορίων πραγματοποιήθηκε από τον Γερμανό φυσικό O. Stern (1888-1970). Τα πειράματά του κατέστησαν επίσης δυνατή την εκτίμηση της κατανομής της ταχύτητας των μορίων. Η ρύθμιση Stern φαίνεται στο Σχ. 70. Ένα σύρμα πλατίνας επικαλυμμένο με ένα στρώμα αργύρου τεντώνεται κατά μήκος του άξονα του εσωτερικού κυλίνδρου με μια σχισμή, η οποία θερμαίνεται από ένα ρεύμα όταν αντλείται ο αέρας. Το ασήμι εξατμίζεται όταν θερμαίνεται. Τα ασημένια άτομα, που διαφεύγουν από τη σχισμή, χτυπούν την εσωτερική επιφάνεια του δεύτερου κυλίνδρου, δίνοντας μια εικόνα της σχισμής Ο.
Εάν η συσκευή περιστραφεί γύρω από τον κοινό άξονα των κυλίνδρων, τότε τα άτομα αργύρου δεν θα εγκατασταθούν στο κενό, αλλά θα μετατοπιστούν από το σημείο Ογια κάποια απόσταση s. Η εικόνα σχισμής είναι θολή. Εξετάζοντας το πάχος του εναποτιθέμενου στρώματος, είναι δυνατό να εκτιμηθεί η κατανομή της ταχύτητας των μορίων, η οποία αντιστοιχεί στη Maxwellian κατανομή.
Γνωρίζοντας τις ακτίνες των κυλίνδρων, τη γωνιακή τους ταχύτητα περιστροφής, καθώς και τη μέτρηση s, είναι δυνατόν να υπολογιστεί η ταχύτητα κίνησης των ατόμων αργύρου σε μια δεδομένη θερμοκρασία του σύρματος. Τα πειραματικά αποτελέσματα έδειξαν ότι η μέση ταχύτητα των ατόμων αργύρου είναι κοντά σε αυτήν που προκύπτει από τη Maxwellian ταχύτητα κατανομής των μορίων.
3. Ζήστε την εμπειρία του Lammert.Αυτό το πείραμα καθιστά δυνατό τον ακριβέστερο προσδιορισμό του νόμου κατανομής ταχύτητας για μόρια. Το διάγραμμα της εγκατάστασης κενού φαίνεται στο Σχ. 71. Η μοριακή δέσμη που σχηματίζεται από την πηγή, περνώντας από τη σχισμή, εισέρχεται στον δέκτη. Δύο δίσκοι με σχισμές στερεωμένες σε έναν κοινό άξονα τοποθετούνται μεταξύ της πηγής και του δέκτη. Όταν οι δίσκοι είναι ακίνητοι, τα μόρια φτάνουν στον δέκτη, περνώντας από τις σχισμές και στα δύο

δίσκους. Εάν ο άξονας τεθεί σε περιστροφή, τότε ο δέκτης φτάνει μόνο από εκείνα τα μόρια που έχουν περάσει την υποδοχή στον πρώτο δίσκο και τα οποία περνούν χρόνο ίσο ή πολλαπλάσιο του χρόνου περιστροφής του δίσκου για να ταξιδέψουν μεταξύ των δίσκων. Άλλα μόρια διατηρούνται από τον δεύτερο δίσκο. Αλλάζοντας τη γωνιακή ταχύτητα περιστροφής των δίσκων και μετρώντας τον αριθμό των μορίων που εισέρχονται στον δέκτη, είναι δυνατό να αποκαλυφθεί ο νόμος κατανομής των ταχυτήτων των μορίων. Αυτό το πείραμα επιβεβαίωσε επίσης την εγκυρότητα της κατανομής Maxwellian ταχύτητας μορίων.
4. Πειραματικός προσδιορισμός της σταθεράς Avogadro.Χρησιμοποιώντας την ιδέα της κατανομής μοριακού ύψους (βλέπε τύπο (45.4)), ο Γάλλος επιστήμονας J Perrin (1870-1942) προσδιόρισε πειραματικά τη σταθερά του Avogadro. Εξετάζοντας την κίνηση Μπράουν υπό μικροσκόπιο, πείστηκε ότι τα σωματίδια Μπράουν κατανέμονται κατά μήκος του ύψους όπως μόρια αερίου σε ένα βαρυτικό πεδίο. Εφαρμόζοντας τη διανομή Boltzmann σε αυτά, μπορούμε να γράψουμε
![]()
όπου Μ- σωματιδιακή μάζα, Μ 1 είναι η μάζα του υγρού που μετατοπίζεται από αυτό: m = 4/3 r 3 , m 1 = 4/3 r 3 1 (ρ είναι η ακτίνα του σωματιδίου, είναι η πυκνότητα του σωματιδίου, 1 είναι η πυκνότητα του υγρού).
Αν n 1 και n 2 είναι οι συγκεντρώσεις σωματιδίων σε επίπεδα η 1 και η 2, α k = R / N ΕΝΑ , τότε

Εννοια Να, που ελήφθη από τα έργα του J. Perrin, αντιστοιχούσε στις τιμές που ελήφθησαν σε άλλα πειράματα, γεγονός που επιβεβαιώνει την εφαρμογή της κατανομής (45,4) στα Brownian σωματίδια.
Η μοριακή-κινητική θεωρία τεκμηριώνεται Ας δώσουμε μερικές από τις αποδείξεις της άτακτης χαοτικής κίνησης των μορίων: και την επιθυμία του αερίου να καταλάβει ολόκληρο τον όγκο που του παρέχεται, την εξάπλωση του μυρωδάτου αερίου σε όλο το δωμάτιο. β Η κίνηση Μπράουν είναι μια άτακτη κίνηση των μικρότερων σωματιδίων της ύλης που είναι ορατά σε ένα μικροσκόπιο σε αιωρούμενη κατάσταση και αδιάλυτα σε αυτό. Η διάχυση εκδηλώνεται σε όλα τα σώματα σε αέρια, υγρά και στερεά, αλλά σε διαφορετικό βαθμό. Η διάχυση σε αέρια μπορεί να παρατηρηθεί εάν ένα δοχείο με οσμή ...
Μοιραστείτε τη δουλειά σας στα κοινωνικά μέσα
Εάν αυτή η εργασία δεν σας ταιριάζει στο κάτω μέρος της σελίδας υπάρχει μια λίστα με παρόμοια έργα. Μπορείτε επίσης να χρησιμοποιήσετε το κουμπί αναζήτησης
ΠΕΙΡΑΜΑΤΙΚΗ ΥΠΟΒΑΘΜΙΣΗ ΜΟΡΙΑΚΟ-ΚΙΝΗΤΙΚΗΣ ΘΕΩΡΙΑΣ
Σύμφωνα με τη μοριακή -κινητική θεωρία, όλες οι ουσίες αποτελούνται από τα μικρότερα σωματίδια - μόρια. Τα μόρια βρίσκονται σε συνεχή κίνηση και αλληλεπιδρούν μεταξύ τους. Ένα μόριο είναι το μικρότερο σωματίδιο μιας ουσίας που έχει τις χημικές του ιδιότητες. Τα μόρια αποτελούνται από απλούστερα σωματίδια - άτομα χημικών στοιχείων. Τα μόρια διαφόρων ουσιών έχουν διαφορετικές ατομικές συνθέσεις.
Τα μόρια έχουν κινητική ενέργειαΕ συγγενής και ταυτόχρονα τη δυνητική ενέργεια αλληλεπίδρασηςΕ ιδρώτας ... Σε αέρια κατάσταση E kin> E ιδρώτας ... Σε υγρές και στερεές καταστάσεις, η κινητική ενέργεια των σωματιδίων είναι συγκρίσιμη με την ενέργεια της αλληλεπίδρασής τους.
Τρία βασικά σημεία μοριακή κινητική θεωρία:
1. Όλες οι ουσίες αποτελούνται από μόρια, δηλ. έχουν διακριτή δομή, τα μόρια χωρίζονται ανά διαστήματα.
2. Τα μόρια βρίσκονται σε συνεχή τυχαία (χαοτική) κίνηση.
3. Υπάρχουν δυνάμεις αλληλεπίδρασης μεταξύ των μορίων του σώματος.
Η μοριακή κινητική θεωρία τεκμηριώνεται
Ακολουθούν ορισμένα στοιχεία για την τυχαία (χαοτική) κίνηση μορίων:
α) την επιθυμία του αερίου να καταλάβει ολόκληρο τον όγκο που του παρέχεται (η εξάπλωση οσμών σε όλο το δωμάτιο)
β) Κίνηση Μπράουν - η ακανόνιστη κίνηση των μικρότερων σωματιδίων της ύλης που είναι ορατά σε ένα μικροσκόπιο, τα οποία είναι σε αιώρηση και αδιάλυτα σε αυτό. Αυτή η κίνηση συμβαίνει υπό την επίδραση τυχαίων επιπτώσεων μορίων που περιβάλλουν το υγρό, τα οποία βρίσκονται σε συνεχή χαοτική κίνηση.
γ) διάχυση - αμοιβαία διείσδυση μορίων παρακείμενων ουσιών. Κατά τη διάχυση, τα μόρια ενός σώματος, σε συνεχή κίνηση, διαπερνούν τα κενά μεταξύ των μορίων ενός άλλου σώματος που έρχονται σε επαφή με αυτό και εξαπλώνονται μεταξύ τους. Η διάχυση εκδηλώνεται σε όλα τα σώματα - σε αέρια, υγρά και στερεά - αλλά σε διαφορετικό βαθμό.
1. Διάχυση.
Η διάχυση σε αέρια μπορεί να παρατηρηθεί εάν ένα δοχείο με οσμή αερίου ανοίξει σε εσωτερικούς χώρους. Μετά από λίγο, το αέριο θα εξαπλωθεί σε όλο το δωμάτιο.
Η διάχυση στα υγρά είναι πολύ πιο αργή από ό, τι στα αέρια. Για παράδειγμα, ρίξτε ένα διάλυμα θειικού χαλκού σε ένα ποτήρι και στη συνέχεια προσθέστε πολύ προσεκτικά ένα στρώμα νερού και αφήστε το γυαλί σε ένα δωμάτιο με σταθερή θερμοκρασία και όπου δεν υπόκειται σε ανακίνηση. Μετά από λίγο, θα παρατηρήσουμε την εξαφάνιση του αιχμηρού ορίου μεταξύ βιτριόλης και νερού και μετά από λίγες ημέρες τα υγρά θα αναμειχθούν, παρά το γεγονός ότι η πυκνότητα του βιτριόλης είναι μεγαλύτερη από την πυκνότητα του νερού. Διαχέει επίσης νερό με αλκοόλ και άλλα υγρά.
Η διάχυση στα στερεά είναι ακόμη πιο αργή από ό, τι στα υγρά (από αρκετές ώρες έως αρκετά χρόνια). Μπορεί να παρατηρηθεί μόνο σε καλά εδαφικά σώματα, όταν οι αποστάσεις μεταξύ των επιφανειών των σωμάτων του εδάφους είναι κοντά στις αποστάσεις μεταξύ των μορίων (10-8 εκ). Σε αυτή την περίπτωση, ο ρυθμός διάχυσης αυξάνεται με την αύξηση της θερμοκρασίας και της πίεσης.
Στοιχεία για τη δυναμική αλληλεπίδραση μορίων:
α) παραμόρφωση σωμάτων υπό την επίδραση δύναμης ·
β) διατήρηση του σχήματος από στερεά.
γ) επιφανειακή τάση των υγρών και, κατά συνέπεια, το φαινόμενο της διαβροχής και της τριχοειδούς.
Υπάρχουν ταυτόχρονα ελκυστικές και απωθητικές δυνάμεις μεταξύ των μορίων (Εικ. 1). Σε μικρές αποστάσεις μεταξύ μορίων, επικρατούν απωθητικές δυνάμεις. Καθώς η απόσταση r μεταξύ των μορίων αυξάνεται, τόσο οι δυνάμεις έλξης όσο και οι δυνάμεις απώθησης μειώνονται και οι δυνάμεις απώθησης μειώνονται γρηγορότερα. Επομένως, για κάποια τιμή του r 0 (απόσταση μεταξύ μορίων) οι δυνάμεις έλξης και οι απωθητικές δυνάμεις είναι αμοιβαία ισορροπημένες.
Ρύζι. 1 Δυνάμεις έλξης και δυνάμεις απώθησης.
Εάν συμφωνήσουμε να αποδώσουμε ένα θετικό πρόσημο σε απωθητικές δυνάμεις και ένα αρνητικό πρόσημο σε δυνάμεις έλξης και κάνουμε μια αλγεβρική προσθήκη των δυνάμεων της απώθησης και της έλξης, τότε έχουμε το γράφημα που φαίνεται στο Σχήμα 2.

Ρύζι. 2 Αλγεβρική προσθήκη των δυνάμεων της απώθησης και της έλξης.

Ρύζι. 3 Εξάρτηση της δυνητικής ενέργειας αλληλεπίδρασης μορίων από την απόσταση μεταξύ τους.
Το σχήμα 3 δείχνει μια γραφική παράσταση της εξάρτησης της δυνητικής ενέργειας αλληλεπίδρασης μορίων από την απόσταση μεταξύ τους. Απόσταση r 0 μεταξύ των μορίων αντιστοιχεί στο ελάχιστο της δυνητικής τους ενέργειας (Εικ. 3). Για να αλλάξετε την απόσταση μεταξύ των μορίων προς τη μία ή την άλλη κατεύθυνση, απαιτείται να ξοδέψετε εργασία ενάντια στις επικρατούσες δυνάμεις έλξης ή απώθησης. Σε μικρότερες αποστάσεις (Εικ. 2), η καμπύλη ανεβαίνει απότομα. αυτή η περιοχή αντιστοιχεί σε μια ισχυρή απώθηση μορίων (που οφείλεται κυρίως στην απώθηση του Coulomb των πυρήνων που πλησιάζουν). Σε μεγάλες αποστάσεις, τα μόρια έλκονται.
Απόσταση r 0 αντιστοιχεί σε μια σταθερή ισορροπία αμοιβαία θέση μορίων. Το σχήμα 2 δείχνει ότι με την αύξηση της απόστασης μεταξύ των μορίων, οι δυνάμεις έλξης που επικρατούν αποκαθιστούν τη θέση ισορροπίας και με μείωση της απόστασης μεταξύ τους, αποκαθίσταται η ισορροπία από τις επικρατούσες αποκρουστικές δυνάμεις.
Σύγχρονες πειραματικές μέθοδοι της φυσικής (δομική ανάλυση ακτίνων Χ, παρατήρηση με ηλεκτρονικό μικροσκόπιο κ.λπ.) επέτρεψαν την παρατήρηση της μικροδομής των ουσιών.
2. Αριθμός Avogadro.
Ο αριθμός γραμμαρίων μιας ουσίας ίσης με το μοριακό βάρος αυτής της ουσίας ονομάζεται γραμμομόριο ή γραμμομόριο. Για παράδειγμα, 2 g υδρογόνου είναι γραμμάριο υδρογόνου. 32 γραμμάρια οξυγόνου αποτελούν ένα γραμμάριο οξυγόνου. Η μάζα ενός γραμμομορίου μιας ουσίας ονομάζεται μοριακή μάζα αυτής της ουσίας.
Συμβολίζεται μεΜ. Για το υδρογόνο ![]() ? για οξυγόνο
? για οξυγόνο ![]() ? για το άζωτο
? για το άζωτο ![]() και τα λοιπά.
και τα λοιπά.
Ο αριθμός των μορίων που περιέχονται σε ένα mole διαφορετικών ουσιών είναι ο ίδιος και ονομάζεται αριθμός Avogadro (ΝΕΝΑ).
![]()
Ο αριθμός του Avogadro είναι εξαιρετικά μεγάλος. Για να νιώσετε την κολοσσιαία φύση του, φανταστείτε ότι ένας αριθμός κεφαλών καρφιτσών (το καθένα περίπου 1 mm σε διάμετρο), ίσος με τον αριθμό του Avogadro, χύθηκε στη Μαύρη Θάλασσα. Ταυτόχρονα, θα αποδειχθεί ότι δεν υπάρχει πλέον χώρος για νερό στη Μαύρη Θάλασσα: δεν θα γεμίζει μόνο μέχρι το χείλος, αλλά και με ένα μεγάλο πλεόνασμα, με αυτές τις κεφαλές πείρου. Ένας αβογκαντρικός αριθμός κεφαλών καρφιτσών θα μπορούσε να καλύψει μια περιοχή ίση, για παράδειγμα, με το έδαφος της Γαλλίας, με ένα στρώμα πάχους περίπου 1 χλμ. Και ένας τόσο τεράστιος αριθμός μεμονωμένων μορίων περιέχονται μόνο σε 18 g νερού. σε 2 g υδρογόνου κ.λπ.
Διαπιστώθηκε ότι σε 1 εκατοστό 3 οποιοδήποτε αέριο υπό κανονικές συνθήκες (δηλ. στο 0 0 C και πίεση 760 mm. rt Άρθρ.) Περιέχει 2.710 19 μόρια.
Αν πάρουμε τον αριθμό των τούβλων ίσο με αυτόν τον αριθμό, τότε, όταν είναι πυκνά συσκευασμένα, αυτά τα τούβλα θα καλύπτουν ολόκληρη την επιφάνεια της γης με ένα στρώμα ύψους 120 μ. Η κινητική θεωρία των αερίων επιτρέπει τον υπολογισμό μόνο της μέσης ελεύθερης διαδρομής ενός αερίου μόριο (δηλαδή μόριο από σύγκρουση σε σύγκρουση με άλλα μόρια) και τη διάμετρο του μορίου.
Εδώ είναι μερικά από τα αποτελέσματα αυτών των υπολογισμών.
|
Ουσία |
Ελεύθερο μήκος διαδρομής στα 760 mm Hg |
Διάμετρος μορίου |
|
Υδρογόνο Η 2 |
1,12310 -5 εκ |
2.310 -8 εκ |
|
Οξυγόνο Ο 2 |
0,64710 -5 εκ |
2,910 -8 εκ |
|
Άζωτο Ν 2 |
0.59910 -5 εκ |
3,110 -8 εκ |
Οι διάμετροι μεμονωμένων μορίων είναι μικρές τιμές. Σε μεγέθυνση ενός εκατομμυρίου φορές, τα μόρια θα έχουν το μέγεθος μιας κουκκίδας στην γραμματοσειρά αυτού του βιβλίου. Ας δηλώσουμε με m - τη μάζα ενός αερίου (οποιασδήποτε ουσίας). Μετά η στάσηδίνει τον αριθμό των γραμμομορίων αερίου.
Ο αριθμός των μορίων αερίου n μπορεί να εκφραστεί:
(1).
Ο αριθμός των μορίων ανά μονάδα όγκου n 0 θα είναι ίσο με:
(2), όπου: V - όγκος αερίου.
Η μάζα ενός μορίου m 0 μπορεί να καθοριστεί με τον τύπο:
 (3) .
(3) .
Η σχετική μάζα του μορίου mσχετ ονομάζεται ποσότητα ίση με την αναλογία της απόλυτης μάζας του μορίου m 0 στο 1/12 της μάζας ενός ατόμου άνθρακα m oc.
 (4), όπου m oc = 210 -26 kg.
(4), όπου m oc = 210 -26 kg.
3. Ιδανική εξίσωση αερίου και ισοεπεξεργασίες.
Χρησιμοποιώντας την εξίσωση κατάστασης για ένα ιδανικό αέριο, είναι δυνατόν να μελετηθούν διαδικασίες στις οποίες η μάζα του αερίου και μία από τις τρεις παραμέτρους - πίεση, όγκος ή θερμοκρασία - παραμένουν αμετάβλητες. Οι ποσοτικές σχέσεις μεταξύ δύο παραμέτρων αερίου σε σταθερή τιμή της τρίτης παραμέτρου ονομάζονται νόμοι αερίου.
Οι διαδικασίες που προχωρούν με την αμετάβλητη τιμή μιας από τις παραμέτρους ονομάζονται ισοεπεξεργασίες (από το ελληνικό "isos" - ίσες). Είναι αλήθεια ότι στην πραγματικότητα, καμία διαδικασία δεν μπορεί να προχωρήσει με μια αυστηρά καθορισμένη τιμή οποιασδήποτε παραμέτρου. Υπάρχουν πάντα ορισμένες επιρροές που παραβιάζουν τη σταθερότητα της θερμοκρασίας, της πίεσης ή του όγκου. Μόνο υπό εργαστηριακές συνθήκες είναι δυνατόν να διατηρηθεί η σταθερότητα αυτής ή εκείνης της παραμέτρου με καλή ακρίβεια, αλλά στη λειτουργία τεχνικών συσκευών και στη φύση αυτό είναι πρακτικά αδύνατο.
Η ισοεπεξεργασία είναι ένα εξιδανικευμένο μοντέλο μιας πραγματικής διαδικασίας που αντικατοπτρίζει μόνο κατά προσέγγιση την πραγματικότητα.
Η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος μακροσκοπικών σωμάτων σε σταθερή θερμοκρασία ονομάζεται ισοθερμική.
Για να διατηρείται σταθερή η θερμοκρασία του αερίου, είναι απαραίτητο να μπορεί να ανταλλάξει θερμότητα με ένα μεγάλο σύστημα - έναν θερμοστάτη. Διαφορετικά, η θερμοκρασία του αερίου θα αλλάξει κατά τη διάρκεια της συμπίεσης ή της διαστολής. Ο ατμοσφαιρικός αέρας μπορεί να χρησιμεύσει ως θερμοστάτης εάν η θερμοκρασία του δεν αλλάξει αισθητά σε όλη τη διαδικασία.
Σύμφωνα με την εξίσωση κατάστασης ενός ιδανικού αερίου σε οποιαδήποτε κατάσταση με σταθερή θερμοκρασία, το γινόμενο της πίεσης του αερίου και ο όγκος του παραμένει σταθερό: pV = const στο T = const. Για ένα αέριο μιας δεδομένης μάζας, το γινόμενο της πίεσης του αερίου και του όγκου του είναι σταθερό εάν η θερμοκρασία του αερίου δεν αλλάξει.
Ο νόμος αυτός ανακαλύφθηκε πειραματικά από τον Άγγλο επιστήμονα R. Boiler (1627-1691) και κάπως αργότερα από τον Γάλλο επιστήμονα E Mariotte (1620-1684). Ως εκ τούτου, ονομάζεται νόμος Boyle-Mariotte.
Ο νόμος του Boyle - Η Mariotte ισχύει για τυχόν αέρια, καθώς και για τα μείγματά τους, για παράδειγμα, για τον αέρα. Μόνο σε πιέσεις αρκετές εκατοντάδες φορές υψηλότερες από τις ατμοσφαιρικές, η απόκλιση από αυτόν τον νόμο γίνεται σημαντική.
Η εξάρτηση της πίεσης του αερίου από τον όγκο σε μια σταθερή θερμοκρασία απεικονίζεται γραφικά από μια καμπύλη που ονομάζεται ισόθερμη. Η ισοθερμία αερίου απεικονίζει την αντίστροφη σχέση μεταξύ πίεσης και όγκου. Μια καμπύλη αυτού του είδους ονομάζεται υπερβολή στα μαθηματικά.
Διαφορετικές ισόθερμες αντιστοιχούν σε διαφορετικές σταθερές θερμοκρασίες. Καθώς η θερμοκρασία αυξάνεται, η πίεση σύμφωνα με την εξίσωση της κατάστασης αυξάνεται εάν V = const. Επομένως, η ισόθερμη που αντιστοιχεί σε υψηλότερη θερμοκρασία Τ 2 , βρίσκεται πάνω από την ισόθερμη που αντιστοιχεί σε χαμηλότερη θερμοκρασία Τ 1 .
Μια ισοθερμική διαδικασία μπορεί να θεωρηθεί περίπου ως η διαδικασία της αργής συμπίεσης του αέρα όταν το αέριο διαστέλλεται κάτω από το έμβολο της αντλίας όταν αντλείται έξω από το δοχείο. Είναι αλήθεια ότι η θερμοκρασία του αερίου αλλάζει σε αυτή την περίπτωση, αλλά στην πρώτη προσέγγιση αυτή η αλλαγή μπορεί να αγνοηθεί.
Η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερή πίεση ονομάζεται ισοβαρική (από το ελληνικό "baros" - βάρος, βάρος).
Σύμφωνα με την εξίσωση, σε οποιαδήποτε κατάσταση αερίου με σταθερή πίεση, ο λόγος του όγκου του αερίου προς τη θερμοκρασία του παραμένει σταθερός: = const σε p = const.
Για ένα αέριο μιας δεδομένης μάζας, η αναλογία όγκου προς θερμοκρασία είναι σταθερή εάν η πίεση του αερίου δεν αλλάξει.
Ο νόμος αυτός θεσπίστηκε πειραματικά το 1802 από τον Γάλλο επιστήμονα J. Gay-Lussac (1778-1850) και ονομάζεται νόμος Gay-Lussac.
Σύμφωνα με την εξίσωση, ο όγκος του αερίου εξαρτάται γραμμικά από τη θερμοκρασία σε σταθερή πίεση: V = const T.
Αυτή η εξάρτηση απεικονίζεται γραφικά με μια ευθεία γραμμή, η οποία ονομάζεται ισομπάρα. Διαφορετικές ισοβάστες αντιστοιχούν σε διαφορετικές πιέσεις. Με την αύξηση της πίεσης, ο όγκος του αερίου σε σταθερή θερμοκρασία μειώνεται σύμφωνα με τον νόμο Boyle-Mariotte. Επομένως, η ισοβάρα που αντιστοιχεί στην υψηλότερη πίεση p 2 , βρίσκεται κάτω από την ισοβάρα που αντιστοιχεί στη χαμηλότερη πίεση p 1 .
Σε χαμηλές θερμοκρασίες, όλες οι ιδανικές ισοβάστες αερίου συγκλίνουν στο σημείο T = 0. Αλλά αυτό δεν σημαίνει ότι ο όγκος του πραγματικού αερίου εξαφανίζεται πραγματικά. Όλα τα αέρια μετατρέπονται σε υγρό με ισχυρή ψύξη και η εξίσωση της κατάστασης δεν εφαρμόζεται στα υγρά.
Η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερό όγκο ονομάζεται ισοχορική (από το ελληνικό "χορέμα" - χωρητικότητα).
Από την εξίσωση κατάστασης προκύπτει ότι σε οποιαδήποτε κατάσταση αερίου με σταθερό όγκο, ο λόγος πίεσης αερίου προς τη θερμοκρασία του παραμένει αμετάβλητος: = const σε V = const.
Για ένα αέριο μιας δεδομένης μάζας, η αναλογία πίεσης προς θερμοκρασία είναι σταθερή αν ο όγκος δεν αλλάξει.
Αυτός ο νόμος για το αέριο θεσπίστηκε το 1787 από τον Γάλλο φυσικό J. Charles (1746 - 1823) και ονομάζεται νόμος του Καρόλου. Σύμφωνα με την εξίσωση:
Const σε V = const της πίεσης του αερίου εξαρτάται γραμμικά από τη θερμοκρασία σε σταθερό όγκο: p = const T.
Αυτή η εξάρτηση απεικονίζεται με μια ευθεία γραμμή, που ονομάζεται ισοχόρεια.
Διαφορετικοί ισοχώροι αντιστοιχούν σε διαφορετικούς όγκους. Με αύξηση του όγκου του αερίου σε σταθερή θερμοκρασία, η πίεσή του μειώνεται σύμφωνα με τον νόμο Boyle-Mariotte. Επομένως, η ισόχωρα που αντιστοιχεί σε μεγαλύτερο όγκο V 2 , βρίσκεται κάτω από την ισόχωρα που αντιστοιχεί στον μικρότερο όγκο V 1 .
Σύμφωνα με την εξίσωση, όλες οι ισοχορδές ξεκινούν στο σημείο T = 0.
Αυτό σημαίνει ότι η πίεση ενός ιδανικού αερίου στο απόλυτο μηδέν είναι μηδέν.
Η αύξηση της πίεσης του αερίου σε οποιοδήποτε δοχείο ή σε ένα λαμπτήρα όταν θερμαίνεται είναι μια ισοχορική διαδικασία. Η ισοχωρική διαδικασία χρησιμοποιείται σε θερμοστάτες αερίου σταθερού όγκου.
4. Θερμοκρασία.
Κάθε μακροσκοπικό σώμα ή ομάδα μακροσκοπικών σωμάτων ονομάζεται θερμοδυναμικό σύστημα.
Η θερμική ή θερμοδυναμική ισορροπία είναι μια κατάσταση ενός θερμοδυναμικού συστήματος στην οποία όλες οι μακροσκοπικές του παράμετροι παραμένουν αμετάβλητες: όγκος, πίεση δεν αλλάζει, δεν πραγματοποιείται ανταλλαγή θερμότητας, δεν υπάρχουν μεταβάσεις από μία κατάσταση συσσωμάτωσης σε άλλη κ.λπ. Υπό σταθερές εξωτερικές συνθήκες, κάθε θερμοδυναμικό σύστημα περνά αυθόρμητα σε κατάσταση θερμικής ισορροπίας.
Η θερμοκρασία είναι μια φυσική ποσότητα που χαρακτηρίζει την κατάσταση της θερμικής ισορροπίας ενός συστήματος σωμάτων: όλα τα σώματα του συστήματος, τα οποία βρίσκονται σε θερμική ισορροπία μεταξύ τους, έχουν την ίδια θερμοκρασία.
Η απόλυτη μηδενική θερμοκρασία είναι η περιοριστική θερμοκρασία στην οποία η πίεση ενός ιδανικού αερίου σε σταθερό όγκο πρέπει να είναι μηδέν ή ο όγκος ενός ιδανικού αερίου σε σταθερή πίεση πρέπει να είναι ίσος με μηδέν.
Το θερμόμετρο είναι μια συσκευή για τη μέτρηση της θερμοκρασίας. Συνήθως, τα θερμόμετρα βαθμονομούνται σε κλίμακα Κελσίου: η θερμοκρασία κρυστάλλωσης του νερού (τήξη πάγου) αντιστοιχεί σε 0 ° C και το σημείο βρασμού του είναι 100 ° C.
Ο Κέλβιν εισήγαγε μια απόλυτη κλίμακα θερμοκρασίας, σύμφωνα με την οποία η μηδενική θερμοκρασία αντιστοιχεί στο απόλυτο μηδέν, η μονάδα μέτρησης της θερμοκρασίας στην κλίμακα Κέλβιν είναι ίση με βαθμούς Κελσίου: [Τ] = 1 Κ (Κέλβιν).
Σχέση μεταξύ θερμοκρασίας σε μονάδες ενέργειας και θερμοκρασίας σε Kelvin:
όπου k = 1,38 * 10 -23 Το J / K είναι η σταθερά του Boltzmann.
Σχέση μεταξύ της απόλυτης κλίμακας και της κλίμακας Κελσίου:
T = t + 273, όπου t - θερμοκρασία σε βαθμούς Κελσίου.
Η μέση κινητική ενέργεια της χαοτικής κίνησης των μορίων του αερίου είναι ανάλογη με την απόλυτη θερμοκρασία:
Λαμβάνοντας υπόψη την ισότητα (1), η βασική εξίσωση της μοριακής κινητικής θεωρίας μπορεί να γραφτεί ως εξής: p = nkT.
Βασικές εξισώσεις της μοριακής-κινητικής θεωρίας του ιδανικού αερίου για πίεση.
Ένα αέριο ονομάζεται ιδανικό εάν:
1) ο εγγενής όγκος μορίων αερίου είναι αμελητέος σε σύγκριση με τον όγκο του δοχείου.
2) δεν υπάρχουν δυνάμεις αλληλεπίδρασης μεταξύ μορίων αερίου.
3) οι συγκρούσεις μορίων αερίου με τα τοιχώματα του αγγείου είναι απολύτως ελαστικές.
Τα πραγματικά αέρια (για παράδειγμα, οξυγόνο και ήλιο) υπό συνθήκες κοντά στο φυσιολογικό, καθώς και σε χαμηλές πιέσεις και υψηλές θερμοκρασίες είναι κοντά στα ιδανικά αέρια. Τα σωματίδια του ιδανικού αερίου στα διαστήματα μεταξύ των συγκρούσεων κινούνται ομοιόμορφα και ευθύγραμμα. Η πίεση αερίου στα τοιχώματα του δοχείου μπορεί να θεωρηθεί ως μια σειρά ταχέως επακόλουθων επιπτώσεων μορίων αερίου στον τοίχο. Ας δούμε πώς να υπολογίσουμε την πίεση που προκαλείται από μεμονωμένες επιπτώσεις. Ας φανταστούμε ότι μια σειρά ξεχωριστών και συχνών χτυπημάτων συμβαίνει σε μια συγκεκριμένη επιφάνεια. Ας βρούμε μια τέτοια μέση σταθερή δύναμη
Όπου t 1, t 2, t 3 ... t n - ο χρόνος αλληλεπίδρασης του πρώτου, δεύτερου, ..., ν-ου μορίου με το τοίχωμα (δηλαδή τη διάρκεια της πρόσκρουσης) · φά 1, f 2, f 3 ... f n - τις δυνάμεις πρόσκρουσης των μορίων στον τοίχο. Αυτός ο τύπος συνεπάγεται:
![]() (7).
(7).
Η μέση δύναμη πίεσης που προκαλείται από έναν αριθμό επιμέρους κρούσεων σε μια συγκεκριμένη επιφάνεια είναι αριθμητικά ίση με το άθροισμα των παλμών όλων των επιπτώσεων που δέχεται αυτή η επιφάνεια ανά μονάδα χρόνου ονομάζεται ισοχώρος.
5. Ταχύτητες μορίων αερίου.
Ο τύπος (12) μπορεί να γραφτεί ως εξής:
(15), όπου (μάζα αερίου).
Από την έκφραση (15), υπολογίζουμε τη μέση τετραγωνική ταχύτητα των μορίων του αερίου:
(16) .
Γνωρίζοντας ότι (R-καθολική σταθερά αερίου · R = 8,31), αποκτούμε νέες εκφράσεις για τον προσδιορισμό
 (17) .
(17) .
Ο πειραματικός προσδιορισμός των ταχυτήτων κίνησης των μορίων ατμών αργύρου πραγματοποιήθηκε για πρώτη φορά το 1920 από τον Stern.

Ρύζι. 5. Η εμπειρία του Στερν.
Ο αέρας αντλήθηκε από τον γυάλινο κύλινδρο Ε (Εικ. 5). Μέσα σε αυτόν τον κύλινδρο τοποθετήθηκε ένας δεύτερος κύλινδρος D, ο οποίος έχει έναν κοινό άξονα Ο μαζί του. Κατά μήκος της γενιάς του κυλίνδρου D υπήρχε μια σχισμή με τη μορφή μιας στενής σχισμής C. Ένα ασημένιο επιχρυσωμένο σύρμα τεντώθηκε κατά μήκος του άξονα, μέσω του οποίου θα μπορούσε να περάσει το ρεύμα. Ταυτόχρονα, το σύρμα θερμάνθηκε και το ασήμι από την επιφάνειά του μετατράπηκε σε ατμό. Τα μόρια ατμού αργύρου διασκορπίστηκαν σε διαφορετικές κατευθύνσεις, μερικά από αυτά πέρασαν μέσα από την εγκοπή C του κυλίνδρου D και στην εσωτερική επιφάνεια του κυλίνδρου Ε επιτεύχθηκε επίστρωση αργύρου με τη μορφή μιας στενής λωρίδας. Στο σχ. 5, η θέση της ασημένιας λωρίδας σημειώνεται με το γράμμα Α.
Όταν ολόκληρο το σύστημα τέθηκε σε πολύ γρήγορη κίνηση με τέτοιο τρόπο ώστε το σύρμα να ήταν ο άξονας περιστροφής, τότε η λωρίδα Α στον κύλινδρο Ε αποδείχθηκε ότι μετατοπίστηκε στο πλάι, δηλ. για παράδειγμα, όχι στο σημείο Α, αλλά στο σημείο Β. Αυτό συνέβη επειδή ενώ τα μόρια αργύρου πετούσαν στο μονοπάτι CA, το σημείο Α του κυλίνδρου Ε είχε χρόνο να γυρίσει μια απόσταση ΑΒ και τα μόρια αργύρου δεν έπεσαν στο σημείο Α, αλλά στο σημείο ΣΙ.
Ας ορίσουμε την τιμή της μετατόπισης της ασημένιας λωρίδας AB = d? η ακτίνα του κυλίνδρου E έως R, η ακτίνα του κυλίνδρου D έως r και ο αριθμός περιστροφών ολόκληρου του συστήματος ανά δευτερόλεπτο μέσων
Σε μια περιστροφή του συστήματος, το σημείο Α στην επιφάνεια του κυλίνδρου Ε θα καλύψει μια διαδρομή ίση με την περιφέρεια 2πR και σε 1 δευτερόλεπτο θα καλύψει μια απόσταση... Ο χρόνος t, κατά τον οποίο το σημείο Α μετακινήθηκε στην απόσταση AB = d, θα είναι ίσος με:... Κατά τη διάρκεια του χρόνου t, τα μόρια ατμού αργύρου πέταξαν σε απόσταση CA = R - r ... Η ταχύτητα της κίνησής τους v μπορεί να βρεθεί ως η διανυόμενη απόσταση διαιρούμενη με το χρόνο:ή, αντικαθιστώντας το t, παίρνουμε:![]() .
.
Η επίστρωση αργύρου στο τοίχωμα του κυλίνδρου D αποδείχθηκε θολή, γεγονός που επιβεβαίωσε την παρουσία διαφορετικών ταχυτήτων μοριακής κίνησης Από το πείραμα, ήταν δυνατό να προσδιοριστεί η πιο πιθανή ταχύτητα v ver που αντιστοιχούσε στο μεγαλύτερο πάχος της επένδυσης αργύρου.
Η πιο πιθανή ταχύτητα μπορεί να υπολογιστεί χρησιμοποιώντας τον τύπο που δίνει ο Maxwell:(δεκαοχτώ). Σύμφωνα με τους υπολογισμούς του Maxwell, η μέση αριθμητική ταχύτητα κίνησης των μορίων είναι: (19).
(19).
6. Η εξίσωση κατάστασης ενός ιδανικού αερίου - η εξίσωση Mendeleev -Clapeyron.
Από τη βασική εξίσωση της μοριακής κινητικής θεωρίας (ο τύπος (14) ακολουθεί τον νόμο του Avogadro: ίσοι όγκοι ανόμοιων αερίων υπό τις ίδιες συνθήκες (η ίδια θερμοκρασία και η ίδια πίεση) περιέχουν τον ίδιο αριθμό μορίων:(για ένα αέριο),(για άλλο αέριο).
Αν V 1 = V 2? Τ 1 = Τ 2; r 1 = r 2, στη συνέχεια n 01 = n 02.
Θυμηθείτε ότι η μονάδα της ποσότητας μιας ουσίας στο σύστημα SI είναι η γραμμομοριακή μάζα (γραμμομόριο)Μ ένα γραμμομόριο μιας ουσίας ονομάζεται μοριακή μάζα αυτής της ουσίας. Ο αριθμός των μορίων που περιέχονται σε ένα mole διαφορετικών ουσιών είναι ο ίδιος και ονομάζεται αριθμός Avogadro (ΝΑ = 6,0210 23 1 / mol).
Ας γράψουμε την εξίσωση κατάστασης για ένα ιδανικό αέριο για ένα γραμμομόριο:, όπου V m - ο όγκος ενός γραμμομορίου αερίου ·, όπου V m - ο όγκος ενός γραμμομορίου αερίου · (καθολική σταθερά αερίου).
Τέλος, έχουμε: (26).
Η εξίσωση (26) ονομάζεται εξίσωση Clapeyron (για ένα γραμμομόριο αερίου). Υπό κανονικές συνθήκες (p = 1.01310 5 Pa και Τ = 273,15 0 Κ) γραμμομοριακός όγκος οποιουδήποτε αερίου V m = 22.410 -3 ... Από τον τύπο (26) ορίζουμε;
![]() .
.
Από την εξίσωση (26) για ένα γραμμομόριο αερίου, μπορείτε να μεταβείτε στην εξίσωση Mendeleev-Clapeyron για οποιαδήποτε μάζα αερίου m.
Συμπεριφορά δίνει τον αριθμό των γραμμομορίων αερίου. Η αριστερή και η δεξιά πλευρά της ανισότητας (26) πολλαπλασιάζονται με.
Εχουμε  , πού είναι ο όγκος του αερίου.
, πού είναι ο όγκος του αερίου.
Ας γράψουμε επιτέλους: (27 ) ... Η εξίσωση (27) είναι η εξίσωση Mendeleev-Clapeyron. Η πυκνότητα αερίου μπορεί να εισαχθεί σε αυτήν την εξίσωσηκαι .
Στον τύπο (27), αντικαθιστούμε το V και λαμβάνουμεή .
7. Έμπειροι νόμοι για το φυσικό αέριο. Πίεση μείγματος ιδανικών αερίων (νόμος του Ντάλτον).
Πειραματικά, πολύ πριν την εμφάνιση της μοριακής-κινητικής θεωρίας, ανακαλύφθηκε ένας αριθμός νόμων που περιγράφουν ισοεπεξεργασίες ισορροπίας σε ένα ιδανικό αέριο. Η ισοεπεξεργασία είναι μια διαδικασία ισορροπίας στην οποία μία από τις παραμέτρους κατάστασης δεν αλλάζει (σταθερά). Υπάρχουν ισοθερμικές (Τ = const), ισοβαρικές (p = const), ισοχρονικές (V = const) ισοεπεξεργασίες. Η ισοθερμική διαδικασία περιγράφεται από τον νόμο Boyle-Mariotte: "εάν κατά τη διάρκεια της διαδικασίας η μάζα και η θερμοκρασία ενός ιδανικού αερίου δεν αλλάζουν, τότε το γινόμενο της πίεσης του αερίου και του όγκου του είναι σταθερό PV = const (29). Μια γραφική αναπαράσταση μιας εξίσωσης κατάστασης ονομάζεται διάγραμμα κατάστασης. Στην περίπτωση των ισοεργασιών, τα διαγράμματα κατάστασης απεικονίζονται ως δισδιάστατες (επίπεδες) καμπύλες και ονομάζονται ισόθερμες, ισοβαρές και ισοχώρες, αντίστοιχα.
Οι ισοθερμίες που αντιστοιχούν σε δύο διαφορετικές θερμοκρασίες φαίνονται στο Σχ. 6



Ρύζι. 6 Ισοθερμίες που αντιστοιχούν σε δύο διαφορετικές θερμοκρασίες.
Η ισοβαρική διαδικασία περιγράφεται από τον νόμο Gay-Lussac: "εάν κατά τη διάρκεια της διαδικασίας η πίεση και η μάζα ενός ιδανικού αερίου δεν αλλάζουν, τότε ο λόγος του όγκου του αερίου προς την απόλυτη θερμοκρασία του είναι μια σταθερή τιμή:(30).
Οι Ισομπαρές που αντιστοιχούν σε δύο διαφορετικές πιέσεις φαίνονται στο Σχ. 7.



Ρύζι. 7 Isobars που αντιστοιχούν σε δύο διαφορετικές πιέσεις.
Η εξίσωση της ισοβαρικής διαδικασίας μπορεί να γραφτεί διαφορετικά:![]() 31), όπου V 0 - όγκος αερίου στο 0 0 C; V t - όγκος αερίου σε t 0
ΝΤΟ; t είναι η θερμοκρασία του αερίου σε βαθμούς Κελσίου.α
είναι ο συντελεστής ογκομετρικής διαστολής. Από τον τύπο (31) προκύπτει ότι... Τα πειράματα του Γάλλου φυσικού Gay-Lussac (1802) έδειξαν ότι οι συντελεστές ογκομετρικής διαστολής όλων των τύπων αερίων είναι οι ίδιοι και, δηλ. όταν θερμανθεί κατά 1 0
Το αέριο C αυξάνει τον όγκο του κατά ένα κλάσμα του όγκου που καταλάμβανε στο 0 0
Γ. Στο σχ. 8 δείχνει ένα γράφημα της εξάρτησης του όγκου αερίου Vτ στη θερμοκρασία t 0 C.
31), όπου V 0 - όγκος αερίου στο 0 0 C; V t - όγκος αερίου σε t 0
ΝΤΟ; t είναι η θερμοκρασία του αερίου σε βαθμούς Κελσίου.α
είναι ο συντελεστής ογκομετρικής διαστολής. Από τον τύπο (31) προκύπτει ότι... Τα πειράματα του Γάλλου φυσικού Gay-Lussac (1802) έδειξαν ότι οι συντελεστές ογκομετρικής διαστολής όλων των τύπων αερίων είναι οι ίδιοι και, δηλ. όταν θερμανθεί κατά 1 0
Το αέριο C αυξάνει τον όγκο του κατά ένα κλάσμα του όγκου που καταλάμβανε στο 0 0
Γ. Στο σχ. 8 δείχνει ένα γράφημα της εξάρτησης του όγκου αερίου Vτ στη θερμοκρασία t 0 C.

Ρύζι. οκτώ. Το γράφημα της εξάρτησης του όγκου του αερίου Vτ στη θερμοκρασία t 0 C.
Η ισοχωρική διαδικασία περιγράφεται από τον νόμο του Charles: "εάν κατά τη διάρκεια της διαδικασίας ο όγκος και η μάζα ενός ιδανικού αερίου δεν αλλάξουν, τότε ο λόγος της πίεσης του αερίου προς την απόλυτη θερμοκρασία του είναι μια σταθερή τιμή:
(32).
Οι ισοχορδές που αντιστοιχούν σε δύο διαφορετικούς όγκους φαίνονται στο Σχ. εννέα.



Ρύζι. εννέα. Ισοχώρια που αντιστοιχούν σε δύο διαφορετικούς τόμους.
Η εξίσωση της ισοχορικής διαδικασίας μπορεί να γραφτεί διαφορετικά:![]() (33), όπου - πίεση αερίου στοΜΕ; - πίεση αερίου στο t, t είναι η θερμοκρασία του αερίου σε βαθμούς Κελσίου.- συντελεστής πίεσης θερμοκρασίας. Από τον τύπο (33) προκύπτει ότι... Για όλα τα αέρια και
(33), όπου - πίεση αερίου στοΜΕ; - πίεση αερίου στο t, t είναι η θερμοκρασία του αερίου σε βαθμούς Κελσίου.- συντελεστής πίεσης θερμοκρασίας. Από τον τύπο (33) προκύπτει ότι... Για όλα τα αέρια και ![]() ... Εάν το αέριο θερμανθεί σεС (στο V = const), τότε η πίεση του αερίου θα αυξηθεί κατάμέρος της πίεσης που είχεΓ. Το σχήμα 10 δείχνει ένα γράφημα της πίεσης του αερίου έναντι της θερμοκρασίας t.
... Εάν το αέριο θερμανθεί σεС (στο V = const), τότε η πίεση του αερίου θα αυξηθεί κατάμέρος της πίεσης που είχεΓ. Το σχήμα 10 δείχνει ένα γράφημα της πίεσης του αερίου έναντι της θερμοκρασίας t.

Ρύζι. δέκα. Το γράφημα της εξάρτησης της πίεσης του αερίου από τη θερμοκρασία t.
Αν συνεχίσουμε τη γραμμή ΑΒ στη διασταύρωσή της με τον άξονα x (σημείο), τότε η τιμή αυτής της τετμημένης καθορίζεται από τον τύπο (33), εάνισοδυναμεί με μηδέν.
![]() ;
;
Επομένως, σε θερμοκρασίαη πίεση του αερίου θα έπρεπε να είχε εξαφανιστεί, ωστόσο, με τέτοια ψύξη, το αέριο δεν θα διατηρήσει την αέρια του κατάσταση, αλλά θα μετατραπεί σε υγρό και ακόμη και σε στερεό. Θερμοκρασίαονομάζεται απόλυτο μηδέν.
Στην περίπτωση ενός μηχανικού μείγματος αερίων που δεν εισέρχονται σε χημικές αντιδράσεις, η πίεση του μίγματος καθορίζεται επίσης από τον τύπο![]() , όπου (συγκέντρωση μίγματοςείναι ίσο με το άθροισμα των συγκεντρώσεων των συστατικών του μείγματος, μόνο n - συστατικά).
, όπου (συγκέντρωση μίγματοςείναι ίσο με το άθροισμα των συγκεντρώσεων των συστατικών του μείγματος, μόνο n - συστατικά).
Ο νόμος του Ντάλτον αναφέρει: Πίεση μίγματοςίσο με το άθροισμα των μερικών πιέσεων των αερίων που σχηματίζουν το μείγμα.... Πίεση ![]() ονομάζεται μερική. Η μερική πίεση είναι η πίεση που θα δημιουργούσε ένα δεδομένο αέριο εάν καταλάμβανε μόνο του το δοχείο στο οποίο βρίσκεται το μείγμα (στην ίδια ποσότητα στην οποία περιέχεται στο μίγμα).
ονομάζεται μερική. Η μερική πίεση είναι η πίεση που θα δημιουργούσε ένα δεδομένο αέριο εάν καταλάμβανε μόνο του το δοχείο στο οποίο βρίσκεται το μείγμα (στην ίδια ποσότητα στην οποία περιέχεται στο μίγμα).
ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Brychkov Yu.A., Marichev O.I., Prudnikov A.P. Αόριστοι Ολοκληρωμένοι Πίνακες: Ένα Εγχειρίδιο. - Μ .: Nauka, 1986.
2. Kogan M.N. Δυναμική του αραιωμένου αερίου. Μόσχα, Fizmatlit, 1999.
3. Kikoin AK, Molecular Physics. Μ., Fizmatlit, 1976.
4. Sivukhin D.V. Γενικό μάθημα φυσικής, τ. 2. Θερμοδυναμική και μοριακή φυσική. Μ., Fizmatlit, 1989.
5. Kiryanov A.P., Korshunov S.M. Θερμοδυναμική και Μοριακή Φυσική. Εγχειρίδιο μαθητή. Ed. καθηγητής ΚΟΛΑΣΗ. Gladuna. - Μ., «Εκπαίδευση», 1977.
ΣΕΛΙΔΑ \ * MERGEFORMAT 3
Άλλα παρόμοια έργα που μπορεί να σας ενδιαφέρουν. Wshm> |
|||
| 13389. | Βασικές αρχές της μοριακής κινητικής θεωρίας (MKT) | 98,58 KB | |
| Όλες οι ουσίες αποτελούνται από σωματίδια ατομικών μορίων που χωρίζονται ανά διαστήματα. Στοιχεία: φωτογραφίες ατόμων και μορίων που έχουν ληφθεί με ηλεκτρονικό μικροσκόπιο. τη δυνατότητα μηχανικής σύνθλιψης μιας ουσίας διάλυσης μιας ουσίας σε συμπίεση διάχυσης νερού και διαστολής αερίων. Brownian κίνηση μικρών ξένων σωματιδίων που αιωρούνται σε ένα υγρό υπό την επίδραση μη αντισταθμισμένων επιπτώσεων μορίων. | |||
| 8473. | Μοριακή κινητική θεωρία (MKT) | 170,1 KB | |
| Μέση ενέργεια ενός μορίου Πίεση αερίου από την άποψη του MKT Εξίσωση κατάστασης ιδανικού αερίου Τεχνική και θερμοδυναμική θερμοκρασία Ιδανική έλξη αερίου και απώθηση μορίων Σύμφωνα με την MKT, κάθε στερεό υγρό αέριο σώμα αποτελείται από τα μικρότερα απομονωμένα σωματίδια που ονομάζονται μόρια. Με μια μικρή αλλαγή στην αμοιβαία απόσταση μεταξύ των μορίων από r σε rΔr, οι δυνάμεις αλληλεπίδρασης κάνουν το έργο Δυνητική ενέργεια ... | |||
| 2278. | ELEMENTARY ΜΟΡΙΑΚΗ-ΚΙΝΗΤΙΚΗ ΘΕΩΡΙΑ ΑΕΡΙΩΝ | 35,23 KB | |
| εξηγούνται αν δεχτούμε τις ακόλουθες διατάξεις της μοριακής κινητικής θεωρίας της δομής της ύλης: 1. Όλα τα σώματα αποτελούνται από μόρια ατόμων ή ιόντων. Τα μόρια, τα άτομα από τα οποία αποτελείται το σώμα, βρίσκονται σε συνεχή χαοτική κίνηση που ονομάζεται θερμική. | |||
| 2649. | Μοριακή κινητική θεωρία (MKT) ενός ιδανικού αερίου | 572,41 KB | |
| Μοριακή κινητική θεωρία του MKT ενός ιδανικού αερίου Σχέδιο Έννοια ενός ιδανικού αερίου. Εσωτερική ενέργεια ενός ιδανικού αερίου. Η πίεση αερίου από την άποψη της μοριακής κινητικής θεωρίας ενός ιδανικού αερίου είναι η βασική εξίσωση της μοριακής κινητικής θεωρίας. Η εξίσωση κατάστασης για ένα ιδανικό αέριο είναι η εξίσωση Clapeyron-Mendeleev. | |||
| 21064. | ΤΑΥΤΟΠΟΙΗΣΗ ΚΑΛΛΙΕΡΓΕΙΩΝ ΣΥΛΛΟΓΗΣ ΒΑΚΤΕΡΙΑΣ ΜΕ ΣΥΓΧΡΟΝΕΣ ΜΑΖΙΚΕΣ-ΣΠΕΚΤΡΟΜΕΤΡΙΚΕΣ ΚΑΙ ΜΟΡΙΑΚΟΓΕΝΕΤΙΚΕΣ ΜΕΘΟΔΟΥΣ | 917,68 KB | |
| Απομονώθηκαν καθαρές καλλιέργειες μικροοργανισμών, προσδιορίστηκαν μορφολογικά και πολιτισμικά χαρακτηριστικά. Πραγματοποιήθηκε ταυτοποίηση με μεθόδους MALDI-MS και PCR, ακολουθούμενη από αλληλουχία νουκλεοτιδικών αλληλουχιών θραυσμάτων γονιδίου 16S rRNA. | |||
| 12050. | Ένα σύνολο αντιδραστηρίων για μοριακή γενετική διάγνωση μονοκλωνικών και πολυκλωνικών πληθυσμών κυττάρων Β λεμφοκυττάρων με τη μέθοδο της αλυσιδωτής αντίδρασης πολυμεράσης (LYMPHOCLON) | 17,25 KB | |
| Δημιουργήθηκε ένα σύνολο αντιδραστηρίων για μοριακή γενετική διάγνωση μονοκλωνικών και πολυκλωνικών πληθυσμών Β-λεμφοκυττάρων με τη μέθοδο της αλυσιδωτής αντίδρασης πολυμεράσης LYMPHOCLON. Το κιτ αντιδραστηρίου LYMPHOKLON προορίζεται για διαφορική διάγνωση μονοκλωνικών και πολυκλωνικών πληθυσμών κυττάρων Β λεμφοκυττάρων σε υλικό βιοψίας τμημάτων ιστού παραφίνης με αλυσιδωτή αντίδραση πολυμεράσης με ανίχνευση προϊόντων ενίσχυσης με κάθετη ηλεκτροφόρηση σε γέλη ακρυλαμιδίου. Το κιτ προορίζεται μόνο για in vitro διαγνωστική χρήση. | |||
| 21333. | Βιοχημική λογική για το μπάντμιντον | 36,73 KB | |
| Εισαγωγή Θεωρήστε το μπάντμιντον ως ένα άθλημα που απαιτεί από έναν αθλητή να ξοδέψει πολλή δύναμη και ενέργεια, ο οποίος είναι σε θέση να κινητοποιήσει αμέσως το σώμα του για να κάνει άλματα, κινήσεις ισχυρών χτυπημάτων και που ξέρει πώς να χαλαρώσει σε σύντομο χρονικό διάστημα για να ανακουφίσει την ένταση και αμέσως μαζευτείτε για να συνεχίσετε το παιχνίδι. Για τους προπονητές και τους αθλητές, είναι απαραίτητο να γνωρίζουν και να λαμβάνουν υπόψη τις χημικές διεργασίες που συμβαίνουν στο σώμα του αθλητή κατά τη διάρκεια προπόνησης, παιχνιδιών και αγώνων κατά τον προσδιορισμό της απόδοσης των αθλητών στον βέλτιστο τρόπο λειτουργίας τους ... | |||
| 21845. | Αιτιολόγηση της τιμής των προϊόντων της εταιρείας | 131,66 KB | |
| Περιγραφή της επιχείρησης Ιδιωτική επιχείρηση Elegy Τύποι δραστηριότητας παραγωγή μεταλλικών πλακιδίων. Αυτή η αυλάκωση προστατεύει την οροφή από διαρροές νερού από το εξωτερικό και σώζει τον αγοραστή μεταλλικών πλακιδίων από την αγορά υδροφραγμού · το υδροφράγμα είναι ένα πολυμερές φιλμ που τοποθετείται κάτω από το μεταλλικό πλακίδιο. Όλα αυτά μειώνουν το κόστος παραγωγής μεταλλικών πλακιδίων. μεταλλικά πλακάκια στον εξοπλισμό PE Elegy ... | |||
| 13812. | Αιτιολόγηση του τεχνολογικού συστήματος απολύμανσης λυμάτων | 291,22 KB | |
| Η κύρια ρύπανση των λυμάτων είναι η φυσιολογική απέκκριση ανθρώπων και ζώων, απορριμμάτων και απορριμμάτων που προκύπτουν από το πλύσιμο τροφίμων, σκευών κουζίνας, πλύσης ρούχων, πλύσης χώρων και ποτίσματος δρόμων, καθώς και τεχνολογικές απώλειες, απόβλητα και απόβλητα σε βιομηχανικές επιχειρήσεις. Τα οικιακά και πολλά βιομηχανικά λύματα περιέχουν σημαντικές ποσότητες οργανικής ύλης | |||
| 12917. | Αιτιολόγηση των εκτιμήσεων των απαιτούμενων παραμέτρων και των σφαλμάτων τους | 160,34 KB | |
| Ας τονίσουμε ότι ο προσδιορισμός των συστηματικών σφαλμάτων δεν είναι έργο των στατιστικών. Θα υποθέσουμε ότι η εκτίμηση των αντίστοιχων παραμέτρων είναι καλή εάν πληροί τις ακόλουθες προϋποθέσεις. Αποτελεσματική υπό την έννοια ότι η αμερόληπτη εκτίμηση θα είχε τη μικρότερη διακύμανση. Αυτό μόνο το ξέρουμε. | |||
Είμαστε περιτριγυρισμένοι από διάφορα αντικείμενα. Μπορούμε να δούμε ότι αυτά είναι είτε στερεά, είτε υγρά, είτε αέρια. Πολλά ερωτήματα γεννιούνται για όλα όσα μας περιβάλλουν. Απαντήσεις σε πολλές ερωτήσεις δίνονται από μοριακή κινητική θεωρία.
Η μοριακή κινητική θεωρία είναι ένα σύνολο απόψεων που χρησιμοποιούνται για να περιγράψουν τις παρατηρούμενες και μετρημένες ιδιότητες μιας ουσίας με βάση τη μελέτη των ιδιοτήτων των ατόμων και των μορίων μιας δεδομένης ουσίας, την αλληλεπίδραση και την κίνησή τους.
Βασικές αρχές της μοριακής κινητικής θεωρίας
Όλα τα σώματα αποτελούνται από σωματίδια - άτομα, μόρια, ιόντα.
Όλα τα σωματίδια βρίσκονται σε συνεχή χαοτική θερμική κίνηση.
Υπάρχουν δυνάμεις αλληλεπίδρασης μεταξύ των σωματιδίων οποιουδήποτε σώματος - έλξη και απώθηση.
Έτσι, στη μοριακή κινητική θεωρία, το αντικείμενο μελέτης είναι ένα σύστημα που αποτελείται από μεγάλο αριθμό σωματιδίων - μακροσύστημα... Οι νόμοι της μηχανικής δεν ισχύουν για να εξηγήσουν τη συμπεριφορά ενός τέτοιου συστήματος. Ως εκ τούτου, η κύρια μέθοδος έρευνας είναι στατιστική μέθοδοςμελετώντας τις ιδιότητες της ύλης.
Για να εξηγήσετε και να προβλέψετε φαινόμενα, είναι σημαντικό να γνωρίζετε βασικά χαρακτηριστικά των μορίων:
- Διαστάσεις (επεξεργασία)

Μια εκτίμηση του μεγέθους ενός μορίου μπορεί να γίνει ως το μέγεθος ενός κύβου α που περιέχει ένα μόριο, με βάση την πυκνότητα των στερεών ή υγρών ουσιών και τη μάζα ενός μορίου:

- Μοριακή μάζα
Αναλογία μάζας ύλης Μστον αριθμό των μορίων Νσε αυτήν την ουσία:
- Σχετικό μοριακό βάρος
Ο λόγος της μάζας ενός μορίου (ή ατόμου) μιας δεδομένης ουσίας προς το 1/12 της μάζας ενός ατόμου άνθρακα:
- Ποσότητα ουσίας
Η ποσότητα της ουσίας είναι ίση με την αναλογία του αριθμού των σωματιδίων Νστο σώμα (άτομα - σε ατομική ουσία, μόρια - σε μοριακή) έως τον αριθμό μορίων σε ένα γραμμομόριο μιας ουσίας ΝΕΝΑ:

- Η σταθερά του Αβογκάντρο
Ο αριθμός των μορίων που περιέχονται σε 1 γραμμομόριο μιας ουσίας.
- Μοριακή μάζα
Η γραμμομοριακή μάζα μιας ουσίας είναι η μάζα μιας ουσίας που λαμβάνεται σε ποσότητα 1 mole.
Στο Διεθνές Σύστημα Μονάδων, η γραμμομοριακή μάζα μιας ουσίας εκφράζεται σε kg / mol.
- Αλληλεπίδραση (ποσοτικά με βάση την εμπειρία)

Η αλληλεπίδραση των μορίων χαρακτηρίζεται τόσο από έλξη όσο και απόκρουση: σε αποστάσεις ρ
Η μοριακή κινητική θεωρία καθιστά δυνατή την κατανόηση γιατί μια ουσία μπορεί να βρίσκεται σε αέρια, υγρή και στερεή κατάσταση. Από την άποψη της MKT, οι συγκεντρωτικές καταστάσεις διαφέρουν ως προς η τιμή της μέσης απόστασης μεταξύ των μορίων και η φύση της κίνησης των μορίων μεταξύ τους.
Οι κύριες διατάξεις της μοριακής κινητικής θεωρίας έχουν επιβεβαιωθεί επανειλημμένα από διάφορα φυσικά πειράματα. Για παράδειγμα, με έρευνα:
Α) Διάχυση
Β) Μπράουνια κίνηση
Σύντομη περίληψη
Η μοριακή κινητική θεωρία εξηγεί τη δομή και τις ιδιότητες των σωμάτων με βάση την κίνηση και την αλληλεπίδραση ατόμων, μορίων και ιόντων. Το MKT βασίζεται στο τρεις θέσεις, τα οποία επιβεβαιώθηκαν πλήρως πειραματικά και θεωρητικά:
1) όλα τα σώματα αποτελούνται από σωματίδια - μόρια, άτομα, ιόντα.
2) τα σωματίδια βρίσκονται σε συνεχή χαοτική θερμική κίνηση.
3) υπάρχουν δυνάμεις αλληλεπίδρασης μεταξύ των σωματιδίων οποιουδήποτε σώματος - έλξη και απώθηση.
Η μοριακή δομή μιας ουσίας επιβεβαιώνεται με την άμεση παρατήρηση των μορίων σε ηλεκτρονικά μικροσκόπια, καθώς και με τη διάλυση των στερεών σε υγρά, τη συμπιεστότητα και τη διαπερατότητα της ουσίας. Θερμική κίνηση - κίνηση και διάχυση Brown. Η παρουσία διαμοριακής αλληλεπίδρασης με τη δύναμη και την ελαστικότητα των στερεών, την επιφανειακή τάση των υγρών.
Υποστηρικτικές σημειώσεις για το μάθημα:

Ερωτήσεις για αυτοέλεγχο στο μπλοκ "Βασικές αρχές της μοριακής κινητικής θεωρίας και η πειραματική τους τεκμηρίωση"
- Διατυπώστε τις κύριες διατάξεις της μοριακής κινητικής θεωρίας.
- Ποιες παρατηρήσεις και πειράματα επιβεβαιώνουν τις κύριες διατάξεις της μοριακής κινητικής θεωρίας;
- Τι είναι το Μόριο; άτομο?
- Τι ονομάζεται σχετικό μοριακό βάρος; Ποιος τύπος εκφράζει αυτήν την έννοια;
- Τι ονομάζεται ποσότητα μιας ουσίας; Ποιος τύπος εκφράζει αυτήν την έννοια; Ποια είναι η μονάδα ποσότητας μιας ουσίας;
- Τι ονομάζεται σταθερά Avogadro;
- Ποια είναι η γραμμομοριακή μάζα μιας ουσίας; Ποιος τύπος εκφράζει το νόημα αυτής της έννοιας; Ποια είναι η μονάδα της μοριακής μάζας;
- Ποια είναι η φύση των διαμοριακών δυνάμεων;
- Ποιες είναι οι ιδιότητες των δυνάμεων της μοριακής αλληλεπίδρασης;
- Πώς εξαρτώνται οι δυνάμεις αλληλεπίδρασης από την απόσταση μεταξύ τους;
- Περιγράψτε τη φύση της κίνησης των μορίων σε αέρια, υγρά και στερεά.
- Ποια είναι η φύση της συσκευασίας σωματιδίων σε αέρια, υγρά και στερεά;
- Ποια είναι η μέση απόσταση μεταξύ μορίων σε αέρια, υγρά και στερεά;
- Αναφέρετε τις βασικές ιδιότητες των αερίων, των υγρών, των στερεών.
- Τι ονομάζεται κίνηση Μπράουν;
- Τι δείχνει η κίνηση Brownian;
- Τι ονομάζεται διάχυση; Δώστε παραδείγματα διάχυσης σε αέρια, υγρά και στερεά.
- 18. Πώς εξαρτάται ο ρυθμός διάχυσης από τη θερμοκρασία των σωμάτων;
Μοριακή κινητική θεωρία (MKT)Είναι ένα δόγμα που εξηγεί τα θερμικά φαινόμενα στα μακροσκοπικά σώματα και τις εσωτερικές ιδιότητες αυτών των σωμάτων από την κίνηση και την αλληλεπίδραση ατόμων, μορίων και ιόντων που αποτελούν τα σώματα. Το MCT της δομής της ύλης βασίζεται σε τρεις διατάξεις:
- Η ύλη αποτελείται από σωματίδια - μόρια, άτομα και ιόντα. Αυτά τα σωματίδια περιέχουν μικρότερα στοιχειώδη σωματίδια. Ένα μόριο είναι το μικρότερο σταθερό σωματίδιο μιας δεδομένης ουσίας. Το μόριο έχει τις βασικές χημικές ιδιότητες μιας ουσίας. Ένα μόριο είναι το όριο σχάσης μιας ουσίας, δηλαδή το μικρότερο μέρος μιας ουσίας που είναι ικανό να διατηρήσει τις ιδιότητες αυτής της ουσίας. Ένα άτομο είναι το μικρότερο σωματίδιο ενός δεδομένου χημικού στοιχείου.
- Τα σωματίδια που αποτελούν την ουσία βρίσκονται σε συνεχή χαοτική (διαταραγμένη) κίνηση.
- Τα σωματίδια της ύλης αλληλεπιδρούν μεταξύ τους - έλκονται και απωθούνται.
Αυτές οι βασικές προτάσεις επιβεβαιώνονται πειραματικά και θεωρητικά.
Σύνθεση της ουσίας
Οι σύγχρονες συσκευές καθιστούν δυνατή την παρατήρηση εικόνων μεμονωμένων ατόμων και μορίων. Χρησιμοποιώντας ηλεκτρονικό μικροσκόπιο ή προβολέα ιόντων (μικροσκόπιο), μπορούν να ληφθούν εικόνες μεμονωμένων ατόμων και να εκτιμηθεί το μέγεθός τους. Η διάμετρος οποιουδήποτε ατόμου είναι της τάξης d = 10 -8 cm (10 -10 m). Τα μόρια είναι μεγαλύτερα από τα άτομα. Δεδομένου ότι τα μόρια αποτελούνται από πολλά άτομα, όσο μεγαλύτερος είναι ο αριθμός ατόμων σε ένα μόριο, τόσο μεγαλύτερο είναι το μέγεθός του. Τα μοριακά μεγέθη κυμαίνονται από 10 -8 cm (10 -10 m) έως 10 -5 cm (10 -7 m).
Χαοτική κίνηση σωματιδίων
Η συνεχής χαοτική κίνηση των σωματιδίων επιβεβαιώνεται με κίνηση και διάχυση Brown. Η τυχαία κίνηση σημαίνει ότι τα μόρια δεν έχουν προτιμώμενες διαδρομές και οι κινήσεις τους έχουν τυχαίες κατευθύνσεις. Αυτό σημαίνει ότι όλες οι κατευθύνσεις είναι εξίσου πιθανές.
Διάχυση(από τη λατινική διάχυση - εξάπλωση, εξάπλωση) - ένα φαινόμενο όταν, ως αποτέλεσμα της θερμικής κίνησης μιας ουσίας, συμβαίνει αυθόρμητη διείσδυση μιας ουσίας σε άλλη (εάν αυτές οι ουσίες είναι σε επαφή).
Η αμοιβαία ανάμειξη ουσιών συμβαίνει λόγω της συνεχούς και τυχαίας κίνησης ατόμων ή μορίων (ή άλλων σωματιδίων) μιας ουσίας. Με την πάροδο του χρόνου, το βάθος διείσδυσης μορίων μιας ουσίας σε άλλη αυξάνεται. Το βάθος διείσδυσης εξαρτάται από τη θερμοκρασία: όσο υψηλότερη είναι η θερμοκρασία, τόσο μεγαλύτερη είναι η ταχύτητα κίνησης των σωματιδίων της ουσίας και τόσο πιο γρήγορα προχωρά η διάχυση.
Η διάχυση παρατηρείται σε όλες τις καταστάσεις της ύλης - σε αέρια, υγρά και στερεά. Ένα παράδειγμα διάχυσης στα αέρια είναι η εξάπλωση των οσμών στον αέρα απουσία άμεσης ανάμιξης. Η διάχυση σε στερεά εξασφαλίζει τη σύνδεση των μετάλλων κατά τη συγκόλληση, τη συγκόλληση, την επίστρωση χρωμίου κ.λπ. Στα αέρια και τα υγρά, η διάχυση συμβαίνει πολύ πιο γρήγορα από ό, τι στα στερεά.
Η ύπαρξη σταθερών υγρών και στερεών εξηγείται από την παρουσία δυνάμεων διαμοριακής αλληλεπίδρασης (δυνάμεις αμοιβαίας έλξης και απώθησης). Οι ίδιοι λόγοι εξηγούν τη χαμηλή συμπιεστότητα των υγρών και την ικανότητα των στερεών να αντιστέκονται σε παραμορφώσεις συμπίεσης και τάσης.
Οι δυνάμεις της διαμοριακής αλληλεπίδρασης είναι ηλεκτρομαγνητικής φύσης - αυτές είναι δυνάμεις ηλεκτρικής προέλευσης. Ο λόγος για αυτό είναι ότι τα μόρια και τα άτομα αποτελούνται από φορτισμένα σωματίδια με αντίθετα σημάδια φορτίου - ηλεκτρόνια και θετικά φορτισμένους ατομικούς πυρήνες. Γενικά, τα μόρια είναι ηλεκτρικά ουδέτερα. Σύμφωνα με τις ηλεκτρικές του ιδιότητες, ένα μόριο μπορεί να θεωρηθεί περίπου ως ηλεκτρικό δίπολο.
Η ισχύς της αλληλεπίδρασης μεταξύ μορίων εξαρτάται από την απόσταση μεταξύ των μορίων. Αυτή η εξάρτηση φαίνεται στο Σχ. 1.1 Εδώ φαίνονται οι προβολές των δυνάμεων αλληλεπίδρασης σε ευθεία γραμμή που διέρχεται από τα κέντρα των μορίων.
Ρύζι. 1.1 Εξάρτηση των διαμοριακών δυνάμεων από την απόσταση μεταξύ των ατόμων που αλληλεπιδρούν.
Όπως μπορείτε να δείτε, καθώς η απόσταση μεταξύ των μορίων r μειώνεται, η ελκυστική δύναμη F r pr αυξάνεται (κόκκινη γραμμή στο σχήμα). Όπως ήδη αναφέρθηκε, οι δυνάμεις έλξης θεωρούνται αρνητικές, επομένως, καθώς η απόσταση μειώνεται, η καμπύλη κατεβαίνει, δηλαδή, στην αρνητική ζώνη του γραφήματος.
Οι δυνάμεις έλξης ενεργούν καθώς δύο άτομα ή μόρια πλησιάζουν το ένα το άλλο, ενώ η απόσταση r μεταξύ των κέντρων των μορίων είναι στην περιοχή των 10 -9 m (2-3 διαμέτρους μορίων). Καθώς η απόσταση αυτή αυξάνεται, οι δυνάμεις έλξης εξασθενούν. Οι δυνάμεις της βαρύτητας είναι δυνάμεις μικρής εμβέλειας.
όπου ένα- συντελεστής ανάλογα με τον τύπο των ελκτικών δυνάμεων και τη δομή των μορίων που αλληλεπιδρούν.
Με περαιτέρω προσέγγιση ατόμων ή μορίων σε αποστάσεις μεταξύ των κέντρων μορίων της τάξης των 10-10 m (αυτή η απόσταση είναι συγκρίσιμη με τις γραμμικές διαστάσεις των ανόργανων μορίων), εμφανίζονται απωθητικές δυνάμεις F r (μπλε γραμμή στο Σχ. 1.1) Το Αυτές οι δυνάμεις εμφανίζονται λόγω της αμοιβαίας απώθησης των θετικά φορτισμένων ατόμων στο μόριο και μειώνονται με την αύξηση της απόστασης r ακόμη πιο γρήγορα από τις δυνάμεις έλξης (όπως φαίνεται στο γράφημα - η μπλε γραμμή τείνει στο μηδέν πιο "απότομα" από την κόκκινη ένας).
όπου σι- συντελεστής ανάλογα με τον τύπο των απωθητικών δυνάμεων και τη δομή των μορίων που αλληλεπιδρούν.
Σε απόσταση r = r 0 (αυτή η απόσταση είναι περίπου ίση με το άθροισμα των ακτίνων των μορίων), οι δυνάμεις έλξης εξισορροπούν τις δυνάμεις της απώθησης και η προβολή της προκύπτουσας δύναμης είναι F r = 0. Αυτή η κατάσταση αντιστοιχεί στην πιο σταθερή διάταξη των αλληλεπιδρώντων μορίων.
Στη γενική περίπτωση, η προκύπτουσα δύναμη είναι ίση με:
Για r> r 0, η έλξη των μορίων υπερβαίνει την απώθηση, για το r< r 0 – отталкивание молекул превосходит их притяжение.
Η εξάρτηση των δυνάμεων αλληλεπίδρασης μορίων από την απόσταση μεταξύ τους εξηγεί ποιοτικά τον μοριακό μηχανισμό εμφάνισης ελαστικών δυνάμεων σε στερεά.
Όταν ένα στερεό τεντώνεται, τα σωματίδια απομακρύνονται το ένα από το άλλο σε αποστάσεις που υπερβαίνουν το r 0. Σε αυτή την περίπτωση, εμφανίζονται οι δυνάμεις έλξης των μορίων, τα οποία επιστρέφουν τα σωματίδια στην αρχική τους θέση.
Όταν ένα στερεό συμπιέζεται, τα σωματίδια πλησιάζουν το ένα το άλλο σε αποστάσεις μικρότερες από την απόσταση r 0. Αυτό οδηγεί σε αύξηση των απωθητικών δυνάμεων, οι οποίες επιστρέφουν τα σωματίδια στην αρχική τους θέση και εμποδίζουν την περαιτέρω συμπίεση.
Εάν η μετατόπιση των μορίων από τις θέσεις ισορροπίας είναι μικρή, τότε οι δυνάμεις της αλληλεπίδρασης αυξάνονται γραμμικά με την αύξηση της μετατόπισης. Στο γράφημα, αυτό το τμήμα εμφανίζεται με μια παχιά ανοιχτό πράσινη γραμμή.
Επομένως, σε μικρές παραμορφώσεις (εκατομμύρια φορές μεγαλύτερες από το μέγεθος των μορίων), εκπληρώνεται ο νόμος του Χουκ, σύμφωνα με τον οποίο η ελαστική δύναμη είναι ανάλογη της παραμόρφωσης. Σε μεγάλες μετατοπίσεις, ο νόμος του Χουκ δεν ισχύει.
Ορισμός 1
Μοριακή κινητική θεωρία- Αυτό είναι το δόγμα της δομής και των ιδιοτήτων της ύλης, που βασίζεται στην ιδέα της ύπαρξης ατόμων και μορίων, ως τα μικρότερα σωματίδια χημικών ουσιών.
Οι κύριες διατάξεις της μοριακής κινητικής θεωρίας του μορίου:
- Όλες οι ουσίες μπορούν να βρίσκονται σε υγρή, στερεή και αέρια κατάσταση. Σχηματίζονται από σωματίδια που αποτελούνται από άτομα. Τα στοιχειώδη μόρια μπορούν να έχουν πολύπλοκη δομή, δηλαδή να περιέχουν πολλά άτομα. Τα μόρια και τα άτομα είναι ηλεκτρικά ουδέτερα σωματίδια που, υπό ορισμένες συνθήκες, αποκτούν ένα επιπλέον ηλεκτρικό φορτίο και μετατρέπονται σε θετικά ή αρνητικά ιόντα.
- Τα άτομα και τα μόρια κινούνται συνεχώς.
- Τα σωματίδια με ηλεκτρική φύση δύναμης αλληλεπιδρούν μεταξύ τους.
Οι κύριες διατάξεις των ΤΠΕ και τα παραδείγματά τους παρατέθηκαν παραπάνω. Υπάρχει μικρή βαρυτική επίδραση μεταξύ των σωματιδίων.
Εικόνα 3. 1 1 Τροχιά σωματιδίων Brown's.
Ορισμός 2
Η Brownian κίνηση μορίων και ατόμων επιβεβαιώνει την ύπαρξη των κύριων διατάξεων της μοριακής κινητικής θεωρίας και την τεκμηριώνει πειραματικά. Αυτή η θερμική κίνηση των σωματιδίων συμβαίνει με μόρια αιωρούμενα σε υγρό ή αέριο.
Πειραματική τεκμηρίωση των κύριων διατάξεων της μοριακής κινητικής θεωρίας
Το 1827, ο R. Brown ανακάλυψε αυτή την κίνηση, η οποία οφείλεται στις τυχαίες κρούσεις και κινήσεις μορίων. Δεδομένου ότι η διαδικασία ήταν χαοτική, τα χτυπήματα δεν μπορούσαν να ισορροπήσουν το ένα το άλλο. Ως εκ τούτου, το συμπέρασμα ότι η ταχύτητα ενός σωματιδίου Brown δεν μπορεί να είναι σταθερή, αλλάζει συνεχώς και η κίνηση της κατεύθυνσης απεικονίζεται με τη μορφή ζιγκ -ζαγκ, που φαίνεται στο σχήμα 3. 1 1
Ο Αϊνστάιν μίλησε για την κίνηση Μπράουν το 1905. Η θεωρία του επιβεβαιώθηκε στα πειράματα του J. Perrin το 1908 - 1911.
Ορισμός 3
Συμπέρασμα από τη θεωρία του Αϊνστάιν: τετράγωνη μετατόπιση< r 2 >ενός σωματιδίου Brown's σε σχέση με την αρχική θέση, κατά μέσο όρο σε πολλά σωματίδια Brown, είναι ανάλογο με το χρόνο παρατήρησης t.
Εκφραση< r 2 >= D t εξηγεί τον νόμο διάχυσης. Σύμφωνα με τη θεωρία, έχουμε ότι το D αυξάνεται μονότονα με την αύξηση της θερμοκρασίας. Η ακανόνιστη κίνηση είναι ορατή παρουσία διάχυσης.
Ορισμός 4
ΔιάχυσηΕίναι ο ορισμός του φαινομένου διείσδυσης δύο ή περισσότερων ουσιών που έρχονται σε επαφή μεταξύ τους.
Αυτή η διαδικασία λαμβάνει χώρα γρήγορα σε ένα μη ομοιόμορφο αέριο. Μέσω παραδειγμάτων διάχυσης με διαφορετικές πυκνότητες, μπορεί να ληφθεί ένα ομοιογενές μείγμα. Όταν το οξυγόνο Ο 2 και το υδρογόνο Η 2 με ένα διάφραγμα βρίσκονται στο ίδιο δοχείο, τότε όταν αφαιρείται, τα αέρια αρχίζουν να αναμειγνύονται, σχηματίζοντας ένα επικίνδυνο μείγμα. Η διαδικασία είναι δυνατή όταν υπάρχει υδρογόνο στην κορυφή και οξυγόνο στο κάτω μέρος.
Οι διαδικασίες αλληλεπίδρασης λαμβάνουν χώρα επίσης σε υγρά, αλλά πολύ πιο αργά. Εάν διαλύσετε ένα στερεό, τη ζάχαρη, στο νερό, έχουμε ένα ομοιογενές διάλυμα, το οποίο είναι ένα σαφές παράδειγμα των διαδικασιών διάχυσης σε υγρά. Υπό πραγματικές συνθήκες, η ανάμειξη σε υγρά και αέρια καλύπτεται με διαδικασίες ταχείας ανάμιξης, για παράδειγμα, όταν συμβαίνουν ροές μεταφοράς.
Η διάχυση των στερεών διακρίνεται από την πιο αργή ταχύτητα. Εάν η επιφάνεια αλληλεπίδρασης μετάλλων καθαριστεί, τότε μπορείτε να δείτε ότι για μεγάλο χρονικό διάστημα, άτομα ενός άλλου μετάλλου θα εμφανιστούν σε καθένα από αυτά.
Ορισμός 5
Η διάχυση και η κίνηση Μπράουν θεωρούνται σχετικά φαινόμενα.
Όταν τα σωματίδια και των δύο ουσιών αλληλεπιδρούν, η κίνηση είναι τυχαία, δηλαδή παρατηρείται μια χαοτική θερμική κίνηση μορίων.
Οι δυνάμεις που δρουν μεταξύ δύο μορίων εξαρτώνται από την απόσταση μεταξύ τους. Τα μόρια περιέχουν θετικά και αρνητικά φορτία. Σε μεγάλες αποστάσεις, οι δυνάμεις της διαμοριακής έλξης επικρατούν, σε μικρές αποστάσεις, οι δυνάμεις της απώθησης.
Σχέδιο 3 . 1 . 2 δείχνει την εξάρτηση της προκύπτουσας δύναμης F και της δυνητικής ενέργειας E p της αλληλεπίδρασης μεταξύ μορίων από την απόσταση μεταξύ των κέντρων τους. Σε απόσταση r = r 0, η δύναμη αλληλεπίδρασης μετατρέπεται στο μηδέν. Αυτή η απόσταση θεωρείται συμβατικά ως η διάμετρος του μορίου. Στο r = r 0, η πιθανή ενέργεια αλληλεπίδρασης είναι ελάχιστη.
Ορισμός 6
Για να απομακρυνθούν δύο μόρια με απόσταση r 0, πρέπει να ενημερωθεί το E 0, που ονομάζεται η ενέργεια της σύνδεσης ή το βάθος του δυναμικού φρεατίου.

Εικόνα 3. 1 2Η δύναμη της αλληλεπίδρασης φάκαι δυνητική ενέργεια αλληλεπίδρασηςΕ σελ δύο μόρια. F> 0- δύναμη απώθησης, φά< 0 - δύναμη της βαρύτητας.
Δεδομένου ότι τα μόρια είναι μικρά, τα απλά μονοατομικά μόρια δεν μπορούν να είναι περισσότερα από 10 - 10 μ. Τα σύνθετα μπορούν να φτάσουν εκατοντάδες φορές μεγαλύτερα μεγέθη.
Ορισμός 7
Η διαταραγμένη χαοτική κίνηση των μορίων ονομάζεται θερμική κίνηση.
Καθώς η θερμοκρασία αυξάνεται, η κινητική ενέργεια της θερμικής κίνησης αυξάνεται. Σε χαμηλές θερμοκρασίες, η μέση κινητική ενέργεια, στις περισσότερες περιπτώσεις, αποδεικνύεται μικρότερη από την τιμή του δυνητικού βάθους φρεατίου Ε 0. Αυτή η περίπτωση δείχνει ότι τα μόρια ρέουν σε μια υγρή ή στερεή ουσία με μέση απόσταση μεταξύ τους r 0. Εάν η θερμοκρασία αυξηθεί, τότε η μέση κινητική ενέργεια του μορίου υπερβαίνει το Ε 0, τότε διασκορπίζονται και σχηματίζουν αέρια ουσία.
Στα στερεά, τα μόρια κινούνται τυχαία γύρω από σταθερά κέντρα, δηλαδή θέσεις ισορροπίας. Στο διάστημα, μπορεί να κατανέμεται ακανόνιστα (σε άμορφα σώματα) ή με το σχηματισμό διατεταγμένων ογκομετρικών δομών (κρυσταλλικά σώματα).
Συγκεντρωτικές καταστάσεις ουσιών
Η ελευθερία της θερμικής κίνησης των μορίων φαίνεται στα υγρά, αφού δεν έχουν προσκόλληση στα κέντρα, γεγονός που τους επιτρέπει να κινούνται σε όλο τον όγκο. Αυτό εξηγεί τη ρευστότητά του.
Ορισμός 8
Εάν τα μόρια είναι κοντά μεταξύ τους, μπορούν να σχηματίσουν διατεταγμένες δομές με πολλά μόρια. Αυτό το φαινόμενο ονομάζεται παραγγελία μικρής εμβέλειας. Παραγγελία μεγάλης εμβέλειαςχαρακτηριστικό των κρυσταλλικών σωμάτων.
Η απόσταση μεταξύ των μορίων στα αέρια είναι πολύ μεγαλύτερη, επομένως οι δυνάμεις δράσης είναι μικρές και οι κινήσεις τους κινούνται σε ευθεία γραμμή, περιμένοντας την επόμενη σύγκρουση. Μια τιμή 10 - 8 m είναι η μέση απόσταση μεταξύ μορίων αέρα υπό κανονικές συνθήκες. Δεδομένου ότι η αλληλεπίδραση δυνάμεων είναι ασθενής, τα αέρια διαστέλλονται και μπορούν να γεμίσουν οποιονδήποτε όγκο του δοχείου. Όταν η αλληλεπίδρασή τους τείνει στο μηδέν, τότε μιλούν για την αναπαράσταση ενός ιδανικού αερίου.
Κινητικό μοντέλο ιδανικού αερίου
Σε mct, η ποσότητα της ουσίας θεωρείται ανάλογη με τον αριθμό των σωματιδίων.
Ορισμός 9
ΣκώροςΕίναι η ποσότητα μιας ουσίας που περιέχει τόσα σωματίδια (μόρια) όσα άτομα υπάρχουν σε 0,012 έως g άνθρακα C 12. Ένα μόριο άνθρακα αποτελείται από ένα άτομο. Συνεπώς, προκύπτει ότι 1 γραμμομόριο μιας ουσίας έχει τον ίδιο αριθμό μορίων. Αυτός ο αριθμός καλείται μόνιμος ΑβογκάντροΝ Α: Ν Α = 6, 02 ċ 1023 mol - 1.
Τύπος για τον προσδιορισμό της ποσότητας της ουσίας ν γράφεται ως ο λόγος Ν του αριθμού των σωματιδίων προς τη σταθερά του Αβογκάντρο Ν Α: ν = Ν Ν Α.
Ορισμός 10
Η μάζα ενός γραμμομορίου ουσίαςπου ονομάζεται γραμμομοριακή μάζα Μ. Είναι σταθερό με τη μορφή του τύπου Μ = Ν Α ċ m 0.
Η μοριακή μάζα εκφράζεται σε χιλιόγραμμα ανά γραμμομόριο (k g / mol).
Ορισμός 11
Εάν μια ουσία έχει ένα άτομο στη σύνθεσή της, τότε γίνεται λόγος για την ατομική μάζα ενός σωματιδίου. Η μονάδα ενός ατόμου είναι 1 12 μάζες του ισοτόπου του άνθρακα C 12, που ονομάζεται μονάδα ατομικής μάζαςκαι γράφεται ως ( ένα. τρώω.): 1 α. μονάδες = 1,66 ċ 10 - 27 στην πόλη.
Αυτή η τιμή συμπίπτει με τις μάζες του πρωτονίου και του νετρονίου.
Ορισμός 12
Ο λόγος της μάζας ενός ατόμου ή μορίου μιας δεδομένης ουσίας προς το 1 12 της μάζας ενός ατόμου άνθρακα ονομάζεται σχετική μάζα.
Εάν παρατηρήσετε σφάλμα στο κείμενο, επιλέξτε το και πατήστε Ctrl + Enter