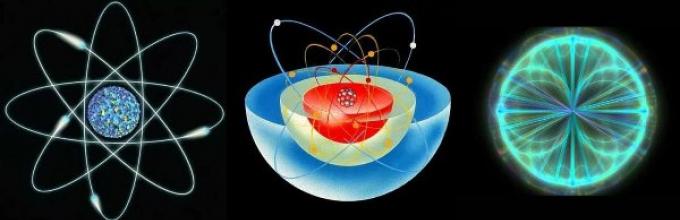
Σύνθεση του ατόμου.
Ένα άτομο αποτελείται από ατομικό πυρήνα Και νέφος ηλεκτρονίων .
Ο πυρήνας ενός ατόμου αποτελείται από πρωτόνια ( p+) και τα νετρόνια ( n 0). Τα περισσότερα άτομα υδρογόνου έχουν έναν πυρήνα που αποτελείται από ένα πρωτόνιο.
Αριθμός πρωτονίων Ν(p+) ισούται με το πυρηνικό φορτίο ( Ζ) και τον τακτικό αριθμό του στοιχείου στη φυσική σειρά στοιχείων (και στον περιοδικό πίνακα στοιχείων).
Ν(Π +) = Ζ
Άθροισμα νετρονίων Ν(n 0), που υποδηλώνεται απλώς με το γράμμα Νκαι τον αριθμό των πρωτονίων Ζπου ονομάζεται μαζικός αριθμόςκαι ορίζεται από την επιστολή ΕΝΑ.
ΕΝΑ = Ζ + Ν
Το ηλεκτρονιακό κέλυφος ενός ατόμου αποτελείται από ηλεκτρόνια που κινούνται γύρω από τον πυρήνα ( μι -).
Αριθμός ηλεκτρονίων Ν(μι-) στο ηλεκτρονιακό κέλυφος ενός ουδέτερου ατόμου ισούται με τον αριθμό των πρωτονίων Ζστον πυρήνα του.
Η μάζα ενός πρωτονίου είναι περίπου ίση με τη μάζα ενός νετρονίου και 1840 φορές περισσότερη μάζαηλεκτρόνιο, οπότε η μάζα του ατόμου είναι πρακτικά ίση με τη μάζα του πυρήνα.
Το σχήμα του ατόμου είναι σφαιρικό. Η ακτίνα του πυρήνα είναι περίπου 100.000 φορές μικρότερη από την ακτίνα του ατόμου.
Χημικό στοιχείο- τύπος ατόμων (συλλογή ατόμων) με το ίδιο πυρηνικό φορτίο (με τον ίδιο αριθμό πρωτονίων στον πυρήνα).
Ισότοπο- μια συλλογή ατόμων του ίδιου στοιχείου με τον ίδιο αριθμό νετρονίων στον πυρήνα (ή έναν τύπο ατόμου με τον ίδιο αριθμό πρωτονίων και τον ίδιο αριθμό νετρονίων στον πυρήνα).
Τα διαφορετικά ισότοπα διαφέρουν μεταξύ τους ως προς τον αριθμό των νετρονίων στους πυρήνες των ατόμων τους.
Ονομασία μεμονωμένου ατόμου ή ισοτόπου: (Σύμβολο στοιχείου E), για παράδειγμα: .
Δομή του ηλεκτρονιακού κελύφους ενός ατόμου
Ατομικό τροχιακό- κατάσταση ενός ηλεκτρονίου σε ένα άτομο. Το σύμβολο για το τροχιακό είναι . Κάθε τροχιακό έχει ένα αντίστοιχο νέφος ηλεκτρονίων.
Τα τροχιακά των πραγματικών ατόμων στη θεμελιώδη (μη διεγερμένη) κατάσταση είναι τεσσάρων τύπων: μικρό, Π, ρεΚαι φά.
Ηλεκτρονικό σύννεφο- το τμήμα του χώρου στο οποίο μπορεί να βρεθεί ένα ηλεκτρόνιο με πιθανότητα 90 (ή περισσότερο) τοις εκατό.
Σημείωση: μερικές φορές οι έννοιες «ατομικό τροχιακό» και «νέφος ηλεκτρονίων» δεν διακρίνονται, αποκαλώντας και τα δύο «ατομικό τροχιακό».
Το ηλεκτρονιακό κέλυφος ενός ατόμου είναι στρωματοποιημένο. Ηλεκτρονικό στρώμαπου σχηματίζονται από νέφη ηλεκτρονίων ίδιου μεγέθους. Τα τροχιακά ενός στρώματος σχηματίζονται ηλεκτρονικό ("ενεργειακό") επίπεδο, οι ενέργειές τους είναι ίδιες για το άτομο υδρογόνου, αλλά διαφορετικές για άλλα άτομα.
Τα τροχιακά του ίδιου τύπου ομαδοποιούνται σε ηλεκτρονική (ενέργεια)υποεπίπεδα:
μικρό-υποεπίπεδο (αποτελείται από ένα μικρό-τροχιακά), σύμβολο - .
Π-υποεπίπεδο (αποτελείται από τρία Π
ρε-υποεπίπεδο (αποτελείται από πέντε ρε-τροχιακά), σύμβολο - .
φά-υποεπίπεδο (αποτελείται από επτά φά-τροχιακά), σύμβολο - .
Οι ενέργειες των τροχιακών του ίδιου υποεπίπεδου είναι οι ίδιες.
Κατά τον καθορισμό υποεπίπεδων, ο αριθμός του επιπέδου (ηλεκτρονικό επίπεδο) προστίθεται στο σύμβολο υποεπίπεδου, για παράδειγμα: 2 μικρό, 3Π, 5ρεπου σημαίνει μικρό-υποεπίπεδο του δεύτερου επιπέδου, Π-υποεπίπεδο του τρίτου επιπέδου, ρε-υποεπίπεδο του πέμπτου επιπέδου.
Ο συνολικός αριθμός των υποεπιπέδων σε ένα επίπεδο είναι ίσος με τον αριθμό του επιπέδου n. Ο συνολικός αριθμός των τροχιακών σε ένα επίπεδο είναι ίσος με n 2. Αντίστοιχα, ο συνολικός αριθμός των νεφών σε ένα στρώμα είναι επίσης ίσος με n 2 .
Ονομασίες: - ελεύθερο τροχιακό (χωρίς ηλεκτρόνια), - τροχιακό με ασύζευκτο ηλεκτρόνιο, - ένα τροχιακό με ένα ζεύγος ηλεκτρονίων (με δύο ηλεκτρόνια).
Η σειρά με την οποία τα ηλεκτρόνια γεμίζουν τα τροχιακά ενός ατόμου καθορίζεται από τρεις νόμους της φύσης (οι διατυπώσεις δίνονται με απλοποιημένους όρους):
1. Η αρχή της ελάχιστης ενέργειας - τα ηλεκτρόνια γεμίζουν τα τροχιακά κατά σειρά αυξανόμενης ενέργειας των τροχιακών.
2. Η αρχή Pauli - δεν μπορούν να υπάρχουν περισσότερα από δύο ηλεκτρόνια σε ένα τροχιακό.
3. Κανόνας του Hund - μέσα σε ένα υποεπίπεδο, τα ηλεκτρόνια γεμίζουν πρώτα κενά τροχιακά (ένα κάθε φορά), και μόνο μετά από αυτό σχηματίζουν ζεύγη ηλεκτρονίων.
Ο συνολικός αριθμός ηλεκτρονίων στο ηλεκτρονικό επίπεδο (ή στο στρώμα ηλεκτρονίων) είναι 2 n 2 .
Η κατανομή των υποεπιπέδων ανά ενέργεια εκφράζεται ως εξής (κατά σειρά αυξανόμενης ενέργειας):
1μικρό, 2μικρό, 2Π, 3μικρό, 3Π, 4μικρό, 3ρε, 4Π, 5μικρό, 4ρε, 5Π, 6μικρό, 4φά, 5ρε, 6Π, 7μικρό, 5φά, 6ρε, 7Π ...
Αυτή η ακολουθία εκφράζεται ξεκάθαρα με ένα ενεργειακό διάγραμμα:
Η κατανομή των ηλεκτρονίων ενός ατόμου σε επίπεδα, υποεπίπεδα και τροχιακά (ηλεκτρονική διαμόρφωση ενός ατόμου) μπορεί να απεικονιστεί ως τύπος ηλεκτρονίων, ενεργειακό διάγραμμα ή, πιο απλά, ως διάγραμμα ηλεκτρονικών στοιβάδων ("διάγραμμα ηλεκτρονίων").
Παραδείγματα ηλεκτρονική δομήάτομα:
ηλεκτρόνια σθένους- ηλεκτρόνια του ατόμου που μπορούν να λάβουν μέρος στο σχηματισμό χημικοί δεσμοί. Για οποιοδήποτε άτομο, αυτά είναι όλα τα εξωτερικά ηλεκτρόνια συν τα προ-εξωτερικά ηλεκτρόνια των οποίων η ενέργεια είναι μεγαλύτερη από αυτή των εξωτερικών. Για παράδειγμα: το άτομο Ca έχει 4 εξωτερικά ηλεκτρόνια μικρό 2, είναι επίσης σθένος? το άτομο Fe έχει 4 εξωτερικά ηλεκτρόνια μικρό 2 αλλά έχει 3 ρε 6, επομένως το άτομο σιδήρου έχει 8 ηλεκτρόνια σθένους. Ο ηλεκτρονικός τύπος σθένους του ατόμου ασβεστίου είναι 4 μικρό 2 και άτομα σιδήρου - 4 μικρό 2 3ρε 6 .
Περιοδικός πίνακας χημικών στοιχείων του D. I. Mendeleev
(φυσικό σύστημα χημικών στοιχείων)
Περιοδικός νόμοςχημικά στοιχεία (σύγχρονη σύνθεση): ιδιότητες χημικών στοιχείων, καθώς και απλές και σύνθετες ουσίες, που σχηματίζονται από αυτούς, εξαρτώνται περιοδικά από την τιμή του φορτίου από τους ατομικούς πυρήνες.
Περιοδικός Πίνακας- γραφική έκφραση του περιοδικού νόμου.
Φυσική σειρά χημικών στοιχείων- μια σειρά από χημικά στοιχεία διατεταγμένα ανάλογα με τον αυξανόμενο αριθμό πρωτονίων στους πυρήνες των ατόμων τους ή, το ίδιο, σύμφωνα με τα αυξανόμενα φορτία των πυρήνων αυτών των ατόμων. Ο ατομικός αριθμός ενός στοιχείου αυτής της σειράς είναι ίσος με τον αριθμό των πρωτονίων στον πυρήνα οποιουδήποτε ατόμου αυτού του στοιχείου.
Ο πίνακας των χημικών στοιχείων κατασκευάζεται «κόβοντας» τη φυσική σειρά των χημικών στοιχείων σε έμμηνα(οριζόντιες σειρές του πίνακα) και ομαδοποιήσεις (κάθετες στήλες του πίνακα) στοιχείων με παρόμοια ηλεκτρονική δομή ατόμων.
Ανάλογα με τον τρόπο που συνδυάζετε στοιχεία σε ομάδες, ο πίνακας μπορεί να είναι μεγάλη περίοδος(στοιχεία με τον ίδιο αριθμό και τον ίδιο τύπο ηλεκτρονίων σθένους συλλέγονται σε ομάδες) και μικρή περίοδος(στοιχεία με τον ίδιο αριθμό ηλεκτρονίων σθένους συλλέγονται σε ομάδες).
Οι ομάδες πινάκων μικρής περιόδου χωρίζονται σε υποομάδες ( κύριοςΚαι πλευρά), που συμπίπτει με τις ομάδες του πίνακα μεγάλης περιόδου.
Όλα τα άτομα των στοιχείων της ίδιας περιόδου έχουν τον ίδιο αριθμό στιβάδων ηλεκτρονίων, ίσο με τον αριθμό της περιόδου.
Αριθμός στοιχείων σε περιόδους: 2, 8, 8, 18, 18, 32, 32. Τα περισσότερα από τα στοιχεία της όγδοης περιόδου ελήφθησαν τεχνητά· τα τελευταία στοιχεία αυτής της περιόδου δεν έχουν ακόμη συντεθεί. Όλες οι περίοδοι εκτός από την πρώτη ξεκινούν με το σχηματισμό ενός στοιχείου αλκαλιμέταλλο(Li, Na, K, κ.λπ.) και τελειώνουν με ένα στοιχείο σχηματισμού ευγενών αερίων (He, Ne, Ar, Kr κ.λπ.).
Στον πίνακα μικρής περιόδου υπάρχουν οκτώ ομάδες, καθεμία από τις οποίες χωρίζεται σε δύο υποομάδες (κύρια και δευτερεύουσα), στον πίνακα μεγάλης περιόδου υπάρχουν δεκαέξι ομάδες, οι οποίες αριθμούνται με λατινικούς αριθμούς με τα γράμματα Α ή Β, για παράδειγμα: IA, IIIB, VIA, VIIB. Η ομάδα ΙΑ του πίνακα μεγάλης περιόδου αντιστοιχεί στην κύρια υποομάδα της πρώτης ομάδας του πίνακα μικρής περιόδου. ομάδα VIIB - δευτερεύουσα υποομάδα της έβδομης ομάδας: τα υπόλοιπα - ομοίως.
Τα χαρακτηριστικά των χημικών στοιχείων αλλάζουν φυσικά σε ομάδες και περιόδους.
Σε περιόδους (με αυξανόμενο αύξοντα αριθμό)
- το πυρηνικό φορτίο αυξάνεται
- ο αριθμός των εξωτερικών ηλεκτρονίων αυξάνεται,
- η ακτίνα των ατόμων μειώνεται,
- η ισχύς του δεσμού μεταξύ ηλεκτρονίων και πυρήνα αυξάνεται (ενέργεια ιονισμού),
- αυξάνεται η ηλεκτραρνητικότητα,
- ενισχύονται οι οξειδωτικές ιδιότητες απλές ουσίες("μη μεταλλικότητα"),
- οι αναγωγικές ιδιότητες των απλών ουσιών εξασθενούν ("μεταλλικότητα"),
- εξασθενεί τον βασικό χαρακτήρα των υδροξειδίων και των αντίστοιχων οξειδίων,
- ο όξινος χαρακτήρας των υδροξειδίων και των αντίστοιχων οξειδίων αυξάνεται.
Σε ομάδες (με αυξανόμενο σειριακό αριθμό)
- το πυρηνικό φορτίο αυξάνεται
- η ακτίνα των ατόμων αυξάνεται (μόνο στις ομάδες Α),
- η ισχύς του δεσμού μεταξύ ηλεκτρονίων και πυρήνα μειώνεται (ενέργεια ιονισμού, μόνο σε ομάδες Α),
- η ηλεκτραρνητικότητα μειώνεται (μόνο στις ομάδες Α),
- οι οξειδωτικές ιδιότητες απλών ουσιών εξασθενούν ("μη μεταλλικότητα", μόνο στις ομάδες Α),
- οι αναγωγικές ιδιότητες των απλών ουσιών ενισχύονται ("μεταλλικότητα", μόνο σε ομάδες Α),
- ο βασικός χαρακτήρας των υδροξειδίων και των αντίστοιχων οξειδίων αυξάνεται (μόνο στις ομάδες Α),
- εξασθενεί τον όξινο χαρακτήρα των υδροξειδίων και των αντίστοιχων οξειδίων (μόνο στις ομάδες Α),
- η σταθερότητα των ενώσεων υδρογόνου μειώνεται (αυξάνεται η αναγωγική τους δράση, μόνο στις Α-ομάδες).
Εργασίες και τεστ με θέμα «Θέμα 9. «Δομή του ατόμου. Περιοδικός νόμος και περιοδικό σύστημα χημικών στοιχείων του D. I. Mendeleev (PSHE) "."
- Περιοδικός νόμος - Περιοδικός νόμος και δομή ατόμων βαθμοί 8–9
Πρέπει να γνωρίζετε: τους νόμους της πλήρωσης των τροχιακών με ηλεκτρόνια (αρχή της ελάχιστης ενέργειας, η αρχή Pauli, ο κανόνας του Hund), τη δομή του περιοδικού πίνακα των στοιχείων.Πρέπει να είστε σε θέση: να προσδιορίσετε τη σύνθεση ενός ατόμου από τη θέση του στοιχείου στον περιοδικό πίνακα και, αντίθετα, να βρείτε ένα στοιχείο στο περιοδικό σύστημα, γνωρίζοντας τη σύστασή του. απεικονίζουν το διάγραμμα δομής, την ηλεκτρονική διαμόρφωση ενός ατόμου, ιόντος και, αντιστρόφως, προσδιορίζουν τη θέση ενός χημικού στοιχείου στο PSCE από το διάγραμμα και την ηλεκτρονική διαμόρφωση. χαρακτηρίζει το στοιχείο και τις ουσίες που σχηματίζει σύμφωνα με τη θέση του στο PSCE· προσδιορίζει τις αλλαγές στην ακτίνα των ατόμων, τις ιδιότητες των χημικών στοιχείων και των ουσιών που σχηματίζουν μέσα σε μία περίοδο και μία κύρια υποομάδα του περιοδικού συστήματος.
Παράδειγμα 1.Προσδιορίστε τον αριθμό των τροχιακών στο τρίτο επίπεδο ηλεκτρονίων. Ποια είναι αυτά τα τροχιακά;
Για να προσδιορίσουμε τον αριθμό των τροχιακών, χρησιμοποιούμε τον τύπο Ντροχιακά = n 2 όπου n- αριθμός επιπέδου. Ντροχιακά = 3 2 = 9. Ένα 3 μικρό-, τρία 3 Π- και πέντε 3 ρε-τροχιακά.Παράδειγμα 2.Προσδιορίστε ποιο άτομο στοιχείου έχει τον ηλεκτρονικό τύπο 1 μικρό 2 2μικρό 2 2Π 6 3μικρό 2 3Π 1 .
Για να προσδιορίσετε ποιο στοιχείο είναι, πρέπει να μάθετε τον ατομικό του αριθμό, ο οποίος είναι ίσος με τον συνολικό αριθμό των ηλεκτρονίων του ατόμου. Σε αυτή την περίπτωση: 2 + 2 + 6 + 2 + 1 = 13. Αυτό είναι αλουμίνιο.Αφού βεβαιωθείτε ότι όλα όσα χρειάζεστε έχουν μάθει, προχωρήστε στην ολοκλήρωση των εργασιών. Σας ευχόμαστε επιτυχία.
Προτεινόμενη ανάγνωση:- O. S. Gabrielyan και άλλοι Χημεία 11η τάξη. Μ., Bustard, 2002;
- Γ. Ε. Ρουτζίτης, Φ. Γ. Φέλντμαν. Χημεία 11η τάξη. Μ., Εκπαίδευση, 2001.
Όπως γνωρίζετε, οτιδήποτε υλικό στο Σύμπαν αποτελείται από άτομα. Ένα άτομο είναι η μικρότερη μονάδα ύλης που φέρει τις ιδιότητές της. Με τη σειρά του, η δομή του ατόμου αποτελείται από μια μαγική τριάδα μικροσωματιδίων: πρωτόνια, νετρόνια και ηλεκτρόνια.
Επιπλέον, κάθε ένα από τα μικροσωματίδια είναι καθολικό. Δηλαδή, δεν μπορείτε να βρείτε δύο διαφορετικά πρωτόνια, νετρόνια ή ηλεκτρόνια στον κόσμο. Είναι όλα απολύτως παρόμοια μεταξύ τους. Και οι ιδιότητες του ατόμου θα εξαρτηθούν μόνο από την ποσοτική σύνθεση αυτών των μικροσωματιδίων γενική δομήάτομο.
Για παράδειγμα, η δομή ενός ατόμου υδρογόνου αποτελείται από ένα πρωτόνιο και ένα ηλεκτρόνιο. Το επόμενο πιο πολύπλοκο άτομο, το ήλιο, αποτελείται από δύο πρωτόνια, δύο νετρόνια και δύο ηλεκτρόνια. Άτομο λιθίου - κατασκευασμένο από τρία πρωτόνια, τέσσερα νετρόνια και τρία ηλεκτρόνια κ.λπ.
Ατομική δομή (από αριστερά προς τα δεξιά): υδρογόνο, ήλιο, λίθιοΤα άτομα συνδυάζονται για να σχηματίσουν μόρια και τα μόρια συνδυάζονται για να σχηματίσουν ουσίες, μέταλλα και οργανισμούς. Το μόριο DNA, το οποίο είναι η βάση όλων των ζωντανών όντων, είναι μια δομή που συναρμολογείται από τα ίδια τρία μαγικά τούβλα του σύμπαντος όπως η πέτρα που βρίσκεται στο δρόμο. Αν και αυτή η δομή είναι πολύ πιο περίπλοκη.
Ακόμα περισσότερο καταπληκτικά γεγονότααποκαλύπτονται όταν προσπαθούμε να ρίξουμε μια πιο προσεκτική ματιά στις αναλογίες και τη δομή του ατομικού συστήματος. Είναι γνωστό ότι ένα άτομο αποτελείται από έναν πυρήνα και ηλεκτρόνια που κινούνται γύρω του κατά μήκος μιας τροχιάς που περιγράφει μια σφαίρα. Δηλαδή, δεν μπορεί καν να ονομαστεί κίνημα με τη συνήθη έννοια του όρου. Μάλλον, το ηλεκτρόνιο βρίσκεται παντού και αμέσως μέσα σε αυτή τη σφαίρα, δημιουργώντας ένα σύννεφο ηλεκτρονίων γύρω από τον πυρήνα και σχηματίζοντας ένα ηλεκτρομαγνητικό πεδίο.
 Σχηματικές αναπαραστάσεις της δομής ενός ατόμου
Σχηματικές αναπαραστάσεις της δομής ενός ατόμου Ο πυρήνας ενός ατόμου αποτελείται από πρωτόνια και νετρόνια και σχεδόν όλη η μάζα του συστήματος είναι συγκεντρωμένη σε αυτόν. Αλλά ταυτόχρονα, ο ίδιος ο πυρήνας είναι τόσο μικρός που αν η ακτίνα του αυξηθεί σε κλίμακα 1 cm, τότε η ακτίνα ολόκληρης της ατομικής δομής θα φτάσει τις εκατοντάδες μέτρα. Έτσι, όλα όσα αντιλαμβανόμαστε ως πυκνή ύλη αποτελούνται από περισσότερο από το 99% των ενεργειακών δεσμών μεταξύ των φυσικών σωματιδίων μόνο και λιγότερο από το 1% των ίδιων των φυσικών μορφών.
Ποιες είναι όμως αυτές οι φυσικές μορφές; Από τι κατασκευάζονται και πόσο υλικό είναι; Για να απαντήσουμε σε αυτές τις ερωτήσεις, ας ρίξουμε μια πιο προσεκτική ματιά στις δομές των πρωτονίων, των νετρονίων και των ηλεκτρονίων. Έτσι, κατεβαίνουμε ένα ακόμη βήμα στα βάθη του μικροκόσμου - στο επίπεδο των υποατομικών σωματιδίων.
Από τι αποτελείται ένα ηλεκτρόνιο;
Το μικρότερο σωματίδιο ενός ατόμου είναι ένα ηλεκτρόνιο. Ένα ηλεκτρόνιο έχει μάζα αλλά όχι όγκο. Στην επιστημονική έννοια, ένα ηλεκτρόνιο δεν αποτελείται από τίποτα, αλλά είναι ένα σημείο χωρίς δομή.
Ένα ηλεκτρόνιο δεν μπορεί να δει στο μικροσκόπιο. Είναι ορατό μόνο στη μορφή ηλεκτρονικό σύννεφο, που μοιάζει με μια θολή σφαίρα γύρω από τον ατομικό πυρήνα. Ταυτόχρονα, είναι αδύνατο να πούμε με ακρίβεια πού βρίσκεται το ηλεκτρόνιο σε μια χρονική στιγμή. Τα όργανα είναι ικανά να συλλάβουν όχι το ίδιο το σωματίδιο, αλλά μόνο το ενεργειακό του ίχνος. Η ουσία του ηλεκτρονίου δεν είναι ενσωματωμένη στην έννοια της ύλης. Μοιάζει μάλλον με κάποια άδεια μορφή που υπάρχει μόνο στην κίνηση και λόγω κίνησης.

Δεν έχει ανακαλυφθεί ακόμη δομή στο ηλεκτρόνιο. Είναι το ίδιο σημειακό σωματίδιο με ένα ενεργειακό κβάντο. Στην πραγματικότητα, ένα ηλεκτρόνιο είναι ενέργεια, ωστόσο, είναι μια πιο σταθερή μορφή του από αυτή που αντιπροσωπεύεται από φωτόνια φωτός.
Αυτή τη στιγμή, το ηλεκτρόνιο θεωρείται αδιαίρετο. Αυτό είναι κατανοητό, γιατί είναι αδύνατο να διαιρεθεί κάτι που δεν έχει όγκο. Ωστόσο, η θεωρία έχει ήδη εξελίξεις σύμφωνα με τις οποίες το ηλεκτρόνιο περιέχει μια τριάδα τέτοιων οιονεί σωματιδίων όπως:
- Orbiton – περιέχει πληροφορίες σχετικά με την τροχιακή θέση του ηλεκτρονίου.
- Spinon – υπεύθυνος για το σπινάρισμα ή τη ροπή.
- Holon - μεταφέρει πληροφορίες σχετικά με το φορτίο του ηλεκτρονίου.
Ωστόσο, όπως βλέπουμε, τα οιονεί σωματίδια δεν έχουν απολύτως τίποτα κοινό με την ύλη και φέρουν μόνο πληροφορίες.
 Φωτογραφίες ατόμων διαφορετικές ουσίες V ηλεκτρονικό μικροσκόπιο
Φωτογραφίες ατόμων διαφορετικές ουσίες V ηλεκτρονικό μικροσκόπιο
Είναι ενδιαφέρον ότι ένα ηλεκτρόνιο μπορεί να απορροφήσει ενεργειακά κβάντα, όπως φως ή θερμότητα. Σε αυτή την περίπτωση, το άτομο μετακινείται σε ένα νέο ενεργειακό επίπεδο και τα όρια του νέφους ηλεκτρονίων επεκτείνονται. Συμβαίνει επίσης ότι η ενέργεια που απορροφάται από ένα ηλεκτρόνιο είναι τόσο μεγάλη που μπορεί να πηδήξει έξω από το ατομικό σύστημα και να συνεχίσει την κίνησή του ως ανεξάρτητο σωματίδιο. Ταυτόχρονα, συμπεριφέρεται σαν φωτόνιο φωτός, δηλαδή φαίνεται να παύει να είναι σωματίδιο και αρχίζει να εμφανίζει τις ιδιότητες ενός κύματος. Αυτό αποδείχθηκε σε ένα πείραμα.
Το πείραμα του Γιουνγκ
Κατά τη διάρκεια του πειράματος, ένα ρεύμα ηλεκτρονίων κατευθύνθηκε σε μια οθόνη με δύο σχισμές κομμένες σε αυτό. Περνώντας μέσα από αυτές τις σχισμές, τα ηλεκτρόνια συγκρούστηκαν με την επιφάνεια μιας άλλης οθόνης προβολής, αφήνοντας το σημάδι τους πάνω της. Ως αποτέλεσμα αυτού του «βομβαρδισμού» ηλεκτρονίων, εμφανίστηκε ένα μοτίβο παρεμβολής στην οθόνη προβολής, παρόμοιο με αυτό που θα εμφανιζόταν εάν τα κύματα, αλλά όχι τα σωματίδια, περνούσαν από δύο σχισμές.
Αυτό το μοτίβο προκύπτει επειδή ένα κύμα που περνά ανάμεσα σε δύο σχισμές χωρίζεται σε δύο κύματα. Ως αποτέλεσμα περαιτέρω κίνησης, τα κύματα επικαλύπτονται μεταξύ τους και σε ορισμένες περιοχές ακυρώνονται αμοιβαία. Το αποτέλεσμα είναι πολλές γραμμές στην οθόνη προβολής, αντί για μία, όπως θα συνέβαινε αν το ηλεκτρόνιο συμπεριφερόταν σαν σωματίδιο.

Δομή του πυρήνα ενός ατόμου: πρωτόνια και νετρόνια
Τα πρωτόνια και τα νετρόνια αποτελούν τον πυρήνα ενός ατόμου. Και παρά το γεγονός ότι ο πυρήνας καταλαμβάνει λιγότερο από το 1% του συνολικού όγκου, σε αυτή τη δομή συγκεντρώνεται σχεδόν ολόκληρη η μάζα του συστήματος. Αλλά οι φυσικοί διχάζονται ως προς τη δομή των πρωτονίων και των νετρονίων, και αυτή τη στιγμήΥπάρχουν δύο θεωρίες ταυτόχρονα.
- Θεωρία Νο 1 - Πρότυπο
Το Καθιερωμένο Μοντέλο λέει ότι τα πρωτόνια και τα νετρόνια αποτελούνται από τρία κουάρκ που συνδέονται με ένα νέφος γκλουονίων. Τα κουάρκ είναι σημειακά σωματίδια, όπως τα κβάντα και τα ηλεκτρόνια. Και τα γκλουόνια είναι εικονικά σωματίδια που εξασφαλίζουν την αλληλεπίδραση των κουάρκ. Ωστόσο, ούτε κουάρκ ούτε γκλουόνια βρέθηκαν ποτέ στη φύση, επομένως αυτό το μοντέλο υπόκειται σε αυστηρή κριτική.
- Θεωρία #2 - Εναλλακτική
Αλλά σύμφωνα με την εναλλακτική θεωρία ενοποιημένου πεδίου που αναπτύχθηκε από τον Αϊνστάιν, το πρωτόνιο, όπως το νετρόνιο, όπως κάθε άλλο σωματίδιο φυσικό κόσμο, είναι ένα ηλεκτρομαγνητικό πεδίο που περιστρέφεται με την ταχύτητα του φωτός.
 Ηλεκτρομαγνητικά πεδίαάνθρωπος και πλανήτης
Ηλεκτρομαγνητικά πεδίαάνθρωπος και πλανήτης Ποιες είναι οι αρχές της ατομικής δομής;
Τα πάντα στον κόσμο - λεπτό και πυκνό, υγρό, στερεό και αέριο - είναι απλώς οι ενεργειακές καταστάσεις αμέτρητων πεδίων που διαπερνούν τον χώρο του Σύμπαντος. Όσο υψηλότερο είναι το επίπεδο ενέργειας στο πεδίο, τόσο πιο λεπτό και λιγότερο αντιληπτό είναι. Όσο χαμηλότερο είναι το επίπεδο ενέργειας, τόσο πιο σταθερό και απτό είναι. Η δομή του ατόμου, καθώς και η δομή οποιασδήποτε άλλης μονάδας του Σύμπαντος, έγκειται στην αλληλεπίδραση τέτοιων πεδίων - διαφορετικών σε ενεργειακή πυκνότητα. Αποδεικνύεται ότι η ύλη είναι απλώς μια ψευδαίσθηση του νου.
Ηλεκτρόνια
Η έννοια του ατόμου προέκυψε στον αρχαίο κόσμο για να προσδιορίσει τα σωματίδια της ύλης. Μεταφρασμένο από τα ελληνικά, το atom σημαίνει «αδιαίρετο».

Ο Ιρλανδός φυσικός Stoney, βασισμένος σε πειράματα, κατέληξε στο συμπέρασμα ότι η ηλεκτρική ενέργεια μεταφέρεται από τα μικρότερα σωματίδια που υπάρχουν στα άτομα όλων των χημικών στοιχείων. Το 1891, ο Stoney πρότεινε να ονομαστούν αυτά τα σωματίδια ηλεκτρόνια, που σημαίνει «κεχριμπαρένιο» στα ελληνικά. Λίγα χρόνια αφότου το ηλεκτρόνιο πήρε το όνομά του, ο Άγγλος φυσικός Joseph Thomson και ο Γάλλος φυσικός Jean Perrin απέδειξαν ότι τα ηλεκτρόνια φέρουν αρνητικό φορτίο. Αυτό είναι το μικρότερο αρνητικό φορτίο, το οποίο στη χημεία λαμβάνεται ως ένα (-1). Ο Thomson κατάφερε μάλιστα να προσδιορίσει την ταχύτητα του ηλεκτρονίου (η ταχύτητα του ηλεκτρονίου στην τροχιά είναι αντιστρόφως ανάλογη με τον αριθμό τροχιάς n. Οι ακτίνες των τροχιών αυξάνονται αναλογικά με το τετράγωνο του αριθμού τροχιάς. Στην πρώτη τροχιά του άτομο υδρογόνου (n=1, Z=1) η ταχύτητα είναι ≈ 2,2·106 m/s, δηλαδή περίπου εκατό φορές μικρότερη από την ταχύτητα του φωτός c = 3·108 m/s) και τη μάζα του ηλεκτρονίου (είναι σχεδόν 2000 φορές μικρότερη από τη μάζα του ατόμου του υδρογόνου).

Κατάσταση ηλεκτρονίων σε ένα άτομο
Η κατάσταση ενός ηλεκτρονίου σε ένα άτομο νοείται ως ένα σύνολο πληροφοριών σχετικά με την ενέργεια ενός συγκεκριμένου ηλεκτρονίου και τον χώρο στον οποίο βρίσκεται. Ένα ηλεκτρόνιο σε ένα άτομο δεν έχει τροχιά κίνησης, δηλαδή μπορούμε μόνο να μιλήσουμε την πιθανότητα να το βρούμε στον χώρο γύρω από τον πυρήνα.
 Μπορεί να βρίσκεται σε οποιοδήποτε μέρος αυτού του χώρου που περιβάλλει τον πυρήνα και το σύνολο των διαφόρων θέσεων του θεωρείται ως ένα νέφος ηλεκτρονίων με μια ορισμένη αρνητική πυκνότητα φορτίου. Μεταφορικά, αυτό μπορεί να φανταστεί ως εξής: αν ήταν δυνατό να φωτογραφηθεί η θέση ενός ηλεκτρονίου σε ένα άτομο μετά από εκατοστά ή εκατομμυριοστά του δευτερολέπτου, όπως σε ένα φινίρισμα φωτογραφίας, τότε το ηλεκτρόνιο σε τέτοιες φωτογραφίες θα παριστάνεται ως κουκκίδες. Εάν υπήρχαν αμέτρητες τέτοιες φωτογραφίες, η εικόνα θα ήταν ένα νέφος ηλεκτρονίων με τη μεγαλύτερη πυκνότητα όπου θα υπήρχαν τα περισσότερα από αυτά τα σημεία.
Μπορεί να βρίσκεται σε οποιοδήποτε μέρος αυτού του χώρου που περιβάλλει τον πυρήνα και το σύνολο των διαφόρων θέσεων του θεωρείται ως ένα νέφος ηλεκτρονίων με μια ορισμένη αρνητική πυκνότητα φορτίου. Μεταφορικά, αυτό μπορεί να φανταστεί ως εξής: αν ήταν δυνατό να φωτογραφηθεί η θέση ενός ηλεκτρονίου σε ένα άτομο μετά από εκατοστά ή εκατομμυριοστά του δευτερολέπτου, όπως σε ένα φινίρισμα φωτογραφίας, τότε το ηλεκτρόνιο σε τέτοιες φωτογραφίες θα παριστάνεται ως κουκκίδες. Εάν υπήρχαν αμέτρητες τέτοιες φωτογραφίες, η εικόνα θα ήταν ένα νέφος ηλεκτρονίων με τη μεγαλύτερη πυκνότητα όπου θα υπήρχαν τα περισσότερα από αυτά τα σημεία.
Ο χώρος γύρω από τον ατομικό πυρήνα στον οποίο είναι πιο πιθανό να βρεθεί ένα ηλεκτρόνιο ονομάζεται τροχιακό. Περιέχει περίπου 90% ηλεκτρονικό σύννεφο, και αυτό σημαίνει ότι περίπου το 90% του χρόνου το ηλεκτρόνιο βρίσκεται σε αυτό το μέρος του χώρου. Διακρίνονται από το σχήμα 4 γνωστοί σήμερα τύποι τροχιακών, τα οποία ονομάζονται λατινικά γράμματα s, p, d και f. Γραφική εικόναΟρισμένες μορφές τροχιακών ηλεκτρονίων φαίνονται στο σχήμα.

Το πιο σημαντικό χαρακτηριστικό της κίνησης ενός ηλεκτρονίου σε ένα συγκεκριμένο τροχιακό είναι ενέργεια της σύνδεσής του με τον πυρήνα. Τα ηλεκτρόνια με παρόμοιες τιμές ενέργειας σχηματίζουν ένα ενιαίο στρώμα ηλεκτρονίων ή ένα επίπεδο ενέργειας. Τα επίπεδα ενέργειας αριθμούνται ξεκινώντας από τον πυρήνα - 1, 2, 3, 4, 5, 6 και 7.
Ο ακέραιος αριθμός n, που δείχνει τον αριθμό του ενεργειακού επιπέδου, ονομάζεται κύριος κβαντικός αριθμός. Χαρακτηρίζει την ενέργεια των ηλεκτρονίων που καταλαμβάνουν ένα δεδομένο ενεργειακό επίπεδο. Τα ηλεκτρόνια του πρώτου ενεργειακού επιπέδου, που βρίσκονται πιο κοντά στον πυρήνα, έχουν τη χαμηλότερη ενέργεια.Σε σύγκριση με τα ηλεκτρόνια του πρώτου επιπέδου, τα ηλεκτρόνια των επόμενων επιπέδων θα χαρακτηρίζονται από μεγάλη παροχή ενέργειας. Κατά συνέπεια, τα ηλεκτρόνια του εξωτερικού επιπέδου είναι λιγότερο στενά συνδεδεμένα με τον ατομικό πυρήνα.
Ο μεγαλύτερος αριθμός ηλεκτρονίων σε ενεργειακό επίπεδο προσδιορίζεται από τον τύπο:
N = 2n 2 ,
όπου N είναι ο μέγιστος αριθμός ηλεκτρονίων. n είναι ο αριθμός επιπέδου ή ο κύριος κβαντικός αριθμός. Κατά συνέπεια, στο πρώτο ενεργειακό επίπεδο που βρίσκεται πιο κοντά στον πυρήνα δεν μπορεί να υπάρχουν περισσότερα από δύο ηλεκτρόνια. στο δεύτερο - όχι περισσότερο από 8. στο τρίτο - όχι περισσότερο από 18. την τέταρτη - όχι περισσότερο από 32.
Ξεκινώντας από το δεύτερο επίπεδο ενέργειας (n = 2), καθένα από τα επίπεδα χωρίζεται σε υποεπίπεδα (υποστιβάδες), ελαφρώς διαφορετικά μεταξύ τους ως προς την ενέργεια δέσμευσης με τον πυρήνα. Ο αριθμός των υποεπιπέδων είναι ίσος με την τιμή του κύριου κβαντικού αριθμού: το πρώτο επίπεδο ενέργειας έχει ένα υποεπίπεδο. το δεύτερο - δύο? τρίτο - τρία? τέταρτο - τέσσερα υποεπίπεδα. Τα υποεπίπεδα, με τη σειρά τους, σχηματίζονται από τροχιακά. Κάθε τιμήΤο n αντιστοιχεί στον αριθμό των τροχιακών ίσο με n.
Τα υποεπίπεδα υποδηλώνονται συνήθως με λατινικά γράμματα, καθώς και με το σχήμα των τροχιακών από τα οποία αποτελούνται: s, p, d, f.

Πρωτόνια και Νετρόνια

Ένα άτομο οποιουδήποτε χημικού στοιχείου είναι συγκρίσιμο με ένα μικροσκοπικό ηλιακό σύστημα. Επομένως, αυτό το μοντέλο του ατόμου, που προτάθηκε από τον E. Rutherford, ονομάζεται πλανητικός.
Ο ατομικός πυρήνας, στον οποίο συγκεντρώνεται ολόκληρη η μάζα του ατόμου, αποτελείται από σωματίδια δύο τύπων - πρωτόνια και νετρόνια.
Τα πρωτόνια έχουν φορτίο ίσο με το φορτίο των ηλεκτρονίων, αλλά αντίθετο στο πρόσημο (+1) και μάζα ίσο με μάζαάτομο υδρογόνου (λαμβάνεται ως μονάδα στη χημεία). Τα νετρόνια δεν φέρουν φορτίο, είναι ουδέτερα και έχουν μάζα ίση με τη μάζα ενός πρωτονίου.
Τα πρωτόνια και τα νετρόνια μαζί ονομάζονται νουκλεόνια (από το λατινικό nucleus - nucleus). Το άθροισμα του αριθμού των πρωτονίων και των νετρονίων σε ένα άτομο ονομάζεται μαζικός αριθμός. Για παράδειγμα, ο αριθμός μάζας ενός ατόμου αλουμινίου είναι:

13 + 14 = 27
αριθμός πρωτονίων 13, αριθμός νετρονίων 14, αριθμός μάζας 27
Δεδομένου ότι η μάζα του ηλεκτρονίου, η οποία είναι αμελητέα μικρή, μπορεί να παραμεληθεί, είναι προφανές ότι ολόκληρη η μάζα του ατόμου είναι συγκεντρωμένη στον πυρήνα. Τα ηλεκτρόνια ονομάζονται e-.
Από το άτομο ηλεκτρικά ουδέτερο, τότε είναι επίσης προφανές ότι ο αριθμός των πρωτονίων και των ηλεκτρονίων σε ένα άτομο είναι ο ίδιος. Είναι ίσος με τον αύξοντα αριθμό του χημικού στοιχείου που του έχει αποδοθεί στο Περιοδικός Πίνακας. Η μάζα ενός ατόμου αποτελείται από τη μάζα των πρωτονίων και των νετρονίων. Γνωρίζοντας τον ατομικό αριθμό του στοιχείου (Ζ), δηλαδή τον αριθμό των πρωτονίων, και τον αριθμό μάζας (Α), ίσο με το άθροισμα των αριθμών των πρωτονίων και των νετρονίων, μπορείτε να βρείτε τον αριθμό των νετρονίων (Ν) χρησιμοποιώντας τον τύπο :

Ν = Α - Ζ
Για παράδειγμα, ο αριθμός των νετρονίων σε ένα άτομο σιδήρου είναι:
56 — 26 = 30
Ισότοπα
Ονομάζονται ποικιλίες ατόμων του ίδιου στοιχείου που έχουν το ίδιο πυρηνικό φορτίο αλλά διαφορετικούς αριθμούς μάζας ισότοπα. Τα χημικά στοιχεία που βρίσκονται στη φύση είναι ένα μείγμα ισοτόπων. Έτσι, ο άνθρακας έχει τρία ισότοπα με μάζες 12, 13, 14. οξυγόνο - τρία ισότοπα με μάζες 16, 17, 18 κ.λπ. Η σχετική ατομική μάζα ενός χημικού στοιχείου που συνήθως δίνεται στον Περιοδικό Πίνακα είναι η μέση τιμή των ατομικών μαζών ενός φυσικού μείγματος ισοτόπων ενός δεδομένου στοιχείου, λαμβάνοντας υπόψη τη σχετική αφθονία τους στη φύση. Χημικές ιδιότητεςΤα ισότοπα των περισσότερων χημικών στοιχείων είναι ακριβώς τα ίδια. Ωστόσο, τα ισότοπα υδρογόνου ποικίλλουν σε μεγάλο βαθμό ως προς τις ιδιότητες λόγω της δραματικής πολλαπλής αύξησης της σχετικής ατομικής τους μάζας. τους δίνονται ακόμη και μεμονωμένα ονόματα και χημικά σύμβολα.

Στοιχεία της πρώτης περιόδου
Διάγραμμα της ηλεκτρονικής δομής του ατόμου υδρογόνου:

Τα διαγράμματα της ηλεκτρονικής δομής των ατόμων δείχνουν την κατανομή των ηλεκτρονίων στα ηλεκτρονικά στρώματα (ενεργειακά επίπεδα).

Γραφικός ηλεκτρονικός τύπος του ατόμου υδρογόνου (δείχνει την κατανομή των ηλεκτρονίων ανά ενεργειακά επίπεδα και υποεπίπεδα):

Οι γραφικοί ηλεκτρονικοί τύποι των ατόμων δείχνουν την κατανομή των ηλεκτρονίων όχι μόνο μεταξύ επιπέδων και υποεπίπεδων, αλλά και μεταξύ τροχιακών.
Σε ένα άτομο ηλίου, το πρώτο στρώμα ηλεκτρονίων είναι πλήρες - έχει 2 ηλεκτρόνια. Το υδρογόνο και το ήλιο είναι s-στοιχεία. Το τροχιακό s αυτών των ατόμων είναι γεμάτο με ηλεκτρόνια.

Για όλα τα στοιχεία της δεύτερης περιόδου γεμίζει το πρώτο ηλεκτρονικό στρώμα, και τα ηλεκτρόνια γεμίζουν τα τροχιακά s και p του δεύτερου στρώματος ηλεκτρονίων σύμφωνα με την αρχή της ελάχιστης ενέργειας (πρώτα s και μετά p) και τους κανόνες Pauli και Hund.
Στο άτομο νέον, το δεύτερο στρώμα ηλεκτρονίων είναι πλήρες - έχει 8 ηλεκτρόνια.
Για τα άτομα των στοιχείων της τρίτης περιόδου, η πρώτη και η δεύτερη ηλεκτρονική στιβάδα συμπληρώνονται, επομένως γεμίζεται η τρίτη ηλεκτρονική στιβάδα, στην οποία τα ηλεκτρόνια μπορούν να καταλάβουν τα 3s-, 3p- και 3d-υποεπίπεδα.
Το άτομο μαγνησίου ολοκληρώνει το 3s ηλεκτρονιακό τροχιακό του. Το Na και το Mg είναι s-στοιχεία.
Στο αλουμίνιο και τα επόμενα στοιχεία, το υποεπίπεδο 3p είναι γεμάτο με ηλεκτρόνια.
Τα στοιχεία της τρίτης περιόδου έχουν μη συμπληρωμένα τρισδιάστατα τροχιακά.
Όλα τα στοιχεία από το Al έως το Ar είναι στοιχεία p. Τα στοιχεία s και p αποτελούν τις κύριες υποομάδες στον Περιοδικό Πίνακα.

Στοιχεία τέταρτης - έβδομης περιόδου
Ένα τέταρτο στρώμα ηλεκτρονίων εμφανίζεται στα άτομα καλίου και ασβεστίου και το υποεπίπεδο 4s είναι γεμάτο, καθώς έχει χαμηλότερη ενέργεια από το υποεπίπεδο 3d.
K, Ca - s-στοιχεία που περιλαμβάνονται στις κύριες υποομάδες. Για άτομα από Sc έως Zn, το 3d υποεπίπεδο είναι γεμάτο με ηλεκτρόνια. Αυτά είναι τρισδιάστατα στοιχεία. Περιλαμβάνονται σε δευτερεύουσες υποομάδες, το εξωτερικό τους ηλεκτρονικό στρώμα είναι γεμάτο και ταξινομούνται ως μεταβατικά στοιχεία.
Δώστε προσοχή στη δομή των ηλεκτρονικών κελυφών ατόμων χρωμίου και χαλκού. Σε αυτά, ένα ηλεκτρόνιο "αποτυγχάνει" από το 4s στο 3d υποεπίπεδο, γεγονός που εξηγείται από τη μεγαλύτερη ενεργειακή σταθερότητα των ηλεκτρονικών διαμορφώσεων που προκύπτουν 3d 5 και 3d 10:

Στο άτομο ψευδαργύρου, η τρίτη στοιβάδα ηλεκτρονίων έχει ολοκληρωθεί - όλα τα υποεπίπεδα 3s, 3p και 3d είναι γεμάτα σε αυτό, με συνολικά 18 ηλεκτρόνια. Στα στοιχεία που ακολουθούν τον ψευδάργυρο, το τέταρτο στρώμα ηλεκτρονίων, το υποεπίπεδο 4p, συνεχίζει να γεμίζει.
Τα στοιχεία από το Ga έως το Kr είναι στοιχεία p.
Το άτομο κρυπτών έχει μια εξωτερική στιβάδα (τέταρτη) που είναι πλήρης και έχει 8 ηλεκτρόνια. Αλλά μπορεί να υπάρχουν συνολικά 32 ηλεκτρόνια στο τέταρτο στρώμα ηλεκτρονίων. το άτομο κρυπτών έχει ακόμη μη συμπληρωμένα υποεπίπεδα 4d και 4f. Για στοιχεία της πέμπτης περιόδου, τα υποεπίπεδα συμπληρώνονται με την ακόλουθη σειρά: 5s - 4d - 5p. Και υπάρχουν επίσης εξαιρέσεις που σχετίζονται με « αποτυχία» ηλεκτρόνια, y 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
Στην έκτη και έβδομη περίοδο, εμφανίζονται τα στοιχεία f, δηλαδή στοιχεία στα οποία γεμίζονται τα υποεπίπεδα 4f και 5f του τρίτου εξωτερικού ηλεκτρονικού στρώματος, αντίστοιχα.
Τα στοιχεία 4f ονομάζονται λανθανίδες.
Τα στοιχεία 5f ονομάζονται ακτινίδες.
Η σειρά πλήρωσης ηλεκτρονικών υποεπιπέδων στα άτομα των στοιχείων της έκτης περιόδου: 55 Cs και 56 στοιχεία Ba - 6s. 57 La … 6s 2 5d x - 5d στοιχείο; 58 Ce - 71 Lu - 4f στοιχεία; 72 Hf - 80 Hg - 5d στοιχεία; 81 T1 - 86 Rn - 6d στοιχεία. Αλλά και εδώ, υπάρχουν στοιχεία στα οποία «παραβιάζεται» η σειρά πλήρωσης των ηλεκτρονικών τροχιακών, η οποία, για παράδειγμα, σχετίζεται με τη μεγαλύτερη ενεργειακή σταθερότητα των μισών και πλήρως γεμισμένων f-υποεπιπέδων, δηλαδή nf 7 και nf 14. Ανάλογα με το τελευταίο υποεπίπεδο του ατόμου που είναι γεμάτο με ηλεκτρόνια, όλα τα στοιχεία χωρίζονται σε τέσσερις οικογένειες ηλεκτρονίων ή μπλοκ:
- s-στοιχεία. Το s-υποεπίπεδο του εξωτερικού επιπέδου του ατόμου είναι γεμάτο με ηλεκτρόνια. Τα s-στοιχεία περιλαμβάνουν υδρογόνο, ήλιο και στοιχεία των κύριων υποομάδων των ομάδων I και II.
- p-στοιχεία. Το p-υποεπίπεδο του εξωτερικού επιπέδου του ατόμου είναι γεμάτο με ηλεκτρόνια. Τα στοιχεία p περιλαμβάνουν στοιχεία των κύριων υποομάδων των ομάδων III-VIII.
- d-στοιχεία. Το d-υποεπίπεδο του προ-εξωτερικού επιπέδου του ατόμου είναι γεμάτο με ηλεκτρόνια. Τα d-στοιχεία περιλαμβάνουν στοιχεία δευτερευουσών υποομάδων των ομάδων I-VIII, δηλαδή στοιχεία plug-in δεκαετιών μεγάλων περιόδων που βρίσκονται μεταξύ s- και p-στοιχείων. Ονομάζονται επίσης μεταβατικά στοιχεία.
- f-στοιχεία. Το υποεπίπεδο f του τρίτου εξωτερικού επιπέδου του ατόμου είναι γεμάτο με ηλεκτρόνια. Αυτά περιλαμβάνουν λανθανίδες και αντινοειδείς ουσίες.

Ο Ελβετός φυσικός W. Pauli το 1925 διαπίστωσε ότι σε ένα άτομο σε ένα τροχιακό δεν μπορούν να υπάρχουν περισσότερα από δύο ηλεκτρόνια που έχουν αντίθετες (αντιπαράλληλες) σπιν (που μεταφράζονται από τα αγγλικά ως «άτρακτος»), δηλαδή έχουν τέτοιες ιδιότητες που υπό όρους μπορούμε να φανταστούμε όπως η περιστροφή ενός ηλεκτρονίου γύρω από τον νοητό άξονά του: δεξιόστροφα ή αριστερόστροφα.

Αυτή η αρχή ονομάζεται Αρχή Pauli. Εάν υπάρχει ένα ηλεκτρόνιο στο τροχιακό, τότε αυτό ονομάζεται ασύζευκτο· εάν υπάρχουν δύο, τότε αυτά είναι ζευγαρωμένα ηλεκτρόνια, δηλαδή ηλεκτρόνια με αντίθετα σπιν. Το σχήμα δείχνει ένα διάγραμμα της διαίρεσης των ενεργειακών επιπέδων σε υποεπίπεδα και τη σειρά με την οποία συμπληρώνονται.


Πολύ συχνά, η δομή των ηλεκτρονικών κελυφών των ατόμων απεικονίζεται χρησιμοποιώντας ενέργεια ή κβαντικά κύτταρα - γράφονται οι λεγόμενοι γραφικοί ηλεκτρονικοί τύποι. Για αυτόν τον συμβολισμό, χρησιμοποιείται ο ακόλουθος συμβολισμός: κάθε κβαντικό κύτταρο χαρακτηρίζεται από ένα κελί που αντιστοιχεί σε ένα τροχιακό. Κάθε ηλεκτρόνιο υποδεικνύεται με ένα βέλος που αντιστοιχεί στην κατεύθυνση του σπιν. Όταν γράφετε έναν γραφικό ηλεκτρονικό τύπο, θα πρέπει να θυμάστε δύο κανόνες: Η αρχή του Pauli και ο κανόνας του F. Hund, σύμφωνα με την οποία τα ηλεκτρόνια καταλαμβάνουν ελεύθερα κύτταρα πρώτα ένα κάθε φορά και έχουν την ίδια τιμή σπιν, και μόνο τότε ζευγαρώνουν, αλλά τα σπιν, σύμφωνα με την αρχή Pauli, θα είναι ήδη αντίθετα κατευθυνόμενα.
Ο κανόνας του Hund και η αρχή του Pauli
Ο κανόνας του Hund- ένας κανόνας κβαντικής χημείας που καθορίζει τη σειρά πλήρωσης των τροχιακών μιας συγκεκριμένης υποστιβάδας και διατυπώνεται ως εξής: η συνολική τιμή του κβαντικού αριθμού σπιν των ηλεκτρονίων μιας δεδομένης υποστιβάδας πρέπει να είναι μέγιστη. Διατυπώθηκε από τον Friedrich Hund το 1925.
Αυτό σημαίνει ότι σε καθένα από τα τροχιακά της υποστιβάδας, ένα ηλεκτρόνιο γεμίζει πρώτα και μόνο αφού εξαντληθούν τα μη γεμάτα τροχιακά, προστίθεται ένα δεύτερο ηλεκτρόνιο σε αυτό το τροχιακό. Σε αυτή την περίπτωση, σε ένα τροχιακό υπάρχουν δύο ηλεκτρόνια με μισά ακέραια σπιν αντίθετου πρόσημου, τα οποία ζευγαρώνουν (σχηματίζουν ένα νέφος δύο ηλεκτρονίων) και, ως αποτέλεσμα, το συνολικό σπιν του τροχιακού γίνεται ίσο με μηδέν.
Άλλη διατύπωση: Χαμηλότερο σε ενέργεια βρίσκεται ο ατομικός όρος για τον οποίο ικανοποιούνται δύο συνθήκες.
- Η πολλαπλότητα είναι μέγιστη
- Όταν οι πολλαπλότητες συμπίπτουν, η συνολική τροχιακή ορμή L είναι μέγιστη.
Ας αναλύσουμε αυτόν τον κανόνα χρησιμοποιώντας το παράδειγμα πλήρωσης τροχιακών p-υποεπιπέδου Π-στοιχεία της δεύτερης περιόδου (δηλαδή, από το βόριο στο νέο (στο διάγραμμα παρακάτω, οι οριζόντιες γραμμές υποδεικνύουν τροχιακά, τα κάθετα βέλη υποδεικνύουν ηλεκτρόνια και η κατεύθυνση του βέλους υποδεικνύει τον προσανατολισμό του σπιν).
Ο κανόνας του Κλετσκόφσκι
Ο κανόνας του Κλετσκόφσκι -καθώς αυξάνεται ο συνολικός αριθμός ηλεκτρονίων στα άτομα (καθώς αυξάνονται τα φορτία των πυρήνων τους, ή σειριακοί αριθμοίχημικά στοιχεία) τα ατομικά τροχιακά συμπληρώνονται με τέτοιο τρόπο ώστε η εμφάνιση ηλεκτρονίων σε τροχιακό με υψηλότερη ενέργεια να εξαρτάται μόνο από τον κύριο κβαντικό αριθμό n και να μην εξαρτάται από όλους τους άλλους κβαντικούς αριθμούς, συμπεριλαμβανομένου του l. Φυσικά, αυτό σημαίνει ότι σε ένα άτομο που μοιάζει με υδρογόνο (ελλείψει απώθησης μεταξύ ηλεκτρονίων), η τροχιακή ενέργεια ενός ηλεκτρονίου καθορίζεται μόνο από τη χωρική απόσταση της πυκνότητας του φορτίου ηλεκτρονίου από τον πυρήνα και δεν εξαρτάται από τα χαρακτηριστικά του κίνηση στο πεδίο του πυρήνα.
Ο εμπειρικός κανόνας Klechkovsky και το σχήμα διάταξης που προκύπτει από αυτόν είναι κάπως αντιφατικά με την πραγματική ενεργειακή ακολουθία των ατομικών τροχιακών μόνο σε δύο παρόμοιες περιπτώσεις: για άτομα Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au , υπάρχει μια «αστοχία» ενός ηλεκτρονίου με s -υποεπίπεδο της εξωτερικής στιβάδας αντικαθίσταται από το d-υποεπίπεδο της προηγούμενης στιβάδας, που οδηγεί σε μια ενεργειακά πιο σταθερή κατάσταση του ατόμου, δηλαδή: μετά την πλήρωση του τροχιακού 6 με δύο ηλεκτρόνια μικρό
Ένα άτομο είναι το μικρότερο σωματίδιο μιας χημικής ουσίας που μπορεί να διατηρήσει τις ιδιότητές του. Η λέξη «άτομο» προέρχεται από την αρχαία ελληνική «άτομος», που σημαίνει «αδιαίρετος». Ανάλογα με το πόσα και ποια σωματίδια υπάρχουν σε ένα άτομο, μπορεί να προσδιοριστεί ένα χημικό στοιχείο.
Συνοπτικά για τη δομή του ατόμου
Πώς μπορείτε να απαριθμήσετε εν συντομία τις βασικές πληροφορίες σχετικά με ένα σωματίδιο με έναν πυρήνα, το οποίο είναι θετικά φορτισμένο. Γύρω από αυτόν τον πυρήνα βρίσκεται ένα αρνητικά φορτισμένο νέφος ηλεκτρονίων. Κάθε άτομο στην κανονική του κατάσταση είναι ουδέτερο. Το μέγεθος αυτού του σωματιδίου μπορεί να καθοριστεί εξ ολοκλήρου από το μέγεθος του νέφους ηλεκτρονίων που περιβάλλει τον πυρήνα.
Ο ίδιος ο πυρήνας, με τη σειρά του, αποτελείται επίσης από μικρότερα σωματίδια - πρωτόνια και νετρόνια. Τα πρωτόνια είναι θετικά φορτισμένα. Τα νετρόνια δεν φέρουν κανένα φορτίο. Ωστόσο, τα πρωτόνια και τα νετρόνια συνδυάζονται σε μια κατηγορία και ονομάζονται νουκλεόνια. Εάν χρειάζονται εν συντομία βασικές πληροφορίες σχετικά με τη δομή του ατόμου, τότε αυτές οι πληροφορίες μπορούν να περιοριστούν στα αναφερόμενα δεδομένα.

Πρώτες πληροφορίες για το άτομο
Οι αρχαίοι Έλληνες υποψιάζονταν ότι η ύλη θα μπορούσε να αποτελείται από μικρά σωματίδια. Πίστευαν ότι ό,τι υπάρχει αποτελείται από άτομα. Ωστόσο, μια τέτοια άποψη είχε καθαρά φιλοσοφικό χαρακτήρα και δεν μπορεί να ερμηνευθεί επιστημονικά.
Ο πρώτος που πήρε βασικές πληροφορίες για τη δομή του ατόμου ήταν ένας Άγγλος επιστήμονας.Αυτός ο ερευνητής ήταν που μπόρεσε να ανακαλύψει ότι δύο χημικό στοιχείομπορεί να εισέλθει σε διαφορετικές αναλογίες και κάθε τέτοιος συνδυασμός θα αντιπροσωπεύει μια νέα ουσία. Για παράδειγμα, οκτώ μέρη του στοιχείου οξυγόνο δημιουργούν διοξείδιο του άνθρακα. Τέσσερα μέρη οξυγόνου είναι μονοξείδιο του άνθρακα.
Το 1803, ο Dalton ανακάλυψε τον λεγόμενο νόμο των πολλαπλών αναλογιών στη χημεία. Χρησιμοποιώντας έμμεσες μετρήσεις (καθώς ούτε ένα άτομο δεν μπορούσε να εξεταστεί κάτω από τα μικροσκόπια εκείνης της εποχής), ο Dalton έκανε ένα συμπέρασμα σχετικά με το σχετικό βάρος των ατόμων.

Η έρευνα του Ράδερφορντ
Σχεδόν έναν αιώνα αργότερα, βασικές πληροφορίες σχετικά με τη δομή των ατόμων επιβεβαιώθηκαν από άλλον Άγγλο χημικό - ο Επιστήμονας πρότεινε ένα μοντέλο του κελύφους ηλεκτρονίων των μικρότερων σωματιδίων.
Εκείνη την εποχή, το «Πλανητικό μοντέλο του ατόμου» του Ράδερφορντ ήταν ένα από τα τα πιο σημαντικά βήματαπου μπορούσε να κάνει η χημεία. Βασικές πληροφορίες για τη δομή του ατόμου έδειξαν ότι ήταν παρόμοια με ηλιακό σύστημα: τα σωματίδια ηλεκτρονίων περιστρέφονται γύρω από τον πυρήνα σε αυστηρά καθορισμένες τροχιές, όπως κάνουν οι πλανήτες.
Ηλεκτρονικό κέλυφος ατόμων και τύποι ατόμων χημικών στοιχείων
Το ηλεκτρονιακό κέλυφος κάθε ατόμου περιέχει ακριβώς τόσα ηλεκτρόνια όσα πρωτόνια υπάρχουν στον πυρήνα του. Αυτός είναι ο λόγος που το άτομο είναι ουδέτερο. Το 1913, ένας άλλος επιστήμονας έλαβε βασικές πληροφορίες για τη δομή του ατόμου. Ο τύπος του Niels Bohr ήταν παρόμοιος με αυτόν που έλαβε ο Rutherford. Σύμφωνα με την ιδέα του, τα ηλεκτρόνια περιστρέφονται επίσης γύρω από τον πυρήνα που βρίσκεται στο κέντρο. Ο Bohr βελτίωσε τη θεωρία του Rutherford και έφερε αρμονία στα δεδομένα της.
Ακόμα και τότε, φόρμουλες για κάποιους ΧΗΜΙΚΕΣ ΟΥΣΙΕΣ. Για παράδειγμα, σχηματικά η δομή του ατόμου αζώτου συμβολίζεται ως 1s 2 2s 2 2p 3, η δομή του ατόμου νατρίου εκφράζεται με τον τύπο 1s 2 2s 2 2p 6 3s 1. Μέσω αυτών των τύπων μπορείτε να δείτε πόσα ηλεκτρόνια κινούνται σε καθένα από τα τροχιακά μιας συγκεκριμένης χημικής ουσίας.

Μοντέλο Schrödinger
Ωστόσο, αργότερα αυτό το ατομικό μοντέλο έγινε επίσης ξεπερασμένο. Βασικές πληροφορίες για τη δομή του ατόμου, γνωστές στην επιστήμη σήμερα, έγιναν σε μεγάλο βαθμό διαθέσιμες χάρη στην έρευνα του Αυστριακού φυσικού
Αυτός προσέφερε νέο μοντέλοη δομή του είναι κυματική. Μέχρι εκείνη τη στιγμή, οι επιστήμονες είχαν ήδη αποδείξει ότι το ηλεκτρόνιο είναι προικισμένο όχι μόνο με τη φύση ενός σωματιδίου, αλλά έχει και τις ιδιότητες ενός κύματος.
Ωστόσο, το μοντέλο Schrödinger και Rutherford έχει επίσης γενικές προμήθειες. Οι θεωρίες τους είναι παρόμοιες στο ότι τα ηλεκτρόνια υπάρχουν σε ορισμένα επίπεδα.
Τέτοια επίπεδα ονομάζονται επίσης ηλεκτρονικά στρώματα. Χρησιμοποιώντας τον αριθμό στάθμης, μπορεί να χαρακτηριστεί η ενέργεια των ηλεκτρονίων. Όσο υψηλότερο είναι το στρώμα, τόσο περισσότερη ενέργεια έχει. Όλα τα επίπεδα μετρώνται από κάτω προς τα πάνω, οπότε ο αριθμός επιπέδου αντιστοιχεί στην ενέργειά του. Κάθε ένα από τα στρώματα στο ηλεκτρονιακό κέλυφος ενός ατόμου έχει τα δικά του υποεπίπεδα. Σε αυτήν την περίπτωση, το πρώτο επίπεδο μπορεί να έχει ένα υποεπίπεδο, το δεύτερο - δύο, το τρίτο - τρία και ούτω καθεξής (δείτε τους παραπάνω ηλεκτρονικούς τύπους για άζωτο και νάτριο).

Ακόμη μικρότερα σωματίδια
Αυτή τη στιγμή, βέβαια, έχουν ανακαλυφθεί ακόμη μικρότερα σωματίδια από το ηλεκτρόνιο, το πρωτόνιο και το νετρόνιο. Είναι γνωστό ότι το πρωτόνιο αποτελείται από κουάρκ. Υπάρχουν ακόμη μικρότερα σωματίδια του σύμπαντος - για παράδειγμα, το νετρίνο, το οποίο είναι εκατό φορές μικρότερο σε μέγεθος από ένα κουάρκ και ένα δισεκατομμύριο φορές μικρότερο από ένα πρωτόνιο.
Ένα νετρίνο είναι ένα τόσο μικρό σωματίδιο που είναι 10 δισεκατομμύρια φορές μικρότερο από, για παράδειγμα, ένας τυραννόσαυρος rex. Ο ίδιος ο τυραννόσαυρος είναι πολλές φορές μικρότερος σε μέγεθος από ολόκληρο το παρατηρήσιμο Σύμπαν.
Βασικές πληροφορίες για τη δομή του ατόμου: ραδιενέργεια
Ήταν πάντα γνωστό ότι ούτε ένας χημική αντίδρασηδεν μπορεί να μετατρέψει ένα στοιχείο σε άλλο. Αλλά στη διαδικασία της ραδιενεργής ακτινοβολίας αυτό συμβαίνει αυθόρμητα.
Ραδιενέργεια είναι η ικανότητα των ατομικών πυρήνων να μετασχηματίζονται σε άλλους πυρήνες - πιο σταθερούς. Όταν οι άνθρωποι έλαβαν βασικές πληροφορίες για τη δομή των ατόμων, τα ισότοπα, σε κάποιο βαθμό, θα μπορούσαν να χρησιμεύσουν ως ενσάρκωση των ονείρων των μεσαιωνικών αλχημιστών.
Καθώς τα ισότοπα διασπώνται, εκπέμπεται ραδιενεργή ακτινοβολία. Αυτό το φαινόμενο ανακαλύφθηκε για πρώτη φορά από τον Μπεκερέλ. Κύρια όψηΗ ραδιενεργή ακτινοβολία είναι η διάσπαση άλφα. Όταν συμβεί, απελευθερώνεται ένα σωματίδιο άλφα. Υπάρχει επίσης η διάσπαση βήτα, κατά την οποία ένα σωματίδιο βήτα εκτοξεύεται από τον πυρήνα ενός ατόμου.
Φυσικά και τεχνητά ισότοπα
Επί του παρόντος, είναι γνωστά περίπου 40 φυσικά ισότοπα. Τα περισσότερα από αυτά εντοπίζονται σε τρεις κατηγορίες: ουράνιο-ράδιο, θόριο και ακτίνιο. Όλα αυτά τα ισότοπα μπορούν να βρεθούν στη φύση - σε βράχους, έδαφος, αέρα. Εκτός όμως από αυτά, είναι επίσης γνωστά περίπου χίλια ισότοπα που παράγονται τεχνητά, τα οποία παράγονται σε πυρηνικούς αντιδραστήρες. Πολλά από αυτά τα ισότοπα χρησιμοποιούνται στην ιατρική, ειδικά στη διάγνωση..

Αναλογίες μέσα σε ένα άτομο
Αν φανταστούμε ένα άτομο του οποίου οι διαστάσεις είναι συγκρίσιμες με τις διαστάσεις ενός διεθνούς αθλητικού σταδίου, τότε μπορούμε να λάβουμε οπτικά τις ακόλουθες αναλογίες. Τα ηλεκτρόνια ενός ατόμου σε ένα τέτοιο «στάδιο» θα βρίσκονται στην κορυφή των κερκίδων. Κάθε ένα θα είναι μικρότερο από το κεφάλι μιας καρφίτσας. Στη συνέχεια, ο πυρήνας θα βρίσκεται στο κέντρο αυτού του χωραφιού και το μέγεθός του δεν θα είναι μεγαλύτερο από το μέγεθος ενός μπιζελιού.
Μερικές φορές οι άνθρωποι ρωτούν πώς μοιάζει πραγματικά ένα άτομο. Στην πραγματικότητα, κυριολεκτικά δεν μοιάζει με τίποτα - όχι για τον λόγο ότι τα μικροσκόπια που χρησιμοποιούνται στην επιστήμη δεν είναι αρκετά καλά. Οι διαστάσεις ενός ατόμου είναι σε εκείνες τις περιοχές όπου η έννοια της «ορατότητας» απλά δεν υπάρχει.
Τα άτομα είναι πολύ μικρά σε μέγεθος. Αλλά πόσο μικρά είναι πραγματικά αυτά τα μεγέθη; Γεγονός είναι ότι ο μικρότερος κόκκος αλατιού, που μόλις είναι ορατός με το ανθρώπινο μάτι, περιέχει περίπου ένα πεμπτοκατομμύριο άτομα.
Αν φανταστούμε ένα άτομο τέτοιου μεγέθους που θα μπορούσε να χωρέσει σε ένα ανθρώπινο χέρι, τότε δίπλα του θα υπήρχαν ιοί μήκους 300 μέτρων. Τα βακτήρια θα είχαν μήκος 3 km και το πάχος μιας ανθρώπινης τρίχας θα ήταν 150 km. Σε ύπτια θέση, θα μπορούσε να ξεπεράσει τα όρια της γήινης ατμόσφαιρας. Και αν ίσχυαν τέτοιες αναλογίες, τότε μια ανθρώπινη τρίχα θα μπορούσε να φτάσει στη Σελήνη σε μήκος. Αυτό είναι ένα τόσο περίπλοκο και ενδιαφέρον άτομο, το οποίο οι επιστήμονες συνεχίζουν να μελετούν μέχρι σήμερα.
Ατομο- το μικρότερο σωματίδιο μιας ουσίας που είναι αδιαίρετο με χημικά μέσα. Τον 20ο αιώνα διαπιστώθηκε πολύπλοκη δομήάτομο. Τα άτομα αποτελούνται από θετικά φορτισμένα πυρήνεςκαι ένα κέλυφος που σχηματίζεται από αρνητικά φορτισμένα ηλεκτρόνια. Το συνολικό φορτίο ενός ελεύθερου ατόμου είναι μηδέν, αφού τα φορτία του πυρήνα και νέφος ηλεκτρονίωνισορροπούν μεταξύ τους. Σε αυτή την περίπτωση, το πυρηνικό φορτίο είναι ίσο με τον αριθμό του στοιχείου στον περιοδικό πίνακα ( ατομικός αριθμός) και ισούται με τον συνολικό αριθμό των ηλεκτρονίων (το φορτίο του ηλεκτρονίου είναι −1).
Ο ατομικός πυρήνας αποτελείται από θετικά φορτισμένο πρωτόνιακαι ουδέτερα σωματίδια - νετρόνια, χωρίς χρέωση. Τα γενικευμένα χαρακτηριστικά των στοιχειωδών σωματιδίων σε ένα άτομο μπορούν να παρουσιαστούν με τη μορφή πίνακα:
Ο αριθμός των πρωτονίων είναι ίσος με το φορτίο του πυρήνα, επομένως ίσος με τον ατομικό αριθμό. Για να βρείτε τον αριθμό των νετρονίων σε ένα άτομο, πρέπει να αφαιρέσετε το φορτίο του πυρήνα (τον αριθμό των πρωτονίων) από την ατομική μάζα (που αποτελείται από τις μάζες πρωτονίων και νετρονίων).
Για παράδειγμα, στο άτομο νατρίου 23 Na ο αριθμός των πρωτονίων είναι p = 11 και ο αριθμός των νετρονίων είναι n = 23 − 11 = 12
Ο αριθμός των νετρονίων στα άτομα του ίδιου στοιχείου μπορεί να είναι διαφορετικός. Τέτοια άτομα ονομάζονται ισότοπα .
Το ηλεκτρονιακό κέλυφος ενός ατόμου έχει επίσης πολύπλοκη δομή. Τα ηλεκτρόνια βρίσκονται σε ενεργειακά επίπεδα (ηλεκτρονικά στρώματα).
Ο αριθμός επιπέδου χαρακτηρίζει την ενέργεια του ηλεκτρονίου. Αυτό οφείλεται στο γεγονός ότι στοιχειώδη σωματίδιαμπορεί να μεταδώσει και να λάβει ενέργεια όχι σε αυθαίρετα μικρές ποσότητες, αλλά σε ορισμένες μερίδες - κβάντα. Όσο υψηλότερο είναι το επίπεδο, τόσο περισσότερη ενέργεια έχει το ηλεκτρόνιο. Δεδομένου ότι όσο χαμηλότερη είναι η ενέργεια του συστήματος, τόσο πιο σταθερό είναι (συγκρίνετε τη χαμηλή σταθερότητα μιας πέτρας στην κορυφή ενός βουνού, η οποία έχει μεγάλο δυναμική ενέργεια, και η σταθερή θέση της ίδιας πέτρας κάτω στην πεδιάδα, όταν η ενέργειά της είναι πολύ χαμηλότερη), γεμίζονται πρώτα τα επίπεδα με χαμηλή ενέργεια ηλεκτρονίων και μόνο μετά τα υψηλά.
Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να φιλοξενήσει ένα επίπεδο μπορεί να υπολογιστεί χρησιμοποιώντας τον τύπο:
N = 2n 2, όπου N είναι ο μέγιστος αριθμός ηλεκτρονίων στο επίπεδο,
n - αριθμός επιπέδου.
Στη συνέχεια, για το πρώτο επίπεδο N = 2 1 2 = 2,
για το δεύτερο N = 2 2 2 = 8, κ.λπ.
Αριθμός ηλεκτρονίων ανά εξωτερικό επίπεδογια στοιχεία των κύριων (Α) υποομάδων ισούται με τον αριθμό της ομάδας.
Στους περισσότερους σύγχρονους περιοδικούς πίνακες, η διάταξη των ηλεκτρονίων ανά επίπεδο υποδεικνύεται στο κελί με το στοιχείο. Πολύ σημαντικόκατανοήσουν ότι τα επίπεδα είναι ευανάγνωστα κάτω πάνω, που αντιστοιχεί στην ενέργειά τους. Επομένως, η στήλη των αριθμών στο κελί με νάτριο:
1
8
2
στο 1ο επίπεδο - 2 ηλεκτρόνια,
στο 2ο επίπεδο - 8 ηλεκτρόνια,
στο 3ο επίπεδο - 1 ηλεκτρόνιο
Προσοχή, αυτό είναι ένα πολύ συνηθισμένο λάθος!
Η κατανομή στάθμης ηλεκτρονίων μπορεί να αναπαρασταθεί ως διάγραμμα:
11 Να)))
2 8 1
Εάν ο περιοδικός πίνακας δεν υποδεικνύει την κατανομή των ηλεκτρονίων ανά επίπεδο, μπορείτε να χρησιμοποιήσετε:
- μέγιστος αριθμός ηλεκτρονίων: στο 1ο επίπεδο όχι περισσότερο από 2 e − ,
στις 2 - 8 e − ,
σε εξωτερικό επίπεδο - 8 e − ; - αριθμός ηλεκτρονίων στο εξωτερικό επίπεδο (για τα πρώτα 20 στοιχεία συμπίπτει με τον αριθμό της ομάδας)
Στη συνέχεια, για το νάτριο η συλλογιστική θα είναι η εξής:
- Ο συνολικός αριθμός ηλεκτρονίων είναι 11, επομένως, το πρώτο επίπεδο είναι γεμάτο και περιέχει 2 e − ;
- Το τρίτο, εξωτερικό επίπεδο περιέχει 1 e − (ομάδα I)
- Το δεύτερο επίπεδο περιέχει τα υπόλοιπα ηλεκτρόνια: 11 − (2 + 1) = 8 (πλήρως γεμάτο)
* Ορισμένοι συγγραφείς, προκειμένου να γίνει σαφέστερη διάκριση μεταξύ ενός ελεύθερου ατόμου και ενός ατόμου σε μια ένωση, προτείνουν τη χρήση του όρου «άτομο» μόνο για τον προσδιορισμό ενός ελεύθερου (ουδέτερου) ατόμου και για τον προσδιορισμό όλων των ατόμων, συμπεριλαμβανομένων εκείνων σε ενώσεις, προτείνουν τον όρο «ατομικά σωματίδια». Ο χρόνος θα δείξει ποια θα είναι η τύχη αυτών των όρων. Από την άποψή μας, ένα άτομο εξ ορισμού είναι ένα σωματίδιο, επομένως, η έκφραση "ατομικά σωματίδια" μπορεί να θεωρηθεί ως ταυτολογία ("έλαιο").
2. Εργασία. Υπολογισμός της ποσότητας της ουσίας ενός από τα προϊόντα της αντίδρασης εάν είναι γνωστή η μάζα της αρχικής ουσίας.
Παράδειγμα:
Ποια ποσότητα ουσίας υδρογόνου θα απελευθερωθεί όταν ο ψευδάργυρος αντιδράσει με υδροχλωρικό οξύ βάρους 146 g;
Λύση:
- Γράφουμε την εξίσωση αντίδρασης: Zn + 2HCl = ZnCl 2 + H 2
- Βρίσκουμε μοριακή μάζα υδροχλωρικού οξέος: M (HCl) = 1 + 35,5 = 36,5 (g/mol)
(η μοριακή μάζα κάθε στοιχείου, αριθμητικά ίση με τη σχετική ατομική μάζα, εξετάζεται στον περιοδικό πίνακα με το πρόσημο του στοιχείου και στρογγυλοποιείται σε ακέραιους αριθμούς, εκτός από το χλώριο, το οποίο λαμβάνεται ως 35,5) - Βρείτε την ποσότητα του υδροχλωρικού οξέος: n (HCl) = m / M = 146 g / 36,5 g/mol = 4 mol
- Καταγράφουμε τα διαθέσιμα δεδομένα πάνω από την εξίσωση αντίδρασης και κάτω από την εξίσωση - τον αριθμό των mol σύμφωνα με την εξίσωση (ίσος με τον συντελεστή μπροστά από την ουσία):
4 mol x mol
Zn + 2HCl = ZnCl 2 + H 2
2 mole 1 mole - Ας κάνουμε μια αναλογία:
4 mol - ΧΕΛΙΑ δερματος
2 mol - 1 mol
(ή με εξήγηση:
από 4 mol υδροχλωρικού οξέος παίρνετε Χγραμμομόριο υδρογόνου,
και από 2 κρεατοελιές - 1 τυφλοπόντικα) - Βρίσκουμε Χ:
Χ= 4 mol 1 mol / 2 mol = 2 mol
Απάντηση: 2 mol.