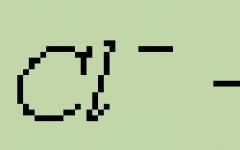ΒΑΣΕΙΣ ΘΕΩΡΗΤΙΚΗΣ ΧΗΜΕΙΑΣ
10. Αντιδράσεις οξειδοαναγωγής
Αντιδράσεις οξειδοαναγωγής σε διαλύματα.
Οι χημικές αντιδράσεις που συμβαίνουν με μια αλλαγή στην κατάσταση οξείδωσης των στοιχείων που αποτελούν τα αντιδρώντα ονομάζονται οξειδοαναγωγή.
Οξείδωση
- είναι η διαδικασία της απελευθέρωσης ηλεκτρονίων από ένα άτομο, ένα μόριο ή ένα ιόν. Αν ένα άτομο δωρίσει τα ηλεκτρόνια του, τότε αποκτά θετικό φορτίο: l - , δωρίζει 1 ηλεκτρόνιο και μετά γίνεται ουδέτερο άτομο:![]()
Εάν ένα θετικά φορτισμένο ιόν ή άτομο δίνει ηλεκτρόνια, τότε η τιμή του θετικού φορτίου του αυξάνεται ανάλογα με τον αριθμό των ηλεκτρονίων που δωρίζονται:

Αναγωγή είναι η διαδικασία σύνδεσης ηλεκτρονίων σε ένα άτομο, μόριο ή ιόν.
Αν ένα άτομο προσκολλήσει ηλεκτρόνια, τότε μετατρέπεται σε αρνητικά φορτισμένο ιόν:

Εάν ένα θετικά φορτισμένο ιόν δέχεται ηλεκτρόνια, τότε η τιμή του φορτίου του μειώνεται:

ή μπορεί να πάει σε ένα ουδέτερο άτομο:

Μέσο οξείδωσης
αποδοχή ηλεκτρονίων. Αποκαταστάτης είναι ένα άτομο, μόριο ή ιόν, δωρίζοντας ηλεκτρόνια.Μέσο οξείδωσης
στην πορεία της αντίδρασης ανηγμένος, αναγωγικός παράγοντας - οξειδωμένος.Θα πρέπει να θυμόμαστε ότι η θεώρηση της οξείδωσης (αναγωγής) ως διαδικασίας παροχής (και αποδοχής) ηλεκτρονίων από άτομα ή ιόντα δεν αντικατοπτρίζει πάντα την πραγματική κατάσταση, καθώς σε πολλές περιπτώσεις δεν υπάρχει πλήρης μεταφορά ηλεκτρονίων, αλλά μόνο μετατόπιση του νέφους ηλεκτρονίων από το ένα άτομο στο άλλο.
Ωστόσο, για τη σύνταξη των εξισώσεων των οξειδοαναγωγικών αντιδράσεων, δεν είναι απαραίτητο ποιος δεσμός σχηματίζεται σε αυτήν την περίπτωση - ιονικός ή ομοιοπολικός. Επομένως, για λόγους απλότητας, θα μιλήσουμε για την προσκόλληση ή την απελευθέρωση ηλεκτρονίων, ανεξάρτητα από τον τύπο του δεσμού.
Προσδιορισμός στοιχειομετρικών συντελεστών στις εξισώσεις οξειδοαναγωγικών αντιδράσεων. Κατά τη σύνταξη της εξίσωσης για την αντίδραση οξειδοαναγωγής, είναι απαραίτητο να προσδιοριστεί ο αναγωγικός παράγοντας, ο οξειδωτικός παράγοντας και ο αριθμός των ηλεκτρονίων που δίνονται και λαμβάνονται. Κατά κανόνα, οι συντελεστές επιλέγονται χρησιμοποιώντας οποιαδήποτε από τις δύο μεθόδους ηλεκτρονικό ισοζύγιο
, οποιαδήποτε μέθοδο ισορροπία ηλεκτρονίων-ιόντων (μερικές φορές το τελευταίο ονομάζεται μέθοδος μισές αντιδράσεις ).Ως παράδειγμα σύνταξης των εξισώσεων των αντιδράσεων οξειδοαναγωγής, ας εξετάσουμε τη διαδικασία οξείδωσης πυρίτη με πυκνό νιτρικό οξύ.
Πρώτα απ 'όλα, ας ορίσουμε τα προϊόντα αντίδρασης.
HNO 3 είναι ένας ισχυρός οξειδωτικός παράγοντας, επομένως το θείο θα οξειδωθεί στη μέγιστη κατάσταση οξείδωσης S 6+, και σίδηρος - έως Fe 3+, ενώ HNO 3 μπορεί να ανακτήσει έωςΟΧΙ ή ΟΧΙ 2. Θα επιλέξουμε ΟΧΙ:Που θα ειναι
H 2 O (στην αριστερή ή δεξιά πλευρά), δεν ξέρουμε ακόμα.1. Ας κάνουμε αίτηση πρώτα μέθοδος ισορροπίας ιόντων ηλεκτρονίων
(ημιαντιδράσεις). Αυτή η μέθοδος εξετάζει τη μετάβαση ηλεκτρονίων από ένα άτομο ή ιόν σε άλλο, λαμβάνοντας υπόψη τη φύση του μέσου (όξινο, αλκαλικό ή ουδέτερο) στο οποίο λαμβάνει χώρα η αντίδραση.Κατά τη σύνταξη των εξισώσεων των διεργασιών οξείδωσης και αναγωγής, για την εξίσωση του αριθμού των ατόμων υδρογόνου και οξυγόνου, εισάγονται είτε μόρια νερού είτε ιόντα υδρογόνου (ανάλογα με το περιβάλλον) (αν το περιβάλλον είναι όξινο),ή μόρια νερού και ιόντα υδροξειδίου (αν το μέσο είναι αλκαλικό).Αντίστοιχα, τα προκύπτοντα προϊόντα στη δεξιά πλευρά της ηλεκτρονικής-ιονικής εξίσωσης θα περιέχουν ιόντα υδρογόνου και μόρια νερού (όξινο μέσο) ή ιόντα υδροξειδίου και μόρια νερού (αλκαλικό μέσο).
Δηλ. όταν γράφουμε ηλεκτρονικές-ιοντικές εξισώσεις, πρέπει να προχωρήσουμε από τη σύνθεση των ιόντων που υπάρχουν πραγματικά στο διάλυμα.Επιπρόσθετα, όπως και στην παρασκευή συντομευμένων ιοντικών εξισώσεων, οι ουσίες είναι ελάχιστα διαχωρισμένες, ελάχιστα διαλυτές ή εκπέμπονται με τη μορφή αερίου πρέπει να είναι γραμμένο σε μοριακή μορφή.
Ας εξετάσουμε την ημιαντίδραση οξείδωσης για την περίπτωσή μας. Μόριο
FeS 2 μετατρέπεται σε ιόν Fe 3+ (F е (N О 3) 3 διασπάται πλήρως σε ιόντα, παραμελούμε την υδρόλυση) και δύο ιόντα SO 4 2 - (διάσταση H 2 SO 4 ):Για να εξισορροπηθεί το οξυγόνο, προσθέστε 8 μόρια Η στην αριστερή πλευρά
2 Α, και προς τα δεξιά - 16 ιόντα Η+ (όξινο μέσο):Η χρέωση στην αριστερή πλευρά είναι 0, η χρέωση στη δεξιά πλευρά είναι +15, άρα
FeS 2 θα πρέπει να δωρίσει 15 ηλεκτρόνια:Ας εξετάσουμε τώρα τη μισή αντίδραση της αναγωγής του νιτρικού ιόντος:
![]()
Πρέπει να αφαιρεθεί από
Ν Ο 3 2 άτομα O. Για να το κάνετε αυτό, προσθέστε 4 ιόντα Н στην αριστερή πλευρά 1+ (όξινο μέσο), και προς τα δεξιά - 2 μόρια H 2 Σχετικά με:Για να εξισορροπήσετε τη φόρτιση στην αριστερή πλευρά (φόρτιση
+3) προσθέστε 3 ηλεκτρόνια:Τέλος, έχουμε:

Μειώνοντας και τα δύο μέρη κατά 16N
+ και 8Η 2 Ω, παίρνουμε τη συντομευμένη ιοντική εξίσωση της αντίδρασης οξειδοαναγωγής:Προσθέτοντας και στις δύο πλευρές της εξίσωσης τον αντίστοιχο αριθμό ιόντων
ΟΧΙ 3 - και H + βρίσκουμε τη μοριακή εξίσωση της αντίδρασης:Λάβετε υπόψη ότι για να προσδιορίσετε την ποσότητα των ηλεκτρονίων που δίνονται και λαμβάνονται, δεν χρειάστηκε ποτέ να προσδιορίσετε την κατάσταση οξείδωσης των στοιχείων. Επιπλέον, λάβαμε υπόψη την επιρροή του περιβάλλοντος και προσδιορίσαμε αυτόματα ότι η H
2 Το O βρίσκεται στη δεξιά πλευρά της εξίσωσης. Δεν υπάρχει αμφιβολία ότι αυτή η μέθοδος πολύ περισσότερο σύμφωνα με τη χημική έννοια από την τυπική μέθοδο ηλεκτρονικής ισορροπίας,αν και το τελευταίο είναι κάπως πιο κατανοητό.2. Ας εξισώσουμε αυτή την αντίδραση με τη μέθοδο ηλεκτρονικό ισοζύγιο ... Η διαδικασία ανάκτησης περιγράφεται:
![]()
Είναι πιο δύσκολο να συντάξετε ένα σχήμα οξείδωσης, καθώς δύο στοιχεία οξειδώνονται ταυτόχρονα -
Fe και S. Μπορείτε να αποδώσετε την κατάσταση οξείδωσης στο σίδηρο 2+, στο θείο 1- και να λάβετε υπόψη ότι υπάρχουν δύο άτομα S ανά άτομο Fe:
Είναι δυνατόν, ωστόσο, να παραιτηθούμε από τον προσδιορισμό των καταστάσεων οξείδωσης και να γράψουμε ένα σχήμα που μοιάζει με το σχήμα
![]()
Η δεξιά πλευρά έχει φορτίο +15, η αριστερή πλευρά - 0, έτσι
FeS 2 θα πρέπει να δωρίσει 15 ηλεκτρόνια. Καταγράφουμε το συνολικό υπόλοιπο:
πέντε μόρια HNO
3 πάμε για οξείδωση FeS 2, και άλλα τρία μόρια HNO 3 απαραίτητο για την εκπαίδευση Fe (NO 3) 3:Για να εξισωθούν υδρογόνο και οξυγόνο, προσθέτουμε δύο μόρια Η στη δεξιά πλευρά
2 Σχετικά με:Η μέθοδος της ισορροπίας ηλεκτρονικών ιόντων είναι πιο καθολική σε σύγκριση με τη μέθοδο της ηλεκτρονικής ισορροπίας και έχει ένα αδιαμφισβήτητο πλεονέκτημα στην επιλογή των συντελεστών
σε πολλές αντιδράσεις οξειδοαναγωγής, ιδίως, με τη συμμετοχή οργανικών ενώσεων, στις οποίες ακόμη και η διαδικασία προσδιορισμού των καταστάσεων οξείδωσης είναι πολύ περίπλοκη.Σκεφτείτε, για παράδειγμα, την οξείδωση του αιθυλενίου, η οποία συμβαίνει όταν διέρχεται από ένα υδατικό διάλυμα υπερμαγγανικού καλίου. Ως αποτέλεσμα, το αιθυλένιο οξειδώνεται σε αιθυλενογλυκόλη HO-
CH 2 - CH 2 -ΟΗ, και το υπερμαγγανικό ανάγεται σε οξείδιο του μαγγανίου (IV), επιπλέον, όπως θα είναι προφανές από την τελική εξίσωση ισορροπίας, το υδροξείδιο του καλίου σχηματίζεται επίσης στα δεξιά:
Αφού πραγματοποιήσουμε τις απαραίτητες αναγωγές τέτοιων όρων, γράφουμε την εξίσωση στην τελική μοριακή μορφή
Τυπικά δυναμικά αντιδράσεων οξειδοαναγωγής.
Η πιθανότητα οποιασδήποτε αντίδρασης οξειδοαναγωγής υπό πραγματικές συνθήκες οφείλεται σε διάφορους λόγους: θερμοκρασία, φύση του οξειδωτικού και αναγωγικού παράγοντα, την οξύτητα του μέσου, τη συγκέντρωση των ουσιών που συμμετέχουν στην αντίδραση κ.λπ. είναι δύσκολο να ληφθούν υπόψη όλοι αυτοί οι παράγοντες, αλλά αν θυμόμαστε ότι οποιαδήποτε αντίδραση οξειδοαναγωγής προχωρά με τη μεταφορά ηλεκτρονίων από τον αναγωγικό παράγοντα στον οξειδωτικό παράγοντα· μπορεί να καθοριστεί ένα κριτήριο για την πιθανότητα μιας τέτοιας αντίδρασης.Τα ποσοτικά χαρακτηριστικά των διεργασιών οξειδοαναγωγής είναι κανονικά δυναμικά οξειδοαναγωγής των οξειδωτικών και αναγωγικών παραγόντων (ή τυπικές δυνατότητεςηλεκτρόδια).
Για να κατανοήσουμε τη φυσικοχημική σημασία τέτοιων δυναμικών, είναι απαραίτητο να αναλυθούν οι λεγόμενες ηλεκτροχημικές διεργασίες.
Οι χημικές διεργασίες που συνοδεύονται από την εμφάνιση ηλεκτρικού ρεύματος ή προκαλούνται από αυτό ονομάζονται ηλεκτροχημικές.
Για να κατανοήσουμε τη φύση των ηλεκτροχημικών διεργασιών, ας στραφούμε στην εξέταση πολλών αρκετά απλών καταστάσεων. Φανταστείτε μια μεταλλική πλάκα βυθισμένη στο νερό. Υπό τη δράση πολικών μορίων νερού, τα μεταλλικά ιόντα αποσπώνται από την επιφάνεια της πλάκας και, ενυδατωμένα, περνούν στην υγρή φάση. Σε αυτή την περίπτωση, το τελευταίο φορτίζεται θετικά και εμφανίζεται περίσσεια ηλεκτρονίων στη μεταλλική πλάκα. Όσο προχωρά η διαδικασία, τόσο μεγαλύτερη γίνεται η χρέωση.
, τόσο η πλάκα όσο και η υγρή φάση.Λόγω της ηλεκτροστατικής έλξης των κατιόντων του διαλύματος και της περίσσειας μεταλλικών ηλεκτρονίων, εμφανίζεται ένα λεγόμενο ηλεκτρικό διπλό στρώμα στη διεπιφάνεια, το οποίο αναστέλλει την περαιτέρω μετάβαση των μεταλλικών ιόντων στην υγρή φάση. Τέλος, έρχεται μια στιγμή που επιτυγχάνεται ισορροπία μεταξύ του διαλύματος και της μεταλλικής πλάκας, η οποία μπορεί να εκφραστεί με την εξίσωση:
ή λαμβάνοντας υπόψη την ενυδάτωση των ιόντων στο διάλυμα:
Η κατάσταση αυτής της ισορροπίας εξαρτάται από τη φύση του μετάλλου, τη συγκέντρωση των ιόντων του στο διάλυμα, τη θερμοκρασία και
πίεση.Όταν ένα μέταλλο δεν βυθίζεται σε νερό, αλλά σε διάλυμα άλατος αυτού του μετάλλου, η ισορροπία, σύμφωνα με την αρχή του Le Chatelier, μετατοπίζεται προς τα αριστερά και όσο περισσότερο, τόσο μεγαλύτερη είναι η συγκέντρωση των μεταλλικών ιόντων στο διάλυμα. Τα ενεργά μέταλλα, ιόντα των οποίων έχουν καλή ικανότητα να περνούν σε διάλυμα, θα φορτιστούν σε αυτή την περίπτωση αρνητικά, αν και σε μικρότερο βαθμό από ό,τι στο καθαρό νερό.
Η ισορροπία μπορεί να μετατοπιστεί προς τα δεξιά αφαιρώντας ηλεκτρόνια από το μέταλλο με τον ένα ή τον άλλο τρόπο. Αυτό θα διαλύσει τη μεταλλική πλάκα. Αντίθετα, αν τροφοδοτηθούν ηλεκτρόνια από το εξωτερικό στη μεταλλική πλάκα, τότε η εναπόθεση ιόντων θα συμβεί σε αυτήν
από λύση.Όταν ένα μέταλλο βυθίζεται σε ένα διάλυμα, σχηματίζεται ένα ηλεκτρικό διπλό στρώμα στη διεπιφάνεια. Η διαφορά δυναμικού που προκύπτει μεταξύ του μετάλλου και της περιβάλλουσας υγρής φάσης ονομάζεται δυναμικό ηλεκτροδίου. Αυτό το δυναμικό είναι χαρακτηριστικό της οξειδοαναγωγικής ικανότητας του μετάλλου με τη μορφή στερεάς φάσης.
Σε ένα απομονωμένο άτομο μετάλλου (μια κατάσταση ενός μονοατομικού ατμού που εμφανίζεται σε υψηλές θερμοκρασίες και υψηλούς βαθμούς σπανιότητας), οι ιδιότητες οξειδοαναγωγής χαρακτηρίζονται από μια διαφορετική ποσότητα, που ονομάζεται δυναμικό ιονισμού. Το δυναμικό ιονισμού είναι η ενέργεια που απαιτείται για να αποσπαστεί ένα ηλεκτρόνιο από ένα απομονωμένο άτομο.
Η απόλυτη τιμή του δυναμικού του ηλεκτροδίου δεν μπορεί να μετρηθεί απευθείας. Ταυτόχρονα, δεν είναι δύσκολο να μετρηθεί η διαφορά στα δυναμικά των ηλεκτροδίων που εμφανίζεται σε ένα σύστημα που αποτελείται από δύο ζεύγη μετάλλου-διαλύματος. Τέτοια ζευγάρια λέγονται ημικύτταρα ... Συμφωνήσαμε να καθορίσουμε τα δυναμικά ηλεκτροδίων των μετάλλων σε σχέση με το λεγόμενο πρότυπο ηλεκτρόδιο υδρογόνου, το δυναμικό του οποίου αυθαίρετα λαμβάνεται ως μηδέν. Ένα τυπικό ηλεκτρόδιο υδρογόνου αποτελείται από μια ειδικά παρασκευασμένη πλάκα πλατίνας βυθισμένη σε διάλυμα οξέος με συγκέντρωση ιόντων υδρογόνου 1 mol / L και πλυμένο με ρεύμα αερίου υδρογόνου σε πίεση 10
5 Pa, σε θερμοκρασία 25 °C.Μια σειρά από τυπικά δυναμικά ηλεκτροδίων.
Εάν μια μεταλλική πλάκα βυθισμένη σε διάλυμα του άλατος της με συγκέντρωση μεταλλικών ιόντων ίση με 1 mol / l συνδεθεί σε ένα τυπικό ηλεκτρόδιο υδρογόνου, θα έχετε ένα γαλβανικό στοιχείο. Η ηλεκτροκινητική δύναμη αυτού του στοιχείου (EMF), μετρημένη στους 25 ° C, χαρακτηρίζει τυπικό δυναμικό ηλεκτροδίου ενός μετάλλου,συνήθως συμβολίζεται ως E °.Τα τυπικά δυναμικά των ηλεκτροδίων που δρουν ως αναγωγικοί παράγοντες σε σχέση με το υδρογόνο έχουν πρόσημο «-» και το σύμβολο «+» έχουν τυπικά δυναμικά ηλεκτροδίων που είναι οξειδωτικοί παράγοντες.
Τα μέταλλα, διατεταγμένα σε αύξουσα σειρά των τυπικών δυναμικών ηλεκτροδίων τους, σχηματίζουν τα λεγόμενα ηλεκτροχημική σειρά τάσεων μετάλλων :Li, Rb, K, wa, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ένας αριθμός τάσεων χαρακτηρίζει τις χημικές ιδιότητες των μετάλλων:
1. Όσο πιο αρνητικό είναι το δυναμικό του ηλεκτροδίου του μετάλλου, τόσο μεγαλύτερη είναι η αναγωγιμότητα του.
2. Κάθε μέταλλο είναι ικανό να εκτοπίζει (ανάγει) από διαλύματα αλάτων εκείνα τα μέταλλα που βρίσκονται στην ηλεκτροχημική σειρά τάσεων μετάλλων μετά από αυτό.
3. Όλα τα μέταλλα που έχουν αρνητικό τυπικό δυναμικό ηλεκτροδίου, δηλαδή αυτά που βρίσκονται στην ηλεκτροχημική σειρά τάσεων μετάλλων στα αριστερά του υδρογόνου, είναι ικανά να το εκτοπίσουν από όξινα διαλύματα.
Όπως και στην περίπτωση του προσδιορισμού της τιμής του E ° των μετάλλων, οι τιμές του E ° των μη μετάλλων μετρώνται σε θερμοκρασία 25 ° C και σε συγκέντρωση όλων των ατομικών και μοριακών σωματιδίων που συμμετέχουν στην ισορροπία ίση με 1 mol / l.
Η αλγεβρική τιμή του τυπικού οξειδοαναγωγικού δυναμικού χαρακτηρίζει την οξειδωτική δραστηριότητα της αντίστοιχης οξειδωμένης μορφής. Έτσι Η σύγκριση των τιμών των τυπικών δυναμικών οξειδοαναγωγής μας επιτρέπει να απαντήσουμε στην ερώτηση: συμβαίνει αυτή ή εκείνη η αντίδραση οξειδοαναγωγής;
Το ποσοτικό κριτήριο για την αξιολόγηση της πιθανότητας μιας συγκεκριμένης αντίδρασης οξειδοαναγωγής είναι θετική τιμή της διαφοράς μεταξύ των τυπικών δυναμικών οξειδοαναγωγής των ημι-αντιδράσεων οξείδωσης και αναγωγής.
Ηλεκτρόλυση διαλυμάτων.
Το σύνολο των οξειδοαναγωγικών αντιδράσεων που συμβαίνουν στα ηλεκτρόδια σε διαλύματα ή λιωμένους ηλεκτρολύτες όταν περνάει ηλεκτρικό ρεύμα μέσα από αυτά ονομάζεται ηλεκτρόλυση.Στην κάθοδο της πηγής ρεύματος, συμβαίνει η διαδικασία μεταφοράς ηλεκτρονίων σε κατιόντα από ένα διάλυμα ή τήγμα, επομένως η κάθοδος είναι ένας «αναγωγικός παράγοντας».Επομένως, στην άνοδο, λαμβάνει χώρα η απελευθέρωση ηλεκτρονίων από ανιόντα η άνοδος είναι ένας «οξειδωτικός παράγοντας».
Κατά τη διάρκεια της ηλεκτρόλυσης, ανταγωνιστικές διεργασίες μπορούν να συμβούν τόσο στην άνοδο όσο και στην κάθοδο.
Όταν η ηλεκτρόλυση πραγματοποιείται με χρήση μιας αδρανούς (μη αναλώσιμης) ανόδου (για παράδειγμα, γραφίτη ή πλατίνα), κατά κανόνα, ανταγωνίζονται δύο διαδικασίες οξείδωσης και δύο διεργασίες αναγωγής:
στην άνοδο - οξείδωση ανιόντων και ιόντων υδροξειδίου,
στην κάθοδο - αναγωγή κατιόντων και ιόντων υδρογόνου.
Κατά τη διεξαγωγή ηλεκτρόλυσης χρησιμοποιώντας μια ενεργή (αναλώσιμη) άνοδο, η διαδικασία είναι περίπλοκη και οι ανταγωνιστικές αντιδράσεις στα ηλεκτρόδια είναι:
στην άνοδο - οξείδωση ανιόντων και ιόντων υδροξειδίου, ανοδική διάλυση μετάλλου - το υλικό της ανόδου.
στην κάθοδο - η αναγωγή του κατιόντος του άλατος και των ιόντων υδρογόνου, η αναγωγή των κατιόντων μετάλλων που λαμβάνονται με τη διάλυση της ανόδου.
Κατά την επιλογή της πιο πιθανής διεργασίας στην άνοδο και την κάθοδο, θα πρέπει να προχωρήσουμε από τη θέση που θα προχωρήσει η αντίδραση για την οποία απαιτείται η μικρότερη κατανάλωση ενέργειας. Επιπλέον, για την επιλογή της πιο πιθανής διεργασίας στην άνοδο και την κάθοδο κατά την ηλεκτρόλυση διαλυμάτων αλάτων με αδρανές ηλεκτρόδιο, χρησιμοποιούνται οι ακόλουθοι κανόνες:
Τα ακόλουθα προϊόντα μπορούν να σχηματιστούν στην άνοδο: α) στην ηλεκτρόλυση διαλυμάτων που περιέχουν ανιόντα F -, SO 4 2-, NΠερίπου 3 - , RO 4 3 - , καθώς και διαλύματα αλκαλίων, απελευθερώνεται οξυγόνο. β) στην οξείδωση των ανιόντων Γμεγάλο - , B r -, ΕΓΩ-απελευθερώνονται χλώριο, βρώμιο, ιώδιο, αντίστοιχα.γ) όταν τα ανιόντα των οργανικών οξέων οξειδώνονται, συμβαίνει η διαδικασία:2. Στην ηλεκτρόλυση διαλυμάτων αλάτων που περιέχουν ιόντα που βρίσκονται στη σειρά τάσεων αριστερά του Al.
3+ , το υδρογόνο εξελίσσεται στην κάθοδο. εάν ένα ιόν βρίσκεται σε μια σειρά από τάσεις στα δεξιά του υδρογόνου, τότε ένα μέταλλο απελευθερώνεται στην κάθοδο.3. Στην ηλεκτρόλυση διαλυμάτων αλάτων που περιέχουν ιόντα που βρίσκονται σε σειρά τάσεων μεταξύ
Al + και H + , ανταγωνιστικές διαδικασίες τόσο της αναγωγής κατιόντων όσο και της έκλυσης υδρογόνου μπορούν να συμβούν στην κάθοδο.Ας εξετάσουμε ως παράδειγμα την ηλεκτρόλυση ενός υδατικού διαλύματος χλωριούχου χαλκού σε αδρανή ηλεκτρόδια. Το διάλυμα περιέχει ιόντα Cu
2+ και 2Сl - τα οποία, υπό τη δράση ηλεκτρικού ρεύματος, κατευθύνονται στα αντίστοιχα ηλεκτρόδια:
Ο μεταλλικός χαλκός απελευθερώνεται στην κάθοδο και το αέριο χλώριο στην άνοδο.
Αν στο εξεταζόμενο παράδειγμα ηλεκτρόλυσης διαλύματος
CuCl 2 πάρτε μια χάλκινη πλάκα ως άνοδο, στη συνέχεια ο χαλκός απελευθερώνεται στην κάθοδο και στην άνοδο, όπου λαμβάνουν χώρα οι διαδικασίες οξείδωσης, αντί να εκκενωθούν ιόντα Cμεγάλο - και την απελευθέρωση χλωρίου, η άνοδος (χαλκός) οξειδώνεται. Σε αυτή την περίπτωση, η ίδια η άνοδος διαλύεται και με τη μορφή ιόντων Cu αυτήμπαίνει σε λύση. Ηλεκτρόλυση CuCl 2 με μια διαλυτή άνοδο μπορεί να γραφτεί ως εξής:
Η ηλεκτρόλυση των διαλυμάτων αλάτων με διαλυτή άνοδο ανάγεται στην οξείδωση του υλικού της ανόδου (διάλυσή του) και συνοδεύεται από τη μεταφορά μετάλλου από την άνοδο στην κάθοδο. Αυτή η ιδιότητα χρησιμοποιείται ευρέως στον καθαρισμό (καθαρισμό) μετάλλων από μόλυνση.
Ηλεκτρόλυση τήγματος. Για τη λήψη πολύ δραστικών μετάλλων (νάτριο, αλουμίνιο, μαγνήσιο, ασβέστιο κ.λπ.) που αλληλεπιδρούν εύκολα με το νερό, χρησιμοποιείται ηλεκτρόλυση λιωμένων αλάτων ή οξειδίων:

Εάν ένα ηλεκτρικό ρεύμα διέρχεται από ένα υδατικό διάλυμα ενός άλατος ενός ενεργού μετάλλου και ενός οξέος που περιέχει οξυγόνο, τότε ούτε τα μεταλλικά κατιόντα ούτε τα ιόντα του υπολείμματος οξέος εκκενώνονται. Το υδρογόνο απελευθερώνεται στην κάθοδο,
και επάνω η άνοδος είναι οξυγόνο και η ηλεκτρόλυση μειώνεται στην ηλεκτρολυτική αποσύνθεση του νερού.Η ηλεκτρόλυση των διαλυμάτων ηλεκτρολυτών είναι ενεργειακά πιο ευνοϊκή από αυτή των τήγματος, αφού οι ηλεκτρολύτες - άλατα και αλκάλια - λιώνουν σε πολύ υψηλές θερμοκρασίες.
Ο νόμος του Faraday για την ηλεκτρόλυση.
Η εξάρτηση της ποσότητας μιας ουσίας που σχηματίζεται υπό τη δράση ενός ηλεκτρικού ρεύματος από το χρόνο, την ισχύ του ρεύματος και τη φύση του ηλεκτρολύτη μπορεί να καθοριστεί με βάση μια γενικευμένη Ο νόμος του Faraday :που T -μάζα της ουσίας που σχηματίζεται κατά την ηλεκτρόλυση (g). E είναι η ισοδύναμη μάζα της ουσίας (g / mol). M είναι η μοριακή μάζα της ουσίας (g / mol). Π- τον αριθμό των δεδομένων ή των λαμβανόμενων ηλεκτρονίων.
I - ένταση ρεύματος (Α); t - διάρκεια της διαδικασίας(Με); F - σταθερά Faraday,που χαρακτηρίζει την ποσότητα ηλεκτρικής ενέργειας που απαιτείται για την απελευθέρωση 1 ισοδύναμης μάζας μιας ουσίας(F = 96.500 C / mol = 26,8 A × h / mol).8. Ταξινόμηση χημικών αντιδράσεων. OVR. Ηλεκτρόλυση
8.3. Αντιδράσεις οξειδοαναγωγής: γενικές διατάξεις
Αντιδράσεις οξειδοαναγωγής(ОВР) είναι οι αντιδράσεις που αλλάζουν την κατάσταση οξείδωσης των ατόμων των στοιχείων. Ως αποτέλεσμα αυτών των αντιδράσεων, ορισμένα άτομα δίνουν ηλεκτρόνια, ενώ άλλα τα λαμβάνουν.
Ο αναγωγικός παράγοντας είναι ένα άτομο, ιόν, μόριο ή PU που δίνει ηλεκτρόνια, ένας οξειδωτικός παράγοντας είναι ένα άτομο, ιόν, μόριο ή PU που δέχεται ηλεκτρόνια:
Η διαδικασία της δωρεάς ηλεκτρονίων ονομάζεται οξείδωση και η διαδικασία λήψης ηλεκτρονίων ονομάζεται ανακατασκευή... Στο OVR, πρέπει να υπάρχει ένας αναγωγικός παράγοντας και ένας οξειδωτικός παράγοντας. Δεν υπάρχει διαδικασία οξείδωσης χωρίς διαδικασία αναγωγής και δεν υπάρχει διαδικασία αναγωγής χωρίς διαδικασία οξείδωσης.
Ο αναγωγικός παράγοντας δωρίζει ηλεκτρόνια και οξειδώνεται, και ο οξειδωτικός παράγοντας δέχεται ηλεκτρόνια και ανάγεται
Η διαδικασία αναγωγής συνοδεύεται από μείωση της κατάστασης οξείδωσης των ατόμων και η διαδικασία οξείδωσης συνοδεύεται από αύξηση της κατάστασης οξείδωσης των ατόμων των στοιχείων. Είναι βολικό να επεξηγηθεί αυτό που ειπώθηκε με το σχήμα (CO - κατάσταση οξείδωσης):

Συγκεκριμένα παραδείγματα διεργασιών οξείδωσης και αναγωγής (σχήματα ηλεκτρονικών ισορροπιών) δίνονται στον πίνακα. 8.1.
Πίνακας 8.1
Παραδείγματα σχημάτων ηλεκτρονικού ισοζυγίου
| Ηλεκτρονικό κύκλωμα ισορροπίας | Χαρακτηριστικό της διαδικασίας |
|---|---|
| Διαδικασία οξείδωσης | |
| Το άτομο ασβεστίου δίνει ηλεκτρόνια, αυξάνει την κατάσταση οξείδωσης, είναι αναγωγικός παράγοντας | |
| Το ιόν Cr +2 δίνει ηλεκτρόνια, αυξάνει την κατάσταση οξείδωσης, είναι αναγωγικός παράγοντας | |
| Το μόριο χλωρίου δίνει ηλεκτρόνια, τα άτομα χλωρίου αυξάνουν την κατάσταση οξείδωσης από 0 σε +1, το χλώριο είναι αναγωγικός παράγοντας | |
| Διαδικασία ανάκτησης | |
| Το άτομο άνθρακα δέχεται ηλεκτρόνια, μειώνει την κατάσταση οξείδωσης, είναι οξειδωτικός παράγοντας | |
| Ένα μόριο οξυγόνου δέχεται ηλεκτρόνια, τα άτομα οξυγόνου μειώνουν την κατάσταση οξείδωσης από 0 σε -2, ένα μόριο οξυγόνου είναι οξειδωτικός παράγοντας | |
| Το ιόν δέχεται ηλεκτρόνια, μειώνει την κατάσταση οξείδωσης, είναι οξειδωτικός παράγοντας | |
Οι πιο σημαντικοί αναγωγικοί παράγοντες: απλές ουσίες μέταλλα; υδρογόνο; άνθρακα σε μορφή οπτάνθρακα· μονοξείδιο του άνθρακα (II); ενώσεις που περιέχουν άτομα στη χαμηλότερη κατάσταση οξείδωσης (υδρίδια μετάλλων, σουλφίδια, ιωδίδια, αμμωνία). ο ισχυρότερος αναγωγικός παράγοντας είναι ένα ηλεκτρικό ρεύμα στην κάθοδο.
Τα πιο σημαντικά οξειδωτικά: απλές ουσίες - αλογόνα, οξυγόνο, όζον. συμπυκνωμένο θειικό οξύ. Νιτρικό οξύ; ένας αριθμός αλάτων (KClO 3, KMnO 4, K 2 Cr 2 O 7); υπεροξείδιο του υδρογόνου H 2 O 2; ο πιο ισχυρός οξειδωτικός παράγοντας είναι το ηλεκτρικό ρεύμα στην άνοδο.
Κατά τη διάρκεια της περιόδου, οι οξειδωτικές ιδιότητες των ατόμων και των απλών ουσιών αυξάνονται: φθόριο - ο ισχυρότερος οξειδωτικός παράγοντας από όλες τις απλές ουσίες... Σε κάθε περίοδο, τα αλογόνα σχηματίζουν απλές ουσίες με τις πιο έντονες οξειδωτικές ιδιότητες.
Στις ομάδες Α, από πάνω προς τα κάτω, οι οξειδωτικές ιδιότητες των ατόμων και των απλών ουσιών εξασθενούν και ενισχύονται οι αναγωγικές ιδιότητες.
Για άτομα του ίδιου τύπου, οι αναγωγικές ιδιότητες αυξάνονται με την αύξηση της ακτίνας τους. για παράδειγμα, τις αναγωγικές ιδιότητες του ανιόντος
Τα I - είναι πιο έντονα από το ανιόν Cl-.
Για τα μέταλλα, οι ιδιότητες οξειδοαναγωγής απλών ουσιών και ιόντων σε ένα υδατικό διάλυμα καθορίζονται από τη θέση του μετάλλου στην ηλεκτροχημική σειρά: από αριστερά προς τα δεξιά (από πάνω προς τα κάτω), οι αναγωγικές ιδιότητες των απλών μετάλλων εξασθενούν: το ισχυρότερο αναγωγικό- λίθιο.
Για μεταλλικά ιόντα σε υδατικό διάλυμα από αριστερά προς τα δεξιά στην ίδια σειρά, αντίστοιχα, οι οξειδωτικές ιδιότητες ενισχύονται: ο πιο ισχυρός οξειδωτικός παράγοντας- ιόντα Au 3 +.
Για να τακτοποιήσετε τους συντελεστές στο ORR, μπορείτε να χρησιμοποιήσετε μια μέθοδο που βασίζεται στην προετοιμασία διαγραμμάτων διαδικασιών οξείδωσης και αναγωγής. Αυτή η μέθοδος ονομάζεται μέθοδος ηλεκτρονικού ισοζυγίου.
Η ουσία της μεθόδου ηλεκτρονικού ισοζυγίου είναι η εξής.
1. Σχεδιάστε το σχήμα αντίδρασης και εντοπίστε τα στοιχεία που άλλαξαν την κατάσταση οξείδωσης.
2. Να σχηματίσετε τις ηλεκτρονικές εξισώσεις των ημι-αντιδράσεων αναγωγής και οξείδωσης.
3. Δεδομένου ότι ο αριθμός των ηλεκτρονίων που δωρίζονται από τον αναγωγικό παράγοντα πρέπει να είναι ίσος με τον αριθμό των ηλεκτρονίων που δίνει ο οξειδωτικός παράγοντας, επιπρόσθετοι παράγοντες βρίσκονται με τη μέθοδο του ελάχιστου κοινού πολλαπλού (LCM).
4. Μπροστά από τους τύπους των αντίστοιχων ουσιών μπαίνουν πρόσθετοι παράγοντες (παραλείπεται ο συντελεστής 1).
5. Εξισώστε τον αριθμό των ατόμων αυτών των στοιχείων που δεν έχουν αλλάξει την κατάσταση οξείδωσης (πρώτα - το υδρογόνο πάνω από το νερό, και στη συνέχεια - ο αριθμός των ατόμων οξυγόνου).
Παράδειγμα σύνταξης εξίσωσης για αντίδραση οξειδοαναγωγής
με τη μέθοδο του ηλεκτρονικού ισοζυγίου.
Διαπιστώνουμε ότι τα άτομα άνθρακα και θείου έχουν αλλάξει την κατάσταση οξείδωσης. Συνθέτουμε τις εξισώσεις των ημι-αντιδράσεων αναγωγής και οξείδωσης:
Για αυτήν την περίπτωση, το LCM είναι 4 και οι πρόσθετοι συντελεστές θα είναι 1 (για άνθρακα) και 2 (για θειικό οξύ).
Καταθέτουμε τους πρόσθετους παράγοντες που βρέθηκαν στο αριστερό και το δεξί μέρος του σχήματος αντίδρασης μπροστά από τους τύπους για ουσίες που περιέχουν άνθρακα και θείο:
C + 2H 2 SO 4 → CO 2 + 2SO 2 + H 2 O
Εξισώνουμε τον αριθμό των ατόμων υδρογόνου βάζοντας έναν παράγοντα 2 μπροστά από τον τύπο του νερού και βεβαιωνόμαστε ότι ο αριθμός των ατόμων οξυγόνου και στις δύο πλευρές της εξίσωσης είναι ο ίδιος. Επομένως, η εξίσωση OVR
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O
Τίθεται το ερώτημα: σε ποιο μέρος του σχήματος OVR πρέπει να τοποθετηθούν οι πρόσθετοι παράγοντες που βρέθηκαν - αριστερά ή δεξιά;
Δεν έχει σημασία για απλές αντιδράσεις. Ωστόσο, πρέπει να ληφθεί υπόψη: εάν προσδιορίζονται πρόσθετοι παράγοντες στην αριστερή πλευρά της εξίσωσης, τότε οι συντελεστές τοποθετούνται μπροστά από τους τύπους των ουσιών στην αριστερή πλευρά. εάν οι υπολογισμοί πραγματοποιήθηκαν για τη δεξιά πλευρά, τότε οι συντελεστές τοποθετούνται στη δεξιά πλευρά της εξίσωσης. Για παράδειγμα:
Με τον αριθμό των ατόμων Al στα αριστερά:
Με τον αριθμό των ατόμων Al στη δεξιά πλευρά:
Στη γενική περίπτωση, εάν στην αντίδραση συμμετέχουν ουσίες μοριακής δομής (O 2, Cl 2, Br 2, I 2, N 2), τότε η επιλογή των συντελεστών βασίζεται στον αριθμό των ατόμων στο μόριο:
Εάν σχηματιστεί N 2 O στην αντίδραση με τη συμμετοχή του HNO 3, τότε το σχήμα ηλεκτρονικής ισορροπίας για το άζωτο γράφεται επίσης καλύτερα με βάση δύο άτομα αζώτου .
Σε ορισμένες αντιδράσεις οξειδοαναγωγής, μία από τις ουσίες μπορεί να δράσει τόσο ως οξειδωτικός παράγοντας (αναγωγικός παράγοντας) όσο και ως παράγοντας σχηματισμού άλατος (δηλαδή, συμμετέχει στον σχηματισμό ενός άλατος).
Τέτοιες αντιδράσεις είναι χαρακτηριστικές, ειδικότερα, για την αλληλεπίδραση μετάλλων με οξειδωτικά οξέα (HNO 3, H 2 SO 4 (πυκνό)), καθώς και οξειδωτικά άλατα (KMnO 4, K 2 Cr 2 O 7, KClO 3, Ca ( OCl) 2) με υδροχλωρικό οξύ (λόγω ανιόντων Cl - το υδροχλωρικό οξύ έχει αναγωγικές ιδιότητες) και άλλα οξέα, το ανιόν του οποίου είναι αναγωγικός παράγοντας.
Ας συνθέσουμε την εξίσωση για την αντίδραση του χαλκού με το αραιό νιτρικό οξύ:
Βλέπουμε ότι μερικά από τα μόρια του νιτρικού οξέος δαπανώνται για την οξείδωση του χαλκού, ενώ ανάγονται σε μονοξείδιο του αζώτου (II), και μερικά πηγαίνουν στη δέσμευση των σχηματισμένων ιόντων Cu 2+ στο άλας Cu (NO 3) 2 (στο το άλας, η κατάσταση οξείδωσης του ατόμου του αζώτου είναι η ίδια, όπως στο οξύ, δηλαδή δεν αλλάζει). Σε τέτοιες αντιδράσεις, ένας πρόσθετος παράγοντας για το οξειδωτικό στοιχείο τοποθετείται πάντα στη δεξιά πλευρά πριν από τον τύπο για το προϊόν αναγωγής, σε αυτήν την περίπτωση, πριν από τον τύπο NO και όχι HNO 3 ή Cu (NO 3) 2.
Μπροστά από τον τύπο HNO 3, βάζουμε έναν παράγοντα 8 (δύο μόρια HNO 3 δαπανώνται για την οξείδωση του χαλκού και έξι - για τη σύνδεση τριών ιόντων Cu 2+ στο άλας), εξισώνουμε τους αριθμούς των Η και Ο άτομα και πάρτε
3Cu + 8HNO 3 = 3Cu (NO 3) 2 + 2NO + 4H 2 O.
Σε άλλες περιπτώσεις, ένα οξύ, για παράδειγμα το υδροχλωρικό οξύ, μπορεί ταυτόχρονα να είναι και αναγωγικός παράγοντας και να συμμετέχει στο σχηματισμό ενός άλατος:
Παράδειγμα 8.5. Υπολογίστε πόση μάζα HNO 3 δαπανάται για το σχηματισμό άλατος όταν η αντίδραση, η εξίσωση της οποίας είναι
ο ψευδάργυρος εισέρχεται με μάζα 1,4 g.
Λύση. Από την εξίσωση της αντίδρασης, βλέπουμε ότι από 8 γραμμομόρια νιτρικού οξέος, μόνο 2 γραμμομόρια μπήκαν στην οξείδωση 3 γραμμομορίων ψευδαργύρου (πριν από τον τύπο του προϊόντος αναγωγής οξέος, ΝΟ, υπάρχει συντελεστής 2). Το αλάτισμα κατανάλωσε 6 mol οξέος, το οποίο είναι εύκολο να προσδιοριστεί πολλαπλασιάζοντας τον παράγοντα 3 μπροστά από τον τύπο άλατος Zn (HNO 3) 2 με τον αριθμό των υπολειμμάτων οξέος σε μια μονάδα άλατος τύπου, δηλ. στις 2.
η (Ζη) = 1,4 / 65 = 0,0215 (mol).
x = 0,043 mol;
m (HNO 3) = n (HNO 3) M (HNO 3) = 0,043 ⋅ 63 = 2,71 (g)
Απάντηση: 2,71 γρ.
Σε ορισμένες OVR, η κατάσταση οξείδωσης αλλάζει από τα άτομα όχι δύο, αλλά τριών στοιχείων.
Παράδειγμα 8.6. Τοποθετήστε τους συντελεστές στο ORR που ρέει σύμφωνα με το σχήμα FeS + O 2 → Fe 2 O 3 + SO 2 χρησιμοποιώντας τη μέθοδο ηλεκτρονικού ισοζυγίου.
Λύση. Βλέπουμε ότι η κατάσταση οξείδωσης αλλάζει από τα άτομα τριών στοιχείων: Fe, S και O. Σε τέτοιες περιπτώσεις, οι αριθμοί των ηλεκτρονίων που δίνονται από τα άτομα διαφορετικών στοιχείων αθροίζονται:
Έχοντας τοποθετήσει τους στοιχειομετρικούς συντελεστές, παίρνουμε:
4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2.
Ας εξετάσουμε παραδείγματα επίλυσης άλλων τύπων εργασιών εξετάσεων σε αυτό το θέμα.
Παράδειγμα 8.7. Αναφέρατε τον αριθμό των ηλεκτρονίων που μεταφέρθηκαν από τον αναγωγικό παράγοντα στον οξειδωτικό παράγοντα κατά την πλήρη αποσύνθεση του νιτρικού χαλκού (II), βάρους 28,2 g.
Λύση. Καταγράφουμε την εξίσωση της αντίδρασης αποσύνθεσης άλατος και το σχήμα της ηλεκτρονικής ισορροπίας του ORP. Μ = 188 g / mol.
Βλέπουμε ότι σχηματίζονται 2 mol O 2 κατά την αποσύνθεση 4 mol αλατιού. Σε αυτή την περίπτωση, 4 mol ηλεκτρονίων μεταφέρονται από τα άτομα του αναγωγικού παράγοντα (σε αυτήν την περίπτωση, αυτά είναι ιόντα) στον οξειδωτικό παράγοντα (δηλαδή στα ιόντα): ... Εφόσον η χημική ποσότητα του αλατιού είναι n = 28,2 / 188 = = 0,15 (mol), έχουμε:
2 mol αλατιού - 4 mol ηλεκτρονίων
0,15 mol - x
n (e) = x = 4 ⋅ 0,15 / 2 = 0,3 (mol),
N (e) = N A n (e) = 6,02 ⋅ 10 23 ⋅ 0,3 = 1,806 ⋅ 10 23 (ηλεκτρόνια).
Απάντηση: 1.806 ⋅ 10 23.
Παράδειγμα 8.8. Όταν το θειικό οξύ αλληλεπιδρά με χημική ποσότητα 0,02 mol με μαγνήσιο, προστέθηκαν άτομα θείου 7,224 × 10 22 ηλεκτρόνια. Βρείτε τον τύπο για ένα προϊόν μείωσης οξέος.
Λύση. Στη γενική περίπτωση, τα σχήματα των διαδικασιών αναγωγής των ατόμων θείου στη σύνθεση του θειικού οξέος μπορούν να είναι τα εξής:
εκείνοι. 1 mole ατόμων θείου μπορεί να πάρει 2, 6 ή 8 mole ηλεκτρονίων. Λαμβάνοντας υπόψη ότι 1 mol οξέος περιέχει 1 mol ατόμων θείου, δηλ. n (H 2 SO 4) = n (S), έχουμε:
n (e) = N (e) / N A = (7,224 ⋅ 10 22) / (6,02 ⋅ 10 23) = 0,12 (mol).
Υπολογίζουμε τον αριθμό των ηλεκτρονίων που λαμβάνονται από 1 mol οξέος:
0,02 mol οξέος παίρνει 0,12 mol ηλεκτρονίων
1 mol - x
n (e) = x = 0,12 / 0,02 = 6 (mol).
Αυτό το αποτέλεσμα αντιστοιχεί στη διαδικασία αναγωγής του θειικού οξέος σε θείο:
Απάντηση: θείο.
Παράδειγμα 8.9. Στην αντίδραση του άνθρακα με το πυκνό νιτρικό οξύ, σχηματίζεται νερό και δύο οξείδια που σχηματίζουν άλατα. Βρείτε τη μάζα του άνθρακα που αντέδρασε εάν τα οξειδωτικά άτομα πήραν 0,2 mol ηλεκτρονίων σε αυτή τη διαδικασία.
Λύση. Η αλληλεπίδραση των ουσιών προχωρά σύμφωνα με το σχήμα αντίδρασης
Συνθέτουμε τις εξισώσεις ημι-αντιδράσεων οξείδωσης και αναγωγής:
Από τα σχήματα ηλεκτρονικής ισορροπίας βλέπουμε ότι εάν τα άτομα του οξειδωτικού παράγοντα () δέχονται 4 mol ηλεκτρονίων, τότε στην αντίδραση εισέρχεται 1 mol (12 g) άνθρακα. Συνθέτουμε και λύνουμε την αναλογία:
4 moles ηλεκτρονίων - 12 g άνθρακα
0,2 - x
x = 0,2 ⋅ 12 4 = 0,6 (d).
Απάντηση: 0,6 γρ.
Ταξινόμηση οξειδοαναγωγικών αντιδράσεων
Διάκριση μεταξύ διαμοριακών και ενδομοριακών οξειδοαναγωγικών αντιδράσεων.
Πότε διαμοριακή OVRτα άτομα του οξειδωτικού και του αναγωγικού παράγοντα αποτελούν μέρος διαφορετικών ουσιών και είναι άτομα διαφορετικών χημικών στοιχείων.
Πότε ενδομοριακή OVRτα άτομα του οξειδωτικού και του αναγωγικού παράγοντα αποτελούν μέρος της ίδιας ουσίας. Οι ενδομοριακές αντιδράσεις περιλαμβάνουν δυσαναλογία, στην οποία ο οξειδωτικός παράγοντας και ο αναγωγικός παράγοντας είναι άτομα του ίδιου χημικού στοιχείου στην ίδια ουσία. Τέτοιες αντιδράσεις είναι δυνατές για ουσίες που περιέχουν άτομα με ενδιάμεση κατάσταση οξείδωσης.
Παράδειγμα 8.10. Αναφέρετε το σχήμα της δυσαναλογίας IRR:
1) MnO 2 + HCl → MnCl 2 + Cl 2 + H 2 O
2) Zn + H 2 SO 4 → ZnSO 4 + H 2
3) KI + Cl 2 → KCl + I 2
4) Cl 2 + KOH → KCl + KClO + H 2 O
Λύση . Οι αντιδράσεις 1) –3) είναι διαμοριακές OVR:
Η αντίδραση δυσαναλογίας είναι η αντίδραση 4), καθώς περιέχει ένα άτομο χλωρίου και έναν οξειδωτικό παράγοντα και έναν αναγωγικό παράγοντα:
Απάντηση: 4).
Είναι δυνατό να αξιολογηθούν ποιοτικά οι οξειδοαναγωγικές ιδιότητες των ουσιών με βάση την ανάλυση των καταστάσεων οξείδωσης των ατόμων στη σύνθεση μιας ουσίας:
1) εάν το άτομο που είναι υπεύθυνο για τις ιδιότητες οξειδοαναγωγής βρίσκεται στην υψηλότερη κατάσταση οξείδωσης, τότε αυτό το άτομο δεν μπορεί πλέον να δώσει ηλεκτρόνια, αλλά μπορεί μόνο να τα δεχτεί. Επομένως, στο OVR, αυτή η ουσία θα εκτεθεί μόνο οξειδωτικές ιδιότητες... Παραδείγματα τέτοιων ουσιών (οι τύποι υποδεικνύουν την κατάσταση οξείδωσης του ατόμου που είναι υπεύθυνο για τις ιδιότητες οξειδοαναγωγής):
2) εάν το άτομο που είναι υπεύθυνο για τις ιδιότητες οξειδοαναγωγής βρίσκεται στη χαμηλότερη κατάσταση οξείδωσης, τότε αυτή η ουσία στο ORP θα εμφανίσει μόνο αποκαταστατικές ιδιότητες(αυτό το άτομο δεν μπορεί πλέον να δεχτεί ηλεκτρόνια, μπορεί μόνο να τα δώσει μακριά). Παραδείγματα τέτοιων ουσιών:,. Επομένως, μόνο αναγωγικές ιδιότητες στο ORR παρουσιάζονται από όλα τα ανιόντα αλογόνου (με εξαίρεση το F-, για την οξείδωση του οποίου χρησιμοποιείται ηλεκτρικό ρεύμα στην άνοδο), ιόν σουλφιδίου S 2–, άτομο αζώτου στο μόριο αμμωνίας, υδρίδιο ιόν Η -. Τα μέταλλα (Na, K, Fe) έχουν μόνο αναγωγικές ιδιότητες.
3) εάν ένα άτομο ενός στοιχείου βρίσκεται σε ενδιάμεση κατάσταση οξείδωσης (η κατάσταση οξείδωσης είναι μεγαλύτερη από την ελάχιστη, αλλά μικρότερη από τη μέγιστη), τότε η αντίστοιχη ουσία (ιόν), ανάλογα με τις συνθήκες, θα εμφανίσει διπλό οξειδωτικά-αποκαταστατικές ιδιότητες: ισχυρότερα οξειδωτικά θα οξειδώσουν αυτές τις ουσίες (ιόντα) και οι ισχυρότεροι αναγωγικοί παράγοντες θα τις μειώσουν. Παραδείγματα τέτοιων ουσιών: θείο, αφού η υψηλότερη κατάσταση οξείδωσης του ατόμου του θείου είναι +6 και η χαμηλότερη είναι −2, οξείδιο του θείου (IV), οξείδιο του αζώτου (III) (η υψηλότερη κατάσταση οξείδωσης του ατόμου του αζώτου είναι +5 , και το χαμηλότερο είναι −3), υπεροξείδιο του υδρογόνου (η υψηλότερη κατάσταση οξείδωσης του ατόμου οξυγόνου είναι +2 και η χαμηλότερη είναι −2). Οι ιδιότητες διπλής οξειδοαναγωγής παρουσιάζονται από ιόντα μετάλλων σε ενδιάμεση κατάσταση οξείδωσης: Fe 2+, Mn +4, Cr +3, κ.λπ.
Παράδειγμα 8.11. Μια αντίδραση οξειδοαναγωγής δεν μπορεί να προχωρήσει, το σχήμα της οποίας:
1) Cl 2 + KOH → KCl + KClO 3 + H 2 O
2) S + NaOH → Na 2 S + Na 2 SO 3 + H 2 O
3) KClO → KClO 3 + KClO 4
4) KBr + Cl 2 → KCl + Br
Λύση. Η αντίδραση, το σχήμα της οποίας υποδεικνύεται στον αριθμό 3), δεν μπορεί να προχωρήσει, καθώς υπάρχει ένας αναγωγικός παράγοντας, αλλά δεν υπάρχει οξειδωτικός παράγοντας:
Απάντηση: 3).
Για ορισμένες ουσίες, η δυαδικότητα οξειδοαναγωγής οφείλεται στην παρουσία στη σύνθεσή τους διαφόρων ατόμων τόσο στη χαμηλότερη όσο και στην υψηλότερη κατάσταση οξείδωσης. Για παράδειγμα, το υδροχλωρικό οξύ (HCl) είναι ένας οξειδωτικός παράγοντας λόγω του ατόμου του υδρογόνου (η υψηλότερη κατάσταση οξείδωσης, ίση με +1) και ένας αναγωγικός παράγοντας λόγω του ανιόντος Cl (η χαμηλότερη κατάσταση οξείδωσης).
Η OVR είναι αδύνατη μεταξύ ουσιών που εμφανίζουν μόνο οξειδωτικές (HNO 3 και H 2 SO 4, KMnO 4 και K 2 CrO 7) ή μόνο αναγωγικές ιδιότητες (HCl και HBr, HI και H 2 S)
Τα OVR είναι εξαιρετικά κοινά στη φύση (μεταβολισμός σε ζωντανούς οργανισμούς, φωτοσύνθεση, αναπνοή, αποσύνθεση, καύση), χρησιμοποιούνται ευρέως από τον άνθρωπο για διάφορους σκοπούς (λήψη μετάλλων από μεταλλεύματα, οξέα, αλκάλια, αμμωνία και αλογόνα, δημιουργία χημικών πηγών ρεύματος, λήψη θερμότητα και ενέργεια όταν καίγονται διάφορες ουσίες). Σημειώστε ότι το OVR συχνά περιπλέκει τη ζωή μας (καταστροφή τροφίμων, φρούτων και λαχανικών, διάβρωση μετάλλων - όλα αυτά συνδέονται με την πορεία διαφόρων διεργασιών οξειδοαναγωγής).
Πολλές ουσίες έχουν ειδικές ιδιότητες, οι οποίες στη χημεία ονομάζονται συνήθως οξειδωτικές ή αναγωγικές.
Ορισμένες χημικές ουσίες παρουσιάζουν τις ιδιότητες οξειδωτικών παραγόντων, άλλες - αναγωγικών παραγόντων, ενώ ορισμένες ενώσεις μπορούν να εμφανίσουν και τις δύο ιδιότητες ταυτόχρονα (για παράδειγμα, το υπεροξείδιο του υδρογόνου H 2 O 2).
Τι είναι ένας οξειδωτικός παράγοντας και ένας αναγωγικός παράγοντας, οξείδωση και αναγωγή;
Οι οξειδοαναγωγικές ιδιότητες μιας ουσίας συνδέονται με τη διαδικασία της παροχής και λήψης ηλεκτρονίων από άτομα, ιόντα ή μόρια.
Οξειδωτικός παράγοντας είναι μια ουσία που λαμβάνει ηλεκτρόνια κατά τη διάρκεια μιας αντίδρασης, δηλαδή ανάγεται. αναγωγικός παράγοντας - δίνει ηλεκτρόνια, δηλαδή οξειδώνεται. Οι διαδικασίες μεταφοράς ηλεκτρονίων από μια ουσία σε μια άλλη ονομάζονται συνήθως αντιδράσεις οξειδοαναγωγής.
Οι ενώσεις που περιέχουν άτομα στοιχείων με τη μέγιστη κατάσταση οξείδωσης μπορούν να είναι οξειδωτικοί παράγοντες μόνο λόγω αυτών των ατόμων, καθώς έχουν ήδη εγκαταλείψει όλα τα ηλεκτρόνια σθένους τους και μπορούν να δέχονται μόνο ηλεκτρόνια. Η μέγιστη κατάσταση οξείδωσης ενός ατόμου ενός στοιχείου είναι ίση με τον αριθμό της ομάδας του περιοδικού πίνακα στην οποία ανήκει αυτό το στοιχείο. Οι ενώσεις που περιέχουν άτομα στοιχείων με ελάχιστη κατάσταση οξείδωσης μπορούν να χρησιμεύσουν μόνο ως αναγωγικοί παράγοντες, καθώς είναι ικανές να δωρίσουν ηλεκτρόνια, επειδή το εξωτερικό ενεργειακό επίπεδο τέτοιων ατόμων συμπληρώνεται από οκτώ ηλεκτρόνια
Αυτές περιλαμβάνουν αντιδράσεις στις οποίες οι αντιδρώντες ουσίες ανταλλάσσουν ηλεκτρόνια, ενώ αλλάζουν την κατάσταση οξείδωσης των ατόμων των στοιχείων που αποτελούν τις αντιδρώντες ουσίες.
Για παράδειγμα:
Zn + 2H + → Zn 2+ + H 2,
FeS 2 + 8HNO 3 (συμπ.) = Fe (NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O,
Η συντριπτική πλειοψηφία των χημικών αντιδράσεων είναι αντιδράσεις οξειδοαναγωγής, παίζουν εξαιρετικά σημαντικό ρόλο.
Η οξείδωση είναι η διαδικασία δωρεάς ηλεκτρονίων από ένα άτομο, ένα μόριο ή ένα ιόν.
Εάν ένα άτομο δωρίσει τα ηλεκτρόνια του, τότε αποκτά θετικό φορτίο:
Για παράδειγμα:
Al - 3e - = Al 3+
H2 - 2e - = 2H +
Η οξείδωση αυξάνει την κατάσταση οξείδωσης.
Εάν ένα αρνητικά φορτισμένο ιόν (φορτίο -1), για παράδειγμα Cl-, δώσει 1 ηλεκτρόνιο, τότε γίνεται ουδέτερο άτομο:
2Cl - - 2e - = Cl 2
Εάν ένα θετικά φορτισμένο ιόν ή άτομο δίνει ηλεκτρόνια, τότε η τιμή του θετικού φορτίου του αυξάνεται ανάλογα με τον αριθμό των ηλεκτρονίων που δωρίζονται:
Fe 2+ - e - = Fe 3+
Αναγωγή είναι η διαδικασία σύνδεσης ηλεκτρονίων σε ένα άτομο, μόριο ή ιόν.
Εάν ένα άτομο προσκολλήσει ηλεκτρόνια, τότε μετατρέπεται σε ένα αρνητικά φορτισμένο ιόν:
Για παράδειγμα:
Сl 2 + 2- = 2Сl -
S + 2e - = S 2-
Εάν ένα θετικά φορτισμένο ιόν δέχεται ηλεκτρόνια, τότε η τιμή του φορτίου του μειώνεται:
Fe 3+ + e- = Fe 2+
ή μπορεί να πάει σε ένα ουδέτερο άτομο:
Fe 2+ + 2e- = Fe 0
Οξειδωτικός παράγοντας είναι ένα άτομο, μόριο ή ιόν που δέχεται ηλεκτρόνια. Ένας αναγωγικός παράγοντας είναι ένα άτομο, μόριο ή ιόν που δίνει ηλεκτρόνια.
Ο οξειδωτικός παράγοντας ανάγεται κατά τη διάρκεια της αντίδρασης, ο αναγωγικός παράγοντας οξειδώνεται.
Η οξείδωση συνοδεύεται πάντα από αναγωγή και αντίστροφα, η αναγωγή συνδέεται πάντα με οξείδωση, η οποία μπορεί να εκφραστεί με τις εξισώσεις:
Αναγωγικός παράγοντας - e - ↔ Οξειδωτικός παράγοντας
Οξειδωτικό + e - ↔ Αναγωγικός παράγοντας
Επομένως, οι αντιδράσεις οξειδοαναγωγής είναι μια ενότητα δύο αντίθετων διεργασιών - οξείδωσης και αναγωγής
Οι σημαντικότεροι αναγωγικοί και οξειδωτικοί παράγοντες
|
Αναγωγικοί παράγοντες |
Οξειδωτικά |
Μέταλλα, υδρογόνο, άνθρακας Μονοξείδιο του άνθρακα (II) CO Υδρόθειο H 2 S, οξείδιο του θείου (IV) SO 2, θειικό οξύ H 2 SO 3 και τα άλατά του Υδροϊωδικό οξύ HI, υδροβρωμικό οξύ HBr, υδροχλωρικό οξύ HCl Χλωριούχος κασσίτερος (II) SnCl 2, θειικός σίδηρος (II) FeSO 4, θειικό μαγγάνιο (II) MnSO 4, θειικό χρώμιο (III) Cr 2 (SO 4) 3 Νιτρώδες οξύ HNO 2, αμμωνία NH 3, υδραζίνη N 2 H 4, μονοξείδιο του αζώτου (II) NO Φωσφορικό οξύ H 3 PO 3 Αλδεΰδες, αλκοόλες, μυρμηκικά και οξαλικά οξέα, γλυκόζη Κάθοδος ηλεκτρόλυσης |
Αλογόνα Υπερμαγγανικό κάλιο KMnO 4, μαγγανικό κάλιο K 2 MnO 4, οξείδιο μαγγανίου (IV) MnO 2 Διχρωμικό κάλιο K 2 Cr 2 O 7, χρωμικό κάλιο K 2 CrO 4 Νιτρικό οξύ HNO 3 Οξυγόνο O 2, όζον O 3, υπεροξείδιο του υδρογόνου Н 2 О 2 Θειικό οξύ H 2 SO 4 (συγκ.), Σεληνικό οξύ H 2 SeO 4 Οξείδιο χαλκού (II) CuO, οξείδιο αργύρου (I) Ag 2 O, οξείδιο μολύβδου (IV) PbO 2 Ιόντα ευγενών μετάλλων (Ag +, Au 3+, κ.λπ.) Χλωριούχος σίδηρος (III) FeCl 3 Υποχλωριώδες, χλωρικά και υπερχλωρικά Tsarskaya βότκα, ένα μείγμα συμπυκνωμένων νιτρικών και υδροφθορικών οξέων Άνοδος ηλεκτρόλυσης |
Μέθοδος ηλεκτρονικής ισορροπίας.
Για την εξίσωση του ORR, χρησιμοποιούνται διάφορες μέθοδοι, από τις οποίες θα εξετάσουμε μία προς το παρόν - τη μέθοδο ηλεκτρονικού ισοζυγίου.
Ας γράψουμε την εξίσωση για την αντίδραση μεταξύ αλουμινίου και οξυγόνου:
Al + O 2 = Al 2 O 3
Μην ξεγελιέστε από την απλότητα αυτής της εξίσωσης. Το καθήκον μας είναι να βρούμε μια μέθοδο που στο μέλλον θα σας επιτρέψει να εξισορροπήσετε πολύ πιο σύνθετες αντιδράσεις.
Ποια είναι λοιπόν η Μέθοδος Ηλεκτρονικού Ισοζυγίου; Η ισορροπία είναι ισότητα. Ως εκ τούτου, ο αριθμός των ηλεκτρονίων που ένα στοιχείο εγκαταλείπει και ένα άλλο στοιχείο λαμβάνει σε αυτή την αντίδραση θα πρέπει να είναι ο ίδιος. Αρχικά, αυτή η ποσότητα φαίνεται διαφορετική, κάτι που είναι εμφανές από τις διαφορετικές καταστάσεις οξείδωσης του αλουμινίου και του οξυγόνου:
Al 0 + O 2 0 = Al 2 +3 O 3 -2
Το αλουμίνιο δίνει ηλεκτρόνια (αποκτά θετική κατάσταση οξείδωσης) και το οξυγόνο δέχεται ηλεκτρόνια (αποκτά αρνητική κατάσταση οξείδωσης). Για να πάρει την κατάσταση οξείδωσης +3, το άτομο αλουμινίου πρέπει να δώσει 3 ηλεκτρόνια. Ένα μόριο οξυγόνου, για να μετατραπεί σε άτομα οξυγόνου με κατάσταση οξείδωσης -2, πρέπει να δέχεται 4 ηλεκτρόνια:
Al 0 - 3e- = Al +3
O 2 0 + 4e- = 2O -2
Για να εξισωθεί ο αριθμός των ηλεκτρονίων που δόθηκαν και ελήφθησαν, η πρώτη εξίσωση πρέπει να πολλαπλασιαστεί με 4 και η δεύτερη με 3. Για να γίνει αυτό, αρκεί να μετακινήσετε τους αριθμούς των ηλεκτρονίων που δόθηκαν και λήφθηκαν έναντι της επάνω και της κάτω γραμμής, όπως φαίνεται στο το παραπάνω διάγραμμα.
Αν τώρα στην εξίσωση πριν από τον αναγωγικό παράγοντα (Al) βάλουμε τον συντελεστή 4 που βρήκαμε, και πριν από τον οξειδωτικό παράγοντα (O 2) - τον συντελεστή που βρήκαμε 3, τότε ο αριθμός των ηλεκτρονίων που δίνονται και λαμβάνονται εξισώνεται και γίνεται ίσος με 12. Επιτυγχάνεται η ηλεκτρονική ισορροπία. Μπορεί να φανεί ότι απαιτείται ένας παράγοντας 2 πριν από το προϊόν αντίδρασης Al 2 O 3. Τώρα η εξίσωση της αντίδρασης οξειδοαναγωγής είναι ίση με:
4Al + 3O 2 = 2Al 2 O 3
Όλα τα πλεονεκτήματα της μεθόδου ηλεκτρονικής ισορροπίας εκδηλώνονται σε πιο περίπλοκες περιπτώσεις από την οξείδωση του αλουμινίου με οξυγόνο.
Για παράδειγμα, το γνωστό "υπερμαγγανικό κάλιο" - υπερμαγγανικό κάλιο KMnO 4 - είναι ένας ισχυρός οξειδωτικός παράγοντας λόγω του ατόμου Mn σε κατάσταση οξείδωσης +7. Ακόμη και το ανιόν χλωρίου Cl - του δίνει ένα ηλεκτρόνιο, που μετατρέπεται σε άτομο χλωρίου. Μερικές φορές χρησιμοποιείται για την παραγωγή αερίου χλωρίου στο εργαστήριο:
K + Mn +7 O 4 -2 + K + Cl - + H 2 SO 4 = Cl 2 0 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
Ας συντάξουμε ένα ηλεκτρονικό διάγραμμα ισορροπίας:
Mn +7 + 5e- = Mn +2
2Cl - - 2e- = Cl 2 0
Δύο και πέντε είναι οι κύριοι συντελεστές της εξίσωσης, χάρη στους οποίους είναι εύκολο να βρεθούν όλοι οι άλλοι συντελεστές. Πριν από το Cl 2, θα πρέπει να βάλετε έναν συντελεστή 5 (ή 2 × 5 = 10 μπροστά από το KСl) και πριν από το KMnO 4 - έναν συντελεστή 2. Όλοι οι άλλοι παράγοντες συνδέονται με αυτούς τους δύο παράγοντες. Είναι πολύ πιο εύκολο από την απλή απαρίθμηση αριθμών.
2 KMnO 4 + 10KCl + 8H 2 SO 4 = 5 Cl 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2 O
Για να εξισώσετε τον αριθμό των ατόμων Κ (12 άτομα στα αριστερά), πρέπει να βάλετε έναν παράγοντα 6 μπροστά από το K 2 SO 4 στη δεξιά πλευρά της εξίσωσης. Τέλος, για να εξισώσετε το οξυγόνο και το υδρογόνο, αρκεί να βάλετε ένας παράγοντας 8 μπροστά από H 2 SO 4 και H 2 O. Πήραμε την εξίσωση σε τελική μορφή.
Η μέθοδος ηλεκτρονικής ισορροπίας, όπως μπορούμε να δούμε, δεν αποκλείει τη συνήθη επιλογή συντελεστών στις εξισώσεις των αντιδράσεων οξειδοαναγωγής, αλλά μπορεί να διευκολύνει σημαντικά μια τέτοια επιλογή.
Σύνταξη της εξίσωσης για την αντίδραση του χαλκού με διάλυμα νιτρικού παλλαδίου (II). Ας γράψουμε τους τύπους των αρχικών και τελικών ουσιών της αντίδρασης και δείξουμε τις αλλαγές στις καταστάσεις οξείδωσης:
από το οποίο προκύπτει ότι για ένα αναγωγικό και ένα οξειδωτικό οι συντελεστές είναι ίσοι με 1. Η τελική εξίσωση αντίδρασης:
Cu + Pd (NO 3) 2 = Cu (NO 3) 2 + Pd
Όπως φαίνεται, τα ηλεκτρόνια δεν εμφανίζονται στη συνολική εξίσωση αντίδρασης.
Για να ελέγξουμε την ορθότητα της εξίσωσης που συντάχθηκε, μετράμε τον αριθμό των ατόμων κάθε στοιχείου στη δεξιά και την αριστερή πλευρά του. Για παράδειγμα, στη δεξιά πλευρά υπάρχουν 6 άτομα οξυγόνου, στην αριστερή πλευρά υπάρχουν επίσης 6 άτομα. παλλάδιο 1 και 1; ο χαλκός είναι επίσης 1 και 1. Αυτό σημαίνει ότι η εξίσωση έχει συντεθεί σωστά.
Ξαναγράφουμε αυτή την εξίσωση σε ιοντική μορφή:
Cu + Pd 2+ + 2NO 3 - = Cu 2+ + 2NO 3 - + Pd
Και αφού μειώσουμε τα ίδια ιόντα, παίρνουμε
Cu + Pd 2+ = Cu 2+ + Pd
Διατύπωση της εξίσωσης αντίδρασης για την αλληλεπίδραση οξειδίου μαγγανίου (IV) με πυκνό υδροχλωρικό οξύ
(με τη βοήθεια αυτής της αντίδρασης στο εργαστήριο λαμβάνεται χλώριο).
Ας γράψουμε τους τύπους των αρχικών και τελικών ουσιών της αντίδρασης:
НCl + МnО 2 → Сl 2 + MnСl 2 + Н 2 О
Ας δείξουμε την αλλαγή στις καταστάσεις οξείδωσης των ατόμων πριν και μετά την αντίδραση:
Αυτή η αντίδραση είναι οξειδοαναγωγική, καθώς οι καταστάσεις οξείδωσης των ατόμων χλωρίου και μαγγανίου αλλάζουν. Το НCl είναι αναγωγικός παράγοντας, το MnО 2 είναι οξειδωτικός παράγοντας. Συνθέτουμε ηλεκτρονικές εξισώσεις:

και βρείτε τους συντελεστές για τον αναγωγικό και τον οξειδωτικό παράγοντα. Είναι αντίστοιχα ίσα με 2 και 1. Ο συντελεστής 2 (και όχι 1) τίθεται επειδή 2 άτομα χλωρίου με κατάσταση οξείδωσης -1 δίνουν 2 ηλεκτρόνια. Αυτός ο συντελεστής βρίσκεται ήδη στην ηλεκτρονική εξίσωση:
2HCl + MnO 2 → Сl 2 + MnСl 2 + Н 2 О
Βρίσκουμε τους συντελεστές για άλλα αντιδρώντα. Από τις ηλεκτρονικές εξισώσεις φαίνεται ότι για 2 mol HCl υπάρχει 1 mol MnO2. Ωστόσο, δεδομένου ότι για τη δέσμευση του διπλά φορτισμένου ιόντος μαγγανίου που προκύπτει, χρειάζονται άλλα 2 mol οξέος, θα πρέπει να τεθεί ένας συντελεστής 4 μπροστά από τον αναγωγικό παράγοντα. Τότε το νερό θα αποδειχθεί 2 mol. Η τελική εξίσωση είναι
4НCl + МnО 2 = Сl 2 + MnСl 2 + 2Н 2 О
Ο έλεγχος της ορθογραφίας μιας εξίσωσης μπορεί να περιοριστεί στην μέτρηση του αριθμού των ατόμων ενός στοιχείου, για παράδειγμα του χλωρίου: 4 στα αριστερά και 2 + 2 = 4 στα δεξιά.
Δεδομένου ότι η μέθοδος ηλεκτρονικής ισορροπίας απεικονίζει τις εξισώσεις αντίδρασης σε μοριακή μορφή, μετά την κατάρτιση και την επαλήθευση, θα πρέπει να γραφτούν σε ιοντική μορφή.
Ας ξαναγράψουμε αυτή την εξίσωση σε ιοντική μορφή:
4Н + + 4Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Сl - + 2Н 2 О
και αφού ακυρώσουμε πανομοιότυπα ιόντα και στις δύο πλευρές της εξίσωσης, λαμβάνουμε
4Н + + 2Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Н 2 О
Διατύπωση της εξίσωσης αντίδρασης για την αλληλεπίδραση υδρόθειου με οξινισμένο διάλυμα υπερμαγγανικού καλίου.
Ας γράψουμε το σχήμα αντίδρασης - τους τύπους των αρχικών και λαμβανόμενων ουσιών:
Н 2 S + КМnO 4 + Н 2 SO 4 → S + МnSО 4 + К 2 SO 4 + Н 2 О
Στη συνέχεια δείχνουμε την αλλαγή στις καταστάσεις οξείδωσης των ατόμων πριν και μετά την αντίδραση:
Οι καταστάσεις οξείδωσης των ατόμων θείου και μαγγανίου αλλάζουν (το H 2 S είναι αναγωγικός παράγοντας, το KMnO 4 είναι οξειδωτικός παράγοντας). Συνθέτουμε ηλεκτρονικές εξισώσεις, δηλ. απεικονίζουμε τις διαδικασίες ανάκρουσης και προσκόλλησης ηλεκτρονίων:
Και τέλος, βρίσκουμε τους συντελεστές για τον οξειδωτικό και τον αναγωγικό παράγοντα και στη συνέχεια για τα άλλα αντιδρώντα. Από τις ηλεκτρονικές εξισώσεις φαίνεται ότι είναι απαραίτητο να ληφθούν 5 mol Н 2 S και 2 mol ΚМnО 4, τότε παίρνουμε 5 mol ατόμων S και 2 mol MnSО 4. Επιπλέον, συγκρίνοντας τα άτομα στην αριστερή και δεξιά πλευρά της εξίσωσης, διαπιστώνουμε ότι σχηματίζονται επίσης 1 mol K 2 SO 4 και 8 mol νερού. Η τελική εξίσωση αντίδρασης θα είναι
5Н 2 S + 2КМnО 4 + ЗН 2 SO 4 = 5S + 2ΜnSО 4 + К 2 SO 4 + 8Н 2 О
Η ορθότητα της γραφής της εξίσωσης επιβεβαιώνεται μετρώντας τα άτομα ενός στοιχείου, για παράδειγμα, το οξυγόνο. στην αριστερή τους πλευρά 2 4 + 3 4 = 20 και στη δεξιά πλευρά 2 4 + 4 + 8 = 20.
Ξαναγράφουμε την εξίσωση σε ιοντική μορφή:
5H 2 S + 2MnO 4 - + 6H + = 5S + 2Mn 2+ + 8H 2 O
Είναι γνωστό ότι μια σωστά γραμμένη εξίσωση αντίδρασης είναι μια έκφραση του νόμου της διατήρησης της μάζας των ουσιών. Επομένως, ο αριθμός των ίδιων ατόμων στα αρχικά υλικά και στα προϊόντα αντίδρασης πρέπει να είναι ο ίδιος. Οι χρεώσεις πρέπει επίσης να διατηρηθούν. Το άθροισμα των φορτίων των πρώτων υλών πρέπει πάντα να είναι ίσο με το άθροισμα των φορτίων των προϊόντων αντίδρασης.
Η μέθοδος του ισοζυγίου ηλεκτρονίων είναι πιο ευέλικτη από τη μέθοδο της ηλεκτρονικής ισορροπίας και έχει ένα αναμφισβήτητο πλεονέκτημα στην επιλογή συντελεστών σε πολλές αντιδράσεις οξειδοαναγωγής, ιδίως με τη συμμετοχή οργανικών ενώσεων, στις οποίες ακόμη και η διαδικασία για τον προσδιορισμό των καταστάσεων οξείδωσης είναι πολύ περίπλοκο.
Ταξινόμηση OVR
Υπάρχουν τρεις κύριοι τύποι οξειδοαναγωγικών αντιδράσεων:
1) Αντιδράσεις διαμοριακής οξείδωσης-αναγωγής
(όταν ο οξειδωτικός και ο αναγωγικός παράγοντας είναι διαφορετικές ουσίες).
2) Αντιδράσεις δυσαναλογίας
(όταν η ίδια ουσία μπορεί να χρησιμεύσει ως οξειδωτικό και αναγωγικό μέσο).
3) Αντιδράσεις ενδομοριακής οξείδωσης-αναγωγής
(όταν το ένα μέρος του μορίου δρα ως οξειδωτικός παράγοντας και το άλλο ως αναγωγικός παράγοντας).>
Ας εξετάσουμε παραδείγματα τριών τύπων αντιδράσεων.
1. Οι αντιδράσεις διαμοριακής οξείδωσης-αναγωγής είναι όλες οι αντιδράσεις που έχουμε ήδη εξετάσει σε αυτή την παράγραφο.
Ας εξετάσουμε μια κάπως πιο περίπλοκη περίπτωση, όταν δεν μπορεί να καταναλωθεί όλος ο οξειδωτικός παράγοντας στην αντίδραση, καθώς μέρος του εμπλέκεται στη συνήθη - μη οξειδοαναγωγική αντίδραση ανταλλαγής:
Cu 0 + H + N +5 O 3 -2 = Cu +2 (N +5 O 3 -2) 2 + N +2 O -2 + H 2 O
Μέρος των σωματιδίων NO 3 - συμμετέχει στην αντίδραση ως οξειδωτικός παράγοντας, δίνοντας οξείδιο του αζώτου NO, και μέρος των ιόντων NO 3 - αμετάβλητο, πηγαίνει στην ένωση χαλκού Cu (NO 3) 2. Ας συνθέσουμε ένα ηλεκτρονικό ισοζύγιο:
Cu 0 - 2e- = Cu +2
N +5 + 3e- = N +2
Ας βάλουμε τον συντελεστή 3 που βρέθηκε για τον χαλκό μπροστά από τον Cu και τον Cu (NO 3) 2. Αλλά ο συντελεστής 2 πρέπει να τεθεί μόνο μπροστά από το ΝΟ, επειδή όλο το άζωτο σε αυτό συμμετείχε στην αντίδραση οξειδοαναγωγής. Θα ήταν λάθος να βάλουμε συντελεστή 2 μπροστά από το HNO 3, επειδή αυτή η ουσία περιλαμβάνει επίσης εκείνα τα άτομα αζώτου που δεν συμμετέχουν στην οξείδωση-αναγωγή και αποτελούν μέρος του προϊόντος Cu (NO 3) 2 (σωματίδια NO 3 - εδώ ονομάζεται μερικές φορές "ιόν - παρατηρητής").
Οι υπόλοιποι συντελεστές επιλέγονται χωρίς δυσκολία χρησιμοποιώντας αυτούς που έχουν ήδη βρεθεί:
3 Cu + 8HNO 3 = 3 Cu (NO 3) 2 + 2 NO + 4H 2 O
2. Αντιδράσεις δυσαναλογίας συμβαίνουν όταν τα μόρια της ίδιας ουσίας είναι ικανά να οξειδώνονται και να μειώνουν το ένα το άλλο. Αυτό καθίσταται δυνατό εάν η ουσία περιέχει άτομα κάποιου στοιχείου σε ενδιάμεση κατάσταση οξείδωσης.
Επομένως, η κατάσταση οξείδωσης είναι ικανή τόσο να μειώνεται όσο και να αυξάνεται. Για παράδειγμα:
HN +3 O 2 = HN +5 O 3 + N +2 O + H 2 O
Αυτή η αντίδραση μπορεί να θεωρηθεί ως αντίδραση μεταξύ HNO 2 και HNO 2 ως οξειδωτικό και αναγωγικό παράγοντα και μπορεί να εφαρμοστεί η μέθοδος ηλεκτρονικής ισορροπίας:
HN +3 O 2 + HN +3 O 2 = HN +5 O3 + N +2 O + H 2 O
Ν +3 - 2e- = Ν +5
Ν +3 + ε- = Ν +2
Παίρνουμε την εξίσωση:
2HNO 2 + 1HNO 2 = 1 HNO 3 + 2 NO + H 2 O
Ή, προσθέτοντας μαζί τους κρεατοελιές HNO 2:
3HNO 2 = HNO 3 + 2NO + H 2 O
Οι ενδομοριακές αντιδράσεις οξείδωσης-αναγωγής συμβαίνουν όταν οξειδωτικά και αναγωγικά άτομα βρίσκονται δίπλα σε ένα μόριο. Εξετάστε την αποσύνθεση του άλατος Berthollet KClO 3 κατά τη θέρμανση:
KCl +5 O 3 -2 = KCl - + O 2 0
Αυτή η εξίσωση υπακούει επίσης στην απαίτηση ηλεκτρονικού υπολοίπου:
Cl +5 + 6e- = Cl -
2O -2 - 2e- = O 2 0
Εδώ προκύπτει η δυσκολία - ποιον από τους δύο συντελεστές που βρέθηκαν να βάλουμε μπροστά από το KClO 3 - τελικά, αυτό το μόριο περιέχει και οξειδωτικό και αναγωγικό παράγοντα;
Σε τέτοιες περιπτώσεις, οι συντελεστές που βρέθηκαν τοποθετούνται πριν από τα γινόμενα:
KClO 3 = 2KCl + 3O 2
Τώρα είναι σαφές ότι το KClO 3 πρέπει να προηγείται του συντελεστή 2.
2KClO 3 = 2KCl + 3O 2
Η αντίδραση ενδομοριακής αποσύνθεσης του άλατος κουκουλών όταν θερμαίνεται χρησιμοποιείται για τη λήψη οξυγόνου στο εργαστήριο.
Μέθοδος ημιαντίδρασης

Όπως υποδηλώνει το όνομα, αυτή η μέθοδος βασίζεται στην προετοιμασία ιοντικών εξισώσεων για τη διαδικασία οξείδωσης και τη διαδικασία αναγωγής, ακολουθούμενη από την άθροισή τους σε μια γενική εξίσωση.
Για παράδειγμα, ας συντάξουμε την εξίσωση της ίδιας αντίδρασης που χρησιμοποιήθηκε για να εξηγήσει τη μέθοδο ηλεκτρονικής ισορροπίας.
Όταν το υδρόθειο H 2 S διέρχεται από ένα οξινισμένο διάλυμα υπερμαγγανικού καλίου KMnO 4, το βυσσινί χρώμα εξαφανίζεται και το διάλυμα γίνεται θολό.
Η εμπειρία δείχνει ότι η θολότητα του διαλύματος προκύπτει ως αποτέλεσμα του σχηματισμού στοιχειακού θείου, δηλ. η πορεία της διαδικασίας:
H 2 S → S + 2H +
Αυτό το σχήμα εξισώνεται για τον αριθμό των ατόμων. Για να εξισωθεί ο αριθμός των φορτίων, δύο ηλεκτρόνια πρέπει να αφαιρεθούν από την αριστερή πλευρά του κυκλώματος, μετά την οποία το βέλος μπορεί να αντικατασταθεί με ένα σύμβολο ίσου:
Н 2 S - 2е - = S + 2H +
Αυτή είναι η πρώτη μισή αντίδραση - η διαδικασία οξείδωσης του αναγωγικού παράγοντα Н 2 S.
Ο αποχρωματισμός του διαλύματος σχετίζεται με τη μετάβαση του ιόντος MnO 4 - (έχει χρώμα βατόμουρου) στο ιόν Mn 2+ (σχεδόν άχρωμο και μόνο σε υψηλή συγκέντρωση έχει ελαφρώς ροζ χρώμα), το οποίο μπορεί να εκφραστεί από το σχέδιο
MnO 4 - → Mn 2+
Σε ένα όξινο διάλυμα, το οξυγόνο, το οποίο είναι μέρος των ιόντων MnO 4, μαζί με τα ιόντα υδρογόνου, σχηματίζουν τελικά νερό. Επομένως, γράφουμε τη διαδικασία μετάβασης ως εξής:
MnO 4 - + 8H + → Mn 2+ + 4H 2 O
Για να αντικαταστήσετε το βέλος με σύμβολο ίσου, πρέπει επίσης να εξισωθούν οι χρεώσεις. Δεδομένου ότι οι αρχικές ουσίες έχουν επτά θετικά φορτία (7+) και οι τελικές έχουν δύο θετικά (2+), τότε για να εκπληρωθεί η προϋπόθεση για τη διατήρηση των φορτίων, είναι απαραίτητο να προστεθούν πέντε ηλεκτρόνια στην αριστερή πλευρά του κυκλώματος :
MnO 4 - + 8H + + 5e - = Mn 2+ + 4H 2 O
Αυτή είναι η δεύτερη ημιαντίδραση - η διαδικασία μείωσης του οξειδωτικού παράγοντα, δηλ. υπερμαγγανικό ιόν
Για να συνθέσετε τη γενική εξίσωση αντίδρασης, είναι απαραίτητο να προσθέσετε τις εξισώσεις μισής αντίδρασης ανά όρο, έχοντας προηγουμένως εξισώσει τους αριθμούς των ηλεκτρονίων που δόθηκαν και ελήφθησαν. Στην περίπτωση αυτή, σύμφωνα με τους κανόνες εύρεσης του μικρότερου πολλαπλάσιου, προσδιορίζονται οι αντίστοιχοι παράγοντες με τους οποίους πολλαπλασιάζονται οι εξισώσεις των ημιαντιδράσεων. Εν ολίγοις, η καταγραφή πραγματοποιείται ως εξής:

Και, έχοντας μειωθεί κατά 10H +, τελικά παίρνουμε
5H 2 S + 2MnO 4 - + 6H + = 5S + 2Mn 2+ + 8H 2 O
Ελέγχουμε την ορθότητα της εξίσωσης που συντάχθηκε με την ιοντική μορφή: ο αριθμός των ατόμων οξυγόνου στην αριστερή πλευρά είναι 8, στη δεξιά πλευρά 8. αριθμός φορτίσεων: στην αριστερή πλευρά (2 -) + (6+) = 4+, στη δεξιά πλευρά 2 (2+) = 4+. Η εξίσωση είναι σωστή, αφού τα άτομα και τα φορτία είναι ίσα.
Με τη μέθοδο των ημι-αντιδράσεων, η εξίσωση αντίδρασης συντάσσεται σε ιοντική μορφή. Για να περάσουμε από αυτήν στην εξίσωση σε μοριακή μορφή, προχωράμε ως εξής: στην αριστερή πλευρά της ιοντικής εξίσωσης, επιλέγουμε το αντίστοιχο κατιόν για κάθε ανιόν και για κάθε κατιόν - ένα ανιόν. Στη συνέχεια γράφουμε τα ίδια ιόντα στον ίδιο αριθμό στη δεξιά πλευρά της εξίσωσης, μετά από την οποία συνδυάζουμε τα ιόντα σε μόρια:

Έτσι, η σύνταξη των εξισώσεων των οξειδοαναγωγικών αντιδράσεων με τη μέθοδο της μισής αντίδρασης οδηγεί στο ίδιο αποτέλεσμα με τη μέθοδο της ηλεκτρονικής ισορροπίας.
Ας συγκρίνουμε και τις δύο μεθόδους. Το πλεονέκτημα της μεθόδου των ημι-αντιδράσεων σε σύγκριση με τη μέθοδο της ηλεκτρονικής ισορροπίας είναι ότι. ότι δεν χρησιμοποιεί υποθετικά ιόντα, αλλά πραγματικά. Πράγματι, δεν υπάρχουν ιόντα στο διάλυμα, αλλά υπάρχουν ιόντα.
Με τη μέθοδο ημιαντίδρασης, δεν χρειάζεται να γνωρίζετε την κατάσταση οξείδωσης των ατόμων.
Η σύνταξη μεμονωμένων ιοντικών εξισώσεων ημιαντίδρασης είναι απαραίτητη για την κατανόηση των χημικών διεργασιών σε ένα γαλβανικό στοιχείο και κατά τη διάρκεια της ηλεκτρόλυσης. Με αυτή τη μέθοδο είναι ορατός ο ρόλος του περιβάλλοντος ως ενεργού συμμετέχοντος στην όλη διαδικασία. Τέλος, όταν χρησιμοποιείτε τη μέθοδο μισής αντίδρασης, δεν χρειάζεται να γνωρίζετε όλες τις ουσίες που προκύπτουν, εμφανίζονται στην εξίσωση της αντίδρασης όταν αυτή προέρχεται. Επομένως, θα πρέπει να προτιμάται η μέθοδος των ημι-αντιδράσεων και θα πρέπει να εφαρμόζεται κατά τη σύνταξη εξισώσεων για όλες τις αντιδράσεις οξειδοαναγωγής που λαμβάνουν χώρα σε υδατικά διαλύματα.
Οι αντιδράσεις οξειδοαναγωγής, ή εν συντομία ORR, αποτελούν ένα από τα θεμέλια του αντικειμένου της χημείας, αφού περιγράφουν την αλληλεπίδραση μεμονωμένων χημικών στοιχείων μεταξύ τους. Όπως υποδηλώνει το όνομα, αυτές οι αντιδράσεις περιλαμβάνουν τουλάχιστον δύο διαφορετικές χημικές ουσίες, η μία από τις οποίες δρα ως οξειδωτικός παράγοντας και η άλλη ως αναγωγικός παράγοντας. Προφανώς, είναι πολύ σημαντικό να μπορούμε να τα διακρίνουμε και να τα προσδιορίζουμε σε διάφορες χημικές αντιδράσεις.
Πώς να αναγνωρίσετε έναν οξειδωτικό και έναν αναγωγικό παράγονταΗ κύρια δυσκολία στον προσδιορισμό του οξειδωτικού και του αναγωγικού παράγοντα στις χημικές αντιδράσεις είναι ότι οι ίδιες ουσίες σε διαφορετικές περιπτώσεις μπορεί να είναι και οξειδωτικοί και αναγωγικοί παράγοντες. Για να μάθετε πώς να προσδιορίζετε σωστά τον ρόλο ενός συγκεκριμένου χημικού στοιχείου σε μια αντίδραση, πρέπει να κατανοήσετε με σαφήνεια τις ακόλουθες βασικές έννοιες.
- Με οξείδωση ονομάζεται η διαδικασία απελευθέρωσης ηλεκτρονίων από το εξωτερικό στρώμα ηλεκτρονίων ενός χημικού στοιχείου. Με τη σειρά του μέσο οξείδωσης θα υπάρχει ένα άτομο, μόριο ή ιόν που δέχεται ηλεκτρόνια και έτσι μειώνει την κατάσταση οξείδωσής του, η οποία είναι αναρρώνω ... Μετά από μια χημική αντίδραση αλληλεπίδρασης με άλλη ουσία, ο οξειδωτικός παράγοντας αποκτά πάντα θετικό φορτίο.
- Αποκατάσταση ονομάζεται η διαδικασία σύνδεσης ηλεκτρονίων στο εξωτερικό στρώμα ηλεκτρονίων ενός χημικού στοιχείου. Αποκαταστάτης θα υπάρχει ένα άτομο, ένα μόριο ή ένα ιόν που δίνει τα ηλεκτρόνια του και έτσι θα αυξήσει την κατάσταση οξείδωσής τους, δηλαδή οξειδώθηκε ... Μετά από μια χημική αντίδραση αλληλεπίδρασης με άλλη ουσία, ο αναγωγικός παράγοντας αποκτά πάντα θετικό φορτίο.
- Με απλά λόγια, ένας οξειδωτικός παράγοντας είναι μια ουσία που "λαμβάνει" ηλεκτρόνια και ένας αναγωγικός παράγοντας είναι μια ουσία που τα δίνει σε έναν οξειδωτικό παράγοντα. Είναι δυνατό να προσδιοριστεί ποιος παίζει το ρόλο ενός οξειδωτικού παράγοντα σε μια αντίδραση οξειδοαναγωγής, ποιος είναι ένας αναγωγικός παράγοντας και σε ποιες περιπτώσεις ένας οξειδωτικός παράγοντας γίνεται αναγωγικός παράγοντας και αντίστροφα, γνωρίζοντας την τυπική συμπεριφορά στις χημικές αντιδράσεις μεμονωμένων στοιχείων.
- Τυπικοί αναγωγικοί παράγοντες είναι τα μέταλλα και το υδρογόνο: Fe, K, Ca, Cu, Mg, Na, Zn, H). Όσο λιγότερο ιονισμένα είναι, τόσο μεγαλύτερες είναι οι αναγωγικές τους ιδιότητες. Για παράδειγμα, ο μερικώς οξειδωμένος σίδηρος, ο οποίος δίνει ένα ηλεκτρόνιο και έχει φορτίο +1, θα μπορεί να δώσει ένα λιγότερο ηλεκτρόνιο σε σύγκριση με τον «καθαρό» σίδηρο. Επίσης αναγωγικοί παράγοντες μπορεί να είναι ενώσεις χημικών στοιχείων στη χαμηλότερη κατάσταση οξείδωσης, στην οποία γεμίζουν όλα τα ελεύθερα τροχιακά και τα οποία μπορούν να δωρίσουν μόνο ηλεκτρόνια, για παράδειγμα, αμμωνία NH 3, υδρόθειο H 2 S, υδροβρώμιο HBr, υδροιώδιο HI, υδροχλώριο HCl.
- Πολλά αμέταλλα (F, Cl, I, O, Br) είναι τυπικοί οξειδωτικοί παράγοντες. Επίσης οξειδωτικοί παράγοντες μπορεί να είναι μέταλλα με υψηλή κατάσταση οξείδωσης (Fe +3, Sn +4, Mn +4), καθώς και ορισμένες ενώσεις στοιχείων σε υψηλή κατάσταση οξείδωσης: υπερμαγγανικό κάλιο KMnO 4, θειικό οξύ Н 2 SO 4, νιτρικό οξύ HNO 3, οξείδιο του χαλκού CuO, χλωριούχος σίδηρος FeCl 3.
- Χημικές ενώσεις σε ατελείς ή ενδιάμεσες καταστάσεις οξείδωσης, για παράδειγμα, το μονοβασικό νιτρικό οξύ HNO 2, το υπεροξείδιο του υδρογόνου H 2 O 2, το θειικό οξύ H 2 SO 3 μπορούν να εμφανίσουν τόσο οξειδωτικές όσο και αναγωγικές ιδιότητες, ανάλογα με τις οξειδοαναγωγικές ιδιότητες του δεύτερου αντιδραστηρίου η αλληλεπίδραση...

Από αυτό το παράδειγμα προκύπτει ότι ένα άτομο νατρίου δωρίζει το ηλεκτρόνιό του σε ένα άτομο οξυγόνου. Επομένως, το νάτριο είναι ένας αναγωγικός παράγοντας και το οξυγόνο είναι ένας οξειδωτικός παράγοντας. Σε αυτή την περίπτωση, το νάτριο θα οξειδωθεί πλήρως, αφού θα δώσει τον μέγιστο δυνατό αριθμό ηλεκτρονίων και το άτομο οξυγόνου δεν θα μειωθεί εντελώς, αφού θα μπορεί να δεχτεί άλλο ηλεκτρόνιο από άλλο άτομο οξυγόνου.