Δάσκαλος:
Εκπαιδευτικό ίδρυμα: επαγγελματικό λύκειο του μετρό της Αγίας Πετρούπολης
Ακαδημαϊκή πειθαρχία: χημεία
Θέμα: "Οργανικές ενώσεις που περιέχουν οξυγόνο και άζωτο"
Το κοινό-στόχο: 1 πορεία
Τύπος μαθήματος: γενίκευση υλικού, 1 acad. ώρα.
Στόχοι μαθήματος:
Η γνώση: να γνωρίζετε τους τύπους και τις ιδιότητες των οργανικών ουσιών που περιέχουν οξυγόνο και που περιέχουν άζωτο
Κατανόηση:κατανοήστε την εξάρτηση των ιδιοτήτων των ουσιών από τη δομή του μορίου, από τη λειτουργική ομάδα
Εφαρμογή: Χρησιμοποιήστε πληροφορίες σχετικά με τις ιδιότητες των ουσιών για να συντάξετε εξισώσεις χημικών αντιδράσεων.
Ανάλυση: Αναλύστε την αμοιβαία επίδραση ομάδων ατόμων σε μόρια οργανικών ουσιών.
Σύνθεση:γενικεύουν πληροφορίες σχετικά με τις ιδιότητες των οργανικών ουσιών με τη μορφή μιας αλυσίδας μετασχηματισμών
Εκτίμηση: αυτοαξιολόγηση σύμφωνα με τις προτεινόμενες επικεφαλίδες.
Εξοπλισμός: διαδραστικός πίνακας, παρουσίαση πολυμέσων.
Πλάνο μαθήματος:
1. Οργ. στιγμή
2. Επανάληψη αυτού που είχε μάθει προηγουμένως.
3. Ομιλίες των μαθητών.
4. Αυτοπροσδιορισμός των μαθητών από τα επίπεδα αυτοεκτίμησης.
5. Ανεξάρτητη εργασία Φοιτητές.
6. Συνοψίζοντας τα αποτελέσματα σύμφωνα με το κριτήριο προσανατολισμένο σύστημα.
7. Εργασία στο σπίτι.
Κατά τη διάρκεια των μαθημάτων
1. Οργάνωση του χρόνου.
Δημιουργία ομάδας, έκθεση επικεφαλής ομάδας σχετικά με τον αριθμό των μαθητών που είναι παρόντες.
2. Επανάληψη προηγούμενων μαθημάτων
Πληροφορίες για λειτουργικές ομάδες, κατηγορίες ουσιών που περιέχουν οξυγόνο και αζώτου, σχετικά με τους απλούστερους εκπροσώπους αυτών των τάξεων με τη χρήση διαδραστικού πίνακα και παρουσίασης πολυμέσων.
Ποια ομάδα ατόμων, η οποία υπάρχει απαραιτήτως στα μόρια των ουσιών μιας συγκεκριμένης κατηγορίας, καθορίζει τη χημική λειτουργία της ουσίας, δηλαδή Χημικές ιδιότητες?
Απάντηση: λειτουργική ομάδα ατόμων
Δώστε ένα όνομα στη λειτουργική ομάδα - OH
Απάντηση: η ομάδα ατόμων υδροξυλίου.
Ποια κατηγορία ουσιών ορίζει η ομάδα ατόμων υδροξυλίου;
Απάντηση: Αλκοόλες, εάν 1 ομάδα είναι ΟΗ, μονοϋδρική αλκοόλη, εάν περισσότερες από μία ομάδες είναι ΟΗ, πολυυδρικές αλκοόλες.
Δώστε το όνομα στη λειτουργική ομάδα - DREAM. Ποια κατηγορία ουσιών ορίζει;
Απάντηση: η ομάδα αλδεϋδης καθορίζει την κατηγορία των αλδεϋδών.
Ονομάστε τις συναρτήσεις στην ομάδα - SLEEP. Τι τάξη ορίζει;
Απάντηση: η ομάδα καρβοξυλίου ορίζει την κατηγορία καρβοξυλικών οξέων.
Ονομάστε τις συναρτήσεις στην ομάδα - NH2. Τι τάξη ορίζει;
Απάντηση: Η αμινομάδα ορίζει την κατηγορία των αμινών ή την κατηγορία των αμινοξέων.
Ακούμε τα μηνύματα των μαθητών με την παρουσίαση παρουσιάσεων πολυμέσων σχετικά με τους απλούστερους εκπροσώπους διαφόρων κατηγοριών ουσιών που περιέχουν οξυγόνο και άζωτο.
3. Ομιλίες των μαθητών.
Μήνυμα 1.
Αιθανόλη С2Н5ОН, κατηγορία μονοϋδρικών αλκοολών, λειτουργική ομάδα - υδροξυλομάδα ατόμων - ΟΗ. Ποιοτική αντίδραση - αλληλεπίδραση με οξείδιο του χαλκού (II) με το σχηματισμό αλδεΰδης. Χημικές ιδιότητες (διάκριση 2 αντιδράσεων) - καύση και αλληλεπίδραση με μέταλλα (Na).
Μήνυμα 2.
Προπανοτριόλη (γλυκερόλη) C3H7 (OH) 3. Κατηγορία - πολυυδρικές αλκοόλες, λειτουργικές ομάδες - διάφορες υδροξυλομάδες - ΟΗ Ποιοτική αντίδραση - αλληλεπίδραση με υδροξείδιο του χαλκού (II). Χημικές ιδιότητες - αλληλεπίδραση με το νάτριο και με τα αλογονίδια υδρογόνου.
Εργαστηριακή εμπειρία:
Ρίξτε περίπου 1 ml διαλύματος αθροιστικού χαλκού (II) σε δοκιμαστικό σωλήνα και προσθέστε λίγο διάλυμα υδροξειδίου του νατρίου έως ότου σχηματιστεί ένα μπλε ίζημα υδροξειδίου χαλκού (II). Προσθέστε στάγδην διάλυμα γλυκερίνης στο προκύπτον ίζημα. Ανακινήστε το μείγμα. Σημειώνουμε ότι ο μετασχηματισμός του μπλε ιζήματος σε μπλε διάλυμα.
(γλυκερίνη + Cu (OH) 2 ----- μπλε διάλυμα)
Μήνυμα 3.
Το Phenol C6H5OH είναι ο απλούστερος εκπρόσωπος της κατηγορίας φαινόλης.
Η λειτουργική ομάδα είναι η ομάδα υδροξυλίου –ΟΗ. Ποιοτική αντίδραση - ο σχηματισμός ιώδους διαλύματος όταν αλληλεπιδρά με χλωριούχο σίδηρο (III) ή ο σχηματισμός λευκού ιζήματος όταν αλληλεπιδρά με βρώμιο. Χημικές ιδιότητες: η φαινόλη είναι ασθενές οξύ, αλληλεπιδρά σε μέταλλα (Na) με αλκάλια (NaOH) και με βρώμιο.
Μήνυμα 4.
Αιθανόλη ή ακεταλδεΰδη CH3-COH Λειτουργική ομάδα - COH αλδεϋδη ομάδα. Κατηγορία - αλδεϋδες. Η ποιοτική αντίδραση είναι η αντίδραση του «ασημένιου καθρέφτη». Χημικές ιδιότητες: αντίδραση μείωσης και αντίδραση οξείδωσης.
Εργαστηριακή εμπειρία: εμπειρία επίδειξης.
Σε δοκιμαστικό σωλήνα που περιέχει 1 ml αλδεΰδης ( διάλυμα νερού) προσθέστε μερικές σταγόνες διαλύματος αμμωνίας οξειδίου του αργύρου. Ζεσταίνουμε τον δοκιμαστικό σωλήνα. Παρατηρούμε την απελευθέρωση αργύρου στα τοιχώματα του δοκιμαστικού σωλήνα, η γυάλινη επιφάνεια γίνεται σαν καθρέφτης.
Μήνυμα 5.
Αιθανικό οξύ CH3-COOH (οξικό οξύ). Κατηγορία - καρβοξυλικά οξέα. Λειτουργική ομάδα - ομάδα καρβοξυλίου COOH. Ποιοτική αντίδραση - η ένδειξη litmus γίνεται κόκκινη.
Χημικές ιδιότητες: όπως οποιοδήποτε οξύ αλληλεπιδρά με μέταλλα (Na), βασικά οξείδια (Na2O), αλκάλια (NaOH).
Εργαστηριακή εμπειρία:
Ρίξτε λίγο οξικό οξύ σε ένα στεγνό, καθαρό δοκιμαστικό σωλήνα με καθολική ένδειξη. Η ένδειξη γίνεται κόκκινη.
Μήνυμα 6.
Γλυκόζη C6H12O6. Κατηγορία - υδατάνθρακες. Λειτουργικές ομάδες: 5-ΟΗ και 1-COH, δηλαδή αλδεϋδροαλκοόλη. Ποιοτικές αντιδράσεις: αλληλεπίδραση με υδροξείδιο του χαλκού για σχηματισμό κυανού διαλύματος. Η αντίδραση του «ασημένιου καθρέφτη» με την απελευθέρωση αργύρου στα τοιχώματα του δοκιμαστικού σωλήνα. Χημικές ιδιότητες: αναγωγή σε εξαεδρική αλκοόλη, οξείδωση σε γλυκονικό οξύ, αντίδραση ζύμωσης.
Μήνυμα 7.
Ανιλίνη C6H5-NH2.
Λειτουργική ομάδα - αμινομάδα NH2. Κατηγορία - αμίνες. Ποιοτική αντίδραση: αλληλεπίδραση με νερό βρωμίου με σχηματισμό λευκού ιζήματος. Χημικές ιδιότητες: αλληλεπίδραση με υδροχλωρικό οξύ και με βρώμιο.
Μήνυμα 8.
Αμινοαιθανικό οξύ NH2-CH2-COOH ή αμινοξικό οξύ.
Κατηγορία - αμινοξέα. Λειτουργικές ομάδες: - αμινομάδα NH2 και ομάδα καρβοξυλίου -COOH. Χημικές ιδιότητες: AK - αμφοτερικές ενώσεις; - Το NH2 προσδίδει βασικές ιδιότητες, - COOH - όξινες ιδιότητες. Ως εκ τούτου, τα αμινοξέα μπορούν να συνδυαστούν μεταξύ τους, σχηματίζοντας πρωτεϊνικά μόρια και η πρωτεΐνη είναι η βάση της ζωής στον πλανήτη μας.
4. Αυτοπροσδιορισμός των μαθητών από τα επίπεδα αυτοεκτίμησης.
Διαδραστικός πίνακας: οι μαθητές εξοικειώνονται με τον χάρτη αυτοαξιολόγησης της εξέλιξης στο μάθημα και επισημαίνουν το επίπεδό τους.
1. Μπορώ να προσδιορίσω τη λειτουργική ομάδα και τον απλούστερο εκπρόσωπο της τάξης των οργανικών ουσιών με τη βοήθεια ενός δασκάλου και μιας σύνοψης (6-7 βαθμοί).
2. Μπορώ να προσδιορίσω τη λειτουργική ομάδα, τον απλούστερο εκπρόσωπο της τάξης των οργανικών ουσιών, χωρίς τη βοήθεια ενός δασκάλου και χωρίς τη βοήθεια μιας σύνοψης (8-10 βαθμοί).
3. Μπορώ να προσδιορίσω την ποιοτική αντίδραση και τις χημικές ιδιότητες μιας ουσίας με τη βοήθεια ενός δασκάλου και μια σύνοψη (11-14 βαθμοί).
4. Μπορώ να προσδιορίσω την ποιοτική αντίδραση και τις χημικές ιδιότητες μιας ουσίας χωρίς τη βοήθεια ενός δασκάλου και χωρίς μια σύνοψη (15-18 βαθμοί).
Τάξη | Λειτουργικές ομάδες | Ο απλούστερος εκπρόσωπος | Ποιοτικές αντιδράσεις | Χημικές ιδιότητες |
Μονατομικός αλκοόλες | ||||
Πολυυδρικές αλκοόλες | ||||
Φαινόλες | ||||
Αλδεϋδες | ||||
Καρβοξυλικά οξέα | ||||
Υδατάνθρακες | ||||
Αμίνες | ||||
Αμινοξέα |
Οι μαθητές εισάγονται σε ένα σύστημα αξιολόγησης βάσει κριτηρίων.
Κριτήρια:
18 - 15 βαθμοί - "εξαιρετικό"
βαθμοί - "καλό"
10 - 6 βαθμοί - "ικανοποιητικό"
5 ή λιγότερο - "μη ικανοποιητικό"
5. Ανεξάρτητη εργασία μαθητών.
6. Συνοψίζοντας τα αποτελέσματα σύμφωνα με ένα κριτήριο προσανατολισμένο σύστημα (ανακοίνωση του αριθμού των βαθμών στους μαθητές).
7. Εργασία στο σπίτι:γεμίζοντας το τραπέζι.
Κάνοντας κλικ στο κουμπί "Λήψη αρχείου", θα κατεβάσετε το αρχείο που χρειάζεστε δωρεάν.
Πριν από τη λήψη αυτού του αρχείου, θυμηθείτε εκείνες τις καλές περιλήψεις, δοκιμές, άρθρα, διατριβές, άρθρα και άλλα έγγραφα που δεν έχουν διεκδικηθεί στον υπολογιστή σας. Αυτό είναι το έργο σας, πρέπει να συμμετέχει στην ανάπτυξη της κοινωνίας και να ωφελεί τους ανθρώπους. Βρείτε αυτά τα έργα και υποβάλετε στη βάση γνώσεων.
Εμείς και όλοι οι φοιτητές, οι μεταπτυχιακοί φοιτητές, οι νέοι επιστήμονες που χρησιμοποιούν τη βάση γνώσεων στις σπουδές και τη δουλειά τους θα είμαστε πολύ ευγνώμονες σε εσάς.
Για να κατεβάσετε ένα αρχείο με ένα έγγραφο, στο παρακάτω πεδίο, εισαγάγετε έναν πενταψήφιο αριθμό και κάντε κλικ στο κουμπί "Λήψη αρχείου"
Παρόμοια έγγραφα
- - πρωτοταγείς αμίνες YMN 2 ·
- - δευτεροταγείς αμίνες KI / NN ·
- - τριτοταγείς αμίνες KK "K" N.
Ονοματολογία παραγώγων βενζολίου, ποικιλίες και μέθοδοι παρασκευής, αρχές και οδηγίες πρακτική χρήση... Δομή και αρωματικότητα βενζολίου. Ο κανόνας και τα χαρακτηριστικά της εφαρμογής της Hückel. Μη βενζοϊκές αρωματικές ενώσεις.
περίληψη, προστέθηκε 08/05/2013
Αρωματικοί υδρογονάνθρακες: γενικά χαρακτηριστικά. Ονοματολογία και ισομερισμός, φυσικές και χημικές ιδιότητες των αρωματικών υδρογονανθράκων. Ο μηχανισμός αντιδράσεων ηλεκτροφιλικής και πυρηνόφιλης υποκατάστασης στην αρωματική σειρά. Η χρήση των αρενών, η τοξικότητά τους.
περίληψη, προστέθηκε 12/11/2011
Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες που περιέχουν μόνο απλούς δεσμούς άνθρακα. Παραγωγή αλκανίων: βιομηχανική μέθοδος, νίτρωση και οξείδωση. Οι υδρογονάνθρακες που περιέχουν διπλό δεσμό άνθρακα είναι αλκένια ή αιθυλενικοί υδρογονάνθρακες. Υδρογονάνθρακες διενίου.
προστέθηκε διάλεξη 02/05/2009
Οι ακόρεστες ενώσεις με δύο διπλούς δεσμούς στο μόριο είναι οι υδρογονάνθρακες διενίου. Η σχέση μεταξύ της δομής των υδρογονανθράκων διενίου και των ιδιοτήτων τους. Μέθοδοι για την παραγωγή δισβινυλίου, ισοπρενίου, συνθετικού καουτσούκ. Οργανικά αλογονίδια και η ταξινόμησή τους.
προστέθηκε διάλεξη στις 19/2/2009
Δομή, ονοματολογία αλκενίων. Ακόρεστοι υδρογονάνθρακες, τα μόρια των οποίων περιέχουν έναν διπλό δεσμό C-C. Τροχιακός υβριδισμός. Εικόνα της χωρικής δομής των ατόμων. Χωρικός ισομερισμός του σκελετού άνθρακα. Φυσικές ιδιότητες των αλκενίων.
η παρουσίαση προστέθηκε στις 08/06/2015
Ανάπτυξη ιδεών για τη βιολογική προέλευση του λαδιού. Παραφινικοί, ναφθενικοί και αρωματικοί υδρογονάνθρακες. Πίεση κορεσμού λαδιού με αέριο. Θερμοκρασία κρυστάλλωσης, θολότητα, στερεοποίηση. Διαφορά στις ιδιότητες λαδιού μέσα σε μια δεξαμενή που φέρει λάδι.
το σεμινάριο προστέθηκε στις 02/05/2014
Η έννοια των αλκανίων (κορεσμένοι υδρογονάνθρακες, παραφίνες, αλειφατικές ενώσεις), οι συστηματικές και ορθολογική ονοματολογία... Χημικές ιδιότητες αλκανίων, ριζική υποκατάσταση και αντιδράσεις οξείδωσης. Λήψη και ανάκτηση ακόρεστων υδρογονανθράκων.
Οι οργανικές ουσίες είναι μια κατηγορία ενώσεων που περιέχουν άνθρακα (εξαιρουμένων των καρβιδίων, των ανθρακικών, των οξειδίων του άνθρακα και των κυανιδίων). Το όνομα "οργανικές ενώσεις" εμφανίστηκε σε πρώιμο στάδιο στην ανάπτυξη της χημείας και μιλάει από μόνο του για επιστήμονες ... Wikipedia
Ένας από τους πιο σημαντικούς τύπους ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ... Περιέχουν άζωτο. Περιέχουν στο μόριο έναν δεσμό υδρογόνου άνθρακα και άνθρακα αζώτου. Το έλαιο περιέχει έναν ετερόκυκλο που περιέχει άζωτο, πυριδίνη. Το άζωτο είναι μέρος πρωτεϊνών, νουκλεϊκών οξέων και ... ... Wikipedia
Organogermanium ενώσεις Οργανομεταλλικές ενώσεις που περιέχουν το δεσμό "germanium carbon". Μερικές φορές ονομάζονται οργανικές ενώσεις που περιέχουν γερμάνιο. Η πρώτη οργανογερμανική ένωση τετρααιθυλεργέρνη ήταν ... ... Wikipedia
Οι ενώσεις οργανοπυριτίου είναι ενώσεις στα μόρια των οποίων υπάρχει ένας άμεσος δεσμός πυριτίου-άνθρακα. Οι ενώσεις οργανοπυριτίου ονομάζονται μερικές φορές σιλικόνες, από τη λατινική ονομασία πυριτίου πυριτίου. Οργανικές ενώσεις πυριτίου ... ... Wikipedia
ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ, οργανική ύλη τάξη χημικές ενώσειςπου περιέχει άνθρακα (εκτός από τα καρβίδια, το ανθρακικό οξύ, τα ανθρακικά, τα οξείδια του άνθρακα και τα κυανίδια). Περιεχόμενα 1 Ιστορία 2 Classi ... Wikipedia
Οι οργανομεταλλικές ενώσεις (MOCs) είναι οργανικές ενώσεις στις οποίες υπάρχει δεσμός μεταξύ ενός ατόμου μετάλλου και ενός ατόμου άνθρακα / ατόμων. Περιεχόμενα 1 Τύποι οργανομεταλλικών ενώσεων 2 ... Wikipedia
Οι ενώσεις οργανοαλογόνου είναι οργανικές ουσίες που περιέχουν τουλάχιστον έναν δεσμό αλογόνου άνθρακα C Hal. Οι ενώσεις οργανοαλογόνου, ανάλογα με τη φύση του αλογόνου, υποδιαιρούνται σε: ενώσεις οργανοφθορίου · ... ... Wikipedia
Οι οργανομεταλλικές ενώσεις (MOC) είναι οργανικές ενώσεις στα μόρια των οποίων υπάρχει ένας δεσμός ενός ατόμου μετάλλου με ένα άτομο άνθρακα / άτομα. Περιεχόμενα 1 Τύποι οργανομεταλλικών ενώσεων 2 Μέθοδοι απόκτησης ... Wikipedia
Οργανικές ενώσεις στις οποίες υπάρχει δεσμός κασσίτερου-άνθρακα μπορούν να περιέχουν δισθενή και τετρασθενή κασσίτερο. Περιεχόμενα 1 Μέθοδοι σύνθεσης 2 Τύποι 3 ... Wikipedia
- (ετερόκυκλοι) οργανικές ενώσεις που περιέχουν δακτυλίους, οι οποίες, μαζί με τον άνθρακα, περιλαμβάνουν άτομα άλλων στοιχείων. Μπορεί να θεωρηθεί ως καρβοκυκλικές ενώσεις με ετερο-υποκαταστάτες (ετεροάτομα) στον δακτύλιο. Τα περισσότερα ... ... Wikipedia
Το άζωτο, όπως το οξυγόνο, είναι συχνά μέρος οργανικών ουσιών και οι ενώσεις του είναι απαραίτητες για τους ζωντανούς οργανισμούς.
Οι ενώσεις που περιέχουν άζωτο είναι πιο διαφορετικές από αυτές που περιέχουν οξυγόνο. Αυτό οφείλεται στο γεγονός ότι το άζωτο έχει μεγαλύτερη ισχύ και ταυτόχρονα έχει τρεις υβριδικές καταστάσεις, όπως ένα άτομο άνθρακα. Συνδέσεις με μονό επικοινωνία C-S ονομάζονται αμίνες, με διπλό δεσμό C \u003d N - ιμίνες, με τριπλό δεσμό C \u003d K - νιτρίλια.
Η ουσιαστική διαφορά μεταξύ αζώτου και οξυγόνου έγκειται στο γεγονός ότι το άζωτο μπορεί να εισέλθει σε οργανικές ενώσεις τόσο σε μειωμένες όσο και σε οξειδωμένες καταστάσεις. Η ηλεκτροαρνητικότητα του αζώτου (x \u003d 3,0) είναι υψηλότερη από εκείνη του άνθρακα (x \u003d 2,5) και χαμηλότερη από εκείνη του οξυγόνου (x \u003d 3,5). Εάν το άζωτο συνδέεται με τον άνθρακα και το υδρογόνο, τότε η κατάσταση οξείδωσης είναι -3. Σε ενώσεις που περιέχουν την νίτρο ομάδα -G) 2, το άζωτο συνδέεται με οξυγόνο και άνθρακα και βρίσκεται στην κατάσταση οξείδωσης +3. Οι οργανικές ενώσεις με οξειδωμένο άζωτο περιέχουν μια εσωτερική παροχή οξειδωτικού. Όταν υπάρχουν αρκετές νιτροομάδες στο μόριο, η ένωση γίνεται εκρηκτική. Αυτός ο τύπος ουσίας περιλαμβάνει 2,4,6-τρινιτροτολουόλιο (TNT).
Το μειωμένο άζωτο προσδίδει στις οργανικές ενώσεις τις ίδιες ιδιότητες με το οξυγόνο: πολικότητα, βασικότητα και οξύτητα, ικανότητα
σχηματίζουν δεσμούς υδρογόνου. Ωστόσο, η πολικότητα των ενώσεων που περιέχουν άζωτο είναι μικρότερη και οι δεσμοί υδρογόνου είναι ασθενέστεροι από εκείνους των ενώσεων που περιέχουν οξυγόνο. Επομένως, για μερικούς φυσικές ιδιότητες οι αμίνες βρίσκονται μεταξύ υδρογονανθράκων και αλκοολών. Ενώ όλες οι αλκοόλες είναι υγρά υπό κανονικές συνθήκες, ορισμένες αμίνες είναι αέριες:
Δυνατότητα αζώτου vr Ο 3-υβριδισμός είναι ένας καλός δότης ζευγών ηλεκτρονίων. Επομένως, όπως ήδη γνωρίζουμε, οι αμίνες εμφανίζουν μάλλον ισχυρές βασικές ιδιότητες. Σε μικρότερο βαθμό, οι ιδιότητες του δότη εκφράζονται σε άζωτο στην κατάσταση υβριδισμού $ p2. Οι όξινες ιδιότητες των οργανικών ενώσεων που περιέχουν άζωτο είναι πολύ ασθενέστερες από αυτές που περιέχουν οξυγόνο. Αλλά με τη συμμετοχή ηλεκτρονίων αζώτου σε σύζευξη με η-ηλεκτρόνια και άνθρακα, εμφανίζονται όξινες ιδιότητες.
Μία από τις κατηγορίες ουσιών που περιέχουν άζωτο - αμίνες. Αυτό είναι το όνομα οργανικών ουσιών που περιέχουν άζωτο στις οποίες ένα άτομο αζώτου συνδυάζεται με ρίζες υδρογονανθράκων και τον αντίστοιχο αριθμό ατόμων υδρογόνου. Ανάλογα με τον αριθμό των ριζών, υπάρχουν:
Σημειώστε ότι οι έννοιες των πρωτοταγών, δευτερογενών και τριτοταγών αμινών δεν συμπίπτουν με τις αντίστοιχες έννοιες για τις αλκοόλες.
Διακρίνω ομόλογη σειρά περιοριστικές, ακόρεστες και αρωματικές αμίνες. Υπάρχει επίσης μια διαφορά στην ορολογία όταν συγκρίνουμε αλκοόλες και αμίνες. Στις αρωματικές αλκοόλες, η ομάδα υδροξυλίου πρέπει να συνδέεται με ένα άτομο άνθρακα στη ρίζα και όχι στον αρωματικό δακτύλιο. Στην περίπτωση ενώσεων που περιέχουν άζωτο, μια ουσία με ομάδα ΝΗ2 συνδεδεμένη με έναν αρωματικό δακτύλιο θεωρείται επίσης αμίνη.
Οι αμίνες με χαμηλό μοριακό βάρος είναι υγρές ή αέριες ουσίες που είναι πολύ διαλυτές στο νερό. Έχουν μια δυσάρεστη οσμή που θυμίζει αμμωνία. Η συγκεκριμένη μυρωδιά των ψαριών σχετίζεται επίσης με την παρουσία αμινών. Οι υψηλότερες αμίνες έχουν τα ίδια χαρακτηριστικά που παρατηρήθηκαν στις αλκοόλες και τα οξέα - η διαλυτότητα στο νερό μειώνεται και η επιφανειακή δραστηριότητα εμφανίζεται.
Να πάρει αμίνες. Μία από τις μεθόδους παραγωγής αμινών είναι ανάλογη με την παραγωγή αλκοολών. Αυτές είναι αντιδράσεις αλογονωμένων υδρογονανθράκων με αμμωνία, προχωρώντας με τον μηχανισμό της πυρηνόφιλης υποκατάστασης:
Η αμίνη εδώ δεν μπορεί να είναι προϊόν άμεσης αντίδρασης, καθώς το προκύπτον υδροχλώριο αντιδρά μαζί του όπως με μια βάση.
δίνοντας το αλάτι αμίνης. Να τονίσω Ελεύθερος αμίνη, το προκύπτον άλας υποβάλλεται σε επεξεργασία με αλκάλια:
Ο αλογονωμένος υδρογονάνθρακας αντιδρά όχι μόνο με αμμωνία, αλλά και με πρωτοταγής αμίνη... Αυτό σχηματίζει μια δευτεροταγή αμίνη και στο επόμενο στάδιο μια τριτοταγή αμίνη:
Οι αμίνες λαμβάνονται επίσης με υδρογόνωση νιτριλίων:
Οι αρωματικές αμίνες λαμβάνονται με αναγωγή νιτρο ενώσεων. Τα μέταλλα χρησιμοποιούνται ως αναγωγικά μέσα σε όξινο περιβάλλον:
Αυτή η αρωματική αμίνη ονομάζεται ανιλίνη. Η αντίδραση αναγωγής των νιτρο ενώσεων ανακαλύφθηκε από τον NN Zinin το 1842. Στη βιομηχανία, το νιτροβενζόλιο ανάγεται με υδρογόνο σε έναν καταλύτη νικελίου στους ~ 300 ° C. Η ανιλίνη έχει γίνει ένα πολύ σημαντικό ενδιάμεσο προϊόν που χρησιμοποιείται για την παραγωγή βαφών, πολυμερών, φαρμάκων κ.λπ. Η παγκόσμια παραγωγή ανιλίνης υπερβαίνει το 1 εκατομμύριο τόνους ετησίως.
Χημικές ιδιότητες των αμινών. Οι αμίνες συγκαταλέγονται μεταξύ των ουσιών που μπορούν να καούν με το σχηματισμό C02, H2 0 και αζώτου N2.
Ως βάσεις, οι αμίνες είναι παρόμοιες με την αμμωνία, από την οποία παράγονται αντικαθιστώντας το υδρογόνο με ρίζες υδρογονανθράκων. Αυτές οι ρίζες επηρεάζουν τη δύναμη των βάσεων. Η επίδραση των επαγωγικών και μεσομερών επιδράσεων στις βασικές ιδιότητες είναι γενικά αντίθετη από την επίδρασή τους στις όξινες ιδιότητες. Περιορίστε τις αλκοόλες έως όξινες ιδιότητες ασθενέστερο από το νερό και οι περιοριστικές αμίνες σε βασικούς όρους είναι ισχυρότερες από την αμμωνία. Οι φαινόλες είναι πολύ ισχυρότερες στις όξινες ιδιότητες από τις αλκοόλες και η ανιλίνη στις βασικές ιδιότητες είναι πολύ ασθενέστερη από τις κορεσμένες αμίνες.
ΣΕ περιοριστικές αμίνες +/- η επίδραση της ρίζας αυξάνει την πυκνότητα ηλεκτρονίων στο άζωτο, επομένως την ικανότητα του αζώτου να δωρίζει ένα ζεύγος ηλεκτρονίων για να σχηματίσει δεσμός δότη-αποδέκτη... Στην ανιλίνη, το ζεύγος ηλεκτρονίων του αζώτου συμμετέχει σε σύζευξη με αρωματικά ΤΤ ηλεκτρόνια και καθίσταται λιγότερο διαθέσιμο για το σχηματισμό ενός δεσμού δότη-αποδέκτη. Επομένως, οι ουσίες είναι διατεταγμένες στην ακόλουθη σειρά ανάλογα με την αποδυνάμωση των κύριων ιδιοτήτων:
περιοριστικές αμίνες\u003e NH3\u003e αρωματικές αμίνες.
Παράδειγμα 22.15. Σε ποια κατεύθυνση μετατοπίζεται η ισορροπία της αντίδρασης μεταξύ αιθυλαμίνης και υδροχλωρικής ανιλίνης;
Απόφαση. Η αιθυλαμίνη είναι μια ισχυρότερη βάση από την ανιλίνη. Επομένως, η ισορροπία μετατοπίζεται προς το σχηματισμό ανιλίνης:
Οι αμίνες ως βάσεις αντιδρούν με μεταλλικά ιόντα σχηματίζοντας σύνθετες ενώσεις. Το μεταλλικό ιόν ενεργεί ως αποδέκτης του ζεύγους ηλεκτρονίων αζώτου, όπως στην περίπτωση αντιδράσεων με αμμωνία. Υπάρχουν πολλές σύνθετες ενώσεις μετάλλων (/ -μπλοκάρισμα με διάφορες αμίνες. Κατά την ανάμιξη διαλυμάτων θειικού χαλκού και μεθυλαμίνης, σχηματίζεται ένα έντονα χρωματισμένο διάλυμα καθαρότερης απόχρωσης από ό, τι στην περίπτωση αντίδρασης με αμμωνία (παράγραφος 210):
οι διαμίνες του τύπου rNh2CH2CH2 1H2 δίνουν πιο σταθερά σύμπλοκα από τις μονοαμίνες, αφού κάθε μόριο έχει δύο άτομα αζώτου δότη και συνδέεται με δύο δεσμούς δότες-αποδέκτες.
Πρωτογενείς αμίνες από νιτρώδες οξύ (ή νιτρώδες νάτριο σε όξινο περιβάλλον) απαμίνω μετατρέπεται σε αλκοόλες:
Στις πρωτοταγείς και δευτεροταγείς αμίνες, το υδρογόνο της αμινομάδας αντικαθίσταται από ρίζες υδρογονάνθρακα σε αντιδράσεις με παράγωγα αλογόνου (βλέπε την παρασκευή αμινών). Μια αμίνη με ένα αλογονίδιο οξέος δίνει ένα αμίδιο οξέος στο οποίο υπάρχει μια ρίζα που σχετίζεται με άζωτο:
Οι τριτοταγείς αμίνες προσθέτουν αλογονωμένους υδρογονάνθρακες για να σχηματίσουν τετρα-υποκατεστημένα (τεταρτοταγή) άλατα αμμωνίου:
Αυτές είναι κρυσταλλικές ουσίες, εύκολα διαλυτές στο νερό. Σε αντίθεση με τα συμβατικά άλατα αμμωνίου, δεν υδρολύονται ή αποσυντίθενται από αλκάλια.
Σε ανιλίνη και άλλες αρωματικές αμίνες, η ομάδα ΝΗ2 παρουσιάζει θετικό μεσομερικό αποτέλεσμα, επιταχύνοντας τις αντιδράσεις της ηλεκτροφιλικής υποκατάστασης στην αρωματική ρίζα. Η ανιλίνη αποχρωματίζει το νερό του βρωμίου, σχηματίζοντας ένα λευκό ίζημα τριβρωμανιλίνης.
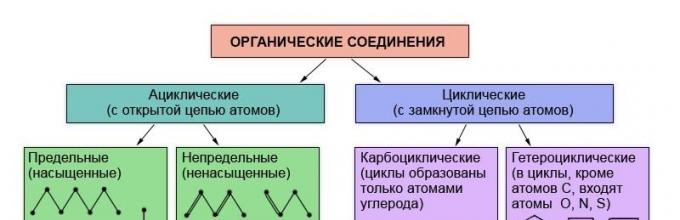
Είναι γνωστό ότι οι ιδιότητες των οργανικών ουσιών καθορίζονται από τη σύνθεσή τους και χημική δομή... Επομένως, δεν προκαλεί έκπληξη το γεγονός ότι η ταξινόμηση των οργανικών ενώσεων βασίζεται στη θεωρία της δομής - στη θεωρία του L.M. Butlerov. Οι οργανικές ουσίες ταξινομούνται σύμφωνα με την παρουσία και τη σειρά σύνδεσης των ατόμων στα μόρια τους. Το πιο ανθεκτικό και λιγότερο μεταβαλλόμενο μέρος ενός μορίου οργανικής ουσίας είναι ο σκελετός του - μια αλυσίδα ατόμων άνθρακα. Ανάλογα με τη σειρά σύνδεσης ατόμων άνθρακα σε αυτήν την αλυσίδα, οι ουσίες χωρίζονται σε κυκλικές, οι οποίες δεν περιέχουν κλειστές αλυσίδες ατόμων άνθρακα σε μόρια και καρβοκυκλικές, που περιέχουν τέτοιες τιμές (κύκλοι) σε μόρια.
Εκτός από τα άτομα άνθρακα και υδρογόνου, μόρια οργανικών ουσιών μπορούν να περιέχουν άτομα και άλλα χημικά στοιχεία... Ουσίες στα μόρια των οποίων αυτά τα λεγόμενα ετεροάτομα περιλαμβάνονται σε μια κλειστή αλυσίδα αναφέρονται ως ετεροκυκλικές ενώσεις.
Τα ετεροάτομα (οξυγόνο, άζωτο, κ.λπ.) μπορούν να αποτελούν μέρος μορίων και ακυκλικών ενώσεων, σχηματίζοντας λειτουργικές ομάδες σε αυτά, για παράδειγμα, υδροξυλ-ΟΗ, καρβονυλ, καρβοξυλ, αμινομάδα -ΝΗ2.
Λειτουργική ομάδα - μια ομάδα ατόμων που καθορίζει τις πιο χαρακτηριστικές χημικές ιδιότητες μιας ουσίας και της ανήκει σε μια συγκεκριμένη κατηγορία ενώσεων. 
Υδρογονάνθρακες- Πρόκειται για ενώσεις που αποτελούνται μόνο από άτομα υδρογόνου και άνθρακα.
Ανάλογα με τη δομή της ανθρακικής αλυσίδας, οι οργανικές ενώσεις χωρίζονται σε ενώσεις με ανοιχτή αλυσίδα - ακυκλικό (αλειφατικό) και κυκλικό - με κλειστή αλυσίδα ατόμων.
Τα κυκλικά χωρίζονται σε δύο ομάδες: καρβοκυκλικές ενώσεις(οι κύκλοι σχηματίζονται μόνο από άτομα άνθρακα) και ετεροκυκλικό (οι κύκλοι περιλαμβάνουν και άλλα άτομα, όπως οξυγόνο, άζωτο, θείο).
Οι καρβοκυκλικές ενώσεις, με τη σειρά τους, περιλαμβάνουν δύο σειρές ενώσεων: αλικυκλικός και αρωματικό.
Οι αρωματικές ενώσεις στην καρδιά της δομής των μορίων έχουν επίπεδες κύκλους που περιέχουν άνθρακα με ένα ειδικό κλειστό σύστημα ρ-ηλεκτρονίων που σχηματίζουν ένα κοινό π π σύστημα (ένα μόνο σύννεφο π-ηλεκτρονίων). Η αρωματικότητα είναι επίσης χαρακτηριστικό πολλών ετεροκυκλικών ενώσεων.
Όλες οι άλλες καρβοκυκλικές ενώσεις ανήκουν στην αλικυκλική σειρά.
Τόσο οι κυκλικοί (αλειφατικοί) όσο και οι κυκλικοί υδρογονάνθρακες μπορούν να περιέχουν πολλαπλούς (διπλούς ή τριπλούς) δεσμούς. Τέτοιοι υδρογονάνθρακες ονομάζονται ακόρεστοι (ακόρεστοι), σε αντίθεση με τον περιορισμό (κορεσμένος), που περιέχει μόνο μεμονωμένους δεσμούς.
Κορεσμένοι αλειφατικοί υδρογονάνθρακες που ονομάζεται αλκάνια, έχουν τον γενικό τύπο C n H 2 n +2, όπου n είναι ο αριθμός ατόμων άνθρακα. Το παλιό τους όνομα χρησιμοποιείται συχνά στις μέρες μας - παραφίνες.
Που περιέχει ένα διπλό δεσμό, πήρα το όνομα αλκένια... Έχουν τον γενικό τύπο C n H 2 n.
Ακόρεστοι αλειφατικοί υδρογονάνθρακεςμε δύο διπλούς δεσμούς που ονομάζεται αλκαδιένια
Ακόρεστοι αλειφατικοί υδρογονάνθρακεςμε έναν τριπλό δεσμό που ονομάζεται αλκύνια... Ο γενικός τύπος τους είναι C n H 2 n - 2.
Κορεσμένοι αλικυκλικοί υδρογονάνθρακες - κυκλοαλκάνια, ο γενικός τύπος τους είναι C n H 2 n.
Μια ειδική ομάδα υδρογονανθράκων αρωματικός, ή αρένες (με ένα κλειστό κοινό σύστημα π-ηλεκτρονίων) είναι γνωστό από το παράδειγμα των υδρογονανθράκων με τον γενικό τύπο C n H2 n -6.
Έτσι, εάν τα μόρια τους περιέχουν ένα ή περισσότερο αντικαταστήστε τα άτομα υδρογόνου με άλλα άτομα ή ομάδες ατόμων (αλογόνα, υδροξυλομάδες, αμινομάδες κ.λπ.), παράγωγα υδρογονανθράκων: παράγωγα αλογόνου, που περιέχουν οξυγόνο, που περιέχουν άζωτο και άλλες οργανικές ενώσεις.
Παράγωγα αλογόνου Οι υδρογονάνθρακες μπορούν να θεωρηθούν ως προϊόντα υποκατάστασης σε υδρογονάνθρακες ενός ή περισσοτέρων ατόμων υδρογόνου από άτομα αλογόνου. Σύμφωνα με αυτό, μπορεί να υπάρχουν περιοριστικά και ακόρεστα μονο-, δι-, τρι- (γενικά πολυ-) αλογόνα παράγωγα.
Γενικός τύπος μονοαλογονωμένων κορεσμένων υδρογονανθράκων:
και η σύνθεση εκφράζεται από τον τύπο
C n H 2 n +1 Г,
όπου το R είναι το υπόλειμμα από έναν κορεσμένο υδρογονάνθρακα (αλκάνιο), μια ρίζα υδρογονάνθρακα (αυτός ο χαρακτηρισμός χρησιμοποιείται περαιτέρω όταν εξετάζουμε άλλες κατηγορίες οργανικών ουσιών), το G είναι άτομο αλογόνου (F, Cl, Br, I).
Αλκοόλ - παράγωγα υδρογονανθράκων στα οποία ένα ή περισσότερα άτομα υδρογόνου αντικαθίστανται από υδροξυλομάδες.
Οι αλκοόλες καλούνται μονοματικός, εάν έχουν μία υδροξυλομάδα, και περιοριστική, εάν είναι παράγωγα αλκανίων.
Ο γενικός τύπος των κορεσμένων μονοϋδρικών αλκοολών:
και η σύνθεσή τους εκφράζεται από τον γενικό τύπο:
C n H 2 n +1 OH ή C n H 2 n +2 O
Παραδείγματα πολυυδρικών αλκοολών είναι γνωστά, δηλαδή, που έχουν αρκετές υδροξυλομάδες.
Φαινόλες - παράγωγα αρωματικών υδρογονανθράκων (σειρά βενζολίου), στα οποία ένα ή περισσότερα άτομα υδρογόνου στον δακτύλιο βενζολίου αντικαθίστανται από ομάδες υδροξυλίου.
Ο απλούστερος αντιπρόσωπος με τον τύπο C 6 H 5 OH ονομάζεται φαινόλη.
Αλδεϋδες και κετόνες - παράγωγα υδρογονανθράκων που περιέχουν μια ομάδα ατόμων καρβονυλίου (καρβονύλιο).
Στα μόρια των αλδεϋδών, ένας δεσμός του καρβονυλίου πηγαίνει σε ένωση με ένα άτομο υδρογόνου, ο άλλος - με μια ρίζα υδρογονάνθρακα.
Στην περίπτωση των κετονών, η καρβονυλομάδα συνδέεται με δύο (γενικά διαφορετικές) ρίζες.
Η σύνθεση κορεσμένων αλδεϋδών και κετονών εκφράζεται με τον τύπο CnH2l O.
Καρβοξυλικά οξέα - παράγωγα υδρογονανθράκων που περιέχουν καρβοξυλομάδες (-COOH).
Εάν το μόριο οξέος έχει μία καρβοξυλική ομάδα, τότε το καρβοξυλικό οξύ είναι μονοβασικό. Γενικός τύπος κορεσμένων μονοβασικών οξέων (R-COOH). Η σύνθεσή τους εκφράζεται με τον τύπο C n H 2 n O2.
Αιθέρες είναι οργανικές ουσίες που περιέχουν δύο ρίζες υδρογονάνθρακα συνδεδεμένες με ένα άτομο οξυγόνου: R-O-R ή R1-O-R 2.
Οι ρίζες μπορεί να είναι ίδιες ή διαφορετικές. Η σύνθεση των αιθέρων εκφράζεται με τον τύπο CnH2n +2O
Εστέρες - ενώσεις που σχηματίζονται αντικαθιστώντας το άτομο υδρογόνου της καρβοξυλομάδας σε καρβοξυλικά οξέα σε μια ρίζα υδρογονάνθρακα.
Νιτρο ενώσεις - παράγωγα υδρογονανθράκων στα οποία ένα ή περισσότερα άτομα υδρογόνου αντικαθίστανται από μια ομάδα νιτρο —ΝΟ2.
Γενικός τύπος περιορισμού των μονονιτρο ενώσεων:
και η σύνθεση εκφράζεται από τον γενικό τύπο
C n H 2 n +1 NO 2.
Αμίνες - Ενώσεις που θεωρούνται παράγωγα αμμωνίας (NH3), στις οποίες άτομα υδρογόνου αντικαθίστανται από ρίζες υδρογονανθράκων.
Ανάλογα με τη φύση της ρίζας, οι αμίνες μπορεί να είναι αλιφατικός και αρωματικό.
Ανάλογα με τον αριθμό των ατόμων υδρογόνου που αντικαθίστανται από ρίζες, διακρίνονται τα ακόλουθα:
Πρωτογενείς αμίνες με τον γενικό τύπο: R-NH2
Δευτερεύων - με τον γενικό τύπο: R 1 -NH-R 2
Τριτοβάθμια - με γενικό τύπο:
Σε μια συγκεκριμένη περίπτωση, οι ρίζες δευτερογενών και τριτοταγών αμινών μπορεί να είναι ίδιες.
Οι πρωτοταγείς αμίνες μπορούν επίσης να θεωρηθούν ως παράγωγα υδρογονανθράκων (αλκάνια) στα οποία ένα άτομο υδρογόνου αντικαθίσταται από μια αμινομάδα -ΝΗ2. Η σύνθεση των περιοριστικών πρωτοταγών αμινών εκφράζεται με τον τύπο CnH2n +3 N.
Αμινοξέα περιέχουν δύο λειτουργικές ομάδες συνδεδεμένες με μια ρίζα υδρογονάνθρακα: αμινομάδα -ΝΗ2 και καρβοξυλ-COOH.
Η σύνθεση των περιοριστικών αμινοξέων που περιέχουν μία αμινομάδα και ένα καρβοξύλιο εκφράζεται με τον τύπο CnH2n +1 NO2.
Είναι γνωστές άλλες σημαντικές οργανικές ενώσεις που έχουν πολλές διαφορετικές ή ίδιες λειτουργικές ομάδες, μακρές γραμμικές αλυσίδες συνδεδεμένες με δακτυλίους βενζολίου. Σε τέτοιες περιπτώσεις, είναι αδύνατος ένας αυστηρός προσδιορισμός της υπαγωγής μιας ουσίας σε οποιαδήποτε συγκεκριμένη κατηγορία. Αυτές οι ενώσεις συχνά απομονώνονται σε συγκεκριμένες ομάδες ουσιών: υδατάνθρακες, πρωτεΐνες, νουκλεϊκά οξέα, αντιβιοτικά, αλκαλοειδή κ.λπ.

Για το όνομα των οργανικών ενώσεων, χρησιμοποιούνται 2 ονοματολογίες - ορθολογικά και συστηματικά (IUPAC) και ασήμαντα ονόματα.
Σύνταξη ονοματολογίας IUPAC
1) Η βάση του ονόματος της ένωσης είναι η ρίζα της λέξης που δηλώνει έναν κορεσμένο υδρογονάνθρακα με τον ίδιο αριθμό ατόμων με την κύρια αλυσίδα.
2) Προστίθεται ένα επίθημα στη ρίζα που χαρακτηρίζει τον βαθμό κορεσμού:
Ένα (περιοριστικό, χωρίς πολλαπλές συνδέσεις).
-en (παρουσία διπλού δεσμού) ·
-in (παρουσία τριπλού δεσμού).
Εάν υπάρχουν πολλοί πολλαπλοί δεσμοί, τότε ο αριθμός τέτοιων δεσμών αναφέρεται στο επίθημα (-διένιο, -τριένιο, κ.λπ.) και μετά το επίθημα, η θέση του πολλαπλού δεσμού πρέπει να αναφέρεται σε αριθμούς, για παράδειγμα:
CH 3 –CH 2 –CH \u003d CH 2 CH 3 –CH \u003d CH - CH 3
βουτένιο-1 βουτένιο-2
CH 2 \u003d CH - CH \u003d CH 2
βουταδιένιο-1,3
Τέτοιες ομάδες όπως ρίζες νιτρο-, αλογόνων, υδρογονανθράκων που δεν περιλαμβάνονται στην κύρια αλυσίδα διεξάγονται στο πρόθεμα. Ωστόσο, παρατίθενται αλφαβητικά. Η θέση του υποκατάστατου υποδεικνύεται από έναν αριθμό μπροστά από το πρόθεμα.
Η σειρά σύνθεσης του ονόματος έχει ως εξής:
1. Βρείτε τη μεγαλύτερη αλυσίδα ατόμων C.
2. Διαδοχικά αριθμήστε τα άτομα άνθρακα της κύριας αλυσίδας, ξεκινώντας από το άκρο που βρίσκεται πλησιέστερα στον κλάδο.
3. Το όνομα του αλκανίου αποτελείται από τα ονόματα των πλευρικών ριζών που παρατίθενται με αλφαβητική σειρά, υποδεικνύοντας τη θέση στην κύρια αλυσίδα και το όνομα της κύριας αλυσίδας.
Ονοματολογία ορισμένων οργανικών ουσιών (ασήμαντες και διεθνείς)