4. Φύση και είδη χημικών δεσμών. Ομοιοπολικό δεσμό
Εφαρμογή. Χωρική δομήμόρια
Κάθε μόριο (για παράδειγμα, CO 2, H 2 O, NH 3) ή μοριακό ιόν (για παράδειγμα, CO 3 2 −, H 3 O +, NH 4 +) έχει μια ορισμένη ποιοτική και ποσοτική σύνθεση, καθώς και δομή ( γεωμετρία). Μοριακή γεωμετρίασχηματίζεται λόγω ενός σταθερού σχετική θέσηάτομα και τιμές γωνίας δεσμού.
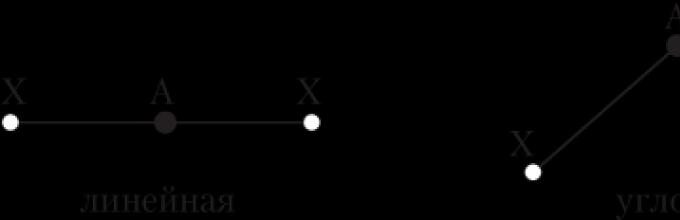
Η γωνία δεσμού είναι η γωνία μεταξύ φανταστικών ευθειών που διέρχονται από τους πυρήνες των χημικά συνδεδεμένων ατόμων. Μπορούμε επίσης να πούμε ότι είναι η γωνία μεταξύ δύο γραμμών δεσμού που έχουν ένα κοινό άτομο.
Μια γραμμή δεσμού είναι μια γραμμή που συνδέει τους πυρήνες δύο χημικά συνδεδεμένων ατόμων.
Μόνο στην περίπτωση των διατομικών μορίων (H 2, Cl 2 κ.λπ.) δεν τίθεται το ζήτημα της γεωμετρίας τους - είναι πάντα γραμμικά, δηλ. οι πυρήνες των ατόμων βρίσκονται στην ίδια ευθεία. Η δομή των πιο πολύπλοκων μορίων μπορεί να μοιάζει με διαφορετική γεωμετρικά σχήματα, Για παράδειγμα:
- τριατομικά μόρια και ιόντα τύπου AX 2 (H 2 O, CO 2, BeCl 2)

- τετραατομικά μόρια και ιόντα τύπου AX 3 (NH 3, BF 3, PCl 3, H 3 O +, SO 3) ή A 4 (P 4, As 4)

- πεντατομικά μόρια και ιόντα τύπου AX 4 (CH 4, XeF 4, GeCl 4)

Υπάρχουν σωματίδια και άλλα πολύπλοκη δομή(οκτάεδρο, τριγωνική διπυραμίδα, επίπεδο κανονικό εξάγωνο). Επιπλέον, τα μόρια και τα ιόντα μπορούν να έχουν το σχήμα ενός παραμορφωμένου τετραέδρου, ενός ακανόνιστου τριγώνου. σε μόρια γωνιακής δομής, οι τιμές του α μπορεί να είναι διαφορετικές (90°, 109°, 120°).
Η δομή των μορίων καθιερώνεται αξιόπιστα πειραματικά χρησιμοποιώντας διάφορες φυσικές μεθόδους. Για να εξηγηθούν οι λόγοι για το σχηματισμό μιας συγκεκριμένης δομής και να προβλεφθεί η γεωμετρία των μορίων, έχουν αναπτυχθεί διάφορα θεωρητικά μοντέλα. Τα πιο εύκολα κατανοητά είναι το μοντέλο απώθησης ζευγών ηλεκτρονίων σθένους (μοντέλο OVEP) και το μοντέλο υβριδισμού ατομικών τροχιακών σθένους (μοντέλο GVAO).
Η βάση όλων (συμπεριλαμβανομένων των δύο προαναφερθέντων) θεωρητικών μοντέλων που εξηγούν τη δομή των μορίων είναι η ακόλουθη πρόταση: η σταθερή κατάσταση ενός μορίου (ιόντος) αντιστοιχεί σε μια χωρική διάταξη ατομικών πυρήνων στην οποία η αμοιβαία απώθηση των ηλεκτρονίων στο σθένος το στρώμα είναι ελάχιστο.
Αυτό λαμβάνει υπόψη την απώθηση των ηλεκτρονίων που συμμετέχουν τόσο στο σχηματισμό ενός χημικού δεσμού (ηλεκτρόνια δεσμού) όσο και εκείνων που δεν συμμετέχουν (μοναχικά ζεύγη ηλεκτρονίων). Λαμβάνεται υπόψη ότι το τροχιακό ενός δεσμού ζεύγους ηλεκτρονίων συγκεντρώνεται συμπαγώς μεταξύ δύο ατόμων και επομένως καταλαμβάνει λιγότερο χώρο από το τροχιακό ενός μοναχικού ζεύγους ηλεκτρονίων. Για το λόγο αυτό, η απωστική επίδραση ενός μη δεσμευτικού (μοναχικού) ζεύγους ηλεκτρονίων και η επίδρασή του στις γωνίες των δεσμών είναι πιο έντονη από αυτή ενός δεσμού.
Μοντέλο OVEP. Αυτή η θεωρία βασίζεται στις ακόλουθες βασικές αρχές (που αναφέρονται με απλοποιημένο τρόπο):
- η γεωμετρία του μορίου καθορίζεται μόνο από σ-δεσμούς (αλλά όχι π-).
- Οι γωνίες μεταξύ των δεσμών εξαρτώνται από τον αριθμό των μεμονωμένων ζευγών ηλεκτρονίων στο κεντρικό άτομο.
Αυτές οι διατάξεις πρέπει να εξεταστούν μαζί, καθώς τόσο τα ηλεκτρόνια ενός χημικού δεσμού όσο και τα μεμονωμένα ζεύγη ηλεκτρονίων απωθούν το ένα το άλλο, γεγονός που οδηγεί τελικά στο σχηματισμό μιας μοριακής δομής στην οποία αυτή η απώθηση είναι ελάχιστη.
Ας εξετάσουμε τη γεωμετρία ορισμένων μορίων και ιόντων από τη σκοπιά της μεθόδου OVEP. Τα ηλεκτρόνια ενός δεσμού σ θα συμβολίζονται με δύο τελείες (:), μεμονωμένα ζεύγη ηλεκτρονίων με ένα συμβατικό σύμβολο ( ή ) ή μια παύλα.
Ας ξεκινήσουμε με το μόριο πέντε ατόμων του μεθανίου CH 4. Σε αυτή την περίπτωση, το κεντρικό άτομο (αυτός ο άνθρακας) έχει εξαντλήσει πλήρως τις δυνατότητές του σθένους και δεν περιέχει μεμονωμένα ζεύγη ηλεκτρονίων σθένους, δηλ. και τα τέσσερα ηλεκτρόνια σθένους σχηματίζουν τέσσερις δεσμούς σ. Πώς πρέπει να τοποθετηθούν τα ηλεκτρόνια του δεσμού σ μεταξύ τους ώστε η μεταξύ τους απώθηση να είναι ελάχιστη; Προφανώς, υπό γωνία 109°, δηλ. κατά μήκος γραμμών που κατευθύνονται στις κορυφές ενός φανταστικού τετραέδρου, στο κέντρο του οποίου βρίσκεται ένα άτομο άνθρακα. Σε αυτή την περίπτωση, τα ηλεκτρόνια που συμμετέχουν στο σχηματισμό του δεσμού είναι όσο το δυνατόν πιο μακριά μεταξύ τους (για τετράγωνη διαμόρφωση, η απόσταση μεταξύ αυτών των ηλεκτρονίων δεσμού είναι μεγαλύτερη και η απώθηση μεταξύ ηλεκτρονίων είναι μικρότερη). Για το λόγο αυτό, το μόριο μεθανίου, καθώς και τα μόρια CCl 4, CBr 4, CF 4, έχουν τη μορφή κανονικό τετράεδρο(λέγεται ότι έχει τετραεδρική δομή):

Το κατιόν αμμωνίου NH + 4 και το ανιόν BF 4 − έχουν την ίδια δομή, αφού τα άτομα αζώτου και βορίου σχηματίζουν τέσσερις δεσμούς σ το καθένα και δεν έχουν μεμονωμένα ζεύγη ηλεκτρονίων.
Ας εξετάσουμε τη δομή του μορίου τετρατομικής αμμωνίας NH 3. Το μόριο αμμωνίας έχει τρία ζεύγη ηλεκτρονίων σύνδεσης και ένα μοναχικό ζεύγος ηλεκτρονίων στο άτομο αζώτου, δηλ. επίσης τέσσερα ζεύγη ηλεκτρονίων. Ωστόσο, η γωνία σύνδεσης θα παραμείνει στις 109°; Όχι, καθώς ένα μεμονωμένο ζεύγος ηλεκτρονίων, που καταλαμβάνει μεγαλύτερο όγκο στο χώρο, έχει ισχυρή απωθητική επίδραση στα ηλεκτρόνια του δεσμού σ, γεγονός που οδηγεί σε ελαφρά μείωση της γωνίας του δεσμού, σε αυτή την περίπτωση αυτή η γωνία είναι περίπου 107°. Το μόριο αμμωνίας έχει το σχήμα μιας τριγωνικής πυραμίδας (πυραμιδική δομή):

Το τετραατομικό ιόν υδρονίου H 3 O + έχει επίσης πυραμιδική δομή: το άτομο οξυγόνου σχηματίζει τρεις δεσμούς σ και περιέχει ένα μόνο ζεύγος ηλεκτρονίων.
Στο μόριο τεσσάρων ατόμων BF 3, ο αριθμός των δεσμών σ είναι επίσης τρεις, αλλά το άτομο του βορίου δεν έχει μεμονωμένα ζεύγη ηλεκτρονίων. Προφανώς, η απώθηση μεταξύ ηλεκτρονίων θα είναι ελάχιστη εάν το μόριο BF 3 έχει το σχήμα ενός κανονικού επίπεδου τριγώνου με γωνία δεσμού 120°:

Τα μόρια BCl 3, BH 3, AlH 3, AlF 3, AlCl 3, SO 3 έχουν την ίδια δομή και για τους ίδιους λόγους.
Τι δομή θα έχει ένα μόριο νερού;
Ένα τριατομικό μόριο νερού έχει τέσσερα ζεύγη ηλεκτρονίων, αλλά μόνο δύο από αυτά είναι ηλεκτρόνια σ-δεσμού, τα υπόλοιπα δύο είναι μόνα ζεύγη ηλεκτρονίων του ατόμου οξυγόνου. Η απωστική επίδραση δύο μεμονωμένων ζευγών ηλεκτρονίων σε ένα μόριο H 2 O είναι ισχυρότερη από ό, τι σε ένα μόριο αμμωνίας με ένα μόνο ζεύγος, επομένως η γωνία δεσμού H–O–H είναι μικρότερη από τη γωνία H–N–H σε ένα μόριο αμμωνίας : σε ένα μόριο νερού η γωνία δεσμού είναι περίπου 105° :

Το μόριο CO 2 (O=C=O) έχει επίσης δύο ζεύγη ηλεκτρονίων σύνδεσης (θεωρούμε μόνο δεσμούς σ), ωστόσο, σε αντίθεση με ένα μόριο νερού, το άτομο άνθρακα δεν έχει μόνα ζεύγη ηλεκτρονίων. Προφανώς, η απώθηση μεταξύ ζευγών ηλεκτρονίων σε αυτή την περίπτωση θα είναι ελάχιστη εάν βρίσκονται σε γωνία 180°, δηλ. στο γραμμική μορφήΜόρια CO 2:
Τα μόρια BeH 2, BeF 2, BeCl 2 έχουν παρόμοια δομή και για τους ίδιους λόγους. Σε ένα τριατομικό μόριο SO 2, το κεντρικό άτομο (άτομο θείου) σχηματίζει επίσης δύο δεσμούς σ, αλλά έχει ένα μόνο ζεύγος ηλεκτρονίων, επομένως το μόριο του οξειδίου του θείου (IV) έχει γωνιακή δομή, αλλά η γωνία δεσμού σε αυτό είναι μεγαλύτερη από σε ένα μόριο νερού (το άτομο οξυγόνου δύο μόνα ζεύγη ηλεκτρονίων και το άτομο θείου έχει μόνο ένα):

Μερικά τριατομικά μόρια της σύνθεσης ABC (για παράδειγμα, H–C≡N, Br–C≡N, S=C=Te, S=C=O) έχουν επίσης γραμμική δομή, στην οποία το κεντρικό άτομο δεν έχει μόνο ζεύγη ηλεκτρονίων. Όμως το μόριο HClO έχει γωνιακή δομή (α ≈ 103°), αφού το κεντρικό άτομο, το άτομο οξυγόνου, περιέχει δύο μόνα ζεύγη ηλεκτρονίων.
Χρησιμοποιώντας το μοντέλο OVEP, μπορείτε επίσης να προβλέψετε τη δομή των μορίων οργανική ύλη. Για παράδειγμα, στο μόριο ακετυλενίου C 2 H 2, κάθε άτομο άνθρακα σχηματίζει δύο δεσμούς σ και τα άτομα άνθρακα δεν έχουν μόνα ζεύγη ηλεκτρονίων. Επομένως, το μόριο έχει γραμμική δομή H–C≡C–H.
Στο μόριο αιθενίου C 2 H 4, κάθε άτομο άνθρακα σχηματίζει τρεις δεσμούς σ, οι οποίοι, ελλείψει μεμονωμένων ζευγών ηλεκτρονίων στα άτομα άνθρακα, οδηγούν σε μια τριγωνική διάταξη ατόμων γύρω από κάθε άτομο άνθρακα:
Στον πίνακα 4.2 συνοψίζει ορισμένα δεδομένα σχετικά με τη δομή των μορίων και των ιόντων.
Πίνακας 4.2
Σχέση μεταξύ της δομής των μορίων (ιόντων) και του αριθμού σ -δεσμοί και μεμονωμένα ζεύγη ηλεκτρονίων του κεντρικού ατόμου
| Τύπος μορίου (ιόν) | Αριθμός δεσμών σ που σχηματίζονται από το κεντρικό άτομο | Αριθμός μεμονωμένων ζευγών ηλεκτρονίων | Δομή, γωνία σύνδεσης | Παραδείγματα σωματιδίων (επισημαίνεται το κεντρικό άτομο) |
|---|---|---|---|---|
| ΑΒ 2 | 2 | 0 | Γραμμική, α = 180° | CO 2 , Be H 2 , HC N , Be Cl 2 , C 2 H 2 , N 2 O , C S 2 |
| 1 | Γωνιακή, 90°< α < 120° | Sn Cl 2, S O 2, N O 2 − | ||
| 2 | Angular, α< 109° | H 2 O , O F 2 , H 2 S , H 2 Se , S F 2 , Xe O 2 , − | ||
| ΑΒ 3 | 3 | 0 | Τριγωνικό, α ≈ 120° | B F 3, B H 3, B Cl 3, Al F 3, S O 3, C O 3 2 −, N O 3 − |
| 1 | Τριγωνική πυραμίδα, α< 109° | N H 3 , H 3 O + , N F 3 , S O 3 2 − , P F 3 , P Cl 3 , As H 3 | ||
| ΑΒ 4 | 4 | 0 | Τετράεδρο, α = 109° | N H 4 + , CH 4 , Si H 4 , B F 4 , B H 4 − , S O 4 2 − , A l H 4 − |
Μοντέλο GVAO. Η κύρια θέση αυτού του μοντέλου είναι ότι ο σχηματισμός ομοιοπολικών δεσμών δεν περιλαμβάνει «καθαρά» τροχιακά σθένους s -, p - και d, αλλά τα λεγόμενα υβριδικά τροχιακά. Στη συνέχεια, εξετάζεται ο υβριδισμός που περιλαμβάνει μόνο 2p- και 2s-AOs.
Υβριδισμός είναι το φαινόμενο της ανάμειξης τροχιακών σθένους, με αποτέλεσμα να ευθυγραμμίζονται σε σχήμα και ενέργεια.
Η έννοια του υβριδισμού χρησιμοποιείται πάντα όταν ηλεκτρόνια διαφορετικών ενεργειακών υποεπιπέδων που δεν διαφέρουν πολύ σε ενέργεια συμμετέχουν στο σχηματισμό χημικών δεσμών: 2s και 2p, 4s, 4p και 3d κ.λπ.
Το υβριδικό τροχιακό δεν είναι παρόμοιο σε σχήμα με το αρχικό 2p- και 2s-AO. Έχει το σχήμα ενός ακανόνιστου τρισδιάστατου σχήματος οκτώ:
Όπως μπορούμε να δούμε, τα υβριδικά AO είναι πιο επιμήκη, επομένως μπορούν να επικαλύπτονται καλύτερα και να σχηματίζουν ισχυρότερους ομοιοπολικούς δεσμούς. Όταν τα υβριδικά τροχιακά επικαλύπτονται, σχηματίζονται μόνο σ δεσμοί. Λόγω του ειδικού σχήματός τους, τα υβριδικά AOs δεν συμμετέχουν στο σχηματισμό π-δεσμών (μόνο τα μη υβριδικά AO σχηματίζουν π-δεσμούς). Ο αριθμός των υβριδικών τροχιακών είναι πάντα ίσος με τον αριθμό των αρχικών AO που συμμετέχουν στον υβριδισμό. Τα υβριδικά τροχιακά πρέπει να είναι προσανατολισμένα στο διάστημα με τέτοιο τρόπο ώστε να εξασφαλίζεται η μέγιστη απόστασή τους μεταξύ τους. Σε αυτή την περίπτωση, η απώθηση των ηλεκτρονίων που βρίσκονται πάνω τους (δεσμευτικά και μη) θα είναι ελάχιστη. η ενέργεια ολόκληρου του μορίου θα είναι επίσης ελάχιστη.
Το μοντέλο GVAO υποθέτει ότι ο υβριδισμός περιλαμβάνει τροχιακά με παρόμοιες ενεργειακές τιμές (δηλαδή τροχιακά σθένους) και επαρκώς υψηλή πυκνότητα ηλεκτρονίων. Η πυκνότητα ηλεκτρονίων ενός τροχιακού μειώνεται καθώς αυξάνεται το μέγεθός του, επομένως ο ρόλος στον υβριδισμό είναι ιδιαίτερα σημαντικός για μόρια στοιχείων μικρών περιόδων.
Θα πρέπει να θυμόμαστε ότι το GVAO δεν είναι πραγματικό φυσικό φαινόμενο, αλλά μια βολική έννοια (μαθηματικό μοντέλο) που σας επιτρέπει να περιγράψετε τη δομή ορισμένων μορίων. Ο σχηματισμός υβριδικών AOs δεν ανιχνεύεται με καμία φυσική μέθοδο. Ωστόσο, η θεωρία του υβριδισμού έχει κάποια φυσική αιτιολόγηση.
Ας εξετάσουμε τη δομή του μορίου του μεθανίου. Είναι γνωστό ότι το μόριο CH4 έχει το σχήμα ενός κανονικού τετραέδρου με ένα άτομο άνθρακα στο κέντρο· και οι τέσσερις δεσμοί C–H σχηματίζονται από έναν μηχανισμό ανταλλαγής και έχουν την ίδια ενέργεια και μήκος, δηλ. είναι ισοδύναμα. Είναι πολύ απλό να εξηγήσουμε την παρουσία τεσσάρων μη ζευγαρωμένων ηλεκτρονίων σε ένα άτομο άνθρακα, υποθέτοντας τη μετάβασή του σε μια διεγερμένη κατάσταση:

Ωστόσο, αυτή η διαδικασία δεν εξηγεί σε καμία περίπτωση την ισοδυναμία και των τεσσάρων δεσμών C–H, αφού σύμφωνα με το παραπάνω σχήμα, τρεις από αυτούς σχηματίζονται με τη συμμετοχή του 2p-AO του ατόμου άνθρακα, ο ένας με τη συμμετοχή του το 2s-AO, και το σχήμα και η ενέργεια των 2p και 2s-AO είναι διαφορετικά.
Για να εξηγήσει αυτό και άλλα παρόμοια γεγονότα, ο L. Pauling ανέπτυξε την έννοια του GVAO. Υποτίθεται ότι η ανάμειξη των τροχιακών συμβαίνει τη στιγμή του σχηματισμού χημικών δεσμών. Αυτή η διαδικασίααπαιτεί ενεργειακή δαπάνη για τη σύζευξη ηλεκτρονίων, η οποία, ωστόσο, αντισταθμίζεται από την απελευθέρωση ενέργειας όταν τα υβριδικά AO σχηματίζουν ισχυρότερους (σε σύγκριση με τους μη υβριδικούς) δεσμούς.
Με βάση τη φύση και τον αριθμό των ΑΟ που εμπλέκονται στον υβριδισμό, διακρίνονται διάφοροι τύποι.
Στην περίπτωση του υβριδισμού sp 3, ένα s και τρία p τροχιακά αναμειγνύονται (εξ ου και το όνομα του τύπου υβριδισμού). Για ένα άτομο άνθρακα, η διαδικασία μπορεί να αναπαρασταθεί ως εξής:
1 s 2 2 s 2 2 p x 1 2 p y 1 → μετάπτωση ηλεκτρονίων 1 s 2 2 s 1 2 p x 1 2 p y 1 2 p z 1 → υβριδισμός 1 s 2 2 (s p 3) 4
ή χρησιμοποιώντας ηλεκτρονικές διαμορφώσεις:

Τέσσερα sp 3-υβριδικά AOs καταλαμβάνουν μια ενδιάμεση θέση σε ενέργεια μεταξύ 2p και 2s AOs.
Το σχήμα υβριδισμού sp 3 μπορεί να αναπαρασταθεί χρησιμοποιώντας εικόνες του σχήματος ΑΟ του ατόμου άνθρακα:

Έτσι, ως αποτέλεσμα του υβριδισμού sp 3, σχηματίζονται τέσσερα υβριδικά τροχιακά, καθένα από τα οποία περιέχει ένα ασύζευκτο ηλεκτρόνιο. Αυτά τα τροχιακά βρίσκονται σε γωνία 109°28′ στο διάστημα, γεγονός που εξασφαλίζει ελάχιστη απώθηση των ηλεκτρονίων που βρίσκονται πάνω τους. Εάν συνδέσετε τις κορυφές των υβριδικών τροχιακών, θα έχετε μια τρισδιάστατη φιγούρα - ένα τετράεδρο. Για το λόγο αυτό, μόρια της σύνθεσης AX 4 (CH 4, SiH 4, CCl 4 κ.λπ.), στα οποία πραγματοποιείται αυτός ο τύπος υβριδισμού, έχουν σχήμα τετραέδρου.
Η έννοια του υβριδισμού sp 3 του AO εξηγεί επίσης καλά τη δομή των μορίων H 2 O και NH 3. Υποτίθεται ότι 2s - και 2p -AOs ατόμων αζώτου και οξυγόνου συμμετέχουν στον υβριδισμό. Σε αυτά τα άτομα, ο αριθμός των ηλεκτρονίων σθένους (5 και 6, αντίστοιχα) υπερβαίνει τον αριθμό των sp 3 -υβριδικών AOs (4), επομένως, ορισμένα υβριδικά AO περιέχουν μη ζευγαρωμένα ηλεκτρόνια και μερικά περιέχουν μεμονωμένα ζεύγη ηλεκτρονίων:

Βλέπουμε ότι στο άτομο αζώτου το μοναχικό ζεύγος ηλεκτρονίων βρίσκεται σε ένα υβριδικό ΑΟ και στο άτομο οξυγόνου - σε δύο. Μόνο τα ΑΟ με ασύζευκτα ηλεκτρόνια συμμετέχουν στο σχηματισμό δεσμών με άτομα υδρογόνου και τα μεμονωμένα ζεύγη ηλεκτρονίων θα έχουν απωστική επίδραση (Εικ. 4.5) μεταξύ τους (στην περίπτωση του οξυγόνου) και στα ηλεκτρόνια σύνδεσης (για οξυγόνο και άζωτο ).

Ρύζι. 4.5. Σχήμα απωστικής δράσης δεσμευτικών και μη δεσμευτικών τροχιακών στο μόριο αμμωνίας (α) και νερού (β)
Η απώθηση είναι ισχυρότερη στην περίπτωση του μορίου του νερού. Δεδομένου ότι το άτομο οξυγόνου έχει δύο μόνα ζεύγη ηλεκτρονίων, η απόκλιση από την ιδανική γωνία δεσμού για αυτόν τον τύπο υβριδισμού (109°28′) σε ένα μόριο νερού είναι μεγαλύτερη από ό,τι σε ένα μόριο αμμωνίας (στα μόρια H2O και NH3 η γωνία δεσμού είναι 104, αντίστοιχα, 5° και 107°).
Το μοντέλο υβριδισμού sp 3 χρησιμοποιείται για να εξηγήσει τη δομή του διαμαντιού, του πυριτίου, των ιόντων NH 4 + και H 3 O +, των αλκανίων, των κυκλοαλκανίων κ.λπ. Στην περίπτωση του άνθρακα, αυτός ο τύπος υβριδισμού χρησιμοποιείται πάντα όταν ένα άτομο αυτού στοιχείο σχηματίζει μόνο σ δεσμούς.
Στην περίπτωση του υβριδισμού sp 2, ένα s και δύο p τροχιακά αναμειγνύονται. Ας εξετάσουμε αυτόν τον τύπο υβριδισμού χρησιμοποιώντας το παράδειγμα ενός ατόμου βορίου. Η διαδικασία αναπαρίσταται χρησιμοποιώντας ενεργειακά διαγράμματα


Έτσι, ως αποτέλεσμα του υβριδισμού sp 2 των τροχιακών σθένους του ατόμου του βορίου, σχηματίζονται τρία υβριδικά AOs, κατευθυνόμενα σε γωνία 120°, και ένα από τα τροχιακά 2p δεν συμμετέχει στον υβριδισμό. Τα υβριδικά τροχιακά περιέχουν ένα μη ζευγαρωμένο ηλεκτρόνιο, βρίσκονται στο ίδιο επίπεδο και αν συνδέσετε τις κορυφές τους, θα έχετε κανονικό τρίγωνο. Για το λόγο αυτό, τα μόρια της σύνθεσης AX 3 με υβριδισμό sp 2 των τροχιακών του ατόμου Α έχουν τριγωνική δομή, όπως φαίνεται για το μόριο BF 3:

Το μη υβριδικό 2p-AO του ατόμου του βορίου είναι ελεύθερο (χωρίς κατειλημμένο) και προσανατολισμένο κάθετα στο επίπεδο των δεσμών B–F, επομένως το μόριο BF 3 είναι δέκτης ηλεκτρονίων όταν σχηματίζει έναν ομοιοπολικό δεσμό σύμφωνα με τον μηχανισμό δότη-δέκτη όταν αλληλεπιδρώντας με ένα μόριο αμμωνίας.
Η έννοια του υβριδισμού sp 2 χρησιμοποιείται για να εξηγήσει τη φύση του διπλού δεσμού άνθρακα-άνθρακα στα αλκένια, τη δομή του βενζολίου και του γραφίτη, δηλ. σε περιπτώσεις που το άτομο άνθρακα σχηματίζει τρεις δεσμούς σ και έναν π.
Η χωρική διάταξη των τροχιακών του ατόμου άνθρακα για τον υβριδισμό sp 2 μοιάζει με αυτό: το μη υβριδικό 2p AO είναι προσανατολισμένο κάθετα στο επίπεδο στο οποίο βρίσκονται τα υβριδικά τροχιακά (τόσο το υβριδικό όσο και το μη υβριδικό ΑΟ περιέχουν ένα μη ζευγαρωμένο ηλεκτρόνιο) .

Ας εξετάσουμε το σχηματισμό χημικών δεσμών στο μόριο αιθυλενίου H 2 C=CH 2. Σε αυτό, τα υβριδικά AOs αλληλοεπικαλύπτονται μεταξύ τους και με τα 1s-AOs του ατόμου του υδρογόνου, σχηματίζοντας πέντε σ δεσμούς: έναν C–C και τέσσερις C–H. Τα μη υβριδικά 2p-AO επικαλύπτονται πλευρικά και σχηματίζουν έναν π δεσμό μεταξύ των ατόμων άνθρακα (Εικ. 4.6).

Ρύζι. 4.6. Σχήμα σχηματισμού δεσμών σ (α) και π-δεσμού (β) σε μόριο αιθυλενίου
Στην περίπτωση του υβριδισμού sp, ένα s και ένα p τροχιακό αναμειγνύονται. Ας εξετάσουμε αυτόν τον τύπο υβριδισμού χρησιμοποιώντας το παράδειγμα του ατόμου του βηρυλλίου. Ας φανταστούμε τη διαδικασία υβριδισμού χρησιμοποιώντας ένα ενεργειακό διάγραμμα:

και με εικόνα του σχήματος των τροχιακών
Έτσι, ως αποτέλεσμα του sp-υβριδισμού, σχηματίζονται δύο υβριδικά AOs, το καθένα από τα οποία περιέχει ένα ασύζευκτο ηλεκτρόνιο. Δύο 2p-AO δεν συμμετέχουν στον υβριδισμό και, στην περίπτωση του βηρυλλίου, παραμένουν κενές. Τα υβριδικά τροχιακά είναι προσανατολισμένα σε γωνία 180°, επομένως τα μόρια του τύπου AX 2 με sp-υβριδισμό των τροχιακών του ατόμου Α έχουν γραμμική δομή (Εικ. 4.7).

Ρύζι. 4.7. Χωρική δομή του μορίου BeCl 2
Χρησιμοποιώντας το μοντέλο sp-υβριδισμού των τροχιακών του ατόμου άνθρακα, εξηγείται η φύση του τριπλού δεσμού σε μόρια αλκυνίου. Σε αυτήν την περίπτωση, δύο υβριδικά και δύο μη υβριδικά 2p-AO (που παρουσιάζονται με οριζόντια βέλη →, ←) περιέχουν το καθένα ένα μη ζευγαρωμένο ηλεκτρόνιο:

Στο μόριο ακετυλενίου HC≡CH, λόγω των υβριδικών AOs, σχηματίζονται σ-δεσμοί C–H και C–C:

Τα υβριδικά 2p-AO επικαλύπτονται σε δύο κάθετα επίπεδα και σχηματίζουν δύο π δεσμούς μεταξύ των ατόμων άνθρακα (Εικ. 4.8).

Ρύζι. 4.8. Σχηματική αναπαράσταση των π-δεσμών (a) και των επιπέδων των π-δεσμών (b) στο μόριο ακετυλενίου (η κυματιστή γραμμή δείχνει την πλευρική επικάλυψη του 2p-AO του ατόμου άνθρακα)
Η έννοια του sp-υβριδισμού των τροχιακών του ατόμου άνθρακα καθιστά δυνατή την εξήγηση του σχηματισμού χημικών δεσμών σε μόρια καρβίνης, CO και CO 2, προπαδιένιο (CH 2 =C=CH 2), δηλ. σε όλες τις περιπτώσεις που ένα άτομο άνθρακα σχηματίζει δύο δεσμούς σ και δύο π.
Τα κύρια χαρακτηριστικά των εξεταζόμενων τύπων υβριδισμού και οι γεωμετρικές διαμορφώσεις των μορίων που αντιστοιχούν σε ορισμένους τύπους υβριδισμού των τροχιακών του κεντρικού ατόμου Α (λαμβάνοντας υπόψη την επίδραση των μη δεσμευτικών ζευγών ηλεκτρονίων) παρουσιάζονται στον Πίνακα. 4.3 και 4.4.
Πίνακας 4.3
Τα κύρια χαρακτηριστικά ΔΙΑΦΟΡΕΤΙΚΟΙ ΤΥΠΟΙπαραγωγή μικτών γενών
Συγκρίνοντας τα δεδομένα στον Πίνακα. 4.2 και 4.4, μπορούμε να συμπεράνουμε ότι και τα δύο μοντέλα - OVEP και GVAO - οδηγούν στα ίδια αποτελέσματα όσον αφορά τη δομή των μορίων.
Πίνακας 4.4
Τύποι χωρικής διαμόρφωσης μορίων που αντιστοιχούν σε ορισμένους τύπους υβριδισμού
Χημικός δεσμός
Όλες οι αλληλεπιδράσεις που οδηγούν στο συνδυασμό χημικών σωματιδίων (άτομα, μόρια, ιόντα κ.λπ.) σε ουσίες χωρίζονται σε χημικούς δεσμούς και σε διαμοριακούς δεσμούς (διαμοριακές αλληλεπιδράσεις).
Χημικοί δεσμοί- δεσμούς απευθείας μεταξύ ατόμων. Υπάρχουν ιοντικοί, ομοιοπολικοί και μεταλλικοί δεσμοί.
Διαμοριακούς δεσμούς- συνδέσεις μεταξύ μορίων. Αυτοί είναι δεσμοί υδρογόνου, δεσμοί ιόντος-διπόλου (λόγω του σχηματισμού αυτού του δεσμού, για παράδειγμα, συμβαίνει ο σχηματισμός ενός κελύφους ενυδάτωσης ιόντων), δίπολο-δίπολο (λόγω του σχηματισμού αυτού του δεσμού, συνδυάζονται μόρια πολικών ουσιών , για παράδειγμα, σε υγρή ακετόνη) κ.λπ.
Ιοντικός δεσμός- ένας χημικός δεσμός που σχηματίζεται λόγω της ηλεκτροστατικής έλξης αντίθετα φορτισμένων ιόντων. Σε δυαδικές ενώσεις (ενώσεις δύο στοιχείων), σχηματίζεται όταν τα μεγέθη των συνδεδεμένων ατόμων είναι πολύ διαφορετικά μεταξύ τους: ορισμένα άτομα είναι μεγάλα, άλλα είναι μικρά - δηλαδή, ορισμένα άτομα εγκαταλείπουν εύκολα ηλεκτρόνια, ενώ άλλα τείνουν να αποδεχτείτε τα (συνήθως αυτά είναι άτομα των στοιχείων που σχηματίζουν τυπικά μέταλλα και άτομα στοιχείων που σχηματίζουν τυπικά αμέταλλα). η ηλεκτραρνητικότητα τέτοιων ατόμων είναι επίσης πολύ διαφορετική.
Ο ιοντικός δεσμός είναι μη κατευθυντικός και μη κορεσμένος.
Ομοιοπολικό δεσμό- ένας χημικός δεσμός που προκύπτει λόγω του σχηματισμού ενός κοινού ζεύγους ηλεκτρονίων. Ένας ομοιοπολικός δεσμός σχηματίζεται μεταξύ μικρών ατόμων με την ίδια ή παρόμοια ακτίνα. Απαραίτητη προϋπόθεση είναι η παρουσία μη ζευγαρωμένων ηλεκτρονίων και στα δύο συνδεδεμένα άτομα ( μηχανισμός ανταλλαγής) ή ένα μοναχικό ζεύγος στο ένα άτομο και ένα ελεύθερο τροχιακό στο άλλο (μηχανισμός δότη-δέκτη):
| ΕΝΑ) | H· + ·H H:H | H-H | H 2 | (ένα κοινό ζεύγος ηλεκτρονίων, το Η είναι μονοσθενές). |
| σι) | NN | Ν 2 | (τρία κοινά ζεύγη ηλεκτρονίων, το Ν είναι τρισθενές). | |
| V) | H-F | HF | (ένα κοινό ζεύγος ηλεκτρονίων, τα H και F είναι μονοσθενή). | |
| ΣΟΛ) | NH4+ | (τέσσερα κοινά ζεύγη ηλεκτρονίων, το N είναι τετρασθενές) |
- Με βάση τον αριθμό των κοινών ζευγών ηλεκτρονίων, οι ομοιοπολικοί δεσμοί χωρίζονται σε
- απλό (μονό)- ένα ζεύγος ηλεκτρονίων,
- διπλό- δύο ζεύγη ηλεκτρονίων,
- τριπλάσια- τρία ζεύγη ηλεκτρονίων.
Οι διπλοί και τριπλοί δεσμοί ονομάζονται πολλαπλοί δεσμοί.
Σύμφωνα με την κατανομή της πυκνότητας ηλεκτρονίων μεταξύ συνδεδεμένων ατόμων ομοιοπολικό δεσμόδιαιρείται με μη πολικόΚαι πολικός. Ένας μη πολικός δεσμός σχηματίζεται μεταξύ πανομοιότυπων ατόμων, ένας πολικός - μεταξύ διαφορετικών.
Ηλεκτραρνητικότητα- ένα μέτρο της ικανότητας ενός ατόμου σε μια ουσία να έλκει κοινά ζεύγη ηλεκτρονίων.
Τα ζεύγη ηλεκτρονίων των πολικών δεσμών μετατοπίζονται προς πιο ηλεκτραρνητικά στοιχεία. Η ίδια η μετατόπιση των ζευγών ηλεκτρονίων ονομάζεται πόλωση δεσμού. Τα μερικά (υπερβάλλοντα) φορτία που σχηματίζονται κατά την πόλωση χαρακτηρίζονται + και -, για παράδειγμα: .
Με βάση τη φύση της επικάλυψης των νεφών ηλεκτρονίων ("τροχιακά"), ένας ομοιοπολικός δεσμός χωρίζεται σε -δεσμός και -δεσμός.
-Σχηματίζεται δεσμός λόγω της άμεσης επικάλυψης νεφών ηλεκτρονίων (κατά μήκος της ευθείας γραμμής που συνδέει τους ατομικούς πυρήνες), -Σχηματίζεται δεσμός λόγω πλευρικής επικάλυψης (και στις δύο πλευρές του επιπέδου στο οποίο βρίσκονται οι ατομικοί πυρήνες).
Ένας ομοιοπολικός δεσμός είναι κατευθυντικός και κορεσμένος, καθώς και πολικός.
Το μοντέλο υβριδοποίησης χρησιμοποιείται για να εξηγήσει και να προβλέψει την αμοιβαία κατεύθυνση των ομοιοπολικών δεσμών.
Υβριδισμός ατομικών τροχιακών και νεφών ηλεκτρονίων- την υποτιθέμενη ευθυγράμμιση των ατομικών τροχιακών σε ενέργεια και των νεφών ηλεκτρονίων σε σχήμα όταν ένα άτομο σχηματίζει ομοιοπολικούς δεσμούς.
Οι τρεις πιο συνηθισμένοι τύποι υβριδισμού είναι: sp-, sp 2 και sp 3 -υβριδισμός. Για παράδειγμα:
sp-υβριδισμός - σε μόρια C 2 H 2, BeH 2, CO 2 (γραμμική δομή).
sp 2-υβριδισμός - σε μόρια C 2 H 4, C 6 H 6, BF 3 (επίπεδο τριγωνικό σχήμα).
sp 3-υβριδισμός - σε μόρια CCl 4, SiH 4, CH 4 (τετραεδρική μορφή). NH 3 (πυραμιδικό σχήμα); H 2 O (γωνιακό σχήμα).
Μεταλλική σύνδεση- ένας χημικός δεσμός που σχηματίζεται με την κοινή χρήση των ηλεκτρονίων σθένους όλων των συνδεδεμένων ατόμων ενός μεταλλικού κρυστάλλου. Ως αποτέλεσμα, σχηματίζεται ένα μόνο ηλεκτρονιακό νέφος του κρυστάλλου, το οποίο κινείται εύκολα υπό την επίδραση της ηλεκτρικής τάσης - εξ ου και η υψηλή ηλεκτρική αγωγιμότητα των μετάλλων.
Ένας μεταλλικός δεσμός σχηματίζεται όταν τα άτομα που συνδέονται είναι μεγάλα και επομένως τείνουν να εγκαταλείψουν ηλεκτρόνια. Απλές ουσίες με μεταλλικό δεσμό είναι τα μέταλλα (Na, Ba, Al, Cu, Au κ.λπ.), πολύπλοκες ουσίες είναι διαμεταλλικές ενώσεις (AlCr 2, Ca 2 Cu, Cu 5 Zn 8 κ.λπ.).
Ο μεταλλικός δεσμός δεν έχει κατευθυντικότητα ή κορεσμό. Διατηρείται και σε τήγματα μετάλλων.
Δεσμός υδρογόνου- ένας διαμοριακός δεσμός που σχηματίζεται λόγω της μερικής αποδοχής ενός ζεύγους ηλεκτρονίων από ένα εξαιρετικά ηλεκτραρνητικό άτομο από ένα άτομο υδρογόνου με μεγάλο θετικό μερικό φορτίο. Σχηματίζεται σε περιπτώσεις όπου το ένα μόριο περιέχει ένα άτομο με ένα μόνο ζεύγος ηλεκτρονίων και υψηλή ηλεκτραρνητικότητα (F, O, N) και το άλλο περιέχει ένα άτομο υδρογόνου συνδεδεμένο με έναν εξαιρετικά πολικό δεσμό σε ένα από αυτά τα άτομα. Παραδείγματα διαμοριακών δεσμών υδρογόνου:
H—O—H OH 2, H—O—H NH 3, H—O—H F—H, H—F H—F.
Ενδομοριακοί δεσμοί υδρογόνου υπάρχουν στα πολυπεπτιδικά μόρια, νουκλεϊκά οξέα, πρωτεΐνες κ.λπ.
Ένα μέτρο της ισχύος οποιουδήποτε δεσμού είναι η ενέργεια του δεσμού.
Ενέργεια επικοινωνίας- την ενέργεια που απαιτείται για τη διάσπαση ενός δεδομένου χημικού δεσμού σε 1 mole μιας ουσίας. Η μονάδα μέτρησης είναι 1 kJ/mol.
Οι ενέργειες των ιοντικών και των ομοιοπολικών δεσμών είναι της ίδιας τάξης, η ενέργεια των δεσμών υδρογόνου είναι μια τάξη μεγέθους χαμηλότερη.
Η ενέργεια ενός ομοιοπολικού δεσμού εξαρτάται από το μέγεθος των δεσμευμένων ατόμων (μήκος δεσμού) και από την πολλαπλότητα του δεσμού. Όσο μικρότερα είναι τα άτομα και όσο μεγαλύτερη είναι η πολλαπλότητα του δεσμού, τόσο μεγαλύτερη είναι η ενέργειά του.
Η ενέργεια των ιοντικών δεσμών εξαρτάται από το μέγεθος των ιόντων και τα φορτία τους. Όσο μικρότερα είναι τα ιόντα και όσο μεγαλύτερο είναι το φορτίο τους, τόσο μεγαλύτερη είναι η ενέργεια δέσμευσης.
Δομή της ύλης
Ανάλογα με τον τύπο της δομής, όλες οι ουσίες χωρίζονται σε μοριακόςΚαι μη μοριακό. Μεταξύ των οργανικών ουσιών κυριαρχούν οι μοριακές ουσίες, μεταξύ των ανόργανων ουσιών κυριαρχούν οι μη μοριακές ουσίες.
Με βάση τον τύπο του χημικού δεσμού, οι ουσίες χωρίζονται σε ουσίες με ομοιοπολικούς δεσμούς, σε ουσίες με ιοντικούς δεσμούς (ιονικές ουσίες) και σε ουσίες με μεταλλικούς δεσμούς (μέταλλα).
Οι ουσίες με ομοιοπολικούς δεσμούς μπορεί να είναι μοριακές ή μη μοριακές. Αυτό επηρεάζει σημαντικά τις φυσικές τους ιδιότητες.
Οι μοριακές ουσίες αποτελούνται από μόρια που συνδέονται μεταξύ τους με ασθενείς διαμοριακούς δεσμούς, μεταξύ των οποίων περιλαμβάνονται: H 2, O 2, N 2, Cl 2, Br 2, S 8, P 4 και άλλοι απλές ουσίες; CO 2, SO 2, N 2 O 5, H 2 O, HCl, HF, NH 3, CH 4, C 2 H 5 OH, οργανικά πολυμερή και πολλές άλλες ουσίες. Αυτές οι ουσίες δεν έχουν υψηλή αντοχή, έχουν χαμηλές θερμοκρασίεςτήξη και βρασμό, μην πραγματοποιείτε ηλεκτρική ενέργεια, μερικά από αυτά είναι διαλυτά στο νερό ή σε άλλους διαλύτες.
Μη μοριακές ουσίες με ομοιοπολικούς δεσμούς ή ατομικές ουσίες (διαμάντι, γραφίτης, Si, SiO 2, SiC και άλλα) σχηματίζουν πολύ ισχυρούς κρυστάλλους (με εξαίρεση τον στρωματοποιημένο γραφίτη), είναι αδιάλυτες στο νερό και σε άλλους διαλύτες, έχουν υψηλή τήξη και σημεία βρασμού, τα περισσότερα από αυτά δεν άγουν ηλεκτρικό ρεύμα (εκτός από τον γραφίτη, που είναι ηλεκτρικά αγώγιμο, και τους ημιαγωγούς - πυρίτιο, γερμάνιο κ.λπ.)
Όλες οι ιοντικές ουσίες είναι εκ φύσεως μη μοριακές. Πρόκειται για στερεές, πυρίμαχες ουσίες, διαλύματα και τήγματα των οποίων μεταφέρουν ηλεκτρικό ρεύμα. Πολλά από αυτά είναι διαλυτά στο νερό. Πρέπει να σημειωθεί ότι σε ιοντικές ουσίεςαχ, οι κρύσταλλοι των οποίων αποτελούνται από σύνθετα ιόντα, υπάρχουν και ομοιοπολικοί δεσμοί, για παράδειγμα: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)( ΟΧΙ 3-) κ.λπ. Τα άτομα που απαρτίζουν σύνθετα ιόντα συνδέονται με ομοιοπολικούς δεσμούς.
Μέταλλα (ουσίες με μεταλλικούς δεσμούς)πολύ διαφορετικές ως προς τις φυσικές τους ιδιότητες. Ανάμεσά τους υπάρχουν υγρά (Hg), πολύ μαλακά (Na, K) και πολύ σκληρά μέταλλα (W, Nb).
Χαρακτηριστικό γνώρισμα φυσικές ιδιότητεςμέταλλα είναι η υψηλή ηλεκτρική αγωγιμότητά τους (σε αντίθεση με τους ημιαγωγούς, μειώνεται με την αύξηση της θερμοκρασίας), η υψηλή θερμοχωρητικότητα και η ολκιμότητα (για τα καθαρά μέταλλα).
Στη στερεά κατάσταση, σχεδόν όλες οι ουσίες αποτελούνται από κρυστάλλους. Με βάση τον τύπο της δομής και τον τύπο του χημικού δεσμού, οι κρύσταλλοι ("κρυσταλλικά πλέγματα") χωρίζονται σε ατομικός(κρύσταλλοι μη μοριακών ουσιών με ομοιοπολικούς δεσμούς), ιωνικός(κρύσταλλοι ιοντικών ουσιών), μοριακός(κρύσταλλοι μοριακών ουσιών με ομοιοπολικούς δεσμούς) και μέταλλο(κρύσταλλοι ουσιών με μεταλλικό δεσμό).
Εργασίες και δοκιμές με θέμα «Θέμα 10. «Χημικός δεσμός. Δομή της ύλης».
- Τύποι χημικών δεσμών - Δομή ύλης βαθμού 8–9
Μαθήματα: 2 Εργασίες: 9 Τεστ: 1
- Εργασίες: 9 Τεστ: 1
Αφού εργαστείτε σε αυτό το θέμα, θα πρέπει να κατανοήσετε τις ακόλουθες έννοιες: χημικός δεσμός, διαμοριακός δεσμός, ιοντικός δεσμός, ομοιοπολικό δεσμό, μεταλλική σύνδεση, δεσμός υδρογόνου, απλός δεσμός, διπλός δεσμός, τριπλός δεσμός, πολλαπλοί δεσμοί, μη πολικός δεσμός, πολικός δεσμός, ηλεκτραρνητικότητα, πόλωση δεσμού, - και - δεσμός, υβριδισμός ατομικών τροχιακών, ενέργεια δεσμού.
Πρέπει να γνωρίζετε την ταξινόμηση των ουσιών ανά τύπο δομής, ανά τύπο χημικού δεσμού, την εξάρτηση των ιδιοτήτων των απλών και σύνθετες ουσίεςσχετικά με τον τύπο του χημικού δεσμού και τον τύπο του «κρυσταλλικού πλέγματος».
Πρέπει να είστε σε θέση: να προσδιορίσετε τον τύπο του χημικού δεσμού σε μια ουσία, τον τύπο του υβριδισμού, να συντάξετε διαγράμματα σχηματισμού δεσμών, να χρησιμοποιήσετε την έννοια της ηλεκτραρνητικότητας, έναν αριθμό ηλεκτραρνητικότητας. γνωρίζουν πώς αλλάζει η ηλεκτραρνητικότητα χημικά στοιχείαμια περίοδο και μια ομάδα για τον προσδιορισμό της πολικότητας ενός ομοιοπολικού δεσμού.
Αφού βεβαιωθείτε ότι όλα όσα χρειάζεστε έχουν μάθει, προχωρήστε στην ολοκλήρωση των εργασιών. Σας ευχόμαστε επιτυχία.
Προτεινόμενη ανάγνωση:
- O. S. Gabrielyan, G. G. Lysova. Χημεία 11η τάξη. M., Bustard, 2002.
- Γ. Ε. Ρουτζίτης, Φ. Γ. Φέλντμαν. Χημεία 11η τάξη. Μ., Εκπαίδευση, 2001.
Επιλογή 2
Μέρος Α:
Α'1. Ζεύγος στοιχείων μεταξύ των οποίων σχηματίζεται ιονικός χημικός δεσμός:
α) άνθρακας και θείο, β) υδρογόνο και άζωτο, γ) κάλιο και οξυγόνο, δ) πυρίτιο και υδρογόνο.
Α2.Τύπος ουσίας με ομοιοπολικό δεσμό:
α) NaCl, β) HCl, γ) BaO, δ) Ca 3 N 2.
Α 3.Ο λιγότερο πολικός δεσμός είναι:
α) C – H, β) C – Cl, γ) C – F, δ) C – Br.
Α 4. Η δήλωση ότι το δ είναι δεσμός, σε αντίθεση με το π, είναι αληθής:
α) λιγότερο ισχυρό, β) σχηματίζεται όταν τα ατομικά τροχιακά επικαλύπτονται πλευρικά,
γ) δεν είναι ομοιοπολικό, δ) σχηματίζεται από την αξονική επικάλυψη ατομικών τροχιακών.
Α 5.Μια ουσία στο μόριο της οποίας δεν υπάρχει δεσμός π:
α) αιθυλένιο, β) βενζόλιο, γ) αμμωνία, δ) άζωτο.
Α 6. Το ισχυρότερο μόριο είναι:
α) H 2, β) N 2, γ) F 2, δ) O 2.
Α 7. Στο ιόν CO 3 2-, το άτομο άνθρακα βρίσκεται στην υβριδική κατάσταση sp 2, επομένως το ιόν έχει τη μορφή:
α) γραμμικό, β) τετράεδρο, γ) τρίγωνο, δ) οκτάεδρο.
Α 8. Ένα άτομο άνθρακα έχει αριθμό οξείδωσης -3 και σθένος 4 όταν συνδυάζεται με τον τύπο:
α) CO 2, β) C 2 H 6, γ) CH 3 Cl, δ) CaC 2.
Α 9. Το ατομικό κρυσταλλικό πλέγμα έχει:
α) σόδα, β) νερό, γ) διαμάντι, δ) παραφίνη.
Α 10. Μια ουσία μεταξύ των μορίων της οποίας υπάρχει δεσμός υδρογόνου:
α) αιθάνιο, β) φθοριούχο νάτριο, γ) μονοξείδιο του άνθρακα (4), δ) αιθανόλη.
Α 11. Επιλέξτε μια ομάδα στοιχείων διατεταγμένα κατά σειρά αυξανόμενης ηλεκτραρνητικότητας:
α) Cl, Si, N, O, β) Si, P, N, F, γ) F, Cl, O, Si, δ) O, N, F, Cl.
Α 12. Υπάρχει ένας ομοιοπολικός δεσμός μεταξύ των ατόμων, που σχηματίζεται από έναν μηχανισμό δότη-δέκτη σε μια ουσία, ο τύπος του οποίου είναι:
13.
Α 14.Ο σχηματισμός δεσμών υδρογόνου μπορεί να εξηγηθεί ως εξής:
α) διαλυτότητα οξικό οξύστο νερό, β) όξινες ιδιότητεςαιθανόλη,
γ) υψηλό σημείο τήξης πολλών μετάλλων, δ) αδιαλυτότητα του μεθανίου στο νερό.
Α 15.Τύπος ουσίας με πολικό ομοιοπολικό δεσμό:
α) Cl 2, β) KCl, γ) NH 3, δ) O 2.
Μέρος Β:
Β 1. Από αυτά που προτείνονται, επιλέξτε μια ουσία της οποίας το μόριο περιέχει π δεσμούς: H 2, CH 4, Br 2, N 2, H 2 S, CH 3 OH, NH 3. Γράψτε το όνομα αυτής της ουσίας.
Β 2.Η διαδικασία αλληλεπίδρασης των τροχιακών ηλεκτρονίων, που οδηγεί στην ευθυγράμμισή τους σε σχήμα και ενέργεια, ονομάζεται......
Β 3. Πώς ονομάζεται το φαινόμενο της μεγέθυνσης των κολλοειδών σωματιδίων και της καθίζησης τους από ένα κολλοειδές διάλυμα;
Β 4.Δώστε ένα παράδειγμα ουσίας της οποίας το μόριο περιέχει τρεις δεσμούς δ – και έναν π –. Ονομάστε την ουσία στην ονομαστική περίπτωση.
Β 5.Σε ποια από τις παρακάτω ουσίες είναι οι πιο πολικοί δεσμοί: υδροχλώριο, φθόριο, νερό, αμμωνία, υδρόθειο. Καταγράψτε την επιλεγμένη ουσία με έναν τύπο.
Μέρος Γ:
Από 1.Γράφω δομικούς τύπουςόλες οι ισομερείς ουσίες της σύνθεσης C 4 H 8. Ονομάστε κάθε ουσία.
Γ 2.Να σχηματίσετε τους συντακτικούς τύπους των ουσιών: CHF 3, C 2 H 2 Br 2, O 2.
Συνθέτω γραφικούς τύπους: Mg 3 N 2, Na 2 SO 4, KHCO 3.
Γ 3.
Mg 3 N 2, Cl 2, ZnSO 4, KHS, CH 3 Cl, FeOHCl 2, BrO 2, AsO 4 3-, NH 4 +
ΔοκιμήΝο. 2 «ΔΟΜΗ ΤΗΣ ΥΛΗΣ».
Επιλογή 3
Μέρος Α:
Α'1. Χημικοί δεσμοί σε ουσίες των οποίων οι τύποι είναι CH 4 και CaCl 2, αντίστοιχα:
α) ιοντικά και ομοιοπολικά πολικά, β) ομοιοπολικά πολικά και ιοντικά,
γ) ομοιοπολικά μη πολικά και ιοντικά, δ) ομοιοπολικά πολικά και μεταλλικά.
Α2.Η πολικότητα του δεσμού είναι μεγαλύτερη στην ουσία με τον τύπο:
α) Br 2, β) LiBr, γ) HBr, δ) KBr
Α 3.Η ιοντική φύση του δεσμού στη σειρά των ενώσεων Li 2 O - Na 2 O - K 2 O - Rb 2 O:
α) αυξάνεται, β) μειώνεται, γ) δεν αλλάζει, δ) πρώτα μειώνεται, μετά αυξάνεται.
Α 4. Υπάρχει ένας ομοιοπολικός δεσμός μεταξύ των ατόμων, που σχηματίζεται από έναν μηχανισμό δότη-δέκτη σε μια ουσία, ο τύπος του οποίου είναι:
α) Al(OH) 3, β) [CH 3 NH 3 ]Cl, γ) C 2 H 5 OH, δ) C 6 H 12 O 6.
Α 5.Μερικοί τύποι για ουσίες των οποίων τα μόρια περιέχουν μόνο δεσμούς δ:
α) CH 4 και O 2, β) C 2 H 5 OH και H 2 O, γ) N 2 και CO 2, δ) HBr και C 2 H 4.
Α 6. Η ισχυρότερη σύνδεση αυτών:
α) C - Cl, β) C - F, γ) C - Br, δ) C - I.
Α 7. Μια ομάδα τύπων ενώσεων στις οποίες υπάρχει παρόμοια κατεύθυνση δεσμών, λόγω sp 3 - υβριδισμού ηλεκτρονικών τροχιακών:
α) CH 4, C 2 H 4, C 2 H 2, β) NH 3, CH 4, H 2 O, γ) H 2 O, C 2 H 6, C 6 H 6, δ) C 3 H 8, BCl 3, BeCl 2.
Α 8. Το σθένος και η κατάσταση οξείδωσης του ατόμου άνθρακα στο μόριο της μεθανόλης είναι αντίστοιχα ίσα με:
α) 4 και +4, β) 4 και -2, γ) 3 και +2, δ) 4 και -3.
Α 9. Ουσίες με ιοντικό κρυσταλλικό πλέγμα χαρακτηρίζονται από:
α) κακή διαλυτότητα στο νερό, β) υψηλό σημείο βρασμού, γ) συντήξη, δ) πτητικότητα.
Α 10. Ο σχηματισμός δεσμού υδρογόνου μεταξύ των μορίων οδηγεί σε:
α) για τη μείωση των σημείων βρασμού των ουσιών, β) για τη μείωση της διαλυτότητας των ουσιών στο νερό,
γ) σε αύξηση των σημείων βρασμού των ουσιών, δ) σε αύξηση της πτητικότητας των ουσιών.
Α 11. Τύπος ουσίας με ιοντικό δεσμό:
α) NH 3, β) C 2 H 4, γ) KH, δ) CCl 4.
Α 12. Μόνο δ – δεσμός υπάρχει στο μόριο:
α) άζωτο, β) αιθανόλη, γ) αιθυλένιο, δ) μονοξείδιο του άνθρακα (4).
13. Η μοριακή δομή έχει μια ουσία με τον τύπο:
α) CH4, β) NaOH, γ) SiO 2, δ) Al.
Α 14.Ένας δεσμός υδρογόνου σχηματίζεται μεταξύ:
α) μόρια νερού, β) μόρια υδρογόνου,
γ) μόρια υδρογονάνθρακα, δ) άτομα μετάλλου και άτομα υδρογόνου.
Α 15.Εάν ανακινήσετε δυνατά το μείγμα φυτικού ελαίου και νερού, λαμβάνετε:
α) εναιώρημα, β) γαλάκτωμα, γ) αφρός, δ) αεροζόλ.
Μέρος Β:
Β 1. Ο αριθμός των κοινών ζευγών ηλεκτρονίων μεταξύ των ατόμων βρωμίου σε ένα μόριο Br 2 είναι……
Β 2.Ποιοι δεσμοί σχηματίζουν τον τριπλό δεσμό στο μόριο N 2 (παρουσιάστε την απάντησή σας στην ονομαστική περίπτωση).
Β 3. Στους κόμβους του μεταλλικού κρυσταλλικού πλέγματος υπάρχουν…….. .
Β 4.Δώστε ένα παράδειγμα ουσίας της οποίας το μόριο περιέχει πέντε δ - και δύο π - δεσμούς. Ονομάστε την ουσία στην ονομαστική περίπτωση.
Β 5.Ποιος είναι ο μέγιστος αριθμός δεσμών π που μπορούν να σχηματιστούν μεταξύ δύο ατόμων σε ένα μόριο; (αντιπροσωπεύστε την απάντηση ως αριθμό)
Μέρος Γ:
Από 1.Να γράψετε τους συντακτικούς τύπους όλων των ισομερών ουσιών της σύνθεσης C 5 H 10 O. Ονομάστε κάθε ουσία.
Γ 2.Να σχηματίσετε τους συντακτικούς τύπους των ουσιών: CHCl 3, C 2 H 2 Cl 2, F 2.
Δημιουργήστε γραφικούς τύπους: AlN, CaSO 4, LiHCO 3.
Γ 3.Προσδιορίστε την κατάσταση οξείδωσης σε χημικές ενώσειςκαι ιόντα:
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Σχετική πληροφορία.
Δοκιμή Νο. 2 DKR «ΔΟΜΗ ΟΥΣΙΑΣ».
Α'1. Χημικοί δεσμοί σε ουσίες των οποίων οι τύποι είναι CH 4 και CaCl 2, αντίστοιχα:
α) ιοντικά και ομοιοπολικά πολικά, β) ομοιοπολικά πολικά και ιοντικά,
γ) ομοιοπολικά μη πολικά και ιοντικά, δ) ομοιοπολικά πολικά και μεταλλικά.
Α2.Η πολικότητα του δεσμού είναι μεγαλύτερη στην ουσία με τον τύπο:
α) Br 2, β) LiBr, γ) HBr, δ) KBr
Α 3.Η ιοντική φύση του δεσμού στη σειρά των ενώσεων Li 2 O - Na 2 O - K 2 O - Rb 2 O:
α) αυξάνεται, β) μειώνεται, γ) δεν αλλάζει, δ) πρώτα μειώνεται, μετά αυξάνεται.
Α 4. Υπάρχει ένας ομοιοπολικός δεσμός μεταξύ των ατόμων, που σχηματίζεται από έναν μηχανισμό δότη-δέκτη σε μια ουσία, ο τύπος του οποίου είναι:
α) Al(OH) 3, β) [CH 3 NH 3 ]Cl, γ) C 2 H 5 OH, δ) C 6 H 12 O 6.
Α 5.Μερικοί τύποι για ουσίες των οποίων τα μόρια περιέχουν μόνο δεσμούς δ:
α) CH 4 και O 2, β) C 2 H 5 OH και H 2 O, γ) N 2 και CO 2, δ) HBr και C 2 H 4.
Α 6. Η ισχυρότερη σύνδεση αυτών:
α) C - Cl, β) C - F, γ) C - Br, δ) C - I.
Α 7. Μια ομάδα τύπων ενώσεων στις οποίες υπάρχει παρόμοια κατεύθυνση δεσμών, λόγω sp 3 - υβριδισμού ηλεκτρονικών τροχιακών:
α) CH 4, C 2 H 4, C 2 H 2, β) NH 3, CH 4, H 2 O, γ) H 2 O, C 2 H 6, C 6 H 6, δ) C 3 H 8, BCl 3, BeCl 2.
Α 8. Το σθένος και η κατάσταση οξείδωσης του ατόμου άνθρακα στο μόριο της μεθανόλης είναι αντίστοιχα ίσα με:
α) 4 και +4, β) 4 και -2, γ) 3 και +2, δ) 4 και -3.
Α 9. Ουσίες με ιοντικό κρυσταλλικό πλέγμα χαρακτηρίζονται από:
α) κακή διαλυτότητα στο νερό, β) υψηλό σημείο βρασμού, γ) συντήξη, δ) πτητικότητα.
Α 10. Ο σχηματισμός δεσμού υδρογόνου μεταξύ των μορίων οδηγεί σε:
α) για τη μείωση των σημείων βρασμού των ουσιών, β) για τη μείωση της διαλυτότητας των ουσιών στο νερό,
γ) σε αύξηση των σημείων βρασμού των ουσιών, δ) σε αύξηση της πτητικότητας των ουσιών.
Α 11. Τύπος ουσίας με ιοντικό δεσμό:
α) NH 3, β) C 2 H 4, γ) KH, δ) CCl 4.
Α 12
Α13.Η μοριακή δομή έχει μια ουσία με τον τύπο:
Α 14.Ένας δεσμός υδρογόνου σχηματίζεται μεταξύ:
α) μόρια νερού, β) μόρια υδρογόνου,
γ) μόρια υδρογονάνθρακα, δ) άτομα μετάλλου και άτομα υδρογόνου.
Α 15.Εάν ανακινήσετε δυνατά το μείγμα φυτικού ελαίου και νερού, λαμβάνετε:
α) εναιώρημα, β) γαλάκτωμα, γ) αφρός, δ) αεροζόλ.
Α 16. Τύπος ουσίας με πολικό ομοιοπολικό δεσμό:
α) Cl 2, β) KCl, γ) NH 3, δ) O 2.
Α 17.Μια ουσία μεταξύ των μορίων της οποίας υπάρχει δεσμός υδρογόνου:
α) αιθανόλη, β) μεθάνιο, γ) υδρογόνο, δ) βενζόλιο.
Α 18.Αριθμός κοινών ζευγών ηλεκτρονίων σε ένα μόριο υδρογόνου:
α) ένα, β) δύο, γ) τρία, δ) τέσσερα.
Α 19. Η πολικότητα ενός χημικού δεσμού αυξάνεται σε έναν αριθμό ενώσεων των οποίων οι τύποι είναι:
α) NH 3, HI, O 2, β) CH 4, H 2 O, HF, γ) PH 3, H 2 S, H 2, δ) HCl, CH 4, CL 2.
Α 20.Κρυσταλλικό πλέγμα χλωριούχου νατρίου:
α) ατομική, β) ιοντική, γ) μεταλλική, δ) μοριακή.
Α 21. Αριθμός δεσμών δ και π σε ένα μόριο ακετυλενίου:
α) 5 δ και π - όχι, β) 2 δ και 3 π, γ) 3 δ και 2 π, δ) 4 δ και 1 π.
Α 22. Ουσίες των οποίων οι τύποι είναι: CH 3 – CH 2 – OH και CH 3 – O – CH 3 είναι:
α) ομόλογα, β) ισομερή, γ) την ίδια ουσία, δ) ομόλογα και ισομερή.
Α 23. Το ομόλογο μιας ουσίας της οποίας ο τύπος είναι CH 2 = CH – CH 3 είναι:
α) βουτάνιο, β) βουτένιο - 1, γ) βουτένιο - 2, δ) βουτίνη - 1.
Α 24. Ένας ομοιοπολικός μη πολικός δεσμός σχηματίζεται μεταξύ των ατόμων:
α) υδρογόνο και οξυγόνο, β) άνθρακας και υδρογόνο, γ) χλώριο, δ) μαγνήσιο.
Α 25. Μόνο δ – δεσμός υπάρχει στο μόριο:
α) άζωτο, β) αιθανόλη, γ) αιθυλένιο, δ) μονοξείδιο του άνθρακα (4).
Α 26. Το άτομο αζώτου έχει σθένος 3 και κατάσταση οξείδωσης 0 σε ένα μόριο μιας ουσίας του οποίου ο τύπος είναι:
α) NH 3, β) N 2, γ) CH 3 NO 2, δ) N 2 O 3.
Α 27. Η μοριακή δομή έχει μια ουσία με τον τύπο:
α) CH4, β) NaOH, γ) SiO 2, δ) Al.
Α28.Ο δεσμός C-H είναι ισχυρότερος από τον δεσμό Si-H επειδή:
α) το μήκος του δεσμού είναι μικρότερο, β) το μήκος του δεσμού είναι μεγαλύτερο,
γ) η πολικότητα του δεσμού είναι μικρότερη, δ) η πολικότητα του δεσμού είναι μεγαλύτερη.
Α 29.Υπάρχει ένας ομοιοπολικός δεσμός μεταξύ των ατόμων, που σχηματίζεται από έναν μηχανισμό δότη-δέκτη σε μια ουσία, ο τύπος του οποίου είναι:
α) CH 3 NO 2, β) NH 4 NO 2, γ) C 5 H 8, δ) H 2 O.
Α 30.Ο λιγότερο πολικός δεσμός είναι:
α) C – H, β) C – Cl, γ) C – F, δ) C – Br
Μέρος Β:
Β 1. Ο αριθμός των κοινών ζευγών ηλεκτρονίων μεταξύ των ατόμων βρωμίου σε ένα μόριο Br 2 είναι……
Β 2.Ποιοι δεσμοί σχηματίζουν τον τριπλό δεσμό στο μόριο N 2 (παρουσιάστε την απάντησή σας στην ονομαστική περίπτωση).
Β 3. Στους κόμβους του μεταλλικού κρυσταλλικού πλέγματος υπάρχουν…….. .
Β 4.Δώστε ένα παράδειγμα ουσίας της οποίας το μόριο περιέχει πέντε δ - και δύο π - δεσμούς. Ονομάστε την ουσία στην ονομαστική περίπτωση.
Β 5.
Β 6. Ο αριθμός των κοινών ζευγών ηλεκτρονίων μεταξύ των ατόμων βρωμίου στο μόριο N 2 είναι……
Β 7.Ποιοι δεσμοί σχηματίζουν τον τριπλό δεσμό στο μόριο C 2 H 2 (παρουσιάστε την απάντησή σας στην ονομαστική περίπτωση).
Β 8. Στους κόμβους του ιοντικού κρυσταλλικού πλέγματος υπάρχουν......... .
Β 9.Δώστε ένα παράδειγμα ουσίας της οποίας το μόριο περιέχει πέντε δ – και έναν π – δεσμούς. Ονομάστε την ουσία στην ονομαστική περίπτωση.
Β 10.Ποιος είναι ο μέγιστος αριθμός δεσμών π που μπορούν να σχηματιστούν μεταξύ δύο ατόμων σε ένα μόριο; (αντιπροσωπεύστε την απάντηση ως αριθμό)
Μέρος Γ:
Από 1.Να γράψετε τους συντακτικούς τύπους όλων των ισομερών ουσιών της σύνθεσης C 5 H 10 O. Ονομάστε κάθε ουσία.
Γ 2 .
Να σχηματίσετε τους συντακτικούς τύπους των ουσιών: CHCl 3, C 2 H 2 Cl 2, F 2.
Δημιουργήστε γραφικούς τύπους: AlN, CaSO 4, LiHCO 3.
Γ 3.
HNO 3, HClO 4, K 2 SO 3, KMnO 4, CH 3 F, MgOHCl 2, ClO 3 -, CrO 4 2-, NH 4 +
Γ 4.Να γράψετε τους συντακτικούς τύπους όλων των ισομερών ουσιών της σύνθεσης C 4 H 8 O 2. Ονομάστε κάθε ουσία.
Γ 5 .
Να σχηματίσετε τους συντακτικούς τύπους των ουσιών: CHBr 3, C 2 H 2 Br 2, Br 2.
Δημιουργήστε γραφικούς τύπους: Al 2 S 3, MgSO 4, Li 2 CO 3.
Από 6.Προσδιορίστε το βαθμό οξείδωσης σε χημικές ενώσεις και ιόντα:
CCl 4, Ba(NO 3) 2, Al 2 S 3, HClO 3, Na 2 Cr 2 O 7, K 2 O 4, SrO 2-, Cr 2 O 3 2
Σελίδα 1
Novikova Olesya Vladimirovna
Καθηγήτρια Χημείας και Βιολογίας
Δημοτικό εκπαιδευτικό ίδρυμα - γυμνάσιο με. Προκούντινο
Περιοχή Atkarsky
Περιοχή Σαράτοφ.
Τεστ Νο. 1 με θέμα: «Δομή ουσιών».
Επιλογή Εγώ .
α) υδροχλώριο
β) υδροξείδιο του νατρίου
γ) μονοξείδιο του άνθρακα (II)
δ) μονοξείδιο του άνθρακα (IV)
2. Ένας πολικός ομοιοπολικός δεσμός υπάρχει στο μόριο
α) οξυγόνο
β) ρομβικό θείο
δ) υδρογόνο
3. Χημικός δεσμός σε μόριο διοξειδίου του άνθρακα
α) ομοιοπολική μη πολική
β) ομοιοπολική πολική
γ) μέταλλο
δ) ιοντική
4. Το ισχυρότερο μόριο είναι:
ΕΝΑ) H 2 ;
σι) Ν 2 ;
V) φά 2 ;
ΣΟΛ) Ο 2 .
5. Μια ουσία μεταξύ των μορίων της οποίας υπάρχει δεσμός υδρογόνου:
β) φθοριούχο νάτριο.
γ) μονοξείδιο του άνθρακα (II);
δ) αιθανόλη.
6. Ουσίες με ιοντικό κρυσταλλικό πλέγμα χαρακτηρίζονται από:
α) κακή διαλυτότητα στο νερό. γ) τήξη.
β) υψηλό σημείο βρασμού. δ) αστάθεια.
7. Ο σχηματισμός δεσμού υδρογόνου μεταξύ μορίων οδηγεί σε:
α) σε μείωση των σημείων βρασμού·
β) για τη μείωση της διαλυτότητας των ουσιών στο νερό.
γ) να αυξηθούν οι θερμοκρασίες βρασμού.
δ) να αυξηθεί η πτητότητα των ουσιών.
8. Ποια ουσία περιέχει περισσότερο οξυγόνο σε Na 2 CO 3 ή σε Ca(HCO 3 ) 2;
9. :
Α) SO 2 +H 2 O͢͢→
Β) Na+H 2 O→
Β) Na 2 O+H 2 O→
Δ) S+H 2 O→
10. Λύσε το πρόβλημα :
Πόσο νερό και υδροξείδιο του νατρίου χρειάζονται για την παρασκευή 180 g διαλύματος 15%;
11 . Λύσε το πρόβλημα :
Ποια είναι η μάζα του οξυγόνου που λαμβάνεται με κλασματική απόσταξη 200 m 3 (ν.σ.) αέρα, αν το κλάσμα όγκου του οξυγόνου είναι 0,21;
Τεστ Νο. 1 με θέμα «Δομή ουσιών».
Επιλογή II .
Ο ιονικός χημικός δεσμός εμφανίζεται σε
α) κρυσταλλικό θείο
β) στερεό ιώδιο
γ) ιωδιούχο ασβέστιο
δ) οξείδιο του φωσφόρου (v)
2. Ένας ομοιοπολικός πολικός δεσμός υπάρχει στο μόριο
α) θειικό οξύ
β) πλαστικό θείο
δ) θειούχο ρουβίδιο
3. Χημικός δεσμός σε μόριο υδρογόνου
α) ομοιοπολική μη πολική
β) ομοιοπολική πολική
γ) μέταλλο
δ) ιοντική
4. Οι ισχυρότεροι δεσμοί σε ένα μόριο μιας ουσίας της οποίας ο τύπος είναι:
ΕΝΑ) H 2 μικρό ;
σι) H 2 Se ;
V) H 2 Ο ;
ΣΟΛ) H 2 Te .
5. Η μοριακή δομή έχει ουσίες με τον τύπο:
ΕΝΑ) CH 4 ;
σι) NaOH ;
V) SiO 2 ;
ΣΟΛ) Ο Αλ .
6. Σχηματίζεται δεσμός υδρογόνου μεταξύ:
α) μόρια νερού. γ) μόρια υδρογονανθράκων.
β) μόρια υδρογόνου. δ) άτομα μετάλλου και άτομα υδρογόνου.
7. Ο σχηματισμός δεσμών υδρογόνου μπορεί να εξηγηθεί ως εξής:
α) διαλυτότητα οξικού οξέος στο νερό.
β) όξινες ιδιότητες της αιθανόλης.
γ) υψηλό σημείο τήξης πολλών μετάλλων.
δ) αδιαλυτότητα του μεθανίου στο νερό.
8. Συγκρίνετε την περιεκτικότητα σε θείο του Mg(HSO 4) 2 και CuSO 4;
9. Συμπληρώστε τις εξισώσεις των πιθανών αντιδράσεων :
Α) CO 2 +H 2 O͢͢→
Β) Al+H 2 O→
Β) Fe+H 2 O→
Δ) C+H 2 O→
10. Λύσε το πρόβλημα:
Είναι απαραίτητο να παρασκευαστούν 540 g διαλύματος 12%. νιτρικό οξύ. Υπολογίστε πόσο νερό και οξύ πρέπει να πάρετε για να παρασκευαστεί ένα τέτοιο διάλυμα.
11. Λύσε το πρόβλημα:
Ποια είναι η μάζα του αζώτου που λαμβάνεται από 143,6 λίτρα αέρα που περιέχει 78% κατ' όγκο άζωτο;