Učitelj, nastavnik, profesor:
Obrazovna ustanova: profesionalni Metro Lyceum St. Petersburg
Akademska disciplina: kemija
Tema: "Organski spojevi koji sadrže kisik i dušik"
Ciljna publika: 1 tečaj
Vrsta lekcije: generalizacija materijala, 1 ACAD. sat.
Ciljevi Lekcija:
Znanje: znaju formule i svojstva organskih tvari koje sadrže kisik i dušik
Razumijevanje:razumjeti ovisnost svojstava tvari iz strukture molekule, iz funkcionalne skupine
Primjena: Koristite informacije o svojstvima tvari za prikupljanje jednadžbi kemijskih reakcija.
Analiza: Analizirajte uzajamni utjecaj skupina atoma u molekule organskih tvari.
Sinteza:sažeti informacije o svojstvima organskih tvari u obliku lanca transformacija
Evaluacija: Provesti samopoštovanje na predložene rubrike.
Oprema: interaktivna ploča, multimedijska prezentacija.
Plan učenja:
1. Org. trenutak
2. Ponavljanje prethodno proučavanih.
3. Govori studenata.
4. Samoopredjeljenje učenika u razinama samoprocjene.
5. Neovisni rad Zjenice.
6. Subiranje sustava orijentiranog na kriterij.
7. Domaći zadatak.
Tijekom nastave
1. Organiziranje vremena.
Izgradnja grupe, izvješće glavama grupe o broju prisutnih studenata.
2. Ponavljanje prethodno proučavanih
Informacije o funkcionalnim skupinama, razrede tvari koje sadrže kisik i dušik, o najjednostavnijim predstavnicima ovih klasa koristeći interaktivnu ploču i multimedijsku prezentaciju.
Koja skupina atoma, nužno prisutna u molekulama tvari ovog razreda, određuje kemijsku funkciju tvari, tj. To kemijska svojstva?
Odgovor: Funkcionalna skupina atoma
Dati ime funkcionalne skupine - to
Odgovor: hidroksilna skupina atoma.
Koja klasa tvari određuje hidroksilnu skupinu atoma?
Odgovor: Alkoholi, ako je 1 grupa on, jedno-nestašan alkohol, ako je to više od jedne skupine, polihidrični alkoholi.
Dajte ime funkcionalne skupine - spavanje. Koja klasa tvari određuje?
Odgovor: Aldehid Grupa određuje klasu aldehida.
Dajte ime grupe funkcija - spavanje. Kakvu vrstu određuje?
Odgovor: Karboksilna skupina određuje razred karboksilnih kiselina.
Dajte ime grupe funkcija - NH2. Kakvu vrstu određuje?
Odgovor: Amino grupa određuje razred amina ili klase aminokiselina.
Slušamo izvješća studenata s prezentacijom multimedijskih prezentacija o najjednostavnijim predstavnicima različitih klasa tvari koje sadrže kisik i dušik.
3. Očekivanja studenata.
Poruka 1..
Etanol C2N5ON, klasa pojedinačnih aparalnih alkohola, funkcionalnu skupinu - hidroksilnu skupinu atoma - to. Visokokvalitetna reakcija - interakcija s bakrenim oksidom (II) s formiranjem aldehida. Kemijska svojstva (odvajanje 2 reakcije) - izgaranje i interakcija s metalima (Na).
Poruka 2..
Propanriool (glicerin) C3N7 (OH) 3. Klase - poliatomični alkoholi, funkcionalne skupine - nekoliko hidroksilnih skupina - to. Visokokvalitetna reakcija - interakcija s bakrenim hidroksidom (II). Kemijska svojstva - interakcija s natrija i uzgoj halogena.
Laboratorijsko iskustvo:
U cijevi se ulijevamo oko 1 ml otopine bakra (II) zbroja natrija (II) i doda se lagana otopina natrijevog hidroksida u formiranje plavog precipitata bakrenog hidroksida (II). Do rezultirajućeg sedimenta dodajte kapljinu glicerina. Otrcana smjesa. Napominjemo transformaciju plavog sedimenta u otopinu plave.
(Glicerin + cu (oh) 2 ----- plava otopina)
Poruka 3.
Fenol C6H5OH je najjednostavniji predstavnik Fenol klase.
Funkcionalna skupina - hidroksilna skupina -OH. Visokokvalitetna reakcija je stvaranje ljubičaste otopine pri interakciji s željezom (III) kloridom ili formiranjem bijelog sedimenta pri interakciji s bromom. Kemijska svojstva: Fenol - slaba kiselina, u interakciji u metalima (Na) s alkalijom (NaOH) i brom.
Poruka 4.
Etanol ili octena aldehid CH3-CoH funkcionalna skupina - COH aldehid skupina. Klasa - aldehidi. Visoka kvaliteta reakcija je reakcija "srebro ogledalo". Kemijska svojstva: Reakcija oporavka i oksidacijska reakcija.
Laboratorijsko iskustvo: demonstracijski doživljaj.
U epruveti koja sadrži 1 ml aldehid ( vodena otopina) Dodajemo malo kapi otopine amonijaka srebrnog oksida. Zagrijte ispitnu cijev. Promatramo odabir srebra na zidovima ispitne cijevi, staklena površina postaje ogledalo.
Poruka 5.
Jednoznatna kiselina CH3-COOH (octena kiselina). Klase - karboksilne kiseline. Funkcionalna skupina - COOH karboksilna skupina. Reakcija kvalitete - Lacmus indikator dobiva crveno.
Kemijska svojstva: kao i bilo koja kiselina u interakciji s metalima (Na), glavnim oksidima (Na2O), alkalizom (NaOH).
Laboratorijsko iskustvo:
U suhoj čistoj cijevi s univerzalnim indikatorom, ulijte malo octene kiseline. Indikator pocrveni.
Poruka 6.
Glukoza C6H12O6. Klasa - ugljikohidrati. Funkcionalne skupine: 5-OH i 1-COH, tj. Aldehidrossitis. Kvalitativne reakcije: Interakcija s bakrenim hidroksidom s formiranjem plave otopine. Reakcija "srebro ogledalo" s odvajanjem srebra na zidovima epruvete. Kemijska svojstva: Oporavak u alkoholu sa šest kaputa, oksidacija u glukonskoj kiselini, reakcija fermentacije.
Poruka 7.
Anilin C6H5-NH2.
Funkcionalna skupina - NH2 amino skupina. Klase - amini. Visokokvalitetna reakcija: interakcija s bromom vode sa stvaranjem bijelog sedimenta. Kemijska svojstva: Interakcija s klorovodična kiselina I bromom.
Poruka 8.
Aminoetanična kiselina NH2-CH2-COOH ili aminooctena kiselina.
Klase - aminokiseline. Funkcionalne skupine: - NH2 amino skupina i -COOH karboksilna skupina. Kemijska svojstva: AK - amfoterni spojevi; - NH2 izvješća Osnovna svojstva - COOH - Svojstva kiselina. Stoga su aminokiseline sposobne kombinirati međusobno, formiranje proteinskih molekula, a protein je osnova života na našem planetu.
4. Samoodređenje učenika na samoprocjene razine.
Interaktivna ploča: Učenici se upoznaju s kartama samoprocjene u lekciji i označavaju njihovu razinu.
1. Mogu identificirati funkcionalnu skupinu i najjednostavniji predstavnik klase organskih tvari koje koriste učitelj i sažetak (6-7ball).
2. Mogu odrediti funkcionalnu skupinu, najjednostavniji predstavnik klase organske tvari bez pomoći učitelja i bez pomoći sažetka (8-10balls).
3. Mogu definirati kvalitativnu reakciju i kemijska svojstva tvari koristeći učitelja i sažetak (11-14balla).
4. Mogu definirati kvalitativnu reakciju i kemijska svojstva tvari bez pomoći učitelja i bez kontaminacije (15-18balls).
Klasa | Funkcionalne skupine | Jednostavan predstavnik | Kvalitativne reakcije | Kemijska svojstva |
Monatomski alkohol | ||||
Multiatomični alkoholi | ||||
Fenoli | ||||
Aldehidi | ||||
Karboksilne kiseline | ||||
Ugljikohidrati | ||||
Amini | ||||
Aminokiseline |
Učenici se upoznaju s kriterijskim sustavom procjene.
Kriteriji:
18 - 15 bodova - "Izvrsno"
bodova - "dobro"
10 - 6 bodova - "zadovoljavajuće"
5 ili manje - "nezadovoljavajuće"
5. Samostalni rad studenata.
6. Zbraja rezultate sustava orijentiranog na kriterij (najavu broja studenata).
7. Domaći zadatak:punjenje tablice.
Klikom na gumb "Arhiva preuzimanja" preuzimate datoteku koju trebate potpuno besplatno.
Prije preuzimanja ove datoteke, zapamtite one dobre eseje, kontrolu, tečaj, tezu, članke i druge dokumente koji nisu zatraženi na vašem računalu. Ovo je vaš rad, trebao bi sudjelovati u razvoju društva i koristi ljudima. Pronađite ove radove i pošaljite bazu znanja.
Mi i svi studenti, diplomirani studenti, mladi znanstvenici koji koriste bazu znanja u studijima i radu, bit će vam vrlo zahvalni.
Da biste preuzeli arhiv s dokumentom, u okvir ispod, unesite pet-znamenkasti broj i kliknite gumb "Preuzmi arhivu"
Slične dokumente
- - primarni amini yamn 2;
- - sekundarni amini ki / yn;
- - tercijarni amini KK "K" s.
Nomenklatura derivata benzena, njihove sorte i metode dobivanja, načela i smjera praktična uporaba, Struktura benzena i njegovih aromata. Pravilo Hyukkel i njegove značajke njegove uporabe. Cheversoid aromatski spojevi.
sažetak, dodano 05.08.2013
Aromatski ugljikovodici: Opće karakteristike. Nomenklatura i izomerizam, fizikalna i kemijska svojstva aromatskih ugljikovodika. Mehanizam reakcija električne i nukleofilne supstitucije u aromatskom redu. Primjena arene, njihove toksičnosti.
sažetak, dodano 11.12.2011
Alkanci ograničavaju ugljikovodike koji sadrže samo same karbonine. Dobivanje alkana: industrijska metoda, navoja i oksidacija. Ugljikovodici koji sadrže dvostruki spoj ugljika - alkene ili etilen ugljikovodici. Dien ugljikovodici.
predavanje, dodano 05.02.2009
Nedopupljeni spojevi, s dvije dvostruke veze u molekuli - dien-ugljikovodici. Odnos između strukture dienskih ugljikovodika i njihovih svojstava. Postupke za proizvodnju devirin, izoprena, sintetičke gume. Organski halidi i njihova klasifikacija.
predavanje, dodano 19.02.2009
Struktura, nomenklatura alkena. Nezasićeni ugljikovodici, čije molekule sadrže jednu dvostruku C-C-komunikaciju. Hibridizacija orbitalija. Slika prostorne strukture atoma. Prostorni kavu ugljični kostur. Fizikalna svojstva alkena.
prezentacija, dodano 06.08.2015
Razvoj ideja o organskom podrijetlu ulja. Parafin, nafteni i aromatski ugljikovodici. Plin zasićenje tlaka plina. Kristalizacija, zamućenost, mraz. Razlike u naftnim svojstvima unutar depozita ulja.
tutorial, dodano 02/05/2014
Koncept alkana (zasićeni ugljikovodici, parafini, alifatski spojevi), njihov sustavni i racionalna nomenklatura, Kemijska svojstva alkana, reakcija radikalne supstitucije i oksidacije. Dobivanje i obnavljanje nezasićenih ugljikovodika.
Organske tvari Spojevi klase, koji uključuju ugljik (osim karbida, karbonati, ugljikovih i cijanidnih oksida). Ime "organski spojevi" pojavili su se u ranoj fazi razvoja kemije i govori samo sama znanstvenici ... Wikipedia
Jedan od najvažnijih vrsta organski spojevi, Njihov pripravak uključuje dušik. Oni sadrže ugljikov vodik i dušik ugljik u molekuli. U ulju sadrži heterocikl koji sadrži dušik. Dušik je dio proteina, nukleinskih kiselina i ... ... Wikipedia
Metalometalni spojevi koji sadrže "Germand Carbon". Ponekad se nazivaju organskim spojevima koji sadrže Njemačku. Prva germanička tetraetilgermanska veza bila je ... ... Wikipedia
Silicij-organizirani spojevi, u molekulama postoji izravna veza silicijskog ugljika. Silicij spojevi se ponekad nazivaju silikon iz naziva latinskog silicijskog silicija. Silikonški spojevi ... ... Wikipedia
Organski spojevi organske tvari Klasa kemijski spojevikoji uključuje ugljik (s izuzetkom karbida, karbonske kiseline, karbonata, ugljikovih i cijanidnih oksida). Sadržaj 1 povijest 2 učionica ... Wikipedia
Metalorganski spojevi (MOS) Organski spojevi, u molekulama postoji spajanje metalnog atoma s atoma / atoma ugljika. Sadržaj 1 Vrste metalnih organskih spojeva 2 ... Wikipedia
Halogenički spojevi Organske tvari koje sadrže najmanje jednu vezu s Hal ugljičnim halogenom. Halogenički spojevi, ovisno o prirodi halogena, podijeljeni su u: fluorganijske spojeve; ... ... wikipedia
Metallometalni spojevi (MOS) Organski spojevi, u molekulama postoji spajanje metalnog atoma s atomom / ugljikovim atomima. Sadržaj 1 Vrste metalnih organskih spojeva 2 Metode za dobivanje ... Wikipedia
Organski spojevi u kojima je prisutna ugljična plima može sadržavati i dvovalentnu, tako da je kositar. Sadržaj 1 Metode sinteze 2 vrste 3 ... Wikipedia
- (heterocikli) Organski spojevi koji sadrže cikluse, koji se, zajedno s ugljikom, sastoje od drugih elemenata. Može se smatrati karbocikličkim spojevima s hetero-pločama (heteroatomi) u ciklusu. Najviše ... ... Wikipedia
Dušik, kao što je kisik, često je uključen u sastav organskih tvari, a njegovi spojevi su potrebni za žive organizme.
Spojevi koji sadrže dušik se odlikuju velikom raznolikošću od kisika koji sadrži. To je zbog činjenice da je valencija dušika veća i istovremeno ima tri hibridna stanja, kao što je ugljikov atom. Spojevi s jednim kombiniranje C-S Oni se nazivaju aminima, s dvostrukom vezom s \u003d S - imina, s trostrukom vezom s \u003d K - nitrilom.
Bitna razlika između dušika iz kisika je da dušik može ući u organske spojeve u obnovljenom i oksidiranom stanju. Dušik struje (X \u003d 3.0) je viši nego u ugljiku (X \u003d 2.5), a niži nego kod kisika (X \u003d 3.5). Ako je dušik povezan s ugljikom i vodikom, njegov stupanj oksidacije -3. U spojevima koji sadrže nitro skupinu -ZH) 2, dušik je povezan s kisikom i ugljikom i nalazi se u stupnju oksidacije +3. Organski spojevi s oksidiranim dušikom sadrže unutarnju opskrbu oksidacijskog sredstva. Ako postoji nekoliko nitroupa u molekuli, veza postaje eksplozivna. Tvari ovog tipa su 2,4,6-(trotil).
Obnovljeni dušik daje organske spojeve istu svojstva kao kisik: polaritet, bazičnost i kiselost, sposobnost
kovanje vodikovih veza. Međutim, polaritet spojeva koji sadrže dušik je manji, a vodikove veze su slabije od kisika koji sadrži. Dakle, u nekim fizička svojstva Amini su između ugljikovodika i alkohola. Iako su svi alkoholi u normalnim uvjetima tekućine, neke amine plinovite tvari:
Dušik u stanju bp 3-hibridizacija je dobar donator e-par. Stoga, kao što već znamo, amini pokazuju prilično jaka osnovna svojstva. Na manjinskim svojstvima donatora izražena su u dušiku u stanju $ 2-hibridizacije. Kiselinska svojstva organskih spojeva koji sadrže dušik su mnogo slabiji od kisika koji sadrži. No, uz sudjelovanje elektrona dušika u konjugaciji s TG elektronima i ugljikom, svojstva kiseline se manifestiraju.
Jedan od klasa tvari koje sadrže dušik - amini. Takozvani organske tvari koje sadrže dušik, u kojima je atom dušika spojen na ugljikovodične radikale i odgovarajući broj atoma vodika. Ovisno o broju radikala razlikuju:
Treba napomenuti da se koncepti primarnih, sekundarnih i tercijarnih amina ne podudaraju s odgovarajućim konceptima alkohola.
Razlikovati homološki redovi marginalne, nepredviđene i aromatične amine. Tu je i razlika u terminologiji, ako usporedite alkohole i amine. U aromatskim alkoholima, hidroksogrup treba biti povezana s ugljikovim atomom u radikalu, a ne u aromatskom ciklusu. U slučaju spojeva koji sadrže dušik, tvar sa skupinom Yun 2 povezana s aromatskim ciklusom također se smatra aminom.
Amini s malom molekularnom težinom su tekuće ili plinovite tvari koje su u vodi u vodi. Imaju neugodan miris nalik mirisu amonijaka. Specifični miris riba također je povezan s prisutnošću amina. Najviši amini pojavljuju se iste značajke koje su navedene u alkoholima i kiselinama, pojavljuje se topljivost u vodi i pojavit će se površinska aktivnost.
Dobivanje amina. Jedna od metoda dobivanja amina slična je dobivanju alkohola. To su reakcije ugljikovodika derivata halogena s amonijakom, koje se temelje na mehanizmu nukleofilne supstitucije:
Amin ovdje ne može biti izravan proizvod reakcije, jer formiranje klorida reagira s njim kao bazu.
davanje soli. Za odabir besplatno Dobivena sol amina se obrađuje alkalija:
Halogeni derivati \u200b\u200bugljikovodika reagiraju ne samo s amonijakom, već i sa primarni amin, U isto vrijeme se formira sekundarni amin, a na sljedećoj fazi - tercijarni amin:
Amini se također dobivaju nitrilnim hidrogenacijom:
Aromatski amini se dobivaju vraćanjem nitro spojeva. Metali se koriste kao reducirajuća sredstva:
Ovaj aromatski amin naziva se anilin. Reakcija obnove nitro spojeva je otvorena za N. N. Zinin 1842. godine u industriji, nitrobenzen se smanjuje vodikom na niklovom katalizatoru na ~ 300 ° C. Anilin je postao vrlo važan srednji proizvod koji se koristi za proizvodnju boja, polimera, droge, itd. Globalna proizvodnja anilina godišnje je više od milijun tona.
Kemijska svojstva amina. Amini se odnose na broj tvari sposobnih za spaljivanje sa formiranjem C02, H20 i dušika u 2.
Kako je baza amina slična amonijaku, iz koje je supstitucija vodika nastaje na ugljikovodičnim radikalima. Ovi radikali utječu na snagu baze. Utjecaj induktivnih i mezomernih učinaka na glavne svojstva općenito je suprotan njihovim učincima na kisela svojstva. Ograničiti alkohole po svojstva kiselina Slabiju vodu, a granični amini su glavni od amonijaka; Fenoli kroz kisela svojstva su mnogo jači od alkohola, a anilin prema glavnim svojstvima znatno slabijih od graničnih amina.
NA ograničiti amine +/- Učinak radikala povećava gustoću elektrona na dušik, tako da se sposobnost dušika povećava kako bi se dobio elektronički par za obrazovanje komunikacija za prihvaćanje donatora, U anilin, par dušikovog elektrona sudjeluje u konjugaciji s aromatskim TT elektronima i postaje manje dostupno formiranju donora precizne komunikacije. Stoga se tvari nalaze u sljedećem retku na slabljenju glavnih svojstava:
ograničite amine\u003e na 3\u003e aromatske amine.
Primjer 22.15. U kojem smjeru je ravnoteža reakcije između etil amina i anilin hidroklorida?
Odluka. Etilamin je jača baza od anilina. Stoga je ravnoteža pomaknuta prema analinskoj formiranju:
Amini reagiraju s metalnim ionima, formirajući sveobuhvatne spojeve. Metalni ion djeluje kao elektronički par dušika, kao u slučaju reakcija amonijaka. Mnogi kompleksni spojevi metala (/block s različitim aminima. Kada se miješa bakrene otopine sulfata i metilamina, formira se intenzivno obojena otopina čišće plave nijanse nego u slučaju reakcije amonijaka (paragraf 210):
dimat tipa GS 2 CH2H2H2 daju snažnije komplekse od monoamina, jer svaka molekula ima dva donora dušikovih atoma i vezana za dvije donatorsko-akcepne veze.
Primarni amini pod djelovanjem dušikovog kiselina (ili natrijevog nitrita u kiseloj okolini) netaknut Pretvaranje u alkohole:
U primarnim i sekundarnim aminima, vodikovim amino skupinama zamijenjeno je ugljikovodičnim radikalima u reakcijama s halogenim derivatima (vidi primanje amina). Amin s halogenhidridom daje amidnu kiselinu u kojoj je radikal povezan s dušikom:
Tercijarni amini pričvršćuju halogene derivate ugljikovodika s formiranjem četiri amonijeve (kvartarne) soli:
To su kristalne, dobro topljive u vodenim tvarima. Za razliku od konvencionalnih amonijevih soli, oni ne hidroliziraju i ne razgrađuju alkaliju.
U anilin i drugim aromatskim aminima, skupina na 2 prikazuje pozitivan mezomerni učinak, ubrzavajući reakciju elektrofilne zamjene u aromatskom radikalu. Anilin miješa vodu brom, dok formira bijeli precipitat tribromanilin.
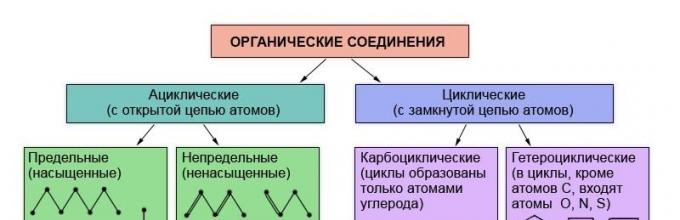
Poznato je da se svojstva organskih tvari određuju njihovim sastavom i kemijska struktura, Stoga nije iznenađujuće da je klasifikacija organskih spojeva teorija strukture - teorija L. M. Butrove. Klasificirane organske tvari u skladu s prisutnošću i redoslijedom spoja atoma u njihovim molekulama. Najtrajniji i izmijenjeni dio molekule organske tvari je njezin kostur - lanac ugljikovih atoma. Ovisno o redoslijedu spoja ugljika atoma u ovom lancu, tvari su podijeljene u acikličke, ne-zatvorene krugove ugljikovih atoma u molekulama i karbocikličke, koji sadrže takve vrijednosti (cikluse) u molekulama.
Osim atoma ugljika i vodika, molekule organske tvari mogu sadržavati atome i druge kemijski elementi, Tvari u molekulama koje su ovi tzv. Heteroatomi su uključene u zatvoreni krug, navode se heterocikličkim spojevima.
Heteroatomi (kisik, dušik itd.) Mogu se uključiti u molekule i acikličke spojeve, formiranje funkcionalnih skupina u njima, na primjer, hidroksil - It, karbonil, karboksil, amino skupina -NN2.
Funkcionalna skupina - skupina atoma, koja određuje najkarakteristična kemijska svojstva tvari i pripadnost specifičnoj klasi spojeva. 
Ugljikovodici- To su spojevi koji se sastoje samo od atoma vodika i ugljika.
Ovisno o strukturi ugljičnog lanca, organski spojevi su podijeljeni u priključci otvorenog lanca - aciklički (alifatski) i ciklički - s zatvorenim lancem atoma.
Ciklički su podijeljeni u dvije skupine: karbociklički spojevi(Ciklusi se formiraju samo ugljikovim atomima) i heterociklički (Ciklusi uključuju i druge atome, kao što je kisik, dušik, sumpor).
Karbociklički spojevi, zauzvrat uključuju dva reda spojeva: aliciklički i aromatično.
Aromatski spojevi na bazi strukture molekula imaju cikluse koji sadrže ravni ugljik s posebno zatvorenim sustavom P-elektrona koji tvore ukupni π-sustav (jedan π-elektronski oblak). Aromati je karakteristično za mnoge heterocikličke spojeve.
Svi ostali karbociklički spojevi odnose se na aliciklički redak.
Oba aciklička (alifatska) i ciklički ugljikovodici mogu sadržavati višestruku (dvostruku ili trostruku) komunikaciju. Takvi ugljikovodici nazivaju se nezasićenim (nezasićenim), za razliku od granice (zasićene), koji sadrži samo pojedinačne veze.
Ograničite alifatske ugljikovodike Poziv alkananci, oni imaju opću formulu s n 2 n +2, gdje je n broj ugljikovih atoma. Njihovo staro ime često se koristi u sadašnjosti - parafina.
Koji sadrži jedna dvostruka komunikacijaNaziv alkeni, Imaju opću formulu s n 2 n.
Nepredviđeni alifatski ugljikovodicis dvije dvostruke veze Poziv alkadienami
Nepredviđeni alifatski ugljikovodicis jednom trostrukom vezom Poziv alkina, Njihova opća formula s NH2N-2.
Ograničite aliciklički ugljikovodici - cikloalkani, njihova opća formula s n 2 n.
Posebna skupina ugljikovodika, aromatičan, ili arenov. (s zatvorenim ukupnim π-elektroničkim sustavom), poznatom iz primjera ugljikovodika s općom formulom s N2N -6.
Dakle, ako u njihovim molekulama jedan ili više Atomi vodika zamjenjuju se s drugim atomima ili skupinama atoma (halogen, hidroksilne skupine, amino skupine itd.) derivati \u200b\u200bugljikovodika: Halogeni derivati, koji sadrži kisik, koji sadrži dušik i drugi organski spojevi.
Derivati \u200b\u200bhalogena Ugljikovodici se mogu smatrati supstitucijskim proizvodima u ugljikovodicima jednog ili više atoma atoma vodika atoma halogena. U skladu s tim, može postojati ograničenje i nepredviđene mono-, tri- (u općim poli-) halogenim derivatima.
Opća formula za monogalogene derivate ugljikovodika:
i pripravak se izražava formulom
C n h 2 n +1 g
ako je R ostatak od graničnog ugljikovodika (alkana), ugljikovodični radikal (ova oznaka se također koristi dalje pri razmatranju drugih klasa organskih tvari), g je atom halogena (F, Cl, BG, i).
Alkohol - Derivati \u200b\u200bugljikovodika u kojima je jedan ili više vodikovih atoma supstituiran s hidroksilnim skupinama.
Alkoholi se nazivaju monatomskiAko imaju jednu hidroksilnu skupinu i ograničite, ako su alkanov derivati.
Opća formula za granične monatomske alkohole:
i njihov sastav se izražava općom formulom:
S n 2 n +1 ili s n 2 n +2
Primjeri polihidričnih alkohola su poznati, tj. Imajući nekoliko gngroksilnih skupina.
Fenoli - derivati \u200b\u200baromatskih ugljikovodika (redak benzena), u kojem jedan ili više vodikovih atoma u benzenskom prstenu su supstituirani s hidroksilnim skupinama.
Najjednostavniji predstavnik s formulom iz 6 h 5 naziva se fenol.
Aldehidi i ketoni - derivati \u200b\u200bugljikovodika koji sadrže karbonilnu skupinu atoma (karbonila).
U aldehidima molekule, jedna karbonilna veza je spojena na spoj s atom vodika, a drugi s ugljikovodičnim radikalom.
U slučaju ketona, karbonilna skupina je povezana s dva (u općim slučajevima različitih) radikala.
Sastav graničnih aldehida i ketona se izražava formulom s N2L O.
Karboksilne kiseline - derivati \u200b\u200bugljikovodika koji sadrže karboksilne skupine (-son).
Ako je jedna karboksilna skupina u kiseloj molekuli, tada je karboksilna kiselina monosularna. Opću formulu ograničavanja mono-abnormalnih kiselina (R-Coxy). Njihov pripravak se izražava formulom s N2NO2.
Jednostavni eteri Oni su organske tvari koje sadrže dva ugljikovodična radikala povezana s atom kisika: R-O-R ili R1 -O-R2.
Radikali mogu biti isti ili različiti. Sastav etera se izražava formulom s NH2N + 2
Osnove - spojevi formirani zamjenom vodikovog atoma karboksilne skupine u karboksilne kiseline na ugljikovodičnom radikalu.
Nitro spoj - Derivati \u200b\u200bugljikovodika u kojima je jedan ili više vodikovih atoma supstituirani na nitro skupini -N02.
Opća formula ograničenja monofime spojeva:
i sastav se izražava općom formulom
S n 2 n + 1 br. 2.
Amini - Spojevi koji se smatraju derivatima amonijaka (NN3), u kojima su atomi vodika supstituirani za ugljikovodične radikale.
Ovisno o prirodi aminskog radikala može biti alifatski i aromatičan.
Ovisno o broju vodikovih atoma supstituiranih na radikalima razlikuje:
Primarni amini s općom formulom: R-NN 2
Sekundarno - s općom formulom: R1 -NN-R2
Tercijarno - s općom formulom:
U određenom slučaju, sekundarni, kao i tercijarni amini radikali mogu biti isti.
Primarni amini se također mogu smatrati derivatima ugljikovodika (alkana), u kojima je jedan vodikov atom supstituiran na amino skupini -NN 2. Sastav graničnih primarnih amina izražena je formulom s N2N +3 N.
Aminokiseline sadrže dvije funkcionalne skupine spojene na ugljikovodični radikal: amino skupinu -NN 2 i karboksil -son.
Sastav ograničavajućih aminokiselina koji sadrže jednu amino skupinu i jedan karboksil se izražava formulom s N2N + 1 N02.
Poznati su i drugi važni organski spojevi koji imaju nekoliko različitih ili identičnih funkcionalnih skupina, dugi linearni lanci povezani s benzenskim prstenom su također poznati. U takvim slučajevima, strogo određivanje pripadnosti tvari na određenu klasu je nemoguće. Ovi spojevi se često izoliraju u specifične skupine tvari: ugljikohidrate, proteine, nukleinske kiseline, antibiotike, alkaloide itd.

Za ime organskih spojeva, koriste se 2 nomenklature - racionalni i sustavni (jupac) i trivijalna imena.
Izrada naslova na nomenklaturi Židova
1) Osnova naslova spoja je korijen riječi koja označava granični ugljikovodik s istim brojem atoma kao i glavni lanac.
2) Uževanje dodaje sufiks koji karakterizira stupanj zasićenja:
(Granica, nema više priključaka);
- (s dvostrukom obveznom);
-U (u prisutnosti trostruke veze).
Ako su više veza su donekle, tada u sufiksu je naveden broj takvih veza (-dien, -, itd.), A nakon sufiksa, potrebno je naznačiti broj višestruke komunikacije, na primjer:
CH3-CH2-CH \u003d CH2CH3-CH \u003d CH-CH3
Buten-1 buten-2
CH2 \u003d CH-CH \u003d CH2
Butadien-1,3
Takve skupine kao nitro, halogeni, ugljikovodični radikali koji nisu uključeni u glavni lanac se uzimaju u konzolu. U isto vrijeme, oni su navedeni u skladu s abecedom. Položaj supstituenta označava se znamenkom prije prefiksa.
Postupak za crtanje imena je sljedeće:
1. Pronađite najduži lanac atoma S.
2. sekvencijalno numerirani atomi ugljika glavnog lanca, počevši od najbližeg kraja.
3. Ime alkane sastoji se od imena bočnih radikala navedenih abecednim redom koji označava položaj u glavnom lancu i naslov glavnog lanca.
Nomenklatura nekih organskih tvari (trivijalno i međunarodno)