Μικρά RNA που σχηματίζουν φουρκέτες ή κοντά RNA που σχηματίζουν φουρκέτες (shRNA short φουρκέτα RNA, μικρή φουρκέτα RNA) μόρια κοντών RNA που σχηματίζουν πυκνές φουρκέτες στη δευτερογενή δομή. Τα ShRNA μπορούν να χρησιμοποιηθούν για την απενεργοποίηση της έκφρασης... ... Wikipedia
RNA πολυμεράση- από κύτταρο T. aquaticus κατά την αντιγραφή. Ορισμένα στοιχεία του ενζύμου γίνονται διαφανή και οι αλυσίδες RNA και DNA είναι πιο ευδιάκριτες. Το ιόν μαγνησίου (κίτρινο) βρίσκεται στην ενεργό θέση του ενζύμου. Η RNA πολυμεράση είναι ένα ένζυμο που εκτελεί ... ... Wikipedia
Παρεμβολή RNA- Παράδοση μικρών RNA που περιέχουν φουρκέτες χρησιμοποιώντας φορέα που βασίζεται σε φακοϊό και ο μηχανισμός παρεμβολής RNA σε κύτταρα θηλαστικών Παρεμβολή RNA (μια ... Wikipedia
γονίδιο RNA- Το μη κωδικοποιητικό RNA (ncRNA) είναι μόρια RNA που δεν μεταφράζονται σε πρωτεΐνες. Το προηγουμένως χρησιμοποιούμενο συνώνυμο, μικρό RNA (smRNA, μικρό RNA), δεν χρησιμοποιείται πλέον, καθώς ορισμένα μη κωδικοποιητικά RNA μπορεί να είναι πολύ ... ... Wikipedia
Μικρά πυρηνικά RNA- (snRNA, snRNA) μια κατηγορία RNA που βρίσκεται στον πυρήνα των ευκαρυωτικών κυττάρων. Μεταγράφονται από RNA πολυμεράση II ή RNA πολυμεράση III και εμπλέκονται σε σημαντικές διεργασίες όπως το μάτισμα (αφαίρεση ιντρονίων από ανώριμο mRNA), η ρύθμιση ... Wikipedia
Μικρά πυρηνικά RNA- (snoRNA, αγγλικά snoRNA) μια κατηγορία μικρών RNA που εμπλέκονται σε χημικές τροποποιήσεις (μεθυλίωση και ψευδουριδυλίωση) του ριβοσωμικού RNA, καθώς και του tRNA και του μικρού πυρηνικού RNA. Σύμφωνα με την ταξινόμηση MeSH, τα μικρά πυρηνικά RNA θεωρούνται υποομάδα... ... Wikipedia
μικρά πυρηνικά (πυρηνικά μικρού μοριακού βάρους) RNA- Μια εκτεταμένη ομάδα (105.106) μικρών πυρηνικών RNA (100.300 νουκλεοτίδια), που σχετίζονται με ετερογενές πυρηνικό RNA, αποτελούν μέρος των μικρών κόκκων ριβονουκλεοπρωτεΐνης του πυρήνα. Τα M.n.RNA είναι απαραίτητο συστατικό του συστήματος ματίσματος... ...
μικρά κυτταροπλασματικά RNA- Μικρά (100-300 νουκλεοτίδια) μόρια RNA που εντοπίζονται στο κυτταρόπλασμα, παρόμοια με το μικρό πυρηνικό RNA. [Arefyev V.A., Lisovenko L.A. Αγγλο-ρωσικό επεξηγηματικό λεξικό γενετικών όρων 1995 407 σελ.] Θέματα γενετική EN scyrpssμικρό κυτταροπλασματικό... ... Οδηγός Τεχνικού Μεταφραστή
μικρά πυρηνικά RNA κατηγορίας U- Μια ομάδα μικρών μορίων RNA που σχετίζονται με πρωτεΐνη (από 60 έως 400 νουκλεοτίδια) που αποτελούν σημαντικό μέρος των περιεχομένων του ματιού και εμπλέκονται στη διαδικασία εκτομής των ιντρονίων. σε 4 από τους 5 καλά μελετημένους τύπους Usn, τα U1, U2, U4 και U5 RNA είναι 5... ... Οδηγός Τεχνικού Μεταφραστή
Βιοδείκτες RNA- * Βιοδείκτες RNA * Βιοδείκτες RNA ένας τεράστιος αριθμός ανθρώπινων μεταγραφών που δεν κωδικοποιούν τη σύνθεση πρωτεϊνών (nsbRNA ή npcRNA). Στις περισσότερες περιπτώσεις, τα μικρά (miRNA, snoRNA) και τα μακρά (αντινόημα RNA, dsRNA και άλλοι τύποι) μόρια RNA είναι... ... Γενεσιολογία. εγκυκλοπαιδικό λεξικό
Βιβλία
- Αγορά για 1877 UAH (μόνο για την Ουκρανία)
- Κλινική γενετική. Εγχειρίδιο (+CD), Bochkov Nikolay Pavlovich, Puzyrev Valery Pavlovich, Smirnikhina Svetlana Anatolyevna. Όλα τα κεφάλαια έχουν αναθεωρηθεί και συμπληρωθεί σε σχέση με την ανάπτυξη της ιατρικής επιστήμης και πρακτικής. Τα κεφάλαια για τις πολυπαραγοντικές ασθένειες, την πρόληψη, τη θεραπεία των κληρονομικών ασθενειών,…
), εμποδίζοντας τη μετάφραση του mRNA στα ριβοσώματα στην πρωτεΐνη που κωδικοποιεί. Τελικά, η επίδραση του μικρού παρεμβαλλόμενου RNA είναι πανομοιότυπη με αυτή της απλής μείωσης της γονιδιακής έκφρασης.
Μικρά παρεμβαλλόμενα RNA ανακαλύφθηκαν το 1999 από την ομάδα του David Baulcombe στο Ηνωμένο Βασίλειο ως συστατικό ενός μετα-μεταγραφικού συστήματος σίγησης γονιδίων στα φυτά. PTGS, en:post-transscriptional gene silencing). Η ομάδα δημοσίευσε τα ευρήματά της στο περιοδικό Science.
Το δίκλωνο RNA μπορεί να ενισχύσει την έκφραση των γονιδίων μέσω ενός μηχανισμού που ονομάζεται ενεργοποίηση γονιδίων που εξαρτάται από το RNA. RNAa, ενεργοποίηση γονιδίου που προκαλείται από μικρό RNA). Έχει αποδειχθεί ότι τα δίκλωνα RNA που είναι συμπληρωματικά προς τους προαγωγείς των γονιδίων-στόχων προκαλούν ενεργοποίηση των αντίστοιχων γονιδίων. Η εξαρτώμενη από RNA ενεργοποίηση κατά τη χορήγηση συνθετικού δίκλωνου RNA έχει αποδειχθεί για ανθρώπινα κύτταρα. Δεν είναι γνωστό εάν παρόμοιο σύστημα υπάρχει στα κύτταρα άλλων οργανισμών.
Παρέχοντας τη δυνατότητα απενεργοποίησης ουσιαστικά οποιουδήποτε γονιδίου κατά βούληση, οι μικρές παρεμβολές RNA που βασίζονται σε RNA έχουν δημιουργήσει τεράστιο ενδιαφέρον για τη βασική και εφαρμοσμένη βιολογία. Ο αριθμός των δοκιμών ευρείας βάσης που βασίζονται σε RNAi για τον εντοπισμό σημαντικών γονιδίων σε βιοχημικές οδούς αυξάνεται. Δεδομένου ότι η ανάπτυξη ασθενειών καθορίζεται επίσης από τη δραστηριότητα των γονιδίων, αναμένεται ότι σε ορισμένες περιπτώσεις, η απενεργοποίηση ενός γονιδίου χρησιμοποιώντας μικρό παρεμβαλλόμενο RNA μπορεί να έχει θεραπευτικό αποτέλεσμα.
Ωστόσο, η εφαρμογή μικρών παρεμβολικών παρεμβολών RNA με βάση το RNA στα ζώα, και ιδιαίτερα στον άνθρωπο, αντιμετωπίζει πολλές δυσκολίες. Πειράματα έδειξαν ότι η αποτελεσματικότητα του μικρού παρεμβαλλόμενου RNA είναι διαφορετική για ΔΙΑΦΟΡΕΤΙΚΟΙ ΤΥΠΟΙκύτταρα: ορισμένα κύτταρα ανταποκρίνονται εύκολα σε μικρό παρεμβαλλόμενο RNA και παρουσιάζουν μείωση της γονιδιακής έκφρασης, ενώ σε άλλα αυτό δεν παρατηρείται, παρά την αποτελεσματική επιμόλυνση. Οι λόγοι αυτού του φαινομένου εξακολουθούν να είναι ελάχιστα κατανοητοί.
Τα αποτελέσματα από τις δοκιμές φάσης 1 των δύο πρώτων θεραπευτικών RNAi (που προορίζονται για τη θεραπεία της εκφύλισης της ωχράς κηλίδας), που δημοσιεύθηκαν στα τέλη του 2005, δείχνουν ότι τα μικρά παρεμβαλλόμενα φάρμακα RNA είναι εύκολα ανεκτά από τους ασθενείς και έχουν αποδεκτές φαρμακοκινητικές ιδιότητες.
Προκαταρκτικές κλινικές δοκιμές μικρών παρεμβαλλόμενων RNA που στοχεύουν τον ιό Έμπολα δείχνουν ότι μπορεί να είναι αποτελεσματικά για την προφύλαξη από τη νόσο μετά την έκθεση. Αυτό το φάρμακο επέτρεψε σε ολόκληρη την ομάδα των πειραματικών πρωτευόντων να επιβιώσει αφού έλαβαν μια θανατηφόρα δόση του ιού Έμπολα του Ζαΐρ
Η μεταφορά στην οποία βασίζεται το όνομα του φαινομένου παρεμβολής RNA αναφέρεται στο πείραμα με την πετούνια, όταν τα γονίδια συνθετάσης ροζ και μοβ χρωστικής χρωστικής που εισήχθησαν τεχνητά στο φυτό δεν αύξησαν την ένταση του χρώματος, αλλά, αντίθετα, τη μείωσαν. Ομοίως, σε «συνηθισμένη» παρεμβολή, η υπέρθεση δύο κυμάτων μπορεί να οδηγήσει σε αμοιβαία «ακύρωση».
Σε ένα ζωντανό κύτταρο, η ροή πληροφοριών μεταξύ του πυρήνα και του κυτταροπλάσματος δεν στεγνώνει ποτέ, αλλά η κατανόηση όλων των «στροβιλισμών» του και η αποκρυπτογράφηση των πληροφοριών που κωδικοποιούνται σε αυτό είναι πραγματικά μια ηράκλεια εργασία. Μια από τις πιο σημαντικές ανακαλύψεις στη βιολογία του περασμένου αιώνα μπορεί να θεωρηθεί η ανακάλυψη μορίων πληροφοριών (ή μήτρας) RNA (mRNA ή mRNA), τα οποία χρησιμεύουν ως ενδιάμεσοι μεταφέροντας «μηνύματα» πληροφοριών από τον πυρήνα (από τα χρωμοσώματα) στο κυτταρόπλασμα. . Ο καθοριστικός ρόλος του RNA στη σύνθεση πρωτεϊνών είχε προβλεφθεί το 1939 στο έργο των Torbjörn Caspersson, Jean Brachet και Jack Schultz και το 1971 ο George Marbaix ξεκίνησε τη σύνθεση της αιμοσφαιρίνης σε ωοκύτταρα βατράχια με έγχυση του αγγελιοφόρου κουνελιού RNA για την κωδικοποίηση αυτής της πρωτεΐνης. πρώτη φορά.
Το 1956-57 στη Σοβιετική Ένωση, ο A. N. Belozersky και ο A. S. Spirin απέδειξαν ανεξάρτητα την ύπαρξη mRNA και επίσης ανακάλυψαν ότι το μεγαλύτερο μέρος του RNA σε ένα κύτταρο δεν είναι πρότυπο, αλλά ριβοσωμικό RNA (rRNA). Το ριβοσωμικό RNA, ο δεύτερος «κύριος» τύπος κυτταρικού RNA, σχηματίζει τον «σκελετό» και το λειτουργικό κέντρο των ριβοσωμάτων σε όλους τους οργανισμούς. Είναι το rRNA (και όχι οι πρωτεΐνες) που ρυθμίζει τα κύρια στάδια της πρωτεϊνοσύνθεσης. Ταυτόχρονα, περιγράφηκε και μελετήθηκε ο τρίτος «κύριος» τύπος RNA - τα RNA μεταφοράς (tRNA), τα οποία σε συνδυασμό με δύο άλλα - mRNA και rRNA - σχηματίζουν ένα ενιαίο σύμπλεγμα πρωτεϊνοσύνθεσης. Σύμφωνα με την αρκετά δημοφιλή υπόθεση του «κόσμου RNA», ήταν αυτό το νουκλεϊκό οξύ που βρισκόταν στην ίδια την αρχή της ζωής στη Γη.
Λόγω του γεγονότος ότι το RNA είναι σημαντικά πιο υδρόφιλο σε σύγκριση με το DNA (λόγω της αντικατάστασης της δεοξυριβόζης με ριβόζη), είναι πιο ασταθές και μπορεί να κινείται σχετικά ελεύθερα στο κύτταρο, και ως εκ τούτου παρέχει βραχύβια αντίγραφα γενετικές πληροφορίες(mRNA) στη θέση όπου αρχίζει η πρωτεϊνοσύνθεση. Ωστόσο, αξίζει να σημειωθεί η "ταλαιπωρία" που σχετίζεται με αυτό - το RNA είναι πολύ ασταθές. Είναι πολύ χειρότερα αποθηκευμένο από το DNA (ακόμη και μέσα σε ένα κύτταρο) και υποβαθμίζεται με την παραμικρή αλλαγή των συνθηκών (θερμοκρασία, pH). Εκτός από τη «δική του» αστάθεια, τεράστια συμβολήανήκει στις ριβονουκλεάσες (ή RNases) - μια κατηγορία ενζύμων διάσπασης RNA που είναι πολύ σταθερά και «πανταχού παρόντα» - ακόμη και το δέρμα των χεριών του πειραματιστή περιέχει αρκετά από αυτά τα ένζυμα για να αναιρέσει ολόκληρο το πείραμα. Εξαιτίας αυτού, η εργασία με RNA είναι πολύ πιο δύσκολη από ό,τι με πρωτεΐνες ή DNA - το τελευταίο μπορεί γενικά να αποθηκευτεί για εκατοντάδες χιλιάδες χρόνια χωρίς ουσιαστικά καμία ζημιά.
Φανταστική φροντίδα κατά τη διάρκεια της εργασίας, τριαπόσταγμα, αποστειρωμένα γάντια, εργαστηριακά γυάλινα σκεύη μιας χρήσης - όλα αυτά είναι απαραίτητα για την πρόληψη της υποβάθμισης του RNA, αλλά η διατήρηση τέτοιων προτύπων δεν ήταν πάντα δυνατή. Ως εκ τούτου, για μεγάλο χρονικό διάστημα, απλά δεν έδωσαν προσοχή σε μικρά «θραύσματα» RNA, τα οποία αναπόφευκτα μόλυναν διαλύματα. Ωστόσο, με την πάροδο του χρόνου, κατέστη σαφές ότι, παρά όλες τις προσπάθειες να διατηρηθεί η στειρότητα της περιοχής εργασίας, συνέχισαν φυσικά να ανακαλύπτονται «συντρίμμια» και στη συνέχεια αποδείχθηκε ότι χιλιάδες βραχέων δίκλωνων RNAs υπάρχουν πάντα στο κυτταρόπλασμα , εκτελώντας πολύ συγκεκριμένες λειτουργίες και είναι απολύτως απαραίτητες για τη φυσιολογική ανάπτυξη των κυττάρων και του οργανισμού.
Αρχή της παρεμβολής RNA
Σήμερα, η μελέτη των μικρών ρυθμιστικών RNA είναι ένας από τους πιο ταχέως αναπτυσσόμενους τομείς ΜΟΡΙΑΚΗ ΒΙΟΛΟΓΙΑ. Ανακαλύφθηκε ότι όλα τα βραχέα RNA εκτελούν τις λειτουργίες τους με βάση ένα φαινόμενο που ονομάζεται παρεμβολή RNA (η ουσία αυτού του φαινομένου είναι η καταστολή της γονιδιακής έκφρασης στο στάδιο της μεταγραφής ή της μετάφρασης με την ενεργό συμμετοχή μικρών μορίων RNA). Ο μηχανισμός της παρεμβολής RNA φαίνεται πολύ σχηματικά στο Σχήμα 1:
Ρύζι. 1. Βασικές αρχές παρεμβολής RNA
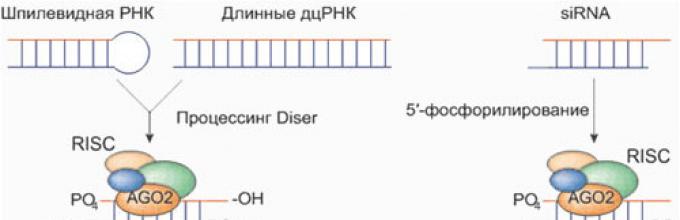
Τα μόρια δίκλωνου RNA (dsRNA) είναι ασυνήθιστα σε φυσιολογικά κύτταρα, αλλά αποτελούν ουσιαστικό βήμα στον κύκλο ζωής πολλών ιών. Μια ειδική πρωτεΐνη που ονομάζεται Dicer, έχοντας ανιχνεύσει dsRNA στο κύτταρο, το «κόβει» σε μικρά θραύσματα. Ο αντιπληροφοριακός κλώνος ενός τέτοιου θραύσματος, το οποίο μπορεί ήδη να ονομαστεί βραχύ παρεμβαλλόμενο RNA (siRNA, από το siRNA - RNA μικρής παρεμβολής), δεσμεύεται από ένα σύμπλεγμα πρωτεϊνών που ονομάζεται RISC (σύμπλεγμα σιγής που προκαλείται από RNA), το κεντρικό στοιχείο του οποίου είναι μια ενδονουκλεάση της οικογένειας των Αργοναυτών. Η σύνδεση με το siRNA ενεργοποιεί το RISC και ενεργοποιεί μια αναζήτηση στο κύτταρο για μόρια DNA και RNA που είναι συμπληρωματικά με το «πρότυπο» siRNA. Η μοίρα τέτοιων μορίων είναι να καταστραφούν ή να αδρανοποιηθούν από το σύμπλεγμα RISC.
Συνοψίζοντας, σύντομες «περικοπές» ξένου (συμπεριλαμβανομένου σκόπιμα εισαγόμενου) δίκλωνου RNA χρησιμεύουν ως «πρότυπο» για μια μεγάλης κλίμακας αναζήτηση και καταστροφή του συμπληρωματικού mRNA (και αυτό ισοδυναμεί με καταστολή της έκφρασης του αντίστοιχου γονιδίου) , όχι μόνο σε ένα κελί, αλλά και σε γειτονικά. Για πολλούς οργανισμούς -πρωτόζωα, μαλάκια, σκουλήκια, έντομα, φυτά- αυτό το φαινόμενο είναι ένας από τους κύριους τρόπους άμυνας του ανοσοποιητικού έναντι των λοιμώξεων.
Το 2006, ο Andrew Fire και ο Craig Mello έλαβαν βραβείο Νόμπελστη Φυσιολογία και την Ιατρική «Για την ανακάλυψη του φαινομένου της παρεμβολής RNA - ο μηχανισμός της γονιδιακής σίγησης με τη συμμετοχή του dsRNA». Αν και το ίδιο το φαινόμενο της παρεμβολής RNA είχε περιγραφεί πολύ πριν (στις αρχές της δεκαετίας του 1980), ήταν έργο των Fire και Mello στο γενικό περίγραμμαπροσδιόρισε τον ρυθμιστικό μηχανισμό των μικρών RNA και σκιαγράφησε μια άγνωστη μέχρι τώρα περιοχή μοριακής έρευνας. Εδώ είναι τα κύρια αποτελέσματα της δουλειάς τους:
- Κατά τη διάρκεια της παρεμβολής RNA, είναι το mRNA (και κανένα άλλο) που διασπάται.
- Το δίκλωνο RNA δρα (προκαλεί διάσπαση) πολύ πιο αποτελεσματικά από το μονόκλωνο RNA. Αυτές οι δύο παρατηρήσεις προέβλεψαν την ύπαρξη ενός εξειδικευμένου συστήματος που μεσολαβεί στη δράση του dsRNA.
- Το dsRNA, συμπληρωματικό σε ένα τμήμα ώριμου mRNA, προκαλεί διάσπαση του τελευταίου. Αυτό έδειξε τον κυτταροπλασματικό εντοπισμό της διαδικασίας και την παρουσία μιας ειδικής ενδονουκλεάσης.
- Μια μικρή ποσότητα dsRNA (πολλά μόρια ανά κύτταρο) αρκεί για να «απενεργοποιήσει» πλήρως το γονίδιο στόχο, γεγονός που υποδηλώνει την ύπαρξη ενός μηχανισμού καταρράκτη κατάλυσης ή/και ενίσχυσης.
Αυτά τα αποτελέσματα έθεσαν τα θεμέλια για έναν ολόκληρο τομέα της σύγχρονης μοριακής βιολογίας - την παρεμβολή RNA - και καθόρισαν τον φορέα εργασίας πολλών ερευνητικών ομάδων σε όλο τον κόσμο για δεκαετίες. Μέχρι σήμερα, έχουν ανακαλυφθεί τρεις μεγάλες ομάδες μικρών RNA που παίζουν στο μοριακό πεδίο ως «ομάδα παρεμβολής RNA». Ας τους γνωρίσουμε πιο αναλυτικά.
Παίκτης #1 – σύντομο παρεμβαλλόμενο RNA
Η εξειδίκευση της παρεμβολής RNA προσδιορίζεται από βραχύ παρεμβαλλόμενο RNA (siRNA) - μικρά δίκλωνα μόρια RNA με σαφώς καθορισμένη δομή (βλ. Εικ. 2).
Τα siRNA είναι τα πιο πρώιμα στην εξέλιξη και είναι πιο διαδεδομένα στα φυτά, στους μονοκύτταρους οργανισμούς και στα ασπόνδυλα. Στα σπονδυλωτά, πρακτικά δεν ανευρίσκονται κανονικά siRNA, επειδή αντικαταστάθηκαν από μεταγενέστερα «μοντέλα» βραχέων RNA (βλ. παρακάτω).
Το siRNA - «πρότυπα» για αναζήτηση στο κυτταρόπλασμα και καταστροφή μορίων mRNA - έχουν μήκος 20-25 νουκλεοτίδια και ένα «ειδικό χαρακτηριστικό»: 2 μη ζευγαρωμένα νουκλεοτίδια στα άκρα 3' και φωσφορυλιωμένα άκρα 5'. Το αντιπληροφοριακό siRNA είναι ικανό (όχι φυσικά από μόνο του, αλλά με τη βοήθεια του συμπλέγματος RISC) να αναγνωρίσει το mRNA και συγκεκριμένα να προκαλέσει την αποδόμησή του: το mRNA στόχος κόβεται στην ακριβή θέση συμπληρωματικά προς το 10ο και το 11ο νουκλεοτίδιο του αντιπληροφοριακή αλυσίδα siRNA.

Ρύζι. 2. Μηχανισμός «παρεμβολής» μεταξύ mRNA και siRNA
Τα «παρεμβαλλόμενα» βραχέα μόρια RNA μπορούν είτε να εισέλθουν στο κύτταρο από το εξωτερικό είτε να «κοπούν» στη θέση τους από μακρύτερο δίκλωνο RNA. Η κύρια πρωτεΐνη που απαιτείται για την κοπή του dsRNA είναι η ενδονουκλεάση Dicer. Η «απενεργοποίηση» του γονιδίου μέσω του μηχανισμού παρεμβολής πραγματοποιείται από το siRNA μαζί με το σύμπλεγμα πρωτεϊνών RISC, το οποίο αποτελείται από τρεις πρωτεΐνες - την ενδονουκλεάση Ago2 και δύο βοηθητικές πρωτεΐνες PACT και TRBP. Αργότερα ανακαλύφθηκε ότι τα σύμπλοκα Dicer και RISC μπορούν να χρησιμοποιήσουν ως «σπόρο» όχι μόνο dsRNA, αλλά και μονόκλωνο RNA που σχηματίζει μια δίκλωνη φουρκέτα, καθώς και έτοιμο siRNA (το τελευταίο παρακάμπτει την «κοπή» στάδιο και συνδέεται αμέσως με το RISC).
Οι λειτουργίες των siRNA στα κύτταρα ασπόνδυλων είναι αρκετά διαφορετικές. Το πρώτο και κύριο πράγμα είναι η ανοσολογική προστασία. Το «παραδοσιακό» ανοσοποιητικό σύστημα (λεμφοκύτταρα + λευκοκύτταρα + μακροφάγα) υπάρχει μόνο σε πολύπλοκους πολυκύτταρους οργανισμούς. Στους μονοκύτταρους οργανισμούς, τα ασπόνδυλα και τα φυτά (που είτε δεν έχουν τέτοιο σύστημα είτε είναι στα σπάργανα), η ανοσολογική άμυνα βασίζεται στην παρεμβολή RNA. Η ανοσία που βασίζεται σε παρεμβολή RNA δεν απαιτεί πολύπλοκα όργανα «εκπαίδευσης» για πρόδρομους ανοσοκυττάρου (σπληνός, θύμος). Ταυτόχρονα, η ποικιλία των θεωρητικά πιθανών βραχέων αλληλουχιών RNA (421 παραλλαγές) συσχετίζεται με τον αριθμό των πιθανών πρωτεϊνικών αντισωμάτων ανώτερων ζώων. Επιπλέον, τα siRNA συντίθενται με βάση το «εχθρικό» RNA που έχει μολύνει το κύτταρο, πράγμα που σημαίνει ότι, σε αντίθεση με τα αντισώματα, «προσαρμόζονται» αμέσως για έναν συγκεκριμένο τύπο μόλυνσης. Και παρόλο που η προστασία που βασίζεται στην παρεμβολή RNA δεν λειτουργεί έξω από το κύτταρο (τουλάχιστον, δεν υπάρχουν ακόμη τέτοια δεδομένα), παρέχει ενδοκυτταρική ανοσία περισσότερο από ικανοποιητικά.
Πρώτα απ 'όλα, το siRNA δημιουργεί αντιϊκή ανοσία καταστρέφοντας το mRNA ή το γονιδιωματικό RNA μολυσματικών οργανισμών (για παράδειγμα, έτσι ανακαλύφθηκαν τα siRNA στα φυτά). Η εισαγωγή του ιικού RNA προκαλεί ισχυρή ενίσχυση συγκεκριμένων siRNA με βάση το μόριο εκκινητή - το ίδιο το ιικό RNA. Επιπλέον, τα siRNA καταστέλλουν την έκφραση διαφόρων κινητών γενετικών στοιχείων (MGEs) και ως εκ τούτου παρέχουν προστασία από ενδογενείς «λοιμώξεις». Οι μεταλλάξεις στα γονίδια του συμπλέγματος RISC συχνά οδηγούν σε αυξημένη αστάθεια του γονιδιώματος λόγω της υψηλής δραστηριότητας MGE. Το siRNA μπορεί να λειτουργήσει ως περιοριστής στην έκφραση των δικών του γονιδίων, ενεργοποιώντας ως απόκριση στην υπερέκφρασή τους. Η ρύθμιση της γονιδιακής λειτουργίας μπορεί να συμβεί όχι μόνο στο επίπεδο της μετάφρασης, αλλά και κατά τη διάρκεια της μεταγραφής - μέσω της μεθυλίωσης των γονιδίων στην ιστόνη H3.
Στη σύγχρονη πειραματική βιολογία, η σημασία της παρεμβολής RNA και των βραχέων RNA δύσκολα μπορεί να υπερεκτιμηθεί. Αναπτύχθηκε μια τεχνολογία για την «απενεργοποίηση» (ή την καταστροφή) μεμονωμένων γονιδίων in vitro (σε κυτταρικές καλλιέργειες) και in vivo (σε έμβρυα), η οποία έχει ήδη γίνει de facto πρότυπο κατά τη μελέτη οποιουδήποτε γονιδίου. Μερικές φορές, ακόμη και για να καθορίσουν τον ρόλο μεμονωμένων γονιδίων σε κάποια διαδικασία, «απενεργοποιούν» συστηματικά όλα τα γονίδια με τη σειρά τους.
Οι φαρμακοποιοί ενδιαφέρθηκαν επίσης για τη δυνατότητα χρήσης του siRNA, καθώς η ικανότητα να ρυθμίζεται ειδικά η λειτουργία μεμονωμένων γονιδίων υπόσχεται πρωτόγνωρες προοπτικές στη θεραπεία μιας σειράς ασθενειών. Το μικρό μέγεθος και η υψηλή ειδικότητα δράσης υπόσχονται υψηλή αποτελεσματικότητα και χαμηλή τοξικότητα των φαρμάκων που βασίζονται σε siRNA. Ωστόσο, δεν έχει καταστεί ακόμη δυνατό να λυθεί το πρόβλημα της παροχής siRNA σε άρρωστα κύτταρα στο σώμα - αυτό οφείλεται στην ευθραυστότητα και την ευθραυστότητα αυτών των μορίων. Και παρόλο που δεκάδες ομάδες προσπαθούν τώρα να βρουν έναν τρόπο να κατευθύνουν αυτές τις «μαγικές σφαίρες» ακριβώς στον στόχο (μέσα σε άρρωστα όργανα), δεν έχουν ακόμη επιτύχει ορατή επιτυχία. Εκτός από αυτό, υπάρχουν και άλλες δυσκολίες. Για παράδειγμα, στην περίπτωση της αντιιικής θεραπείας, η υψηλή επιλεκτικότητα της δράσης του siRNA μπορεί να είναι κακό - καθώς οι ιοί μεταλλάσσονται γρήγορα, το τροποποιημένο στέλεχος θα χάσει πολύ γρήγορα την ευαισθησία στο siRNA που επιλέχθηκε στην αρχή της θεραπείας: είναι γνωστό ότι Η αντικατάσταση ενός μόνο νουκλεοτιδίου στο siRNA οδηγεί σε σημαντική μείωση της επίδρασης παρεμβολής.
Σε αυτό το σημείο αξίζει να θυμηθούμε για άλλη μια φορά - τα siRNA βρέθηκαν μόνο σε φυτά, ασπόνδυλα και μονοκύτταρους οργανισμούς. Αν και ομόλογα πρωτεϊνών για παρεμβολή RNA (Dicer, σύμπλεγμα RISC) υπάρχουν επίσης σε ανώτερα ζώα, τα siRNA δεν ανιχνεύθηκαν με συμβατικές μεθόδους. Τι έκπληξη ήταν όταν εισήχθησαν τεχνητά συνθετικά ανάλογα siRNA προκάλεσαν μια ισχυρή ειδική δοσοεξαρτώμενη επίδραση σε καλλιέργειες κυττάρων θηλαστικών! Αυτό σήμαινε ότι στα κύτταρα των σπονδυλωτών, η παρεμβολή RNA δεν αντικαταστάθηκε από πιο πολύπλοκα ανοσοποιητικά συστήματα, αλλά εξελίχθηκε μαζί με τους οργανισμούς, μετατρέποντας σε κάτι πιο «προηγμένο». Κατά συνέπεια, στα θηλαστικά ήταν απαραίτητο να αναζητηθούν όχι ακριβή ανάλογα των siRNAs, αλλά για τους εξελικτικούς διαδόχους τους.
Παίκτης #2 – microRNA
Πράγματι, με βάση τον εξελικτικά αρχαίο μηχανισμό παρεμβολής RNA, πιο ανεπτυγμένοι οργανισμοί έχουν αναπτύξει δύο εξειδικευμένα συστήματα για τον έλεγχο της λειτουργίας των γονιδίων, το καθένα χρησιμοποιώντας τη δική του ομάδα μικρών RNAs - microRNA και piRNA (Piwi-interacting RNA). Και τα δύο συστήματα εμφανίστηκαν σε σφουγγάρια και συνεντερικά και εξελίχθηκαν μαζί με αυτά, εκτοπίζοντας το siRNA και τον μηχανισμό της «γυμνής» παρεμβολής RNA. Ο ρόλος τους στην παροχή ανοσίας μειώνεται, αφού αυτή τη λειτουργία έχουν αναλάβει πιο προηγμένοι μηχανισμοί κυτταρικής ανοσίας, ιδίως το σύστημα ιντερφερόνης. Ωστόσο, αυτό το σύστημα είναι τόσο ευαίσθητο που ενεργοποιεί και το ίδιο το siRNA: η εμφάνιση μικρού δίκλωνου RNA σε ένα κύτταρο θηλαστικού ενεργοποιεί ένα «σήμα συναγερμού» (ενεργοποιεί την έκκριση ιντερφερόνης και προκαλεί την έκφραση γονιδίων που εξαρτώνται από την ιντερφερόνη, τα οποία μπλοκάρει πλήρως όλες τις μεταφραστικές διαδικασίες). Από αυτή την άποψη, ο μηχανισμός της παρεμβολής RNA σε ανώτερα ζώα διαμεσολαβείται κυρίως από microRNAs και piRNAs - μονόκλωνα μόρια με συγκεκριμένη δομή που δεν ανιχνεύονται από το σύστημα ιντερφερόνης.
Καθώς το γονιδίωμα γινόταν πιο πολύπλοκο, τα microRNA και τα piRNA εμπλέκονταν όλο και περισσότερο στη ρύθμιση της μεταγραφής και της μετάφρασης. Με τον καιρό, μετατράπηκαν σε ένα πρόσθετο, ακριβές και λεπτό σύστημα ρύθμισης του γονιδιώματος. Σε αντίθεση με το siRNA, το microRNA και το piRNA (που ανακαλύφθηκαν το 2001, βλ. Εικ. 3, Α-Β) δεν παράγονται από ξένα δίκλωνα μόρια RNA, αλλά κωδικοποιούνται αρχικά στο γονιδίωμα του οργανισμού ξενιστή.
Ο πρόδρομος του microRNA μεταγράφεται και από τους δύο κλώνους του γονιδιωματικού DNA από την RNA πολυμεράση II, με αποτέλεσμα την εμφάνιση μιας ενδιάμεσης μορφής - pri-microRNA - που φέρει τα χαρακτηριστικά του κανονικού mRNA - m7G cap και polyA ουρά. Αυτός ο πρόδρομος σχηματίζει έναν βρόχο με δύο μονόκλωνες «ουρές» και πολλά μη ζευγαρωμένα νουκλεοτίδια στο κέντρο (Εικ. 3Α). Ένας τέτοιος βρόχος υφίσταται επεξεργασία δύο σταδίων (Εικ. Β): πρώτον, η ενδονουκλεάση Drosha κόβει τις μονόκλωνες «ουρές» RNA από τη φουρκέτα, μετά την οποία η κομμένη φουρκέτα (προ-microRNA) εξάγεται στο κυτταρόπλασμα, όπου αναγνωρίζεται από τον Dicer, ο οποίος κάνει δύο ακόμη κοψίματα (ένα δίκλωνο τμήμα έχει αποκοπεί, χρωματική κωδικοποίηση στο Σχ. 3Α). Σε αυτή τη μορφή, το ώριμο microRNA, παρόμοιο με το siRNA, περιλαμβάνεται στο σύμπλεγμα RISC.
Ο μηχανισμός δράσης πολλών microRNA είναι παρόμοιος με τη δράση των siRNA: ένα βραχύ (21-25 νουκλεοτίδια) μονόκλωνο RNA ως μέρος του συμπλέγματος πρωτεϊνών RISC συνδέεται με υψηλή εξειδίκευση στη συμπληρωματική θέση στην 3'-αμετάφραστη περιοχή του το mRNA στόχο. Η δέσμευση οδηγεί στη διάσπαση του mRNA από την πρωτεΐνη Ago. Ωστόσο, η δραστηριότητα του microRNA (σε σύγκριση με το siRNA) είναι ήδη πιο διαφοροποιημένη - εάν η συμπληρωματικότητα δεν είναι απόλυτη, το mRNA στόχος μπορεί να μην αποικοδομηθεί, αλλά να αποκλειστεί μόνο αναστρέψιμα (δεν θα υπάρξει μετάφραση). Το ίδιο σύμπλεγμα RISC μπορεί επίσης να χρησιμοποιήσει τεχνητά εισαγόμενα siRNA. Αυτό εξηγεί γιατί τα siRNAs που παράγονται κατ' αναλογία με τα πρωτόζωα είναι επίσης ενεργά στα θηλαστικά.
Έτσι, μπορούμε να συμπληρώσουμε την απεικόνιση του μηχανισμού δράσης της παρεμβολής RNA σε ανώτερους (αμφίπλευρα συμμετρικούς) οργανισμούς συνδυάζοντας σε ένα σχήμα το διάγραμμα δράσης των microRNAs και των βιοτεχνολογικά εισαγόμενων siRNAs (Εικ. 3Β).
Ρύζι. 3Α: Δομή ενός δίκλωνου πρόδρομου μορίου microRNA
Κύρια χαρακτηριστικά: η παρουσία διατηρημένων ακολουθιών που σχηματίζουν μια φουρκέτα. την παρουσία ενός συμπληρωματικού αντιγράφου (microRNA*) με δύο "επιπλέον" νουκλεοτίδια στο 3' άκρο. μια συγκεκριμένη αλληλουχία (2–8 bp) που σχηματίζει μια θέση αναγνώρισης για τις ενδονουκλεάσες. Το ίδιο το microRNA επισημαίνεται με κόκκινο χρώμα - είναι αυτό που κόβει το Dicer.

Ρύζι. 3Β: Γενικός μηχανισμός επεξεργασίας microRNA και υλοποίηση της δραστηριότητάς του

Ρύζι. 3Β: Γενικευμένο σχήμα δράσης τεχνητών microRNA και siRNA
Τα τεχνητά siRNA εισάγονται στο κύτταρο χρησιμοποιώντας εξειδικευμένα πλασμίδια (στόχευση siRNA φορέα).
Λειτουργίες του microRNA
Οι φυσιολογικές λειτουργίες των microRNA είναι εξαιρετικά διαφορετικές - στην πραγματικότητα, λειτουργούν ως οι κύριοι μη πρωτεϊνικοί ρυθμιστές της οντογένεσης. Τα microRNA δεν ακυρώνουν, αλλά συμπληρώνουν το «κλασικό» σχήμα γονιδιακής ρύθμισης (επαγωγείς, καταστολείς, συμπίεση χρωματίνης κ.λπ.). Επιπλέον, η σύνθεση των ίδιων των microRNAs ρυθμίζεται πολύπλοκα (ορισμένες δεξαμενές microRNA μπορούν να ενεργοποιηθούν από ιντερφερόνες, ιντερλευκίνες, παράγοντα νέκρωσης όγκου α (TNF-α) και πολλές άλλες κυτοκίνες). Ως αποτέλεσμα, αναδύεται ένα πολυεπίπεδο δίκτυο συντονισμού μιας «ορχήστρας» χιλιάδων γονιδίων, εκπληκτικό στην πολυπλοκότητα και την ευελιξία της, αλλά αυτό δεν τελειώνει εκεί.
Τα microRNA είναι πιο «καθολικά» από τα siRNA: τα γονίδια «θάλαμος» δεν χρειάζεται να είναι 100% συμπληρωματικά - η ρύθμιση πραγματοποιείται επίσης μέσω μερικής αλληλεπίδρασης. Σήμερα, ένα από τα πιο καυτά θέματα στη μοριακή βιολογία είναι η αναζήτηση για microRNA που λειτουργούν ως εναλλακτικοί ρυθμιστές γνωστών φυσιολογικών διεργασιών. Για παράδειγμα, τα microRNA που εμπλέκονται στη ρύθμιση του κυτταρικού κύκλου και της απόπτωσης σε φυτά, Drosophila και νηματώδεις έχουν ήδη περιγραφεί. στους ανθρώπους, τα microRNA ρυθμίζουν το ανοσοποιητικό σύστημα και την ανάπτυξη αιμοποιητικών βλαστοκυττάρων. Η χρήση τεχνολογιών που βασίζονται σε βιοτσίπ (διαλογή μικροσυστοιχίας) έχει δείξει ότι ολόκληρες δεξαμενές μικρών RNA ενεργοποιούνται και απενεργοποιούνται σε διαφορετικά στάδια της κυτταρικής ζωής. Για βιολογικές διεργασίεςεντόπισε δεκάδες συγκεκριμένα microRNA, το επίπεδο έκφρασης των οποίων υπό ορισμένες συνθήκες αλλάζει χιλιάδες φορές, τονίζοντας την εξαιρετική δυνατότητα ελέγχου αυτών των διεργασιών.
Μέχρι πρόσφατα, πίστευαν ότι τα microRNA καταστέλλουν μόνο - πλήρως ή εν μέρει - το έργο των γονιδίων. Ωστόσο, πρόσφατα αποδείχθηκε ότι η δράση των microRNA μπορεί να διαφέρει ριζικά ανάλογα με την κατάσταση του κυττάρου! Σε ένα ενεργά διαιρούμενο κύτταρο, το microRNA συνδέεται με μια συμπληρωματική αλληλουχία στην περιοχή 3' του mRNA και αναστέλλει την πρωτεϊνική σύνθεση (μετάφραση). Ωστόσο, σε κατάσταση ανάπαυσης ή στρες (για παράδειγμα, όταν μεγαλώνετε σε φτωχό περιβάλλον), το ίδιο γεγονός οδηγεί στο ακριβώς αντίθετο αποτέλεσμα - αυξημένη σύνθεση της πρωτεΐνης στόχου!
Εξέλιξη του microRNA
Ο αριθμός των ποικιλιών microRNA σε ανώτερους οργανισμούς δεν έχει ακόμη πλήρως τεκμηριωθεί· σύμφωνα με ορισμένα δεδομένα, υπερβαίνει το 1% του αριθμού των γονιδίων που κωδικοποιούν πρωτεΐνες (στον άνθρωπο, για παράδειγμα, λένε ότι υπάρχουν 700 microRNA, και αυτός ο αριθμός είναι συνεχώς αυξάνεται). Τα microRNA ρυθμίζουν τη δραστηριότητα περίπου 30% όλων των γονιδίων (οι στόχοι για πολλά από αυτά δεν είναι ακόμη γνωστοί) και υπάρχουν τόσο πανταχού παρόντα όσο και ειδικά για τον ιστό μόρια - για παράδειγμα, μια τέτοια σημαντική δεξαμενή microRNA ρυθμίζει την ωρίμανση του στελέχους του αίματος κύτταρα.
Ευρύ προφίλ έκφρασης σε διαφορετικούς ιστούς διαφορετικούς οργανισμούςκαι η βιολογική αφθονία των microRNA υποδηλώνει μια εξελικτικά αρχαία προέλευση. Τα MicroRNAs ανακαλύφθηκαν για πρώτη φορά σε νηματώδεις και για μεγάλο χρονικό διάστημα πίστευαν ότι αυτά τα μόρια εμφανίζονται μόνο σε σφουγγάρια και συνεντερικά. Ωστόσο, αργότερα ανακαλύφθηκαν σε μονοκύτταρα φύκια. Είναι ενδιαφέρον ότι καθώς οι οργανισμοί γίνονται πιο περίπλοκοι, ο αριθμός και η ετερογένεια της δεξαμενής miRNA αυξάνεται επίσης. Αυτό δείχνει έμμεσα ότι η πολυπλοκότητα αυτών των οργανισμών παρέχεται, ειδικότερα, από τη λειτουργία των microRNAs. Η πιθανή εξέλιξη των miRNAs φαίνεται στην Εικ. 4.

Ρύζι. 4. Ποικιλομορφία microRNA σε διαφορετικούς οργανισμούς
Όσο υψηλότερη είναι η οργάνωση του οργανισμού, τόσο περισσότερα microRNA βρίσκονται σε αυτόν (ο αριθμός σε παρένθεση). Τα είδη στα οποία βρέθηκαν μεμονωμένα microRNA επισημαίνονται με κόκκινο χρώμα. Σύμφωνα με .
Μια σαφής εξελικτική σύνδεση μπορεί να γίνει μεταξύ του siRNA και του microRNA, με βάση τα ακόλουθα γεγονότα:
- Η δράση και των δύο τύπων είναι εναλλάξιμη και μεσολαβείται από ομόλογες πρωτεΐνες.
- Τα siRNA που εισάγονται σε κύτταρα θηλαστικών «απενεργοποιούν» ειδικά τα επιθυμητά γονίδια (παρά την ενεργοποίηση της προστασίας από ιντερφερόνη).
- microRNAs ανακαλύπτονται σε όλο και περισσότερους αρχαίους οργανισμούς.
Αυτά και άλλα δεδομένα υποδηλώνουν την προέλευση και των δύο συστημάτων από έναν κοινό «πρόγονο». Είναι επίσης ενδιαφέρον να σημειωθεί ότι η ανοσία «RNA» ως ανεξάρτητος πρόδρομος πρωτεϊνικών αντισωμάτων επιβεβαιώνει τη θεωρία της προέλευσης των πρώτων μορφών ζωής που βασίζονται στο RNA, και όχι στις πρωτεΐνες (υπενθυμίζουμε ότι αυτή είναι η αγαπημένη θεωρία του Ακαδημαϊκού A.S. Spirin) .
Ενώ υπήρχαν μόνο δύο «παίκτες» στην αρένα της μοριακής βιολογίας – το siRNA και το microRNA – ο κύριος «σκοπός» της παρεμβολής RNA φαινόταν εντελώς ξεκάθαρος. Πράγματι: ένα σύνολο ομόλογων βραχέων RNA και πρωτεϊνών σε διαφορετικούς οργανισμούς πραγματοποιεί παρόμοιες δράσεις. Καθώς οι οργανισμοί γίνονται πιο περίπλοκοι, το ίδιο συμβαίνει και με τη λειτουργικότητα.
Ωστόσο, στη διαδικασία της εξέλιξης, η φύση δημιούργησε ένα άλλο, εξελικτικά πιο πρόσφατο και εξαιρετικά εξειδικευμένο σύστημα που βασίζεται στην ίδια επιτυχημένη αρχή της παρεμβολής RNA. Μιλάμε για piRNA (piRNA, από το Piwi-interaction RNA).
Όσο πιο πολύπλοκο είναι το γονιδίωμα, τόσο πιο ανεπτυγμένος και προσαρμοσμένος είναι ο οργανισμός (ή το αντίστροφο; ;-). Ωστόσο, η αυξανόμενη πολυπλοκότητα του γονιδιώματος έχει επίσης ένα μειονέκτημα: ένα σύνθετο γενετικό σύστημα γίνεται ασταθές. Αυτό οδηγεί στην ανάγκη για μηχανισμούς υπεύθυνους για τη διατήρηση της ακεραιότητας του γονιδιώματος - διαφορετικά η αυθόρμητη «ανάμιξη» του DNA απλώς θα το απενεργοποιήσει. Τα κινητά γενετικά στοιχεία (MGEs), ένας από τους κύριους παράγοντες αστάθειας του γονιδιώματος, είναι μικρές ασταθείς περιοχές που μπορούν να μεταγραφούν αυτόνομα και να μεταναστεύσουν σε όλο το γονιδίωμα. Η ενεργοποίηση τέτοιων μετατιθέμενων στοιχείων οδηγεί σε πολλαπλές θραύσεις του DNA στα χρωμοσώματα, που μπορεί να έχουν θανατηφόρες συνέπειες.
Ο αριθμός των MGE αυξάνεται μη γραμμικά με το μέγεθος του γονιδιώματος και η δραστηριότητά τους πρέπει να περιορίζεται. Για να γίνει αυτό, τα ζώα, ξεκινώντας από συνεντερικά, χρησιμοποιούν το ίδιο φαινόμενο παρεμβολής RNA. Αυτή η λειτουργία εκτελείται επίσης από μικρά RNA, αλλά όχι από αυτά που έχουν ήδη συζητηθεί, αλλά από έναν τρίτο τύπο - τα piRNA.
«Πορτρέτο» του piRNA
Τα piRNA είναι μικρά μόρια μήκους 24-30 νουκλεοτιδίων, που κωδικοποιούνται στις κεντρομερείς και τελομερείς περιοχές του χρωμοσώματος. Οι αλληλουχίες πολλών από αυτά είναι συμπληρωματικές με γνωστά κινητά γενετικά στοιχεία, αλλά υπάρχουν πολλά άλλα piRNA που συμπίπτουν με περιοχές λειτουργικών γονιδίων ή με θραύσματα γονιδιώματος των οποίων οι λειτουργίες είναι άγνωστες.
Τα piRNA (καθώς και τα microRNA) κωδικοποιούνται και στους δύο κλώνους του γονιδιωματικού DNA. είναι πολύ μεταβλητά και ποικίλα (έως 500.000 (!) είδη σε έναν οργανισμό). Σε αντίθεση με το siRNA και το microRNA, σχηματίζονται από μία αλυσίδα με χαρακτηριστικό στοιχείο– ουρακίλη (U) στο 5’ άκρο και μεθυλιωμένο 3’ άκρο. Υπάρχουν και άλλες διαφορές:
- Σε αντίθεση με τα siRNA και τα microRNA, δεν απαιτούν επεξεργασία από το Dicer.
- Τα γονίδια piRNA είναι ενεργά μόνο στα γεννητικά κύτταρα (κατά την εμβρυογένεση) και στα γύρω ενδοθηλιακά κύτταρα.
- Η πρωτεϊνική σύνθεση του συστήματος piRNA είναι διαφορετική - αυτές είναι ενδονουκλεάσες της κατηγορίας Piwi (Piwi και Aub) και μια ξεχωριστή ποικιλία Argonaute - Ago3.
Η επεξεργασία και η δραστηριότητα των piRNAs είναι ακόμα ελάχιστα κατανοητές, αλλά είναι ήδη σαφές ότι ο μηχανισμός δράσης είναι εντελώς διαφορετικός από άλλα σύντομα RNA - σήμερα έχει προταθεί ένα μοντέλο πινγκ-πονγκ της δουλειάς τους (Εικ. 5 Α, Β).
Μηχανισμός πινγκ-πονγκ βιογένεσης piRNA

Ρύζι. 5Α: Κυτοπλασματικό μέρος της επεξεργασίας του piRNA
Η βιογένεση και η δραστηριότητα των piRNAs διαμεσολαβείται από την οικογένεια των ενδονουκλεασών Piwi (Ago3, Aub, Piwi). Η δραστηριότητα του piRNA παρέχεται και από τα μονόκλωνα μόρια piRNA - νόημα και αντι-νοηματικά - καθένα από τα οποία συνδέεται με μια συγκεκριμένη ενδονουκλεάση Piwi. Το piRNA αναγνωρίζει τη συμπληρωματική περιοχή του mRNA του τρανσποζονίου (μπλε κλώνος) και την αποκόπτει. Αυτό όχι μόνο απενεργοποιεί το τρανσποζόνιο, αλλά δημιουργεί επίσης ένα νέο piRNA (που συνδέεται με το Ago3 μέσω μεθυλίωσης του 3' άκρου από τη μεθυλάση Hen1). Αυτό το piRNA, με τη σειρά του, αναγνωρίζει το mRNA με μεταγραφές από το σύμπλεγμα πρόδρομων piRNA (κόκκινος κλώνος) - με αυτόν τον τρόπο ο κύκλος κλείνει και το επιθυμητό piRNA παράγεται ξανά.

Ρύζι. 5Β: piRNA στον πυρήνα
Εκτός από την ενδονουκλεάση Aub, η ενδονουκλεάση Piwi μπορεί επίσης να δεσμεύσει αντιπληροφοριακό piRNA. Μετά τη δέσμευση, το σύμπλοκο μεταναστεύει στον πυρήνα, όπου προκαλεί αποικοδόμηση των συμπληρωματικών μεταγραφών και αναδιάταξη της χρωματίνης, προκαλώντας καταστολή της δραστηριότητας του τρανσποζονίου.
Λειτουργίες του piRNA
Η κύρια λειτουργία του piRNA είναι να καταστέλλει τη δραστηριότητα MGE στο επίπεδο της μεταγραφής και της μετάφρασης. Πιστεύεται ότι τα piRNA είναι ενεργά μόνο κατά τη διάρκεια της εμβρυογένεσης, όταν η απρόβλεπτη ανακάτεμα του γονιδιώματος είναι ιδιαίτερα επικίνδυνη και μπορεί να οδηγήσει στο θάνατο του εμβρύου. Αυτό είναι λογικό - όταν το ανοσοποιητικό σύστημα δεν έχει αρχίσει ακόμη να λειτουργεί, τα κύτταρα του εμβρύου χρειάζονται κάποια απλή αλλά αποτελεσματική προστασία. Το έμβρυο προστατεύεται αξιόπιστα από εξωτερικά παθογόνα από τον πλακούντα (ή το κέλυφος του αυγού). Αλλά εκτός από αυτό, η άμυνα είναι επίσης απαραίτητη από ενδογενείς (εσωτερικούς) ιούς, κυρίως MGE.
Αυτός ο ρόλος του piRNA έχει επιβεβαιωθεί από την εμπειρία - «νοκ-άουτ» ή μεταλλάξεις των γονιδίων Ago3, Piwi ή Aub οδηγούν σε σοβαρές αναπτυξιακές διαταραχές (και απότομη αύξηση του αριθμού των μεταλλάξεων στο γονιδίωμα ενός τέτοιου οργανισμού) και επίσης προκαλούν υπογονιμότητα λόγω διακοπής της ανάπτυξης των γεννητικών κυττάρων.
Κατανομή και εξέλιξη των piRNAs
Τα πρώτα piRNA βρίσκονται ήδη σε θαλάσσιες ανεμώνες και σφουγγάρια. Τα φυτά προφανώς ακολούθησαν διαφορετική πορεία - πρωτεΐνες Piwi δεν βρέθηκαν σε αυτά και ο ρόλος ενός "μυγχώματος" για τρανσποζόνια εκτελείται από την ενδονουκλεάση Ago4 και το siRNA.
Σε ανώτερα ζώα, συμπεριλαμβανομένων των ανθρώπων, το σύστημα piRNA είναι πολύ καλά ανεπτυγμένο, αλλά μπορεί να βρεθεί μόνο σε εμβρυϊκά κύτταρα και στο αμνιακό ενδοθήλιο. Γιατί η κατανομή του piRNA στο σώμα είναι τόσο περιορισμένη μένει να φανεί. Μπορούμε να υποθέσουμε ότι, όπως κάθε ισχυρό όπλο, τα piRNA είναι ωφέλιμα μόνο υπό πολύ συγκεκριμένες συνθήκες (κατά την ανάπτυξη του εμβρύου) και στο σώμα των ενηλίκων η δραστηριότητά τους θα προκαλέσει περισσότερο κακό παρά καλό. Ακόμα, ο αριθμός των piRNA υπερβαίνει τον αριθμό των γνωστών πρωτεϊνών κατά μια τάξη μεγέθους και οι μη ειδικές επιδράσεις των piRNA στα ώριμα κύτταρα είναι δύσκολο να προβλεφθούν.
| siRNA | microRNA | piRNA | |
| Διάδοση | Φυτά, Δροσόφιλα, C. elegans. Δεν βρίσκεται σε σπονδυλωτά | Ευκαρυωτες | Εμβρυικά κύτταρα ζώων (ξεκινώντας από συνεντερικά). Όχι σε πρωτόζωα και φυτά |
| Μήκος | 21-22 νουκλεοτίδια | 19-25 νουκλεοτίδια | 24-30 νουκλεοτίδια |
| Δομή | Δίκλωνα, 19 συμπληρωματικά νουκλεοτίδια και δύο μη ζευγαρωμένα νουκλεοτίδια στο 3' άκρο | Σύνθετη δομή μονής αλυσίδας | Σύνθετη δομή μονής αλυσίδας. U στο 5'-τέλος, 2'- Ο-μεθυλιωμένο 3' άκρο |
| Επεξεργασία | Dicer-εξαρτώμενος | Dicer-εξαρτώμενος | Dicer-ανεξάρτητος |
| Ενδονουκλεάσες | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Δραστηριότητα | Αποικοδόμηση συμπληρωματικών mRNA, ακετυλίωση γονιδιωματικού DNA | Αποικοδόμηση ή αναστολή της μετάφρασης του mRNA στόχου | Αποικοδόμηση mRNA που κωδικοποιεί MGE, ρύθμιση μεταγραφής MGE |
| Βιολογικός ρόλος | Αντιϊκή ανοσολογική άμυνα, καταστολή της δραστηριότητας των δικών του γονιδίων | Ρύθμιση της γονιδιακής δραστηριότητας | Καταστολή της δραστηριότητας MGE κατά την εμβρυογένεση |
συμπέρασμα
Εν κατακλείδι, θα ήθελα να παράσχω έναν πίνακα που απεικονίζει την εξέλιξη της συσκευής πρωτεΐνης που εμπλέκεται στην παρεμβολή RNA (Εικ. 6). Μπορεί να φανεί ότι τα πρωτόζωα έχουν το πιο ανεπτυγμένο σύστημα siRNA (οικογένειες πρωτεϊνών Ago, Dicer) και καθώς οι οργανισμοί γίνονται πιο πολύπλοκοι, η έμφαση μετατοπίζεται σε πιο εξειδικευμένα συστήματα - τον αριθμό των ισομορφών πρωτεΐνης για microRNA (Drosha, Pasha) και piRNA ( Piwi, Hen1) αυξάνεται. Ταυτόχρονα, μειώνεται η ποικιλία των ενζύμων που μεσολαβούν στη δράση του siRNA.

Ρύζι. 6. Ποικιλομορφία πρωτεϊνών που εμπλέκονται στην παρεμβολή RNA
Και
Οι αριθμοί δείχνουν τον αριθμό των πρωτεϊνών σε κάθε ομάδα. Στοιχεία χαρακτηριστικά του siRNA και του microRNA επισημαίνονται με μπλε και οι πρωτεΐνες που σχετίζονται με το piRNA επισημαίνονται με κόκκινο. Σύμφωνα με .
Το φαινόμενο της παρεμβολής RNA άρχισε να χρησιμοποιείται από τους πιο απλούς οργανισμούς. Με βάση αυτόν τον μηχανισμό, η φύση δημιούργησε ένα πρωτότυπο του ανοσοποιητικού συστήματος και καθώς οι οργανισμοί γίνονται πιο πολύπλοκοι, η παρεμβολή RNA γίνεται ένας απαραίτητος ρυθμιστής της δραστηριότητας του γονιδιώματος. Δύο διαφορετικοί μηχανισμοί συν τρεις τύποι βραχέων RNA (βλ. συνοπτικό πίνακα) - ως αποτέλεσμα, βλέπουμε χιλιάδες λεπτούς ρυθμιστές διαφόρων μεταβολικών και γενετικών οδών. Αυτή η εντυπωσιακή εικόνα απεικονίζει την ευελιξία και την εξελικτική προσαρμογή των μοριακών βιολογικών συστημάτων. Τα σύντομα RNA αποδεικνύουν και πάλι ότι δεν υπάρχουν «μικρά πράγματα» μέσα στο κύτταρο - υπάρχουν μόνο μικρά μόρια, την πλήρη σημασία του ρόλου των οποίων μόλις αρχίζουμε να καταλαβαίνουμε.
Είναι αλήθεια ότι μια τέτοια φανταστική πολυπλοκότητα υποδηλώνει μάλλον ότι η εξέλιξη είναι «τυφλή» και δρα χωρίς προεγκεκριμένο « Κύριο σχέδιο» .
Βιβλιογραφία
- Gurdon J. B., Lane C. D., Woodland Η. R., Marbaix G. (1971). Χρήση αυγών και ωοκυττάρων βατράχου για τη μελέτη του αγγελιαφόρου RNA και τη μετάφρασή του σε ζωντανά κύτταρα. Nature 233, 177-182;
- Spirin A. S. (2001). Η Βιοσύνθεση Πρωτεϊνών, ο Κόσμος του RNA και η Προέλευση της Ζωής. Δελτίο της Ρωσικής Ακαδημίας Επιστημών 71, 320-328;
- Στοιχεία: "Ολόκληρα μιτοχονδριακά γονιδιώματα εξαφανισμένων ζώων μπορούν πλέον να εξαχθούν από τρίχες".
- Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998). Ισχυρή και ειδική γενετική παρέμβαση από δίκλωνο RNA Caenorhabditis elegans. Nature 391, 806-311;
- Βιομόριο: «MicroRNA που ανακαλύφθηκαν για πρώτη φορά σε μονοκύτταρο οργανισμό».
- Covey S., Al-Kaff Ν., Lángara Α., Turner D. (1997). Τα φυτά καταπολεμούν τη μόλυνση με γονιδιακή σίγαση. Nature 385, 781-782;
- Biomolecule: "Molecular double-dealing: τα ανθρώπινα γονίδια λειτουργούν για τον ιό της γρίπης".
- Ren B. (2010). Μεταγραφή: Οι ενισχυτές κάνουν μη κωδικοποιητικό RNA. Nature 465, 173–174;
- Taganov K.D., Boldin M.P., Chang K.J., Baltimore D. (2006). Η εξαρτώμενη από το NF-κΒ επαγωγή του microRNA miR-146, ενός αναστολέα που στοχεύει σε πρωτεΐνες σηματοδότησης εγγενών ανοσολογικών αποκρίσεων. Proc. Natl. Ακαδ. Sci. ΗΠΑ. 103, 12481-12486;
- O'Connell R. M., Rao D. S., Chaudhuri A. A., Boldin M. P., Taganov K. D., Nicoll J., Paquette R. L., Baltimore D. (2008). Η παρατεταμένη έκφραση του microRNA-155 σε αιμοποιητικά βλαστοκύτταρα προκαλεί μυελοπολλαπλασιαστική διαταραχή. J. Εχρ. Med. 205, 585-594;
- Βιομόριο: "microRNA - όσο πιο μακριά στο δάσος, τόσο περισσότερα καυσόξυλα";
- Στοιχεία: «Η επιπλοκή του σώματος στα αρχαία ζώα συνδέθηκε με την εμφάνιση νέων ρυθμιστικών μορίων».
- Grimson A., Srivastava M., Fahey B., Woodcroft B.J., Chiang H.R., King N., Degnan B.M., Rokhsar D.S., Bartel D.P. (2008). Πρώιμη προέλευση και εξέλιξη των microRNA και των RNA που αλληλεπιδρούν με Piwi σε ζώα. Nature 455, 1193–1197.
- Aravin A., Hannon G., Brennecke J. (2007). Το μονοπάτι Piwi-piRNA παρέχει μια προσαρμοστική άμυνα στον αγώνα όπλων με transposon. Science 318, 761–764;
- Βιομόριο: "
Άρθρο για τον διαγωνισμό «bio/mol/text»: Τα τελευταία χρόνια, το RNA - και ειδικά οι «μη κλασικές» ποικιλίες του - έχει προσελκύσει την προσοχή των βιολόγων σε όλο τον κόσμο. Αποδείχθηκε ότι η ρύθμιση από μη κωδικοποιητικά RNA είναι ευρέως διαδεδομένη - από ιούς και βακτήρια μέχρι τον άνθρωπο. Η μελέτη της ποικιλομορφίας των μικρών ρυθμιστών RNA βακτηρίων έχει αποδείξει ξεκάθαρα τον σημαντικό ρόλο τους τόσο στον ενδιάμεσο μεταβολισμό όσο και στις προσαρμοστικές αποκρίσεις. Αυτό το άρθρο περιγράφει τους τύπους μικρών RNA βακτηρίων και τους ρυθμιστικούς μηχανισμούς που πραγματοποιούνται με τη βοήθειά τους. Ιδιαίτερη έμφαση δίνεται στον ρόλο αυτών των μορίων στη ζωή των βακτηριακών παραγόντων που προκαλούν ιδιαίτερα επικίνδυνες λοιμώξεις.
RNA: περισσότερα από ένα αντίγραφο DNA
Οι περισσότεροι αναγνώστες αυτού του ιστότοπου γνωρίζουν τους βασικούς μηχανισμούς ενός ζωντανού κυττάρου από το σχολείο. Στα μαθήματα βιολογίας, από τους νόμους του Mendel έως τα έργα αιχμής για την αλληλουχία του γονιδιώματος, το κόκκινο νήμα διατρέχει την ιδέα ενός σημαντικού γενετικού προγράμματος για την ανάπτυξη ενός οργανισμού, γνωστό στους επαγγελματίες βιολόγους ως κεντρικό δόγμα της μοριακής βιολογίας. Δηλώνει ότι το μόριο DNA δρα ως φορέας και φύλακας της γενετικής πληροφορίας, η οποία, μέσω ενός ενδιάμεσου - αγγελιοφόρου RNA (mRNA), και με τη συμμετοχή του ριβοσωμικού (rRNA) και του RNA μεταφοράς (tRNA), - πραγματοποιείται με τη μορφή πρωτεϊνών. Τα τελευταία καθορίζουν το είδος και τον ατομικό φαινότυπο.
Αυτή η κατάσταση και η ανάθεση του RNA στο ρόλο ενός δευτερεύοντος συμμετέχοντος στη μοριακή απόδοση παρέμεινε στην επιστημονική κοινότητα μέχρι τη δεκαετία του '80 του περασμένου αιώνα. Η εργασία του T. Chek, ο οποίος έδειξε ότι το RNA μπορεί να λειτουργήσει ως καταλύτης, μας ανάγκασε να ρίξουμε μια πιο προσεκτική ματιά στο RNA χημικές αντιδράσεις. Παλαιότερα, πίστευαν ότι η επιτάχυνση των χημικών διεργασιών σε ένα κύτταρο είναι προνόμιο των ενζύμων που είναι αποκλειστικά πρωτεϊνικής φύσης. Η ανακάλυψη της καταλυτικής δραστηριότητας στο RNA είχε εκτεταμένες συνέπειες - μαζί με τις προηγούμενες θεωρητικές εργασίες του K. Woese και κατέστησε δυνατή τη δημιουργία μιας πιθανής εικόνας της εξέλιξης των πρεβιοτικών στον πλανήτη μας. Γεγονός είναι ότι από την ανακάλυψη της λειτουργίας του DNA ως φορέα γενετικής πληροφορίας, το δίλημμα αυτού που εμφανίστηκε νωρίτερα στην πορεία της εξέλιξης - DNA ή η πρωτεΐνη που είναι απαραίτητη για την αναπαραγωγή του DNA - φαινόταν σχεδόν τόσο φιλοσοφικό (δηλαδή, άσκοπο) ως το ερώτημα για την υπεροχή της εμφάνισης του κοτόπουλου ή του αυγού. Μετά την ανακάλυψη του T. Chek, η λύση πήρε πολύ πραγματικό σχήμα - βρέθηκε ένα μόριο που είχε τις ιδιότητες τόσο ενός φορέα πληροφοριών όσο και ενός βιοκαταλύτη (αν και στην υποτυπώδη μορφή του). Με τον καιρό, αυτές οι μελέτες εξελίχθηκαν σε μια ολόκληρη κατεύθυνση στη βιολογία, μελετώντας την προέλευση της ζωής μέσα από το πρίσμα του λεγόμενου «κόσμου RNA».
Έτσι έγινε φανερό ότι αρχαίος κόσμοςΤο RNA θα μπορούσε να σχετίζεται με την προέλευση και την άνθηση της πρωτογενούς ζωής. Ωστόσο, δεν προκύπτει αυτόματα από αυτό ότι το RNA στους σύγχρονους οργανισμούς δεν είναι ένας αρχαϊσμός προσαρμοσμένος στις ανάγκες των ενδοκυτταρικών μοριακών συστημάτων, αλλά ένας πραγματικά σημαντικός συμμετέχων στο μοριακό σύνολο του κυττάρου. Μόνο η ανάπτυξη μοριακών μεθόδων - ειδικότερα, η αλληλούχιση νουκλεϊκά οξέα, - έδειξε ότι το RNA είναι πραγματικά απαραίτητο στο κύτταρο, και όχι μόνο με τη μορφή της κανονικής τριάδας «mRNA, rRNA, tRNA». Ήδη τα πρώτα εκτεταμένα δεδομένα για την αλληλουχία του DNA έδειχναν ένα γεγονός που στην αρχή φαινόταν δύσκολο να εξηγηθεί - τα περισσότερα αποδείχθηκαν ότι ήταν μη κωδικοποίηση- δηλαδή, μη μεταφορά πληροφοριών σχετικά με μόρια πρωτεΐνης ή «τυποποιημένο» RNA. Φυσικά, αυτό μπορεί να αποδοθεί εν μέρει σε «γενετικά υπολείμματα» - «απενεργοποιημένα» ή χαμένα θραύσματα γονιδιώματος. Αλλά η εξοικονόμηση ενός τέτοιου ποσού «προίκας» για βιολογικά συστήματα που προσπαθούν να ξοδέψουν ενέργεια με φειδώ φαίνεται παράλογη.
Πράγματι, πιο λεπτομερείς και λεπτές ερευνητικές μέθοδοι κατέστησαν δυνατή την ανακάλυψη μιας ολόκληρης κατηγορίας ρυθμιστών RNA γονιδιακής έκφρασης, που γεμίζουν εν μέρει τον διαγονιδιακό χώρο. Ακόμη και πριν διαβάσετε τις πλήρεις αλληλουχίες των ευκαρυωτικών γονιδιωμάτων σε στρογγυλούς σκώληκες C. elegansΑπομονώθηκαν microRNAs - μικρά μόρια (περίπου 20 νουκλεοτίδια) που μπορούν να συνδεθούν ειδικά σε περιοχές του mRNA σύμφωνα με την αρχή της συμπληρωματικότητας. Είναι εύκολο να μαντέψει κανείς ότι σε τέτοιες περιπτώσεις δεν είναι πλέον δυνατή η ανάγνωση πληροφοριών σχετικά με τις κωδικοποιημένες πρωτεΐνες με mRNA: το ριβόσωμα απλά δεν μπορεί να «τρέξει» μέσα από μια τέτοια θέση που ξαφνικά έχει γίνει δίκλωνο. Αυτός ο μηχανισμός καταστολής της γονιδιακής έκφρασης, που ονομάζεται Παρεμβολή RNA, έχει ήδη αναλυθεί σχετικά με το «βιομόριο» με αρκετή λεπτομέρεια. Μέχρι σήμερα έχουν ανακαλυφθεί χιλιάδες μόρια microRNA και άλλα μη κωδικοποιητικά RNA (piRNA, snoRNA, nanoRNA κ.λπ.). Στους ευκαρυώτες (συμπεριλαμβανομένων των ανθρώπων), βρίσκονται σε διαγονιδιακές περιοχές. Ο σημαντικός τους ρόλος στη διαφοροποίηση των κυττάρων, την καρκινογένεση, την ανοσοαπόκριση και άλλες διεργασίες και παθολογίες έχει αποδειχθεί.
Τα μικρά RNA είναι ένας δούρειος ίππος για τις βακτηριακές πρωτεΐνες
Παρά το γεγονός ότι τα RNA που δεν κωδικοποιούν πρωτεΐνες σε βακτήρια έχουν ανακαλυφθεί πολλά νωρίτερα από την πρώτηπαρόμοιοι ρυθμιστές σε ευκαρυώτες, ο ρόλος τους στο μεταβολισμό των βακτηριακών κυττάρων έχει από καιρό καλυφθεί για την επιστημονική κοινότητα. Αυτό είναι κατανοητό - παραδοσιακά, το βακτηριακό κύτταρο θεωρήθηκε μια πιο πρωτόγονη και λιγότερο μυστηριώδης δομή για τον ερευνητή, η πολυπλοκότητα της οποίας δεν μπορεί να συγκριθεί με τη συσσώρευση δομών σε ένα ευκαρυωτικό κύτταρο. Επιπλέον, στα βακτηριακά γονιδιώματα το περιεχόμενο των μη κωδικοποιητικών πληροφοριών αποτελεί μόνο ένα μικρό ποσοστό του συνολικού μήκους του DNA, φτάνοντας το μέγιστο 40% σε ορισμένα μυκοβακτήρια. Όμως, δεδομένου ότι τα microRNA βρίσκονται ακόμη και σε ιούς, στα βακτήρια θα πρέπει να παίζουν σημαντικό ρυθμιστικό ρόλο, ακόμη περισσότερο.
Αποδείχθηκε ότι τα προκαρυωτικά έχουν πολλούς μικρούς ρυθμιστές RNA. Συμβατικά, όλα μπορούν να χωριστούν σε δύο ομάδες:
- Μόρια RNA που πρέπει να συνδεθούν με πρωτεΐνες για να εκτελέσουν τη λειτουργία τους.
- RNA που συνδέονται συμπληρωματικά με άλλα RNA (αποτελούν την πλειοψηφία των γνωστών ρυθμιστικών μορίων RNA).
Η πρώτη ομάδα περιλαμβάνει μικρά RNA για τα οποία η δέσμευση πρωτεΐνης είναι δυνατή, αλλά όχι απαραίτητη. Ένα πολύ γνωστό παράδειγμα είναι η RNase P, η οποία δρα ως ριβοένζυμο στο tRNA που «ωριμάζει». Ωστόσο, εάν η RNase P μπορεί να λειτουργήσει χωρίς συστατικό πρωτεΐνης, τότε για άλλα μικρά RNA αυτής της ομάδας, η σύνδεση με την πρωτεΐνη είναι υποχρεωτική (και τα ίδια είναι, στην πραγματικότητα, συμπαράγοντες). Για παράδειγμα, το tmRNA ενεργοποιεί ένα σύμπλοκο πρωτεϊνικό σύμπλεγμα, το οποίο λειτουργεί ως «κύριο κλειδί» για ένα «κολλημένο» ριβόσωμα - εάν το αγγελιαφόρο RNA από το οποίο διαβάζεται έχει φτάσει στο τέλος του και το κωδικόνιο λήξης δεν έχει συναντηθεί.
Ένας ακόμη πιο συναρπαστικός μηχανισμός άμεσης αλληλεπίδρασης μικρών RNA με πρωτεΐνες είναι επίσης γνωστός. Οι πρωτεΐνες που συνδέονται με τα «παραδοσιακά» νουκλεϊκά οξέα είναι ευρέως κατανεμημένες σε οποιοδήποτε κύτταρο. Το προκαρυωτικό κύτταρο δεν αποτελεί εξαίρεση. Για παράδειγμα, οι πρωτεΐνες του που μοιάζουν με ιστόνη βοηθούν στη σωστή συσκευασία του κλώνου του DNA και συγκεκριμένες πρωτεΐνες καταστολέα έχουν συγγένεια με την περιοχή χειριστή των βακτηριακών γονιδίων. Έχει αποδειχθεί ότι αυτοί οι καταστολείς μπορούν να ανασταλούν από μικρά RNA που μιμούνται θέσεις δέσμευσης DNA «εγγενείς» για αυτές τις πρωτεΐνες. Έτσι, στο μικρό RNA CsrB (Εικ. 1) υπάρχουν 18 θέσεις «δόλωμα» που χρησιμεύουν για να εμποδίσουν την πρωτεΐνη καταστολέα CsrA να φτάσει στον πραγματικό της στόχο - το οπερόνιο γλυκογόνου. Παρεμπιπτόντως, μεταξύ των πρωτεϊνών καταστολέα που χάνονται λόγω τέτοιων μικρών RNA, υπάρχουν ρυθμιστές των παγκόσμιων μεταβολικών οδών, γεγονός που καθιστά δυνατή την επανειλημμένη ενίσχυση του ανασταλτικού σήματος του μικρού RNA. Για παράδειγμα, το κάνει αυτό μικρό RNA 6S, «μιμείται» τον πρωτεϊνικό παράγοντα σ 70. Με τη διαμορφωτική «εξαπάτηση», καταλαμβάνοντας τα κέντρα δέσμευσης της RNA πολυμεράσης με τον παράγοντα σίγμα, απαγορεύει την έκφραση των γονιδίων «οικιακής φροντίδας».
Εικόνα 1. Βιοπληροφορικά προβλεπόμενη δευτερογενής δομή του μικρού RNA CsrB από Vibrio choleraeΜ66-2.Τα μικρά RNA είναι μονόκλωνα μόρια, αλλά, όπως και για άλλα RNA, η αναδίπλωση σε μια σταθερή χωρική δομή συνοδεύεται από το σχηματισμό περιοχών όπου το μόριο υβριδοποιείται με τον εαυτό του. Ονομάζονται πολυάριθμες στροφές στη δομή με τη μορφή ανοιχτών δακτυλίων γόβα στιλέτο. Σε ορισμένες περιπτώσεις, ένας συνδυασμός φουρκέτες επιτρέπει στο RNA να λειτουργεί ως «σφουγγάρι», δεσμεύοντας μη ομοιοπολικά ορισμένες πρωτεΐνες. Αλλά πιο συχνά, μόρια αυτού του τύπου παρεμβαίνουν στο DNA ή το RNA. Σε αυτή την περίπτωση, η χωρική δομή του μικρού RNA διαταράσσεται και σχηματίζονται νέες θέσεις υβριδισμού με το μόριο στόχο. Ο χάρτης θερμότητας αντανακλά την πιθανότητα ότι το αντίστοιχο ζεύγος νουκλεοτιδίων θα συνδεθεί πράγματι με έναν ενδομοριακό δεσμό υδρογόνου. για μη ζευγαρωμένες τομές - η πιθανότητα σχηματισμού δεσμών υδρογόνου με τυχόν τμήματα μέσα στο μόριο. Η εικόνα λήφθηκε χρησιμοποιώντας το πρόγραμμα RNAfold.
Μικρά RNA βακτηρίων παρεμβαίνουν... και μάλιστα με μεγάλη επιτυχία!
Ο μηχανισμός με τον οποίο λειτουργούν οι ρυθμιστές της δεύτερης ομάδας είναι, γενικά, παρόμοιος με εκείνον των ρυθμιστικών RNA στους ευκαρυώτες - πρόκειται για την ίδια παρεμβολή RNA μέσω υβριδισμού με mRNA, μόνο που οι ίδιες οι αλυσίδες των μικρών RNA είναι συχνά μεγαλύτερες - έως και αρκετές εκατοντάδες νουκλεοτίδια ( εκ.ρύζι. 1). Ως αποτέλεσμα, λόγω του μικρού RNA, τα ριβοσώματα δεν μπορούν να διαβάσουν πληροφορίες από το mRNA. Αν και συχνά, φαίνεται, δεν καταλήγει σε αυτό: τα προκύπτοντα σύμπλοκα «μικρού RNA - mRNA» γίνονται στόχος των RNases (όπως η RNase P).
Η συμπαγής πυκνότητα και η πυκνότητα του προκαρυωτικού γονιδιώματος γίνεται αισθητή: εάν στους ευκαρυωτικούς τα περισσότερα ρυθμιστικά RNA είναι γραμμένα σε χωριστούς τόπους (τις περισσότερες φορές δεν κωδικοποιούν πρωτεΐνες), τότε πολλά μικρά RNA βακτηρίων μπορούν να κωδικοποιηθούν στην ίδια περιοχή DNA με τα κατασταλμένα γονίδιο, αλλά στις αντίθετες αλυσίδες! Αυτά τα RNA ονομάζονται cis-κωδικοποιημένη(αντινόημα) και μικρά RNA που βρίσκονται σε κάποια απόσταση από το κατασταλμένο τμήμα του DNA - δια-κωδικοποιημένα. Προφανώς, η διάταξη των cis-RNA μπορεί να θεωρηθεί θρίαμβος της εργονομίας: μπορούν να διαβαστούν από τον αντίθετο κλώνο DNA τη στιγμή της εκτύλιξής του ταυτόχρονα με το μεταγράφημα στόχου, γεγονός που καθιστά δυνατό τον ακριβή έλεγχο της ποσότητας της πρωτεΐνης που συντίθεται.
Τα μικρά RNA στο trans εξελίσσονται ανεξάρτητα από το mRNA στόχο και η αλληλουχία του ρυθμιστή αλλάζει πιο έντονα ως αποτέλεσμα μεταλλάξεων. Ίσως αυτή η διάταξη είναι ωφέλιμη μόνο για το βακτηριακό κύτταρο, καθώς το μικρό RNA αποκτά δραστηριότητα έναντι προηγουμένως ασυνήθιστων στόχων, γεγονός που μειώνει το κόστος χρόνου και ενέργειας για τη δημιουργία άλλων ρυθμιστών. Από την άλλη πλευρά, η πίεση επιλογής εμποδίζει το trans-μικρό RNA να μεταλλάσσεται υπερβολικά επειδή θα χάσει τη δραστηριότητα. Ωστόσο, για να υβριδοποιηθούν με αγγελιοφόρο RNA, τα περισσότερα trans-μικρά RNA απαιτούν έναν βοηθό, την πρωτεΐνη Hfq. Προφανώς, διαφορετικά, η ατελής συμπληρωματικότητα του μικρού RNA μπορεί να δημιουργήσει προβλήματα για τη σύνδεση με τον στόχο.
Προφανώς, ο πιθανός ρυθμιστικός μηχανισμός που βασίζεται στην αρχή «ένα μικρό RNA - πολλοί στόχοι» βοηθά στην ενοποίηση των μεταβολικών δικτύων του βακτηρίου, κάτι που είναι εξαιρετικά απαραίτητο σε συνθήκες σύντομης μονοκυτταρικής ζωής. Κάποιος μπορεί να συνεχίσει να κάνει εικασίες για το θέμα και να υποθέσει ότι με τη βοήθεια trans-κωδικοποιημένων μικρών RNA, αποστέλλονται «οδηγίες» έκφρασης από λειτουργικά συγγενείς, αλλά φυσικά απομακρυσμένους τόπους. Η ανάγκη για αυτό το είδος γενετικής «ονομαστικής κλήσης» εξηγείται λογικά ένας μεγάλος αριθμός απόμικρά RNA που βρίσκονται σε παθογόνα βακτήρια. Για παράδειγμα, αρκετές εκατοντάδες μικρά RNA βρέθηκαν στον κάτοχο ρεκόρ για αυτόν τον δείκτη - Vibrio cholerae ( Vibrio cholerae). Αυτός είναι ένας μικροοργανισμός που μπορεί να επιβιώσει στο περιβάλλον υδάτινο περιβάλλον (τόσο φρέσκο όσο και αλμυρό), και σε υδρόβια οστρακοειδή, και σε ψάρια και στα έντερα του ανθρώπου - δεν υπάρχει τρόπος χωρίς περίπλοκη προσαρμογή με τη βοήθεια ρυθμιστικών μορίων!
Το CRISPR προστατεύει την υγεία των βακτηρίων
Μικρά RNA έχουν επίσης χρησιμοποιηθεί για την επίλυση ενός άλλου πιεστικού προβλήματος για τα βακτήρια. Ακόμη και οι πιο κακόβουλοι παθογόνοι κόκκοι και βάκιλοι μπορεί να είναι ανίσχυροι μπροστά στον κίνδυνο που ενέχουν ειδικοί ιοί - βακτηριοφάγοι, ικανοί να καταστρέψουν τον βακτηριακό πληθυσμό με αστραπιαία ταχύτητα. Οι πολυκύτταροι οργανισμοί διαθέτουν ένα εξειδικευμένο σύστημα προστασίας από ιούς - απρόσβλητος, μέσω των κυττάρων και των ουσιών που εκκρίνουν, προστατεύοντας τον οργανισμό απρόσκλητους επισκέπτες(συμπεριλαμβανομένων εκείνων ιογενούς φύσης). Ένα βακτηριακό κύτταρο είναι μοναχικό, αλλά δεν είναι τόσο ευάλωτο όσο μπορεί να φαίνεται με την πρώτη ματιά. Οι τόποι ενεργούν ως φύλακες των συνταγών για τη διατήρηση της αντιϊκής ανοσίας των βακτηρίων CRISPR- ομαδοποιημένες κανονικές-διακεκομμένες σύντομες παλινδρομικές επαναλήψεις ( ομαδοποιούνται τακτικά διακεκομμένες σύντομες παλινδρομικές επαναλήψεις) (Εικ. 2; ). Στα προκαρυωτικά γονιδιώματα, κάθε κασέτα CRISPR αντιπροσωπεύεται από μια αλληλουχία οδηγού μήκους αρκετών εκατοντάδων νουκλεοτιδίων, ακολουθούμενη από μια σειρά 2-24 (μερικές φορές έως και 400) επαναλήψεων που χωρίζονται από διαχωριστικές περιοχές που είναι παρόμοιες σε μήκος αλλά μοναδικές σε αλληλουχία νουκλεοτιδίων. Το μήκος κάθε διαχωριστή και επανάληψης δεν υπερβαίνει τα εκατό ζεύγη βάσεων.

Σχήμα 2. Τόπος CRISPR και επεξεργασία του αντίστοιχου μικρού του RNA σε ένα λειτουργικό αντίγραφο.Στο γονιδίωμα CRISPR- η κασέτα αντιπροσωπεύεται από αποστάτες διάσπαρτους μεταξύ τους (στο σχήμα χαρακτηρίζονται ως Sp), εν μέρει ομόλογη με περιοχές του DNA φάγου και επαναλαμβάνει ( Με) Μήκος 24–48 bp, που δείχνει δυαδική συμμετρία. Σε αντίθεση με τις επαναλήψεις, οι διαχωριστές στον ίδιο τόπο έχουν το ίδιο μήκος (σε διαφορετικά βακτήρια αυτό μπορεί να είναι 20-70 νουκλεοτίδια), αλλά διαφέρουν ως προς την αλληλουχία νουκλεοτιδίων. Οι ενότητες "spacer-repeat" μπορεί να είναι αρκετά μεγάλες και να αποτελούνται από αρκετές εκατοντάδες μονάδες. Ολόκληρη η δομή πλαισιώνεται στη μία πλευρά από μια ακολουθία οδηγών ( LP, αρκετές εκατοντάδες ζεύγη βάσεων). Τα γονίδια Cas βρίσκονται κοντά ( ντο RISPR-όπως καισυσχετισμένο), οργανωμένο σε οπερόνιο. Οι πρωτεΐνες που διαβάζονται από αυτές εκτελούν έναν αριθμό βοηθητικών λειτουργιών, παρέχοντας επεξεργασία της μεταγραφής που διαβάζεται από CRISPR-τόπος, ο επιτυχής υβριδισμός του με τον στόχο DNA του φάγου, η εισαγωγή νέων στοιχείων στον τόπο κ.λπ. Το CrRNA που σχηματίζεται ως αποτέλεσμα της επεξεργασίας πολλαπλών σταδίων υβριδοποιείται με ένα τμήμα DNA (κάτω μέρος του σχήματος) που εγχέεται από τον φάγο στο βακτήριο. Αυτό αποσιωπά τη μηχανή μεταγραφής του ιού και σταματά την αναπαραγωγή του στο προκαρυωτικό κύτταρο.
Λεπτομερής μηχανισμός για την ανάδυση των πάντων CRISPR-ο τόπος μένει να μελετηθεί. Σήμερα όμως, έχει προταθεί ένα σχηματικό διάγραμμα της εμφάνισης των διαχωριστών, των σημαντικότερων δομών στη σύνθεσή του. Αποδεικνύεται ότι οι «κυνηγοί βακτηρίων» χτυπιούνται από τα δικά τους όπλα - νουκλεϊκά οξέα, ή μάλλον, «τρόπαια» γενετικές πληροφορίες που έλαβαν βακτήρια από φάγους σε προηγούμενες μάχες! Το γεγονός είναι ότι δεν αποδεικνύονται θανατηφόροι όλοι οι φάγοι που εισέρχονται σε ένα βακτηριακό κύτταρο. Το DNA τέτοιων φάγων (πιθανώς ταξινομημένων ως εύκρατων) κόβεται από ειδικές πρωτεΐνες Cas (πλευρά γονιδίων τους CRISPR) σε μικρά θραύσματα. Μερικά από αυτά τα θραύσματα θα ενσωματωθούν CRISPR- τόποι του γονιδιώματος «ξενιστή». Και όταν το DNA του φάγου εισέλθει ξανά στο βακτηριακό κύτταρο, συναντά μικρό RNA από CRISPR-τόπος, εκείνη τη στιγμή που εκφράζεται και υποβάλλεται σε επεξεργασία από πρωτεΐνες Cas. Μετά από αυτό, η αδρανοποίηση της ιικής γενετικής πληροφορίας λαμβάνει χώρα σύμφωνα με τον μηχανισμό παρεμβολής RNA που ήδη περιγράφηκε παραπάνω.
Από την υπόθεση του σχηματισμού διαχωριστών, δεν είναι σαφές γιατί χρειάζονται επαναλήψεις μεταξύ τους, εντός ενός τόπου ελαφρώς διαφορετικού μήκους, αλλά σχεδόν πανομοιότυπων σε σειρά; Ανοίγει εδώ ευρύχωρος χώροςγια φαντασία. Ίσως, χωρίς επαναλήψεις, θα ήταν προβληματικό να χωρίσουμε τα γενετικά δεδομένα σε σημασιολογικά τμήματα, παρόμοια με τομείς σε έναν σκληρό δίσκο υπολογιστή, και στη συνέχεια να αποκτήσουμε πρόσβαση στο μηχάνημα μεταγραφής σε αυστηρά καθορισμένες περιοχές CRISPR-Ο τόπος θα γίνει δύσκολος; Ή μήπως οι επαναλήψεις απλοποιούν τις διαδικασίες ανασυνδυασμού όταν εισάγονται νέα στοιχεία DNA φάγου; Ή μήπως είναι «σημεία στίξης» που είναι απαραίτητα για την επεξεργασία CRISPR; Όπως και να έχει, ένας βιολογικός λόγος που εξηγεί τη συμπεριφορά ενός βακτηριακού κυττάρου με τον τρόπο του Πλιούσκιν του Γκόγκολ θα βρεθεί σε εύθετο χρόνο.
CRISPR, όντας ένα «χρονικό» της σχέσης μεταξύ ενός βακτηρίου και ενός φάγου, μπορεί να χρησιμοποιηθεί σε φυλογενετικές μελέτες. Έτσι, πρόσφατα πραγματοποιήθηκε πληκτρολόγηση σύμφωνα με CRISPRμας επέτρεψε να δούμε την εξέλιξη μεμονωμένων στελεχών του μικροβίου της πανώλης ( Yersinia pestis). Ερευνήστε τα CRISPR- Οι «γενεαλογίες» ρίχνουν φως σε γεγονότα πριν από μισή χιλιετία, όταν στελέχη εισήλθαν στη Μογγολία από τη σημερινή Κίνα. Αλλά όχι για όλα τα βακτήρια, και ιδιαίτερα τα παθογόνα, αυτή τη μέθοδοεφαρμόσιμος. Παρά τις πρόσφατες ενδείξεις για τις προβλεπόμενες πρωτεΐνες επεξεργασίας CRISPR σε παθογόνα της τουλαραιμίας ( Francisella tularensis) και τη χολέρα, τα ίδια τα CRISPR, αν υπάρχουν στο γονιδίωμά τους, είναι λίγα σε αριθμό. Ίσως οι φάγοι, δεδομένης της θετικής συμβολής τους στην απόκτηση λοιμογόνου δράσης από παθογόνους εκπροσώπους του βακτηριακού βασιλείου, δεν είναι τόσο επιβλαβείς και επικίνδυνοι για να αμυνθούν εναντίον τους χρησιμοποιώντας το CRISPR; Ή μήπως οι ιοί που επιτίθενται σε αυτά τα βακτήρια είναι πολύ διαφορετικοί και η στρατηγική της «παρέμβασης» της ανοσίας του RNA εναντίον τους είναι μάταιη;

Εικόνα 3. Μερικοί μηχανισμοί λειτουργίας του ριβοδιακόπτη.Οι Riboswitches (riboswitches) είναι ενσωματωμένοι στο αγγελιαφόρο RNA, αλλά χαρακτηρίζονται από μεγάλη ελευθερία διαμορφωτικής συμπεριφοράς, ανάλογα με συγκεκριμένους συνδετήρες, γεγονός που δίνει λόγους να θεωρηθούν οι riboswitches ως ανεξάρτητες μονάδες μικρών RNA. Μια αλλαγή στη διαμόρφωση της πλατφόρμας έκφρασης επηρεάζει τη θέση προσγείωσης του ριβοσώματος στο mRNA ( RBS), και, κατά συνέπεια, καθορίζει τη διαθεσιμότητα όλου του mRNA για ανάγνωση. Οι Riboswitches είναι σε κάποιο βαθμό παρόμοιοι με τον τομέα χειριστή στο κλασικό μοντέλο λάκκα-οπερόνιο - αλλά μόνο οι περιοχές απταμερούς συνήθως ρυθμίζονται από ουσίες χαμηλού μοριακού βάρους και διακόπτουν τη λειτουργία του γονιδίου στο επίπεδο του mRNA, όχι του DNA. ΕΝΑ - Ελλείψει συνδέτη, ριβοδιακόπτες btuB (μεταφορέας κοβαλαμίνης)Και thiM (εξαρτώμενο από πυροφωσφορική θειαμίνη), τα οποία πραγματοποιούν μη νουκλεολυτική καταστολή του mRNA, «ενεργοποιούνται» ( ΕΠΙ) και αφήστε το ριβόσωμα να συνεχίσει τη δουλειά του. Σύνδεση συνδέτη με ριβοδιακόπτη ( ΜΑΚΡΙΑ ΑΠΟ-θέση) οδηγεί στο σχηματισμό φουρκέτας, καθιστώντας αυτή την περιοχή απρόσιτη στο ριβόσωμα. σι - Ριβοδιακόπτης λυσίνης lysCαπουσία συνδέτη περιλαμβάνεται επίσης ( ΕΠΙ). Η απενεργοποίηση του ριβοδιακόπτη εμποδίζει το ριβόσωμα να έχει πρόσβαση στο mRNA. Αλλά σε αντίθεση με τους ριβοδιακόπτες που περιγράφονται παραπάνω, στον διακόπτη λυσίνης, όταν είναι απενεργοποιημένος, ένα τμήμα "εκτίθεται", κόβεται από ένα ειδικό σύμπλεγμα RNase ( αποικοδομητικός), και όλο το mRNA χρησιμοποιείται, διασπώντας σε μικρά θραύσματα. Η καταστολή από τον ριβοδιακόπτη σε αυτή την περίπτωση ονομάζεται πυρηνολυτική ( πυρηνολυτικό) και είναι μη αναστρέψιμη, επειδή, σε αντίθεση με το παράδειγμα ( ΕΝΑ ), αντίστροφη εναλλαγή (επιστροφή σε ΕΠΙ) δεν είναι πλέον δυνατή. Είναι σημαντικό να σημειωθεί ότι με αυτόν τον τρόπο μπορεί να επιτευχθεί η χρήση μιας ομάδας «περιττών» mRNA: ένας ριβοδιακόπτης είναι παρόμοιος με ένα μέρος ενός παιδικού συνόλου κατασκευής και μια ολόκληρη ομάδα λειτουργικά σχετιζόμενων μορίων μήτρας μπορεί να έχει διακόπτες παρόμοιους σε δομή.
Riboswitch - αισθητήρας για βακτήρια
Έτσι, υπάρχουν μικρά RNA που συσχετίζουν τις πρωτεΐνες, υπάρχουν μικρά RNA που παρεμβαίνουν στο mRNA του ίδιου του βακτηρίου, καθώς και RNA που συλλαμβάνονται από βακτήρια από ιούς και καταστέλλουν το DNA φάγων. Είναι δυνατόν να φανταστούμε κάποιον άλλο μηχανισμό ρύθμισης χρησιμοποιώντας μικρά RNA; Αποδεικνύεται ναι. Αν αναλύσουμε όσα περιγράφηκαν παραπάνω, θα διαπιστώσουμε ότι σε όλες τις περιπτώσεις αντινοηματικής ρύθμισης, παρατηρείται παρεμβολή μικρού RNA και του στόχου ως αποτέλεσμα υβριδισμού δύο άτομομόρια. Γιατί να μην κανονίσουμε μικρό RNA ως μέρος της ίδιας της μεταγραφής? Τότε είναι δυνατό, αλλάζοντας τη διαμόρφωση ενός τέτοιου «άστοχου Κοζάκου» μέσα στο mRNA, να αλλάξει η προσβασιμότητα ολόκληρου του προτύπου για ανάγνωση κατά τη μετάφραση ή, που είναι ακόμη πιο ενεργειακά σκόπιμο, να ρυθμιστεί η βιοσύνθεση του mRNA, δηλ. μεταγραφή!
Τέτοιες δομές είναι ευρέως παρούσες στα βακτηριακά κύτταρα και είναι γνωστές ως riboswitches ( ριμποδιακόπτης). Εντοπίζονται πριν από την αρχή του κωδικοποιητικού τμήματος του γονιδίου, στο 5' άκρο του mRNA. Συμβατικά, δύο δομικά μοτίβα μπορούν να διακριθούν στη σύνθεση των ριβοδιακοπτών: περιοχή απταμερούς, υπεύθυνη για τη δέσμευση με τον συνδέτη (ενεργό) και πλατφόρμα έκφρασης, παρέχοντας ρύθμιση της γονιδιακής έκφρασης μέσω της μετάβασης του mRNA σε εναλλακτικές χωρικές δομές. Για παράδειγμα, ένας τέτοιος διακόπτης (τύπου "off") χρησιμοποιείται για τη λειτουργία οπερόνιο λυσίνης: όταν υπάρχει περίσσεια λυσίνης, υπάρχει με τη μορφή «μπλεγμένης» χωρική δομή, που εμποδίζει την ανάγνωση από το οπερόνιο, και αν υπάρχει έλλειψη, ο ριβοδιακόπτης «ξετυλίγεται» και συντίθενται οι πρωτεΐνες που είναι απαραίτητες για τη βιοσύνθεση της λυσίνης (Εικ. 3).
Το περιγραφόμενο σχηματικό διάγραμμα της συσκευής ριμποδιακόπτη δεν είναι κανόνας· υπάρχουν παραλλαγές. Ένας περίεργος διακόπτης ριμποσκόπτης "ενεργοποίησης" ανακαλύφθηκε στο Vibrio cholerae: η πλατφόρμα έκφρασης προηγείται δύο ταυτόχροναπεριοχή απταμερούς. Προφανώς, αυτό παρέχει μεγαλύτερη ευαισθησία και πιο ομαλή απόκριση στην εμφάνιση ενός άλλου αμινοξέος στο κύτταρο - της γλυκίνης. Ίσως, ένας «διπλός» ριβοδιακόπτης στο γονιδίωμα του παθογόνου, παρόμοιος στην αρχή της δράσης, εμπλέκεται έμμεσα στο υψηλό ποσοστό επιβίωσης του βακτηρίου άνθρακας (Bacillus anthracis). Αντιδρά σε μια ένωση που αποτελεί μέρος του ελάχιστου μέσου και είναι ζωτικής σημασίας για αυτό το μικρόβιο - η πυροφωσφορική θειαμίνη.
Εκτός από την εναλλαγή μεταβολικών οδών ανάλογα με το «μενού» που είναι διαθέσιμο στο βακτηριακό κύτταρο, οι ριβοδιακόπτες μπορούν να είναι αισθητήρες βακτηριακής ομοιόστασης. Έτσι, παρατηρήθηκαν στη ρύθμιση της διαθεσιμότητας ενός γονιδίου για ανάγνωση όταν διαταράσσεται η λειτουργία του συστήματος μετάφρασης μέσα στο κύτταρο (για παράδειγμα, σήματα όπως η εμφάνιση «μη φορτισμένων» tRNA και «ελαττωματικών» (σταματημένων) ριβοσωμάτων ), ή όταν αλλάζουν περιβαλλοντικοί παράγοντες (για παράδειγμα, αύξηση της θερμοκρασίας) .
Δεν χρειάζεται πρωτεΐνες, δώστε μας RNA!
Τι σημαίνει λοιπόν η παρουσία μιας τέτοιας ποικιλίας μικρών ρυθμιστών RNA μέσα στα βακτήρια; Αυτό υποδηλώνει απόρριψη της ιδέας όπου οι πρωτεΐνες είναι οι κύριοι «διαχειριστές» ή βλέπουμε μια άλλη τάση της μόδας; Προφανώς, ούτε το ένα ούτε το άλλο. Φυσικά, ορισμένα μικρά RNA είναι παγκόσμιοι ρυθμιστές των μεταβολικών οδών, όπως το αναφερόμενο CsrB, το οποίο εμπλέκεται, μαζί με το CsrC, στη ρύθμιση της αποθήκευσης οργανικού άνθρακα. Δεδομένης όμως της αρχής του διπλασιασμού των λειτουργιών στα βιολογικά συστήματα, τα βακτηριακά μικρά RNA μπορούν να συγκριθούν με έναν «διαχειριστή κρίσης» και όχι με έναν CEO. Έτσι, σε συνθήκες όπου για την επιβίωση ενός μικροοργανισμού είναι απαραίτητο γρήγορααναδιαμορφώνουν τον ενδοκυτταρικό μεταβολισμό, ο ρυθμιστικός τους ρόλος μπορεί να είναι αποφασιστικός και πιο αποτελεσματικός από εκείνον των πρωτεϊνών με παρόμοιες λειτουργίες. Έτσι, οι ρυθμιστές RNA είναι υπεύθυνοι, μάλλον, για μια γρήγορη απόκριση, λιγότερο σταθεροί και αξιόπιστοι από ό,τι στην περίπτωση των πρωτεϊνών: δεν πρέπει να ξεχνάμε ότι το μικρό RNA διατηρεί την τρισδιάστατη δομή του και συγκρατείται στην ανασταλμένη μήτρα από ασθενείς δεσμούς υδρογόνου.
Τα ήδη αναφερθέντα μικρά RNA του Vibrio cholerae μπορούν να παρέχουν έμμεση επιβεβαίωση αυτών των θέσεων. Για αυτό το βακτήριο, η είσοδος στο ανθρώπινο σώμα δεν είναι επιθυμητός στόχος, αλλά, προφανώς, κατάσταση έκτακτης ανάγκης. Η παραγωγή τοξινών και η ενεργοποίηση άλλων οδών που σχετίζονται με τη λοιμογόνο δύναμη σε αυτή την περίπτωση είναι απλώς μια αμυντική αντίδραση στην επιθετική αντίθεση του περιβάλλοντος και των κυττάρων του σώματος σε «άγνωστους». Οι «σωτήρες» εδώ είναι μικρά RNA, για παράδειγμα το Qrr, που βοηθούν το vibrio, κάτω από στρεσογόνες συνθήκες, να τροποποιήσει τη στρατηγική επιβίωσής του, αλλάζοντας τη συλλογική συμπεριφορά. Αυτή η υπόθεση μπορεί επίσης να επιβεβαιωθεί έμμεσα από την ανακάλυψη του μικρού RNA VrrA, το οποίο συντίθεται ενεργά όταν υπάρχουν δονήσεις στο σώμα και καταστέλλει την παραγωγή μεμβρανικών πρωτεϊνών Omp. Οι «κρυμμένες» μεμβρανικές πρωτεΐνες στην αρχική φάση της μόλυνσης μπορεί να βοηθήσουν στην αποφυγή μιας ισχυρής ανοσολογικής απόκρισης από το ανθρώπινο σώμα (Εικ. 4).

Εικόνα 4. Μικρά RNA στην υλοποίηση των παθογόνων ιδιοτήτων του Vibrio cholerae. ΕΝΑ - Το Vibrio cholerae έχει καλή αίσθηση και αναπαράγεται καλά στο υδάτινο περιβάλλον. Το ανθρώπινο σώμα πιθανώς δεν είναι η κύρια οικολογική θέση για αυτό το μικρόβιο. σι - Μόλις περάσει η οδός μετάδοσης της λοίμωξης από το νερό ή την τροφή σε ένα επιθετικό περιβάλλον - το ανθρώπινο λεπτό έντερο - τα δονήματα, από άποψη οργανωμένης συμπεριφοράς, αρχίζουν να μοιάζουν με ψευδοοργανισμό, το κύριο καθήκον του οποίου είναι να συγκρατήσει την ανοσολογική απόκριση και δημιουργούν ένα ευνοϊκό περιβάλλον για αποικισμό. Μεγάλης σημασίαςΤα μεμβρανικά κυστίδια είναι υπεύθυνα για το συντονισμό των ενεργειών εντός του βακτηριακού πληθυσμού και την αλληλεπίδρασή τους με το σώμα. Οι μη πλήρως κατανοητοί περιβαλλοντικοί παράγοντες στο έντερο δρουν ως σήματα για την έκφραση μικρών RNA (για παράδειγμα, VrrA) σε δονήσεις. Ως αποτέλεσμα, ενεργοποιείται ο μηχανισμός σχηματισμού κυστιδίων, τα οποία είναι μη ανοσογόνα όταν ο αριθμός των κυττάρων Vibrio στο έντερο είναι χαμηλός. Εκτός από το περιγραφόμενο αποτέλεσμα, τα μικρά RNA βοηθούν στην «απόκρυψη» των μεμβρανικών πρωτεϊνών Omp που είναι δυνητικά προκλητικές για το ανθρώπινο ανοσοποιητικό σύστημα. Με την έμμεση συμμετοχή των μικρών RNA Qrr1-4, ενεργοποιείται η εντατική παραγωγή τοξίνης χολέρας (δεν φαίνεται στο σχήμα), η οποία συμπληρώνει το εύρος των προσαρμοστικών αντιδράσεων του Vibrio cholerae. V - Μέσα σε λίγες ώρες, ο αριθμός των βακτηριακών κυττάρων αυξάνεται και η δεξαμενή των μικρών VrrA RNAs μειώνεται, γεγονός που πιθανότατα οδηγεί στην έκθεση των πρωτεϊνών της μεμβράνης. Ο αριθμός των «κενών» κυστιδίων μειώνεται επίσης σταδιακά και σε αυτό το στάδιο αντικαθίστανται από ανοσογόνα που παραδίδονται στα εντεροκύτταρα. Προφανώς, αυτό είναι μέρος του «σχεδίου» για την εφαρμογή ενός σύνθετου σήματος, το νόημα του οποίου είναι να προκαλέσει την εκκένωση των δονήσεων από το ανθρώπινο σώμα. Σημείωση: η αναλογία μεγέθους των βακτηριακών κυττάρων και των εντεροκυττάρων δεν τηρείται.
Θα είναι ενδιαφέρον να δούμε πώς θα αλλάξει η κατανόησή μας για τους ρυθμιστές μικρών RNA όταν ληφθούν νέα δεδομένα σε πλατφόρμες RNAseq, συμπεριλαμβανομένων των ελεύθερων και μη καλλιεργημένων μορφών. Πρόσφατη εργασία με τη χρήση «βαθιάς αλληλουχίας» έχει ήδη αποφέρει απροσδόκητα αποτελέσματα, υποδεικνύοντας την παρουσία μορίων που μοιάζουν με microRNA σε μεταλλαγμένους στρεπτόκοκκους. Φυσικά, τέτοια δεδομένα χρειάζονται προσεκτικό διπλό έλεγχο, αλλά όπως και να έχει, μπορούμε με βεβαιότητα να πούμε ότι η μελέτη μικρών RNA στα βακτήρια θα φέρει πολλές εκπλήξεις.
Ευχαριστίες
Οι πρωτότυπες ιδέες και ο σχεδιασμός σύνθεσης κατά τη δημιουργία της εικόνας τίτλου, καθώς και της εικόνας 4, ανήκουν σε πτυχιούχο του Ινστιτούτου Αρχιολογίας του Νότιου Ομοσπονδιακού Πανεπιστημίου Kopaeva E.A. Η παρουσία του Σχήματος 2 στο άρθρο είναι αξία του αναπληρωτή καθηγητή του τμήματος. Zoology SFU G.B. Μπαχτάτζε. Πραγματοποίησε επίσης επιστημονική διόρθωση και αναθεώρηση του σχήματος του τίτλου και του Σχήματος 4. Ο συγγραφέας τους εκφράζει τη βαθιά του ευγνωμοσύνη για την υπομονή και τη δημιουργική τους προσέγγιση στο θέμα. Ιδιαίτερες ευχαριστίες στον συνάδελφό μου, ανώτερο ερευνητή. εργαστήριο. βιοχημεία μικροβίων του Rostov Anti-Plague Institute Sorokin V.M. για τη συζήτηση του κειμένου του άρθρου και τη διατύπωση πολύτιμων σχολίων.
Βιβλιογραφία
- Carl Woese (1928–2012) ;;. 80 , 1148-1154;
- R. R. Breaker. (2012). Riboswitches και ο κόσμος του RNA. Cold Spring Harbor Perspectives in Biology. 4 , a003566-a003566;
- J. Patrick Bardill, Brian K. Hammer. (2012). Τα μη κωδικοποιητικά sRNA ρυθμίζουν τη λοιμογόνο δύναμη στο βακτηριακό παθογόνο Vibrio cholerae. Βιολογία RNA. 9 , 392-401;
- Heon-Jin Lee, Su-Hyung Hong. (2012). Ανάλυση μικρού RNA μεγέθους microRNA σε Streptococcus mutans με βαθύ προσδιορισμό αλληλουχίας. FEMS Microbiol Lett. 326 , 131-136;
- Μ.-Π. Caron, L. Bastet, A. Lussier, M. Simoneau-Roy, E. Masse, D. A. Lafontaine. (2012). Έλεγχος ριβοδιακόπτη διπλής δράσης της έναρξης μετάφρασης και της αποσύνθεσης του mRNA. Πρακτικά της Εθνικής Ακαδημίας Επιστημών. 109 , E3444-E3453.
ΕΙΜΑΙ. Deichman, S.V. Zinoviev, A.Yu. Baryshnikov
ΕΚΦΡΑΣΗ ΓΟΝΙΔΙΩΝ ΚΑΙ ΜΙΚΡΑ RNA ΣΤΗΝ ΟΓΚΟΛΟΓΙΑ
GU RONC im. N.N.Blokhin RAMS, Μόσχα
ΠΕΡΙΛΗΨΗ
Το άρθρο παρουσιάζει τον ρόλο των μικρών RNA που ελέγχουν τις περισσότερες από τις ζωτικές λειτουργίες του κυττάρου και του σώματος, και την πιθανή σύνδεσή τους, ειδικότερα, με την ογκογένεση και άλλους (συμπεριλαμβανομένων των υποθετικών) ενδοκυτταρικών μηχανισμών γονιδιωματικής έκφρασης.
Λέξεις-κλειδιά: μικρά RNA, παρεμβολή RNA (RNAi), δίκλωνο RNA (dsRNA), επεξεργασία RNA, ογκογένεση.
ΕΙΜΑΙ. Ντάιχμαν, S.V.Zinoviev, A.Yu.Baryshnikov.
Η ΕΚΦΡΑΣΗ ΓΟΝΙΔΙΩΝ ΚΑΙ ΜΙΚΡΑ RNA ΣΤΗΝ ΟΓΚΟΛΟΓΙΑ
Ν.Ν. Blokhin Russian Cancer Research Center RAMS, Μόσχαω
ΑΦΗΡΗΜΕΝΗ
Στην έντυπη εργασία παρουσιάζεται ο ρόλος των μικρών RNA που επιβλέπουν την πλειονότητα των ζωτικών λειτουργιών του κυττάρου και του οργανισμού και πιθανή σύνδεσή τους ιδίως με την ογκογένεση και άλλους (συμπεριλαμβανομένων των υποθετικών) ενδοκυτταρικών μηχανισμών έκφρασης του γονιδιώματος.
Λέξεις κλειδιά: Μικρά RNA, RNA παρεμβολής (RNAi), δίκλωνα RNA (dsRNAs), επεξεργασία RNA, ογκογένεση.
Εισαγωγή
Η έκφραση μεμονωμένων γονιδίων και ολόκληρων ευκαρυωτικών γονιδιωμάτων, συμπεριλαμβανομένης της επεξεργασίας, διαφόρων τύπων μεταγραφής, ματίσματος, αναδιατάξεων, επεξεργασίας RNA, ανασυνδυασμού, μετάφρασης, παρεμβολής RNA, ρυθμίζεται από ορισμένες πρωτεΐνες (προϊόντα ρυθμιστικών, δομικών, ομοιοτικών γονιδίων, μεταγραφικών παραγόντων). , κινητά στοιχεία, RNA και τελεστές χαμηλού μοριακού βάρους. Μεταξύ των RNA επεξεργασίας είναι το rRNA, το tRNA, το mRNA, ορισμένοι τύποι ρυθμιστικού RNA και το μικρό RNA.
Είναι πλέον γνωστό ότι τα μικρά RNA δεν κωδικοποιούν πρωτεΐνες, συχνά αριθμούν εκατοντάδες ανά γονιδίωμα, και εμπλέκονται στη ρύθμιση της έκφρασης διαφόρων ευκαρυωτικών γονιδίων (σωματικά, ανοσοποιητικά, βλαστικά κύτταρα, βλαστοκύτταρα). Οι διαδικασίες διαφοροποίησης (αιματοποίηση, αγγειογένεση, λιπογένεση, μυογένεση, νευρογένεση), μορφογένεση (συμπεριλαμβανομένης εμβρυϊκά στάδια, ανάπτυξη/ανάπτυξη, φυσιολογική ρύθμιση), πολλαπλασιασμός, απόπτωση, καρκινογένεση, μεταλλαξιογένεση, ανοσογένεση, γήρανση (παράταση ζωής), επιγενετική σίγαση. έχουν σημειωθεί περιπτώσεις μεταβολικής ρύθμισης (για παράδειγμα, γλυκοσφιγγολιπίδια). Μια ευρύτερη κατηγορία μη κωδικοποιημένων RNA 20-300/500 νουκλεοτιδίων και τα RNP τους βρίσκονται όχι μόνο στον πυρήνα/πυρήνα/κυτταρόπλασμα, αλλά και σε κυτταρικά οργανίδια που περιέχουν DNA (μιτοχόνδρια ζώων, microRNA και μικρές συναινετικές αλληλουχίες για μεταγραφές χλωροπλάστες έχουν βρεθεί στο RNA των φυτών).
Για έλεγχο και ρύθμιση v.n. διεργασίες, είναι σημαντικό: 1. ότι μικρού μεγέθους φυσικά/τεχνητά RNA (μικρά RNA, tRNA, κ.λπ.) και τα σύμπλοκά τους με πρωτεΐνες (RNPs) είναι ικανά για διαμεμβρανική κυτταρική και μιτοχονδριακή μεταφορά. 2. ότι μετά τη διάσπαση των μιτοχονδρίων, μέρος του περιεχομένου τους, RNA και RNP, μπορεί να καταλήξει στο κυτταρόπλασμα και τον πυρήνα. Οι αναφερόμενες ιδιότητες των μικρών RNA (SRNA), των οποίων ο λειτουργικά σημαντικός ρόλος αυξάνεται μόνο στη διαδικασία της μελέτης, προφανώς έχουν σχέση με τον παράγοντα εγρήγορσης για τον καρκίνο και άλλες γενετικές ασθένειες. Ταυτόχρονα, έγινε σαφής η υψηλή σημασία των επιγονιδιωματικών τροποποιήσεων της χρωματίνης στην εμφάνιση όγκων. Θα εξετάσουμε μόνο έναν πολύ περιορισμένο αριθμό περιπτώσεων από πολλές παρόμοιες.
Μικρά RNA
Ο μηχανισμός δράσης των μικρών RNA είναι η ικανότητά τους να συνδέονται σχεδόν συμπληρωματικά με τις 3"-αμετάφραστες περιοχές (3"-UTRs) των mRNA-στόχων (τα οποία μερικές φορές περιέχουν DNA/RNA που μεταθέτει στοιχεία MIR/LINE-2, καθώς και συντηρητικό Alu επαναλαμβάνεται ) και προκαλούν παρεμβολή RNA (RNAi=RNAi, ιδιαίτερα κατά τη διάρκεια μιας αντιϊκής απόκρισης). Η επιπλοκή, ωστόσο, είναι ότι εκτός από τα κυτταρικά, υπάρχουν επίσης μικρά RNA που κωδικοποιούνται από ιούς (έρπης, SV40, κ.λπ.· EBV, για παράδειγμα, περιέχει 23 και KSHV - 12 miRNAs) που αλληλεπιδρούν με μεταγραφές και των δύο τον ιό και τον ξενιστή. Περισσότερα από 5 χιλιάδες κυτταρικά/ιικά miRNA μόνο είναι γνωστά σε 58 είδη. Το RNAi εκκινεί είτε την αποικοδόμηση (με τη συμμετοχή του συμπλόκου RISC, του συμπλέγματος σίγασης που προκαλείται από RNA) κατά μήκος των ευάλωτων στη νουκλεάση θραυσμάτων συνεχών ελίκων lncRNA (δίκλωνο mRNA RNA, κ.λπ.), είτε μερικώς αναστρέψιμη αναστολή ασυνεχώς ελικοειδή lncRNA κατά τη μετάφραση των mRNA στόχων. Τα ώριμα μικρά RNA (~15-28 νουκλεοτίδια) σχηματίζονται στο κυτταρόπλασμα από τους πυρηνικά επεξεργασμένους προδρόμους τους ποικίλου μήκους (δεκάδες και εκατοντάδες νουκλεοτίδια). Επιπλέον, μικρά RNA εμπλέκονται στο σχηματισμό της δομής της σιωπηλής χρωματίνης, στη ρύθμιση της μεταγραφής μεμονωμένων γονιδίων, στην καταστολή της έκφρασης τρανσποζονίων και στη διατήρηση της λειτουργικής δομής των εκτεταμένων περιοχών της ετεροχρωματίνης.
Υπάρχουν διάφοροι κύριοι τύποι μικρών RNA. Τα πιο καλά μελετημένα είναι τα microRNA (miRNAs) και τα μικρά παρεμβαλλόμενα RNA (siRNAs). Επιπλέον, μεταξύ των μικρών RNAs, μελετώνται τα ακόλουθα: piRNAs ενεργά σε βλαστικά κύτταρα. μικρά παρεμβαλλόμενα RNA που σχετίζονται με ενδογενή ρετροτρανσποζόνια και επαναλαμβανόμενα στοιχεία (με τοπική/σφαιρική ετεροχρωματοποίηση - ξεκινώντας από τα πρώιμα στάδια της εμβρυογένεσης, διατήρηση του επιπέδου των τελομερών), Drosophila rasiRNAs. Συχνά κωδικοποιούνται από εσώνια πρωτεϊνικών γονιδίων και λειτουργικά σημαντικά στη μετάφραση, μεταγραφή, μάτισμα (απο-/μεθυλίωση, ψευδουριδυλίωση νουκλεϊκών οξέων) μικρά πυρηνικά (snRNAs) και πυρηνικά (snoRNAs) RNA. μικρά ρυθμιστικά RNA, smRNA, με ελάχιστα γνωστές λειτουργίες, συμπληρωματικά προς τα μοτίβα NRSE (Στοιχείο Περιοριστικού Σιγαστήρα Νευρώνων) που δεσμεύει το DNA. φυτά που μετενεργοποιούν μικρά παρεμβαλλόμενα RNA, tasiRNA. σύντομη φουρκέτα RNA, shRNA, που παρέχουν μακροπρόθεσμα RNAi (σταθερή γονιδιακή σίγηση) μακρών δομών lncRNA κατά τη διάρκεια της αντιϊκής απόκρισης σε ζώα.
Μικρά RNA (miRNAs, siRNAs, κ.λπ.) αλληλεπιδρούν με νεοσυντιθέμενα μεταγραφήματα του πυρήνα/κυτταροπλάσματος (ρυθμίζοντας το μάτισμα, μετάφραση του mRNA, μεθυλίωση/ψευδουριδυλίωση του rRNA, κ.λπ.) και τη χρωματίνη (κατά τη διάρκεια της προσωρινής τοπικής και επιγενετικά κληρονομούμενης ετεροχρωματικής διοχρωματοποίησης γεννητικά κύτταρα). Η ετεροχρωματινοποίηση, ειδικότερα, συνοδεύεται από απο-/μεθυλίωση του DNA, καθώς και μεθυλίωση, ακετυλίωση, φωσφορυλίωση και ουβικουϊτινοποίηση των ιστονών (τροποποίηση του «κώδικα ιστόνης»).
Τα πρώτα από τα μικρά RNA ήταν τα miRNA του νηματώδους Caenorhabditis elegans (lin-4), οι ιδιότητες και τα γονίδιά τους και λίγο αργότερα τα miRNA του φυτού Arabidopsis thaliana. Επί του παρόντος συνδέονται με πολυκύτταροι οργανισμοί, αν και εμφανίζονται στο μονοκύτταρο φύκι Chlamydomonas reinhardtii, και στα μονοπάτια σιγής που μοιάζουν με RNAi, σε σχέση με την αντιική/όπως προστασία που περιλαμβάνει τα λεγόμενα. psiRNAs, που συζητήθηκαν για προκαρυώτες. Τα γονιδιώματα πολλών ευκαρυωτών (συμπεριλαμβανομένης της Drosophila και των ανθρώπων) περιέχουν αρκετές εκατοντάδες γονίδια miRNA. Αυτά τα ειδικά για το στάδιο/ιστό γονίδια (καθώς και οι αντίστοιχες περιοχές mRNA στόχου τους) είναι συχνά πολύ ομόλογα σε φυλογενετικά απομακρυσμένα είδη, αλλά μερικά από αυτά είναι ειδικά για τη γενεαλογία. Τα miRNA περιέχονται σε εξόνια (κωδικοποιώντας πρωτεΐνες, γονίδια RNA), ιντρόνια (συνήθως προ-mRNA), διαγονιδιακά διαχωριστικά (συμπεριλαμβανομένων των επαναλήψεων), έχουν μήκος έως 70-120 νουκλεοτίδια (ή περισσότερα) και σχηματίζουν βρόχο/στέλεχος φουρκέτας δομές. Για τον προσδιορισμό των γονιδίων τους δεν χρησιμοποιούνται μόνο βιοχημικές και γενετικές προσεγγίσεις, αλλά και υπολογιστικές προσεγγίσεις.
Το πιο τυπικό μήκος της «περιοχής εργασίας» των ώριμων miRNA είναι 21-22 νουκλεοτίδια. Αυτά είναι ίσως τα πιο πολλά από τα γονίδια που δεν κωδικοποιούν πρωτεΐνες. Μπορούν να εντοπιστούν με τη μορφή μεμονωμένων αντιγράφων (πιο συχνά) ή συστάδων που περιέχουν πολλά παρόμοια ή διαφορετικά γονίδια miRNA, μεταγραφόμενα (συχνά από αυτόνομους προαγωγείς) ως μακρύτερος πρόδρομος, επεξεργασμένοι σε διάφορα στάδια σε μεμονωμένα miRNA. Πιστεύεται ότι υπάρχει ένα ρυθμιστικό δίκτυο miRNA που ελέγχει πολλές θεμελιώδεις βιολογικές διεργασίες (συμπεριλαμβανομένης της ογκογένεσης/μετάστασης). πιθανώς τουλάχιστον το 30% των γονιδίων που εκφράζονται στον άνθρωπο ρυθμίζονται από miRNAs.
Αυτή η διαδικασία περιλαμβάνει τα ειδικά για το lncRNA ένζυμα που μοιάζουν με RNase III, Drosha (πυρηνική ριβονουκλεάση, ξεκινά την επεξεργασία των ιντρονικών προ-miRNAs μετά το μάτισμα του κύριου μεταγράφου) και το Dicer, το οποίο λειτουργεί στο κυτταρόπλασμα και διασπά/υποδομεί, αντίστοιχα, τη φουρκέτα. Τα miRNA (για ώριμα miRNAs) και οι υβριδικές δομές miRNA/mRNA σχηματίστηκαν αργότερα. Μικρά RNA, μαζί με αρκετές πρωτεΐνες (συμπεριλαμβανομένων vn RNases, πρωτεϊνών της οικογένειας AGO, τρανςμεθυλάσες/ακετυλάσες κ.λπ.) και με τη συμμετοχή των λεγόμενων. Τα σύμπλοκα που μοιάζουν με RISC και RITS (το δεύτερο επάγει μεταγραφική σίγαση) είναι ικανά, αντίστοιχα, να προκαλέσουν RNAi/αποδόμηση και επακόλουθη γονιδιακή σίγηση στα επίπεδα RNA (πριν/κατά τη μετάφραση) και DNA (κατά τη μεταγραφή της ετεροχρωματίνης).
Κάθε miRNA δυνητικά ζευγαρώνει με πολλαπλούς στόχους και κάθε στόχος ελέγχεται από έναν αριθμό miRNAs (θυμίζει την επεξεργασία του προ-mRNA με τη μεσολάβηση gRNA σε κινετοπλάστες τρυπανοσώματος). Η ανάλυση in vitro έδειξε ότι η ρύθμιση του miRNA (καθώς και η επεξεργασία του RNA) είναι ένας βασικός μετα-μεταγραφικός ρυθμιστής της γονιδιακής έκφρασης. Παρόμοια miRNA που ανταγωνίζονται για τον ίδιο στόχο είναι πιθανοί μεταρυθμιστές των αλληλεπιδράσεων RNA-RNA και RNA-πρωτεΐνης.
Στα ζώα, τα miRNAs μελετώνται καλύτερα στο νηματώδη Caenorhabditis Elegans. περισσότερα από 112 γονίδια έχουν περιγραφεί. Χιλιάδες ενδογενή siRNAs (χωρίς γονίδια, συσχετισμένα, ειδικότερα, με μεταγραφές και τρανσποζόνια που προκαλούνται από τη σπερματογένεση) βρίσκονται επίσης εδώ. Και τα δύο μικρά RNA των μεταζωανών μπορούν να δημιουργηθούν από πολυμεράσες RNA που παρουσιάζουν τη δραστηριότητα (όχι ομολογία) του RdRP-II (όπως για τα περισσότερα άλλα RNA) και των τύπων RdRP-III. Τα ώριμα μικρά RNA είναι παρόμοια σε σύνθεση (συμπεριλαμβανομένων των τερματικών 5"-φωσφορικών και 3"-ΟΗ), μήκους (συνήθως 21-22 νουκλεοτιδίων) και λειτουργίας και μπορούν να ανταγωνιστούν για τον ίδιο στόχο. Ωστόσο, η αποικοδόμηση του RNA, ακόμη και με πλήρη συμπληρωματικότητα στόχου, σχετίζεται συχνότερα με τα siRNA. μεταφραστική καταστολή, με μερική, συνήθως 5-6 νουκλεοτίδια, συμπληρωματικότητα - με miRNAs. και οι πρόδρομοι, αντίστοιχα, είναι εξω-/ενδογενείς (εκατοντάδες/χιλιάδες νουκλεοτίδια) για τα siRNA, και συνήθως ενδογενείς (δεκάδες/εκατοντάδες νουκλεοτίδια) για τα miRNA και η βιογένεσή τους είναι διαφορετική. Ωστόσο, σε ορισμένα συστήματα αυτές οι διαφορές είναι αναστρέψιμες.
Το RNAi, που διαμεσολαβείται από τα siRNA και τα miRNA, έχει διάφορους φυσικούς ρόλους: από τη ρύθμιση της γονιδιακής έκφρασης και της ετεροχρωματίνης έως την προστασία του γονιδιώματος από τρανσποζόνια και ιούς. αλλά τα siRNA και ορισμένα miRNA δεν διατηρούνται μεταξύ των ειδών. Στα φυτά (Arabidopsis thaliana) βρέθηκαν τα ακόλουθα: siRNAs που αντιστοιχούν τόσο σε γονίδια όσο και σε διαγονιδιακές (συμπεριλαμβανομένων διαχωριστών, επαναλήψεων) περιοχές. ένας τεράστιος αριθμός πιθανών θέσεων γονιδιώματος για διάφορους τύπους μικρών RNA. Τα νηματώδη έχουν επίσης τα λεγόμενα μεταβλητά αυτόνομα εκφραζόμενα 21U-RNA (dasRNAs). Έχουν ένα μονοφωσφορικό 5"-Υ, περιλαμβάνουν 21 νουκλεοτίδια (20 από αυτά είναι μεταβλητά) και βρίσκονται μεταξύ ή μέσα στα εσώνια των γονιδίων που κωδικοποιούν πρωτεΐνες σε περισσότερες από 5700 θέσεις σε δύο περιοχές του χρωμοσώματος IV.
Τα MiRNA παίζουν σημαντικό ρόλο στη γονιδιακή έκφραση στην υγεία και τις ασθένειες. στον άνθρωπο υπάρχουν τουλάχιστον 450-500 τέτοια γονίδια. Συνήθως δεσμεύονται με τις περιοχές 3"-UTR του mRNA (άλλοι στόχοι), μπορούν επιλεκτικά και ποσοτικά (ιδίως κατά την αφαίρεση προϊόντων γονιδίων χαμηλής έκφρασης από την κυκλοφορία) να εμποδίσουν το έργο ορισμένων γονιδίων και τη δραστηριότητα άλλων γονιδίων. αποδείχθηκε ότι τα σύνολα προφίλ εκφραζόμενων μικρο-RNA (και οι στόχοι τους) αλλάζουν δυναμικά κατά τη διάρκεια της οντογένεσης, της διαφοροποίησης των κυττάρων και των ιστών. αριθμός συνάψεων νευρικό κύτταρο(που περιλαμβάνει miRNA-134, άλλα μικρά RNA), την ανάπτυξη πολλών παθολογιών (ογκογένεση, ανοσοανεπάρκεια, γενετικές ασθένειες, παρκινσονισμός, νόσος Alzheimer, οφθαλμολογικές διαταραχές (ρετινοβλάστωμα κ.λπ.) που σχετίζονται με λοιμώξεις διαφόρων φύσεων). Ο συνολικός αριθμός των ανιχνευθέντων miRNAs αυξάνεται πολύ πιο γρήγορα από την περιγραφή του ρυθμιστικού τους ρόλου και της συσχέτισής τους με συγκεκριμένους στόχους.
Η υπολογιστική ανάλυση προβλέπει εκατοντάδες στόχους mRNA για μεμονωμένα miRNA και τη ρύθμιση μεμονωμένων mRNA από πολλαπλά miRNA. Έτσι, τα miRNA μπορούν να εξυπηρετήσουν τον σκοπό της εξάλειψης των μεταγραφών των γονιδίων-στόχων ή λεπτό συντονισμόη έκφρασή τους στο μεταγραφικό/μεταφραστικό επίπεδο. Θεωρητική θεώρηση και πειραματικά αποτελέσματαυποστηρίζουν την ύπαρξη διαφορετικών ρόλων για τα miRNA.
Στην ανασκόπηση αντικατοπτρίζεται ένας πιο πλήρης κατάλογος πτυχών που σχετίζονται με τον θεμελιώδη ρόλο των μικρών RNA στους ευκαρυώτες στις διαδικασίες ανάπτυξης/ανάπτυξης και σε ορισμένες παθολογίες (συμπεριλαμβανομένης της επιγονιδιωματικής του καρκίνου).
Μικρά RNA στην Ογκολογία
Οι διαδικασίες ανάπτυξης, ανάπτυξης, εξέλιξης και μετάστασης των όγκων συνοδεύονται από πολλές επιγενετικές αλλαγές που εξελίσσονται σε σπανιότερες, επίμονα κληρονομικές γενετικές αλλαγές. Οι σπάνιες μεταλλάξεις όμως μπορεί να έχουν μεγάλο βάρος (για ένα συγκεκριμένο άτομο, νοσολογία), γιατί σε σχέση με μεμονωμένα γονίδια (για παράδειγμα APC, K-ras, p53) τα λεγόμενα Φαινόμενο «χοάνης» που σχετίζεται με σχεδόν μη αναστρέψιμη ανάπτυξη/συνέπειες καρκίνου. Η ειδική για τον όγκο ετερογένεια των προγονικών κυττάρων όσον αφορά το προφίλ έκφρασης διαφόρων γονιδίων (πρωτεΐνες, RNA, μικρά RNA) προσδιορίζεται από σχετικές παραλλαγές στις αναδομημένες επιγονιδιωματικές δομές. Το επιγονιδίωμα διαμορφώνεται με μεθυλίωση, μετα-μεταφραστικές τροποποιήσεις/αντικαταστάσεις ιστονών (με μη κανονικές), αναδιαμόρφωση της νουκλεοσωμικής δομής των γονιδίων/χρωματίνης (συμπεριλαμβανομένης της γονιδιωματικής αποτύπωσης, δηλ. δυσλειτουργίας της έκφρασης αλληλόμορφων γονιδίων γονιδίων και γονιδίων Χ). ). Όλα αυτά, και με τη συμμετοχή των RNAi που ρυθμίζονται από μικρά RNA, οδηγούν στην εμφάνιση ελαττωματικών ετεροχρωματικών (συμπεριλαμβανομένων των υπομεθυλιωμένων κεντρομερών) δομών.
Ο σχηματισμός γονιδιακών μεταλλάξεων μπορεί να προηγηθεί από τη γνωστή συσσώρευση εκατοντάδων χιλιάδων σωματικών κλωνικών μεταλλάξεων σε απλές επαναλήψεις ή μικροδορυφόρους μιας μη κωδικοποιητικής (σπάνια κωδικοποιητικής) περιοχής - τουλάχιστον σε όγκους με φαινότυπο μικροδορυφορικού μεταλλάκτη (MMP). ; αποτελούν σημαντικό μέρος των καρκίνων του παχέος εντέρου, καθώς και των καρκίνων του πνεύμονα, του στομάχου, του ενδομητρίου κ.λπ. Οι ασταθείς μονο-/ετερονουκλεοτιδικές επαναλήψεις μικροδορυφόρου (poly-A6-10, παρόμοιο) περιέχονται πολλές φορές πιο συχνά σε ρυθμιστικά μη κωδικοποιητικά γονίδια που ελέγχουν την έκφραση (εσώνια, διαγονιδιακά) από ό,τι στις περιοχές κωδικοποίησης (εξόνια) του γονιδιώματος των μικροδορυφορικά ασταθών, MSI+, όγκων. Αν και η φύση της εμφάνισης και οι μηχανισμοί εντοπισμού των σταθερών/ασταθών περιοχών της MS δεν είναι απολύτως σαφείς, ο σχηματισμός αστάθειας της MS συσχετίστηκε με τη συχνότητα μεταλλάξεων πολλών γονιδίων που δεν είχαν προηγουμένως μεταλλαχθεί σε όγκους MSI+ και πιθανώς διοχέτευαν τις οδούς την εξέλιξή τους· Επιπλέον, η συχνότητα επαναλαμβανόμενων μεταλλάξεων MSI σε αυτούς τους όγκους αυξήθηκε κατά περισσότερες από δύο τάξεις μεγέθους. Δεν έχουν αναλυθεί όλα τα γονίδια για την παρουσία επαναλήψεων, αλλά ο βαθμός μεταβλητότητάς τους σε περιοχές κωδικοποίησης/μη κωδικοποίησης είναι διαφορετικός και η ακρίβεια των μεθόδων για τον προσδιορισμό της συχνότητας των μεταλλάξεων είναι σχετική. Είναι σημαντικό ότι οι μη κωδικοποιητικές περιοχές των επαναλήψεων που μεταβάλλονται με MSI είναι συχνά διαλληλικές, ενώ οι περιοχές κωδικοποίησης είναι μονοαλληλικές.
Μια συνολική μείωση της μεθυλίωσης στους όγκους είναι χαρακτηριστική για επαναλήψεις, μετατιθέμενα στοιχεία (TEs, η μεταγραφή τους αυξάνεται), προαγωγείς, θέσεις CpG των ογκοκατασταλτικών γονιδίων miRNA και συσχετίζεται με την υπερμεταγραφή των ρετροτρανσποζονίων σε προοδευτικά καρκινικά κύτταρα. Κανονικά, οι διακυμάνσεις στο «μεθυλώμα» σχετίζονται με «κύματα μεθυλίωσης» ειδικά για γονέα/στάδιο/ιστό και ισχυρή μεθυλίωση κεντρομερών δορυφορικών περιοχών της ετεροχρωματίνης, που ρυθμίζονται από μικρά RNA. Όταν οι δορυφόροι υπομεθυλιώνονται, η προκύπτουσα αστάθεια των χρωμοσωμάτων συνοδεύεται από αυξημένο ανασυνδυασμό και η διακοπή της μεθυλίωσης ΜΕ μπορεί να προκαλέσει την έκφρασή τους. Αυτοί οι παράγοντες ευνοούν την ανάπτυξη ενός φαινοτύπου όγκου. Η θεραπεία με μικρό RNA μπορεί να είναι εξαιρετικά ειδική, αλλά πρέπει να ελέγχεται γιατί Οι στόχοι μπορεί να είναι όχι μόνο μεμονωμένοι, αλλά και πολλά μόρια mRNA/RNA και πρόσφατα συντιθέμενα RNA διαφόρων (συμπεριλαμβανομένων μη κωδικοποιητικών διαγονιδιακών επαναλήψεων) περιοχών χρωμοσωμάτων.
Το μεγαλύτερο μέρος του ανθρώπινου γονιδιώματος αποτελείται από επαναλήψεις και ΜΕ. Το ρετροτρανσποζόνιο L1 (στοιχείο LINE) περιέχει, όπως οι ενδογενείς ρετροϊοί, αντίστροφηάση (RTase), ενδονουκλεάση και είναι δυνητικά ικανό να μεταφέρει μη αυτόνομα (Alu, SVA, κ.λπ.) ρετροστοιχεία. Η σίγαση των L1/όμοιων στοιχείων συμβαίνει ως αποτέλεσμα της μεθυλίωσης σε θέσεις CpG. Σημειώστε ότι μεταξύ των θέσεων CpG του γονιδιώματος, οι νησίδες CpG των προαγωγέων γονιδίων είναι ασθενώς μεθυλιωμένες και η ίδια η 5-μεθυλκυτοσίνη είναι μια δυνητικά μεταλλαξιογόνος βάση, απαμινωμένη σε θυμίνη (χημικά ή με τη συμμετοχή επεξεργασίας RNA/(DNA), DNA επισκευή); Ωστόσο, ορισμένα από τα νησιά CpG υπόκεινται σε υπερβολική παρεκκλίνουσα μεθυλίωση, που συνοδεύεται από καταστολή των κατασταλτικών γονιδίων και ανάπτυξη καρκίνου. Στη συνέχεια: η πρωτεΐνη δέσμευσης RNA που κωδικοποιείται από το L1, αλληλεπιδρώντας με τις πρωτεΐνες AGO2 (οικογένεια Argo-naute) και FMRP (εύθραυστη πρωτεΐνη νοητικής καθυστέρησης, πρωτεΐνη του συμπλέγματος τελεστή RISC), προάγει την κίνηση του στοιχείου L1 - κάτι που υποδεικνύει μια πιθανή αμοιβαία ρύθμιση των συστημάτων RNAi και αναδρομή των ανθρώπινων στοιχείων LINE. Είναι σημαντικό, ειδικότερα, οι επαναλήψεις Alu να μπορούν να μετακινηθούν στην περιοχή ιντρονίων/εξονίων των γονιδίων.
Αυτοί και παρόμοιοι μηχανισμοί μπορούν να ενισχύσουν την παθολογική πλαστικότητα του γονιδιώματος των καρκινικών κυττάρων. Η καταστολή της RTase (που κωδικοποιείται, όπως η ενδονουκλεάση, από στοιχεία L1· η RTase κωδικοποιείται επίσης από ενδογενείς ρετροϊούς) μέσω του μηχανισμού RNAi συνοδεύτηκε από μείωση του πολλαπλασιασμού και αυξημένη διαφοροποίηση σε έναν αριθμό καρκινικών κυτταρικών σειρών. Όταν το στοιχείο L1 εισήχθη σε ένα πρωτο-ογκογονίδιο ή κατασταλτικό γονίδιο, παρατηρήθηκαν θραύσματα διπλού κλώνου DNA. Σε βλαστικούς ιστούς (ποντίκια/άνθρωπος), το επίπεδο έκφρασης του L1 αυξήθηκε και η μεθυλίωση του εξαρτιόταν από το σύστημα σίγησης που σχετίζεται με piRNAs (26-30-bp), όπου οι πρωτεΐνες PIWI είναι παραλλαγές της μεγάλης οικογένειας πρωτεϊνών Argo-naute , μεταλλάξεις στις οποίες οδηγούν σε απομεθυλίωση/αποκατάστολή L1/όμοιων στοιχείων με μακρές τερματικές επαναλήψεις. Οι πρωτεΐνες PIWI, σε μεγαλύτερο βαθμό από τις πρωτεΐνες Dicer-1/2 και Ago, σχετίζονται με τις οδούς σίγησης των rasiRNAs. Οι οδοί σίγησης που διαμεσολαβούνται από τα piRNA/siRNA πραγματοποιούνται μέσω ενδοπυρηνικών σωμάτων που περιέχουν μεγάλα εξελικτικά διατηρημένα πολυπρωτεϊνικά σύμπλοκα PcG, οι λειτουργίες των οποίων συχνά επηρεάζονται σε κύτταρα όγκου. Αυτά τα σύμπλοκα είναι υπεύθυνα για δράση μεγάλης εμβέλειας (σε περισσότερο από 10 kb, μεταξύ των χρωμοσωμάτων) και ρυθμίζουν το σύμπλεγμα των γονιδίων HOX που είναι υπεύθυνα για το σχέδιο σώματος.
Νέες αρχές αντιπληροφοριακής θεραπείας μπορούν να αναπτυχθούν λαμβάνοντας υπόψη τη γνώση για περισσότερο ειδικούς (από τους αναστολείς τροποποίησης ιστόνης της μεθυλίωσης DNA/πρωτεΐνης) αντικαρκινικούς επιγονιδιωματικούς παράγοντες, τις θεμελιώδεις αρχές της σίγησης του επιγονιδιωματικού RNA και τον ρόλο των μικρών RNA στην καρκινογένεση.
Micro-RNA στην Ογκολογία
Είναι γνωστό ότι η αυξημένη ανάπτυξη του όγκου και η μετάσταση μπορεί να συνοδεύεται από αύξηση ορισμένων και μείωση της έκφρασης άλλων ατόμων/συνόλων miRNAs (Πίνακας 1). Μερικά από αυτά μπορεί να έχουν αιτιολογικό ρόλο στην ογκογένεση. Και ακόμη και τα ίδια miRNAs (όπως το miR-21/-24) σε διαφορετικά καρκινικά κύτταρα μπορούν να εμφανίσουν τόσο ογκογόνες όσο και κατασταλτικές ιδιότητες. Κάθε τύπος ανθρώπινου κακοήθους όγκου διακρίνεται ξεκάθαρα από το «δακτυλικό του αποτύπωμα miRNA» και ορισμένα miRNA μπορούν να λειτουργήσουν ως ογκογονίδια, καταστολείς όγκου, εκκινητές κυτταρικής μετανάστευσης, εισβολής και μετάστασης. Σε παθολογικά αλλοιωμένους ιστούς, συχνά εντοπίζονται μειωμένες ποσότητες βασικών miRNA που πιθανώς εμπλέκονται σε αντικαρκινικά αμυντικά συστήματα. Τα miRNAs (miRs) που εμπλέκονται στην ογκογένεση έχουν σχηματίσει την ιδέα του λεγόμενου. «oncomirah»: ανάλυση της έκφρασης περισσότερων από 200 miRNAs σε περισσότερα από 1000 δείγματα λεμφωμάτων και συμπαγών καρκίνων κατέστησε δυνατή την επιτυχή ταξινόμηση των όγκων σε υποτύπους ανάλογα με την προέλευση και το στάδιο διαφοροποίησής τους. Οι λειτουργίες και ο ρόλος των miRNAs έχουν μελετηθεί επιτυχώς χρησιμοποιώντας: ολιγονουκλεοτίδια αντι-miR τροποποιημένα (για αύξηση της διάρκειας ζωής) σε ομάδες 2"-Ο-μεθυλίου και 2"-Ο-μεθοξυαιθυλίου. καθώς και τα ολιγονουκλεοτίδια LNA, στα οποία τα άτομα οξυγόνου ριβόζης στις θέσεις 2" και 4" συνδέονται με μια γέφυρα μεθυλενίου.
(Τραπέζι 1)……………….
Ογκος | miRNAs |
Καρκίνος του πνεύμονα | 17-92 , ας-7↓ , 124a↓ , 126 ↓ , 143 ↓ , 145 ↓ , 155 , 191 , 205 , 210 |
Καρκίνος του μαστού | 21 , 125b↓ , 145 ↓ , 155 |
Καρκίνος του προστάτη | 15α ↓ , 16-1 ↓ , 21 , 143 ↓ ,145 ↓ |
Καρκίνο του εντέρου | 19α , 21 , 143 ↓ , 145 ↓ |
Καρκίνος παγκρέατος | 21 , 103 , 107 , 155 v |
Καρκίνος ωοθηκών | 210 |
Χρόνια λεμφοκυτταρική λευχαιμία | 15α ↓ , 16-1 ↓ , 16-2 , 23 σι , 24-1 , 29 ↓ , 146 , 155 , 195 , 221 , 223 ↓ |
Τραπέζι 1 .
miRNA των οποίων η έκφραση αυξάνεται () ή μειώνεται ( ↓ ) σε μερικούς από τους πιο κοινούς όγκους σε σύγκριση με τους φυσιολογικούς ιστούς (βλ. και επίσης).
Πιστεύεται ότι ο ρυθμιστικός ρόλος της έκφρασης, της εξαφάνισης και της ενίσχυσης των γονιδίων miRNA στην προδιάθεση για έναρξη, ανάπτυξη και εξέλιξη των περισσότερων όγκων είναι σημαντικός και οι μεταλλάξεις στα ζεύγη miRNA/mRNA στόχου συγχρονίζονται. Το προφίλ έκφρασης των miRNAs μπορεί να χρησιμοποιηθεί για ταξινόμηση, διάγνωση και κλινική πρόγνωση στην ογκολογία. Οι αλλαγές στην έκφραση των miRNAs μπορούν να επηρεάσουν τον κυτταρικό κύκλο, το πρόγραμμα επιβίωσης του κυττάρου. Οι μεταλλάξεις των miRNAs σε βλαστοκύτταρα και σωματικά κύτταρα (καθώς και η επιλογή πολυμορφικών παραλλαγών των στόχων mRNA) μπορεί να συμβάλουν ή ακόμη και να διαδραματίσουν κρίσιμο ρόλο στην ανάπτυξη, την εξέλιξη και την παθοφυσιολογία πολλών (αν όχι όλων) κακοηθειών. Με τη βοήθεια των miRNAs, είναι δυνατή η διόρθωση της απόπτωσης.
Εκτός από μεμονωμένα miRNA, ανακαλύφθηκαν συστάδες από αυτά, που δρουν ως ογκογονίδιο που προκαλεί την ανάπτυξη, ειδικότερα, του καρκίνου του αιμοποιητικού ιστού σε πειραματόζωα. Τα γονίδια miRNA με ογκογονικές και κατασταλτικές ιδιότητες μπορούν να εντοπιστούν στο ίδιο σύμπλεγμα. Η ανάλυση συστάδων των προφίλ έκφρασης miRNAs σε όγκους καθιστά δυνατό τον προσδιορισμό της προέλευσής τους (επιθήλιο, αιμοποιητικός ιστός κ.λπ.) και την ταξινόμηση διαφορετικών όγκων του ίδιου ιστού με μη ταυτόσημους μηχανισμούς μετασχηματισμού. Η αξιολόγηση του προφίλ έκφρασης των miRNAs μπορεί να πραγματοποιηθεί χρησιμοποιώντας νανο-/μικροσυστοιχίες. Η ακρίβεια μιας τέτοιας ταξινόμησης, κατά την ανάπτυξη της τεχνολογίας (που δεν είναι εύκολη), αποδεικνύεται ότι είναι υψηλότερη από τη χρήση προφίλ mRNA. Μερικά από τα miRNA εμπλέκονται στη διαφοροποίηση των αιμοποιητικών κυττάρων (ποντίκι, άνθρωπος), στην έναρξη της εξέλιξης των καρκινικών κυττάρων. Τα ανθρώπινα γονίδια miRNA βρίσκονται συχνά στο λεγόμενο. «Εύθραυστες» θέσεις, περιοχές με κυριαρχία διαγραφών/εισαγωγών, σπασίματα σημείων, μετατοπίσεις, μεταθέσεις, ελάχιστα διαγραμμένες και ενισχυμένες περιοχές ετεροχρωματίνης που εμπλέκονται στην ογκογένεση.
Αγγειογένεση . Ο ρόλος των miRNAs στην αγγειογένεση είναι πιθανώς σημαντικός. Η αυξημένη αγγειογένεση σε ορισμένα ανθρώπινα αδενοκαρκινώματα που ενεργοποιήθηκαν από Myc συνοδεύτηκε από αλλαγές στο πρότυπο έκφρασης ορισμένων miRNAs και η γονιδιακή καταστροφή άλλων miRNAs οδήγησε σε εξασθένηση και καταστολή της ανάπτυξης του όγκου. Η ανάπτυξη του όγκου συνοδεύτηκε από μεταλλάξεις στα γονίδια K-ras, Myc και TP53, αυξημένη παραγωγή του αγγειογόνου παράγοντα VEGF και βαθμό αγγείωσης που σχετίζεται με το Myc. ενώ οι αντιαγγειογενετικοί παράγοντες Tsp1 και CTGF καταστέλλονταν από το miR-17-92 και άλλα σχετιζόμενα με συστάδες miRNA. Η αγγειογένεση και η αγγείωση του όγκου ενισχύθηκαν (ιδιαίτερα στα κολοκύτταρα) με τη συνέκφραση δύο ογκογονιδίων αντί ενός.
Η εξουδετέρωση του αντιαγγειογόνου παράγοντα LATS2, ενός αναστολέα της ζωικής εξαρτώμενης από κυκλίνη κινάσης (CDK2, άνθρωπος/ποντίκι), με miRNAs-372/373 («δυνητικά ογκογονίδια») διέγειρε την ανάπτυξη όγκου των όρχεων χωρίς να βλάψει το γονίδιο p53.
Πιθανοί ρυθμιστές αγγειογενετικών ιδιοτήτων (in-vitro/in-vivo) είναι το miR-221/222, στόχοι του οποίου, οι υποδοχείς c-Kit (άλλοι), είναι παράγοντες αγγειογένεσης των ενδοθηλιακών φλεβικών κυττάρων HUVEC του ομφάλιου λώρου κ.λπ. Αυτά τα miRNA και το c-Kit αλληλεπιδρούν ως μέρος ενός πολύπλοκου κύκλου που ελέγχει την ικανότητα των ενδοθηλιακών κυττάρων να σχηματίζουν νέα τριχοειδή αγγεία.
Χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ). Στη χρόνια λεμφοκυτταρική λευχαιμία Β-κυττάρων (CLL), ένα μειωμένο επίπεδο γονιδιακής έκφρασης miR-15a/miR-16-1 (και άλλα) σημειώνεται στην περιοχή 13q14 του ανθρώπινου χρωμοσώματος - τη θέση των πιο κοινών δομικών ανωμαλιών ( συμπεριλαμβανομένων των διαγραφών της περιοχής των 30 kb), αν και το γονιδίωμα εξέφραζε εκατοντάδες ανθρώπινα ώριμα και προ-miRNAs. Και τα δύο miRNA, δυνητικά αποτελεσματικά στη θεραπεία όγκων, περιείχαν αντιπληροφοριακές περιοχές της αντιαποπτωτικής πρωτεΐνης Bcl2, κατέστειλαν την υπερέκφρασή της, διέγειραν την απόπτωση, αλλά απουσίαζαν σχεδόν/εντελώς στα δύο τρίτα των «αποκλίνων» κυττάρων CLL. Συχνές μεταλλάξεις των αλληλουχούμενων miRNAs σε βλαστοκύτταρα/σωματικά κύτταρα εντοπίστηκαν σε 11 από τους 75 ασθενείς (14,7%) με οικογενειακή προδιάθεση για ΧΛΛ (άγνωστος τρόπος κληρονομικότητας), αλλά όχι σε 160 υγιείς ασθενείς. Αυτές οι παρατηρήσεις εγείρουν εικασίες σχετικά με την άμεση λειτουργία των miRNAs στη λευκογένεση. Επί του παρόντος, δεν είναι όλα γνωστά για τη σχέση μεταξύ των επιπέδων γονιδιακής έκφρασης των miRNAs (και των λειτουργιών τους) και άλλων γονιδίων σε φυσιολογικά/καρκινικά κύτταρα.
ΕγγραφοΣυνάφεια. Η δυσλειτουργία του προσωπικού νεύρου κατά τη διάρκεια χειρουργικής επέμβασης στην παρωτίδα σιελογόνων αδένων είναι ένα από τα τρέχοντα προβλήματακαι καθορίζεται τόσο από τον επιπολασμό της νόσου όσο και από τη σημαντική συχνότητα
Dawson Church - η ιδιοφυΐα είναι στα γονίδιά σου η επιγενετική ιατρική και η νέα βιολογία των προθέσεων βιβλίο από τη βιβλιοθήκη www e - puzzle ru βιβλίο από τη βιβλιοθήκη www e - puzzle ru πίνακας περιεχομένων
ΒιβλίοΗθική πνευματικότητα ογκολογία hiv p garyaev* μια σύνοψη enfi
ΕγγραφοΑυτό το άρθρο αντικατοπτρίζει Μια νέα ματιάσχετικά με το πρόβλημα της ογκολογίας και της μόλυνσης από τον ιό HIV υπό το πρίσμα της Γενετικής Γλωσσικών Κυμάτων (LWG) και της Θεωρίας Κωδικοποίησης της Ουσίας (ESC) με βάση τη ρωσική και άλλες κοινωνικο-πολιτιστικές πραγματικότητες.
Ογκολογικό Ερευνητικό Κέντρο και Blokhina Odintsova Anastasia Sergeevna νέα σχήματα χημειοθεραπείας για προχωρημένο και υποτροπιάζοντα καρκίνο του τραχήλου της μήτρας 14/01/12 – ογκολογία
ΠΤΥΧΙΑΚΗ ΕΡΓΑΣΙΑ4.4. Προσδιορισμός του γονιδίου του ισοενζύμου της ουριδίνης γλυκορονυλ τρανσφεράσης (UGT1A1) στον ορό αίματος ασθενών με καρκίνο του τραχήλου της μήτρας που έλαβαν χημειοθεραπεία πρώτης γραμμής με ιρινοτεκάνη με παράγωγα πλατίνας 105