Δοκιμή με θέμα «Αλκάνια» 2016
1.Ποιο μόριο υδρογονάνθρακα μπορεί να έχει διακλαδισμένη ανθρακική αλυσίδα;
1) μεθάνιο CH 4 2) αιθάνιο C 2 Ν 6 3) προπάνιο C 3 Ν 8 4) βουτάνιο C 4 Ν 10
2.Δομικός τύπος προπανίου C 3 Ν 8
1)Χ 2 -SN 3 -SN 3 2)Χ 3 -SN 2 -SN 3 3) CH 3 -CH-CH 4 4) CH 2 -SN 4 -SN 2
3. Κύριο μέρος φυσικού αερίου
1) μεθάνιο 2) αιθάνιο 3) προπάνιο 4) βουτάνιο
4.Το μόριο μεθανίου έχει δεσμό άνθρακα-άνθρακα
1) απλό 2) διπλό 3) τριπλό 4) καμία τέτοια σύνδεση
5.Τύπος ομόλογου μεθανίου 1) Γ 3 Ν 6 2) Γ 4 Ν 8 3) Γ 6 Ν 12 4) Γ 5 Ν 12
6.Να αναφέρετε τη σωστή κρίση
Τα αλκάνια Α. χαρακτηρίζονται από αντιδράσεις προσθήκης
Τα Β. αλκάνια χαρακτηρίζονται από αντιδράσεις υποκατάστασης
7. Τα ισομερή είναι διαφορετικά
1) ποιοτική σύνθεση 2) ποσοτική σύνθεση 3) δομή 4) ομόλογη διαφορά
8. Ένα ισομερές επτανίου είναι
1) 2,3-διμεθυλεπτάνιο 2) 2,3-διμεθυλπεντάνιο 3) 2,3-διμεθυλβουτάνιο 4) 2,3-διμεθυλεξάνιο
9.Φόρμουλα νιτροαιθανίου
1) CH 3 -SN 2 - Ο ΟΧΙ 2 2) CH 3 -SN 2 - ΟΧΙ 2
3) CH 3 -SN 2 - ΝΝ 2 4) CH 3 -SN 2 -SN 2 -SN 2 - ΟΧΙ 2
10. Ποια ουσία λείπει από το φυσικό αέριο;
1) μεθάνιο 2) αιθάνιο 3) πεντάνιο 4) βουτάνιο
11. Προσδιορίστε ποια από τις αναφερόμενες ενώσεις έχει τη μέγιστη κατάσταση οξείδωσης του ατόμου άνθρακα;
1)Χ 2 Ο 2) CH 3 OH 3)SSμεγάλο 4 4) Γ 2 Ν 4
12. Κάθε άτομο άνθρακα σε ένα μόριο αιθανίου σχηματίζεται
1) δύο δεσμοί σ και δύο δεσμοί π 2) τρεις δεσμοί σ και ένας δεσμός π
3) τέσσερις δεσμοί σ 4) ένας σ και τρεις δεσμοί
13.μεθάνιο είναι το κύριο συστατικό
1) πετρέλαιο 2) φυσικό αέριο 3) αέριο σύνθεσης 4) αέριο φούρνου οπτάνθρακα
14.Να αναφέρετε τη σωστή κρίση
Τα αλκάνια Α. χαρακτηρίζονται από αντιδράσεις υποκατάστασης
Το Β. αιθάνιο αποχρωματίζει το διάλυμα υπερμαγγανικού καλίου
1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες
15. Ποια προϊόντα μπορούν να ληφθούν με την αντίδραση βρωμοαιθανίου και βρωμίου προπανίου με μέταλλο νατρίου;
1) βουτάνιο 2) εξάνιο
3) μίγμα βουτανίου και εξανίου 4) μίγμα εξανίου, βουτανίου, πεντανίου
16.Να αναφέρετε το όνομα του ριζικού – Χ.Θ 3
1) βουτύλιο 2) μεθάνιο 3) αιθύλιο 4) μεθύλιο
17. Προσδιορίστε τον τύπο της ρίζας αιθυλίου
1) -C 2 H 6 2b) -C 3 H 7 3) -C 2 H 5 4d) -C 4 H 9
18.Μήκος Συνδέσεις S-Sσε μόρια αλκανίων
1) 0,109 nm 2) 0,154 nm 3) 0,120 nm 4) 0,134 nm
19. Ως αποτέλεσμα της αντίδρασης αφυδρογόνωσης των αλκανίων, διασπώνται τα ακόλουθα:
1) νερό 2) υδρογόνο 3) άνθρακας 4) οξυγόνο
20. Ποιες συνθήκες είναι απαραίτητες για να ξεκινήσει η αντίδραση μεθανίου και χλωρίου;
1) ψύξη 2) θέρμανση 3) αύξηση πίεσης 4) φωτισμός
21.Από κατάσταση συνάθροισηςαλκάνια:
1) αέρια, υγρά 3Β) υγρά, στερεά
2) αέρια, υγρά, στερεά 4) αέρια, στερεά
22. Ένα μόριο μεθανίου έχει τη μορφή:
1) τετραγωνική πυραμίδα 2) τετράεδρο 3) οκτάεδρο 4) τετράγωνο
23. Το ισομερές του 2,3-διμεθυλοβουτανίου είναι:
1) εξάνιο 2) 2,3 – διμεθυλοκυκλοεξάνιο 3) κυκλοεξάνιο 4) 2-μεθυλοβουτάνιο
24. ΔΕΝ ισχύει για την αντίδραση υποκατάστασης
1) αφυδρογόνωση 2) βρωμίωση 3) νίτρωση 4) χλωρίωση
25. Στο δεύτερο στάδιο της χλωρίωσης του μεθανίου,
1) τετραχλωράνθρακας 2) τριχλωρομεθάνιο 3) διχλωρομεθάνιο 4) 1,2 – διχλωροαιθάνιο
26. Το αιθάνιο αλληλεπιδρά με καθεμία από ένα ζευγάρι ουσιών:
1) Εγώ 2 και Ν 2 2 ) HBr και H 2 Ο 3)Cl 2 και Ο 2 4) Ν 2 και NaOH
27. Ως αποτέλεσμα της αντίδρασης μπορεί να ληφθεί χλωριούχο μεθάνιο
Α) μεθάνιο με υδροχλώριο Β) μεθάνιο με υδροχλωρικό οξύ
Β) μεθάνιο με χλώριο υπό φωτισμό Δ) μεθάνιο με διάλυμα χλωρίου σε νερό
28. Ως αποτέλεσμα της θερμικής αποσύνθεσης του μεθανίου στους 1500 °C,
1) Γ 2 Ν 2 και Ν 2 2) CO και H 2 3) Γ και Ν 2 4) CO 2 και Ν 2 ΣΧΕΤΙΚΑ ΜΕ
29. Στην αντίδραση βρωμίωσης προπανίου, απαραίτητη προϋπόθεση είναι:
1) φωτισμός από το ηλιακό φως 3) παρουσία καταλύτη
2) η αντίδραση γίνεται υπό κανονικές συνθήκες 4) θέρμανση
30.Πώς οξειδώνονται τα αλκάνια κατά τη διαδικασία της καύσης;
1) υδρογόνο στον αέρα 2) οξυγόνο στον αέρα 3) υπερμαγγανικό κάλιο 4) αλκάνια δεν καίγονται
31. Η αντίδραση Wurtz είναι η αντίδραση….
Α) νίτρωση αλκανίων Β) αλληλεπίδραση μονοαλογονού παραγώγου μεΝα
Β) βρωμίωση Δ) καμία τέτοια αντίδραση
32. Η αντίδραση που οδηγεί σε επιμήκυνση της ανθρακικής αλυσίδας είναι
1) ισομερισμός αλκανίων 3) υδρογόνωση αλκενίων
2) αποκαρβοξυλίωση άλατα νατρίου καρβοξυλικά οξέα 4) Αντίδραση Wurtz
33.Τι δεν σχηματίζεται κατά την αφυδρογόνωση των αλκανίων; 1) αρένες 2) αλκίνια 3) αλκένια 4) αδκαδιένια
34.Ονομάστε τα «πλησιέστερα ομόλογα» του προπανίου.
1) Γ 4 Ν 10 2) Χ.Θ 4 3) Γ 6 Ν 12 4) Γ 2 Ν 6
35 Τα αλκάνια στο εργαστήριο λαμβάνονται:
Α) κατά τη διάσπαση του λαδιού Β) υδρογόνωση του άνθρακα
Β) Αντίδραση Wurtz Δ) Αντίδραση Kucherov
36. Να αναφέρετε τον τύπο ενός αλκανίου, το οποίο είναι υγρό υπό κανονικές συνθήκες
1) Γ 4 Ν 10 2) Γ 16 Ν 34 3) Γ 7 Ν 16 4) CH 4
37. Με την αύξηση του αριθμού των ατόμων άνθρακα στα μόρια υδρογονανθράκων, το σημείο βρασμού αυτών των υδρογονανθράκων
1) δεν αλλάζει 2) μειώνεται
3) αυξάνεται 4) πρώτα αυξάνεται, μετά μειώνεται
38.Κατά τη θερμική αποσύνθεση του μεθανίου σε θερμοκρασία 1000°C 0 σχηματίζονται Γ
1) αιθάλη και υδρογόνο 2) μονοξείδιο του άνθρακα και υδρογόνο
3) διοξείδιο του άνθρακα και υδρογόνο 4) ακετυλένιο και υδρογόνο
39. Όταν το οξικό κάλιο και το υδροξείδιο του καλίου συντήκονται, απελευθερώνεται ένα αέριο προϊόν
1) υδρογόνο 2) διοξείδιο του άνθρακα 3) μεθάνιο 4) αιθάνιο
40. Το εξάνιο δεν αντιδρά με το υδροχλώριο γιατί
1) δεν υπάρχουν π δεσμοί στο μόριό του 2) το εξάνιο είναι υδρογονάνθρακας
3) το μόριο του εξανίου είναι μη πολικό 4) δεν υπάρχουν δεσμοί υδρογόνου μεταξύ των ατόμων
41. Το προϊόν αντίδρασης (κυρίαρχο) του 2-βρωμοπροπανίου με νάτριο είναι
1) 2,3-διμεθυλοβουτάνιο 2) εξάνιο 3) κυκλοεξάνιο 4) προπένιο
43. Πόσο διαφορετικές ουσίεςφαίνεται στο σχήμα: 1) 7 2) 4 3) 3 4) 2
44. Κατά την αναμόρφωση του μεθυλοκυκλοεξανίου, ως αποτέλεσμα των αντιδράσεων ισομερισμού και αφυδρογόνωσης, μετατρέπεται σε
1) αιθυλοκυκλοπεντάνιο 2) εξένιο 3) βενζόλιο 4) τολουόλιο
45. Τα αλκάνια υφίστανται τις ακόλουθες αντιδράσεις: α) υποκατάσταση. β) προσχώρηση· γ) οξείδωση; δ) πολυμερισμός. ε) ισομερισμός
1)α,β,γ 2)α,γ,ε 3)α,β,γ,δ,ε 4) β,δ,ε
46. Το αιθάνιο αλληλεπιδρά με
1) αλογόνα 2) υδρογόνο3) καρβοξυλικά οξέα 4)υδροαλογονίδια
47. Η μετατροπή του βουτανίου σε βουτένιο αναφέρεται στην αντίδραση
1) πολυμερισμός 2) αφυδρογόνωση 3) αφυδάτωση 4) ισομερισμός
48. Το δομικό ισομερές του κανονικού ν-εξανίου είναι
1) 3-αιθυλοπεντάνιο 2) 2-μεθυλπροπάνιο 3) 2,2-διμεθυλπροπάνιο 4)2,2-διμεθυλβουτάνιο
49. Η αλληλεπίδραση του μεθανίου με το χλώριο είναι αντίδραση
1) ενώσεις, εξώθερμες 2) υποκατάσταση, ενδόθερμες
3) ενώσεις, ενδόθερμες 4) υποκατάσταση, εξώθερμες
50. Είναι αλήθεια; τις ακόλουθες κρίσειςγια τους υδρογονάνθρακες;
Α. Όλα τα αλκάνια είναι αέρια.
Β. Το μεθάνιο αποχρωματίζει ένα υδατικό διάλυμα υπερμαγγανικού καλίου.
1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο κρίσεις είναι σωστές 4) και οι δύο κρίσεις είναι λανθασμένες
51. Το βουτάνιο μπορεί να ληφθεί με την αντίδραση Wurtz, το σχήμα της οποίας είναι
1) C 4 H 8 t°"γάτα → 2) C 4 H 9 C1 + KOH (αλκοόλ) → 3) C 2 H 5 C1 + Na → 4) 2 C 2 H 4 t°"γάτα →
Δοκιμή με θέμα «Αλκάνια» 2016
52. Το ισοβουτάνιο αντιδρά με
1) υδροχλωρικό οξύ 2) υδρογόνο 3) υδροβρώμιο 4) νιτρικό οξύ
53. Η αλληλεπίδραση του μεθανίου με το χλώριο είναι αντίδραση
1) αντικατάσταση, μη αναστρέψιμη 3) ανταλλαγή, μη αναστρέψιμη
2) αντικατάσταση, αναστρέψιμη 4) ανταλλαγή, αναστρέψιμη
54. Κατά τη θέρμανση ενός μείγματος 2-χλωροπροπανίου και χλωροαιθανίου με μέταλλο νατρίου, σχηματίζεται χλωριούχο νάτριο και ένα μείγμα
1) 2,3-διμεθυλβουτάνιο, βουτάνιο, 2-μεθυλβουτάνιο 2) εξάνιο, 2-μεθυλβουτάνιο, 1,2-διχλωροαιθάνιο
3) 2,3-διμεθυλβουτάνιο, βουτάνιο, 2-μεθυλβουτάνιο 4) 2,3-διμεθυλβουτάνιο, 2-μεθυλβουτάνιο, βουτάνιο
55 Ποιες από τις παρακάτω προτάσεις είναι σωστές;
Α. Η αφυδροκυκλοποίηση του ν-επτανίου παράγει βενζόλιο.
Β. Το μεθάνιο δεν υφίσταται αντιδράσεις προσθήκης.
1) μόνο το Α είναι αληθές 2) μόνο το Β είναι αληθές 3) και οι δύο προτάσεις είναι αληθείς 4) και οι δύο προτάσεις είναι ψευδείς
56.Όνομα αλκανίου Χ.Θ 3 -CH (CH 3 ) -CH 2 -C (CH 3 ) 2 - CH 3
57. Το 2-χλωροβουτάνιο σχηματίζεται κυρίως από την αντίδραση
1) βουτένιο-1 και χλώριο 2) βουτίνη-1 και υδροχλώριο
3) βουτάνιο και χλώριο 4) βουτίνη-2 και υδροχλώριο
58. Το μεθάνιο αντιδρά
1) με υδροχλώριο 2) με υδρατμούς σε καταλύτη
3) ισομερισμός 4) με βρωμιούχο νερό
59. Περιέχει έξι άτομα άνθρακα
1)2-μεθυλοβουτάνιο2)2,2-
διμεθυλβουτάνιο 3) 2-μεθυλπροπάνιο 4) 3-μεθυλεξάνιο
60. Το 2-μεθυλπεντάνιο και το 2-μεθυλεξάνιο είναι σχετικά μεταξύ τους
1) ανάλογα 2) ρίζες 3) ομόλογα 4) ισομερή
61. Μπορεί να παραχθεί αιθάνιο
1) αφυδάτωση αιθανόλης 2) ηλεκτρόλυση διαλύματος οξικού καλίου
3) υδρογόνωση αιθανόλης 4) αφυδάτωση αιθανοϊκού οξέος
62. Ισομερή είναι
1)3-μεθυλεξάνιο και οκτάνιο 2)3-αιθυλοπεντάνιο και 3-μεθυλπεντάνιο
3)2,2-διμεθυλπεντάνιο και 2,2-διμεθυλεξάνιο 4)2-μεθυλπεντάνιο και εξάνιο
64.Αριθμός οργανική ύλη, που σχηματίζονται όταν το βρωμομεθάνιο και το βρωμοαιθάνιο θερμαίνονται με μέταλλο νάτριο, ισούται με 1) 1 2)2 3)3 4)4
Καθήκοντα υψηλότερο επίπεδοδυσκολίες
66. Όλα τα αλκάνια μπορούν να αντιδράσουν με:
1) υδρογόνο 2) οξυγόνο 3) νερό
4) χλώριο 5) υδροχλώριο 6) νιτρικό οξύ Απάντηση____________
67 Το μεθάνιο χαρακτηρίζεται από:
1) αντίδραση υδρογόνωσης 2) τετραεδρικό σχήμα του μορίου
3) διαθεσιμότητα π -δεσμοί στο μόριο 5) αντιδράσεις με υδραλογονίδια
4) sp 3 -υβριδισμός των τροχιακών του ατόμου άνθρακα στο μόριο
6) καύση στον αέρα Απάντηση: ________
68. Εμφανίζεται η αντίδραση του προπανίου με το χλώριο
1) με μηχανισμό ριζικής αλυσίδας2) με τον ενδιάμεσο σχηματισμό ενός σωματιδίου CH 3 -SN + -SN 3
3) χωρίς καταλύτη 4) σε υδατικό διάλυμα
5) με σχηματισμό προπενίου 6) με ρήξησ -δεσμοί στο μόριο προπανίουΑπάντηση____________
69 Αντίδραση προπανίου και βρωμίου
3) οδηγεί στον κατά προτίμηση σχηματισμό 2-βρωμοπροπανίου
4) οδηγεί στον προτιμησιακό σχηματισμό 1-βρωμοπροπανίου
5) εμφανίζεται συνήθως στο σκοτάδι
6) είναι μια καταλυτική διαδικασία Απάντηση: _______
69.Χλωρίωση μεθανίου
1) οδηγεί σταθερά στον σχηματισμό διαφόρων υποκατεστημένου με χλώριο μεθανίου
2) ξεκινά με τη διαδικασία διάσπασης του δεσμού στο μόριο του μεθανίου
3) αναφέρεται σε ριζικές αντιδράσεις
4) εκτελείται στο σκοτάδι
5) είναι μια τυπική καταλυτική διαδικασία
6) αναφέρεται σε εξώθερμες διεργασίες Απάντηση: _________
70.Χλωρίωση μεθανίου
1) ρέει μέσα ιοντικό μηχανισμό 2) αναφέρεται σε ριζικές αντιδράσεις
3) ξεκινά με τη διαδικασία διάσπασης του δεσμού στο μόριο χλωρίου 5) αναφέρεται σε ενδόθερμες διεργασίες
4) προχωρά μέσω μιας ενδιάμεσης αντίδρασης: CH 4 →C + 4H 6) οδηγεί στο σχηματισμό χλωρομεθανίου
Απάντηση: __________
71. Ο μηχανισμός της αντίδρασης χλωρίωσης μεθανίου περιλαμβάνει τα ακόλουθα στάδια:
1)CH 4 → CH 3 + H 2) C1 2 → 2C1
3)C1 + CH 4 → CH 3 C1 + H 4) CH 4 → C + 4H
5) C1 2 + CH 4 → CH 3 C1 + HC1 6) H + Cl → HC1
Απάντηση: __________
72. Αντίδραση 2-μεθυλοπροπανίου και βρωμίου
1) αναφέρεται σε αντιδράσεις υποκατάστασης
2) προχωρά μέσω ενός ριζοσπαστικού μηχανισμού
3) οδηγεί στον κατά προτίμηση σχηματισμό 1-βρωμο-2-μεθυλοπροπανίου
4) οδηγεί στον προτιμώμενο σχηματισμό 2-βρωμο-2-μεθυλοπροπανίου
5) εμφανίζεται συνήθως στο σκοτάδι
6) είναι μια καταλυτική διαδικασία Απάντηση: __________
73. Το 2-μεθυλοβουτάνιο χαρακτηρίζεται από το γεγονός ότι
1) χρησιμοποιείται για την παραγωγή ισοπρενίου
2) αλληλεπιδρά με το χλώριο παρουσία A1C1 3
3) κατά τη χλωρίωση σχηματίζει κυρίως 2-χλωρο-2-μεθυλοβουτάνιο
4) είναι ένα ισομερές διμεθυλοπροπανίου
5) όταν αλληλεπιδρά με το υδροξείδιο του χαλκού (II), σχηματίζει 2-μεθυλοβουτανάλη
6) δεν σχηματίζει εκρηκτικά μείγματα με τον αέρα
Απάντηση:__________
74.Ο Ίθαν χαρακτηρίζεται από το γεγονός ότι αυτός
1) μπορεί να ληφθεί με ηλεκτρόλυση προπιονικού καλίου 2) αλληλεπιδρά με το βρώμιο στο φως
3) κατά την αφυδρογόνωση μετατρέπεται διαδοχικά σε αιθυλένιο και ακετυλένιο
4) υφίσταται αντίδραση Wurtz 5) οξειδώνεται από τον αέρα σε συνθήκες περιβάλλοντος.
6) είναι ομόλογο του οκτανίου Απάντηση: ______________
75. Η αντίδραση βρωμίωσης μεθανίου προχωρά
1) με ριζικό μηχανισμό 2) σε ένα στάδιο
3) με σχηματισμό διαφόρων βρωμοπαραγώγων 4) στο σκοτάδι και χωρίς θέρμανση
5) με απελευθέρωση θερμότητας
6) σύμφωνα με τον κανόνα του V.V. Markovnikov Απάντηση: _____.
76. Για την παραγωγή μεθανίου μπορείτε να χρησιμοποιήσετε τις ακόλουθες αντιδράσεις:
1) θέρμανση οξικού καλίου με υδροξείδιο του καλίου 2) αποσύνθεση του αιθανίου όταν θερμαίνεται
3) υδρόλυση καρβιδίου του αργιλίου 4) χλωρομεθάνιο με νάτριο
5) αναγωγή μεθανάλης 6) υδρογόνο με άνθρακα Απάντηση: _________
77. Η αλληλεπίδραση προχωρά σύμφωνα με τον ριζοσπαστικό μηχανισμό
1) προπένιο και βρωμιούχο νερό 2) προπένιο και υδροβρώμιο
3) προπένιο και χλώριο (σε υδατικό διάλυμα) 4) προπένιο και χλώριο (στους 500°C)
5) αιθάνιο και οξυγόνο 6) μεθάνιο και χλώριο
Απάντηση: ________
78. Το μεθάνιο σχηματίζεται όταν
1) υδρόλυση του καρβιδίου του ασβεστίου CaC 2 2) υδρόλυση του καρβιδίου του αργιλίου Α1 4 ΜΕ 3
3) υδρογόνωση αιθυλενίου 4) φρύξη οξικού νατρίου με υδροξείδιο νατρίου
5) αποσύνθεση βενζολίου 6) αφυδάτωση εθυλική αλκοόληΑπάντηση: ____________ .
79. Το βουτάνιο χαρακτηρίζεται από:
1) ισομερισμός 4) αλληλεπίδραση με νάτριο
2) ενυδάτωση 5) υδρογόνωση
3) αλληλεπίδραση με αλογόνα 6) καταλυτική οξείδωση
Απάντηση: ____________
80. Επιλέξτε τα χαρακτηριστικά του αιθανίου:
Α) αέρια ουσία Β) καίγεται με ωχρογαλαζωπή φλόγα
Γ) έχει πικάντικη οσμή Δ) 1,5 φορές βαρύτερη από το υδρογόνο
Ε) διαλυτό στο νερό Ε) υφίσταται αντιδράσεις προσθήκης
Απάντηση: _____________________
– αυτοί είναι κορεσμένοι (ή κορεσμένοι) μη κυκλικοί υδρογονάνθρακες στους οποίους δεσμεύονται όλοι οι δεσμοίμονόκλινο.
Γενικός τύπος:
C n H 2 n +2
Όλα τα άτομα άνθρακα στα αλκάνια έχουν sp 3 - υβριδισμός.
Τα πρώτα τέσσερα μέλη της ομόλογης σειράς αλκανίων είναι αέρια, τα C5–C17 είναι υγρά και ξεκινώντας από το C18 είναι στερεά. Όλα τα αλκάνια είναι ελαφρύτερα από το νερό, αδιάλυτα στο νερό και δεν αναμειγνύονται με αυτό.
Χημικές ιδιότητες.
1) Ο δεσμός του άνθρακα με το υδρογόνο στα αλκάνια είναι χαμηλής πολικότητας.
2) Επομένως, η ρήξη του στις αντιδράσεις είναι δυνατή μόνο με ομολυτικό μηχανισμό:
Αυτό είναι δυνατό μόνο σε σκληρές συνθήκες.
3) Οι κορεσμένοι (κορεσμένοι) υδρογονάνθρακες δεν έχουν την ικανότητα να μπαίνουν σε αντιδράσεις προσθήκης. Χαρακτηρίζονται από αντιδράσεις υποκατάστασης άτομα υδρογόνου και δυνατός. Αυτές οι αντιδράσεις συμβαίνουν είτε με τη θερμότητα, είτε με το φως, είτε με τη χρήση καταλυτών.
Αλκάνια μην αντιδράςΜε συμπυκνωμένα οξέα, αλκάλια, υπερμαγγανικό κάλιο, βρωμιούχο νερό.
I. Αντιδράσεις υποκατάστασης.
1) Αλογόνωση: ριζική υποκατάσταση.
Χλώριο και βρώμιο σε φως ή θερμότητα.
Α) χλωρίωση: η διαδικασία είναι γρήγορη, επομένως προχωρά αδιάκριτα, σχηματίζεται ένα μείγμα προϊόντων υποκατάστασης:
CH 3 - CH 2 - CH 3 + Cl 2 – (ελαφρύ) CH 3 -CH 2 -CH 2 Cl + CH 3 -CHCl-CH 3 + HCl
Β) βρωμίωση:
CH 3 CH 3
CH 3 -CH 2 -CH -CH 3 +Br 2 – (ελαφρύ) CH3-CH2-C-CH3 + HBr
Η βρωμίωση είναι μια πιο αργή και επιλεκτική διαδικασία.
Επιλεκτικότητα βρωμίωσης:
τριτογενές > δευτερεύον > πρωτογενές άτομο άνθρακα.
Μηχανισμός ριζικής αντικατάστασης:Αλυσίδα ελεύθερες ρίζες.
Ελεύθερες ρίζες R ∙ είναι ένα ΠΟΛΥ ΕΝΕΡΓΟ σωματίδιο που φέρει ένα ασύζευκτο ηλεκτρόνιο και τείνει να σχηματίσει δεσμό με κάποιο άλλο άτομο.
1) Έναρξη κυκλώματος (έναρξη): Ένα μόριο χλωρίου διασπάται σε δύο ρίζες με τη δράση ενός ελαφρού κβαντικού. Cl · :
2) Ανάπτυξη αλυσίδας: Η ρίζα χλωρίου αφαιρεί ένα άτομο υδρογόνου από το αλκάνιο. Σε αυτή την περίπτωση, σχηματίζεται ένα ενδιάμεσο σωματίδιο - μια ρίζα αλκυλίου, η οποία με τη σειρά της αφαιρεί ένα άτομο χλωρίου από το μόριο Cl 2. Σε αυτή την περίπτωση, λαμβάνεται ξανά μια ρίζα χλωρίου και η διαδικασία επαναλαμβάνεται - η αλυσίδα συνεχίζει:
3) Ανοικτό κύκλωμα: ο συνδυασμός δύο ριζών σε ένα μόριο.
2) Νίτρωση
(αντίδραση του M.I. Konovalov):
Ο μηχανισμός αντίδρασης είναι επίσης ριζικός.
Θέρμανση στους 140°C με αραιό (10%) νιτρικό οξύ:
CH 3 CH 3
CH3-CH2-CH-CH3 + HNO3 CH3-CH2-C-CH3 + H2O
Επιλεκτικότητα νίτρωσης: ΟΧΙ 2
τριτογενές > δευτερεύον > πρωτογενές άτομο άνθρακα.
3) Πυρόλυση - μετατροπή αλκανίων υπό την επίδραση της θερμότητας.
α) Για αλκάνια μακράς αλυσίδας, η πυρόλυση παράγει ένα αλκάνιο και ένα αλκένιο. Επιπλέον, με μήκος μεγαλύτερο από 5 άτομα C, το αποτέλεσμα είναι ένα μείγμα υδρογονανθράκων διαφορετικού μήκους.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3 - CH 3 + CH 2 = CH 2
σι) Πυρόλυση μεθανίουσυμβαίνει με δύο πιθανούς τρόπους:
1. μακροχρόνια θέρμανση μεθανίου: CH 4 - 1500° C C+2H2
2. στιγμιαία θέρμανση στους 1500 βαθμούς και άμεση ψύξη:
2CH 4 - 1500° C H–C ≡ C –H + 3H 2
Ασετυλίνη
4) Ισομερισμός - αναδιάταξη του ανθρακικού σκελετού με σχηματισμό άλλων ισομερών:όταν θερμαίνεται με καταλύτη AlCl 3.
CH3-CH2-CH2-CH3-(100 o, AlCl3) CH 3 - CH - CH 3
5) Οξείδωση:
1) Καύση:
CH 4 + 2O 2 ⇆ CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆ 5CO 2 + 6H 2 O
2) Καταλυτική οξείδωση:
Μεθάνιο: CH 4 + O 2 - (καταλύτης) ένα μείγμα CH 3 OH, HSON και HCOOH
Βουτάνιο: C 4 H 10 + O 2 - (καταλύτης) 2 CH 3 COOH ( οξικό οξύ)
6) Αφυδρογόνωση και κυκλοποίηση.
1) Τα βραχέα αλκάνια αφυδρογονώνονται σε αλκένια ή διένια:
C 2 H 6 – (κατ., t) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 – (κατ. Cr 2 O 3, t) βουταδιένιο + Η 2
2) Παρουσία καταλύτη, το εξάνιο και το επτάνιο μετατρέπονται σε βενζόλιο και τολουόλιο, αντίστοιχα.
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 – (κατ. Pt, t) + 4 H 2
Παραλαβή:
1) Αντίδραση Wurtz:επίδραση του μεταλλικού νατρίου στα μονοαλογόνα παράγωγα υδρογονανθράκων:
2CH 3 –Χ 2 Br + 2Na CH 3 –Χ 2 –Χ 2 –Χ 3 +2NaBr
Ο σκελετός άνθρακα διπλασιάζεται. Η αντίδραση είναι κατάλληλη για την παρασκευή συμμετρικών αλκανίων.
2) Αποκαρβοξυλίωση αλάτων καρβοξυλικού οξέος(αντίδραση Dumas): σύντηξη αλάτων καρβοξυλικών οξέων με αλκάλια.
Έτσι παράγεται το μεθάνιο με θέρμανση οξικού νατρίου με υδροξείδιο του νατρίου.
CH 3 COONa + NaOH( σύντηξη) CH 4 +Να 2 CO 3
3) Ηλεκτρόλυση διαλυμάτων αλάτων καρβοξυλικού οξέος(αντίδραση Kolbe):
2CH 3 COONa + 2H 2 O – (ηλεκτρικό ρεύμα) 2CO 2 + H 2 + C 2 H 6 + 2NaOH
κάθοδος:
το νερό εκκενώνεται: 2Η 2 O + 2e Ν 2 + 2ΟΗ -
άνοδος:
εκκένωση ανιόντων οξέος: 2CH 3 ΕΤΣΙ - -2ε 2CO 2 + CH 3 -SN 3
4) Υδρόλυση καρβιδίου αλουμινίου– παραγωγή μεθανίου.
Ο Αλ 4 ντο 3 +12H 2 Ο 3CH 4 + 4Al(OH) 3
5) Υδρογόνωση ακόρεστων ή κυκλικών υδρογονανθράκωνπαρουσία καταλυτών (πλατίνα, παλλάδιο, νικέλιο).
R–CH=CH–R’ + H 2 – κατ R–CH 2 –Χ 2 -R'
(κυκλοπροπάνιο) + Η 2 – Pd CH 3 –Χ 2 –Χ 3 (προπάνιο)
6) Τα αλκάνια μπορούν να ληφθούν από το πετρέλαιο με πυρόλυση ή κλασματική απόσταξη.
Ετοιμαζόμαστε για την Ενιαία Κρατική Εξεταστική.Αλκάνυ.
ΑΛΚΑΝΙΟ (κορεσμένοι υδρογονάνθρακες, παραφίνες)
Τα αλκάνια είναι αλειφατικοί (άκυκλοι) κορεσμένοι υδρογονάνθρακες στους οποίους τα άτομα άνθρακα αλληλοσυνδέονται με απλούς (μονούς) δεσμούς σε ευθείες ή διακλαδισμένες αλυσίδες, μεμε τον γενικό τύπο C n H 2n+2, όπου n ≥1.
Αλκάνια – ονομασία κορεσμένων υδρογονανθράκων κατά διεθνής ονοματολογία.
Παραφίνες – ένα ιστορικά καθιερωμένο όνομα που αντικατοπτρίζει τις ιδιότητες αυτών των ενώσεων (από το Lat. parrum affinis – μικρή συγγένεια, χαμηλή δραστηριότητα).
Ακραία, ή κορεσμένα , αυτοί οι υδρογονάνθρακες ονομάζονται λόγω του πλήρους κορεσμού της ανθρακικής αλυσίδας με άτομα υδρογόνου.
Ομόλογες σειρές αλκανίων
Αλκάνια, που έχουν γενικό τύπο C n H 2n+2 , είναι μια σειρά σχετικών ενώσεων με την ίδια δομή, στην οποία κάθε επόμενο μέλος διαφέρει από το προηγούμενο κατά μια σταθερή ομάδα ατόμων (-CH 2 -). Αυτή η ακολουθία συνδέσεων ονομάζεταιομόλογες σειρές(από το ελληνικό ομόλογο - παρόμοια), μεμονωμένα μέλη αυτής της σειράς -ομόλογα , και η ομάδα ατόμων στα οποία διαφέρουν τα γειτονικά ομόλογα είναιομολογική διαφορά.
- CH 4 – πρώτο μέλος της ομόλογης σειράς –μεθάνιο (περιέχει 1 άτομο C).
- CH 3 - CH 3 ή CH 3 - CH 3 - αιθάνιο (2 άτομα C).
- CH 3 -CH 2 -CH 3 ή CH 3 - CH 2 - CH 3 - προπάνιο (3 άτομα C).
- CH 3 -CH 2 -CH 2 -CH 3 ή CH 3 - CH 2 - CH 2 - CH 3 – βουτάνιο (4 άτομα C).
Επίθημα -αν είναι χαρακτηριστικό των ονομάτων όλων των αλκανίων. Ξεκινώντας από το πέμπτο ομόλογο, το όνομα του αλκανίου σχηματίζεται από τον ελληνικό αριθμό, που δείχνει τον αριθμό των ατόμων άνθρακα στο μόριο και το επίθημα-ανιο: πεντάνιο C5H12, εξάνιο C6H14, επτάνιο C7H16, οκτάνιο C8H18, εννεάνιο C9H20, δεκάνιο C10H22, κ.λπ.
Τα ομόλογα διαφέρουν ως προς το μοριακό βάρος και, ως εκ τούτου, στις φυσικές ιδιότητες. Με την αύξηση του αριθμού των ατόμων άνθρακα σε ένα μόριο αλκανίου σε μια ομόλογη σειρά, παρατηρείται μια φυσική αλλαγή στις φυσικές ιδιότητες των ομολόγων: οι θερμοκρασίες βρασμού και τήξης αυξάνονται και η πυκνότητα αυξάνεται. Όλα τα αλκάνια είναι ελαφρύτερα από το νερό και είναι αδιάλυτα σε αυτό, αλλά είναι διαλυτά σε μη πολικούς διαλύτες (για παράδειγμα, βενζόλιο) και είναι από μόνα τους καλοί διαλύτες. Αλκάνια από CH 4 έως C 4 H 10 – αέρια, από C 5 H 12 έως C 17 H 36 – υγρά, μετά – στερεά. Έχοντας το ίδιο σύνθεση υψηλής ποιότηταςκαι τον ίδιο τύπο χημικών δεσμών, τα ομόλογα έχουν παρόμοιες χημικές ιδιότητες. Επομένως, γνωρίζοντας Χημικές ιδιότητεςένα από τα μέλη μιας ομόλογης σειράς, είναι δυνατό να προβλεφθεί η χημική συμπεριφορά άλλων μελών αυτής της σειράς.
Δομή αλκανίων
Τα αλκάνια έχουν δύο τύπους χημικών δεσμών:
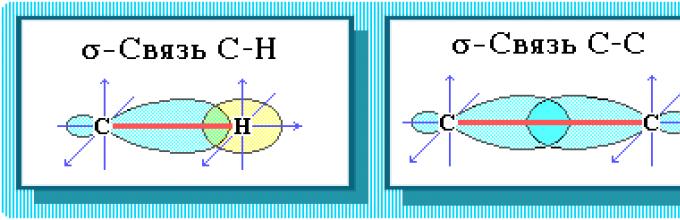
C–C και C–H.
Ο δεσμός C-C είναι ομοιοπολικός μη πολικός. Ο δεσμός C–H είναι ομοιοπολικός, ασθενώς πολικός, επειδή άνθρακας και υδρογόνου είναι κοντά σε ηλεκτραρνητικότητα).
Όλα τα άτομα άνθρακα στα αλκάνια βρίσκονται σε κατάσταση sp 3-υβριδισμός.
Τέσσερις δεσμοί σ άνθρακα κατευθύνονται στο διάστημα υπό γωνία 109Ο 28", που αντιστοιχεί στην ελάχιστη απώθηση ηλεκτρονίων. Επομένως, το μόριο του απλούστερου αντιπροσώπου των αλκανίων - μεθανίου CH 4 – έχει σχήμα τετραέδρου, στο κέντρο του οποίου υπάρχει άτομο άνθρακα, και στις κορυφές υπάρχουν άτομα υδρογόνου.
Ισομέρεια αλκανίων
Ισομέρεια είναι το φαινόμενο της ύπαρξης ενώσεων που έχουν την ίδια σύσταση (ίδια μοριακός τύπος), αλλά διαφορετική δομή. Τέτοιες συνδέσεις ονομάζονταιισομερή.
Οι διαφορές στη σειρά με την οποία τα άτομα συνδυάζονται στα μόρια (δηλαδή, η χημική δομή) οδηγούν σεδομική ισομέρεια (ισομέρεια σκελετού άνθρακα). Στη σειρά των αλκανίων, η δομική ισομέρεια εκδηλώνεται όταν η αλυσίδα περιέχει 4 ή περισσότερα άτομα άνθρακα, δηλ. ξεκινώντας με βουτάνιο C 4 Ν 10 . Για παράδειγμα, ένα αλκάνιο της σύνθεσης C 4 Η 10 μπορεί να υπάρχει στη μορφήδύο δομικά ισομερή:
CH 3 – CH 2 – CH 2 – CH 3 (βουτάνιο) και CH 3 – CH(CH 3 ) – CH 3 (2-μεθυλπροπάνιο).
Τα δομικά ισομερή διαφέρουν ως προς τις φυσικές ιδιότητες. Τα αλκάνια με διακλαδισμένη δομή, λόγω της λιγότερο πυκνής συσσώρευσης μορίων και, κατά συνέπεια, των λιγότερων διαμοριακών αλληλεπιδράσεων, βράζουν σε χαμηλότερη θερμοκρασία από τα μη διακλαδισμένα ισομερή τους.
Χημικές ιδιότητες των αλκανίων
Το ασήμαντο (ιστορικό) όνομα για τα αλκάνια - "παραφίνες" - σημαίνει "δεν έχω συγγένεια". Αλκάνια στο φυσιολογικές συνθήκεςχημικά ανενεργό. Χαμηλός αντιδραστικότηταΤα αλκάνια οφείλονται στην πολύ χαμηλή πολικότητα των δεσμών C-C και C-H στα μόριά τους λόγω της σχεδόν πανομοιότυπης ηλεκτραρνητικότητας των ατόμων άνθρακα και υδρογόνου. Οι κορεσμένοι υδρογονάνθρακες υπό κανονικές συνθήκες δεν αλληλεπιδρούν με συμπυκνωμένα οξέα, αλκάλια ή ακόμη και με ένα τέτοιο ενεργό αντιδραστήριο όπως το υπερμαγγανικό κάλιο. Τα αλκάνια είναι γενικά ανίκανα για αντιδράσεις προσθήκης λόγω του ακραίου κορεσμού όλων των δεσμών των ατόμων άνθρακα.
I. Αντιδράσεις υποκατάστασης
Κάτω από ορισμένες συνθήκες (όταν θερμαίνονται, ή στο φως, ή με τη χρήση καταλυτών), οι δεσμοί C-H σπάνε και τα άτομα υδρογόνου αντικαθίστανται από άλλα άτομα ή ομάδες ατόμων. Σε αυτές τις αντιδράσεις, λαμβάνει χώρα ομολυτική διάσπαση ομοιοπολικών δεσμών, δηλαδή διεξάγονται με μηχανισμό ελεύθερων ριζών (αλυσίδα).
1) Αλογόνωση
Η αλογόνωση των αλκανίων είναι η αντίδραση αντικατάστασης ενός ή περισσότερων ατόμων υδρογόνου σε ένα μόριο αλκανίου με ένα αλογόνο. Τα προϊόντα της αντίδρασης ονομάζονται αλογονοαλκάνια ή παράγωγα αλογόνου των αλκανίων R-Cl ή C n H 2n+1 – Cl.
Η αντίδραση των αλκανίων με το χλώριο και το βρώμιο συμβαίνει στο φως ή όταν θερμαίνονται.
Χλωρίωση μεθανίου:
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1ο στάδιο)
(hν - ελαφρύ κβαντικό, CH 3 Cl - χλωρομεθάνιο)
Εάν υπάρχει αρκετό χλώριο, η αντίδραση συνεχίζεται περαιτέρω:
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (στάδιο 2)
(CH 2 Cl 2 - διχλωρομεθάνιο)
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3ο στάδιο)
(CHCl 3 – τριχλωρομεθάνιο ή χλωροφόρμιο)
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4ο στάδιο)
(CCl 4 - τετραχλωράνθρακα)
Η αντίδραση αλογόνωσης των αλκανίων λαμβάνει χώρα μέσω ενός μηχανισμού ριζικής αλυσίδας. Στην ανάπτυξη της θεωρίας των αλυσιδωτών αντιδράσεων, τα έργα του ακαδημαϊκού, βραβευμένου βραβείο Νόμπελ N.N. Semenova.
Ο ρυθμός της αντίδρασης αντικατάστασης του υδρογόνου με ένα άτομο αλογόνου είναι υψηλότερος για τα αλογονοαλκάνια παρά για το αντίστοιχο αλκάνιο, αυτό οφείλεται στο αμοιβαία επιρροήάτομα σε ένα μόριο. Καθώς η ρίζα υδρογονάνθρακα αυξάνεται, τα πιο κινητικά άτομα υδρογόνου παραμένουν στο άτομο άνθρακα που βρίσκεται πλησιέστερα στον υποκαταστάτη:
CH 3 –CH 2 –Cl + Cl 2 hν → CH 3 – CHCl 2 + HCl
(CH 3 – CHCl 2 – 1,1-διχλωροαιθάνιο)
Κατά τη χλωρίωση ή τη βρωμίωση ενός αλκανίου με δευτερογενή ή τριτοταγή άτομα άνθρακα, είναι ευκολότερο να αντικατασταθεί το υδρογόνο στο τριτοταγές άτομο, πιο δύσκολο στο δευτερεύον και ακόμη πιο δύσκολο στο πρωτεύον. Αυτό εξηγείται από τη μεγαλύτερη σταθερότητα των τριτογενών και δευτερογενών ριζών υδρογονάνθρακα σε σύγκριση με τις πρωτογενείς λόγω της μετεγκατάστασης του μη ζευγαρωμένου ηλεκτρονίου. Επομένως, για παράδειγμα, κατά τη βρωμίωση του προπανίου, το κύριο προϊόν αντίδρασης είναι το 2-βρωμοπροπάνιο:
Με το φθόριο η αντίδραση συμβαίνει εκρηκτικά.
2) Νίτρωση (αντίδραση Konovalov)
Παρά το γεγονός ότι υπό κανονικές συνθήκες τα αλκάνια δεν αντιδρούν με πυκνό νιτρικό οξύ, όταν θερμαίνονται στους 140°C με αραιό (10%) νιτρικό οξύ υπό πίεση, εμφανίζεται μια αντίδραση νίτρωσης - η αντικατάσταση ενός ατόμου υδρογόνου με μια νιτροομάδαΝΟ2. Προϊόντα αντίδρασης – νιτροαλκάνια R-NO 2 ή C n H 2n+1 – NO 2.
Σχέδιο αντίδρασης:
CH 4 + HNO 3 t˚С,Р → CH 3 NO 2 + H 2 Ο (νίτρωση του μεθανίου παράγει νιτρομεθάνιο).
Στις αντιδράσεις, τα άτομα υδρογόνου αντικαθίστανται πιο εύκολα σε τριτοταγή άτομα άνθρακα, μετά σε δευτερεύοντα και, τέλος, σε πρωτεύοντα άτομα.
3) Σουλφονίωση
Το θειικό οξύ σε συνηθισμένες θερμοκρασίες δεν έχει καμία επίδραση στα αλκάνια, αλλά σε χαμηλές θερμοκρασίες συμπυκνώνεταιθειικό οξύμπορεί να δράσει στο όριουδρογονάνθρακεςπου οδηγεί στην αντικατάσταση ενός ατόμου υδρογόνου με μια σουλφοομάδα SO 3Η
II. Αντιδράσεις οξείδωσης αλκανίων
Σε συνηθισμένες θερμοκρασίες, τα αλκάνια δεν αντιδρούν ακόμη και με ισχυρά οξειδωτικά μέσα (H 2 Cr 2 O 7, KMnO 4, κ.λπ.).
1) Όταν εισάγονται σε ανοιχτή φλόγα, τα αλκάνια καίγονται. Σε αυτή την περίπτωση, σε περίσσεια οξυγόνου, οξειδώνονται πλήρως σε CO 2 και νερό. Η καύση των υδρογονανθράκων συνοδεύεται από την απελευθέρωση μεγάλης ποσότητας θερμότητας (εξώθερμη αντίδραση).
CH 4 + 2O 2 →CO 2 + 2H 2 O+ Q
C 5 H 12 + 8O 2 →5CO 2 + 6H 2 O + Q
Η εξίσωση για την αντίδραση καύσης των αλκανίων σε γενική μορφή:
Από αυτή την εξίσωση προκύπτει ότι με την αύξηση του αριθμού των ατόμων άνθρακα ( n ) σε ένα αλκάνιο αυξάνεται η ποσότητα οξυγόνου που απαιτείται για την πλήρη οξείδωσή του. Κατά την καύση υψηλότερων αλκανίων ( n >>1) το οξυγόνο που περιέχεται στον αέρα μπορεί να μην είναι αρκετό για την πλήρη οξείδωσή τους σε CO 2
. Στη συνέχεια σχηματίζονται προϊόντα μερικής οξείδωσης:μονοξείδιο του άνθρακα CO,
αιθάλη (λεπτός άνθρακας, μηδέν βαθμόοξείδωση). Επομένως, τα υψηλότερα αλκάνια καίγονται στον αέρα με μια καπνιστή φλόγα και το τοξικό μονοξείδιο του άνθρακα που απελευθερώνεται στην πορεία (άοσμο και άχρωμο) αποτελεί κίνδυνο για τον άνθρωπο.
Η καύση του μεθανίου με έλλειψη οξυγόνου συμβαίνει σύμφωνα με τις εξισώσεις:
2CH 4 + 3O 2 → 2CO + 4H 2 O
CH 4 + O 2 → C + 2H 2 O
2) Καταλυτική οξείδωση με ατμοσφαιρικό οξυγόνο.
Η μερική οξείδωση των αλκανίων σε σχετικά χαμηλή θερμοκρασία και με τη χρήση καταλυτών συνοδεύεται από τη ρήξη μόνο μέρους των δεσμών C-C και C-H και χρησιμοποιείται για τη λήψη πολύτιμων προϊόντων: καρβοξυλικά οξέα, κετόνες, αλδεΰδες και αλκοόλες.
2CH 4 + O 2 → 2CH 3 OH (CH 3 OH - μεθανόλη)
CH 4 + O 2 →HCOH +H 2 O (HCOH - μεθανάλη)
2CH 4 + 3O 2 → 2HCOOH +2H 2 O (HCOOH – μεθανοϊκό οξύ)
Όταν το βουτάνιο οξειδώνεται ατελώς, λαμβάνεται οξικό οξύ:
2C 4 H 10 + 5O 2 → 4СH 3 COOH + 2H 2 O
ΙΙΙ. Θερμικοί μετασχηματισμοί αλκανίων
1) Πυρόλυση αλκανίων– η διαδικασία της θερμικής αποσύνθεσης των υδρογονανθράκων, η οποία βασίζεται στις αντιδράσεις διάσπασης της ανθρακικής αλυσίδας των μεγάλων μορίων με το σχηματισμό μορίων αλκανίων και αλκενίων με μικρότερη αλυσίδα.
Η πυρόλυση των αλκανίων είναι η βάση της διύλισης λαδιού προκειμένου να ληφθούν προϊόντα χαμηλότερου μοριακού βάρους, τα οποία χρησιμοποιούνται ως καύσιμα κινητήρων, λιπαντικά κ.λπ., καθώς και πρώτες ύλες για τη χημική και πετροχημική βιομηχανία.
Υπάρχουν δύο τρόποι για να πραγματοποιηθεί αυτή η διαδικασία:θερμική πυρόλυση(όταν θερμαίνεται χωρίς πρόσβαση αέρα) καικαταλυτική πυρόλυση(πιο μέτρια θέρμανση παρουσία καταλύτη).
C 10 H 22 t°С → C 5 H 12 + C 5 H 10
2) Αφυδρογόνωση αλκανίων
Όταν θερμαίνονται αλκάνια παρουσία καταλυτών (Pt, Pd, Ni, Cr 2 O 3, Al 2 O 3 ) το καταλυτικό τουςαφυδρογόνωση – αφαίρεση ατόμων υδρογόνου λόγω θραύσης δεσμών C-H.
3) Ισομερισμός αλκανίων.
Τα αλκάνια κανονικής δομής υπό την επίδραση καταλυτών και κατά τη θέρμανση είναι ικανά να μετατραπούν σε διακλαδισμένα αλκάνια χωρίς να αλλάξουν τη σύσταση των μορίων, δηλ. εισέρχονται σε αντιδράσεις ισομερισμού. Αυτές οι αντιδράσεις περιλαμβάνουν αλκάνια των οποίων τα μόρια περιέχουν τουλάχιστον 4 άτομα άνθρακα.
Για παράδειγμα, ο ισομερισμός του ν-πεντανίου σε ισοπεντάνιο (2-μεθυλοβουτάνιο) συμβαίνει στους 100°C παρουσία ενός καταλύτη χλωριούχου αργιλίου:
4) Αντίδραση αφυδροκυκλοποίησης ή αρωματοποίησης
Τα αλκάνια με κύρια αλυσίδα 6 ή περισσότερων ατόμων άνθρακα εισέρχονται σε μια αντίδραση αφυδροκυκλοποίησης, αλλά πάντα σχηματίζουν έναν 6-μελή δακτύλιο (κυκλοεξάνιο και τα παράγωγά του). Υπό συνθήκες αντίδρασης, αυτός ο κύκλος υφίσταται περαιτέρω αφυδρογόνωση και μετατρέπεται στον ενεργειακά πιο σταθερό δακτύλιο βενζολίου ενός αρωματικού υδρογονάνθρακα (αρένιο). Για παράδειγμα:
Αυτές οι αντιδράσεις αποτελούν τη βάση της διαδικασίας αναμόρφωσης - την επεξεργασία των προϊόντων πετρελαίου για την παραγωγή αρένων (αρωματισμός κορεσμένων υδρογονανθράκων) και υδρογόνου. Ο μετασχηματισμός των ν-αλκανίων σε αρένες οδηγεί σε βελτίωση της αντίστασης κρούσης της βενζίνης.
5) Θερμική αποσύνθεση σε απλές ουσίες
CH 4 t → C + 2H 2
6) Πυρόλυση μεθανίου.
Στους 1500 °C εμφανίζεταιδιαμοριακή αφυδρογόνωσημεθάνιο
με το σχηματισμό ακετυλενίου:
2CH 4 1500°С → C 2 H 2 + 3H 2
Αυτή η αντίδραση χρησιμοποιείται για εργοστασιακή παραγωγήασετυλίνη.
IV. Μετατροπή μεθανίου
Η αντίδραση της αλληλεπίδρασης του μεθανίου με τους υδρατμούς είναι σημαντική, ως αποτέλεσμα της οποίας σχηματίζεται ένα μείγμα μονοξειδίου του άνθρακα (II) με υδρογόνο - «αέριο σύνθεσης»:
Αυτή η αντίδραση χρησιμοποιείται για την παραγωγή υδρογόνου. Το αέριο σύνθεσης χρησιμεύει ως πρώτη ύλη για την παραγωγή διαφόρων υδρογονανθράκων.
Παρασκευή αλκανίων
Τα αλκάνια απομονώνονται από φυσικές πηγές (φυσικά και συναφή αέρια, πετρέλαιο). Το φυσικό αέριο αποτελείται από μεθάνιο έως και 95%. Το αέριο βάλτου, που σχηματίζεται ως αποτέλεσμα της βακτηριακής επεξεργασίας (σήψης) των υδατανθράκων, έχει την ίδια σύνθεση. Τα συνδεδεμένα αέρια πετρελαίου αποτελούνται κυρίως από αιθάνιο, προπάνιο, βουτάνιο και εν μέρει πεντάνιο. Διαχωρίζονται από το λάδι σε ειδικές εγκαταστάσεις επεξεργασίας λαδιών. Ελλείψει σταθμών συμπυκνώματος αερίου, τα σχετικά αέρια πετρελαίου καίγονται σε φωτοβολίδες, κάτι που είναι μια εξαιρετικά παράλογη και σπάταλη πρακτική στην παραγωγή πετρελαίου. Ταυτόχρονα με τα αέρια, το λάδι καθαρίζεται από νερό, βρωμιά και άμμο και μετά εισέρχεται στον σωλήνα για μεταφορά. Από λάδι κατά την απόσταξη του λαμβάνεται
περισσότερες από 100 μεμονωμένες ενώσεις, ίσια και διακλαδισμένα αλκάνια, κυκλοαλκάνια και αρωματικούς υδρογονάνθρακες.
Χρησιμοποιούνται επίσης συνθετικές μέθοδοι.
- Πυρόλυση αλκανίων (βιομηχανική μέθοδος)
- Υδρογόνωση ακόρεστων υδρογονανθράκων:
C n H 2n + H 2 t˚С, Ni ή Pd → C n H 2n+2
Σύνθεση πιο πολύπλοκων αλκανίων με τη δράση μεταλλικού νατρίου σε μονοαλογονοαλκάνια με λιγότερα άτομα άνθρακα:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
Η αντίδραση Wurtz έχει νόημα μόνο για την παρασκευή από ένα αλκυλαλογονίδιο, αφού διαφορετικά ένα μείγμα αλκανίων είναι δύσκολο να διαχωριστεί σε εργαστηριακές συνθήκες.
Για παράδειγμα:
Εκτός από το προπάνιο C 3 H 8 σχηματίζεται βουτάνιο C 4 H 10 (από 2 μόρια C 2 H 5 Br ) και αιθάνιο C 2 H 6 ( από 2 μόρια CH 3 Br ).
- Θερμική αποκαρβοξυλίωση. Σύντηξη αλάτων καρβοξυλικών οξέων με αλκάλια (αντίδραση Dumas):
ή γενικά
R-COONa + NaOH R-H + Na 2 CO 3
- Ηλεκτρόλυση αλάτων καρβοξυλικών οξέων (αντίδραση Kolbe):
- Ισομερισμός. Υπό την επίδραση των καταλυτών, όταν θερμαίνονται, αλκάνια κανονικής δομής υφίστανται ισομερισμό - αναδιάταξη του σκελετού άνθρακα με σχηματισμό διακλαδισμένων αλκανίων
- Οι υγροί υδρογονάνθρακες αποτελούν σημαντικό ποσοστό των καυσίμων κινητήρων και πυραύλων και χρησιμοποιούνται ως διαλύτες.
- Το λάδι βαζελίνης (ένα μείγμα υγρών υδρογονανθράκων με έως και 15 άτομα άνθρακα) είναι ένα διαφανές, άοσμο και άγευστο υγρό, που χρησιμοποιείται στην ιατρική, την αρωματοποιία και τα καλλυντικά.
- Η βαζελίνη (ένα μείγμα υγρών και στερεών κορεσμένων υδρογονανθράκων με αριθμό ατόμων άνθρακα έως 25) χρησιμοποιείται για την παρασκευή αλοιφών που χρησιμοποιούνται στην ιατρική.
- Παραφίνη (μίγμα στερεών αλκανίων C 19 -С 35 ) - μια λευκή στερεή μάζα χωρίς οσμή και γεύση (mp 50-70 ° C) - χρησιμοποιείται για την κατασκευή κεριών, εμποτισμού σπίρτων και χαρτιού περιτυλίγματος, για θερμικές διαδικασίες στην ιατρική. Χρησιμεύει ως πρώτη ύλη για την παραγωγή οργανικών οξέων και αλκοολών, απορρυπαντικάκαι τασιενεργά.
- Κανονικοί κορεσμένοι υδρογονάνθρακες μέσου μοριακού βάρους χρησιμοποιούνται ως θρεπτικό υπόστρωμα στη μικροβιολογική σύνθεση πρωτεΐνης από λάδι.
- Μεγάλη σημασία έχουν τα παράγωγα αλογόνου των αλκανίων, τα οποία χρησιμοποιούνται ως διαλύτες, ψυκτικά και πρώτες ύλες για περαιτέρω συνθέσεις.
- Στη σύγχρονη πετροχημική βιομηχανία, οι κορεσμένοι υδρογονάνθρακες αποτελούν τη βάση για την απόκτηση μιας ποικιλίας ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ, σημαντική πρώτη ύλη στις διαδικασίες λήψης ενδιαμέσων για την παραγωγή πλαστικών, καουτσούκ, συνθετικών ινών, απορρυπαντικών και πολλών άλλων ουσιών.
Πηγές
- Γ.Ι.Δερυαμπίνα, Γ.Β.Καντάρια. Οργανική χημεία. Ηλεκτρονικός πόρος.
- I.I.Novoshinsky, N.S.Novoshinskaya. Οργανική χημεία: εγχειρίδιο για μαθητές γυμνασίου και υποψήφιους. – Μ.: OOO «Εκδοτικός Οίκος ONICS 21ος αιώνας», 2004
- Kuzmenko N.E., Eremin V.V., Popkov V.A. Η αρχή της χημείας. Σύγχρονη πορείαγια όσους εισέρχονται στα πανεπιστήμια. Μ.: Εξεταστική, 2002.
Αλκάνια Δομή αλκανίων
Αλκάνια (παραφίνες)– αλειφατικοί (μη κυκλικοί) κορεσμένοι υδρογονάνθρακες, στους οποίους τα άτομα άνθρακα συνδέονται μεταξύ τους με απλούς (μονούς) δεσμούς σε ευθείες ή διακλαδισμένες αλυσίδες.
Τα αλκάνια έχουν τον γενικό τύπο ντο n H 2 n +2 , Οπου n– αριθμός ατόμων άνθρακα.
Χημική δομή. Τα Valkans έχουν δύο τύπους χημικών δεσμών:
S–SΚαι SH.
Ο δεσμός C-C είναι ομοιοπολικός μη πολικός. Ο δεσμός C–H είναι ομοιοπολικός, ασθενώς πολικός, επειδή άνθρακας και υδρογόνου είναι κοντά σε ηλεκτραρνητικότητα (2,5 για τον άνθρακα και 2,1 για το υδρογόνο). Εκπαίδευση ομοιοπολικούς δεσμούςστα αλκάνια λόγω των κοινών ζευγών ηλεκτρονίων ατόμων άνθρακα και υδρογόνου μπορούν να παρουσιαστούν χρησιμοποιώντας ηλεκτρονικούς τύπους:
Ηλεκτρονικά και δομικούς τύπουςκατοπτρίζω χημική δομή, αλλά μην δώσετε μια ιδέα για χωρική δομή των μορίων, το οποίο επηρεάζει σημαντικά τις ιδιότητες της ουσίας.
Χωρική δομή , δηλ. αμοιβαία διευθέτησηάτομα ενός μορίου στο διάστημα εξαρτώνται από τον προσανατολισμό των ατομικών τροχιακών (AO) αυτών των ατόμων. Σε υδρογονάνθρακες κύριος ρόλοςΟ χωρικός προσανατολισμός των τροχιακών ατόμων άνθρακα παίζει ρόλο, αφού το σφαιρικό 1s-AO του ατόμου υδρογόνου στερείται συγκεκριμένου προσανατολισμού.
Η χωρική διάταξη του άνθρακα ΑΟ, με τη σειρά του, εξαρτάται από τον τύπο του υβριδισμού του. Το κορεσμένο άτομο άνθρακα στα αλκάνια συνδέεται με τέσσερα άλλα άτομα. Επομένως, η κατάστασή του αντιστοιχεί σε υβριδισμό sp 3. Σε αυτή την περίπτωση, καθένα από τα τέσσερα sp 3 -υβριδικά AOs άνθρακα συμμετέχει σε αξονική (-) επικάλυψη με το s-AO του υδρογόνου ή με το sp 3 -AO ενός άλλου ατόμου άνθρακα, σχηματίζοντας δεσμούς -CH ή C-C.

Τέσσερις δεσμοί άνθρακα κατευθύνονται στο διάστημα με τετραεδρική γωνία 109 o 28". Επομένως, το μόριο του απλούστερου αντιπροσώπου των αλκανίων - του μεθανίου CH 4 - έχει σχήμα τετραέδρου, στο κέντρο του οποίου υπάρχει ένα άτομο άνθρακα, και στις κορυφές υπάρχουν άτομα υδρογόνου:

Γωνία δεσμού Το N-C-H είναι ίσο 109 o 28'. Η χωρική δομή του μεθανίου μπορεί να παρουσιαστεί χρησιμοποιώντας μοντέλα ογκομετρίας (κλίμακα) και σφαιρών και ραβδιών.

Για την εγγραφή, είναι βολικό να χρησιμοποιήσετε μια χωρική (στερεοχημική) φόρμουλα.

Στο μόριο του επόμενου ομολόγου - αιθανίου C 2 H 6 - δύο τετραεδρικά sp 3 - άτομα άνθρακα σχηματίζουν μια πιο περίπλοκη χωρική δομή:

Τα μόρια αλκανίων που περιέχουν περισσότερα από 2 άτομα άνθρακα χαρακτηρίζονται από καμπύλα σχήματα.

Ονοματολογία
Σύμφωνα με την ονοματολογία IUPAC, τα ονόματα των κορεσμένων υδρογονανθράκων χαρακτηρίζονται από το επίθημα -ένα. Οι τέσσερις πρώτοι υδρογονάνθρακες έχουν ιστορικά καθιερωμένα ονόματα, ξεκινώντας από το πέμπτο, το όνομα του υδρογονάνθρακα βασίζεται στην ελληνική ονομασία για τον αντίστοιχο αριθμό ατόμων άνθρακα.
Οι υδρογονάνθρακες με κανονική αλυσίδα ατόμων άνθρακα έχουν τα ακόλουθα ονόματα:
| CH 4 - μεθάνιο | CH3-(CH2)5-CH3-επτάνιο |
Τα ονόματα των υδρογονανθράκων διακλαδισμένης αλυσίδας κατασκευάζονται ως εξής:
1. Η βάση του ονόματος αυτής της σύνδεσηςπάρτε το όνομα του υδρογονάνθρακα που αντιστοιχεί στον αριθμό των ατόμων άνθρακα στην κύρια αλυσίδα.
Η κύρια αλυσίδα ατόμων άνθρακα θεωρείται ότι είναι:
α) το μεγαλύτερο·
β) το πιο σύνθετο (με τον μέγιστο αριθμό υποκαταστημάτων). Εάν σε έναν υδρογονάνθρακα μπορούν να διακριθούν δύο ή περισσότερες ίσες μακριές αλυσίδες, τότε ως κύρια επιλέγεται αυτή με τη μεγαλύτερη αλυσίδα. μεγαλύτερο αριθμόκλαδια δεντρου:

2. Μετά τον καθορισμό της κύριας αλυσίδας, είναι απαραίτητο να επαναριθμήσετε τα άτομα άνθρακα. Η αρίθμηση ξεκινά από το άκρο της αλυσίδας στο οποίο είναι πλησιέστερο οποιοδήποτε από τα αλκύλια. Εάν διαφορετικά αλκύλια βρίσκονται σε ίσες αποστάσεις και από τα δύο άκρα της αλυσίδας, τότε η αρίθμηση ξεκινά από το άκρο στο οποίο είναι πιο κοντά η ρίζα με τον μικρότερο αριθμό ατόμων άνθρακα (μεθύλιο, αιθύλιο, προπύλιο κ.λπ.). Για παράδειγμα:


Εάν πανομοιότυπες ρίζες που καθορίζουν την αρχή της αρίθμησης βρίσκονται σε ίση απόσταση και από τα δύο άκρα της αλυσίδας, αλλά υπάρχουν περισσότερες από αυτές στη μία πλευρά παρά στην άλλη, τότε η αρίθμηση ξεκινά από το τέλος όπου ο αριθμός των κλαδιών είναι μεγαλύτερος: 
2, 2, 4-τριμεθυλοπεντάνιο

2, 3, 6-τριμεθυλεπτάνιο
Κατά την ονομασία μιας ένωσης, πρώτα απαριθμήστε τους υποκαταστάτες με αλφαβητική σειρά (οι αριθμοί δεν λαμβάνονται υπόψη) και πριν από το όνομα της ρίζας βάζουν έναν αριθμό που αντιστοιχεί στον αριθμό του ατόμου άνθρακα της κύριας αλυσίδας στην οποία βρίσκεται αυτή η ρίζα . Μετά από αυτό, ονομάζεται ο υδρογονάνθρακας που αντιστοιχεί στην κύρια αλυσίδα των ατόμων άνθρακα, διαχωρίζοντας τη λέξη από τους αριθμούς με παύλα.
Εάν ένας υδρογονάνθρακας περιέχει πολλές ίδιες ρίζες, τότε ο αριθμός τους συμβολίζεται με ελληνικό αριθμό (di, tri, tetra, κ.λπ.) και τοποθετείται μπροστά από το όνομα αυτών των ριζών και η θέση τους υποδεικνύεται, ως συνήθως, με αριθμούς, με τους αριθμούς χωρισμένους με κόμματα, τακτοποιημένα κατά σειρά αυξήσεων και τοποθετούνται πριν από το όνομα αυτών των ριζών, χωρίζοντάς τες από αυτό με παύλα.
ΚΥΚΛΟΑΛΚΑΝΟΙ
Τα ονόματα των κυκλοαλκανίων σχηματίζονται με την προσθήκη ενός προθέματος κυκλο-στο όνομα του αντίστοιχου μη διακλαδισμένου κορεσμένου υδρογονάνθρακα με τον ίδιο αριθμό ατόμων άνθρακα:
Οι υποκαταστάτες αριθμούνται ανάλογα με τη θέση τους στον κύκλο με τέτοιο τρόπο ώστε το άθροισμα των αριθμών να είναι ελάχιστο:
Ισομέρεια
Ισομερή- πρόκειται για ουσίες που έχουν την ίδια σύνθεση και τον ίδιο μοριακό τύπο και μάζα, αλλά διαφορετική χημική δομή, και επομένως έχουν διαφορετικές φυσικές και χημικές ιδιότητες.
Δομική ισομέρεια
Ο λόγος για την εκδήλωση του δομικού ισομερισμού στη σειρά των αλκανίων είναι η ικανότητα των ατόμων άνθρακα να σχηματίζουν αλυσίδες διαφορετικών δομών. Αυτός ο τύπος δομικής ισομέρειας ονομάζεται ισομέρεια ανθρακικού σκελετού.
Τα δομικά ισομερή έχουν την ίδια σύνθεση, αλλά διαφέρουν ως προς τη χημική δομή, ενώ οι χημικές ιδιότητες των ισομερών είναι παρόμοιες, αλλά οι φυσικές ιδιότητες είναι διαφορετικές. Τα αλκάνια με διακλαδισμένη δομή, λόγω της λιγότερο πυκνής συσσώρευσης μορίων και, κατά συνέπεια, των λιγότερων διαμοριακών αλληλεπιδράσεων, βράζουν σε χαμηλότερη θερμοκρασία από τα μη διακλαδισμένα ισομερή τους.
Στα μόρια του μεθανίου CH 4, του αιθανίου C 2 H 6 και του προπανίου C 3 H 8 μπορεί να υπάρχει μόνο μία τάξη σύνδεσης ατόμων, δηλαδή τα τρία πρώτα μέλη της ομόλογης σειράς αλκανίων δεν έχουν ισομερή. Για το βουτάνιο C4H10, είναι δυνατές δύο δομές:

Ένα από αυτά τα ισομερή (n-βουτάνιο) περιέχει μια ευθεία αλυσίδα άνθρακα και το άλλο, το ισοβουτάνιο, περιέχει μια διακλαδισμένη (ισοδομή).
Με την αύξηση του αριθμού των ατόμων άνθρακα στα μόρια, αυξάνονται οι δυνατότητες διακλάδωσης της αλυσίδας, δηλ. ο αριθμός των ισομερών αυξάνεται με τον αριθμό των ατόμων άνθρακα.

Στη σειρά των ριζοσπαστών συναντάμε και το φαινόμενο του ισομερισμού. Επιπλέον, ο αριθμός των ισομερών στις ρίζες είναι σημαντικά μεγαλύτερος από ότι στα αντίστοιχα αλκάνια τους. Για παράδειγμα, το προπάνιο, όπως είναι γνωστό, δεν έχει ισομερή και η ρίζα προπυλίου έχει δύο ισομερή: n-προπύλιο και ισοπροπύλιο:
|
CH3-CH3-CH2- και H3C-CH-CH3
Περιστροφική ισομέρεια αλκανίων
Η περιστροφή των ατόμων γύρω από τον δεσμό s δεν θα οδηγήσει στη διάσπασή του. Ως αποτέλεσμα της ενδομοριακής περιστροφής κατά μήκος των δεσμών C–C, τα μόρια αλκανίου, ξεκινώντας από το αιθάνιο C 2 H 6, μπορούν να λάβουν διαφορετικά γεωμετρικά σχήματα.
Διάφορες χωρικές μορφές ενός μορίου που μετασχηματίζονται μεταξύ τους περιστρέφοντας γύρω από τους δεσμούς C-C ονομάζονται διαμορφώσειςή περιστροφικά ισομερή(conformers).
Τα περιστροφικά ισομερή ενός μορίου είναι οι ενεργειακά άνισες καταστάσεις του. Η αλληλομετατροπή τους γίνεται γρήγορα και συνεχώς ως αποτέλεσμα της θερμικής κίνησης. Επομένως, τα περιστροφικά ισομερή δεν μπορούν να απομονωθούν ατομική μορφή, αλλά η ύπαρξή τους έχει αποδειχθεί με φυσικές μεθόδους. Ορισμένες διαμορφώσεις είναι πιο σταθερές (ενεργειακά ευνοϊκές) και το μόριο παραμένει σε τέτοιες καταστάσεις για μεγαλύτερο χρονικό διάστημα.
Υπό κανονικές συνθήκες, τα πρώτα τέσσερα μέλη της ομόλογης σειράς αλκανίων είναι αέρια, τα C 5 - C 17 είναι υγρά και ξεκινώντας από το C 18 είναι στερεά. Τα σημεία τήξης και βρασμού των αλκανίων της πυκνότητάς τους αυξάνονται με την αύξηση του μοριακού βάρους. Όλα τα αλκάνια είναι ελαφρύτερα από το νερό και είναι αδιάλυτα σε αυτό, αλλά είναι διαλυτά σε μη πολικούς διαλύτες (για παράδειγμα, βενζόλιο) και είναι από μόνα τους καλοί διαλύτες.
Οι φυσικές ιδιότητες ορισμένων αλκανίων παρουσιάζονται στον πίνακα.
| Ονομα | Τύπος | tpl°C | tμπάλλα°C | ρε 20 4 |
| Μεθάνιο | CH 4 | (στους -164 °C) |
||
| Αιθάνιο | ΜΕ 2 Ν 6 | (στους -100 °C) |
||
| Προπάνιο | ΜΕ 3 Ν 8 | (στους -44,5 °C) |
||
| Βουτάνιο | ΜΕ 4 Ν 10 | (στους 0°C) |
||
| Πεντάνιο | ντο 5 H 12 | |||
| Εξάνιο | ΜΕ 6 Ν 14 | |||
| Επτάνιο | ΜΕ 7 H 16 | |||
| Οκτάνιο | ντο 8 H 18 | |||
| Νονάν | ΜΕ 9 Ν 20 | |||
| πρύτανης | ντο 10 H 22 | |||
| Πενταδεκάνιο | ντο 15 H 32 | |||
| Eikosan | ΜΕ 20 Ν 42 | (στους 37 °C) |
||
| Pentacosan | ντο 25 H 52 | |||
| Τριάκονταν | ΜΕ 30 Ν 62 | |||
| *
ρε 4
20
– σχετική πυκνότητα, δηλ. |
||||
Χημικές ιδιότητες
Το ασήμαντο (ιστορικό) όνομα για τα αλκάνια - "παραφίνες" - σημαίνει "δεν έχω συγγένεια". Τα αλκάνια είναι χημικά ανενεργά. Η χαμηλή αντιδραστικότητα των αλκανίων οφείλεται στην πολύ χαμηλή πολικότητα των δεσμών C-C και C-H στα μόριά τους λόγω της σχεδόν πανομοιότυπης ηλεκτραρνητικότητας των ατόμων άνθρακα και υδρογόνου. Οι κορεσμένοι υδρογονάνθρακες υπό κανονικές συνθήκες δεν αλληλεπιδρούν με συμπυκνωμένα οξέα, αλκάλια ή ακόμη και με ένα τέτοιο ενεργό αντιδραστήριο όπως το υπερμαγγανικό κάλιο.
Χαρακτηρίζονται από αντιδράσεις υποκατάστασης ατόμων υδρογόνου και διάσπαση.
Σε αυτές τις αντιδράσεις, λαμβάνει χώρα ομολυτική διάσπαση ομοιοπολικών δεσμών, δηλαδή διεξάγονται με μηχανισμό ελεύθερων ριζών (αλυσίδα).
Λόγω της αντοχής των δεσμών C–C και C–H, οι αντιδράσεις συμβαίνουν είτε με θέρμανση, είτε στο φως, είτε με τη χρήση καταλυτών.
Ας δούμε μερικά παραδείγματα αντιδράσεων αυτού του τύπου.
Αλογόνωση.Αυτή είναι μια από τις χαρακτηριστικές αντιδράσεις των κορεσμένων υδρογονανθράκων. Η αλογόνωση των αλκανίων λαμβάνει χώρα σε στάδια - όχι περισσότερο από ένα άτομο υδρογόνου αντικαθίσταται σε ένα στάδιο:
CH 4 + Cl 2 → CH 3 Cl + HCl (χλωρομεθάνιο)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (διχλωρομεθάνιο)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (τριχλωρομεθάνιο)
CHCl 3 + Cl 2 → CCl 4 + HCl (τετραχλωριούχος άνθρακας).
Περιέχων άζωτον.Παρά το γεγονός ότι υπό κανονικές συνθήκες τα αλκάνια δεν αλληλεπιδρούν με το πυκνό νιτρικό οξύ, όταν θερμαίνονται στους 140°C με αραιό (10%) νιτρικό οξύ υπό πίεση, εμφανίζεται μια αντίδραση νίτρωσης - η αντικατάσταση ενός ατόμου υδρογόνου με μια νιτροομάδα (Η αντίδραση του M.I. Konovalov ). Όλα τα αλκάνια εισέρχονται σε παρόμοια αντίδραση νίτρωσης υγρής φάσης, αλλά ο ρυθμός αντίδρασης και οι αποδόσεις των νιτροενώσεων είναι χαμηλές. Τα καλύτερα αποτελέσματα παρατηρούνται με αλκάνια που περιέχουν τριτοταγή άτομα άνθρακα.
Ράγισμα.Σε υψηλές θερμοκρασίες παρουσία καταλυτών, οι κορεσμένοι υδρογονάνθρακες υφίστανται διάσπαση, η οποία ονομάζεται πυρόλυση. Κατά τη διάσπαση, οι δεσμοί άνθρακα-άνθρακα σπάνε ομολυτικά για να σχηματίσουν κορεσμένους και ακόρεστους υδρογονάνθρακες με μικρότερες αλυσίδες.
CH 3 – CH 2 – CH 2 – CH 3 (βουτάνιο) –– 400°C CH 3 – CH 3 (αιθάνιο)+ CH 2 = CH 2 (αιθυλένιο)
Η αύξηση της θερμοκρασίας της διεργασίας οδηγεί σε βαθύτερη αποσύνθεση των υδρογονανθράκων και, ειδικότερα, σε αφυδρογόνωση, δηλ. να χωρίσει
υδρογόνο. Έτσι, το μεθάνιο στους 1500ºС οδηγεί σε ακετυλένιο.
2CH 4 –– 1500°C H–C =
C–H(ακετυλένιο) + 3H 2
Ισομερισμός.Υπό την επίδραση των καταλυτών, όταν θερμαίνονται, υδρογονάνθρακες κανονικής δομής υφίστανται ισομερισμό - αναδιάταξη του σκελετού άνθρακα με σχηματισμό διακλαδισμένων αλκανίων.
Οξείδωση. Υπό κανονικές συνθήκες, τα αλκάνια είναι ανθεκτικά στο οξυγόνο και στους οξειδωτικούς παράγοντες. Όταν αναφλέγονται στον αέρα, τα αλκάνια καίγονται, μετατρέπονται σε διοξείδιο του άνθρακα και νερό και απελευθερώνονται ένας μεγάλος αριθμός απόθερμότητα.
CH 4 + 2O 2 – φλόγα CO 2 + 2H 2 O
C 5 H 12 + 8O 2 –– φλόγα 5CO 2 + 6H 2 O
Το να είσαι στη φύση και να λαμβάνεις
Οι κύριες πηγές αλκανίων είναι το πετρέλαιο και το φυσικό αέριο. 

Το μεθάνιο αποτελεί το μεγαλύτερο μέρος του φυσικού αερίου· περιέχει επίσης μικρές ποσότητες αιθανίου, προπανίου και βουτανίου. Το μεθάνιο βρίσκεται στις εκπομπές από βάλτους και ραφές άνθρακα. Μαζί με τα ομόλογα φωτός, το μεθάνιο υπάρχει στα σχετικά αέρια πετρελαίου. Αυτά τα αέρια διαλύονται στο λάδι υπό πίεση και βρίσκονται επίσης πάνω από αυτό. Τα αλκάνια αποτελούν σημαντικό μέρος των προϊόντων πετρελαίου. Το λάδι περιέχει επίσης κυκλοαλκάνια - ονομάζονται ναφθένια (από τα ελληνικά. νέφτι- λάδι). Οι υδρίτες αερίων των αλκανίων, κυρίως το μεθάνιο, είναι επίσης ευρέως διαδεδομένοι στη φύση· εμφανίζονται σε ιζηματογενή πετρώματα στις ηπείρους και στον πυθμένα των ωκεανών. Τα αποθέματά τους πιθανώς υπερβαίνουν τα γνωστά αποθέματα φυσικού αερίου και στο μέλλον μπορεί να γίνουν πηγή μεθανίου και των πλησιέστερων ομολόγων του. Τα αλκάνια λαμβάνονται επίσης με πυρόλυση (κοκκ) κάρβουνοκαι την υδρογόνωσή του (παραγωγή συνθετικού υγρού καυσίμου). Τα στερεά αλκάνια βρίσκονται στη φύση με τη μορφή εναποθέσεων βουνίσιου κεριού - οζοκερίτη, σε κηρώδη επιστρώματα φύλλων, λουλουδιών και σπόρων φυτών και αποτελούν μέρος του κεριού μέλισσας. 
Στη βιομηχανία, τα αλκάνια λαμβάνονται με καταλυτική υδρογόνωση των οξειδίων του άνθρακα CO
Κερί βουνού
και CO 2 (μέθοδος Fischer–Tropsch). Στο εργαστήριο, το μεθάνιο μπορεί να ληφθεί με θέρμανση οξικού νατρίου με στερεά αλκάλια: CH 3 COONa + NaOH → CH 4 + Na 2 CO 3, καθώς και με υδρόλυση ορισμένων καρβιδίων: Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3. Ομόλογα του μεθανίου μπορούν να ληφθούν με την αντίδραση Wurtz, για παράδειγμα: 2CH 3 Br + 2Na→CH 3 –CH 3 + 2NaBr. Στην περίπτωση των διαλογονοαλκανίων, λαμβάνονται κυκλοαλκάνια, για παράδειγμα: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na→ κυκλο-C6H12 + 2NaBr. Τα αλκάνια σχηματίζονται επίσης κατά την αποκαρβοξυλίωση των καρβοξυλικών οξέων και κατά την ηλεκτρόλυση τους.
Εφαρμογές αλκανίων
Οι κορεσμένοι υδρογονάνθρακες χρησιμοποιούνται ευρέως σε μια μεγάλη ποικιλία τομέων της ανθρώπινης ζωής και δραστηριότητας.
Ως πολύτιμο καύσιμο χρησιμοποιούνται αέρια αλκάνια (μείγμα μεθανίου και προπανίου-βουτανίου). 
Οι υγροί υδρογονάνθρακες αποτελούν σημαντικό ποσοστό των καυσίμων κινητήρων και πυραύλων και χρησιμοποιούνται ως διαλύτες.
Το λάδι βαζελίνης (μίγμα υγρών υδρογονανθράκων με έως και 15 άτομα άνθρακα) είναι ένα διαφανές, άοσμο και άγευστο υγρό, που χρησιμοποιείται στην ιατρική, την αρωματοποιία και τα καλλυντικά. 
Η βαζελίνη (ένα μείγμα υγρών και στερεών κορεσμένων υδρογονανθράκων με έως και 25 άτομα άνθρακα) χρησιμοποιείται για την παρασκευή αλοιφών που χρησιμοποιούνται στην ιατρική.
Παραφίνη (μίγμα στερεών αλκανίων C 19 -C 35) - μια λευκή στερεή μάζα χωρίς οσμή και γεύση (mp 50-70 ° C) - που χρησιμοποιείται για την κατασκευή κεριών, εμποτισμού σπίρτων και χαρτιού περιτυλίγματος, για θερμικές διαδικασίες στην ιατρική. Χρησιμεύει ως πρώτη ύλη για την παραγωγή οργανικών οξέων και αλκοολών, απορρυπαντικών και επιφανειοδραστικών. 
Κανονικοί κορεσμένοι υδρογονάνθρακες μέσου μοριακού βάρους χρησιμοποιούνται ως θρεπτικό υπόστρωμα στη μικροβιολογική σύνθεση πρωτεΐνης από λάδι.
Μεγάλη σημασία έχουν τα παράγωγα αλογόνου των αλκανίων, τα οποία χρησιμοποιούνται ως διαλύτες, ψυκτικά και πρώτες ύλες για περαιτέρω συνθέσεις. Στη σύγχρονη πετροχημική βιομηχανία, οι κορεσμένοι υδρογονάνθρακες αποτελούν τη βάση για την παραγωγή διαφόρων οργανικών ενώσεων, σημαντική πρώτη ύλη στις διαδικασίες λήψης ενδιαμέσων για την παραγωγή πλαστικών, καουτσούκ, συνθετικών ινών, απορρυπαντικών και πολλών άλλων ουσιών.
Δομή αλκανίων
Τα αλκάνια είναι υδρογονάνθρακες στους οποίους συνδέονται τα άτομα μεμονωμένα ομόλογακαι που αντιστοιχούν στον γενικό τύπο C n H 2n+2. Στα μόρια των αλκανίων, όλα τα άτομα άνθρακα βρίσκονται στην κατάσταση sp 3 -υβριδισμός.
Αυτό σημαίνει ότι και τα τέσσερα υβριδικά τροχιακά του ατόμου άνθρακα είναι πανομοιότυπα σε σχήμα, ενέργεια και κατευθύνονται προς τις γωνίες μιας ισόπλευρης τριγωνικής πυραμίδας - τετράεδρο. Οι γωνίες μεταξύ των τροχιακών είναι 109° 28′. Σχεδόν ελεύθερη περιστροφή είναι δυνατή γύρω από έναν μόνο δεσμό άνθρακα-άνθρακα και τα μόρια αλκανίου μπορούν να αποκτήσουν τα περισσότερα διάφορα σχήματαμε γωνίες στα άτομα άνθρακα κοντά στο τετραεδρικό (109° 28′), για παράδειγμα, στο μόριο n-πεντανίου.

Αξίζει ιδιαίτερα να υπενθυμίσουμε τους δεσμούς στα μόρια των αλκανίων. Όλοι οι δεσμοί στα μόρια των κορεσμένων υδρογονανθράκων είναι απλοί. Η επικάλυψη συμβαίνει κατά μήκος του άξονα που συνδέει τους πυρήνες των ατόμων, δηλαδή αυτόν σ ομόλογα. Οι δεσμοί άνθρακα-άνθρακα είναι μη πολικοί και ελάχιστα πολωτικοί. Το μήκος του δεσμού C-C στα αλκάνια είναι 0,154 nm (1,54 10 10 m). Οι δεσμοί C-H είναι κάπως βραχύτεροι. Η πυκνότητα ηλεκτρονίων μετατοπίζεται ελαφρώς προς το πιο ηλεκτραρνητικό άτομο άνθρακα, δηλ. Σύνδεση C-Hείναι ασθενώς πολικό.
Ομόλογη σειρά μεθανίου
Ομόλογα- ουσίες που έχουν παρόμοια δομή και ιδιότητες και διαφέρουν μεταξύ τους μία ή περισσότερες ομάδες CH 2 .


Κορεσμένοι υδρογονάνθρακεςαποτελούν την ομόλογη σειρά του μεθανίου.
Ισομερισμός και ονοματολογία αλκανίων
Τα αλκάνια χαρακτηρίζονται από τα λεγόμενα δομικός ισομερισμός. Τα δομικά ισομερή διαφέρουν μεταξύ τους ως προς τη δομή του σκελετού άνθρακα. Το απλούστερο αλκάνιο, το οποίο χαρακτηρίζεται από δομικά ισομερή, είναι το βουτάνιο.

Ας εξετάσουμε λεπτομερέστερα τη βασική ονοματολογία για τα αλκάνια IUPAC.
1. Επιλογή κύριου κυκλώματος. Ο σχηματισμός του ονόματος ενός υδρογονάνθρακα ξεκινά με τον ορισμό της κύριας αλυσίδας - της μεγαλύτερης αλυσίδας ατόμων άνθρακα στο μόριο, που είναι, όπως ήταν, η βάση του.
2. Αρίθμηση ατόμων κύριας αλυσίδας. Στα άτομα της κύριας αλυσίδας εκχωρούνται αριθμοί. Η αρίθμηση των ατόμων της κύριας αλυσίδας ξεκινά από το άκρο στο οποίο ο υποκαταστάτης είναι πιο κοντά (δομές Α, Β). Εάν οι υποκαταστάτες βρίσκονται σε ίση απόσταση από το άκρο της αλυσίδας, τότε η αρίθμηση ξεκινά από το άκρο στο οποίο υπάρχουν περισσότεροι από αυτούς (δομή Β). Εάν διαφορετικοί υποκαταστάτες βρίσκονται σε ίσες αποστάσεις από τα άκρα της αλυσίδας, τότε η αρίθμηση ξεκινά από το άκρο στο οποίο είναι πιο κοντά το ανώτερο (δομή D). Η αρχαιότητα των υποκαταστατών υδρογονάνθρακα καθορίζεται από τη σειρά με την οποία εμφανίζεται το γράμμα με το οποίο αρχίζει το όνομά τους στο αλφάβητο: μεθύλιο (-CH 3), μετά προπύλιο (-CH 2 - CH 2 - CH 3), αιθύλιο (-CH 2 -CH 3 ) κ.λπ.
Σημειώστε ότι το όνομα του υποκαταστάτη σχηματίζεται αντικαθιστώντας το επίθημα -ane με το επίθημα -yl στο όνομα του αντίστοιχου αλκανίου.
3. Σχηματισμός του ονόματος. Στην αρχή του ονόματος, υποδεικνύονται αριθμοί - οι αριθμοί των ατόμων άνθρακα στα οποία βρίσκονται οι υποκαταστάτες. Εάν υπάρχουν πολλοί υποκαταστάτες σε ένα δεδομένο άτομο, τότε ο αντίστοιχος αριθμός στο όνομα επαναλαμβάνεται δύο φορές χωρισμένος με κόμμα (2,2-). Μετά τον αριθμό, μια παύλα δηλώνει τον αριθμό των υποκαταστατών (δι - δύο, τρία - τρία, τετρα - τέσσερα, πεντα - πέντε) και το όνομα του υποκαταστάτη (μεθύλιο, αιθύλιο, προπύλιο). Στη συνέχεια, χωρίς κενά ή παύλες, το όνομα της κύριας αλυσίδας. Η κύρια αλυσίδα ονομάζεται υδρογονάνθρακας - μέλος της ομόλογης σειράς μεθανίου (μεθάνιο, αιθάνιο, προπάνιο κ.λπ.).




Οι ονομασίες των ουσιών των οποίων οι δομικοί τύποι δίνονται παραπάνω είναι οι εξής:
Δομή Α: 2-μεθυλοπροπάνιο;
Δομή Β: 3-αιθυλεξάνιο.
Δομή Β: 2,2,4-τριμεθυλοπεντάνιο.
Δομή Δ: 2-μεθυλ 4-αιθυλεξάνιο.
Απουσία κορεσμένων υδρογονανθράκων στα μόρια πολικούς δεσμούς οδηγεί σε αυτά ελάχιστα διαλυτό στο νερό, δεν αλληλεπιδρούν με φορτισμένα σωματίδια (ιόντα). Οι πιο χαρακτηριστικές αντιδράσεις για τα αλκάνια είναι αυτές που αφορούν ελεύθερες ρίζες.
Φυσικές ιδιότητες των αλκανίων
Οι τέσσερις πρώτοι εκπρόσωποι της ομόλογης σειράς του μεθανίου είναι αέρια. Το πιο απλό από αυτά είναι το μεθάνιο - ένα άχρωμο, άγευστο και άοσμο αέριο (η μυρωδιά του "αερίου", όταν το μυρίζετε, πρέπει να καλέσετε το 04, καθορίζεται από τη μυρωδιά των μερκαπτανών - ενώσεις που περιέχουν θείο που προστίθενται ειδικά στο μεθάνιο που χρησιμοποιείται σε οικιακές και βιομηχανικές συσκευές αερίου, έτσι ώστε οι άνθρωποι, που βρίσκονται δίπλα τους, να μπορούν να ανιχνεύσουν τη διαρροή με τη μυρωδιά).
Υδρογονάνθρακες σύνθεσης από ΜΕ 5 Ν 12 πριν ΜΕ 15 Ν 32 - υγρά οι βαρύτεροι υδρογονάνθρακες είναι στερεά. Τα σημεία βρασμού και τήξης των αλκανίων αυξάνονται σταδιακά με την αύξηση του μήκους της ανθρακικής αλυσίδας. Όλοι οι υδρογονάνθρακες είναι ελάχιστα διαλυτοί στο νερό· οι υγροί υδρογονάνθρακες είναι κοινοί οργανικοί διαλύτες.


Χημικές ιδιότητες των αλκανίων
Αντιδράσεις υποκατάστασης.
Οι πιο χαρακτηριστικές αντιδράσεις για τα αλκάνια είναι υποκατάσταση ελεύθερων ριζών, κατά την οποία ένα άτομο υδρογόνου αντικαθίσταται από ένα άτομο αλογόνου ή κάποια ομάδα.
Ας παρουσιάσουμε τις χαρακτηριστικές εξισώσεις αντιδράσεις αλογόνωσης:
Σε περίπτωση περίσσειας αλογόνου, η χλωρίωση μπορεί να προχωρήσει περαιτέρω, μέχρι την πλήρη αντικατάσταση όλων των ατόμων υδρογόνου με χλώριο:

Οι ουσίες που προκύπτουν χρησιμοποιούνται ευρέως ως διαλύτες και πρώτες ύλες σε οργανικές συνθέσεις.
Αντίδραση αφυδρογόνωσης(άντληση υδρογόνου).
Όταν τα αλκάνια περνούν πάνω από έναν καταλύτη (Pt, Ni, Al 2 O 3, Cr 2 O 3) σε υψηλές θερμοκρασίες (400-600 °C), ένα μόριο υδρογόνου εξαλείφεται και αλκένιο:
Αντιδράσεις που συνοδεύονται από την καταστροφή της ανθρακικής αλυσίδας. Όλοι οι κορεσμένοι υδρογονάνθρακες καίγονταιμε το σχηματισμό διοξειδίου του άνθρακα και νερού. Αέριοι υδρογονάνθρακες αναμεμειγμένοι με αέρα σε ορισμένες αναλογίες μπορούν να εκραγούν.
1. Καύση κορεσμένων υδρογονανθράκωνείναι μια εξώθερμη αντίδραση ελεύθερων ριζών που έχει πολύ μεγάλης σημασίαςόταν χρησιμοποιείτε αλκάνια ως καύσιμο:
Γενικά, η αντίδραση καύσης των αλκανίων μπορεί να γραφτεί ως εξής:
2. Θερμική διάσπαση υδρογονανθράκων.
Η διαδικασία προχωρά σύμφωνα με μηχανισμός ελεύθερων ριζών. Η αύξηση της θερμοκρασίας οδηγεί σε ομολυτική διάσπαση του δεσμού άνθρακα-άνθρακα και στο σχηματισμό ελεύθερων ριζών.
Αυτές οι ρίζες αλληλεπιδρούν μεταξύ τους, ανταλλάσσοντας ένα άτομο υδρογόνου, σχηματίζοντας ένα μόριο μόριο αλκανίου και αλκενίου:
Οι αντιδράσεις θερμικής αποσύνθεσης αποτελούν τη βάση της βιομηχανικής διαδικασίας - πυρόλυση υδρογονανθράκων. Αυτή η διαδικασία είναι το πιο σημαντικό στάδιο της διύλισης λαδιού.
3. Πυρόλυση. Όταν το μεθάνιο θερμαίνεται σε θερμοκρασία 1000 °C, πυρόλυση μεθανίου- αποσύνθεση σε απλές ουσίες:
Όταν θερμαίνεται σε θερμοκρασία 1500 °C, ο σχηματισμός του ασετυλίνη:
4. Ισομερισμός. Όταν οι γραμμικοί υδρογονάνθρακες θερμαίνονται με καταλύτη ισομερισμού (χλωριούχο αργίλιο), ουσίες με διακλαδισμένος σκελετός άνθρακα:

5. Αρωματοποίηση. Τα αλκάνια με έξι ή περισσότερα άτομα άνθρακα στην αλυσίδα κυκλοποιούνται παρουσία καταλύτη για να σχηματίσουν βενζόλιο και τα παράγωγά του:

Τα αλκάνια εισέρχονται σε αντιδράσεις που προχωρούν σύμφωνα με τον μηχανισμό των ελεύθερων ριζών, αφού όλα τα άτομα άνθρακα στα μόρια των αλκανίων βρίσκονται σε κατάσταση υβριδισμού sp 3. Τα μόρια αυτών των ουσιών κατασκευάζονται χρησιμοποιώντας ομοιοπολικό μη πολικό C-C(άνθρακας - άνθρακας) δεσμοί και ασθενώς πολικοί δεσμοί C-H (άνθρακας - υδρογόνο). Δεν περιέχουν περιοχές με αυξημένη ή μειωμένη πυκνότητα ηλεκτρονίων, εύκολα πολωμένους δεσμούς, δηλαδή τέτοιους δεσμούς στους οποίους η πυκνότητα των ηλεκτρονίων μπορεί να μετατοπιστεί υπό την επίδραση εξωτερικοί παράγοντες(ηλεκτροστατικά πεδία ιόντων). Κατά συνέπεια, τα αλκάνια δεν θα αντιδράσουν με φορτισμένα σωματίδια, αφού οι δεσμοί στα μόρια των αλκανίων δεν διασπώνται από τον ετερολυτικό μηχανισμό.