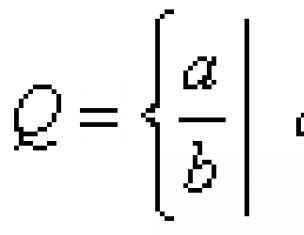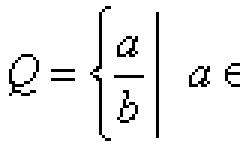Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С 2 - С 1) / (t 2 - t 1)) = ± (DС / Dt)
Где С 1 и С 2 - молярные концентрации веществ в моменты времени t 1 и t 2 соответственно (знак (+) - если скорость определяется по продукту реакции, знак (-) - по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее
скорость определяется количеством столкновений и вероятностью того, что
они приведут к превращению. Число столкновений определяется
концентрациями реагирующих веществ, а вероятность реакции - энергией
сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ.
Большую роль играет характер химических связей и строение молекул
реагентов. Реакции протекают в направлении разрушения менее прочных
связей и образования веществ с более прочными связями. Так, для разрыва
связей в молекулах H 2 и N 2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H 2 O)
требуется меньше энергии, и скорость реакции значительно выше. Реакции
между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением
концентрации (числа частиц в единице объема) чаще происходят
столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
AA + bB + . . . ® . . .
- [A] a [B] b . . .
Константа скорости реакции k зависит
от природы реагирующих веществ, температуры и катализатора, но не
зависит от значения концентраций реагентов.
Физический смысл константы скорости
заключается в том, что она равна скорости реакции при единичных
концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t 1 до t 2 изменение скорости реакции можно рассчитать по формуле:
| |
|
(t 2 - t 1) / 10 |
| Vt 2 / Vt 1 | = g | |
(где Vt 2 и Vt 1 - скорости реакции при температурах t 2 и t 1 соответственно; g- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
- e -Ea/RT
где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная ;
Ea - энергия активации, т.е. энергия, которой должны обладать
сталкивающиеся молекулы, чтобы столкновение привело к химическому
превращению.
Энергетическая диаграмма химической реакции.
| Экзотермическая реакция | Эндотермическая реакция |
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами . Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа ").
§ 12. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Кинетика ферментативных реакций – наука о скоростях ферментативных реакций, их зависимости от различных факторов. Скорость ферментативной реакции определяется химическим количеством прореагировавшего субстрата или образовавшегося продукта реакции в единицу времени в единице объема при определенных условиях:
где v – скорость ферментативной реакции, – изменение концентрации субстрата или продукта реакции, t – время.
Скорость ферментативной реакции зависит от природы фермента, которая определяет его активность. Чем выше активность фермента, тем выше скорость реакции. Активность фермента определяют по скорости реакции, катализируемой ферментом. Мерой активности фермента является одна стандартная единица активности фермента. Одна стандартная единица активности фермента – это такое количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту.
В процессе ферментативной реакции фермент (Е) взаимодействует с субстратом (S), в результате образуется фермент-субстратный комплекс, который затем распадается с высвобождением фермента и продукта (Р) реакции:
Скорость ферментативной реакции зависит от многих факторов: от концентрации субстрата и фермента, температуры, рН среды, наличия различных регуляторных веществ, способных увеличивать или снижать активность ферментов.
Интересно знать! Ферменты используются в медицине для диагностики различных заболеваний. При инфаркте миокарда вследствие повреждения и распада сердечной мышцы в крови резко возрастает содержание ферментов аспартаттрансаминазы и аланинаминотрансферазы. Выявление их активности позволяет диагностировать данное заболевание.
Влияние концентрации субстрата и фермента на скорость ферментативной реакции
Рассмотрим влияние концентрации субстрата на скорость ферментативной реакции (рис. 30.). При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (V max). При таких концентрациях субстрата все молекулы фермента находятся в составе фермент-субстратного комплекса, и достигается полное насыщение активных центров фермента, именно поэтому скорость реакции в этом случае практически не зависит от концентрации субстрата.
Рис. 30. Зависимость скорости ферментативной реакции от концентрации субстрата
График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен, которое получило свое название в честь выдающихся ученых Л.Михаэлиса и М.Ментен, внесших большой вклад в исследование кинетики ферментативных реакций,
где v – скорость ферментативной реакции; [S] – концентрация субстрата; K M – константа Михаэлиса.
Рассмотрим физический смысл константы Михаэлиса. При условии, что v = ½ V max , получаем K M = [S]. Таким образом, константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной.
Скорость ферментативной реакции зависит и от концентрации фермента (рис. 31). Эта зависимость носит прямолинейный характер.
Рис. 31. Зависимость скорости ферментативной реакции от концентрации фермента
Влияние температуры на скорость ферментативной реакции
Зависимость скорости ферментативной реакции от температуры представлена на рис. 32.
Рис. 32. Зависимость скорости ферментативной реакции от температуры.
При низких температурах (приблизительно до 40 – 50 о С) повышение температуры на каждые 10 о С в соответствии с правилом Вант-Гоффа сопровождается увеличением скорости химической реакции в 2 – 4 раза. При высоких температурах более 55 – 60 о С активность фермента резко снижается из-за его тепловой денатурации, и, как следствие этого, наблюдается резкое снижение скорости ферментативной реакции. Максимальная активность ферментов наблюдается обычно в пределах 40 – 60 о С. Температура, при которой активность фермента максимальна, называется температурным оптимумом. Температурный оптимум ферментов термофильных микроорганизмов находится в области более высоких температур.
Влияние рН на скорость ферментативной реакции
График зависимости ферментативной активности от рН представлен на рис. 33.
Рис. 33. Влияние рН на скорость ферментативной реакции
График зависимости от рН имеет колоколообразную форму. Значение рН, при котором активность фермента максимальна, называется рН-оптимумом фермента. Значения рН-оптимума для различных ферментов колеблются в широких пределах.
Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на:
a) ионизацию аминокислотных остатков, участвующих в катализе,
b) ионизацию субстрата,
c) конформацию фермента и его активного центра.
Ингибирование ферментов
Скорость ферментативной реакции может быть снижена действием ряда химических веществ, называемых ингибиторами . Некоторые ингибиторы являются для человека ядами, например, цианиды, другие – используются в качестве лекарственных препаратов.
Ингибиторы можно разделить на два основных типа: необратимые и обратимые . Необратимые ингибиторы (I) связываются с ферментом с образованием комплекса, диссоциация которого с восстановлением активности фермента невозможна:
Примером необратимого ингибитора является диизопропилфторфосфат (ДФФ). ДФФ ингибирует фермент ацетилхолинэстеразу, играющего важную роль в передаче нервного импульса. Этот ингибитор взаимодействует с серином активного центра фермента, блокируя тем самым активность последнего. Вследствие этого нарушается способность отростков нервных клеток нейронов проводить нервный импульс. ДФФ является одним из первых веществ нервно-паралитического действия. На его основе создан ряд относительно нетоксичных для человека и животных инсектицидов - веществ, ядовитых для насекомых.
Обратимые ингибиторы, в отличие от необратимых, при определенных условиях могут быть легко отделены от фермента. Активность последнего при этом восстанавливается:
Среди обратимых ингибиторов выделяют конкурентные и неконкурентные ингибиторы.
Конкурентный ингибитор, являясь структурным аналогом субстрата, взаимодействует с активным центром фермента и таким образом перекрывает доступ субстрата к ферменту. При этом ингибитор не подвергается химическим превращениям и связывается с ферментом обратимо. После диссоциации комплекса EI фермент может связаться либо с субстратом и преобразовать его, либо с ингибитором (рис. 34.). Поскольку и субстрат и ингибитор конкурируют за место в активном центре, такое ингибирование называется конкурентным.
Рис. 34. Механизм действия конкурентного ингибитора.
Конкурентные ингибиторы используются в медицине. Для борьбы с инфекционными болезнями ранее широко применялись сульфаниламидные препараты. Они близки по своей структуре к пара-аминобензойной кислоте (ПАБК), необходимому фактору роста многих патогенных бактерий. ПАБК является предшественником фолиевой кислоты, которая служит кофактором ряда ферментов. Сульфаниламидные препараты выступают в качестве конкурентного ингибитора ферментов синтеза фолиевой кислоты из ПАБК и тем самым подавляют рост и размножение патогенных бактерий.
Неконкурентные ингибиторы по структуре не сходны с субстратом и при образовании EI взаимодействуют не с активным центром, а с другим участком фермента. Взаимодействие ингибитора с ферментом приводит к изменению структуры последнего. Образование EI-комплекса является обратимым, поэтому после его распада фермент вновь способен атаковать субстрат (рис. 35).
Рис. 35. Механизм действия неконкурентного ингибитора
В качестве неконкурентного ингибитора может выступать цианид CN - . Он связывается с ионами металлов, входящими в состав простетических групп и подавляет активность этих ферментов. Отравления цианидами крайне опасны. Они могут привести к летальному исходу.
Аллостерические ферменты
Термин «аллостерический» происходит от греческих слов allo – другой, stereo – участок. Таким образом, аллостерические ферменты наряду с активным центром имеют другой центр, называемый аллостерический центр (рис. 36). С аллостерическим центром связываются вещества, способные изменять активность ферментов, эти вещества называют аллостерическими эффекторами . Эффекторы бывают положительными – активирующими фермент, и отрицательными – ингибирующими, т.е. снижающими активность фермента. Некоторые аллостерические ферменты могут подвергаться действию двух и более эффекторов.
Рис. 36. Структура аллостерического фермента.
Регуляция мультиферментных систем
Некоторые ферменты действуют согласованно, объединяясь в мультиферментные системы, в которых каждый фермент катализирует определенную стадию метаболитического пути:
В мультиферментной системе есть фермент, который определяет скорость всей последовательности реакций. Этот фермент, как правило, бывает аллостерическим и находится в начале матаболитического пути. Он способен, получая различные сигналы, как повышать, так и понижать скорость катализируемой реакции, тем самым регулируя скорость всего процесса.
Скорость химической реакции зависит от многих факторов, включая природу реагирующих веществ, концентрацию реагирующих веществ, температуру, наличие катализаторов. Рассмотрим эти факторы.
1). Природа реагирующих веществ . Если идёт взаимодействие между веществами с ионной связью, то реакция протекает быстрее, чем между веществами с ковалентной связью.
2.) Концентрация реагирующих веществ . Чтобы прошла химическая реакция, необходимо столкновение молекул реагирующих веществ. То есть молекулы должны настолько близко подойти друг к другу, чтобы атомы одной частицы испытывали на себе действие электрических полей другой. Только в этом случае будут возможны переходы электронов и соответствующие перегруппировки атомов, в результате которых образуются молекулы новых веществ. Таким образом, скорость химических реакций пропорциональна числу столкновений, которое происходит между молекулами, а число столкновений, в свою очередь, пропорционально концентрации реагирующих веществ. На основании экспериментального материала норвежские учёные Гульдберг и Вааге и независимо от них русский учёный Бекетов в 1867 году сформулировали основной закон химической кинетики – закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Для общего случая:
закон действующих масс имеет вид:
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции . В основном кинетическом уравнении k – константа скорости реакции, которая зависит от природы реагирующих веществ и температуры.
Большинство химических реакций является обратимыми. В ходе таких реакций продукты их по мере накопления реагируют друг с другом с образованием исходных веществ:
Скорость прямой реакции:
Скорость обратной реакции:
В момент равновесия:
Отсюда закон действующих масс в состоянии равновесия примет вид:
где K – константа равновесия реакции.
3) Влияние температуры на скорость реакции . Скорость химических реакций, как правило, при превышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом.
2Н 2 + О 2 = 2Н 2 О
При 20 0 С скорость реакции практически равна нулю и понадобилось бы 54 млрд.лет, чтобы взаимодействие прошло на 15%. При 500 0 С для образования воды потребуется 50 минут, а при 700 0 С реакция протекает мгновенно.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа : при увеличении температуры на 10 о скорость реакции увеличивается в 2 – 4 раза. Правило Вант-Гоффа записывается:
4) Влияние катализаторов . Скорость химических реакций можно регулировать с помощью катализаторов – веществ, изменяющих скорость реакции и остающихся после реакции в неизменном количестве. Изменение скорости реакции в присутствии катализатора называется катализом. Различают положительный (скорость реакции увеличивается) и отрицательный (скорость реакции уменьшается) катализ. Иногда катализатор образуется в ходе реакции, такие процессы называют автокаталитическими. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. Например:
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Например:
Гетерогенный катализ связан с ферментативными процессами. Все химические процессы, протекающие в живых организмах, катализируются ферментами, которые представляют собой белки с определёнными специализированными функциями. В растворах, в которых идут ферментативные процессы, нет типичной гетерогенной среды, в связи с отсутствием чётко выраженной поверхности раздела фаз. Такие процессы относят к микрогетерогенному катализу.
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение вещества в единицу времени:
υ = ΔC / Δt.
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной , и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt).
Как заставить частицы чаще сталкиваться, т.е. как увеличить скорость химической реакции ?
1. Самый простой способ – повысить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетичекий барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что большинство реакций примерно одинаково увеличивают скорость (примерно в 2-4 раза) при повышении температуры на 10 о С. Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ). Точное значение температурного коэффициента определяется для каждой реакции.
здесь v — скорость химической реакции,
C A и C B — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
N 2 + 3H 2 ↔ 2NH 3
закон действующих масс выглядит так:
– это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно изобрать так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом . Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты - кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака :
N 2 + 3H 2 ↔ 2NH 3
В качестве катализатора используется пористое железо с примесями Al 2 O 3 и K 2 O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды ). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты . Ферментативные катализаторы действуют высокоэффективно и избирательно, с избарительностю 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами . Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоброт. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ. Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод кипящего слоя . Например , при производстве серной кислоты методом кипящег ослоя производят обжиг колчедана.
6. Природа реагирующих веществ . На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ. Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества. Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Скорость химической реакции - изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
 На скорость химической реакции оказывают влияние следующие факторы:
На скорость химической реакции оказывают влияние следующие факторы:
- природа реагирующих веществ;
- концентрация реагирующих веществ;
- поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях);
- температура;
- действие катализаторов.
Теория активных столкновений позволяет объяснить влияние некоторых факторов на скорость химической реакции. Основные положения этой теории:
- Реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
- Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
- К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Для этого частицы должны обладать достаточной энергией.
- Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
- Активность химических веществ проявляется в низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем выше скорость реакции. Например, в реакциях между катионами и анионами энергия активации очень мала, поэтому такие реакции протекают почти мгновенно
Влияние концентрации реагирующих веществ на скорость реакции
При повышении концентрации реагирующих веществ скорость реакции возрастает. Для того чтобы вступить в реакцию, две химические частицы должны сблизиться, поэтому скорость реакции зависит от числа столкновений между ними. Увеличение числа частиц в данном объеме приводит к более частым столкновениям и к возрастанию скорости реакции.
К увеличению скорости реакции протекающей в газовой фазе приведет повышение давления или уменьшение объема, занимаемого смесью.
На основе экспериментальных данных в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ-
Закон действующих масс (ЗДМ) :
 Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. («действующая масса» – синоним современного понятия «концентрация»)
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. («действующая масса» – синоним современного понятия «концентрация»)
аА + bВ = cС + dD, где k – константа скорости реакции
ЗДМ выполняется только для элементарных химических реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.

Выражения для скоростей различных типов реакций
ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Скорость гетерогенных реакций

- Зависит от площади поверхности соприкосновения веществ , т.е. от степени измельчения веществ, полноты смешивания реагентов.
- Пример — горение древесины. Целое полено горит на воздухе сравнительно медленно. Если увеличить поверхность соприкосновения дерева с воздухом, расколов полено на щепки, скорость горения увеличится.
- Пирофорное железо высыпают на лист фильтровальной бумаги. За время падения частицы железа раскаляются и поджигают бумагу.
Влияние температуры на скорость реакции
В XIX веке голландский ученый Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 о С скорости многих реакций возрастают в 2-4 раза.
Правило Вант-Гоффа

При повышении температуры на каждые 10 ◦ С скорость реакции увеличивается в 2-4 раза.
Здесь γ (греческая буква «гамма») — так называемый температурный коэффициент или коэффициент Вант-Гоффа, принимает значения от 2 до 4.
Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:

Чем больше E a конкретной реакции, тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Повышение Т приводит к увеличению константы скорости, это объясняется тем, что повышение температуры приводит к быстрому увеличению числа «энергичных» молекул, способных преодолевать активационный барьер E a .
Влияние катализатора на скорость реакции
Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации.
Катализаторы – это вещества, участвующие в химической реакции и увеличивающие ее скорость, но по окончании реакции остающиеся неизменными качественно и количественно.
Ингибиторы – вещества, замедляющие химические реакции.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом .